-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Studium kontaminace pracovišť a profesionální expozice zdravotnických pracovníků zajišťujících přípravu a aplikaci protinádorových léčiv
Research of workplace contamination and occupational exposure of healthcare professionals to antineoplastic drugs
The aim of this study was to investigate the occupational exposure of healthcare professionals to cytotoxic drugs. Our study focused on monitoring of surface contamination of preparation and administration working areas at Masaryk Memorial Cancer Institute, Brno. For this purpose, the most exposed working places were wiped and analyzed for the presence of cyclophosphamide, 5-fluorouracil and platinum containing drugs. Determination of cyclophosphamide was based on high performance liquid chromatography coupled with mass spectrometry (HPLC-MS) and platinum-containing compounds were analysed by inductively coupled plasma mass spectrometry (ICP-MS). Determination of 5-fluorouracil by high performance liquid chromatography with ultraviolet detection (HPLC-UV) showed poor selectivity and robustness. During the monitoring, 163 samples were collected and 130 of them (80%) were positive for at least one of the studied analytes. In total, 92 samples were positive for both cyclophosphamide and platinum together. Considering two types of the working areas monitored (preparation vs. administration departments), the contamination levels were found to be similar and generally comparable with the situation reported in other industrial countries. The study contributed to the identification of major sources of contamination and served as one of the primary impulses leading to better and safer management during handling cytotoxic drug.
Key words:
antineoplastic agents, cytotoxic drugs, occupational exposure, surface contamination
Autoři: L. Doležalová 1; P. Odráška 1,2,3; L. Gorná 1; J. Kuta 3; M. Oravec 3; M. Prudilová 1; R. Vejpustková 1; L. Bláha 2,3
Působiště autorů: Ústavní lékárna, Masarykův onkologický ústav, Brno, vedoucí organizace prof. MUDr. Jiří Vorlíček, CSc. 1; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno, doc. MUDr. Dalibor Valík, Ph. D. 2; RECETOX (Research Centre for Environmental Chemistry and Ecotoxicology) Přírodovědecká fakulta, Masarykova univerzita, Brno, ředitel prof. RNDr. Ivan Holoubek, CSc. 3
Vyšlo v časopise: Pracov. Lék., 61, 2009, No. 3, s. 117-122.
Kategorie: Původní práce
Souhrn
Za účelem výzkumu profesionální expozice cytotoxickým léčivům byla v Masarykově onkologickém ústavu v Brně sledována kontaminace místních pracovišť zajišťujících přípravu a aplikaci chemoterapie. K realizaci této studie byla použita metoda stanovení cyklofosfamidu, 5-fluorouracilu a platinových cytostatik ve stěrech pracovního prostředí. Z použitých analytických metod se velmi dobře osvědčila metoda stanovení cyklofosfamidu pomocí vysoce účinné kapalinové chromatografie s hmotnostně spektrometrickou detekcí (HPLC-MS) a platinových cytostatik pomocí hmotnostní spektrometrie s indukčně vázaným plazmatem (ICP-MS). Omezená selektivita/robustnost však byla zjištěna u stanovení 5-fluorouracilu kapalinovou chromatografií s ultrafialovou detekcí (jedna ze starších tradičních metod využívaných pro sledování kontaminace). Během monitorování bylo celkově analyzováno 163 vzorků, z nichž 130 (80 %) bylo pozitivních na přítomnost alespoň jednoho ze sledovaných analytů. U 92 vzorků (56 %) byla nalezena detekovatelná množství cyklofosfamidu i platinových cytostatik zároveň. Výsledky kontaminace obou sledovaných segmentů pracovního prostředí Masarykova onkologického ústavu (segment přípravy vs aplikace léčiv) byly srovnatelné a řádově odpovídaly výsledkům publikovaných ve světové literatuře. Provedené monitorování poukázalo na zdroje znečištění a podpořilo iniciaci prací, které povedou k nápravě zjištěných nedostatků.
Klíčová slova:
cytostatika, cytotoxická léčiva, profesní expozice, povrchová kontaminaceÚvod
Manipulace s protinádorovými léčivy (příprava, aplikace, likvidace), stejně jako péče o onkologického pacienta, je spojena s potenciálním ohrožením zdraví zdravotnického personálu v důsledku expozice těmto léčivům, u kterých byla prokázána řada negativních účinků. Z hlediska chronického působení cytotoxických léčiv (CL), které je pro profesionální expozici nejvíce typické, jsou nejvýznamnější genotoxické, karcinogenní a teratogenní účinky těchto látek. Kromě toho lze očekávat i hypersenzitivní reakce nebo endokrinní či imunosupresivní účinky [2, 9, 12, 15].
Kontaminace CL byla v minulosti opakovaně doložena na pracovištích začleněných do přípravy nebo aplikace CL v ČR i ve světě. Nanogramy až mikrogramy CL (nejčastěji cyklofosfamidu) na m3 vnitřního vzduchu byly zjištěny v přípravnách i lůžkových oddělení [13, 14, 20]. Četné jsou také zprávy o kontaminaci různého vnitřního vybavení a povrchů na klinických odděleních. Přítomnost CL lze běžně prokázat na podlahách, pracovních pultech, policích, dveřích, telefonech a počítačových klávesnicích [3, 6, 11, 16, 19, 23], použitých ochranných rukavicích, ložním prádle pacientů, hygienických zařízeních [4, 7, 8, 26] a také na obalech léčivých přípravků odebíraných od výrobců [4, 17, 21].
S ohledem na poznatky o relativně malé volatilitě běžně předepisovaných CL a naopak vysoké četnosti dokladů kontaminace povrchů na onkologických odděleních lze z hlediska profesionální expozice CL přisuzovat největší důležitost dermálnímu příjmu těchto látek [14, 18, 25, 26]. Naproti tomu inhalace aerosolů a/nebo par CL, stejně jako orální příjem, připadají v úvahu spíše výjimečně (např. v důsledku havárie spojené s únikem CL do volného prostředí nebo vířením kontaminovaných částic deponovaných na povrch pracovních ploch). Z hlediska ochrany zdraví pracovníků nakládajících s CL se tedy zdá být primárně nejdůležitější minimalizace či eliminace povrchové kontaminace.
Za účelem studia distribuce tohoto typu kontaminace byly v Masarykově onkologickém ústavu v Brně (MOÚ) zavedeny analytické metody pro stanovení nejčastěji používaných léčiv (cyklofosfamid, fluorouracil, platinová cytostatika) ve stěrech pracovního prostředí. Zavedené metodiky byly použity pro porovnání úrovně kontaminace různých oddělení zajišťujících přípravu a aplikaci CL (sklad a aseptická přípravna CL ústavní lékárny, denní stacionář, lůžkové oddělení). Pro usnadnění vzájemného porovnání monitorovaných pracovišť mezi sebou byla na jednotlivých pracovištích vzorkována vždy stejná odběrová místa: pracovní stůl, podlaha, předměty – objekty přicházející často do kontaktu s rukama zdravotníků (telefon, počítačová myš, kliky materiálových propustí...).
Materiál a metody
Odběr a příprava vzorku
Stěr se z vybrané plochy (obvykle 30 x 30 cm) odebírá pomocí stěrky z netkané textilie (Mesoft, 7,5 x 7,5 cm) navlhčené 0,75 ml 20 mM acetátového pufru (pH = 4). Použitá stěrka se pak extrahuje v ultrazvukové lázni ve stejném pufru přidaném ke vzorku do konečného objemu 25 ml (doba extrakce = 30 minut). Výsledný extrakt byl na závěr centrifugován 10 minut při 20 tis. ot./min, a poté postoupen k analýze.
Stanovení cyklofosfamidu
Stanovení cyklofosfamidu bylo provedeno metodami kapalinové chromatografie v tandemu s hmotnostní spektrometrií (HPLC-MS; Agilent HP1200 HPLC System s detektorem Agilent 6410 TripleQuad). K separaci byla využita kolona ZORBAX SB-18 (2,1 x 30 mm, 3,5 μm). Hmotnostní detekce byla založena na sledování iontového přechodu 261 → 140 (m/z+).
Stanovení 5-fluorouracilu
Stanovení 5-fluorouracilu probíhalo na kapalinovém chromatografu s UV detektorem (Agilent HP1200 HPLC-UV System) a kolonou Supelco ABZplus (4,6 mm x 250 mm, 5 μm). Pro kvantifikaci analytu jsme využili záznamu absorbance při 266 nm.
Stanovení platiny
Stanovení platinových komplexů bylo založeno na kvantifikaci celkového množství platiny ve vzorku metodou hmotnostní spektrometrie s indukčně vázaným plazmatem (ICP-MS Agilent System 7500ce). Připravené extrakty se před samotnou analýzou ředily 1% HCl v poměru 1 : 14. K detekci se využívá sledování nuklidů Pt 194 a 195.
Ověření metody
Ověření použitelnosti jednotlivých metodik bylo provedeno opakovaným zpracováním kontrolních vzorků se známým množství analytu. Krátkodobá opakovatelnost byla stanovena paralelním zpracováním tří vzorků od každé koncentrace. Dlouhodobá opakovatelnost byla odvozena od výsledků tří sérií analýz provedených vždy s odstupem jednoho týdne. Ostatními prezentovanými parametry metody jsou výtěžnost metody a účinnost vzorkování. Stanovení výtěžnosti metody (zpracování vzorku) se zakládá na hodnocení dat získaných během předešlých měření. Účinnost vzorkování byla ověřena zpracováním tří vzorků získaných vzorkováním kontrolních ploch s přesně definovanou kontaminací [1]. Použitelnost metody pro stanovení léčiv s obsahem platiny byla ověřována na příkladu cisplatiny, jejíž spotřeba je v Masarykově onkologickém ústavu z uvedené skupiny léčiv (platinová cytostatika) nejvyšší.
Výsledky
Charakterizace analytické metody
V první fázi jsme se zaměřili na detailnější charakterizaci analytických metodik – výsledné hodnoty výtěžností a opakovatelnosti metod pro všechny analyty (v různých koncentracích) jsou sumarizovány v tabulce 1. Velmi dobrou výtěžnost (90–117%) i opakovatelnost (do 12 %) metodik jsme získali v případě cyklofosfamidu a 5-fluorouracilu. Pro platinová cytostatika byla zavedená metoda méně přesná (opakovatelnost do 25 %, výtěžnost 50–60%). Z provedených experimentů vyplývá, že zlepšení obou stanovovaných charakteristik by bylo možné docílit pouze změnou složení extrakčního roztoku, což by se však opět negativně projevilo u zbývajících dvou analytů (provádí se stanovení všech tří látek z jednoho stěru/extraktu). Omezenou výtěžnost metody pro platinová cytostatika do velké míry kompenzuje vysoká citlivost analytického stanovení platiny pomocí hmotnostní spektrometrie s indukčně vázaným plazmatem. Limit detekce (LD) metody pro platinová cytostatika byl stanoven na 0,5 ng Pt/stěr. Obdobná citlivost byla zjištěna také u stanovení cyklofosfamidu metodou HPLC-MS (LD = 2 ng/stěr). Naproti tomu HPLC-UV metoda pro stanovení fluorouracilu je limitovaná svou malou citlivostí (LD = 200 ng/stěr) a špatnou selektivitou. Stanovování nízkých množství fluorouracilu je často komplikováno různými matricovými jevy, které použitá metoda nedokáže odstranit.
Tab. 1. Parametry opakovatelnosti a výtěžnosti metody pro cyklofosfamid, fluorouracil a cisplatinu 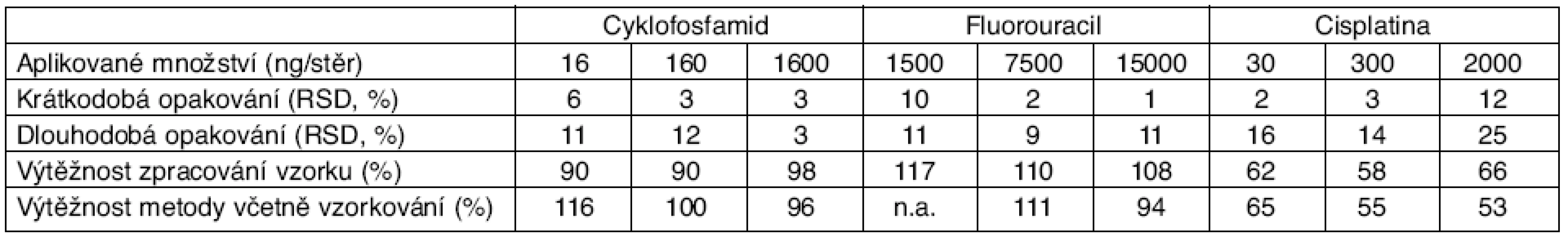
RSD – relativní směrodatná odchylka, n. a. – nekvantifikováno z důvodu interferujícího působení matrice vzorku Monitorování povrchové kontaminace
S využitím těchto metod bylo analyzováno celkem 163 vzorků, z nichž 130 (80 %) bylo shledáno pozitivních na přítomnost alespoň jednoho ze sledovaných analytů (nejčastěji cyklofosfamidu nebo platinových cytostatik, zejména s ohledem na vysokou citlivost analytických metod). U 92 vzorků (56 %) byly současně nalezeny cyklofosfamid i platina. Fluorouracil se podařilo spolehlivě prokázat pouze u 16 vzorků (10 %). Tento výsledek je dán nízkou citlivostí metody. Frekvence pozitivních nálezů cyklofosfamidu a platiny a rozpětí nalezených hodnot u vzorků z nejvýznamnějších stěrových míst jsou prezentovány v tabulce 2.
Tab. 2. Srovnání povrchové kontaminace na jednotlivých pracovištích MOÚ 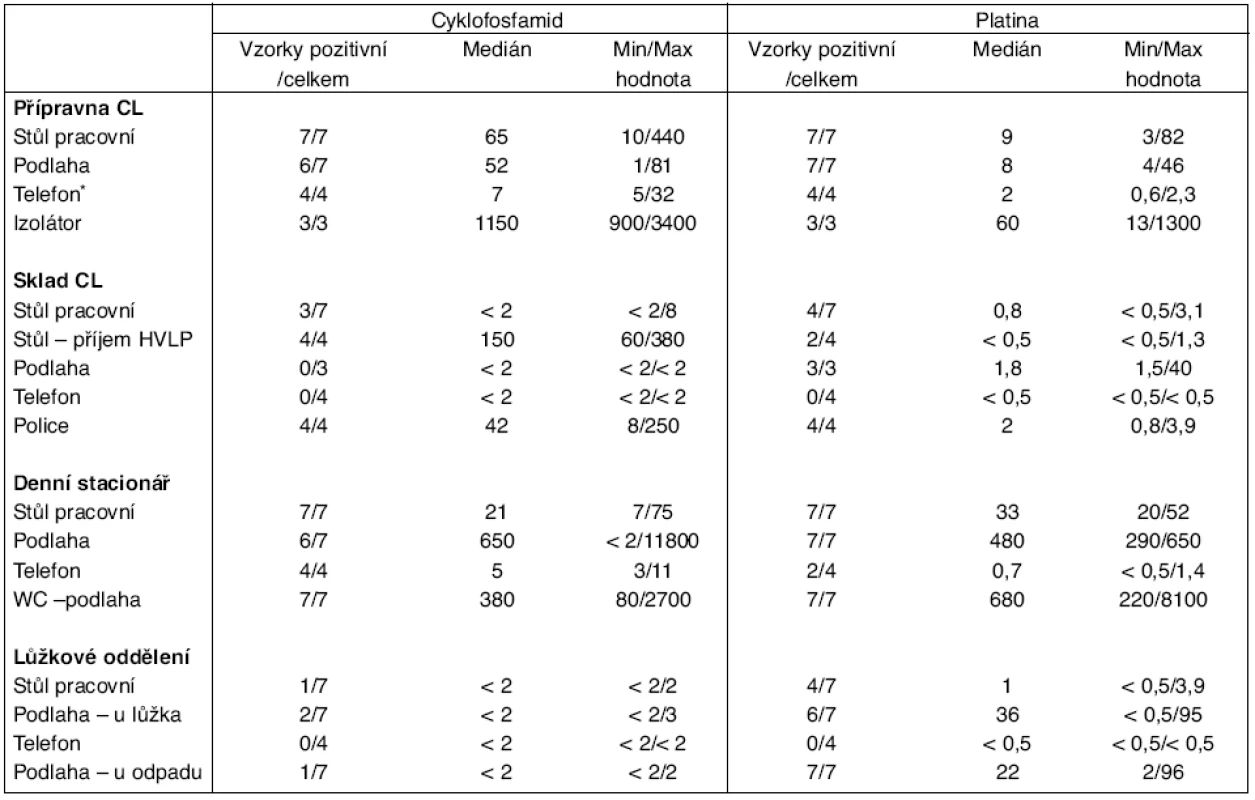
*ukázka výsledků zjištěných u standardně monitorovaného vybavení, CL – cytotoxická protinádorová léčiva; stěry odebírány ve většině případů z plochy 30 x 30 cm a hodnoty jsou tedy vyjádřeny v ng / 900 cm2; u telefonů byly provedeny stěry celého objektu (ng/objekt). V rámci ústavní lékárny byla nejvyšší kontaminace nalezena v přípravně CL, kde se v pracovním prostředí izolátoru pohybovaly naměřené hodnoty cyklofosfamidu v rozmezí 900–3400 ng/stěr, platiny 13–1300 ng/stěr. Na vybavení přípravny CL (stůl, podlaha, telefon) byly hodnoty kontaminace řádově v desítkách ng/stěr. Ve skladu CL nedosahovala kontaminace tak vysokých hodnot jako v přípravně CL, na stole pro příjem léčiv a na policích se nalezené hodnoty pohybovaly v desítkách až stovkách ng/stěr.
Na denním stacionáři byly stanoveny vysoké hodnoty kontaminace na podlaze pod infuzními stojany (cyklofosfamid až 11800 ng/stěr, cisplatina až 650 ng/stěr) a na toaletách pro pacienty (cyklofosfamid až 2700 ng/stěr, platina až 8100 ng/stěr).
Na lůžkovém oddělení se hodnoty kontaminace pohybovaly mezi hranicí stanovitelnosti a desítkami ng/stěr.
Nálezy fluorouracilu v tabulce prezentovány nejsou, neboť robustnost/selektivita použité metody se ukázala být nedostatečná. U mnohých vzorků byly pozorovány matricové interference, které mohly často zastínit signál sledovaného analytu.
Diskuse
Z celkového počtu tří zavedených metod se v praxi dobře osvědčily metody pro stanovení cyklofosfamidu pomocí HPLC-MS a platinových cytostatik pomocí ICP-MS. Použitím těchto metod lze uvedené analyty dobře stanovit u většiny odebraných vzorků, což je v praxi předpoklad pro dobrý popis studovaných poměrů kontaminace vnitřního pracovního prostředí.
V rámci provedeného monitoringu se potvrdilo očekávání kontaminace přípravny CL (viz tabulka 2). Tyto prostory jsou nejvíce exponované díky skutečnosti, že jsou zde centralizovány rizikové operace související s ředěním a transportem léčiva z originálního obalu do materiálu určeného k aplikaci. V souladu s tím bylo v rámci několika nezávislých měření pozorováno, že koncentrace objevující se na pracovní ploše uvnitř izolátoru mohou dosahovat až několika mikrogramů na stěr (plocha 900 cm2), což jsou hodnoty přibližně 100krát vyšší než na jiných místech uvnitř přípravny CL (vně izolátoru).
Sklad CL byl v porovnání s přípravnou CL kontaminovaný méně často a nalezené koncentrace byly také nižší. Výjimkou byl pouze stůl pro přejímání CL od dodavatelů, kde jsou CL vybalovány a označovány. Například u cyklofosfamidu byly nalezeny obdobné hodnoty jako na stole, který je umístěn v přípravně CL a slouží k zabalení (zatavení) připravených CL do ochranné fólie před odesláním k aplikaci pacientům.
Co do četnosti i míry kontaminace odpovídala přípravně CL situace nalezená na denním stacionáři, na kterém se denně realizuje 100–150 individuálních aplikací chemoterapie. Na podlaze místnosti pod aplikačními stojany byla stanovena mikrogramová množství cyklofosfamidu i platiny. Původ této kontaminace bude pramenit zřejmě v manipulacích prováděných během podání chemoterapie (odpojování pacienta během aplikace, připojování či odpojování bolusů, závěrečné ukončení aplikace), kdy určitá množství zbylých CL mohou unikat do okolního prostředí. Z hlediska prevence kontaminace pracovního prostředí lze doporučit začlenění kompletace infuzního vaku a setu do procesu přípravy CL prováděné v uzavřeném prostoru izolátoru. Ze stejného důvodu se při aplikaci CL nedoporučuje ani opakované využívání infuzních setů (tj. přepichování setu z jednoho vaku do druhého).
Mikrogramová množství obou cytostatik byla stanovena také na podlaze toalety pro pacienty. Hygienická zařízení využívaná onkologickými pacienty je proto nezbytné počítat mezi významné zdroje kontaminace oddělení zajišťujících aplikaci CL.
Na základě koncentrací zjištěných v ústavní lékárně a denním stacionáři a s přihlédnutím k odlišným pracovním podmínkám lze předpokládat, že expozice CL bude vyšší u pracovníků denního stacionáře. Důvodem jsou rozdílné standardy pro používané pracovní oděvy a ochranné pracovní prostředky a doba setrvání na kontaminovaném pracovišti. Zatímco příprava CL je legislativně vázána na aseptické prostředí a používání četných ochranných prostředků (kombinézy, chemoprotektivní jednorázové ochranné rukavice, rouška), aplikace CL tak striktně upravována není. Vzhledem k tomu, že prostory sloužící pro podávání chemoterapie jsou primárně koncipovány, aby naplňovaly především potřeby klientů centra, je velký důraz kladen na tvorbu a udržování harmonického prostředí, které pacienta nestresuje, nýbrž uklidňuje. V souladu s touto snahou lze jen stěží očekávat, že by aplikující sestry začaly používat jakékoli speciální (ochranné) oděvy, jako je tomu u pracovníků zajišťujících přípravu CL. Onkologickým oddělením lze však doporučit zavedení oděvů s dlouhými rukávy, praní pracovních oděvů po každé směně a důslednou kontrolu používání jednorázových ochranných rukavic.
Porovnáme-li zjištěné hodnoty kontaminace s výsledky obdobných studií, zjistíme, že v rámci lékáren (přípraven CL) se námi naměřené hodnoty řádově blíží (desítky až stovky pg/cm2) hodnotám zjištěným v Německu [22] nebo ve Švédsku [10]. S ohledem na situaci v segmentu aplikace CL je situace obdobná. Blízké hodnoty kontaminace byly pozorovány např. v Holandsku [7]. Srovnáním situací v nemocničních lékárnách oproti onkologickým ambulancím se v Itálii zabývala také Ursini et al. [26]. Podle zjištění tohoto kolektivu byla kontaminace denního stacionáře dokonce přibližně 4krát vyšší než ta, která byla zjištěna v přípravně CL.
Otázku kvantifikace zdravotních rizik lze na základě dat o kontaminaci pracovního prostředí řešit prozatím jen velmi zevrubně. Kompletní analýza rizik se neobejde bez kvantitativních informací charakterizujících biologický příjem studovaného toxikantu. V našem případě proto nabízíme alespoň srovnání výsledků naší studie se studiemi, ve kterých jsou data o kontaminaci pracoviště doplněna o výsledky biomonitorování příjmu CL (cyklofosfamidu) exponovanými pracovníky. Takovými studiemi jsou např. práce Vandenbroucka a Robayse [27] či Sessinka [23]. Tyto studie referovaly o přibližně stejném znečištění pracovního prostředí (respektive podlahy a pracovních stolů) a současně o exkreci cyklofosfamidu v moči pracovníků (pozorovaná množství 0,18–17,75 μg cyklofosfamidu/24 hod.). Výsledné zdravotní riziko (celoživotní vzestup pravděpodobnosti incidence leukémie a nádorů močového měchýře) pak bylo odvozeno kombinací získaných hodnot s poznatky o kinetice a toxicitě cyklofosfamidu a pro vyšší hodnoty kontaminace činilo až 39 000 případů/milion exponovaných pracovníků. Za mezní akceptovatelné riziko vyplývající z expozice jednomu toxikantu se přitom zpravidla uvažuje 100 případů/milion osob [5]. Hlavním závěrem Vandenbrouckovi studie bylo, že při současné úrovni kontaminace může u některých pracovníků dojít až k téměř 400násobnému zvýšení rizika vzniku nádorů nad přijatelnou míru rizika [27]. Nutno však kriticky dodat, že uvedená maximální exkrece 17,75 μg cyklofosfamidu/24 hod. je ojedinělou hodnotou. V literatuře se hodnoty exkrecí nejčastěji pohybují do 1 μg cyklofosfamidu/24 hod. Avšak i tyto hodnoty jsou stále násobně vyšší (10–20krát), než hodnoty odpovídající výše uvedenému tolerovatelnému riziku [5].
Závěr
Závěrdem lze konstatovat, že byly vyvinuty a charakterizovány analytické metodiky, které úspěšně umožňují sledování kontaminace pracovního prostředí nebezpečnými cytoxickými léčivy (cyklofosfamid, platinová cytostatika). Naše studie prokázala detekovatelné hladiny obou analytů na pracovištích Masarykova onkologického ústavu v hladinách dosahujících až mikrogramů na stěr (cca 900 cm2). Z hlediska pracovního režimu se jako rizikové jeví zejména pracoviště denního stacionáře, kde jsou léčiva aplikována pacientům ve velkém množství.
Došlo dne 7. 8. 2009. Přijato do tisku dne 21. 8. 2009.
Kontaktní adresa:
PharmDr. Lenka Doležalová
Masarykův onkologický ústav
Ústavní lékárna
Žlutý kopec 7
656 53 Brno
e-mail: dolezal@mou.cz
Zdroje
1. Occupational Safety & Health Administration: Method Evaluation Guidelines for Surface Sampling Methods, Salt Lake Technical Center, USA. Dostupné na www: http://www.osha.gov/dts/sltc/methods/surfacesampling/surfacesampling.html
2. BAKER, G. L., KAHL, L. E., ZEE, B. C., STOLZER, B. L., AGARWAL, A. K., MEDSGER, T. A. Malignancy Following Treatment of Rheumatoid-Arthritis with Cyclophosphamide – Long-Term Case-Control Follow-up-Study. Am. J. Med., 1987, 83, 1, s. 1–9.
3. CONNOR, T. H., ANDERSON, R. W., SESSINK, P. J. M., BROADFIELD, L., POWER, L. A. Surface contamination with antineoplastic agents in six cancer treatment centers in Canada and the United States. Am. J. Health. Syst. Pharm., 1999, 56, 14, s. 1427–1432.
4. CONNOR, T. H., SESSINK, P. J. M., HARRISON, B. R., PRETTY, J. R., PETERS, B. G., ALFARO, R. M., BILOS, A., BECKMANN, G., BING, M. R., ANDERSON, L. M., DECHRISTOFORO, R. Surface contamination of chemotherapy drug vials and evaluation of new vial-cleaning techniques: Results of three studies. Am. J. Health. Syst. Pharm., 2005, 62, 5, s. 475–484.
5. ČUPR, P., KOPTÍKOVÁ, J., ŠANTROCH, J., BARTOŠ, T., BEDNÁŘOVÁ, Z., MUŽÍK, J., HOLOUBEK, I., DUŠEK, L. Metodické možnosti hodnocení zdravotních rizik na populaŹní úrovni s využitím dostupných environmentálních a epidemiologických dat. Klinická onkologie, 2007, 20, 4, s. 190–196.
6. FLORIDIA, L., PIETROPAOLO, A. M., TAVAZZANI, M., RUBINO, F. M., COLOMBI, A. Measurement of surface contamination from nucleoside analogue antineoplastic drugs by high-performance liquid chromatography in occupational hygiene studies of oncologic hospital departments. Journal of Chromatography B, 1999, 724, 2, s. 325–334.
7. FRANSMAN, W., VERMEULEN, R., KROMHOUT, H. Occupational dermal exposure to cyclophosphamide in Dutch hospitals: A pilot study. Ann. Occup. Hyg., 2004, 48, 3, s. 237–244.
8. FRANSMAN, W., VERMEULEN, R., KROMHOUT, H. Dermal exposure to cyclophosphamide in hospitals during preparation, nursing and cleaning activities. Int. Arch. Occup. Environ. Health., 2005, 78, 5, s. 403–412.
9. FUCHS, J., HENGSTLER, J. G., JUNG, D., HILTL, G., KONIETZKO, J., OESCH, F. DNA damage in nurses handling antineoplastic agents. Mutation Research/Genetic Toxicology, 1995, 342, 1–2, s. 17–23.
10. HEDMER, M., GEORGIADI, A., BREMBERG, E. R. M., JONSSON, B. A. G. Surface contamination of cyclophosphamide packaging and surface contamination with antineoplastic drugs in a hospital pharmacy in Sweden. Ann. Occup. Hyg., 2005, 49, 7, s. 629–637.
11. HEDMER, M., JONSSON, B. A. G., NYGREN, O. Development and validation of methods for environmental monitoring of cyclophosphamide in workplaces. Journal of Environmental Monitoring, 2004, 6, 12, s. 979–984.
12. HEMMINKI, K., KYYRONEN, P., LINDBOHM, M. L. Spontaneous-Abortions and Malformations in the Offspring of Nurses Exposed to Anesthetic-Gases, Cytostatic Drugs, and Other Potential Hazards in Hospitals, Based on Registered Information of Outcome. J. Epidemiol. Community Health, 1985, 39, 2, s. 141–147.
13. KIFFMEYER, T., KUBE, C., OPIOLKA, S., SCHMIDT, K. G., SCHOPPE, G. M. S. P. J. Vapour pressures, evaporation behaviour and airborne concentrations of hazardous drugs: implications for occupational safety. The Pharmaceutical Journal, 2002, 268, s. 331–337.
14. KROMHOUT, H., HOEK, F., UITTERHOEVE, R., HUIJBERS, R., OVERMARS, R. F., ANZION, R., VERMEULEN, R. Postulating a dermal pathway for exposure to anti-neoplastic drugs among hospital workers. Ann. Occup. Hyg., 2000, 44, 7, s. 551–560.
15. KRSTEV, S., PERUNICIC, B., VIDAKOVIC, A. Work practice and some adverse health effects in nurses handling antineoplastic drugs. Med. Lav., 2003, 94, 5, s. 432–439.
16. MASON, H. J., BLAIR, S., SAMS, C., JONES, K., GARFITT, S. J., CUSCHIERI, M. J., BAXTER, P. J. Exposure to antineoplastic drugs in two UK hospital pharmacy units. Ann. Occup. Hyg., 2005, 49, 7, s. 603–610.
17. MASON, H. J., MORTON, J., GARFITT, S. J., IQBAL, S., JONES, K. Cytotoxic drug contamination on the outside of vials delivered to a hospital pharmacy. Ann. Occup. Hyg., 2003, 47, 8, s. 681–685.
18. McDEVITT, J. J., LEES, P. S. J., MCDIARMID, M. A. Exposure of Hospital Pharmacists and Nurses to Antineoplastic Agents. J. Occup. Environ. Med., 1993, 35, 1, s. 57–60.
19. MICOLI, G., TURCI, R., ARPELLINI, M., MINOIA, C. Determination of 5-fluorouracil in environmental samples by solid-phase extraction and high-performance liquid chromatography with ultraviolet detection. Journal of Chromatography B, 2001, 750, 1, s. 25–32.
20. MINOIA, C., TURCI, R., SOTTANI, C., SCHIAVI, A., PERBELLINI, L., ANGELERI, S., DRAICCHIO, F., APOSTOLI, P. Application of high performance liquid chromatography tandem mass spectrometry in the environmental and biological monitoring of health care personnel occupationally exposed to cyclophosphamide and ifosfamide. Rapid Commun. Mass Spectrom., 1998, 12, 20, s. 1485–1493.
21. NYGREN, O., GUSTAVSSON, B., STROM, L., FRIBERG, A. Cisplatin contamination observed on the outside of drug vials. Ann. Occup. Hyg., 2002, 46, 6, s. 555–557.
22. SCHMAUS, G., SCHIERL, R., FUNCK, S. Monitoring surface contamination by antineoplastic drugs using gas chromatography-mass spectrometry and voltammetry. Am. J. Health. Syst. Pharm., 2002, 59, 10, s. 956–961.
23. SESSINK, P. J. M., BOER, K. A., SCHEEFHALS, A. P. H., ANZION, R. B. M., BOS, R.P. Occupational Exposure to Antineoplastic Agents at Several Departments in a Hospital - Environmental Contamination and Excretion of Cyclophosphamide and Ifosfamide in Urine of Exposed Workers. Int. Arch. Occup. Environ. Health, 1992, 64, 2, s. 105–112.
24. SESSINK, P. J. M., KROESE, E. D., VANKRANEN, H. J., BOS, R. P. Cancer Risk Assessment for Health-Care Workers Occupationally Exposed to Cyclophasphamide. Int. Arch. Occup. Environ. Health, 1995, 67, 5, s. 317–323.
25. SESSINK, P. J. M., TIMMERSMANS, J. L., ANZION, R. B. M., BOS, R. P. Assessment of Occupational Exposure of Pharmaceutical Plant Workers to 5-Fluorouracil – Determination of Alpha-Fluoro-Beta-Alanine in Urine. J. Occup. Environ. Med., 1994, 36, 1, s. 79–83.
26. SESSINK, P. J. M., VANDEKERKHOF, M. C. A., ANZION, R. B. M., NOORDHOEK, J., BOS, R. P. Environmental Contamination and Assessment of Exposure to Antineoplastic Agents by Determination of Cyclophosphamide in Urine of Exposed Pharmacy Technicians – Is Skin Absorption an Important Exposure Route. Arch. Environ. Health, 1994, 49, 3, s. 165–169.
27. URSINI, C. L., CAVALLO, D., COLOMBI, A., GIGLIO, M., MARINACCIO, A., IAVICOLI, S. Evaluation of early DNA damage in healthcare workers handling antineoplastic drugs. Int. Arch. Occup. Environ. Health, 2006, 80, 2, s. 134–140.
28. VANDENBROUCKE, J., ROBAYS, H. How to protect environment and employees against cytotoxic agents, the UZ Ghent experience. Journal of Oncology Pharmacy Practice, 2001, 6, 4, s. 146–152.
Štítky
Hygiena a epidemiológia Hyperbarická medicína Pracovné lekárstvo
Článek Novinky v očkování
Článok vyšiel v časopisePracovní lékařství
Najčítanejšie tento týždeň
2009 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- V ČR chybí specializovaná péče o pacienty s nervosvalovým onemocněním
-
Všetky články tohto čísla
- Analýza výskytu kliešťovej encefalitídy ako choroby z povolania v Slovenskej republike a Českej republike za roky 1989–2008
- Radiační zátěž zdravotníků při vyšetřování sentinelové uzliny
- Lze zvýšit efektivitu léčby profesionálních poruch pohybového aparátu?
- Studium kontaminace pracovišť a profesionální expozice zdravotnických pracovníků zajišťujících přípravu a aplikaci protinádorových léčiv
- Nanorozměry v kontextu pracovnělékařské problematiky
- Profesionálne pneumopatie a súčasné možnosti rehabilitačnej liečby
- Bolestivá postižení pohybového aparátu při práci v kanceláři
- Jak uznáváme nemoci z povolání dýchacích cest, plic a pohrudnice*
- Novinky v očkování
- Připravovaná změna poskytování náhrad osobám trpícím profesionálním poškozením zdraví
- Pracovní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Jak uznáváme nemoci z povolání dýchacích cest, plic a pohrudnice*
- Bolestivá postižení pohybového aparátu při práci v kanceláři
- Profesionálne pneumopatie a súčasné možnosti rehabilitačnej liečby
- Analýza výskytu kliešťovej encefalitídy ako choroby z povolania v Slovenskej republike a Českej republike za roky 1989–2008
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



