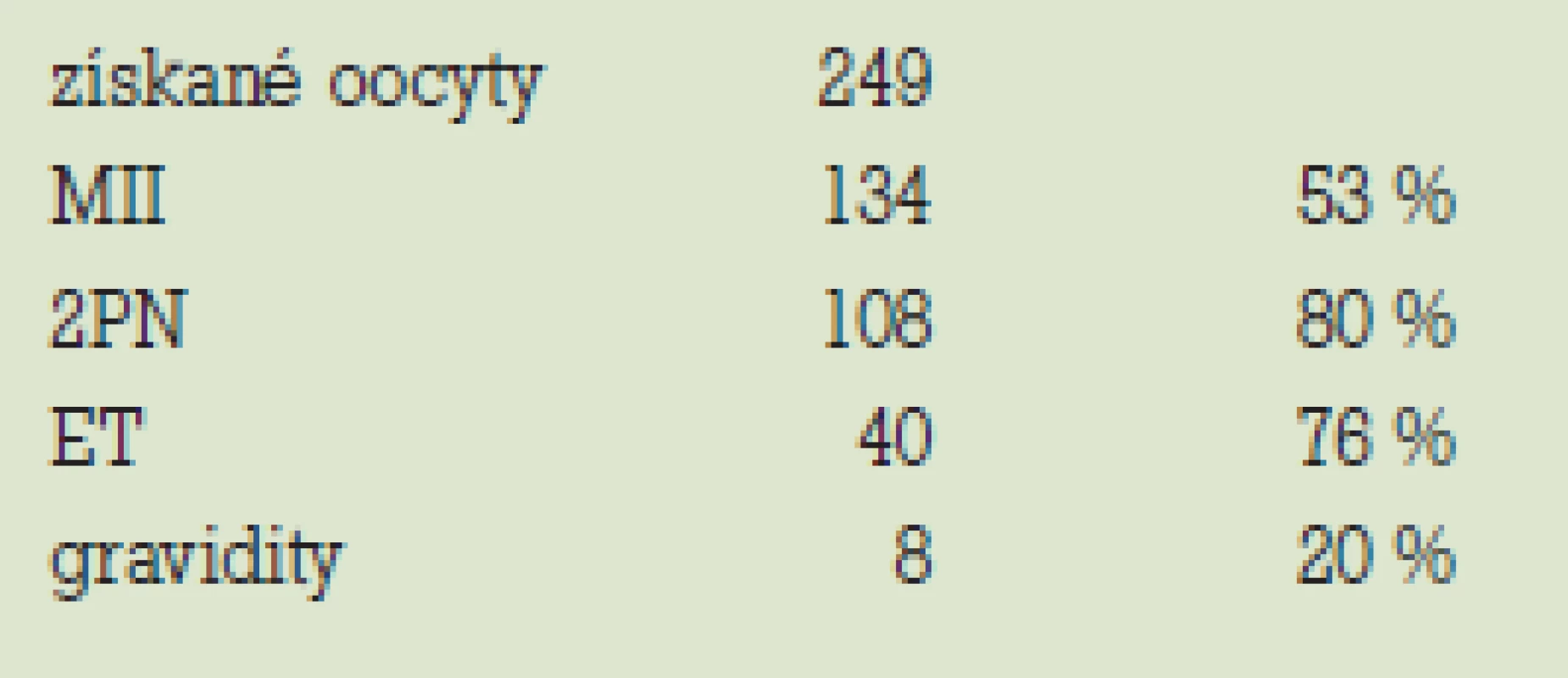-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
In vitro maturácia oocytov: naše skúsenosti s prevenciou OHSS u rizikových pacientok
In vitro maturation of oocytes – our experiencies in prevention of ovarian hyperstimulation syndromein patients at risk of OHSS
In vitro maturation (IVM) of oocytes is a method of infertility treatment used in human medicine from the end of the 80ties of the last century. This is a safe possibility of infertility treatment of women at the risk of ovarian hyperstimulation syndrome(OHSS), low responders and is lowering the costs for infertility treatment by IVF.
Key words:
in vitro maturation (IVM) – polycystic ovaries (PCO) – ovarian hyperstimulation syndrome (OHSS)
Autori: A. Ďurechová; A. Calamar; L. Maršík; J. Války
Vyšlo v časopise: Prakt Gyn 2007; 11(4): 184-187
Publikováno v Praktickej gynekológii 2006; 13(4): 283–286.
Súhrn
In vitro maturácia oocytov je metóda liečby neplodnosti, ktorá sa v humánnej medicíne používa od konca 80. rokov minulého storočia. Je bezpečnou možnosťou liečby žien patriacich do rizikovej skupiny pre OHSS, žien s nedostatočnou odpoveďou na hormónovú stimuláciu a znižuje náklady na liečbu neplodnosti pomocou IVF. V našom centre používame túto techniku od decembra 2005. Sústredili sme sa najmä na pacientky s rizikom OHSS.
Kľúčové slová:
in vitro maturácia oocytov (IVM) – polycystické ováriá (PCO) – ováriový hyperstimulačný syndróm (OHSS)Úvod
Narodenie 1. dieťaťa po in vitro fertilizácii (IVF) a embryotransfere (ET) v roku 1978 otvorilo cestu pre liečbu neplodnosti tisícom párov na svete. IVF/ET cykly ako ich poznáme dnes sa vykryštalizovali v posledných 20. rokoch. Cieľom liečby je získanie čo najväčšieho počtu zrelých oocytov z ovária pri kontrolovanej ováriovej hyperstimulácii suprafyziologickými dávkami exogénnych gonadotropínov. Laboratórna časť procesu predstavuje fertilizáciu a včasné embryonálne štádium.
Odber oocytov začal laparoskopicky v celkovej inhalačnej anestézii. Dnes odoberáme oocyty v krátkej intravenóznej anestézii pod kontrolou ultrazvuku transvaginálne punkčnou ihlou. Zmenili sa aj stimulačné protokoly – od natívnych cyklov k individuálnej, na pacienta šitej stimulácii. Metóda intracytoplazmatickej injekcie spermie (ICSI) umožnila takmer dokonale vyriešiť problém mužskej neplodnosti. Zmenila sa technika aj filozofia ET – predĺžená kultivácia, selektívny embryotransfer jedného embrya a predimplantačná genetická diagnostika znižujú riziko viacplodovej gravidity a zvyšujú úspešnosť liečby.
Neúspech liečby neznamená len nedosiahnutie cieľa – gravidity, ale aj zrušenie cyklu pre neúspešnú stimuláciu u pacientok s nedostatečnou odpoveďou ovárií (low responders) a pre riziko ováriového hyperstimulačného syndrómu (OHSS) u pacientok z rizikovej skupiny. Neúspech predstavuje nielen ekonomické straty ale aj stres pre pacienta. V mnohých krajinách je obmedzený počet cyklov hradených zo zdravotného poistenia.
Prvý literárny údaj o dozrievaní nezrelých králičích oocytov in vitro pochádza z roku 1935 [8]. V roku 1965 proces maturácie oocytov in vitro (IVM) u ľudí opísal a potvrdil Edwards [2], aj keď u ľudí prebieha tento proces menej intenzívne ako u iných cicavcov. Zo začiatku 90. rokov 20. storočia pochádzajú prvé literárne údaje o úspešnej liečbe neplodnosti pomocou IVM v humánnej medicíne [5,13].
Prvá úspešná gravidita pochádza z oocytov získaných z excidovaného ováriového tkaniva [5,3]. Možností využitia tejto metódy v liečbe neplodnosti je niekoľko. V prvom rade zníženie rizika ováriového hyperstimulačného syndrómu (OHSS) u rizikových pacientok (najčastejšie ženy s polycystickými ováriami), zníženie nákladov na liekovú prípravu, zníženie výskytu vedľajších účinkov spôsobených podávaním gonadotropínov a analógov GnRH a liečba neplodnosti u žien s nízkou ováriovou rezervou [3,14]. Pravdepodobne môže znížiť aj riziko výskytu ováriového karcinómu u žien opakovane stimulovaných a liečených pre neplodnosť [14].
Ováriový hyperstimulačný syndróm
Ováriový hyperstimulačný syndróm je vážna, potencionálne letálna komplikácia liečby neplodnosti metódami asistovanej reprodukcie (AR) s incidenciou 0,5–11,2 % [1].
Kľúčovým momentom vzniku tohto syndrómu je podanie chóriového gonadotropínu (hCG) na indukciu ovulácie.
OHSS má široké spektrum laboratórnych zmien a klinických príznakov. Charakterizuje ho zvýšenie ováriovej aktivitiy, zväčšenie ovárií, únik intravazálnej tekutiny do tzv. tretieho priestoru, hemokoncentrácia, hyperkoagulácia, oligúria až anúria, alterácia hepatálnych funkcií, peritoneové dráždenie, vaskulárne komplikácie, rozvrat vnútorného prostredia až možný exitus. Patogenéza OHSS nie je doteraz celkom známa, liečba je preto len symptomatická, nie kauzálna a prevencia tejto komplikácie vzhľadom na jej závažnosť je nesmierne dôležitá. Spočíva v rozpoznaní rizikových faktorov, vo výbere a v prispôsobení stimulačných protokolov, ďalej vo vynechaní hCG a zastavení liečby pri hroziacom OHSS.
Najvážnejšie rizikové faktory OHSS sú polycystické vaječníky (PCO), vek pod 35 rokov, astenický habitus. Pri syndróme polycystických vaječníkov sa predpokladá vyššia senzitivita na gonadotropíny v dôsledku vyššieho počtu folikulov v rôznom štádiu zrelosti a patologickej odpovede endogénnych gonadotropínov a steroidných hormónov na stimuláciu [9].
Veľké množstvo klasifikačných systémov hovorí o stupni neistoty a nejednotnosti pri posudzovaní príčiny OHSS a tým aj názorov na klasifikáciu a celkový manažment vrátane prevencie a liečby (tab. 1, 2).
Tab. 1. Klasifikácia OHSS podľa Golana (1989). 
Tab. 2. Klasifikácia ťažkého OHSS podľa Navota (1992). 
Dahl et al rozdelili OHSS na skorý a neskorý s rôznymi rizikovými faktormi a s rôznym klinickým priebehom. Príznaky sú podobné, bez ohľadu na obdobie vzniku, ale závažnosť a prognóza závisia od prítomnosti gravidity.
Ak sa ťažkosti objavia v neskorej luteálnej fáze a nenastane implantácia, spontánne a rapídne ustúpia so začiatkom menštruácie. Ak nastane implantácia, nastáva zhoršenie klinického stavu a ťažkosti pretrvávajú do 12. týždňa gravidity.
In vitro maturácia oocytov
Moderná liečba neplodnosti metódami ART predpokladá podávanie gonadotropínov na zvýšenie počtu získaných oocytov, embryí a z toho vyplývajúcu vyššiu úspešnosť. Podľa údajov z registra ESHRE z roku 2001 je úspešnosť liečby neplodnosti pomocou IVF v Európe 20,4 % až 36,9 % [1]. Klasické stimulačné protokoly predpokladajú podávanie gonadotropínov približne 10 dní, niekoľko ultrazvukových kontrol a pri dostatočnej veľkosti folikulov (minimálne 2 nad 17 mm) podanie hCG.
Hormónová príprava pred odberom nezrelých oocytov je podstatne kratšia, cca 3–4 dni, nezaťažuje tak organizmus pacientky nepriaznivými účinkami liečby vysokou dávkou hormónov. Je ekonomicky menej náročná a aj pri vyššej dávke gonadotropínov vylučuje riziko OHSS. Literárne údaje o podávaní hCG nie sú jednoznačné. Autori z ázijských krajín podávajú hCG 36 hod pred odberom oocytov [15]. V Európe sa uprednostňuje odber oocytov bez podania hCG [4]. Úspešnosť cyklov po IVM maturácii oocytov je 20 až 27 % [15].
Vek pacientok vhodných na IVM je od 18 do 35 rokov, BMI 18 až 30 kg/m2. Nemali by mať ďalšie endokrinné ochorenia a viac ako 3 neúspešné IVF cykly.
Indikácie na cyklus s IVM oocytov:
- ťažký PCO syndróm
- výskyt OHSS v predchádzajúcich stimuláciách
- natívne cykly bez liekovej prípravy
- ťažká oligoasthenoteratozoospermia
- tubárny faktor sterility
- idiopatická sterilita
- low responders
- endometrióza
IVM možno využiť pri maturácii oocytov získaných zo zmrazeného ováriového tkaniva, z ováriového tkaniva hneď po ovarektómii, zo stimulovaných aj nestimulovaných ovárií a u pacientok s PCO. Je aj riešením pre pacientky v bežnej stimulácii s rozvíjajúcim sa OHSS, pripadne pre pacientky s veľmi diferencovaným rastom folikulov.
Materiál a metódy
Od decembra 2005 do augusta 2006 sme realizovali 52 cyklov IVF/ICSI s IVM oocytov. Počet klasických IVF/ICSI cyklov v uvedenom období bol 420.
IVM cyklus začíname ultrazvukom ovárií – zmeraním objemu ovária a stanovením počtu antrálnych folikulov 2.–3. deň cyklu.
Podmienky pre začatie cyklu sú:
- na ováriu nie sú cysty
- nie je prítomný folikul nad 10 mm
- výška endometria je menej ako 4 mm
- hladina E2 je menej ako 0,2 nmol/l Kontrolujeme sérové hladiny LH a E2.
Ultrazvukové vyšetrenie opakujeme 6. až 8. deň cyklu. Odber nezrelých oocytov vykonáme prv ako 1 z folikulov dosiahne veľkosť 14 mm punkčnou ihlou K-OSN-1730-A-60 (COOK)
Pri vyhľadávaní oocytov v laboratóriu používame sitko (cell strainer – FALCON). Skúmavku z folikulovou tekutinou vylejeme cez sitko, kde sa zachytia oocyty, premyjeme Flushing médiom a potom vyhľadávame vajíčka. Získané oocyty sa kultivujú v in vitro maturačnom médiu (firma MEDICULT) do ktorého pridáme FSH a Pregnyl. Ráno pred odberom sa pacientke ešte odoberie krv, a po centrifugácii sa sérum pridáva do IVM média. Pred použitím sa médium prefiltruje cez filter (MILLEX) (0,22 μm), a uloží sa do CO2 inkubátora minimálne na 2 hodiny. Vo finálnom IVM médiu oocyty kultivujeme 30–36 hod od času odberu. Oocyty oplodňujeme ICSI metódou a premiestnime ich do sekvenčného IVF média, kde sa kultivujú až do dňa transferu. Na 2. deň ráno oocyty vyhodnocujeme, a väčšinou na 3. deň od odberu prebieha transfer embryí.
V deň odberu začíname prípravu endometria p.o. podávaním Estrofemu 2 mg 3 × 1 tabletka. Deň po odbere sa pridáva Utrogestan 100 mg vaginálne 3 × 2 globule. ET robíme pod ultrazvukovou kontrolou, s naplneným močovým mechúrom katétrom K-SOFT 5000 (COOK). Transferujeme 1 až 2 embryá.
Výsledky
Do cyklu IVF/ICSI z IVM oocytov bolo zaradených 52 pacientok. 33 pacientok malo indikáciu PCO, 19 pacientok bolo indikovaných pre PCO syndróm a andrologický faktor, 3 pacientky boli zaradené pre anamnézu PCO a opakovaného OHSS, 1 pacientka pre rozvíjajúci sa OHSS počas kontrolovanej ováriovej hyperstimulácie a 4 pacientky pre andrologický faktor neplodnosti. 1 pacientka s PCO bola zaradená pre opakovane neúspešnú stimuláciu v klasických stimulačných protokoloch (tab. 3).
Tab. 3. Počet IVM/ICSI cyklov, indikácie. 
Všetky pacientky mali stimuláciu gonadotropínmi: dávka 75 IU – 15 pacientok, dávka 150 IU – 24 pacientok. 13 bola dávka upravovaná individuálne až do 225 IU. Doba stimulácie bola 3 až 6 dní, len v 2 prípadoch 13 dní.
Veľkosť folikulov pred odberom bola od 8 do 12 mm. U pacientky s rozvíjajúcim sa OHSS od 12 do 14 mm. Odber sme vykonali 7. až 10. deň cyklu, u 13 pacientok 13. až 15. deň cyklu.
Získali sme celkovo 249 oocytov. 134 oocytov dosiahlo štádium M II (53 %). 108 embryí dosiahlo štádium 2PN (FR 80 %). ET bol u 40 pacientok (76 %) (tab. 4). 8. až 12. deň cyklu 22krát, 13. až 16. deň cyklu 18krát. Zrušený bol 2krát pre pozitívny nález patológie pri PGD, 6krát pre nedostatočnú maturáciu oocytov. Oocyty sme nezískali len v 1 prípade.
Z celkového počtu 52 pacientok sme dosiahli graviditu v 8 prípadoch, čo predstavuje úspešnosť liečby na cyklus 20 % (tab. 4).
OHSS sa nevyskytlo ani u 1 pacientky.
V klasických IVF cykloch (420) sme za sledované obdobie dosiahli FR 80 %, PR 35–38 %. OHSS sa vyskytlo v 20 prípadoch (4 %).
Záver
Náš súbor je malý, ale FR a PR dosiahli hodnoty udávané v literatúre [7,4].
Literárne údaje o podávaní gonadotropínov sú rôzne. Niektorí autori preferujú cyklus bez stimulácie [7] iní odporúčajú podávanie rekombinantných FSH pre zvýšenie úspešnosti [10]. FSH síce nezvyšuje počet získaných oocytov, ale signifikantne zvýši ich kvalitu a počet MII oocytov po kultivácii.
Kvalita endometria a synchronizácia je jeden z dôležitých momentov. Embryá sú transferované do endometria so skrátenou folikulárnou fázou. Odber nezrelých oocytov spôsobí nedostatočnú prípravu endometria na implantáciu v dôsledku zníženého estradiolu a progesterónu [12]. Exogénne podávanie estradiolu a progestorónu je preto nevyhnutné zosynchronizovať s vývinovým štádiom embrya. V literatúre sa uvádza najvyššia úspešnosť pri transfere 2dňového embrya do endometria pripravovaného progesterónom 3–4 dni [11].
V literatúre sú údaje [6] o podávaní hCG 36 hod pred odberom oocytov na zvýšenie PR. V našom súbore sme hCG nepodávali.
IVM ooocytov je metóda asistovanej reprodukcie, ktorá umožní aj ženám s PCO cyklus IVF/ICSI bez rizika OHSS a zníži náklady na liečbu. Umožní fertilitu aj ženám, ktoré sa musia podrobiť ováriovej chirurgii.
MUDr. Andrea Ďurechová
Ana Calamar
MUDr. Ladislav Maršík
doc. MUDr. Jozef Války, CSc.
ISCARE, Bratislava, Slovenská republika
Zdroje
1. Andersen A et al. Assisted reproductive technology in Europe 2001. Results generated from European registers by ESHRE. Hum Reprod 2005; 20(5): 1158–1176.
2. Edwards RG. Maturation in vitro of mouse, sheep, cow, pig, rhesus monkey and human ovarian oocytes. Nature 1965; 208 : 349–351.
3. Freidén B et al. Birth of a healthy infant after in vitrooocyte maturation and ICSI in a woman with diminished ovarian response: Case report. Hum Reprod 2005; 20(9): 2556–2558.
4. Hreinsson J et al. Recombinant LH is equally effective as recombinant hCG in promoting oocyte maturatio in a clinical in vitro maturation programme: a randomized study. Hum Reprod 2003; 18(10): 2131–2136.
5. Cha KY et al. Pregnancy after in vitro fertilisation of human follicular oocytes collected from nonstimulated cycles, their culture in vitro and their transfer in donor oocyte program. Fertil Steril 1991; 55 : 109–113.
6. Chian RC et al. Pregnancies resulting from in vitro maturated oocytes retrieved from patients with polycystic ovary syndrome after priming with human chorionic gonadotropin. Fertil Steril 1999; 72 : 639–642.
7. Mikkelsen AL et al. In-vitro maturation of human oocytes from regularly menstruating women may be successful without follicle stimulating hormone priming. Hum Reprod 1999; 14(7): 1847–1851.
8. Pincus G et al. The comparative behavior of mammalian eggs in vitro end in vivo. J Exp Med 1935; 62 : 655–675.
9. Raj S et al. The use of gonadotrophin for the industion of ovulation in women with polycystic ovary syndrome. Fertil Steril 1977; 28 : 1280–1284.
10. Ri-Cheng Ch. In vitro maturation of immature oocytes for infertile women in PCOS. Reprod Biomed Online 2004; 8(5): 547–552.
11. Rosenwaks Z. Donor eggs:their applicaion in modern reproductive technologies. Fertil Steril 1987; 47 : 895–909.
12. Russell JB et al. Unstimulated immature oocyte retrieval: early versus midfollicular endometrial priming. Fertil Steril 1997; 67 : 616–620.
13. Trounson A et al. In vitro maturation and fertilization and developmental competence of oocytes recovered from untraeted polycystic ovarian patients. Fertil Steril 1994; 62 : 353–362.
14. Wynn P et al. Pretreatment with follicle stimulating hormone promotes the numbers of human oocytes reaching metaphase II by in vitro maturation. Hum Reprod 1998; 13(11): 3132–3138.
15. Yu-Hung L et al. Combinatio of FSH priming and hCG priming for in vitro maturation of human oocytes. Hum Reprod 2003; 18(8): 1632–1636.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Edukační kazuistikyČlánek Předčasné ovariální selháníČlánek Digitální obrazový archivČlánek Odborné akce
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2007 Číslo 4- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Pater semper incertus, sed nonnumquam etiam mater incerta est
-
Autorská soutěž praktické gynekologie
O nejlepší článek v roce 2007 - Edukační kazuistiky
- Štítna žľaza z pohľadu gynekológa
- Diferenciální diagnostika a terapie opakovaných těhotenských ztrát – 1. část
- Předčasné ovariální selhání
- Legální anonymní odložení novorozence – současné možnosti v ČR
- Digitální obrazový archiv
- In vitro maturácia oocytov: naše skúsenosti s prevenciou OHSS u rizikových pacientok
- Odborné akce
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Předčasné ovariální selhání
- Legální anonymní odložení novorozence – současné možnosti v ČR
- Diferenciální diagnostika a terapie opakovaných těhotenských ztrát – 1. část
- In vitro maturácia oocytov: naše skúsenosti s prevenciou OHSS u rizikových pacientok
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy