-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Perspektívy prevencie karcinómu maternicového krčka
Perspectives in the prevention of uterine cervix carcinoma
Sexually transmitted HPV infection is the basic etiological factor of uterine cervix carcinoma. Despite the existence of effective screening methods in the secondary prevention, the incidence of cervical carcinoma is still too high. Today, vaccination against HPV is a powerful tool in the primary prevention of this disease. In the close future, we will be able to significantly lower the occurrence of this type of cancer. However, classical prebioptic diagnostic methods will still play an important role in the prevention (Fig. 3, Tab. 1 [25]).
Key words:
uterine cervix carcinoma, HPV, vaccination, screening
Autoři: doc. MUDr. Ph.D. Martin Redecha 1; MUDr. Mikuláš Redecha 2; doc. MUDr. Miroslav Korbeľ; CSc. 1; MUDr. Zuzana Nižňanská, Ph.D. 1
Působiště autorů: I. gynekologicko-pôrodnícka klinika LFUK, Bratislava 1; II. gynekologicko-pôrodnícka klinika LFUK, Bratislava 2
Vyšlo v časopise: Prakt Gyn 2008; 12(1): 42-46
Práce je převzata z časopisu Praktická gynekológia 2007; 14(4): 148-153 na základě spolupráce redakcí našich časopisů a dohody o výměně odborných prací.
Souhrn
Základným etiologickým faktorom karcinómu maternicového krčka je sexuálne prenosná infekcia HPV. Aj pri existencii účinných skríningových metód využiteľných v sekundárnej prevencii, je incidencia rakoviny maternicového krčka stále vysoká. V súčasnosti už existujú možnosti primárnej prevencie tohto ochorenia, ktorých podstatou je vakcinácia proti HPV. V neďalekej budúcnosti tak bude možné podstatne znížiť výskyt karcinómu maternicového krčka. Svoje miesto v prevencii však stále budú mať aj klasické prebioptické diagnostické metódy (obr. 3, tab. 1 [25]).
Kľúčové slová:
karcinóm maternicového krčka, HPV, vakcinácia, skríningRakovina maternicového krčka je jedno z mála zhubných ochorení, pri ktorom dnes už poznáme základného vyvolávateľa, ľudský papilomavírus (HPV). Ide o ochorenie, ktoré by malo byť dnes už skôr zriedkavosťou, lebo je považované za dobre „skríningovateľné“. Maternicový krček je dostupný všetkým vyšetreniam, ochorenie sa vyvíja dlhú dobu cez prekancerózy. Máme k dispozícii dostatočne účinné, technicky a ekonomicky nenáročné a pacientku nezaťažujúce vyšetrovacie metódy na ich včasnú diagnostiku. Napriek tomu ide, po karcinóme prsníka, o druhé najčastejšie malígne ochorenie u žien. Podľa dostupných štatistík postihuje vo svete viac ako pol milióna žien ročne, viac ako tretina z nich ochoreniu podľahne [7]. Temer 80 % ochorení sa vyskytuje v rozvojových krajinách, najviac v Južnej Amerike a Afrike. Je to prirodzené, pretože v týchto geografických regiónoch si len ťažko možno predstaviť existenciu systematických skríningových programov. V Európe sa vyskytuje ročne asi 60 000 nových ochorení [18]. Na Slovensku je výskyt v posledných dvoch desaťročiach stabilizovaný, jeho incidencia (výskyt na 100 000 žien) je sa pohybuje okolo 18-18,2, čo v absolútnych číslach znamená o niečo menej ako 500 nových prípadov ročne [19].
Dnes už niet pochýb o úlohe papilomavírusovej infekcie v etiológii karcinómu maternicového krčka. HPV sa však dáva do súvislosti aj s niektorými inými malignitami, pri ktorých je súvislosť s HPV infekciou veľmi pravdepodobná, ale dosiaľ jednoznačne nepotvrdená. V anogenitálnej oblasti ide najmä s karcinómami vulvy a vagíny [5]. Vo viac ako 60 % prípadov sa dá dokázať prítomnosť HPV aj pri karcinóme konečníka. U mužov sa často diagnostikuje HPV pri karcinóme penisu. Zdá sa, že svoju úlohu môže mať HPV v etiológii karcinómov aj v iných lokalitách s viacvrstvovým dlaždicovým epitelom (koža, farynx, larynx, tonzily, ústna dutina). Niektorí autori dokonca uvažujú o úlohe HPV aj v etiológii iných karcinómov, napríklad endometria, ovárií, prostaty a iných [1].
HPV sú však, okrem malignít krčka, zodpovedné aj za vznik niektorých iných, síce benígnych, ale veľmi nepríjemných a ťažko liečiteľných ochorení. Spôsobujú vznik papilomatóznych výrastkov vo všetkých lokalitách s viacvrstvovým dlaždicovým epitelom. V anogenitálnej oblasti ide najmä o condylomata accuminata, papilomatózu pošvy a krčka maternice. U mužov spôsobuje papilomatózu penisu. V dýchacích cestách sú HPV zodpovedné za tvorbu laryngeálnych papilómov, ktoré môžu byť najmä u detí príčinou vážnych, niekedy až život ohrozujúcich stavov [17]. Dnes už vieme, že HPV sú mikroorganizmy, ktoré môžu vážnym spôsobom ovplyvniť život človeka. V prírode sú mimoriadne rozšírené. Infekcie v anogenitálnej lokalite sú považované za sexuálne prenosné. Výskyt anogenitálnej infekcie u žien v Európe a Severnej Amerike je prekvapujúco vysoká. Predpokladá sa, že 75-80 % žien sa počas svojho života dostáva do kontaktu s HPV infekciou. V populácii 25-30ročných žien sa anogenitálna infekcia zisťuje približne v 22-32 %. S pribúdajúcim vekom však jej výskyt klesá, v období päťdesiatky zostávajú pozitívne už len 2-3 % ženskej populácie. Takáto perzistujúca infekcia potom pretrváva až do neskorého sénia [3].
HPV sú malé DNA vírusy z čeľade papovaviridae. Dnes je známych už viac ako 100 genotypov, pričom nie všetky účinkujú rovnako a spôsobujú rovnaké ochorenia. Niektoré pôsobia karcinogénne, iné zasa spôsobujú tvorbu benígnych bradavicových výrastkov, papilómov, kondylómov. Podľa karcinogénneho účinku preto rozdeľujeme genotypy HPV na vysoko (HR HPV) a nízko rizikové (LR HPV). Podiel jednotlivých HR HPV na vzniku karcinómov maternicového krčka je zobrazený v tab. 1. Najčastejšími typmi, ktoré zisťujeme v benígnych - papilomatóznych léziách epitelu sú najmä LR HPV 6 a 11.
Tab. 1. Výskyt typov HPV pri karcinómoch maternicového krčka. 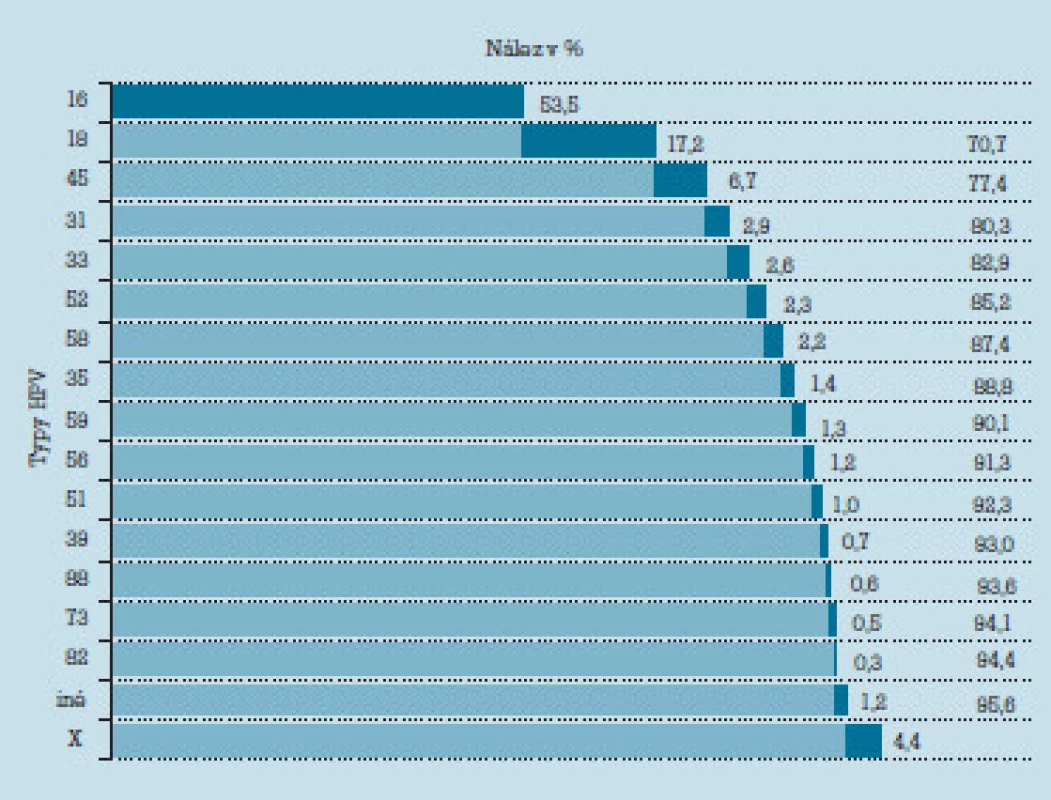
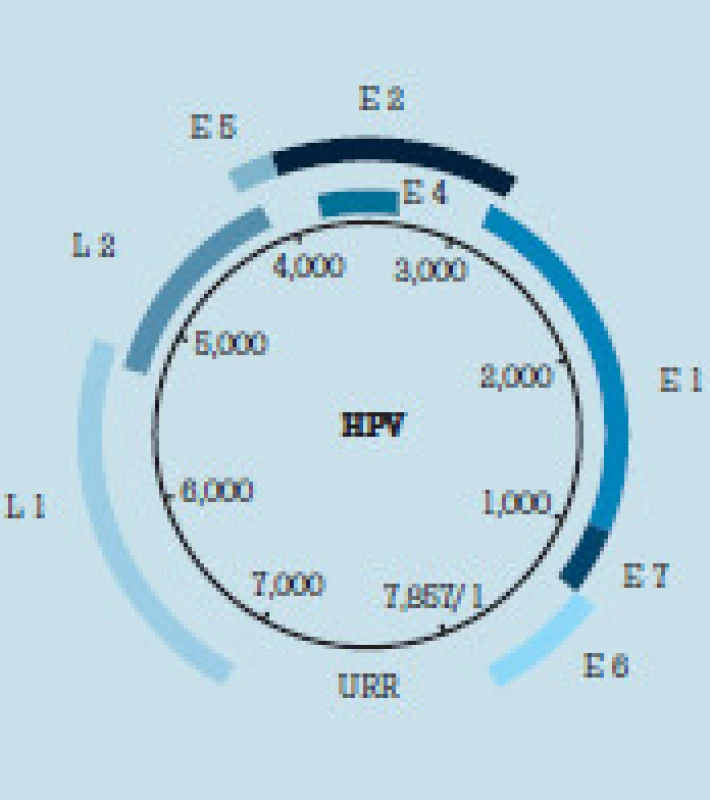
HPV sa skladajú z centrálne uloženého genónu, ktorý tvorí klasická dvojitá závitnica DNA obsahujúca 7 900-8 000 párov báz. Jej hmotnosť je asi 5 × 106 daltonov. Povrch vírusu tvorí bielkovinová kapsida. Oba konce reťazca DNA sú navzájom spojené kovalentnou väzbou, čím dostáva genóm cirkulárny tvar. Štruktúra DNA HPV je dnes už z veľkej časti presne známa. Jej schematické znázornenie je na obr. 1. Z hľadiska onkogenézy sú najdôležitejšie časti E6 a E7 genómu. Ide o časti DNA, v ktorých sú kódy pre syntézu onkogénnych bielkovín p53 a p105Rb a niektorých ďalších. Tieto proteíny sú v podstatnej miere zodpovedné za malígnu transformáciu napadnutej bunky. V častiach genómu označených ako L1 a L2 sú kódované bielkoviny kapsidy. Kapsida vírusu, tvorená týmito dvoma bielkovinami tvorí 85-90 % hmotnosti vírusu. Kapsidový proteín L1 je veľký a je v jednotlivých typoch HPV veľmi podobný. Proteín L2 je menší a u jednotlivých typov HPV odlišný. Schéma kapsidy HPV je znázornená na obr. 2. Oba kapsidové proteíny sú pre infikovanú bunku cudzorodé a majú pre ňu antigénny charakter. Za fyziologických okolností sa vytvárajú proti nim protilátky, ktorými organizmus eliminuje vírus a tak sa bráni proti infekcii [2,21,25].
Možnosti ochrany proti karcinómu krčka maternice
Ochranu proti vzniku krčkového karcinómu možno rozdeliť na 2 základné postupy. Kým na jednej strane ide o praxou overené postupy sekundárnej prevencie, teda včasnú diagnostiku a liečbu prekanceróz, v posledných rokoch sa presadzuje aj možnosť primárnej prevencie, profylaktická vakcinácia proti HPV.
Základným opatrením, vo vyspelých štátoch v posledných rokoch stále dôslednejšie uplatňovaným, je včasná diagnostika prekanceróz formou celoplošného skríningu. Spočíva vo využití, na tento účel veľmi vhodnej diagnostickej metódy, onkologickej cytológie. Ide o prebioptickú diagnostickú metódu, ktorá veľmi dobre spĺňa kritériá pre skríning. V krajinách, v ktorých sa podarilo zaviesť do praxe kvalitný skríning prekanceróz maternicového krčka, sa v priebehu krátkeho času podarilo znížiť výskyt tohto karcinómu o viacej ako 50 %. Ďalším skvalitňovaním skríningových programov, najmä ich stálym rozširovaním na širšie skupiny obyvateľstva, sa aj naďalej dosahuje pokles výskytu krčkových malignít [6,18]. Nevýhodou onkologickej cytológie je významný vplyv subjektívnych faktorov na jej senzitivitu a špecificitu. V niektorých krajinách západnej a strednej Európy, vrátane Slovenska, by sa mal vykonávať kombinovaný skríning. Onkologická cytológia sa pri preventívnych prehliadkach kombinuje s ďalšou diagnostickou metódou - kolposkopiou. Ako ukazujú doterajšie analýzy, kolposkopia v základnom skríningu sa len v minimálnej miere podieľa na jeho skvalitnení [14]. Väčšina odborníkov zastáva názor, že kolposkopia v základnom skríningu podstatne zvyšuje jeho ekonomickú náročnosť pri minimálnom zvýšení výťažnosti. Senzitivita a špecificita kolposkopického vyšetrenia je závislá najmä od špecializácie vyšetrujúceho lekára. Vo väčšine sa preto odporúča jej využitie skôr ako špecializovanej, nadstavbovej metódy, pri podrobnejšej diagnostike suspektných lézií zachytených v skríningu onkologickou cytológiou [12].
V posledných rokoch, po spoznaní úlohy HPV v etiológii karcinómu krčka, vznikli viaceré návrhy skríningových programov založených na diagnostike tohto vírusu. Zatiaľ sú tieto programy, z organizačného a tiež ekonomického hľadiska, aplikovateľné skôr v rozvojových krajinách s neúmerne vysokým výskytom karcinómu krčka a s nemožnosťou realizovať bežne zaužívané a osvedčené skríningové programy. V civilizovaných oblastiach sveta, kde je aplikovateľný cytologický, prípadne aj kolposkopický skríning, je zatiaľ diagnostika a typizácia HPV skôr len doplnkovou, špecializovanou, nadstavbovou metódou pri diagnostike prekanceróz [22].
Druhou možnosťou prevencie karcinómu krčka je ochrana proti infekcii HPV. Keďže ide o sexuálne prenosnú infekciu, základom ochrany je vyhýbanie sa promiskuitnému spôsobu života a dodržiavanie prísne monogamných partnerských vzťahov. Použitie prezervatívu ako bariérovej antikoncepcie, ktorá dostatočne chráni pred prenosom niektorých iných sexuálne prenosných infekcií, je pri HPV otázne. Dosiaľ nebolo presne dokázané, či prezervatív je dostatočnou ochranou proti prenosu HPV. V literatúre sú na túto otázku protichodné názory [13].
Vakcíny proti HPV
Poznanie antigénnych účinkov kapsidových bielkovinových štruktúr HPV priviedlo odborníkov na myšlienku vytvoriť očkovaciu látku proti tomuto vírusu. Ich vývoj sa ešte aj v súčasnosti vyvíja dvoma smermi. Na jednej strane sa pracuje na vývoji tzv. terapeutických vakcín. Ich podstatou je vpravenie hotovej protilátky do organizmu, ktorá by bola schopná eliminovať prítomné vírusy a tým zastaviť ďalšiu progresiu už existujúceho nádorového ochorenia [11]. Druhým smerom vývoja, ktorý dnes už bežne využívame v praxi, sú tzv. profylaktické vakcíny. Ich účinok je založený na tvorbe protilátok po aplikácii do makroorganizmu vírusu podobným časticiam - virus like particles (VLP), ktoré majú rovnaký antigénny charakter ako samotné bielkoviny vírusu (obr. 3). Organizmus po podaní VLP produkuje protilátky, ktoré sú potom účinné aj proti skutočným vírusom. Aj vývoj týchto vakcín sa vyvíjal viacerými cestami. Ako najschodnejšie sa ukázalo použitie vakcín s obsahom VLP, ktoré sú odvodené z hlavného kapsidového proteínu L1. Pracuje sa však aj na výskume vakcín založených na tvorbe protilátok proti L2 proteínu a tiež na kombinovaných vakcínach proti L1 aj L2 proteínu vírusovej kapsidy [9,24]. Vakcíny na princípe VLP L1 HPV sú dnes aj u nás zaregistrované a bežne dostupné. Ide o preparáty farmaceutických spoločnosti MerckSharpDöhne a spoločnosti GlaxoSmithKline, ktoré sú priekopníkmi vo vývoji očkovacích látok proti HPV. Ide o vakcíny využívajúce ako VLP morfologicky a antigénne temer identický proteín s L1 HPV. Za vznik imunity po očkovaní týmito látkami sú, pravdepodobne, zodpovedné IgG. Nepriamym dôkazom takéhoto tvrdenia je, že po pasívnom prenose týchto imunoglobulínov na neimunizovaných jedincov vzniká dočasná imunita aj u nich. Asi u 50 % jedincov očkovaných vakcínou proti HPV sa zisťuje aj zvýšenie hladín IgA. Imunita proti HPV však vzniká aj pri normálnych hladinách IgA [11,15].
Obr. 3. Elektrónovomikroskopický obraz VLP (HPV16). 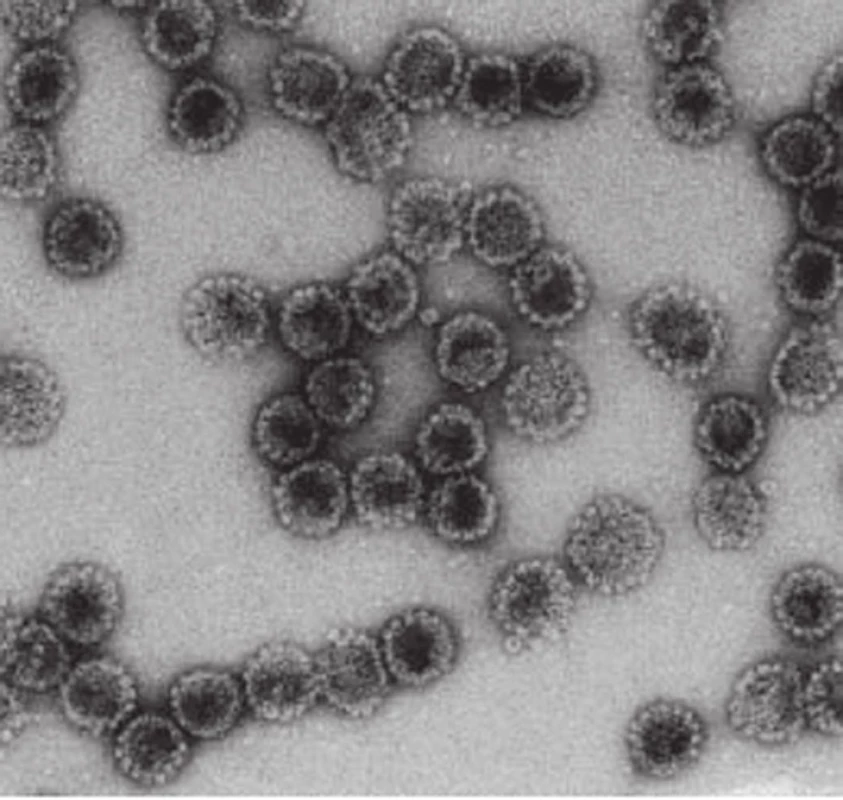
Hladiny protilátok po prekonaní prirodzenej infekcie nezanechávajú dostatočnú imunitu. Po aplikácii očkovacích látok sa v sére zisťuje niekoľko násobne vyššia hladina protilátok ako po natívnej infekcie, ktorá spoľahlivo chráni zaočkovaného jedinca po dobu minimálne 5 rokov [10]. Dlhšie pretrvávanie imunitnej odpovede je v súčasnosti predmetom ďalšieho sledovania. Vyššie hladiny protilátok sú tiež v cervikálnom hliene, čo spôsobuje elimináciu vírusu už na povrchu epitelu. Protilátky v sére zabezpečia ochranu proti vírusom, ktoré preniknú neporušené do hlbších vrstiev sliznice počas pohlavného styku cez drobné ragády vzniknuté pri frikčných pohyboch [25].
L1 proteínové vakcíny, ktoré sú dnes už na trhu, sú dvoj alebo štvorvalentné. Dvojvalentná vakcína je určená na vakcináciu proti najčastejším onkogénnym typom 16 a 18. Štvorvalentná vakcína imunizuje makroogranizmus aj proti nízkorizovým genotypom HPV 6 a 11, ktoré síce nespôsobujú karcinóm, ale sú etiologickým agensom bradavicovitých výrastkov v anogenitálnej oblasti (condylomata accuminata). Pri klinických skúškach sa ukazuje, vakcíny nechráni len proti genotypom 16 a 18, ale vzhľadom na veľmi podobnú štruktúru L1 proteínov jednotlivých genotypov HPV, majú určitý ochranný účinok aj proti iným genotypom HPV [6].
Z hľadiska účinnosti vakcinácie ide o podobnú situáciu ako pri očkovaní proti hepatitíde B, kde sa tiež využívajú purifikované VLP. Na vznik účinnej hladiny protilátok v sére však treba opakované podanie vakcíny. Pri obidvoch dostupných vakcínach sa odporúča 3 dávková aplikácia. Po základnej vakcinačnej dávke sa tvorba protilátok zosilňuje ešte dvoma ďalšími dávkami. Podľa klinických skúšok, ktoré boli doteraz vykonané, sa po takejto aplikácii udržuje dostatočná hladina protilátok v krvi najmenej 48 mesiacov [17]. Sledovanie ďalšieho vývoja hladín protilátok v sére a úroveň ochrany organizmu proti HPV infekcii si vyžaduje dlhšie pokračovanie klinických štúdií.
Najúčinnejšou ochranou proti rakovine maternicového krčka bude v budúcnosti asi vakcinácia proti HPV. I tu sa však stretávame s niektorými medicínskymi, ale najmä ekonomickými problémami. Vakcinácia by sa mala vykonávať u ešte neinfikovaných jedincov, teda ešte u sexuálne inaktívnych dievčat. Z epidemiologického hľadiska by bola najúčinnejšia, ak by sa vykonávala celoplošne, čo by si vyžadovalo nemalé finančné náklady. Selektívna vakcinácia na žiadosť pacientky (na vlastné náklady) by v budúcnosti mohla ovplyvniť výskyt karcinómu maternicového krčka len v ekonomicky vyspelých krajinách [8,12]. Najvyššia incidencia ochorenia je však v ekonomicky zaostalejších oblastiach. Ale aj celoplošná vakcinácia prináša so sebou viaceré otázky. Je vhodné zaočkovať len ženskú alebo aj mužskú časť populácie? Muži sú síce považovaní za prenoscov infekcie, ale HPV je u nich etiologickým faktorom karcinómu penisu. Jeho výskyt je síce podstatne zriedkavejší ako karcinómu krčka, nie je však raritný. Je predpoklad, že HPV zohráva významnú rolu pri vzniku aj iných malignít. Ani celoplošná vakcinácia ženskej populácie proti HPV by však v najbližších desaťročiach neznamenala úplné vynechanie skríningových programov. Ten by sa aj naďalej musel vykonávať u žien, u ktorých sa vakcinácia nevykonala. Doposiaľ vyrobené vakcíny chránia proti infekcii temer 80 % onkogénnych genotypov HPV. Ani zaočkované ženy teda nie sú v plnej miere chránené proti tomuto ochoreniu. Zanedbanie prevencie by preto mohlo mať závažné dôsledky [23].
Záver
Otázky cost-effective v tejto problematike a možnosti praktickej realizácie jednotlivých postupov sú v súčasnosti obsahom viacerých analýz a odborných štúdií. Navrhované sú rozličné modifikácie skríningových programov a schém, ktoré zohľadňujú rôzne možnosti vakcinácie a rozličné skríningové postupy s ohľadom na geografické odlišnosti jednotlivých krajín [11]. V našich podmienkach zatiaľ zostáva stále základnou metódou ochrany sekundárna prevencia. Každá žena má zatiaľ nárok na pravidelné, bezplatné, ročné preventívne gynekologické prehliadky, ktorých súčasťou má byť aj cytologické a kolposkopické vyšetrenie. Vakcinácia proti HPV zatiaľ zostáva na individuálnom rozhodnutí jednotlivcov.
doc. MUDr. Martin Redecha Ph.D.1
doc. MUDr. Miroslav Korbeľ, CSc.1
MUDr. Zuzana Nižňanská, Ph.D.1
1I. gynekologicko-pôrodnícka klinika LFUK, Bratislava
2II. gynekologicko-pôrodnícka klinika LFUK, Bratislava
Zdroje
1. Arbyn M, Paraskevaidis E, Martin-Hirsch P. Clinical utility of HPV-DNA detection: triage of minor cervical lesions, follow-up of women treated for high-grade CIN: an update of pooled evidence. Gynecol Oncol 2005; 99(Suppl 1): 7-11.
2. Asif M, Siddiqui A, Perry M. Human Papillomavirus Quadrivalent (types 6, 11, 16, 18) Recombinant Vaccine (Gardasil®). Drugs 2006; 66 : 1263-1271.
3. Baseman JG, Koutsky JA. The eoidemiology of human papillomavirus infections. J Clin Virol 2005; 32 : 16-24.
4. Castellsagu´e X, Diaz M, de Sanjose S. Worldwide human papillomavirus etiology of cervical adenocarcinoma and its cofactors: implications for screening and prevention. J Natl Cancer Inst 2006; 98 : 303–315.
5. Clifford GM, Smith JS, Plummer M. Human papillomavirus types in invasive cervical cancer worldwide: a metaanalysis. Br J Cancer 2003; 88 : 63-73.
6. Fife KH, Wheeler CM, Koutsky LA. Dose-ranging studies of the safety and immunogenicity of human papillomavirus type 11 and type 16 virus-like particle candidate vaccines in young healthy women. Vaccine 2004; 22 : 2943-2952.
7. Franceschi S. The IARC commitment to cancer prevention: the example of papillomavirus and cervical cancer. Recent Results Cancer Res 2005; 166 : 277-297.
8. Goldie SJ, Kohli M, Grima D et al. Projected clinical benefits and cost-effectiveness of a human papillomavirus 16/18 vaccine. J Natl Cancer Inst 2004; 96 : 604-615.
9. Harper DM, Franco EL, Wheeler C. Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with humanpapillomavirus types 16 and 18 in young women: a randomised controlled trial. Lancet 2004; 364 : 1757-1765.
10. Harper DM, Franco EL, Wheller CM. Sustained efficacy up to 4,5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from a randomised control trial. Lancet 2006; 367 : 1247-1255.
11. Liu DW, Chang JL, Tsao YP et al. Covaccination with adeno-associated virus vectors encoding human papillomavirus 16 L1 proteins and adenovirus encoding murine GM–CSF can elicit strong and prolonged neutralizing antibody. Int J Cancer 2005; 113 : 93-100.
12. Mandic A, Vujkov T. Human papillomavirus vaccine as a new way of preventing cervical cancer: a dream or the future? Ann Oncol 2004; 15 : 197-200.
13. Mao C, Koutsky LA, Ault KA. Efficacy of human papillomavirus-16 vaccine to prevent cervical intraepithelial neoplasia: a randomized controlled trial. Obstet Gynecol 2006; 107 : 18-27.
14. Mayrand MH, Duarte-Franco E, Coutlee F. Randomized controlled trial of human papillomavirus testing versus Pap cytology in the primary screening for cervical cancer precursors: design, methods and preliminary accrual results of the Canadian cervical cancer screening trial (CCCaST). Int J Cancer 2006; 119 : 615-623.
15. Munoz N, Bosch FX, Castellsague X. Against which human papillomavirus types shall we vaccinate and screen? The international perspective. Int J Cancer 2004; 111 : 278-285.
16. Nardelli-Haefliger D, Lurati F, Wirthner D. Immune responses induced by lower airway mucosal immunisation with a human papillomavirus type 16 virus-like particle vaccine. Vaccine 2005; 23 : 3634-3641.
17. Olsson SE. For the Future II Study Group. Post-infection prophylaxis of a quadrivalent HPV (types 6, 11, 16, 18) L1 VLP vaccine: a combined analysis. The 6th International Multidisciplinary Congress of the European Research Organization on Genital Infection and Neoplasia. Abstract. Paris 2006 : 23-26.
18. Parkin DM, Bray F, Ferlay J. Global cancer statistics 2002. Cancer J Clin 2005; 55 : 74-108.
19. Redecha M, Korbeľ M, Nižňanská Z. Výskyt karcinómu maternicového krčka na Slovensku v rokoch 1990-2000. Gynekol Prax 2004; 2 : 118-124.
20. Riedesel JM, Rosenthal SL, Zimet GD. Attitudes about human papillomavirus vaccine among family physicians. J Pediatr Adolesc Gynecol 2005; 18 : 391-398.
21. Sasagawa T, Tani M, Basha W. A human papillomavirus type 16 vaccine by oral delivery of L1 protein. Virus Res 2005; 110 : 81-90.
22. Schiller J, Davies P. Delivering on the promise: HPV vaccines and cervical cancer. Nat Rev Microbiol 2004; 2 : 343-347.
23. Schreckenberger C, Kaufmann AM. Vaccination strategies for the treatment and prevention of cervical cancer. Curr Opin Oncol 2004; 16 : 485-491.
24. Villa LL, Costa RL, Petta CA. Prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle vaccine in young women: a randomised double-blind placebo-controlled multicentre phase II efficacy trial. Lancet Oncol 2005; 6 : 271-278.
25. Yang BH, Bray FI, Parkin DM. Cervical cancer as a priority for prevention in different world regions: An evaluation using years of life lost. Int J Cancer 2004; 109 : 418-424.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Edukační kazuistikaČlánek Úvodní slovo
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2008 Číslo 1- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Ultrazvuková biometrie hlavičky při poloze plodu koncem pánevním
- Raritní případ vlasatobuněčné leukemie v graviditě − kazuistika
- Vliv programovaného a indukovaného porodu na frekvenci císařských řezů a vaginálních operačních porodů
- Nástup menarché, vývoj sekundárnych pohlavných znakov a sekulárny trend u dievčat Bratislavského kraja
- Neradikální operační řešení cervikální gravidity po IVF/ET: kazuistika
- Úvodní slovo
- Jak ženy snáší vaginální kombinovanou antikoncepci NuvaRing®?
- Retrográdní ejakulace – jedna z příčin mužské neplodnosti
- Projekt Menopace: výsledky studie
- Perspektívy prevencie karcinómu maternicového krčka
-
Praktická urogynekologie XVI.
Mělník 2007 - Program postgraduálního a celoživotního vzdělávání v gynekologii a porodnictví na rok 2007
-
Autorská soutěž praktické gynekologie
O nejlepší článek v roce 2008 - Edukační kazuistika
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Retrográdní ejakulace – jedna z příčin mužské neplodnosti
- Ultrazvuková biometrie hlavičky při poloze plodu koncem pánevním
- Jak ženy snáší vaginální kombinovanou antikoncepci NuvaRing®?
- Neradikální operační řešení cervikální gravidity po IVF/ET: kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy