-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Těhotenské ztráty po metodách asistované reprodukce
Pregnancy loss after the assisted reproductive technologies.
In connection with the increasing success rate of the assisted reproductive technology we are more interested in the number of pregnancies ending by the healthy children delivery. Our aim is to increase the number of children born after the assisted reproductive treatment. The retrospective analysis of the group of patients experienced the pregnancy loss was performed. Base on it we would like to offer new therapeutic advancements to reduce the pregnancy loss rate. 649 pregnancies following ART methods during 2004–2007 were analysed retrospectively. Infertility factors, ART methods, applied stimulation protocol, patient’s age and gestational age were observed. All pregnancies types including TOP and loss during the delivery were analysed. Base on tests performed before the treatment procedure was indicated. Total pregnancy loss was 125 (19,3 %), the most frequent missed abortion till the 12th week (10,9 %) and spontaneous abortion (2,0 %). Almost comparable are pregnancy loss rate in case of tubal (21,3 %), ovarian (16,9 %), genetic (18,2 %) and male (18,2 %) factor and endometriosis (20,5 %). Immunologic factor is 50,0 % and idiopathic factor is 31,0 %. In case of depot GnRH agonist use the pregnancy loss rate was 18,8 %, non‑depot GnRH agonist 16,0 %. Use of GnRH antagonist produced 23,6 % loss. In connection with separate methods following results were obtained: ICSI 18,4 %, PGD 20,2 %, OD 25,5 %, TESE 0 %, FET 35,9 %. The average age of women was 30,9 years, the average age of men 32,4. The majority of pregnancies is lossed till the end of the 7th week. The pregnancy loss rate is comparable to data indicated by others authors and even lower compare to some others. Looked on the miscarriages only, the rate is really low, 12,9 %. Ectopic pregnancy rate is also low, 1,2 %. High pregnancy loss rate is found among pregnancies following frozen-thawed embryo transfer, which is according to general presumptions, and among women with immunologic and idiopathic infertility factor. The difference between the GnRH agonist and GnRH antagonist group is significant on behalf of agonists. The average client’s age doesn’t differ from the age of treated couples.
Key words:
pregnancy loss – abortion – infertility – assisted reproductive technology
Autori: L. Hromadová; P. Trávník
; K. Veselá; J. Veselý; G. Tauwinklová
; E. Oráčová
Pôsobisko autorov: Sanatorium REPROMEDA, Brno
Vyšlo v časopise: Prakt Gyn 2009; 13(2): 93-98
Súhrn
Se vrůstající úspěšností metod asistované reprodukce nás stále více zajímá podíl gravidit končících porodem zdravého dítěte. Naším cílem je podíl živě narozených dětí po metodách AR pokud možno ještě zvýšit. Analyzovali jsme soubor pacientek s těhotenskou ztrátou. Na základě této analýzy bychom chtěli případně nabídnout nové terapeutické postupy, které podíl těhotenských ztrát sníží. Byla provedena retrospektivní analýza 649 gravidit vzniklých v sanatoriu REPROMEDA v letech 2004–2007. Jednotlivé typy těhotenských ztrát byly dány do souvislosti se zjištěnou příčinou sterility páru, užitými metodami AR a aplikovaným stimulačním protokolem. Sledovány byly všechny typy těhotenských ztrát včetně UPT po celé období gravidity i v době porodu. Na základě provedených vyšetření byl indikován individualizovaný terapeutický postup. Celkový počet ztrát byl 125 (19,3 %), z čehož nejčastěji se jednalo o missed abortion do 12. t. g. (10,9 %) a spontánní potrat (2,0 %). Téměř srovnatelné podíly těhotenských ztrát nalézáme u tubárního (21,3 %), ovariálního (16,9 %), genetického (18,2 %) a andrologického faktoru (18,2 %) a endometriózy (20,5 %). Procento ztrát bylo vysoké v případě imunologické (50,0 %) a idiopatické (31,0 %) sterility. Při užití dlouhého protokolu s depotním GnRH agonistou činil podíl ztrát 18,8 %, s nedepotním agonistou 16,0 %. V případě krátkého protokolu s užitím GnRH antagonisty jsme našli 23,6 % ztrát. V souvislosti s jednotlivými metodami byly výsledky následující: ICSI 18,4 %, PGD 20,2 %, OD 25,5 %, TESE 0 %, KET 35,9 %. Průměrný věk ženy v době početí byl 30,9 roku, průměrný věk muže 32,4 let. Nejvíce těhotenských ztrát – 61,6% – bylo zaznamenáno do konce 7. týdne gravidity. Procento těhotenských ztrát u námi léčených párů je srovnatelné s daty uváděnými jinými autory, a ve srovnání s některými jinými pracemi dokonce nižší. Hodnotili jsme všechny těhotenské ztráty. Posuzujeme‑li pouze skupinu abortů, je podíl nízký, a to 12,9 %. Zjistili jsme nízký podíl GEU, 1,2 %. Vysoký podíl ztrát je mezi těhotnými po KET, což je v souladu s obecnými předpoklady, a imunologickým a idiopatickým faktorem sterility. Významný rozdíl je při užití GnRH agonisty a antagonisty v neprospěch antagonisty. Průměrný věk žen a mužů s těhotenskou ztrátou se neliší od průměrného věku léčené klientely. Nejvíce těhotenských ztrát bylo zaznamenáno do konce 7. týdne gravidity.
Klíčová slova:
těhotenská ztráta – potrat – sterilita – asistovaná reprodukceSpontánním potratem končí dle literárních údajů 10–30 % [1,2,7] klinicky diagnostikovaných těhotenství. Ve skutečnosti je podíl ztrát vyšší, přibližně 70 %, neboť zhruba v 50 % případů dojde k zániku plodu ještě před zaznamenáním klinického těhotenství [3,4].
V našich krajích se od konce 70. let dynamicky rozvíjí metody asistované reprodukce. Postupně se vyvíjejí další, modernější postupy a spolu s tím se rozšiřuje i spektrum indikací k jejich užití. Zvyšuje se také počet neplodných párů, které jsou pomocí metod asistované reprodukce léčeny. Zatímco začátkem 90. let bylo v České republice zaznamenáno méně než 2000 monitorovaných cyklů [5], v roce 2007 jich bylo již něco kolem 17 000. Podíl těhotných se zvýšil z udávaných 15 % v roce 1993 [5] až na současných asi 50 % gravidit na embryotransfer, čehož standardně dosahují kvalitní centra asistované reprodukce. V sanatoriu REPROMEDA byla v roce 2007 kumulativní úspěšnost 3 IVF cyklů s přenosem čerstvých embryí 98,7 %. V souvislosti s těmito vysokými čísly nás pochopitelně stále více zajímá podíl úspěšně ukončených těhotenství, tedy gravidit, které končí porodem zdravého plodu. Literární prameny udávají 18–30 % spontánních potratů mezi těhotenstvími vzniklými po metodách asistované reprodukce [6]. Tento relativně vysoký údaj je ovlivněn několika fakty: těhotenství po metodách AR jsou mnohem dříve diagnostikována a bedlivě monitorována. V případě spontánních koncepcí mohou některá těhotenství končící potratem uniknout pozornosti a být považována jen za opožděný nástup menstruace. Další důležitou roli zde hraje i fakt, že v IVF centrech pracujeme se selektovanou skupinou klientů, která je zatížena vyšším rizikem těhotenské ztráty. K abortu jsou predisponovány zejména ženy se syndromem polycystických ovarií, partnerky mužů s těžkou oligoasthenoteratospermií, páry se strukturální či numerickou odchylkou chromozomů či ženy opakovaně potrácející. Současně páry léčené v IVF centrech mohou být v průměru starší než populace, která je přirozeně fertilní. Faktem ale zůstává, že díky těhotenským ztrátám je prvotní úspěch mimotělního oplození redukován, což může vést k jeho negativnímu vnímání a psychickým dopadům na léčené páry.
Práce vznikala v našem sanatoriu s myšlenkou primárně zjistit podíl těhotenských ztrát v souboru klientek těhotných po IVF a porovnat tento údaj s daty udávanými v literatuře. Na základě podrobnějších analýz takto definovaného souboru bychom případně měli být schopni nabídnout léčeným párům nové terapeutické postupy vedoucí ke zvýšení podílu úspěšně ukončených těhotenství.
Materiál a metody
V sanatoriu REPROMEDA byla provedena retrospektivní analýza 649 těhotenství vzniklých v letech 2004–2007 v souvislosti s užitím různých metod a technik asistované reprodukce. Při posuzování podílu těhotenských ztrát jsme si všímali faktoru sterility, aplikované metody asistované reprodukce, užitého stimulačního protokolu, průměrného věku ženy a muže v období vzniku těhotenství a gestačního stáří v době ztráty.
U všech párů podstupujících léčbu metodami asistované reprodukce byly před zařazením do léčebného programu vyšetřeny následující parametry: hormonální profil ženy 2.–3. den cyklu, ultrazvuk malé pánve, spermiogram muže, karyotypy obou partnerů. V případě předchozích opakovaných těhotenských ztrát či pozitivní rodinné anamnézy rovněž hladiny antifosfolipidových protilátek a trombofilní mutace partnerky. Na základě těchto vyšetření byl indikován individualizovaný léčebný postup.
Ke stimulaci ovarií pro získání vlastních oocytů byl léčeným ženám podán rekombinantní FSH (Gonal F, Serono; Puregon, Organon) nebo vysoce čištěné urinární preparáty obsahující FSH: LH v poměru 1 : 1 (Menopur, Ferring GmbH). Tyto gonadotropiny byly užity v krátkém stimulačním protokolu s aplikací GnRH antagonisty (Cetrotide, Serono) či dlouhém stimulačním protokolu s GnRH agonisty depotními nebo nedepotními (Diphereline, Beaufour Ipsen Pharma; Decapeptyl, Ferring GmbH; Synarel, Pfizer). Indukce ovulace byla provedena subkutánním podáním 500 mikrogramů rekombinantního hCG (Ovitrelle, Serono) nebo 10 000 IU urinárního hCG (Pregnyl, Organon). Odběr oocytů byl prováděn v celkové anestezii vaginální cestou, oocyty byly oplozovány klasickou fertilizací nebo pomocí intracytoplazmatické injekce spermií (ICSI). Embryotransfer byl proveden 5. den kultivace embryí. V případě užití metody preimplantační genetické diagnostiky (PGD) byla 3. den kultivace bioptována embrya pro odběr 1–2 blastomer. K podpoře luteální fáze byl vaginálně podán mikronizovaný progesteron (Crinone 8 %, Serono; Utrogestan, Laboratoires Besins International).
Dárkyně oocytů byly stimulovány v krátkém protokolu s užitím GnRH antagonisty, pro synchronizaci cyklu užívaly před vlastní stimulací hormonální antikoncepci.
Endometrium pacientek přijímajících darované oocyty bylo připravováno estradiolem v perorální či transdermální formě, k transformaci endometria byl užit mikronizovaný progesteron.
Medikace v cyklech s přenosem zmrazených embryií (kryoembryotransferem) byla obdobná.
Ve všech cyklech byl standardně podáván Dexamethazon 0,5 mg, respektive Prednison 5 mg. Pokud nebyla v minulosti zjištěna alergie na kyselinu acetylsalicylovou, do standardního stimulačního protokolu byl zařazen Anopyrin v dávce 100, respektive 50 a 30 mg. Doporučeno bylo užívání vitamínů určených pro první trimestr gravidity.
V případě anamnézy předchozích těhotenských ztrát a zjištěné pozitivity antifosfolipidových protilátek či trombofilních mutací byly ve spolupráci s klinickým hematologem pacientky zajištěny podáním nízkomolekulárního heparinu, kyseliny listové, případně intravenózních imunoglobulinů.
Při nově zachycených endokrinních poruchách (zejména hyperprolaktinemie, hypotyreóza) byly pacientky adekvátně léčeny ve spolupráci s endokrinologem.
Všem ženám bylo doporučeno provedení těhotenského testu z moči 14. den po embryotransferu. V případě pozitivního výsledku byl 15.–17. den prováděn odběr krve ke stanovení hladiny hCG, estradiolu a progesteronu a současně i ultrazvukové vyšetření. Za pozitivní výsledek byla považována hladina hCG vyšší než 10 IU/l. Jednalo li se o fyziologickou ranou graviditu, nové hormonální a ultrazvukové vyšetření bylo prováděno v rozmezí dalších 10–14 dnů, tedy v 6.–7. týdnu těhotenství. Klinické těhotenství bylo definováno jako průkaz gestačního váčku v děloze, nález embryonální tkáně při histologickém vyšetření preparátu získaného revizí dutiny děložní, případně operací mimoděložní gravidity. Většina těhotných byla v péči sanatoria do konce 7.–8. týdne těhotenství, po stanovení počtu plodů a průkazu srdeční akce byly těhotné předány do těhotenské poradny odesílajícího gynekologa. Podpora vaginálně aplikovaným progesteronem, podání kortikoidů a kyseliny acetylsalicylové byla doporučena do konce 12. týdne těhotenství. Příjemkyním oocytů a ženám těhotným po kryoembryotransferu bylo doporučeno současné užití estradiolu do konce 12. týdne. Vyplývalo li to z diagnózy, některé pacientky zůstávaly dále v odborné péči příslušných specialistů (hematologa, endokrinologa a dalších).
Všechny páry byly v čase předání žádány o pozdější sdělení výsledku probíhajícího těhotenství. Klienti, kteří tak neučinili, byli zpětně na výsledek těhotenství telefonicky dotázáni.
Výsledky
V našem souboru se vyskytly následující těhotenské ztráty: zamlklý potrat (10,9 %), spontánní potrat (2,0 %), spontánní redukce vícečetné gravidity (1,4 %), anembryomola (1,1 %), ztráta po předchozí fetoredukci vícečetné gravidity (0,5 %), mrtvěrozený plod (0,4 %), mimoděložní gravidita (1,2 %), biochemická gravidita (0,8 %), umělé přerušení těhotenství pro VVV plodu (0,5 %), UPT z důvodů matky (0,2 %), exitus plodu po porodu (0,2 %).
Celkový počet těhotenských ztrát byl 125, což je 19,3 %. Vezmeme li v úvahu jen dvě nejčastěji se vyskytující ztráty, což jsou missed abortion a spontánní potrat, získáváme údaj 12,9 %.
Celkový přehled těhotenských ztrát shrnuje graf 1.
Graf 1. Celkový přehled těhotenských ztrát. 
Rozdělení těhotenských ztrát podle faktorů neplodnosti je uvedeno v tabulce 1 a grafu 2.
Graf 2. Přehled těhotenských ztrát podle faktorů neplodnosti. 
Téměř srovnatelné podíly těhotenských ztrát nalézáme u tubárního (21,3 %), ovariálního (16,9 %), genetického (18,2 %) a andrologického faktoru (18,2 %) a endometriózy (20,5 %). Vysoký podíl ztrát nalézáme v případě imunologické (50,0 %) a idiopatické (31 %) sterility.
Tab. 1. Přehled těhotenských ztrát podle faktorů neplodnosti. 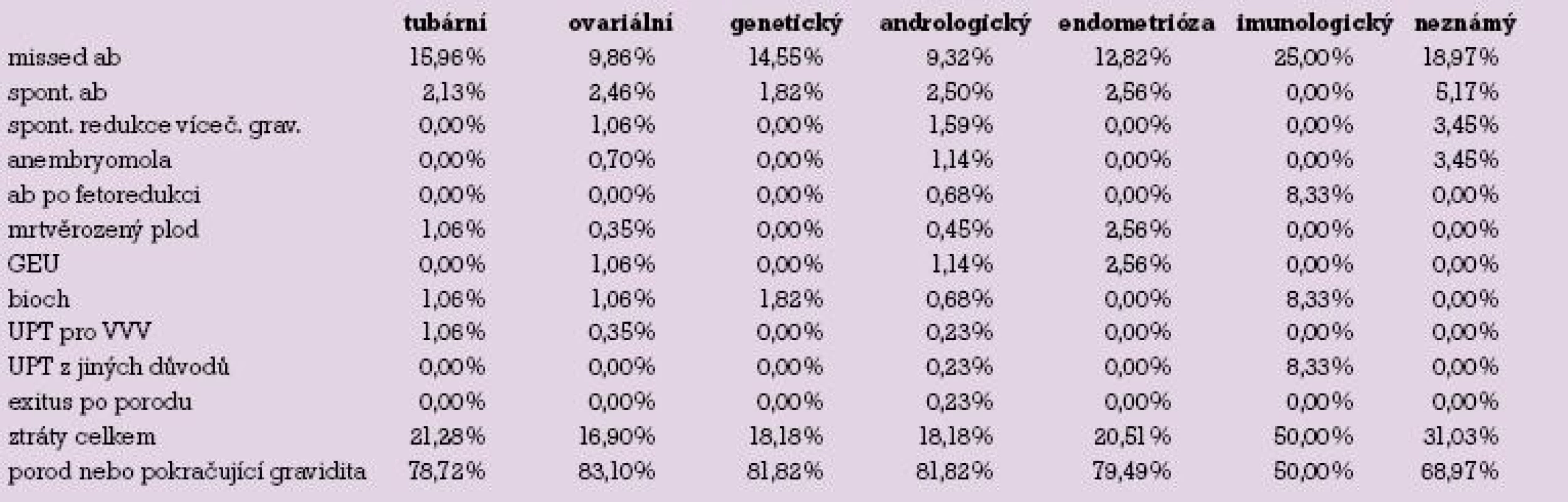
Rozdíl nalézáme v případě užitých stimulačních protokolů – viz graf 3.
Graf 3. Přehled ztrát podle užitého stimulačního protokolu. 
U pacientek stimulovaných v dlou-hém protokolu s užitím depotního GnRH agonisty (v grafu označeno LP) byl podíl ztrát 18,8 %. V protokolech s nedepotním GnRH agonistou (LP 22) ztráty tvořily 16,0 %. Nejvyšší podíl ztrát byl zjištěn v případech, kdy byly pacientky stimulovány FSH v krátkém protokolu s aplikací GnRH antagonisty (SP) – 23,6 %. Jedna pacientka, která byla stimulována při užití ultrakrátkého protokolu (USP), potratila, ztráta byla klasifikována jako missed abortion.
Těhotenské ztráty podle metod shrnuje tabulka 2 a graf 4.
Graf 4. Přehled ztrát podle metod. 
V souvislosti s aplikací techniky mikromanipulačního oplození oocytů (ICSI) došlo k těhotenské ztrátě v 18,4 %. Preimplantační genetická diagnostika (PGD) předcházela 20,2 % ztrát; díky operační technice získání spermií z tkáně varlete (TESE) otěhotnělo celkem 5 pacientek a všechny porodily, podíl ztrát v této skupině je tedy 0 %. 25,5 % těhotenských ztrát je zaznamenáno ve skupině příjemkyň oocytů a 35,9 % ztrát zaznamenáváme ve skupině těhotných po kryoembryotransferu (KET).
Tab. 2. Přehled ztrát podle metod. 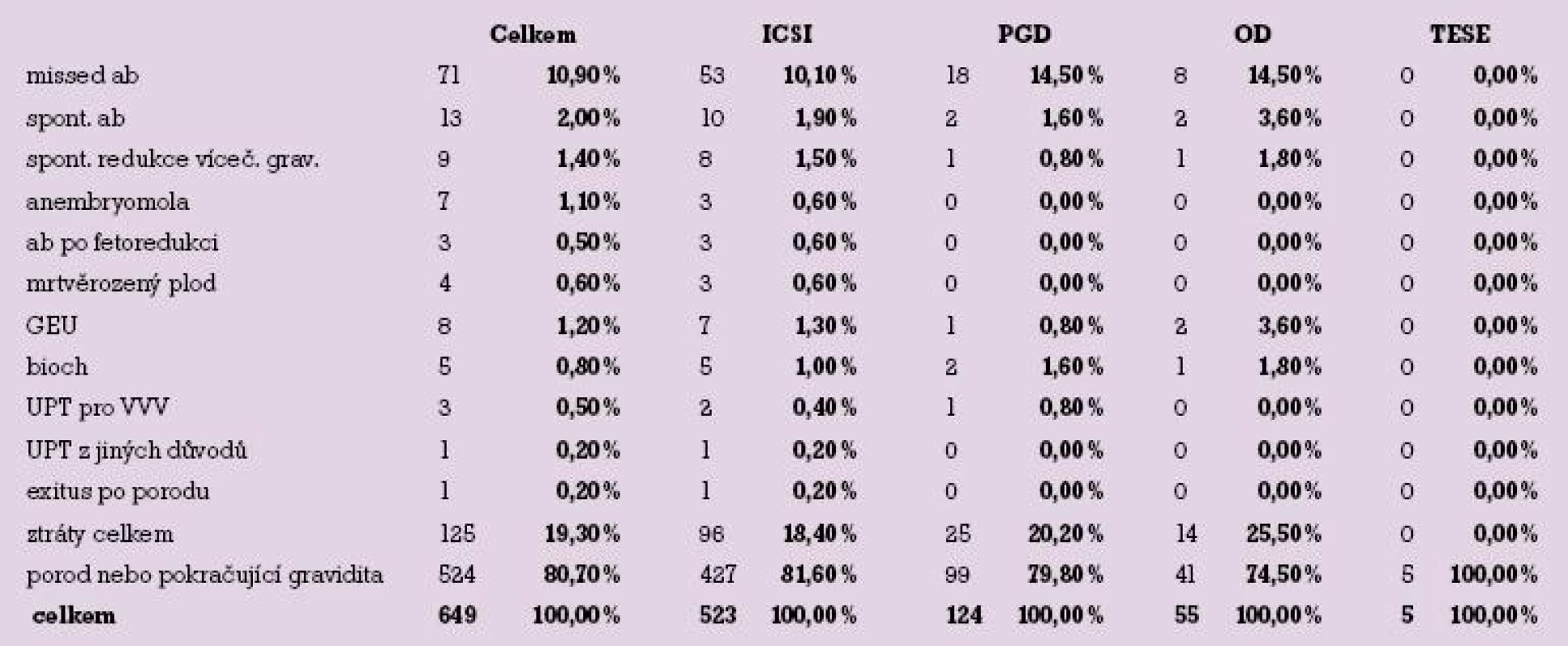
Nejpočetněji jsou zastoupeny dva typy těhotenských ztrát, zamlklý potrat a spontánní potrat. Ve skupině těhotných po ICSI je souhrnný podíl potratů 12,0 %, po PGD 16,1 %, po darování oocytů 18,1 %. Po KET je procento potratů nejvyšší – 28,1 %.
Graf 5. Přehled ztrát podle věku. 
Průměrný věk pacientky s těhotenskou ztrátou byl v době otěhotnění 30,9 let (rozpětí 27,4–34,7), průměrný věk jejich partnerů byl 32,4 roku (29,8–37,9).
Nejvíce těhotenských ztrát, 61,6 %, jsme zaznamenali do konce 7. týdne těhotenství. V této skupině bylo nejvíce zamlklých gravidit, 69 %.
Diskuse
Naše analýza ukázala, že procento těhotenských ztrát u námi léčených párů je srovnatelné s daty uváděnými jinými autory [7,6,9] a ve srovnání s některými jinými pracemi dokonce nižší [1]. Musíme znovu zdůraznit, že jsme do celkového procenta těhotenských ztrát započítali všechny ztráty od rozpoznání těhotenství až do období po porodu včetně indukovaných abortů a ztrát v souvislosti s arteficiálními výkony. Budeme li se zabývat stejně jako ostatní autoři pouze klinickými potraty, potom je procento ztrát nízké, a to 12,9 %. Jedná se o souhrnný podíl abortů po aplikaci všech metod asistované reprodukce.
Zatímco po ICSI, darování oocytů a PGD jsou tyto ztráty srovnatelně zastoupeny, mnohem vyšší podíl potratů je ve skupině těhotných po KET. Tato situace koresponduje s již dříve známými údaji, že kryokonzervace embryí je spojena se zhoršenými těhotenskými výsledky a vyšším podílem těhotenských ztrát ve srovnání s přenosem čerstvých embryí [8]. Navíc těhotenský soubor po KET zahrnuje i těhotenství po KET-PGD, tedy těhotenství vzniklá z embryí po provedené biopsii embryí pro preimplantační genetickou diagnostiku a následném zmrazení nadbytečných geneticky zdravých embryí. Je známo několik prací, které dokladují, že vyjmutí 1–2 blastomer a následná kryokonzervace embryí výrazně redukuje schopnost jejich delšího přežití [10,11].
Vyšší podíl těhotenských ztrát než v jiných skupinách nalézáme v případě imunologického faktoru sterility. Podíváme li se na tuto skupinu podrobněji, mezi všemi ztrátami zde 25 % tvoří missed abortion. Ale současně jsou v této skupině více než ve kterékoli jiné zastoupena biochemická gravidita (8,3 %), těhotenská ztráta po fetoredukci (8,3 %) a nutnost ukončení gravidity z důvodů matky (taktéž 8,3 %). Je možné, že ačkoli imunologický faktor nejčastěji chápeme jako výskyt antispermatických, antizonálních či antifosfolipidových protilátek a jako takový jej s užitím metody ICSI a podáním kyseliny acetylosalicylové, kortikoidů, případně nízkomolekulárního heparinu léčíme, porucha v imunitním systému může být složitější, obtížně detekovatelná a námi již dále špatně terapeuticky ovlivnitelná. V případě vysokého podílu potratů ve skupině s idiopatickou sterilitou (31,0 %) můžeme hypoteticky usuzovat opět na některou neprokázanou patologii v imunitním systému ženy či odchylku genetickou, a to jinou než numerickou či strukturální aberaci chromozomů. Karyotypy obou partnerů zařazených do skupiny s neznámou příčinou sterility byly normální.
Více těhotenských ztrát nalézáme v případě užití krátkého stimulačního protokolu s podáním GnRH antagonisty. GnRH antagonista je aplikován k prevenci předčasného vzestupu LH. Je třeba dále podrobně zhodnotit hladiny LH, estradiolu a progesteronu v době zahájení podání antagonisty u všech žen stimulovaných v krátkém protokolu. Je známý fakt, že expozice vyšším hladinám LH a progesteronu v časné folikulární fázi vede ke snížení podílu pokračujících těhotenství [12,13]. Vysoké hladiny LH a estradiolu v časné folikulární fázi negativně ovlivňují schopnost receptivity endometria. Je li za přispění GnRH antagonisty stimulována dárkyně oocytů a embrya jsou přenášena do dělohy příjemkyň, je tedy tímto způsobem vyloučen negativní vliv endometria, jsou těhotenské výsledky srovnatelné s výsledky IVF cyklů s užitím GnRH agonisty. Užití antagonisty tedy pravděpodobně nemá negativní efekt na zrání oocytu, podíl oplozených oocytů, vývoj ani podíl implantovaných embryí [14].
Průměrný věk ženy s těhotenskou ztrátou byl v době početí 30,9 roku (rozpětí 27,4–34,7), průměrný věk muže byl 32,4 roku (29,8–37,9). V našem souboru se nepotvrdil známý a také námi předpokládaný fakt, že k těhotenským ztrátám dochází ve vyšších věkových kategoriích. Věk klientů s těhotenskou ztrátou se nelišil od průměrného věku klientely sanatoria REPROMEDA.
Podíl mimoděložních gravidit je v našem souboru 1,2 %. Literatura udává podíl GEU po léčbě sterility 0,5–5,5 % [15,16].
Naše analýza je primární sondou do souboru těhotných. Došli jsme k pozitivnímu závěru, že v naší skupině 649 gravidních klientek 524 (80,7 %) těhotných donosilo a porodilo zdravý plod. Podíl všech ztrát v průběhu těhotenství plně koresponduje se zkušenostmi renomovaných pracovišť, podíl potratů je v naší skupině nízký. Přesto se domníváme, že je na místě podrobnější vyhodnocení k tomu, abychom mohli vést cílenější poradenství a individuálně zaměřenou terapii. Dosud jsme nevyhodnotili parametry jako body mass index, podíl pacientek se syndromem PCO, kouření, předchozí aborty, výška endometria a jiné. Tyto skutečnosti u všech léčených žen pečlivě monitorujeme, čekají však na naše statistické hodnocení.
MUDr. Lenka Hromadová
prof. MUDr. Pavel Trávník, DrSc.
MUDr. Kateřina Veselá
MUDr. Jan Veselý, CSc.
Mgr. Gabriela Tauwinklová
Mgr. Eva Oráčová
Sanatorium REPROMEDA, Brno
Zdroje
1. Farr SL, Schive LA, Jamieson DJ. Pregnancy Loss among Pregnancies Conceived through Assisted Reproductive Technology, United States, 1999–2002. American Journal of Epidemiology 2007; 165(12): 1380–1388.
2. Reddy UM. Opakované těhotenské ztráty: negenetické příčiny. Gynekologie po promoci 2007; 7(5): 14–18.
3. Roztočil A. Opakované těhotenské ztráty: negenetické příčiny. Gynekologie po promoci 2007; 7(5): 20–23.
4. Madar J, Nouza K, Nováková D. Imunologické aspekty habituálního potrácení. Moderní gynekologie a porodnictví 2002; 11(4): 621–627.
5. Mardešič T. Indikace a výsledky léčby sterility metodami asistované reprodukce. Moderní gynekologie a porodnictví 2002; 11(4): 565–571.
6. Wang JX, Norman RJ, Wilcox AJ. Incidence of spontaneous abortion among pregnancies produced by assisted reproductive technology. Human Reproduction 2004; 19(2): 272–277.
7. Tummers P, De Sutter P, Dhont M. Risk of spontaneous abortion in singleton and twin pregnancies after IVF/ICSI. Human Reproduction 2003; 18(8): 1720–1723.
8. Salumets A, Suikkari AM, Mäkinen S et al. Frozen embryo transfers: implications of clinical and embryological factors on the pregnancy outcome. Human Reproduction 2006; 21(9): 2368–2374.
9. Winter E, Wang J, Davies MJ et al. Early pregnancy loss following assisted reproductive technology treatment. Human Reproduction 2002; 17(12): 3220–3223.
10. Magli MC, Gianaroli L, Fortini D et al. Impact of blastomere biopsy and cryopreservation techniques on human embryo viability. Human Reproduction 1999; 14(3): 770–773.
11. Joris H, Van den Abbeel E, De Vos A et al. Reduced survival after human embryo biopsy and subsequent cryopreservation. Human Reproduction 1999; 14(11): 2833–2837.
12. Kolibianakis EM, Albano C, Kahn J et al. Exposure to high levels of luteinizing hormone and estradiol in the early follicular phase of gonadotropin‑releasing hormone antagonist cycles is associated with reduced chance of pregnancy. Fertility Sterility 2003; 79(4): 873–880.
13. Kolibianakis EM, Tarlatzis B, Devroy P. GnRH antagonists in IVF. Reproductive BioMedicine Online 2005; 11(2): 271.
14. Prapas N, Prapas Y, Panagiotidis Y et al. GnRH agonist versus GnRH antagonist in oocyte donation cycles: a prospective randomized study. Human Reproduction 2005; 20(6): 1516–1520.
15. Řežábek K. Komplikace léčby sterility. Moderní gynekologie a porodnictví 2002; 11(4): 580–588.
16. Clayton HB, Schieve LA, Peterson HB et al. Ectopic pregnancy risk with assisted reproductive technology procedures. Obstetrics Gynecology 2006; 107(3): 595–604.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2009 Číslo 2- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Identifikácia estrogénového alfa receptora v proliferačnom endometriu a vo svetlobunkovom karcinóme
- Forenzné aspekty asistovanej reprodukcie v legislatívnych podmienkach Českej a Slovenskej republiky
- Úvodní slovo
- Edukační kazuistika
- Peroperační prevence adhezí v gynekologii
- Adenocarcinoma in situ děložního hrdla – rozbor 10 případů
- Terapie karcinomu štítné žlázy pomocí radiojódu 131I, vliv na gonadální funkce a fertilitu
- Některé bioetické otázky asistované reprodukce – literární přehled (Štrasburská konvence, status lidského embrya)
- Těhotenské ztráty po metodách asistované reprodukce
- Intrahepatálna cholestáza gravidných a liečba kyselinou ursodeoxycholovou
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Intrahepatálna cholestáza gravidných a liečba kyselinou ursodeoxycholovou
- Těhotenské ztráty po metodách asistované reprodukce
- Terapie karcinomu štítné žlázy pomocí radiojódu 131I, vliv na gonadální funkce a fertilitu
- Peroperační prevence adhezí v gynekologii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



