-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Farmakoterapie endometriózy v reprodukční gynekologii
Pharmacotherapy of endometriosis in reproductive gynaecology
Endometriosis is defined as an ectopic presence of endometrial tissue outside the uterine cavity causing a chronic inflammatory reaction. Aetiology of endometriosis is most likely multifactorial; retrograde menstruation is a very popular theory, though immune system appears to play an important role. The signs and symptoms of endometriosis include chronic pelvic pain, irregular and strong menstrual bleeding, bleeding between periods, dyspareunia and fertility disorders. The paper provides an overview of the current options available for classification of endometriosis of the lesser pelvis, summarizes epidemiological factors and pathogenetic mechanisms pertaining to the localization of ectopic foci. The paper defines possible clinical signs of the various forms of endometriosis and provides an overview of current options for pharmacological treatment. Hormonal treatment options include administration of oral contraception, progestin-only pills (POP), depot progestins – implants, intrauterine system (IUS) with levonorgestrel, progestins with respect to the results of recent clinical trials with dienogest. Furthermore, therapeutic effects of selective progesterone receptor modulators (SPRM), GnRH analogues and antagonists and Add-back therapy are presented. The overview is completed with a discussion on therapeutic options provided by selective estrogen receptor modulators (SERM), selective aromatase inhibitors (AI) and anti-inflammatory and immunomodulatory therapy. The decision to use pharmacological or surgical treatment of genital forms of endometriosis, or their combination, should be based on the type of endometriosis being treated, i.e. whether this is peritoneal, ovarian, rectovaginal or extragenital form or adenomyosis. The character of pelvic pain and the presence of infertility also influence the choice of suitable therapeutic approach. Microscopic description of ectopic endometrial foci also affects the final outcome of hormonal therapy.
Key words:
endometriosis – pharmacotherapy of endometriosis – infertility – dysmenorrhoea - dyspareunia
Autoři: R. Hudeček; G. Jelenek; Michal Felsinger
Působiště autorů: Gynekologicko-porodnická klinika, LF MU a FN Brno
Vyšlo v časopise: Prakt Gyn 2011; 15(2): 70-77
Kategorie: Přehledová práce
Souhrn
Endometrióza je definována jako ektopická přítomnost endometriální tkáně mimo děložní dutinu, která vyvolává chronickou zánětlivou reakci. Etiologie endometriózy je pravděpodobně multifaktoriální, velmi rozšířenou teorií vzniku je retrográdní menstruace, nicméně velkou úlohu sehrává i imunitní systém. Mezi projevy endometriózy patří chronická pánevní bolest, nepravidelné a silné menstruační krvácení, krvácení mezi menstruacemi, dyspareunie a dysfertilita. Práce uvádí přehled současných možností klasifikace endometriózy malé pánve, shrnuje epidemiologické faktory a patogenetické mechanizmy v souvislosti s lokalizací ektopických ložisek. Definuje možné klinické projevy jednotlivých forem endometriózy a přináší aktuální přehled farmakologických možností léčby. Hormonální terapie zahrnuje aplikaci kombinované orální kontracepce, tablet se samotným progestinem – progestin only pills (POP), depotních progestinů – implantátů, intrauterinního systému (IUS) s levonorgestrelem a progestinů s ohledem na výsledky aktuálních klinických hodnocení dienogestu. Dále jsou prezentovány terapeutické účinky selektivních modulátorů progesteronového receptoru (SPRM), GnRH analog a antagonistů a Add-back terapie. Přehled uzavírá výčet terapeutických možností selektivních modulátorů estrogenových receptorů (SERM), selektivních inhibitorů aromatázy (IA) a protizánětlivá a imunomodulační terapie. Při rozhodování o medikamentózní nebo chirurgické terapii genitálních forem endometriózy či jejich případné kombinaci je třeba zvážit, o jaký typ endometriózy se jedná. Zda jde o formu peritoneální, ovariální, rektovaginální, extragenitální nebo o adenomyózu. Volbu vhodného terapeutického postupu rovněž ovlivňuje charakter pánevní bolesti a přítomnost neplodnosti. Mikroskopická charakteristika ektopických ložisek endometria má také vliv na výsledný efekt hormonální terapie.
Klíčová slova:
endometrióza – farmakoterapie endometriózy – dysfertilita – dysmenorrhoea – dyspareunieÚvod
Endometrióza je definována jako ektopická přítomnost endometriální tkáně mimo děložní dutinu, která vyvolává chronickou zánětlivou reakci. Etiologie endometriózy je pravděpodobně multifaktoriální, velmi rozšířenou teorií vzniku je retrográdní menstruace, nicméně velkou úlohu sehrává i imunitní systém. Mezi projevy endometriózy patří chronická pánevní bolest, nepravidelné a silné menstruační krvácení, krvácení mezi menstruacemi, dyspareunie a dysfertilita.
Klasifikace endometriózy malé pánve
V současné době je uznávána jako hlavní klasifikace endometriózy r-AFS klasifikace (1985) dle American Fertility Society (AFS), která dle rozsahu postižení orgánů malé pánve rozděluje endometriózu na čtyři stadia (I–IV). Nezahrnuje komplexně extragenitální lokalizaci endometriózy a klinické projevy z ní vyplývající. Klasifikace ENZIAN (2005) svým charakterem odpovídá stagingu onkologických nálezů. Popisuje adenomyotický uzel a lokalizace nálezů v Douglasově prostoru a zahrnuje genitální formy (adenomyózu) i extragenitální formy endometriózy (postižení močového měchýře, střeva a ureteru). Další klasifikační systémy vymezují rozsah postižení rektovaginálního septa [1] (obr. 1). Klasifikace endometriózy dle škály Biberogluové a Behrmanové (B&B) (1981) odráží klinické projevy a symptomy endometriózy. B&B klasifikace našla široké uplatnění v klinických studiích. Klasifikace zohledňuje aspekty funkce a kvality života a není korelátem pro vizuální analogovou škálu bolesti. Zahrnuje symptomy charakteru dysmenorey, dyspareunie a chronické pánevní bolesti a dále klinické známky jako pánevní citlivost a induraci (tab. 1).
Obr. 1. Klasifikace endometriózy rektovaginálního septa – Koninncky, Martin (1992). 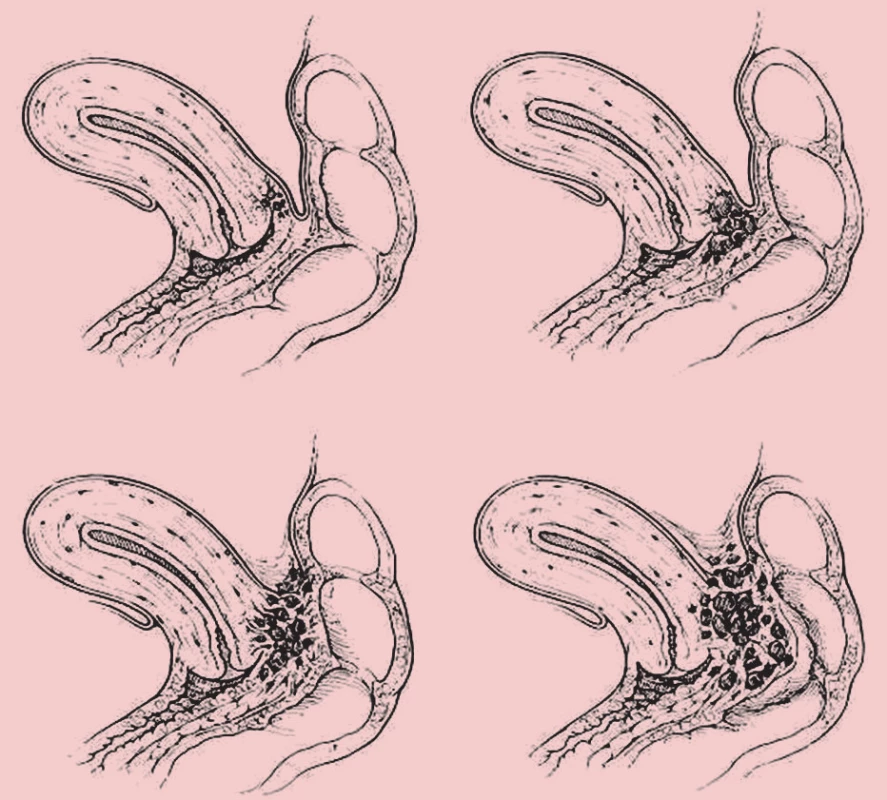
Tab. 1. Klasifikace endometriózy dle Biberogluové a Behrmanové škály (1981). 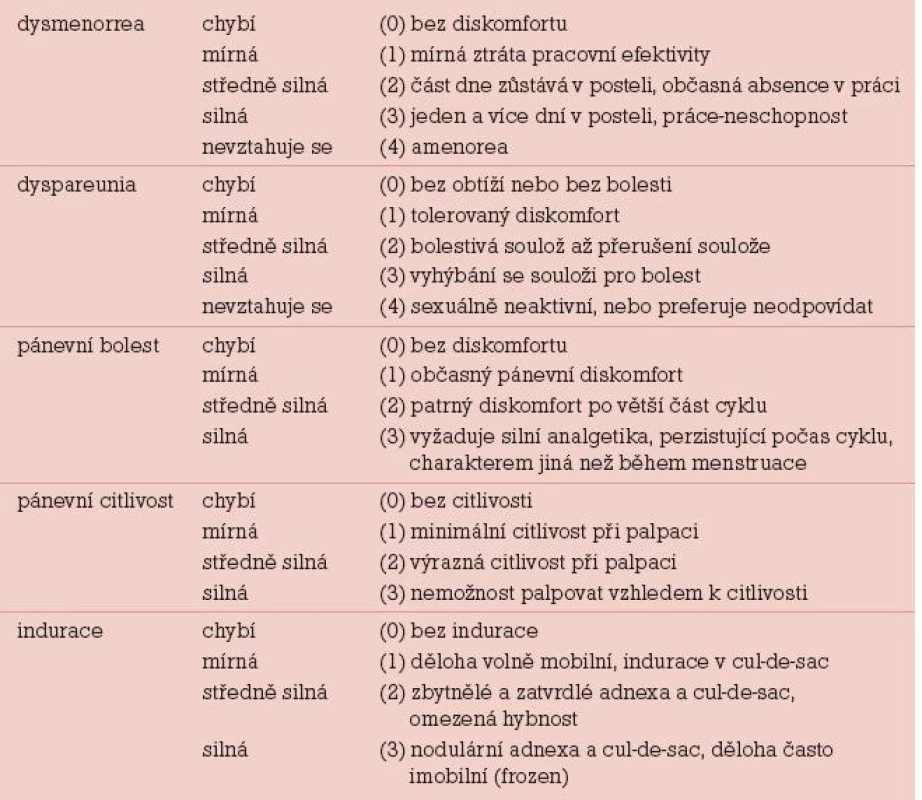
Epidemiologické faktory endometriózy
Endometrióza patří mezi nejčastější gynekologická onemocnění a v klinickém důsledku zpravidla vyvolá chronický zánětlivý proces s autoimunitní reakcí organizmu. Prevalence endometriózy v populaci žen je 7–10%. Mezi rizikové faktory vzniku onemocnění lze zařadit především věk, socioekonomický status, rasu, genetické faktory, časný nástup menarche, polymenoreu, užívání hormonální kontracepce (COC) a životní prostředí. Výskyt endometriózy je typický v reprodukčním období života ženy, jen vzácně se objevuje před menarche. Vrchol incidence dosahuje endometrióza kolem 40. roku života a její výskyt dále klesá především po menopauze.
Endometrióza je spojena se změnami vrozené i získané imunity jak v její humorální, tak buněčné složce [2,3]. Endometriální buňky narušují imunologickou odpověď, a vyhýbají se tak imunologickému dozoru organizmu. Užívání COC má ochranný účinek a snižuje relativní riziko výskytu endometriózy ve srovnání s ženami, které COC neužívaly, a to především prostřednictvím atrofie perzistujících endometriálních ložisek. U žen s vyšším body-mass indexem (BMI) byly prokázány častější poruchy plodnosti v souvislosti s anovulací, ale nižší riziko výskytu endometriózy. Kuřačky mají vzhledem k antiestrogennímu účinku tabáku nižší riziko vzniku endometriózy [4].
Patogenetické mechanizmy a lokalizace endometriózy
Peritoneální a ovariální lokalizace endometriózy je spojena s chronickým krvácením do ložisek a s následnou tvorbou endometriomů [5]. Hluboká forma endometriózy se vyskytuje podél Müllerových vývodů a je spojena s fibromuskulární hyperplazií a tvorbou adenomyotických uzlů. Při vzniku peritoneální endometriózy hraje roli přilnavost ektopicky uložených buněk endometria k peritoneu, jejich invaze do bazální membrány mezotelu a do extracelulární matrix (ECM), lokální neoangiogeneze, imunotolerance a následná proliferaceektopického ložiska [6].
U 75–90% žen s průchodnými vejcovody dochází k retrográdní menstruaci (Sampsonova teorie retrográdního refluxu) a tzv. transtubární diseminaci jako nejčastější formě transportu endometriálních buněk. Prodloužená a silná menstruace spojená s retrográdním krvácením je jedním z hlavních rizikových faktorů vzniku nemoci. Cirkulace peritoneální tekutiny probíhá směrem do parakolických recesů a na levé straně je více obleněna přítomností sigmoidea s delší perzistencí refluxních endometriálních buněk [7]. U žen s endometriózou jsou zjišťovány odlišné vlastnosti eutopického a ektopického endometria [8]. Retrográdně transtubárně odloučené endometrium v průběhu menstruace způsobuje v dutině břišní zánětlivou odpověď se zvýšenou koncentrací imunocytů. Mírná forma endometriózy může být přechodně přítomna u každé ženys průchodnými vejcovody. Invaze endometriálních buněk do mezotelu následuje po iniciální fázi adheze k peritoneální výstelce a je podmíněna rozpadem ECM, která obklopuje buňky. Její rozpad a remodelace je regulována enzymaticky matrixovými metaloproteinázami (MMP), jejichž aktivita je regulována cytokiny, růstovými faktory, steroidnímy hormony a tkáňovými inhibitory metaloproteinázy (TIMP). MMP jsou schopny degradovat složky ECM a bazálních membrán.
V eutopickém endometriu je v průběhu menstruačního cyklu exprese MMP a TIMP regulována steroidními hormony a cytokiny. V ektopických ložiscích dochází k abnormální expresi specifických typů MMP. Aktivita některých MMP je zvýšena v eutopickém endometriu žen s endometriózou, zatímco aktivita TIMP je v něm redukována. Tato nerovnováha svědčí o zvýšeném implantačním potenciálu endometria žen s endometriózou.
Rozhodující pro růst ektopického ložiska endometriózy je jeho post-implantační přežití. Některá ložiska jsou imunorezistentní k cytolýze lymfocytů a eliminaci makrofágy. U žen s endometriózou byla prokázána snížená funkce NK buněk. Endometrióza je spojena s polyklonální aktivací B lymfocytů a zvýšenou koncentrací antifosfolipidových protilátek a protilátek proti tkáním, resp. proti orgánům. Ženy s endometriózou vykazují významně vyšší výskyt hypotyreózy, fibromyalgie, chronického únavového syndromu, astmatu a alergií [9]. Cytokiny a růstové faktory u žen s endometriózou podporují implantaci a růst ektopického endometria [10].
Endometrióza je estrogendependentní onemocnění. Syntézu estrogenu z estradiolu a androstendionukatalyzuje aromatáza [11]. Fyziologickým induktorem aromatázové aktivity v ovariu je folikulostimulační hormon (FSH), zatímco v ložiscích endometriózy způsobují její aktivaci PGE2 cestou cAMP. Estrogeny současně zvyšují produkci PGE2 v ektopických stromálních buňkách stimulací COX2. V těchto buňkách dochází k polymorfizmu genu CYP-19, způsobujícího nadměrnou expresi aromatázy. Androstendion ovariálního a nadledvinového původu je prekurzorem aromatázy, produktem, které je zase estron se slabým estrogenním účinkem, ten se v ektopických buňkách endometria mění na estradiol, zatímco estradiol se v eutopických buňkách mění na estrol. Enzym inaktivující estradiol v buňkách žen s endometriózou není přítomen [12].
Adhezivní proces je pro endometriózu typický. V ložiscích endomeriózy dochází k cyklickým změnám, které vedou k tvorbě hormonů a krvácení do ektopických ložisek. Tyto změny jsou typické pro peritoneální ložiska a nejméně jsou vyjádřeny při rektovaginální lokalizaci endometriózy. Opakované krvácení aktivuje zánětlivou reakci s exsudací fibrinogenu a tvorbou fibrinových provazců. Fibrin je časem nahrazen kolagenem. V extrémním případě může vytvořit až stav tzv. frozen pelvis.
Za vznik ovariální formy endometriózy zodpovídá kombinace superficiální ovariální léze s adhezivním procesem, sekundární postižení implantací endometriózy do funkční ovariální cysty nebo endometriální metaplazie coelomového epitelu uloženého na povrchu ovaria. Většina endometriomů jsou charakteristické pseudocysty s typickým čokoládovým obsahem v důsledku nahromadění menstruační krve a jejích rozpadových derivátů [13].
Hluboká rektovaginální lokalizace endometriózy je charakteristická invazí do tkáňových struktur a orgánů. Postihuje 20–35% žen s endometriózou.Nejčastěji je postiženo rektovaginální septum formou adenomyotického uzlu. Uzel se vyznačuje hyperplazií hladké svaloviny a vaziva obklopujících glandulární složku s výrazně redukovaným buněčným stromatem. Je pravděpodobné, že primárním zdrojem hlubokých forem endometriózy rektovaginálního septa je postižení peritonea Douglasova prostoru.
Adenomyóza je hypertrofie myometria kolem žlázových ložisek v děložní stěně, které může být difuzní nebo fokální, tzv. adenomyom. Adenomyóza bývá také označována jako onemocnění multipar.
Klinické projevy endometriózy
Chronická pánevní bolest se považujeza nejčastější příznak onemocnění a představuje indikaci k provedení diagnostické laparoskopie. Endometrióza se objevuje u 60% žen s primární nebo sekundární dysmenoreou a u 40–50% žen s trvalou pánevní bolestí a dyspareunií. Endoskopická diagnostika endometriózy může být u žen s chronickou pelvalgií opožděná proti pacientkám léčeným pro poruchy plodnosti.
U žen s dysfertilitou je 6–8krát vyšší riziko výskytu endometriózy [14]. Zpravidla se jedná o změnu anatomických poměrů při postižení malé pánve a adnex. Až u 25% žen s endometriózou je pozorován vyšší výskyt syndromu luteinizovaného neprasklého folikulu (LUF). V důsledku ovariálního postižení může být snížena kvalita folikulogeneze v souvislosti s přítomností endometriomů. Ženy s endometriózou III. a IV. stupně mají signifikantně horší výsledky in vitro fertilizace (IVF), především pak nižší pregnancy rate a redukovaný implantační potenciálembryí. U žen s pokročilou endometriózou se zdá, že nižší fertilitu způsobuje horší kvalita oocytů a embryí, nikoli porucha endometriální receptivity. Endometrióza nezvyšuje frekvenci opakovaných potratů. Pacientky s endometriózou mají o 50% nižší plodnost než ženy s čistým tubárním faktorem neplodnosti.
Z extragenitální symptomatologie endometriózy je charakteristická chronická únava, vyčerpanost, nedostatek energie, střevní dyskomfort, bolesti břicha a průjem v období menstruace nebo nevolnost a cefalea. Genitální symptomatologie endometriózy je kromě pelvalgia a dysfertility charakteristická silnou a nepravidelná menstruací, dyspareunií, výskytem lokální nebo systémové mykózy, nepravidelným děložním krvácením či spottingem.
V případě intestinální formy endometriózy se onemocnění diagnostikuje zpravidla později než u genitálního postižení. Manifestuje se častonecyklickou bolestí a postihuje rektosigma, méně často apendix a terminální ileum. U 20% žen se objevuje rektální krvácení, ojediněle odchod krvavého hlenu z rekta nebo stužkovité stolice.
Endometrióza uropoetického traktu představuje druhou nejčastější extragenitální lokalizaci. Jedná se zpravidla o postižení močového měchýře, ureteru nebo ledvin. Příznakem bývá suprapubická bolest, polakisurie, dysurie, urgence a cyklická nebo trvalá mikroskopická hematurie. Postižení může probíhat pod obrazem rekurentní cystitidy. Symptomatická endometrióza močového měchýře je vždy spojena s postižením jeho stěny. Lokalizace lézí je v oblasti trigona a zadní stěny. Endometrióza vesikální stěny se může vyskytovat i v průběhu gravidity a může imitovat maligní proces v močovém měchýři [15].
Endometrióza plic a plesury se vyskytuje ve formě solitárních uzlů. Častěji je postižena pravá plíce a pleura nad bránicí [16]. Klinické projevy rezultují v kašel, hemoptýzu, pleurální bolest a výpotek. Cyklickou epistaxí se může projevit endometrióza nazální sliznice.
Farmakoterapie endometriózy
Konzervativní kauzální léčba je založena na přítomnosti estrogenových a progesteronových receptorů v ektopických ložiscích endometria. Nevýhodou této formy terapie je častý výskyt recidiv primárního onemocnění po ukončení léčby, a to v 30–70% případů. Doba od ukončení léčby po začátek nových potíží je individuální a pohybuje se od 6 do 18 měsíců [17]. I vzhledem k dočasnému účinku je hormonální terapie jednoznačným přínosem, protože 80–90% pacientek s pánevní bolestí v souvislosti s endometriózou udává zlepšení subjektivních obtíží během hormonální léčby [18]. Standardem invazivní léčby endometriózy se stala chirurgická eliminace viditelných lézí.
Hormonální terapie
Smyslem hormonální terapie endometriózy je prostřednictvím amenorey a hypoestrinního stavu vyvolat atrofickézměny ektopického endometria. Aplikací estrogen-progestinové směsi nebo samotných progestinů vyvolá stav tzv. pseudogravidity. V důsledku toho dochází k deciduální proměně funkční endometriální tkáně, tzv. stromoglandulární disociaci. Dlouhodobé působenívede k atrofizaci a nekróze ložisek.Pozitivní účinek je potencovaný anovulací a amenoreou. Chirurgická léčba má cytoredukční charakter, medikamentózní terapie je cytosupresivní [4].
Kombinovaná orální kontracepce
Kontracepce (COC) je metodou první volby u mladších žen s pánevní bolestí a s podezřením na endometriózu nebo s endometriózou laparoskopicky prokázanou. Jedná se o kombinované monofázické preparáty s nízkým obsahem ethinylestradiolu (15–35 μg) v kombinaci s moderními progestiny. Vhodné jsou gestagenně dominantní monofázické přípravky, a to buď s absolutním, nebo relativním nadbytkem progestinu. Dlouhodobé podávání s konstantní hladinou progestinu vede k supresi růstu endometriální tkáně, její pseudodeciduaci a atrofii. Preparáty v nízkých dávkách je vhodné podávat po dobu šesti až dvanácti měsíců. Spokojenost s touto formou terapie dosahuje 60–70%.
Nevýhodou použití estrogen-progestinové léčby je častý výskyt recidiv krátce po jejich vysazení. Ve srovnání s analogy gonadoliberinů mají kombinované monofázické preparáty v průběhu šestiměsíční léčby nižší účinnost v léčbě dysmenorey a dyspareunie. Dlouhodobé kontinuální podání monofázických kombinovaných preparátů může snížit recidivu endometriomů, čímž představují alternativu k chirurgické terapii při adenomyóze.
Tablety se samotným progestinem – progestin only pills (POP)
Zástupcem je Desogestrel (Cerazette), který patří mezi progestiny III. generace. V nedávných studiích byl prokázán signifikantní pokles dysmenorey u pacientek s endometriózou při 20% výskytu krvácení z průniku. Dosud však existuje jen velmi málo klinických hodnocení účinku POP v terapii endometriózy.
Depotní progestiny – implantáty
Etonogestrel (Implanon) je steroidníkontraceptivum s dlouhodobým účinkem po dobu tří let. Implantát obsahuje 68 mg etonogestrelu. Zpočátku se uvolňuje 60–70 μg denně, poslednírok 25–30 μg. Doporučené využití Implanonu je jako lék doplňkové metody volby terapie extragenitálních forem endometriózy (katameniální hemoptýza).
Intrauterinní systém (IUS) s levonorgestrelem (Mirena)
Systém uvolňuje levonorgestrel (LNG) po dobu pěti let v konstantní dávce 20 μg denně, poslední rok 11 μg denně. Inhibuje proliferaci endometria snížením mitotické aktivity s následnou atrofií žlázových buněk [19]. U žen se zavedeným IUS se ve 20–60% objevujeamenorea. U žen s endometriózou dochází při zavedeném nitroděložním systému ke snížení sérové hladiny tumormarkeru CA-125. Ovulace není inhibována. U rektovaginální endometriózy je zavedení spojeno s úlevou od potíží ve smyslu pelvalgie a dyspareunie a zmenšením ložisek endometriózy. Zavedení IUS s LNG příznivě ovlivňuje i obtíže při extrapelvické lokalizaci endometriózy.
Progestiny
Progestiny jsou farmaka s afinitou k progesteronovým receptorům, kteréselektivně ovlivňují. Kompetitivně blokují účinek estradiolu na endometrium. Aktivují enzym katalyzující proměnu estradiolu na estron, a tím způsobují pseudodeciduální přeměnu ektopických ložisek s jejich následnou atrofií. Pro léčbu pánevní bolesti se hodí kontinuální perorální forma progestinů. Mezi nežádoucí účinky aplikace progestinů patří krvácení z průniku, retence tekutin, napětí prsou, emoční labilita s depresemi či akné. Progestiny lze podávat v několika režimech u formy perorální, a to v nízkých dávkách (dienogest, MPA) nebo vysokých dávkách (chlormadinonacetát, MPA). U parenterální – depotní formy (MPA) nastane za 6–12 měsíců úplnáamenorea. Nežádoucími účinky je suprese a anovulace trvající 6–9 měsíců. Preparát s kombinovaným účinkem – Dienogest je využitelný v několika dávkových režimech.
Dienogest (Visanne) je syntetický progestogen, derivát 19-nortestosteronu, který má silný progestagenní účinek, i když jeho afinita k progesteronovému receptoru je pouze 10%. Dienogest působí na endometriózu snížením endogenní produkce estradiolu, a tím potlačuje trofický účinek estradiolu jak v eutopickém, tak ektopickém endometriu. Při dlouhodobém užívání vede aplikace dienogestu k hypoestrogennímu, hypergestagennímu prostředí, ale in vivo nemá žádné signifikantní androgenní, mineralokortikoidní nebo glukokortikoidní účinky.
Klinická, placebem kontrolovaná studie [20] zahrnující 198 pacientek s endometriózou prokázala přednosti přípravku Visanne. Po třech měsících léčby dienogestem byl ve srovnání s placebem prokázán statisticky významný rozdíl (p < 0,0001) a klinicky významné snížení bolesti v porovnání s výchozím stavem před terapií. Po třech měsících léčby dienogestem bylo ve sledované skupině dosaženo signifikantního snížení bolesti v oblasti pánve spojovaného s endometriózou o 50% a více bez relevantního zvýšení souběžně podávané analgetické medikace u 37,3% pacientek užívajících Visanne (placebo: 19,8%); snížení bolesti v oblasti pánve spojované s endometriózou o 75% nebo více bez relevantního zvýšení souběžně podávané analgetické medikace u 18,6% pacientek užívajících Visanne (placebo: 7,3%).
Studie zabývající se efektivním množstvím terapeutických dávek Dienogestu 1mg, 2mg a 4mg/den prokázaly jako optimální dávku 2mg/den, 1mg dávka/den byla ze studie pro výskyt nepravidelného menstruačního krvácení vyloučena. Užívání 4mg/den nebylo spojeno se signifikantně lepším terapeutickým výsledkem oproti dávce 2mg/den.
Následné studie zahrnující celkem 252 pacientek užívajících denní dávku 2mg dienogestu prokázaly podstatné snížení endometriotických lézí po 6 měsících léčby [21]. Srovnání terapie Dienogestem 2mg se současnou terapií GnRH agonisty prokázala stejnou terapeutickou účinnost v léčbě bolestivých symptomů provázejících endometriózu (graf 1). Důležitým výsledkem bylo zjištění, že při terapii Dienogest 2 mg nedochází k antiestrogenním vedlejším účinkům, které terapii GnRH agonisty doprovázejí. Ve studii byl zaznamenán signifikantní rozdíl ve výskytu projevů vegetativního menopauzálního syndromu jako návaly horka (graf 2), změny nálady apod. ve prospěch dienogestu. Dále byl zaznamenán signifikantní rozdíl ve výskytu poklesu kostní denzity (graf 3), rovněž ve prospěch dienogestu proti leuprolid acetátu.
Graf 1. Studie dienogest versus leuprolid acetát – útlum bolesti VAS. 
Graf 2. Studie dienogest versus leuprolid acetát – návaly horka. 
Graf 3. Studie dienogest versus leuprolid acetát – změna kostní denzity. 
Dávkování 2mg dienogestu je kontinuální. Po perorálním podání se dienogest rychle a téměř úplně vstřebává. Maximální sérové koncentrace je dosaženo přibližně za 1,5 hod po jednorázovém podání. Biologická dostupnost je asi 91%. V oběhu se dienogest váže na sérový albumin. Relativně vysoký podíl 10% dienogestu se v oběhu vyskytuje ve volné formě, přibližně 90% je nespecificky vázáno na albumin. Dienogest se kompletně metabolizuje cestami metabolizmu steroidů. Enzym CYP3A4 je hlavním enzymem zodpovědným za metabolizmus dienogestu. Metabolická clearance ze séra Cl/F je 64ml/min.
Sérové hladiny dienogestu se snižují ve dvou fázích. Konečná dispoziční fáze je charakterizována poločasem přibližně 9–10 hod. Dienogest se vylučuje ve formě většinou endokrinologicky neaktivních metabolitů, které odcházejí močí a stolicí. Poločas exkrece metabolitů močí je asi 14 hod. Po perorálním podání je 86% dávky eliminováno během 6 dní, větší část z tohoto množství během 24 hod, převážně močí. Farmakokinetika dienogestu není ovlivněna hladinami SHBG, ustáleného stavu je dosaženo po 4 dnech léčby.
Aplikace dienogestu u žen v reprodukčním věku představuje novou, perspektivní možnost v oblasti farmakologické dlouhodobé terapie genitálních forem endometriózy. Díky srovnatelné účinnosti dienogestu v porovnání s GnRH analogy a současně lepší toleranci a bezpečnosti pro pacientky lze v brzké době očekávat širší uplatnění tohoto preparátu v reprodukční medicíně.
Selektivní modulátory progesteronového receptoru (SPRM)
Při vazbě určité látky na progesteronový receptor dochází k jednomu ze tří efektů. Účinek pak závisí na dávce, místě účinku a přítomnosti nebo absenci progesteronu na receptoru [22]. Při vazbě typu I dochází ke kompletnímu antagonistickému účinku a progesteron je zcela vytěsněn z receptoru. U vazby typu II jde o skupinu mezoprogestinů, kterémají smíšený antagonistický a agonistický účinek. Vazba typu III má antagonistický účinek, ale receptor je obsazen progesteronem. V praxi se užívají mezoprogestiny, což jsou parciální antagonisté, ale v některých tkáních nabývají účinek progesteronu. Selektivně potlačují růst endometria a indukují reverzibilní amenoreu bez nežádoucích vedlejších účinků. Historicky prvním dostupným preparátem byl RU486 (Mifepriston), který je znám pro svůj abortivní účinek. Inhibuje ovulaci a narušuje integritu endometria. Při půlročním užívání způsobuje atrofii a redukci ložisek endometriózy.
GnRH analoga
Po aplikaci GnRH analoga dochází k iniciálnímu vzestupu pituitárních gonadotropinů, tzv. flare-up efektu, který po opakované dávce způsobuje hypofyzární a ovariální inhibici. Účinkem navozené gonadální suprese je reverzibilní hypoestrinní stav s amenoreou. Efektem je pak atrofie a regrese ektopických ložisek endometria [23]. Nástup účinku je rychlejší a efektivnější než u COC a gestagenů. U ovariální endometriózy je terapeutickýefekt sporný. Aplikační formy jsou intramuskulární, subkutánní a intranazální [24]. Aplikace v časné folikulární fázi má vyšší flare-up efekt než podání uprostřed luteální fáze, proto je vhodnější léčbu časovat do luteální fáze cyklu. Léčba trvá 3–6 měsíců. Tříměsíční terapie má sice stejný efekt jako šestiměsíční léčba, ale současně vykazuje kratší interval od skončení léčby a recidivy. Vedlejším účinkem těchto preparátů je osteoporóza. Před zahájení terapie by proto u pacientekměla být provedena denzitometrie a lipidový profil. Maximální doba podávání GnRH bez add-back terapie je 6 měsíců. GnRH antagonisté blokují přímo GnRH hypofyzární receptor, a zabraňují tak jeho aktivaci [25].
GnRH antagonisté
Blokují přímo GnRH hypofyzární receptor, a zabraňují tak jeho aktivaci. Patří sem ganirelix (Orgalutran) a cetrorelixacetát (Cetrotide). Pilotní studie prokázaly regresi endometriózy a klinických projevů po osmi týdnech terapie cetrorelixacetátem 3mg/T, a to bez vedlejších nežádoucích účinků z hypoestrinizmu. Nevýhodou je ekonomická náročnost a nemožnost dlouhodobého podávání.
Add-back terapie
Add-back terapie je hormonální substituční terapie, kterou lze předcházet prolongovanému hypoestrinnímu stavu. Její podání vychází z koncepce dvou rozdílných prahových koncentrací 17 beta-estradiolu v séru, které mohou vést k supresi endometriózy a zároveň zachování kostního metabolizmu a metabolizmu kalcia. Protokoly využívající kombinaci GnRH analog a add-back terapie udržují sérové koncentrace 17 beta-estradiolu, zatímco pouhé podání GnRH analog vede k hypoestrinnímu stavu. Add-back terapie může být zahájena současně s aplikací GnRH nebo s odstupem tří měsíců. Nutnost této terapie je při trvání supresivní terapie delší než 6 měsíců [26]. Estrogeny se v add-back režimu podávají perorálně a transdermálně. Progestiny se podávají v kombinovaném nebo v tzv. pulzním režimu. Pulzní podávání progestinu zlepšuje citlivost steroidních receptorů k estrogenům. Samotné podávání čistých progestinů nemá ochranný účinek na kostní hmotu. Využití vysoko-nízko dávkovaných režimů add-back terapie nemělo na zachování kostní hmoty statisticky významný vliv. Tibolon je syntetický steroid, patří do skupiny STEAR –selektivních regulátorů tkáňové estrogenní aktivity. Má estrogenní, progestagenní a androgenní účinek. V dávce 2,5mg má protektivní efekt na kostní metabolizmus a přitom zachována aktivitu GnRH analog. U všech léčebných režimů je doporučena substituce 500mg kalcia denně a podávání vitaminu D nebo kontinuální podání různých bisfosfonátů.
Selektivní modulátory estrogenových receptorů (SERM)
Jde o látky nesteroidní povahy s afinitou k estrogenovým receptorům. Patří sem raloxifen a tamoxifen. Raloxifen působí přes estrogenový receptor, a to ERalfa a ERbeta. Vzhledem k těmto subtypům a různé míře exprese ER v tkáni je účinek raloxifenu variabilní, nepotlačuje ovulaci ani nezpůsobuje inhibici gonadotropinů a ženy v reprodukčním věku mohou otěhotnět. U tohoto preparátu vykazuje biopsie 30% stromoglandulární disociaci a není v léčbě endometriózy u žen v reprodukčním věku efektivní.
Selektivní inhibitory aromatázy (IA)
Aromatáza je cytochromovaný enzym, který katalyzuje finální krok v konverzi androgenů na estrogeny. Androstendion a testosteron jsou hlavní substráty aromatázy. V ložiscích endometriózy byla zjištěna vysoká koncentrace aromatázy, která zde vytváří lokální nadprodukci estrogenů. Existují kompetitivní inhibitory – anastrozol (Arimidex tbl.), letrozol (Femara tbl.) a inaktivátory aromatázy – např. exemestan (Aromazin tbl.). Efekt těchto léků spočívá v lokální selektivní inhibici estrogenní produkce, aniž je potlačena syntéza jejich steroidů.
Protizánětlivá a imunomodulační terapie
Nesteroidní antirevmatika (NSA) se používají v léčbě endometriózy vzhledem k inhibici klíčového enzymu cyklooxygenázy (COX) v indikaci cyklické pánevní bolesti. Na základě rozdílného účinku na subtypy COX lze skupinu NSA rozdělit do následujících kategorií:
- neselektivní inhibitory, přednostní inhibitory: nimesulid, meloxican, etodolak;
- specifické inhibitory: coxiby.
Použití selektivních inhibitorů COX2 snížilo výskyt nežádoucích účinků na úrovni gastrointestinálního traktu. Imunomodulační terapii reprezentuje pentoxifyllin, který svým imunomodulačním účinkem snižuje produkci a účinek zánětlivých cytokinů a způsobuje regresi peritoneálních ložisek. Během podávání nedochází k inhibici ovulace a k hypoestrinnímustavu. Z dalších látek sem patří interleukin 12, interferon alfa-2b nebo loxoribin.
Závěr
Při rozhodování o medikamentózní nebo chirurgické terapii genitálních forem endometriózy či jejich případné kombinaci je třeba zvážit, o jaký typ endometriózy se jedná. Zda jdeo formu peritoneální, ovariální, rektovaginální, extragenitální nebo o adenomyózu. Volbu vhodného terapeutického postupu rovněž ovlivňuje charakter pánevní bolesti a přítomnost neplodnosti. Mikroskopická charakteristika ektopických ložisek endometria má také vliv na výsledný efekt hormonální terapie. Dobře diferencovaný typ s převahou glandulární složky reaguje lépe než nediferencovaný typ, který je charakteristický např. pro rektovaginální endometriózu. Nejcitlivější na konzervativní léčbu jsou peritoneální ložiska s převahou glandulární složky. Ovariální endometrióza a uzlovité retroperitoneální formy nemoci s malým obsahem glandulární složky a nízkou expresí estrogenových a progesteronových receptorů jsou k hormonální terapii prakticky rezistentní.
prim. MUDr. Robert Hudeček, Ph.D.
Gynekologicko-porodnická klinika, LF MU a FN Brno
rhudecek@fnbrno.cz
Zdroje
1. Koninncky PR, Martin DC. Deep endometriosis: a consequence of infiltration or retraction or possibly adenomyosis externa? Fertil Steril 1992; 58(5): 924–928.
2. Paul Dmowski W, Braun DP. Immunology of endometriosis. Best Pract Res Clin Obstet Gynaecol 2004; 18(2): 245–263.
3. Lebovic DI, Mueller MD, Taylor RN. Immunobiology of endometriosis. Fertil Steril 2001; 75(1): 1–10.
4. Kučera E. Endometrióza. In: Kučera E (ed). Farmakoterapie pro praxi, sv. 26. Praha: Maxdorf 2008.
5. Abrao MS, Neme RM, Carvalho FM et al. Histological classification of endometriosis as a predictor of response to treatment. Int J Gynaecol Obstet 2003; 82(1): 31–40.
6. Nisolle M, Donnez J. Peritoneal endomet-riosis, ovarian endometriosis, and adenomyotic nodules of the rectovaginal septum are free different entities. Fertil Steril 1997; 68(4): 585–596.
7. Al-Fozan H, Tulandi T. Left lateral predisposition of endometriosis and endometrioma. Obstet Gynecol 2003; 101(1): 164–166.
8. Leyendecker G, Kunz G. Endometriosis and adenomyosis. Zentralbl Gynakol 2005; 127(5): 288–294.
9. Sinaii N, Cleary SD, Ballweg ML et al. High rates of autoimmune and endocrine disorders, fibromyalgia, chronic fatigue syndrome and atopic diseases among women with endometriosis: a survey analysis. Hum Reprod 2002; 17(10): 2715–2724.
10. Wu MY, Ho NH. The role of cytokines in endometriosis. Am J Reprod Immunol 2003; 49(5): 285–296.
11. Attar E, Bulun SE. Aromatase and other steroidogenic genes in endometriosis: translational aspects. Hum Reprod Update 2006; 12(1): 49–56.
12. Kitawaki J, Noguchi T, Amatsu T et al. Expression of aromatase cytochrome P450 protein and messenger ribonucleic acid in human endometriotic and adenomyotic tissue but not in normal endometrium. Biol Reprod 1997; 57(3): 514–519.
13. Viganò P, Parazzini F, Somigliana E et al. Endometriosis: epidemiology and aetiological factors. Best Pract Res Clin Obstet Gynaecol 2004; 18(2): 177–200.
14. Manolopoulos K, Tinneberg HR. Endometriosis and infertility. Zentralbl Gynakol 2005; 127(5): 325–328.
15. Feyereisl J, Zavadil M, Krofta L et al. Endometrióza imitující nádor močového měchýře. Čes Gynek 2005; 70(2): 152–155.
16. Kurman RJ. Blaustein’s Pathology of the Female Genital Tract. 5th ed. New York: Springer 2002.
17. Sharpe-Timms KL, Young SL. Understanding endometriosis is the key to successful therapeutic management. Fertil Steril 2004; 81(5): 1201–1203.
18. Mahutte NG, Arici A. Medical management of endometriosis-associated pain. Obstet Gynecol Clin North Am 2003; 30(1): 133–150.
19. Gomes MK, Ferriani RA, Rosa e Silva JC et al. The levonorgestrel-releasing intrauterine system and endometriosis staging. Fertil Steril 2007; 87(5): 1231–1234.
20. Strowitzki T, Faustmann T, Gerlinger C et al. Dienogest in the treatment of endometriosis-associated pelvic pain: a 12-week, randomized, double-blind, placebo-controlled study. Eur J Obstet Gynecol Reprod Biol 2010; 151(2): 193–198.
21. Köhler G, Faustmann TA, Gerlinger C et al. A dose-ranging study to determine the efficacy and safety of 1, 2, and 4 mg of dienogest daily for endometriosis. Int J Gynaecol Obstet 2010; 108(1): 21–25.
22. Chabbert-Buffet N, Meduri G, Bouchard P et al. Selective progesterone receptor modulators and progesterone antagonists: mechanisms of action and clinical applications. Hum Reprod Update 2005; 11(3): 293–307.
23. Schweppe KW. Guidelines for the use of GnRH-analogues in the treatment of endometriosis. Zentralbl Gynakol 2005; 127(5): 308–313.
24. Schindler AE, Christensen B, Henkel A et al. High-dose pilot study with the novel progestogen dienogestin in patients with endometriosis. Gynecol Endocrinol 2006; 22(1): 9–17.
25. Crha I, Ventruba P Anticardiolipin and antihiston levels during the treatment of IVF patients with endometriosis by Goserelin. J Assist Reprod Genet 1996; 13(4): 366–368.
26. Zupi E, Marconi D, Sbracia M et al. Add-back therapy in the treatment of endometriosis-associated pain. Fertil Steril 2004; 82(5): 1303–1308.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Úvodní slovo
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2011 Číslo 2- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Od pohlavného vzrušenia k orgazmu ženy species Homo sapiens: sexuologické parametre orgazmového procesu
- Probiotika v gynekologické praxi
- GyneFix – nitroděložní tělísko bez pevného těla a ramének
- Contraceptive Summit 2011: Women’s Needs and Choices
- Úvodní slovo
- Proteom seminální plazmy u mužů s azoospermií
- Prognostický význam tumor markeru SCCA u pacientek s operabilními stadii dlaždicobuněčného karcinomu děložního hrdla
- Farmakoterapie endometriózy v reprodukční gynekologii
- Role homocysteinu a příbuzných thiolů v etiopatogenezi poruch lidské reprodukce
- Postkoitální servis up to date
- Bolest nenádorového původu v gynekologii a možnosti její léčby
- Diferenciální diagnostika vulvovaginitid
- Disekce aorty u gravidní s Turnerovým syndromem
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- GyneFix – nitroděložní tělísko bez pevného těla a ramének
- Farmakoterapie endometriózy v reprodukční gynekologii
- Prognostický význam tumor markeru SCCA u pacientek s operabilními stadii dlaždicobuněčného karcinomu děložního hrdla
- Probiotika v gynekologické praxi
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



