Prognostický význam tumor markeru SCCA u pacientek s operabilními stadii dlaždicobuněčného karcinomu děložního hrdla
The prognostic value of the SCCA tumour marker in patients surgically treated for squamous cell cervical cancer
Objective:
Evaluation of the role of the SCCA (Squamous Cell Carcinoma Antigen) tumour marker in the prognosis of patients with surgically treated squamous cell cervical cancer, focusing on malignant lymphadenopathy and recurrence of the disease.
Material and methods:
We retrospectively analyzed 110 patients who had undergone radical surgical treatment of early stage squamous cell cervical cancer between 2000–2008 in the Department of Gynaecology and Obstetrics, Faculty of Medicine, Masaryk University and Faculty Hospital, Brno. An association between SCCA serum levels and local tumour size (T), determined by the definitive postoperative histology, were explored, as were any associations between regional malignant lymphadenopathy (N) and serum levels of this tumour marker. Based on their postoperative TNM classification and risk factors, the patients were referred either for follow-up or for adjuvant therapy in the form of radiotherapy or combined chemoradiotherapy, respectively. SCCA serum levels obtained during the regular one-year follow-up or at the manifestation of clinical complaints were also evaluated to detect recurrence of the disease.
Results:
The SCCA elevation was detected in 28 (25.5%) of the 110 squamous cell carcinoma patients. An association between SCCA serum levels and the local tumour size (based on the final postoperative histology) was assessed. The SCCA elevation of up to 10% was detected in the microinvasive cancer T1a stage patients. Tumour growth was associated with a significant increase in the SCCA positivity and absolute levels of the tumour marker. SCCA positivity was identified in approximately 50% of patients with bulky tumour, in whom two- and multiple-fold increase above the upper limit of serum standards was found. Metastatic involvement of regional lymph nodes per a specific SCCA serum level was examined in 3 sets of patients. Malignant lymphadenopathy was found in 8.5% of cases in the first group of patients with serum SCCA negativity. Positive lymph nodes were found in 47% of patients in the group with SCCA serum levels between 1.5 to 3.0 ng/ml. Pathological regional lymphadenopathy was detected in 69% of cases in the group of patients with SCCA serum levels above 3.0 ng/ml. Six recurrences of the disease were found in the group of 95 patients regularly attending the follow-up; in 5 patients, the disease recurred within 7–21 months from the completion of the primary therapy and it recurred after 8 years in one patient. SCCA elevation was identified in all 6 cases; SCCA sensitivity was, therefore, 100%. Elevated SCCA was the first sign of recurrence in one (17%) patient. Other recurrences were diagnosed through clinical complaints manifested outside the regular follow-up.
Conclusion:
SCCA cannot be used for the diagnosis of squamous cell cervical cancer as its elevation occurs only with an increasing volume of the tumour. SCCA negativity does not exclude metastatic involvement of regional lymph nodes; the marker specificity in our sample was 92%. SCCA elevation above the upper limit of normal is associated with an increased risk of malignant lymphadenopathy, sensitivity of this marker for metastatic regional lymph nodes involvement increases significantly only at the two- and multiple-fold SCCA elevation above the upper limit of normal (almost 70% in our group). Consequently, it is necessary to determine the status of regional lymph nodes as soon as the initial stage of cervical cancer (microinvasive stage T1a1 with lymphovascular invasion); significant risk of regional lymphadenopathy is then clearly associated with high-volume tumours. SCCA is a sensitive marker for recurrence in patients with this tumour marker elevation before the primary operation. Most recurrences are manifested within the first two years after the primary therapy, serum positivity is found in approximately 80% of recurrences in larger files.
Key words:
cervical cancer – SCCA (Squamous Cell Carcinoma Antigen) – metastasis – lymph node – radical hysterectomy – pelvic lymphadenectomy
– recurrence
Autori:
Luboš Minář
; Vít Weinberger
Pôsobisko autorov:
Gynekologicko-porodnická klinika, LF MU a FN Brno
Vyšlo v časopise:
Prakt Gyn 2011; 15(2): 64-69
Kategória:
Původní práce
Súhrn
Cíl:
V příspěvku zhodnotíme význam tumoru markeru SCCA (Squamous Cell Carcinoma Antigen) pro prognózu pacientek s operabilními stadii dlaždicobuněčného karcinomu děložního hrdla se zaměřením na nádorovou lymfadenopatii a recidivu základního onemocnění.
Materiál a metodika:
Ve studii jsme retrospektivně analyzovali 110 pacientek, které absolvovaly radikální operační řešení časných stadií spinocelulárního karcinomu děložního hrdla v letech 2000–2008 na Gynekologicko-porodnické klinice LF MU a FN Brno. U pacientek byl hodnocen rozsah sérových hladin SCCA ve vztahu k lokálnímu rozsahu nádoru (T), stanovenému na základě definitivní pooperační histologie, a přítomnost metastatického postižení regionální lymfatické oblasti (N) ve vztahu k určitému rozsahu sérových hladin tohoto tumor markeru. Pacientky byly v souladu s pooperační TNM klasifikací a v závislosti na rizikových faktorech převedeny do dispenzární péče, nebo indikovány k adjuvantní léčbě ve formě radioterapie, resp. kombinované chemoradioterapie. Dále byly sledovány sérové hladiny SCCA, rovněž v průběhu pravidelné dispenzární péče, a to v ročním intervalu nebo při manifestaci klinických potíží v rámci restagingu s cílem diagnózy, ev. recidivy základního onemocnění.
Výsledky:
Elevace SCCA v souboru 110 dlaždicobuněčných karcinomů byla zjištěna u 28 (25,5 %) pacientek. Bylo sledováno rozmezí sérových hladin SCCA ve vztahu k lokálnímu rozsahu nádoru (stanovenému na základě definitivní pooperační histologie). Ve stadiu mikroinvazivního karcinomu T1a se elevace SCCA v našem souboru pohybuje do 10 %. Se signifikantním nárůstem pozitivity SCCA a absolutních hladin se setkáváme v souvislosti s růstem objemu nádoru, u velkoobjemových „bulky“ tumorů se elevace týká cca 50 % případů a narůstá na dvoj- a vícenásobné hodnoty nad horní hranici sérové normy. Metastatické postižení regionálních lymfatických uzlin bylo zjišťováno ve třech souborech pacientek dle určitého rozmezí sérových hladin SCCA. V první skupině pacientek se séronegativitou SCCA byla patologická lymfadenopatie zjištěna v 8,5 % případů, ve druhé skupině pacientek se sérovou hladinou SCCA 1,5–3,0 ng/ml se pozitivita lymfatických uzlin týkala 47 % pacientek a ve skupině pacientek se sérovou hladinou SCCA nad 3,0 ng/ml již byla patologická regionální lymfadenopatie zjištěna u 69 % pacientek. V rámci následné dispenzární péče, kterou z původního počtu 110 pacientek pravidelně absolvovalo 95, bylo zjištěno 6 recidiv základního onemocnění. U pěti pacientek se jednalo o interval 7–21 měsíců od ukončení primární terapie, u jedné pak byla recidiva zachycena po 8 letech. K elevaci SCCA došlo v našem souboru ve všech 6 případech, senzitivita SCCA tedy byla 100%. U jedné (17 %) pacientky byla elevace SCCA prvním příznakem recidivy onemocnění, ostatní recidivy byly diagnostikovány na základě klinických potíží, které se manifestovaly mimo rámec pravidelných dispenzárních kontrol.
Závěr:
SCCA nelze využít pro vlastní diagnostiku spinocelulárního karcinomu děložního hrdla, k jeho elevaci dochází až při zvyšujícím se objemu nádoru. Negativita SCCA nevylučuje metastatické postižení regionálních mízních uzlin, specifita markeru v našem souboru je 92 %. Elevace SCCA nad horní hranici normy je spojena s vyšším rizikem nádorové lymfadenopatie, senzitivita tohoto markeru pro metastatické postižení regionálních mízních uzlin signifikantně narůstá až při dvoj- a vícenásobné elevaci SCCA nad horní hranici normy (v našem souboru necelých 70 %). Z výše uvedeného vyplývá nutnost zjištění stavu regionálních mízních uzlin již od iniciálního mikroinvazivního stadia s výskytem lymfovaskulární invaze, signifikantní riziko regionální lymfadenopatie se pak týká jednoznačně velkoobjemových tumorů. SCCA je senzitivním markerem recidivy onemocnění u pacientů s elevací tumor markeru před primární operací. Nejčastěji se recidivy manifestují během prvních dvou let po ukončení primární terapie, sérová pozitivita se vyskytuje ve větších souborech u cca 80 % recidiv.
Klíčová slova:
karcinom děložního hrdla – SCCA (Squamous Cell Carcinoma Antigen) – metastáza – lymfatická uzlina – radikální hysterektomie – pánevní lymfadenektomie – recidiva
Úvod
Screeningový program a diagnostika dysplastických změn a časných stadií karcinomu děložního hrdla jsou standardizovány. Jejich základem je vyšetření onkologické cytologie doplněné kolposkopickým vyšetřením, při eventuálních diagnostických rozpacích v indikaci diagnostické konizace využíváme testaci HR subtypů HPV. Vlastní diagnóza samozřejmě vychází z histologického vyšetření odebraných tkáňových vzorků. Nádorové markery hrají u karcinomu děložního hrdla roli při odhadu rozsahu onemocnění, jsou faktorem signalizujícím prognózu onemocnění a jsou i součástí vyšetřovacího algoritmu detekce recidiv základního onemocnění pacientek v dispenzární péči. V histologických typech karcinomu děložního hrdla převažuje dlaždicobuněčný karcinom, který tvoří 60–80 % karcinomů v této oblasti. Invazivní dlaždicobuněčný karcinom se dělí podle histologického obrazu na několik typů. Nejčastěji používané dělení je na variantu rohovějící a nerohovějící, dřívější rozlišení na typ velkobuněčný a malobuněčný by se již nemělo používat. V současnosti se termín malobuněčný používá pro malobuněčné varianty s neuroendokrinní diferenciací. Další méně časté varianty pak představují karcinom bazaloidní, verukózní, kondylomatózní, papilární, lymphoepithelioma-like a skvamotranzicionální. Vlastní histologická typizace spinocelulárního karcinomu má prognostický význam na rozdíl od jeho gradingu, který je třístupňový. Z ostatních histologických typů v oblasti děložního hrdla představují 10–15 % adenokarcinomy, dalšími mohou být vzácné histologické varianty, např. karcinom adenoskvamózní, adenoidně cystický, adenoidně bazocelulární nebo nádory s neuroendokrinní diferenciací [1]. Základním tumorovým markerem vzhledem k rozložení histologických typů karcinomu děložního hrdla je (SCCA) Squamous Cell Carcinoma Antigen. SCCA (antigen epidermálních karcinomů) byl objeven v maligních epidermálních tkáních v roce 1977. Biochemicky se jedná o glykoprotein. Fyziologicky je produkován v diferencovaných epidermálních buňkách plodu a zdravých dospělých. Jeho referenční hodnota je cca 1,5 ng/ml. Asi u 5 % zdravé populace je hodnota tohoto markerufyziologicky zvýšená. Příčinou falešnépozitivity jsou některé dermatózy jako psoriáza, ekzém a hyperkeratóza. Mírně zvýšenou produkci SCCA lze detekovat u cca 10 % pacienteks benigními gynekologickými onemocněními, např. u dermoidálních cyst. Patologicky zvýšená produkce tohoto antigenu se typicky vyskytuje u spinocelulárních karcinomů děložního hrdla, pochvy a zevních rodidel. V oblasti onkologických onemocnění nacházíme zvýšené hladiny rovněž u epidermálních karcinomů plic, hlavy a krku. U nerohovějících dlaždicobuněčných karcinomů děložního hrdla lze využít marker CYFRA 21–1, u skupiny adenokarcinomů stoupá SCCA jen asi v 25–30 % případů, proto lze k monitorování stavu pacientek využít marker Ca 125, ev. CEA, které jsou zvýšeny u cca 75 % pacientek [2,3].
Materiál a metodika
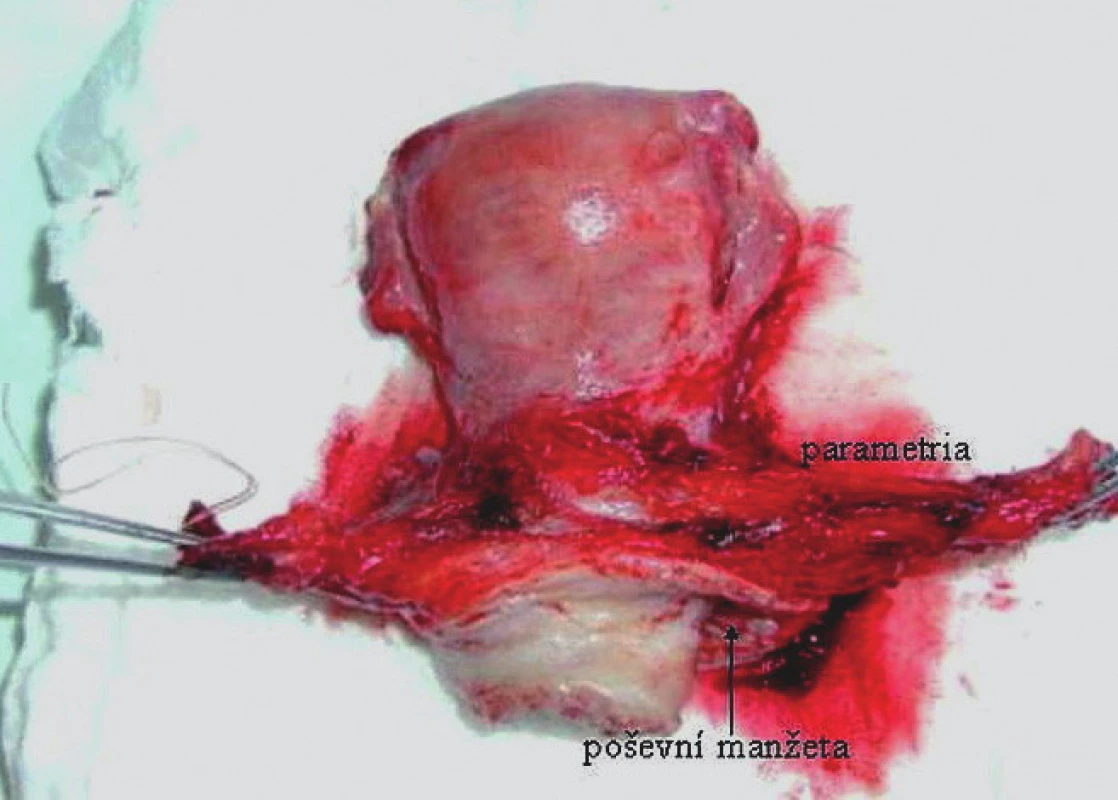
Na našem pracovišti podstoupilo v letech 2000–2008 radikální operační léčbu pro karcinom děložního hrdla 140 pacientek. Z hlediska histopatologických nálezů se ve 110 (78,5 %) případech jednalo o spinocelulární karcinom a v 16 (11,5 %) případech o adenokarcinom, dalších 14 (10 %) případů představovala histologická varianta adenoskvamózního karcinomu. Po provedení stagingových vyšetření byly dle předoperační TNM klasifikace indikovány k radikálnímu operačnímu výkonu pacientky s dlaždicobuněčným karcinomem lokálního rozsahu T1a1 se souběžnou lymfovaskulární invazí (LVSI) až po stadium T2a2 při vyloučení vzdáleného metastatického postižení. Počty pacientek s diagnostikovaným operabilním spinocelulárním karcinomem dle jednotlivých stadií FIGO udává graf 1. Z hlediska typu radikality operačních výkonů byly nálezy dle předoperační TNM klasifikace řešeny v 1 (1 %) případě extrafasciální abdominální hysterektomií s pánevní lymfadenektomií a ve 2 (2 %) případech laparoskopicky asistovanou vaginálníhysterektomií s laparoskopickou pánevní lymfadenektomií. 83 (75 %) pacientek podstoupilo abdominální hysterektomii II. stupně radikality (obr. 1) s pánevní lymfadenektomií, 21 (19 %) pacientek abdominální hysterektomii III. stupně radikality s pánevní lymfadenektomií a 3 (3 %) pacientkyabsolvovaly v rámci fertilitu zachovávajícího radikálního výkonu laparoskopickou pánevní lymfadenektomii s následnou simplexní vaginální trachelektomií. Z 28 pacientek stadia T1b2 podstoupilo 11 (39 %) pacientek neoadjuvantní chemoterapii, dle jejíhoefektu pak byly indikovány k abdominální hysterektomii II. (8 pacientek), resp. III. stupně radikality (3 pacientky). U pacientek byl hodnocen rozsah sérových hladin SCCA ve vztahu k lokálnímu rozsahu nádoru (na základě definitivní pooperační histologie) a přítomnost metastatického postižení regionální lymfatické oblasti ve vztahu k určitému rozsahu sérových hladin tohoto tumor markeru. V souladu s pooperační TNM klasifikací a podle rizikových faktorů byly pacientky převedeny do dispenzární péče nebo indikovány k adjuvantní léčbě ve formě radioterapie, resp. kombinované chemoradioterapie. V dispenzární péči bylo realizováno sledování v tříměsíčních intervalech během prvních 2 let a v šestiměsíčních intervalech během následujících 3 let. Od 6. roku po ukončení primární terapie byl interval prodloužen na 1 rok. Každé vyšetření zahrnovalo celkové fyzikální vyšetření, objektivní gynekologické vyšetření a transvaginální a abdominální ultrazvuk provedený gynekologem. Jedenkrát ročně bylo vyšetření v rámci dispenzarizace doplněno o abdominální ultrazvuk provedený rentgenologem, RTG snímek hrudníku a stanovení sérové hladiny SCCA, při manifestaci klinických potíží byla uvedená vyšetření ještě dále rozšířena. Recidiva onemocnění byla definována jako výskyt onemocnění po 6 a více měsících od ukončení primární terapie.

Výsledky
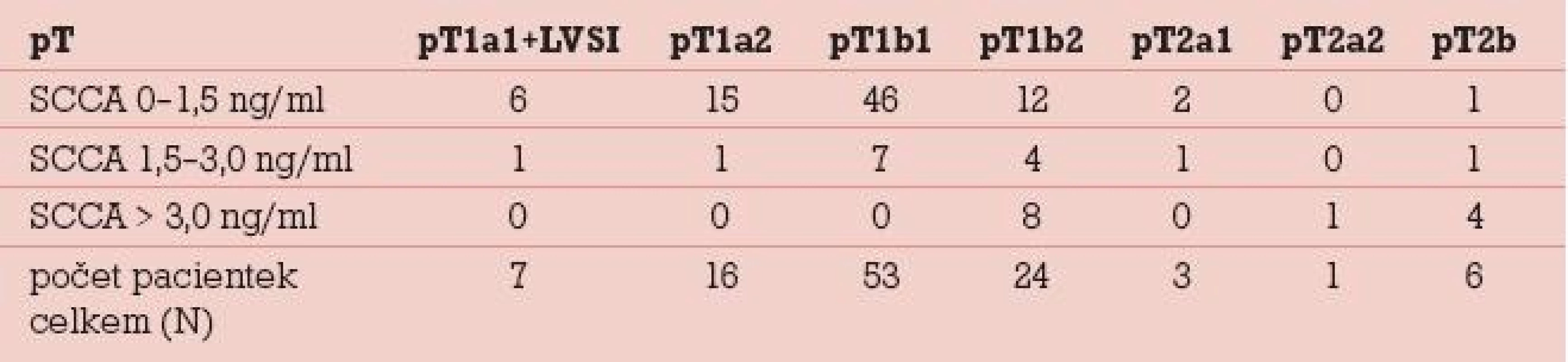
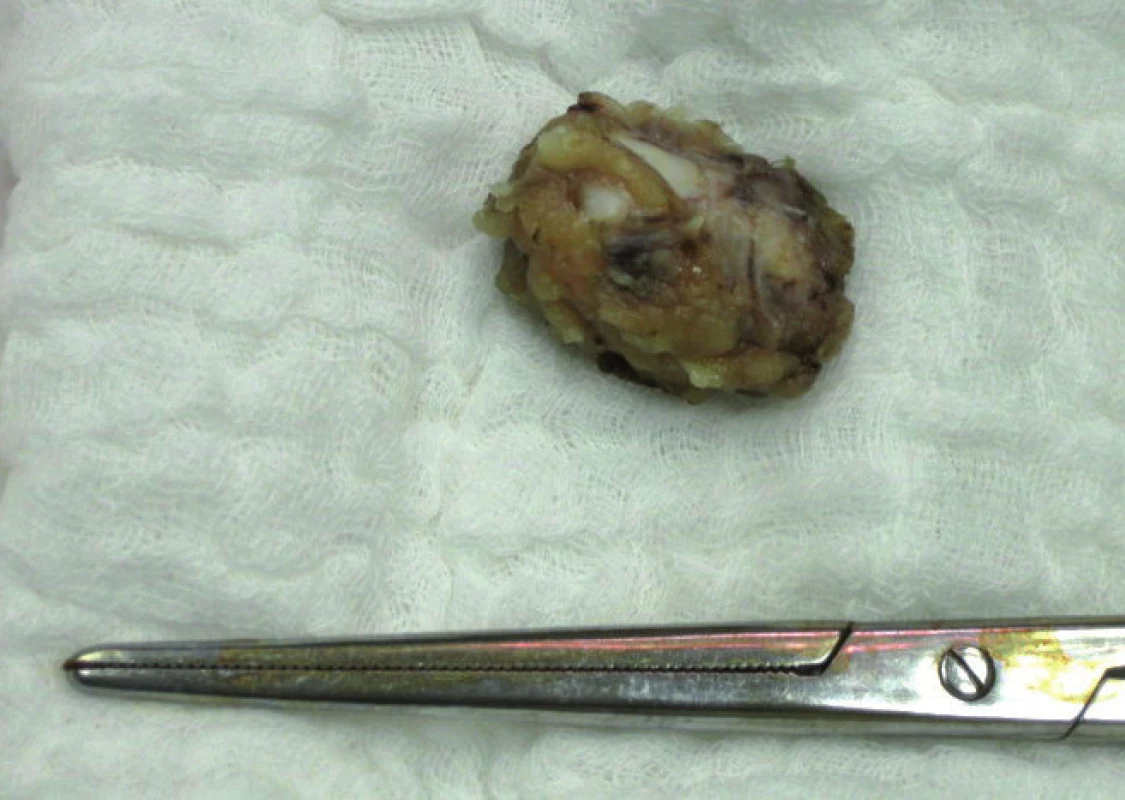
Elevace SCCA v souboru 110 dlaždicobuněčných karcinomů byla zjištěna celkem u 28 (25,5 %) pacientek. Rozmezí sérových hladin SCCA ve vztahu k lokálnímu rozsahu nádoru udává tab. 1. Lokální rozsah nádoru byl stanoven na základě definitivní pooperační histologie (s výjimkou stadia T1b2 u 8 pacientek, u nichž došlo po neoadjuvantní chemoterapii k výrazné regresi nálezu), v tabulce je uvedeno rovněž 6 pacientek, u kterých byla pooperačně zjištěna mikroskopická fokální infiltrace parametrií a lokální rozsah nádoru již tedy odpovídá T2b (na základě stagingu byly 2 z těchto pacientek předoperačně klasifikovány jako T1b1 a 4 pacientky jako T1b2). Ve stadiu mikroinvazivního karcinomu se v našem souboru elevace SCCA pohybuje do 9 %, s nárůstem pozitivity SCCA a absolutních hladin se setkáváme v souvislosti s růstem objemunádoru, u klinicky invazivního karcinomu do 4cm byla sérová pozitivita zjištěna u 13 % pacientek, u velkoobjemových „bulky“ tumorů se v našem souboru objevuje signifikantní elevace týkající se cca 50 % případů. V tomto stadiu rovněž narůstá elevace na dvoj- a vícenásobné hodnoty nad horní hranici sérové normy. Metastatické postižení regionálních lymfatických uzlin (obr. 2) bylo zjišťováno ve 3 souborech pacientek dle sérových hladin SCCA, tj. jak je uvedeno v grafu 2. Do první skupiny pacientek se sérovou hladinou SCCA do 1,5 ng/ml patřilo 82 pacientek, z toho byly u 75 (91,5 %) pacientek lymfatické uzliny negativní, počet pozitivních lymfatických uzlin u 7 (8,5 %) pacientek se pohyboval v rozmezí 1–5 metastaticky postižených lymfatických uzlin. Ve druhé skupině pacientek se sérovou hladinou SCCA 1,5–3,0 ng/ml bylo 15 pacientek, z nichž byly v 8 (53 %) případech lymfatické uzliny negativní, pozitivita lymfatických uzlin (v rozsahu 1–4 lymfatické uzliny a u jedné pacientky 10 metastaticky postižených uzlin) se týkala 7 (47 %) případů.Ve skupině pacientek se sérovou hladinou SCCA nad 3,0 ng/ml bylo 13 pacientek, negativitu regionálních lymfatických uzlin vykázaly v této skupině 4 (31 %) pacientky, pozitivita regionálních lymfatických uzlin (v rozsahu 1–7 lymfatických uzlin) se týkala 9 (69 %) pacientek. V rámci následné dispenzární péče, kterou z původního počtu 110 pacientek pravidelně absolvovalo 95, bylo zjištěno 6 recidiv základního onemocnění. U 5 (86 %) pacientek se jednalo o interval 2 let (7–21 měsíců) od ukončení primární terapie, u jedné pak byla recidiva zachycena po 8 letech. K elevaci SCCA došlo v našem souboru ve všech 6 případech, senzitivita SCCA tedy byla 100 % (tab. 2). U 1 (17 %) pacientky byla elevace SCCA prvním příznakem recidivy onemocnění, ostatní recidivy byly diagnostikovány na základě klinických potíží, které se manifestovaly mimo rámec pravidelných dispenzárních kontrol. Všechny pacientky s recidivou byly komplexně vyšetřeny a recidivy byly ve většině případů (5 pacientek, tj. 86 %) histologicky verifikovány. V jednom případě plicní metastázy, kdy byla biopsie vysoce riziková vzhledem k lokalizaci recidivy, byl recidivující nález diagnostikován pozitivitou dvou zobrazovacích vyšetření v rámci restagingu s využitím PET/CT.

Diskuze
Stanovení sérové hladiny SCCA u spinocelulárního karcinomu děložního hrdla není součástí diagnostiky onemocnění, dle guidelines je fakultativní součástí stagingových vyšetření u již diagnostikovaného onemocnění [3,4]. Literatura uvádí, že sérové hladiny bývají zvýšené asi u 15–20 % pacientek s karcinomem in situ, v I. stadiu onemocnění má zvýšené hodnoty 20–40 % pacientek, ve IV. stadiu pak cca 70 % pacientek. Hodnota SCCA vykazuje korelaci s objemem nádoru a postižením regionálních lymfatických uzlin, a poskytuje nám tedy před zahájením terapie určitou informaci o možném rozsahu nemoci i o její prognóze [5]. Lepší prognóza je spojena s negativními hladinami před léčbou, negativita SCCA však nemá jednoznačnou prediktivní hodnotu pro nepřítomnost metastáz v lymfatických uzlinách [6,7]. Další možností pro využití stanovení hladiny SCCA je monitoring v rámci dispenzární péče, SCCA je dle literárních zdrojů senzitivním markerem recidivy onemocnění, zejména u pacientů s elevací SCCA před primární operací. Nejčastěji se recidivy manifestují během prvních dvou let po ukončení primární terapie, kolem 10 % recidiv se však objevuje po pěti a více letech od skončení primární léčby. Elevace SCCA (po návratu hladiny k normálním hodnotám po ukončení primární léčby) předchází, dle literárních údajů, klinickou manifestaci recidivy o 5–7 měsíců [8]. Vzhledem k tomu, že sérová pozitivita SCCA je udávána cca v 80 % recidiv, může analýza SCCA pomoci k časnější diagnóze recidivy základního onemocnění. Stanovení hladiny SCCA se uplatňuje při odlišení recidivy od fibrózních postchirurgických nebo postradiačních změn [7,9]. Ve 20 % případů nemusí recidivu doprovázet elevace nádorových markerů [6,10]. V literatuře je zároveň uváděno, že i přes časnější diagnózu recidivy základního onemocnění pomocí SCCA analýzy nebylo prokázáno statisticky významné prodloužení doby přežití pacientek sledovaných pomocí SCCA, většina studií rovněž udává i stejné doby přežívání pacientek se symptomatickými a asymptomatickými recidivami [11–13].
Závěr
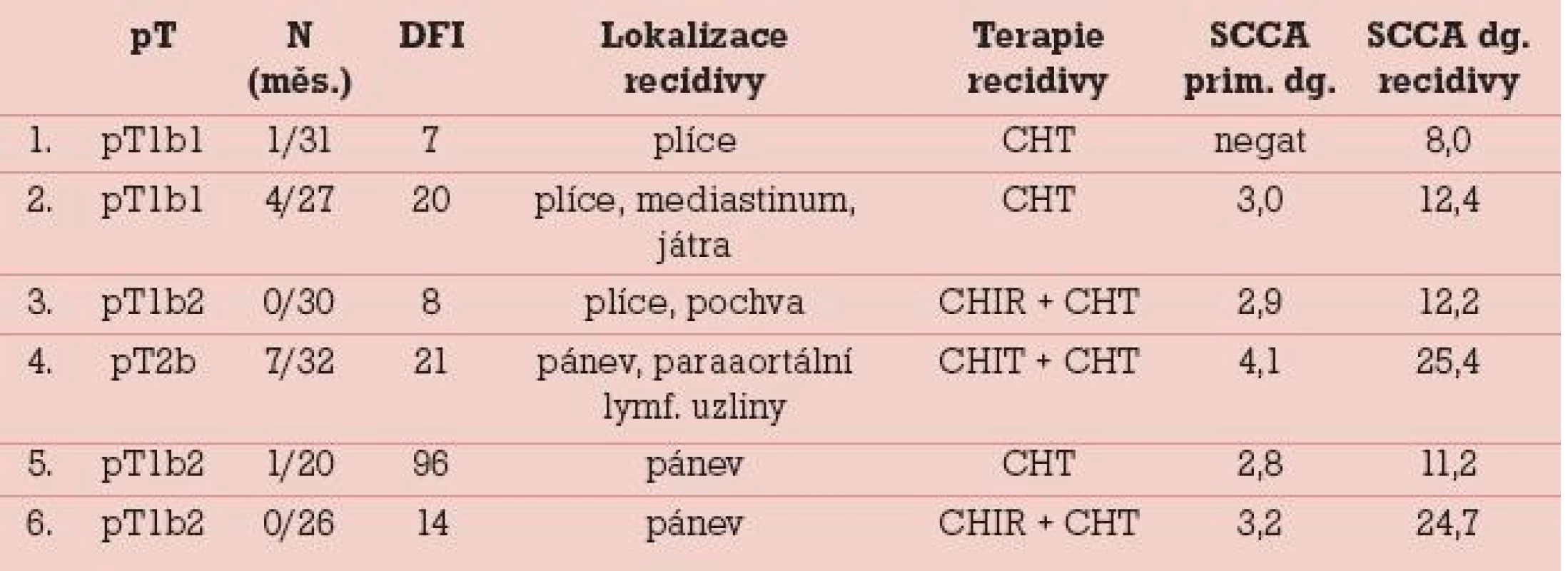
Ve výše uvedené retrospektivní analýze 110 spinocelulárních karcinomů děložního hrdla se elevace nádorového markeru SCCA týká 28 % pacientek. Ve stadiu mikroinvazivního karcinomu se v našem souboru elevace SCCA pohybuje do 10 %, signifikantní nárůst pozitivity SCCA a absolutních hladin vznikal v souvislosti s růstem objemu nádoru, u velkoobjemových „bulky“ tumorů se elevace týká cca 50 % případů a dosahuje na dvoj- a vícenásobné hodnoty horní hranice sérové normy. Negativita SCCA nevylučuje metastatické postižení regionálních mízních uzlin, ale v našem souboru se metastatická lymfadenopatie týkala necelých 10 % séronegativních pacientek. Naopak pozitivita SCCA je spojena se signifikantně vyšším rizikem nádorové lymfadenopatie, při pozitivních hladinách SCCA do 3,0 ng/ml byla lymfadenopatie detekována v necelých 50 % případů, při elevaci nad 3,0 ng/ml bylo metastatické postižení regionálních mízních uzlin zjištěno u 70 % pacientek. Z výše uvedeného vyplývá nutnost zjistit stav regionálních mízních uzlin již od iniciálního mikroinvazivního stadia se souběžnou lymfovaskulární invazí. Signifikantní riziko regionální lymfadenopatie se pak neoddiskutovatelně týká velkoobjemových tumorů. Od toho se odvíjí nezbytnost provedení exaktní systémové pánevní lymfadenektomie s eventuálním peroperačním histologickým vyšetřením makroskopicky suspektních uzlin a eventuální extenzí rozsahu lymfadenektomie do paraaortální oblasti, minimálně v rozsahu nízké paraaortální lymfadenektomie po odstup a. mesenterica inferior. Alternativním postupem může být využití konceptu detekce sentinelové uzliny a při její pozitivitě adekvátně extendovaný radikální operační výkon, nebo naopak ukončení operačního výkonu a další pokračování v léčbě konkomitantní chemoradioterapií [3]. SCCA je dle literatury senzitivním markerem recidivy onemocnění u pacientů s elevací tumor markeru před primární operací, což bylo prokázánoi v našem souboru. Recidivy základního onemocnění se objevují především během prvních dvou let po ukončení primární terapie, přičemž sérovou pozitivitu zjišťujeme cca v 80 % případů recidivy [7,14].
MUDr.
Luboš Minář
Gynekologicko-porodnická
klinika, LF
MU a FN Brno
lubosminar@seznam.cz
Zdroje
1. Motlík K, Živný J. Patologie v ženském lékařství. Praha: Grada Publishing 2001.
2. Masák L. Sérové nádorové markery. In: Cibula D, Petruželka L et al (eds). Onkogynekologie. Praha: Grada Publishing 2009.
3. Benedet JL, Bender H, Jones H 3rd et al. FIGO staging classifications and clinical practice guidelines in the management of gynecologic cancers. FIGO Committee on Gynecologic Oncology. Int J Gynecol Obstet 2000; 70(2): 209–262.
4. Gershenson DM, McGuire WP, Quinn MA et al. Gynecologic Cancer: Controversies in management. Philadelphia: Elsevier Churchill Livingston 1998.
5. Gaarestroom KN, Kenter GG, Bonfrer JM et al. Can initial serum CYFRA 21–1, SCC antigen and TPA levels in squamous cell cervical cancer predict lymph node metastases or prognosis? Gynecol Oncol 2000; 77(1): 164–170.
6. Chan YM, Ng TY, Ngan HY et al. Monitoring of serum squamous cell carcinoma antigen levels in invasive cervical cancer: is it cost-effective? Gynecol Oncol 2002; 84(1): 7–11.
7. Bolli JA, Doering DL, Bosscher JR et al. Squamous cell carcinoma antigen: clinical utility in squamous cell carcinoma of the uterine cervix. Gynecol Oncol 1994; 55(2): 169–173.
8. Duyn A, Van Eijkeren MV, Kenter G et al. Recurrent cervical cancer: detection and prognosis. Acta Obstet Gynecol Scand 2002; 81(4): 351–355.
9. Esajas MD, Duk JM, de Bruijn HW et al. Clinical value of routine serum squamous cell carcinoma antigen in follow-up of patients with early-stage cervical cancer. J Clin Oncol 2001; 19(19): 3960–3966.
10. Morice P, Deyrolle C, Rey A et al. Value of routine follow-up procedures for patients with stage I/II cervical cancer treated with combined surgery-radiation therapy. Ann Oncol 2004; 15(2): 218–223.
11. Mlynček M. Sledování po ukončení léčby. In: Cibula D, Petruželka L et al (eds). Onkogynekologie. Praha: Grada Publishing 2009: 450–451.
12. Lim KC, Howells RE, Evans AS. The role of clinical follow up in early stage cervical cancer in South Wales. BJOG 2004; 111(12): 1444–1448.
13. Olaitan A, Murdoch J, Anderson R et al. A critical evaluation of current protocols for the follow-up of women treated for gynecological malignancies: a pilot study. Int J Gynecol Cancer 2001; 11(5): 349–353.
14. Bodurka-Bevers D, Morris M, Eifel PJ et al. Posttherapy surveillance of women with cervical cancer: an outcomes analysis. Gynecol Oncol 2000; 78(2): 187–193.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicínaČlánok vyšiel v časopise
Praktická gynekologie

2011 Číslo 2
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Mýty a fakta ohledně doporučení v těhotenství
- Je „freeze-all“ pro všechny? Odborníci na fertilitu diskutovali na virtuálním summitu
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
Najčítanejšie v tomto čísle
- GyneFix – nitroděložní tělísko bez pevného těla a ramének
- Farmakoterapie endometriózy v reprodukční gynekologii
- Prognostický význam tumor markeru SCCA u pacientek s operabilními stadii dlaždicobuněčného karcinomu děložního hrdla
- Probiotika v gynekologické praxi
