-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Virové hemoragické horečky
Viral haemorrhagic fevers
Viral haemorrhagic fevers are caused by enveloped RNA viruses that belong to the families Filoviridae (Ebola, Marburg), Arenaviridae (Lassa, Lujo, Junin, Machupo, Guanarito), Bunyaviridae (hantaviruses, Crimean-Congo haemorrhagic fever and Rift Valley fever virus) and Flaviviridae (yellow fever, Omsk haemorrhagic fever virus). These infections manifest as acute systemic febrile illnesses with severe clinical course followed by development of shock syndrome and subsequent multiorgan dysfunction syndrome. Viral haemorrhagic fevers are widespread and present in all continents with the exception of Antarctica and represent typical zoonotic infections with natural foci. The potential for direct human-to-human transmission is significant in Lassa, Ebola, Marburg and Crimean-Congo haemorrhagic fevers. Although the risk of transmission to tourists is relatively low, these infections are feared for their severe clinical course and unavailable specific treatment. Current Ebola outbreak in western Africa shows that these infections represent a significant public health problem. The potential risk represents the use of these pathogens as weapons of mass destruction. Provision of medical care for patients with viral haemorrhagic fever should be restricted to specialized centres.
Keywords:
viral haemorrhagic fevers – tropical medicine – Ebola – Lassa – Crimean-Congo haemorrhagic fever – vaccination
Autoři: M. Trojánek 1,2; H. Roháčová 1,2; V. Marešová 1,2; Stejskal F. 1–4
Působiště autorů: Infekční klinika 2. LF UK a Nemocnice Na Bulovce, Praha Přednosta: doc. MUDr. Dušan Pícha, CSc. 1; Klinika infekčních, parazitárních a tropických nemocí Nemocnice Na Bulovce, Praha Primář: MUDr. Hana Roháčová, PhD. 2; Infekční oddělení, Krajská nemocnice Liberec Primář: MUDr. Adam Vitouš 3; Ústav imunologie a mikrobiologie 1. LF UK a VFN, Praha Přednostka: prof. RNDr. Libuše Kolářová, CSc. 4
Vyšlo v časopise: Prakt. Lék. 2015; 95(1): 4-11
Kategorie: Přehledy
Souhrn
Původci virových hemoragických horeček jsou obalené RNA viry z čeledí Filoviridae (viry Ebola a Marburg), Arenaviridae (viry Lassa, Lujo, Junin, Machupo, Guanarito), Bunyaviridae (hantaviry, viry krymsko-konžské hemoragické horečky a horečky Rift Valley) a Flaviviridae (viry žluté zimnice a omské hemoragické horečky). Tyto nákazy představují skupinu akutních systémových horečnatých onemocnění podobného klinického obrazu, která bývají často doprovázena rozvojem šokového stavu s následným multiorgánovým selháním. Infekce se vyskytují na všech kontinentech mimo Antarktidy a patří mezi typické zoonózy a nákazy s přírodní ohniskovostí. Přenos přímým kontaktem s nemocným nebo jeho tělesnými tekutinami je významný zejména u horeček Lassa, Ebola, Marburg a krymsko-konžské hemoragické horečky. Přestože riziko infekce pro turisty je nízké, patří tato onemocnění mezi obávaná pro jejich závažný klinický průběh a nedostupnost cílené léčby. Současná rozsáhlá epidemie horečky Ebola v západní Africe ukazuje, že tyto infekce mohou představovat zdravotnický problém s globálními důsledky. Dalším potenciálním rizikem by mohlo být zneužití těchto patogenů jako zbraní hromadného ničení. Péče o pacienty s podezřením na tyto infekce vyžaduje dodržování přísných bariérových opatření a hospitalizaci na vysoce specializovaném oddělení.
Klíčová slova:
virové hemoragické horečky – tropická medicína – Ebola – Lassa – krymsko-konžská hemoragická horečka – očkováníÚVOD
Virové hemoragické horečky představují skupinu akutních infekčních onemocnění obdobného klinického obrazu a závažného klinického průběhu, který bývá komplikován rozvojem šokového stavu s krvácivými projevy a multiorgánovým selháním, jež často vede k úmrtí nemocného. Termín „hemoragická horečka“ byl poprvé použit ve třicátých letech 20. století pro označení epidemie vyvolané hantaviry ve východní Asii. Hemoragické horečky vyvolávají obalené RNA viry náležící do čtyř různých čeledí (Filoviridae, Arenaviridae, Bunyaviridae a Flaviviridae), které se vyskytují na všech kontinentech s výjimkou Antarktidy (tab. 1) (12). Tato onemocnění patří mezi zoonózy a nákazy s přírodní ohniskovostí a jejich rozšíření je vázáno na výskyt zvířecího rezervoáru nebo vektoru nákazy. Většina původců hemoragických horeček koluje v přírodě v enzootických cyklech a k nákaze lidí dochází nejčastěji náhodným kontaktem s rezervoárovým zvířetem (4, 12). Přenos přímým kontaktem s nemocným člověkem nebo jeho tělesnými tekutinami je epidemiologicky významný především u horeček Lassa, Ebola, Marburg a krymsko-konžské hemoragické horečky. Přenos kapénkovou infekcí nebyl dosud prokázán (9).
Tab. 1. Přehled virových hemoragických horeček (volně upraveno podle 4, 12 a 35) 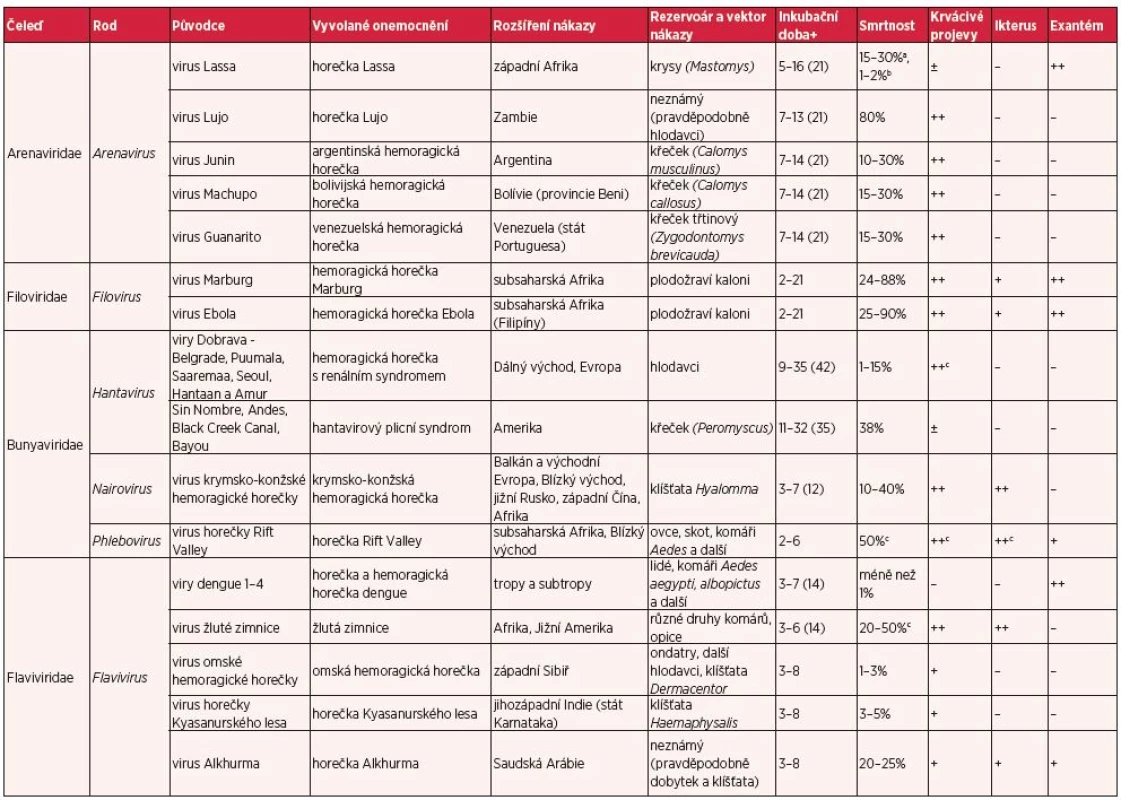
+ obvyklá (maximální) inkubační doba nákazy (dny) a hospitalizovaní pacienti, b všichni nakažení, c hemoragická/závažně probíhající forma onemocnění – ... příznak obvykle nepřítomen, ± ... zřídka, + obvykle přítomen, ++ ... častý Problematika těchto infekcí je v současnosti vysoce aktuální s ohledem na dosud nejrozsáhlejší epidemii horečky Ebola, která probíhá v západní Africe. Vzhledem k předpokládaným počtům nakažených a rozsahu epidemie nelze vyloučit import této nákazy i do evropských zemí.
PATOGENEZE A KLINICKÝ OBRAZ HEMORAGICKÝCH HOREČEK
Patogenetické mechanismy, které se u jednotlivých virových hemoragických horeček uplatňují, jsou nápadně podobné patofyziologickým pochodům u bakteriální sepse a septického šoku (35). U nakažených osob dochází k nadprodukci prozánětlivých cytokinů infikovanými monocyty a makrofágy, poškození integrity cév, snížení efektivního intravaskulárního cirkulujícího objemu s následným rozvojem šokového stavu. Na vaskulárním postižení se méně často podílí i přímý cytopatický efekt viru na buňky endotelu, aktivace komplementu a ukládání imunokomplexů (25). Obvykle bývá přítomna porucha hemostázy při trombocytopenii nebo trombocytopatii, snížené syntéze koagulačních faktorů v játrech nebo diseminované intravaskulární koagulopatii. Nezřídka dochází k terminálnímu poškození orgánů přímým cytopatickým efektem viru (např. jaterní selhání u žluté zimnice, plicní postižení u hantavirového plicního syndromu) nebo v důsledku systémové zánětlivé reakce a šokového stavu (akutní renální selhání, ARDS apod.) (4).
V počátku onemocnění bývá klinický obraz jednotlivých hemoragických horeček shodný a ve většině případů neodlišitelný od jiných infekčních či interních onemocnění doprovázených febrilním stavem (4, 17). Nákaza začíná náhle z plného zdraví rozvojem nespecifických prodromálních příznaků, jakými jsou horečka, zimnice, únava až pocit vyčerpanosti, nechutenství, nevolnost, bolesti hlavy, kloubů, svalů a dyspeptické obtíže (zvracení, průjem, bolesti břicha). U postižených bývá pozorován výsev exantému, subikterus kůže nebo sklér, avšak rozvinutý ikterus nepatří mezi obvyklé příznaky virových hemoragických horeček s výjimkou žluté zimnice a horečky Rift Valley. Typická je konjunktivální injekce nebo subkonjunktivální hematom. Mezi časté symptomy patří i respirační příznaky jako např. suchý dráždivý kašel. Horečka Lassa a omská hemoragická horečka bývají doprovázeny výraznou bolestí v krku. Hrdlo bývá zarudlé, s petechiemi na patře, méně často i s exsudativními změnami na sliznicích (12). Výše uvedené infekce se mohou vzácně manifestovat pouze těmito příznaky (31, 34). Obvyklá je palpační citlivost až bolestivost břicha a různě vyjádřená hepatosplenomegalie (35).
Postupně dochází k rozvoji vazomotorické nestability, k centralizaci oběhu, periferie bývá chladná, opocená, cyanotická, prodlužuje se kapilární návrat. V souvislosti se zvýšenou vaskulární permeabilitou dochází k úniku tekutin a rozvoji plicního edému, popisovány bývají pleurální, méně často i perikardiální či retroperitoneální výpotky (21). Krvácivé projevy jsou popisovány především u krymsko-konžské hemoragické horečky, žluté zimnice a horeček Ebola a Marburg. Projevují se výsevem petechií až ekchymóz, které jsou zejména v počátku onemocnění lokalizovány v axile a v oblasti ramenního pletence. Mezi další projevy hemoragické diatézy patří epistaxe, krvácení z dásní a z míst po vpichu. Krvácení do gastrointestinálního traktu (hemateméza, meléna a hematochezie) je považováno za prognosticky nepříznivé. U žen bývá přítomna metroragie, u těhotných dochází ke spontánním potratům. Masivní hemoptýza a hematurie nepatří do typického klinického obrazu, ke krvácení rovněž téměř nikdy nedochází do 48 hodin od začátku onemocnění. Krvácivé projevy se vyskytují pouze u 30–50 % nakažených virem Ebola, proto nepřítomnost výše uvedených příznaků nevylučuje nákazu viry hemoragických horeček (4, 21, 35). Postižení centrálního nervového systému se manifestuje poruchami chůze, třesem, dysesteziemi a hyperesteziemi, fotofobií, záchvaty křečí, kvalitativní a kvantitativní poruchou vědomí (12).
V časné fázi nákazy bývá v krevním obrazu leukocytopenie s relativní neutrofilií a trombocytopenie. Obvykle jsou přítomny laboratorní známky renální insuficience, hepatálního postižení a diseminované intravaskulární koagulopatie (21). Postupně dochází ke zhoršování celkového stavu, rozvoji šoku a multiorgánovému selhání. U závažných forem infekce nakažený umírá mezi 7. až 10. dnem od počátku onemocnění. Mezi klinické známky nepříznivé prognózy onemocnění patří rozvinutý šokový stav, krvácivé projevy a neurologická symptomatologie (4, 12, 21).
V průběhu rekonvalescence si nemocní stěžují na únavu až celkovou slabost či na přetrvávající bolesti kloubů a svalů. Z neuropsychiatrických příznaků bývají časté depresivně-úzkostné stavy, podrážděnost a poruchy paměti. Tyto příznaky však obvykle během 1–3 měsíců spontánně ustupují (4).
EPIDEMIOLOGIE
Filoviry
Do této čeledi jsou řazeny viry Ebola (subtypy Zaire, Sudan, Bundibugyo, Tai Forest, Reston) a Marburg. Virus Ebola Reston se vyskytuje v jihovýchodní Asii a není patogenní pro člověka. Rezervoárem filovirů jsou pravděpodobně plodožraví kaloni. Tuto domněnku potvrzuje průkaz RNA a antigenu viru Ebola Zaire v séru kaloně kladivohlavého (Hypsignathus monstrosus), kaloně Franquetova (Epomops franqueti) a kaloně řetízkového (Myonycteris torquata). Virus Marburg byl izolován od kaloně egyptského (Rousettus aegyptiacus) (22). První známá epidemie horečky Ebola proběhla v roce 1976 v Súdánu a Demokratické republice Kongo (tehdejší Zaire). Virus byl pojmenován podle názvu řeky protékající v okolí konžského města Yambuku, kde se epidemie vyskytla (24).
Dosud poslední epidemie nákazy vyvolaná kmenem viru Ebola Zaire probíhá v západní Africe. Infekce tímto subtypem se zatím vyskytovaly pouze ve střední Africe. Výskyt nákazy v této oblasti je překvapivý, neboť horečka Ebola se v západní Africe nevyskytla – mimo jeden případ nákazy virem Ebola Tai Forest diagnostikovaný v roce 1994 na Pobřeží slonoviny. Pomocí molekulárně-biologické analýzy bylo prokázáno, že nový kmen viru má více než 97% sekvenční homogenitu s kmeny, které se vyskytují ve střední Africe. Dosud není zcela jasné, zda virus koloval v této oblasti v izolovaných enzootických cyklech i v minulosti, či zda byl tento kmen recentně zavlečen. K přenosu nákazy na osoby zřejmě došlo v souvislosti s lovem a konzumací kaloňů či primátů, což bylo prokázáno i u předchozích epidemií, které proběhly v Gabunu (3).
První případy infekce byly diagnostikovány v březnu 2014 v chudých zalesněných oblastech jihovýchodní Guiney (Gueckedou, Macenta, Kissidougou). Následně však došlo k dalšímu šíření nákazy do hlavního města Conakry, Libérie, Sierra Leone, Nigérie a Senegalu. V posledních dvou jmenovaných státech se další šíření nákazy v současné době podařilo zastavit. V souvislosti s dosud největší epidemií horečky Ebola vyhlásila Světová zdravotnická organizace dne 8. srpna 2014 stav ohrožení mezinárodního významu (Public Health Emergency of International Concern). Do 23. října 2014 bylo hlášeno celkem 10 141 případů a 4922 úmrtí (2, 38). Nezávisle na této epidemii byl v roce 2014 prokázán výskyt nákazy vyvolané odlišným kmenem viru Ebola Zaire i v Demokratické republice Kongo, kde bylo dosud hlášeno 62 případů onemocnění a 35 úmrtí (38).
Infekce virem Marburg byla poprvé popsána v roce 1967 ve stejnojmenném německém městě a v Bělehradu v tehdejší Jugoslávii. K nákaze došlo v laboratoři při práci s infikovanými kočkodany (Cercopithecus aethiops), kteří byli dovezeni z Ugandy. Do Evropy byl v roce 2008 importován případ horečky Marburg u nizozemské turistky, která navštívila ugandské jeskyně. Retrospektivně byla prokázána nákaza virem Marburg i u americké pacientky, která prodělala nespecifické horečnaté onemocnění bez krvácivých projevů a navštívila stejnou jeskyni spolu s nizozemskou cestovatelkou. V roce 2012 byl hlášen výskyt hemoragické horečky v turistických oblastech Ugandy (Kabale, Kampala, Mbara a Ibande) a v říjnu 2014 byl prokázán výskyt horečky Marburg v Kampale (24, 38). Přehled všech případů onemocnění vyvolaných filoviry uvádí tabulka 2.
Tab. 2. Počet hlášených případů hemoragických horeček Ebola a Marburg 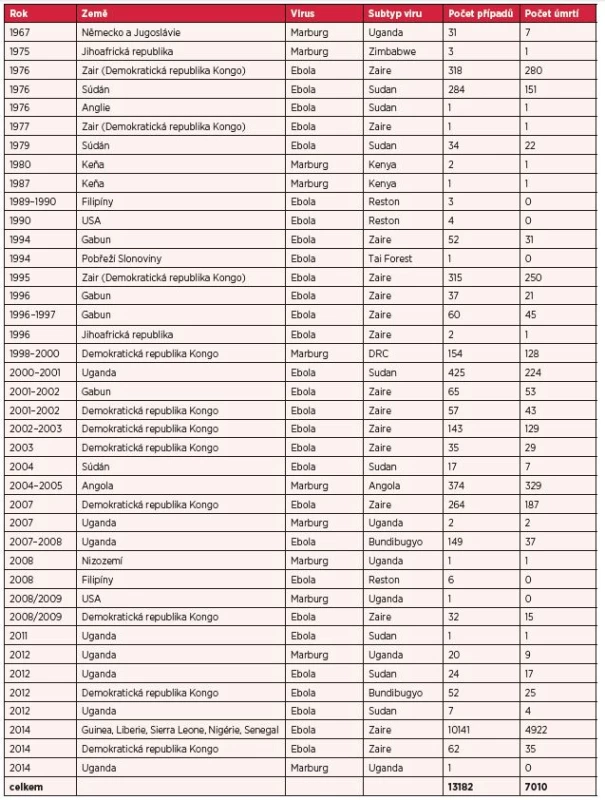
Upraveno dle 4, 24, 38. Počet případů k 23. 10. 2014. Arenaviry
Arenaviry se dělí na skupinu virů Starého světa, mezi které náleží Lassa a Lujo, a skupinu virů Nového světa neboli komplexu Tacaribe, kam řadíme viry Junin, Machupo a Guanarito. Arenaviry Starého světa infikují myšovité hlodavce (Muridae) z podčeledi pravých myší (Murinae) a zástupci arenavirů Nového světa podčeleď amerických křečků (Sigmodontinae). U těchto drobných hlodavců arenaviry vyvolávají chronickou inaparentní infekci, často s prolongovanou či celoživotní virémií a možností vertikálního přenosu. Virus je vylučován močí, slinami a výkaly. Člověk se nejčastěji nakazí vdechnutím infekčního aerosolu, pokousáním hlodavci nebo požitím potravin kontaminovaných exkrety hlodavců. Obdobně jako u filovirových nákaz existuje u této skupiny virů významné riziko mezilidského přenosu. Virus je vylučován po prodělání nákazy močí a seminální tekutinou po řadu měsíců (14, 15, 32).
Horečka Lassa byla poprvé popsána v roce 1969 během epidemie v severovýchodní Nigérii. Rezervoárem viru je hlodavec Mastomys natalensis, který se vyskytuje v blízkosti lidských obydlí. Nákaza je široce rozšířena v západní Africe. Rozsáhlé epidemie byly hlášeny z Nigérie, Guiney, Libérie a Sierra Leone. Odhaduje se, že infekce ročně postihne přibližně 200 000 osob, z toho asi 3000 nemocných nákaze podlehnou (12, 31). Případy infekce byly opakovaně importovány do Evropy, celkem 12 případů nákazy bylo prokázáno ve Velké Británii, v roce 2000 byl diagnostikován jeden případ v Nizozemí a v letech 2000 a 2006 byly importovány celkem tři případy do Německa (1, 38).
Nákaza virem Lujo byla prvně diagnostikována v roce 2008 u ženy, která pobývala v okolí Lusaky v Zambii. Virem se také infikovali čtyři zdravotníci, kteří se podíleli na transportu nakažené a ošetřování pacientů v Johannesburgu. Označení Lujo navrhli vědci z CDC, neboť označuje spojení prvních dvou písmen měst, kde se nákaza vyskytla – Lusaka a Johannesburg (12).
Argentinská hemoragická horečka cirkuluje v enzootických cyklech v úrodných oblastech pamp Jižní Ameriky. V roce 1958 byl izolován původce onemocnění virus Junin, rezervoárem viru je myšovitý hlodavec Calomys musculinus. K nákaze dochází nejčastěji během žní, tj. v březnu až červnu, inhalací infekčního aerosolu a více než tři čtvrtiny nakažených tvoří zemědělci. Ročně bývá diagnostikováno 100–800 případů nákazy a od padesátých let 20. století bylo hlášeno již více než 30 000 případů manifestního onemocnění. Výrazný pokles nemocnosti byl zaznamenán v souvislosti se zavedením účinné vakcinace živou oslabenou očkovací látkou v osmdesátých letech 20. století (10, 15).
Výskyt bolívijské hemoragické horečky byl poprvé dokumentován v roce 1959 a původce nákazy – virus Machupo – byl izolován v roce 1963. Rezervoárem nákazy jsou hlodavci C. callosus. V letech 1962–1964 proběhly rozsáhlé epidemie onemocnění, během kterých bylo nakaženo více než 1000 osob a z toho 180 zemřelo. Díky dobré kontrole rozšíření hlodavců nebyl až do devadesátých let 20. století hlášen žádný případ onemocnění. V devadesátých letech bylo celkem diagnostikováno 19 případů nákazy (15).
Venezuelská horečka byla poprvé popsána v roce 1989 a jako původce nákazy byl identifikován virus Guanarito. Dosud bylo hlášeno přibližně 200 případů onemocnění. Mezi lety 1992 a 2002 incidence onemocnění významně poklesla, avšak v roce 2002 proběhla epidemie nákazy, během které onemocnělo 18 osob, z čehož dvě zemřely (15).
Bunyaviry
Do čeledi Bunyaviridae je řazeno pět rodů: Hantavirus, Nairovirus (virus krymsko-konžské hemoragické horečky), Phlebovirus (virus horečky Rift Valley), Bunyavirus a Tospovirus (12, 35).
Hantaviry se dělí na skupinu virů Starého světa, mezi které patří viry Dobrava-Belgrade, Puumala, Saaremaa, Seoul, Hantaan a Amur vyvolávající hemoragickou horečku s renálním postižením (HFRS) a mírnější formu označovanou jako epidemická nefropatie (NE), a na skupinu virů Nového světa, kam náleží původci hantavirového plicního syndromu (HPS). Celosvětový počet případů se odhaduje na 150 000–200 000 ročně a z tohoto počtu více než 70 % představují případy HFRS v Číně vyvolané viry Hantaan a Seoul (12, 27). V Evropě bývá ročně diagnostikováno přibližně 10 000 případů HFRS/NE. Mezi hantaviry, které se endemicky vyskytují v Evropě, náleží viry Dobrava-Belgrade, Puumala a Saaremaa. Rezervoárem virů Dobrava-Belgrade a Saaremaa jsou myšice (rod Apodemus) a viru Puumala norníci (rod Myodes). Klinický průběh bývá závažný zejména u nákaz vyvolaných virem Dobrava-Belgrade, zatímco nákaza viry Puumala a Saaremaa probíhá obvykle nekomplikovaně. Nejvíce případů infekce je hlášeno z Finska, severního Švédska, Arden, jihozápadního Německa, Balkánu a Ruska (36).
Původcem hantavirového plicního syndromu je virus Sin Nombre, který byl identifikován v roce 1993 během epidemie na jihozápadě USA (Four Corners Region). Rezervoárem viru jsou křečci z rodu Peromyscus. V roce 1995 byl popsán virus Andes, který se endemicky vyskytuje v Argentině. Do současné doby bylo popsáno více než 15 různých hantavirů Nového světa, které vyvolávají HPS (14, 27).
První známá epidemie krymsko-konžské hemoragické horečky proběhla v roce 1944 ve stepní části Krymu. V roce 1956 byl shodný virus izolován v Demokratické republice Kongo. Rezervoárem infekce jsou divoce žijící a hospodářská zvířata (zajíci, kozy, ovce, dobytek, pštrosi). Virus může přenášet více než 30 druhů klíšťat, avšak nejčastěji se uplatňují klíšťata rodu Hyalomma (8). K přenosu infekce na člověka dochází sáním klíšťat, manipulací s nakaženými zvířaty nebo kontaktem s nakaženou osobou. Onemocnění je rozšířeno v Africe, jihovýchodní Evropě, na Středním východě a v západní Asii. Nejvíce případů je hlášeno z Turecka a mezi lety 2002–2007 zde bylo zaznamenáno 1820 případů, z toho ve třech případech se jednalo o nozokomiální nákazu a k úmrtí došlo u 92 nakažených (40). V Evropě byl výskyt nákazy prokázán v Bulharsku, zemích bývalé Jugoslávie, Albánii, Řecku, na Ukrajině a v jihozápadních oblastech Ruské federace (26).
Horečka Rift Valley představuje arbovirové onemocnění, jež vyvolává flebovirus přenášený komáry a flebotomy. Infekce byla poprvé popsána v roce 1931 během rozsáhlé epizoocie spojené s vysokým počtem potratů a případů fulminantně probíhající nekrotizující hepatitidy u ovcí na farmě blízko jezera Naivasha v centrální Keni. Nákaza způsobuje rozsáhlé epidemie a devastující epizoocie s vysokou smrtností u dobytka a dalších přežvýkavců. Vektorem viru jsou komáři rodu Aedes (16). Mezi osoby v riziku onemocnění patří zemědělci, veterináři, pracovníci jatek, venkovské obyvatelstvo, vojáci a turisté pobývající ve volné přírodě. Riziko nákazy pro turisty je nízké, rovněž dosud nebyl prokázán mezilidský nebo nozokomiální přenos nákazy. Onemocnění je rozšířeno v subsaharské Africe, v Egyptě a na Arabském poloostrově. Rozsáhlé epidemie byly spojeny s velkými epizoociemi v roce 1975 v Jihoafrické republice (JAR) a v roce 1977 a 1978 v Egyptě. V září 2000 byly diagnostikovány případy onemocnění v Saudské Arábii a Jemenu, což byly první země s výskytem horečky Rift Valley mimo Afriku. Epidemie horečky Rift Valley byly nedávno hlášeny ze Somálska (2006–2007), Keni (2006–2007), Tanzánie (2007), Súdánu (2007–2008), Mayotte (2007–2008), Madagaskaru (2008), Svazijska (2008), JAR (2008–2010) a Mauretánie (2012). V roce 2010 byl jeden případ importován do Německa u turisty, který pobýval v JAR (4, 18, 35).
Flaviviry
Rod Flavivirus se dělí na dvě fylogeneticky a antigenně odlišné skupiny virů: flaviviry přenášené komáry, mezi které patří např. viry dengue, žluté zimnice, a flaviviry přenášené klíšťaty (např. virus omské hemoragické horečky, horečky Kyasanurského lesa a virus Alkhurma) (23).
Epidemie nákazy podobné žluté zimnici byla poprvé popsána v Santo Domingo v Karibiku v roce 1493. Přenos viru komáry objasnil kubánský lékař Carlos Juan Finlay, který rovněž navrhl opatření k eradikaci onemocnění (37). Žlutá zimnice se vyskytuje v pralesních a městských cyklech a je v současné době rozšířena v subsaharské Africe a Jižní Americe. Infekce se nevyskytuje v Asii. Odhaduje se, že ročně se virem nakazí přibližně 200 000 osob a z tohoto počtu 30 000 infekci podlehne (11).
Případy omské hemoragické horečky byly poprvé zachyceny v roce 1941 v omské oblasti v tehdejším Sovětském svazu. Rezervoárem nákazy jsou hraboši (Microcotus gregalis) a ondatry (Ondatra zibethicus), vektorem klíšťata Dermacentor reticulatus (D. marginatus) a Ixodes apronophorus. U hlodavců nákaza probíhá inaparentně, výjimku představují ondatry, u kterých dochází k rozvoji encefalitidy s vysokou smrtností. Člověk se nejčastěji nakazí kontaktem s infikovaným zvířetem, pokousáním či sáním klíštěte. Dosud nebyl prokázán mezilidský přenos nákazy (6). Opakovaně však byly zaznamenány případy laboratorní nákazy, ke dvěma případům došlo i v tehdejším Československu (34).
Horečka Kyasanurského lesa byla popsána v roce 1957 jako horečnaté onemocnění vyskytující se na severu indického subkontinentu ve státu Karnataka. Virus je přenášen klíšťaty Haemaphysalis, rezervoárem nákazy je krysa Blanfordova (Rattus blanfordi), veverka tříosá (Funambulus tristriatus tristriatus) a rejsek pižmový (Suncus murinus). Symptomatická nákaza u zvířat byla prokázána pouze u opic (13).
První případ horečky Alkhurma byl zaznamenán v Mekce v Saudské Arábii v roce 1995. Virus byl pojmenován podle osady, ze které pocházely ovce, od kterých se pravděpodobně nakazila osoba, u níž byla nákaza poprvé diagnostikována. Do současné doby se onemocnění vyskytlo v Saudské Arábii v Mekce, Džiddě, Džizánu a Najránu (28).
DIAGNOSTIKA
Laboratorní diagnostika by měla probíhat v laboratoři s adekvátním materiálním a personálním zajištěním (BSL-4). V časné fázi nákazy jsou využívány zejména molekulárně-biologické metody (RT-PCR) a detekce antigenu metodou ELISA. Mezi jejich výhody patří možnost práce s neinfekčním vzorkem biologického materiálu po jeho ozáření. V rozvojových zemích se využívá jednokrokové izotermální amplifikace nukleové kyseliny metodou RT-LAMP (loop-mediated isothermal amplification) (7). V pozdějších stadiích onemocnění je možné využít sérologického průkazu virus-specifických protilátek. V současné době je nejčastěji využívána metoda ELISA, eventuálně nepřímá imunofluorescence, RIA a Western-blot. Mezi náročnější metody, které se využívají pro výzkumné účely, patří izolace viru na tkáňových kulturách nebo na laboratorních zvířatech, případně elektronová mikroskopie (12, 35).
DIFERENCIÁLNÍ DIAGNOSTIKA
Vzhledem k nespecifickým projevům virových hemoragických horeček jsou tyto infekce v časné fázi klinicky neodlišitelné od jiných horečnatých onemocnění. Diferenciální diagnostika zahrnuje celou řadu endemicky se vyskytujících i kosmopolitně rozšířených infekčních onemocnění. Opomenuta by však neměla být ani interní onemocnění (12, 35).
Podezření na virovou hemoragickou horečku by mělo vzbudit horečnaté onemocnění u nemocného, který v posledních třech týdnech před rozvojem příznaků pobýval v oblastech s výskytem hemoragické horečky a udává kontakt s krví nebo tělesnými tekutinami nemocné osoby nebo zvířete, kontakt s živým nebo nedávno usmrceným zvířetem pocházejícím z oblasti s endemickým výskytem hemoragické horečky, pracoval v laboratoři s viry hemoragických horeček nebo měl pohlavní styk s osobou, která v posledních třech měsících prodělala virovou hemoragickou horečku (4, 5, 18).
Mezi hemoragické horečky s nejvyšší incidencí patří hantavirová hemoragická horečka s renálním syndromem, žlutá zimnice, Lassa, Ebola, krymsko-konžská hemoragická horečka, jihoamerické hemoragické horečky, horečka Rift Valley, Kyasanurského lesa a omská hemoragická horečka. U všech osob s odpovídající cestovní anamnézou i v případě splnění výše uvedených podmínek by však měla být vyloučena pravděpodobnější infekční onemocnění jako malárie, břišní tyfus a paratyfy, arbovirózy, rickettsiózy, návratný tyfus, leptospirózy, meningokoková či jiná bakteriální sepse (5, 12).
TERAPIE, POSTEXPOZIČNÍ PROFYLAXE A PREVENCE
Ošetřování pacienta s podezřením nebo prokázanou virovou hemoragickou horečkou by mělo probíhat ve specializovaných centrech, kde je pacientovi poskytnuta odborná péče a zároveň je zajištěna izolace nemocného (17).
V současné době není u většiny virových hemoragických horeček dostupná kauzální terapie, proto má význam především symptomatická a podpůrná léčba. Jelikož patofyziologické pochody, které probíhají u hemoragických horeček, jsou obdobné jako u závažné bakteriální sepse, využívá se shodných terapeutických postupů. Nezbytné je oběhově a ventilačně stabilizovat pacienta, normalizovat orgánovou perfuzi a zabezpečit dostatečnou oxygenaci organismu (17, 35). Základem léčby je adekvátní náhrada tekutin, avšak masivní doplnění cirkulujícího objemu při často přítomné endoteliální dysfunkci může vést k redistribuci tekutin v organismu, k úniku tekutin do třetích prostor a rozvoji plicního edému (4). V rozvojových zemích se u filovirových nákaz osvědčila rehydratace orálními roztoky (33).
Jediným účinným dostupným antivirovým preparátem, který lze využít v léčbě některých hemoragických horeček, je ribavirin. Terapie ribavirinem, pokud byla zahájena do 6 dnů od rozvoje příznaků, snížila smrtnost horečky Lassa z 55 % na 5 %. Předpokládá se, že ribavirin je účinný i v terapii příbuzných arenavirových a vybraných bunyavirových infekcí (hantaviry), avšak výsledky klinických studií u krymsko-konžské hemoragické horečky a horečky Rift Valley nejsou jednoznačné. Preparát není účinný na filoviry (14).
Užití rekonvalescentní plazmy snížilo smrtnost argentinské hemoragické horečky z 15–30 % na méně než 1 %, pokud byla aplikována do 8 dnů od začátku onemocnění (10). Podání hyperimunního heterologního nebo homologního séra se ukázalo jako účinné při léčbě krymsko-konžské hemoragické horečky a užívá se v případě nákazy virem Ebola (8).
V souvislosti s probíhající epidemií horečky Ebola byla použita experimentální terapie preparátem ZMapp (Mapp Biopharmaceutical, Inc.), který obsahuje směs tří humanizovaných monoklonálních protilátek cílených proti antigenům viru Ebola Zaire, které byly připraveny rekombinantní technologií. ZMapp byl použit i u několika pacientů, ale míra účinnosti není zcela jasná. Další experimentální antivirový přípravek představuje TEKM-EBOLA (Tekmira), což je antivirově působící směs tzv. malých interferujících molekul RNA (siRNA). Mezi vyvíjené antivirově působící preparáty patří pyrazinkarboxamidový derivát favipiravir (T-705), preparát Sarepta (AVI/7537) a nukleosidový analog BCX4430 (Biocryst) (39). Potenciálním širokospektrým antivirotikem by mohl být i bavituximab, což je monoklonální protilátka proti fosfatidylserinu exponovanému na membránách obalených virů a buňkách nakažených viry (20, 39).
Ve vývoji je celá řada vakcín proti viru Ebola. Mezi nejnadějnější kandidátní vakcíny, které prokázaly účinnost během preklinických testů na primátech, patří vakcína cAD3-EBOV vyvíjená společností GlaxoSmithKline (GSK) a americkým Národním ústavem pro alergie a infekční nemoci a vakcína rVSV∆G-EBOV-GPV, kterou vyvíjí společnost NewLink Genetics. V případě první jmenované vakcíny je jako vektor využit inaktivovaný šimpanzí adenovirus (sérotyp 3). Vakcína je vyvíjena v monovalentní formě, která obsahuje geny viru Ebola Zaire, a v bivalentní variantě, která navíc obsahuje geny subtypu Sudan. V současné době probíhají s touto očkovací látkou dvě klinické studie první fáze v USA a Velké Británii. Druhá vakcína využívá jako vektor atenuo-vaný virus vezikulární stomatitidy a v průběhu října 2014 se očekává zahájení studie první fáze klinického testování. Tato vakcína byla profylakticky podána v březnu 2009 laboratorní pracovnici, která se poranila jehlou kontaminovanou virem Ebola Zaire v německém ústavu Bernharda Nochta v Hamburgu (19, 39).
POSTUP PŘI PODEZŘENÍ NA NÁKAZU VIROVOU HEMORAGICKOU HOREČKOU V ČR
Organizace péče o pacienty s vysoce nebezpečnou nákazou se v civilním sektoru České republiky řídí Usnesením vlády č. 785/2011 o Národním akčním plánu České republiky pro případ vzniku události podléhající Mezinárodním zdravotnickým předpisům a usnesením vlády č. 15/2013 „Směrnice pro jednotný postup při vzniku mimořádné události podléhající Mezinárodním zdravotnickým předpisům v souvislosti s výskytem vysoce nakažlivé nemoci ve zdravotnickém zařízení“. Výše uvedená usnesení vlády jsou implementací Mezinárodních zdravotnických předpisů (30).
Podle výše uvedené směrnice zdravotnické zařízení, které stanovilo podezření na VNN, zajistí izolaci pacienta v dispozičně oddělené místnosti, provede opatření k zamezení příjmu pacientů a vstupu dalších osob do vyhrazené části, kde je pacient umístěn, zajistí klinické vyšetření a nezbytné ošetření nemocného, zjistí údaje o pacientovi a jeho kontaktech a přes operační a informační středisko Hasičského záchranného sboru (HZS) kontaktuje pracovníka místně příslušného orgánu ochrany veřejného zdraví. Zdravotnické zařízení je povinné u všech pracovníků, kteří přijdou do kontaktu s pacientem, zajistit použití osobních ochranných prostředků (30). Podle instrukcí Ministerstva zdravotnictví ČR (MZČR) tyto pomůcky v optimální variantě zahrnují jednorázovou filtrační polomasku třídy FFP3 s elastickou těsnící linií, uzavřené ochranné brýle, dvě vrstvy rukavic, přičemž vrchní musí být chemicky odolná (např. nitril či butyl) a celotělový ochranný oděv s kapucí, který v minimální variantě vyžadován není (29).
Krajská hygienická stanice (KHS) zajistí informování MZČR, HZS, Policie ČR a ZZS, aktivuje síly a prostředky potřebné k výjezdu do zdravotnického zařízení, které ohlásilo podezření na VNN, provede epidemiologické šetření u pacienta s podezřením na VNN a u všech osob, které s ním přišly do kontaktu. Skutečnosti zjištěné epidemiologickým šetřením předá MZČR (30).
Jako poskytovatel zdravotních služeb a koncový článek pro izolaci pacientů s prokázanou nebo suspektní vysoce nebezpečnou nákazou (VNN) je určeno Národní centrum pro vysoce nebezpečné nákazy zřízené MZ ČR v roce 1996 na Klinice infekčních, parazitárních a tropických nemocí Nemocnice Na Bulovce v Praze (KIPTN NNB). Převoz pacienta na toto pracoviště zajišťuje zdravotnická záchranná služba. Během transportu musí být užito ochranného prostředku (biovak) a osobních ochranných pomůcek. Přepravu vzorků biologického materiálu zajišťuje Speciální mobilní biologický tým Armády ČR, který náleží pod Ústřední vojenský zdravotní ústav (Praha), nebo dopravní zdravotní služba podle instrukcí vydaných MZ ČR.
KHS po konzultaci s KIPTN NNB a MZ ČR rozhodne o druhu a rozsahu protiepidemických opatření, zejména stanoví druh karanténních opatření u pacienta a jeho blízkých kontaktů, způsob dezinfekce kontaminovaných předmětů. KHS dále informuje příslušný krajský úřad o mimořádné situaci a přijatých opatřeních. MZ ČR předá informace o vzniklé situaci kontaktnímu místu WHO, Evropské komisi (DG SANCO) a ECDC cestou systému rychlého varování (Early Warning and Response System) (30).
ZÁVĚR
Přestože riziko nákazy a importu virové hemoragické horečky při pobytu v oblastech endemického výskytu je relativně nízké, je nezbytné tuto možnost zvažovat v diferenciální diagnostice febrilních stavů po návratu z rizikových oblastí. V současné době není pro většinu hemoragických horeček dostupná efektivní cílená antivirová terapie, avšak nemocnému by měla být poskytnuta adekvátní intenzivní a resuscitační péči, která může ovlivnit prognózu onemocnění.
Seznam použitých zkratek
ARDS Acute respiratory distress syndrome
ECDC European Centre for Disease Control and Prevention
HFRS Haemorrhagic fever with renal syndrome
HPS Hantavirus pulmonary syndrome
HZS Hasičský záchranný sbor
KHS Krajská hygienická stanice
KIPTN NNB Klinika infekčních, parazitárních a tropických nemocí Nemocnice Na Bulovce
MZČR Ministerstvo zdravotnictví ČR
NE Nephropathia epidemica
VNN Vysoce nebezpečné nákazy
Střet zájmů: žádný.
ADRESA PRO KORESPONDENCI:
MUDr. Milan Trojánek
1. infekční klinika 2. LF UK a Nemocnice Na Bulovce
Budínova 2, 180 81 Praha 8
e-mail: milan.trojanek@bulovka.cz
Zdroje
1. Atkin S, Anakari S, Gothard P, et al. The first case of Lassa fever imported from Mali to the United Kingdom, February 2009. Euro Surveill 2009; 14(10): 1–3.
2. Baize S, Pannetier D, Oestereich L, et al. Emergence of Zaire Ebola virus disease in Guinea-preliminary report. N Engl J Med 2014; 371(15): 1418–1425.
3. Bausch DG, Schwar, L. Outbreak of ebola virus disease in Guinea: where ecology meets economy. PLoS Negl Trop Dis 2014; 8(7), e3056.
4. Bausch DG. Viral hemorrhagic fevers. In D. Schlossberg et al. Clinical Infectious Diseases. 1st Ed. New York: Cambridge University Press 2008; 1319–1332.
5. Beeching NJ, Fletcher TE, Hill DR, Thomson GL. Travellers and viral haemorrhagic fevers: what are the risks? Int J Antimicrob Agents 2010; 36(Suppl 1): S26–35.
6. Dobler G. Zoonotic tick-borne flaviviruses. Vet Microbio, 2010; 140(3–4): 221–228.
7. Dong J, Olano JP, McBride JW. Emerging pathogens: challenges and successes of molecular diagnostics. J Mol Diagn 2008; 10(3): 185–197.
8. Ergonul O. Crimean-Congo hemorrhagic fever virus: new outbreaks, new discoveries. Curr Opin Virol 2012; 2(2): 215–220.
9. Ftika L, Maltezou HC. Viral haemorrhagic fevers in healthcare settings, J Hosp Infect 2013; 83(3): 185–192.
10. Gomez RM, Jaquenod de Giusti C, Sanchez Vallduvi MM, et al. Junin virus. A XXI century update. Microbes Infect 2011; 13(4): 303–311.
11. Gubler DJ. The changing epidemiology of yellow fever and dengue, 1900 to 2003: full circle? Comp Immunol Microbiol Infect Dis 2004; 27(5): 319–330.
12. Guerrant RL, Walker DH, Weller PF, et al. Tropical infectious diseases: principles and practice. 3rd Ed. New York: Saunders 2011.
13. Holbrook MR. Kyasanur forest disease. Antiviral Res 2012; 96(3): 353–362.
14. Charrel RN, Coutard B, Baronti C. Arenaviruses and hantaviruses: from epidemiology and genomics to antivirals. Antiviral Res 2011; 90(2): 102–114.
15. Charrel RN, de Lamballerie X. Arenaviruses other than Lassa virus. Antiviral Res 2003; 57(1–2): 89–100.
16. Ikegami T, Makino S. The pathogenesis of Rift Valley fever. Viruses 2011; 3(5): 493–519.
17. Ippolito G, Feldmann H, Lanini S, et al. Viral hemorrhagic fevers: advancing the level of treatment. BMC Med 2012; 10(31): 1–8.
18. Isaacson M. Viral hemorrhagic fever hazards for travelers in Africa. Clin Infect Dis 2001; 33(10): 1707–1712.
19. Kanapathipillai R, Restrepo AM, Fast P, et al. Ebola vaccine - an urgent international priority. N Engl J Med 2014 [on line] 2014-10-07 [cit. 2014-10-15]. Dostupné z: http://www.nejm.org/doi/full/10.1056/NEJMp1412166.
20. Kondratowicz AS, Maury WJ. Ebolavirus: a brief review of novel therapeutic targets. Future Microbiol 2012; 7(1): 1–4.
21. Kortepeter MG, Bausch DG, Bray M. Basic clinical and laboratory features of filoviral hemorrhagic fever. J Infect Dis 2011; 204(Suppl 3): S810–816.
22. Leroy EM, Gonzalez JP, Baize S. Ebola and Marburg haemorrhagic fever viruses: major scientific advances, but a relatively minor public health threat for Africa. Clin Microbiol Infect 2011; 17(7): 964–976.
23. Mackenzie JS, Gubler DJ, Petersen LR. Emerging flaviviruses: the spread and resurgence of Japanese encephalitis, West Nile and dengue viruses. Nat Med 2004; 10(Suppl 12): S98–109.
24. MacNeil A, Rollin PE. Ebola and Marburg hemorrhagic fevers: neglected tropical diseases? PLoS Negl Trop Dis 2012; 6(6):, e1546.
25. Mahanty S, Bray M. Pathogenesis of filoviral haemorrhagic fevers. Lancet Infect Dis 2004; 4(8): 487–498.
26. Maltezou HC, Papa A. Crimean-Congo hemorrhagic fever: risk for emergence of new endemic foci in Europe? Travel Med Infect Dis 2010; 8(3): 139–143.
27. Manigold T, Vial P. Human hantavirus infections: epidemiology, clinical features, pathogenesis and immunology. Swiss Med Wkly 2014; 144, w13937 [on line] [cit. 2014-09-15]. Dostupné na: http://www.smw.ch/scripts/stream_pdf.php?doi=smw-2014-13937.
28. Memish ZA, Fagbo SF, Assiri AM, et al. Alkhurma viral hemorrhagic fever virus: proposed guidelines for detection, prevention, and control in Saudi Arabia. PLoS Negl Trop Dis 2012; 6(7): e1604.
29. Ministerstvo zdravotnictví ČR. Minimální a optimální vybavení ordinací VPL proti vysoce nebezpečným infekcím [on line] [cit. 2014-10-11]. Dostupné na: http://www.svl.cz/files/files/Zpravy/42761_OOPP.pdf
30. Ministerstvo zdravotnictví ČR. Směrnice pro jednotný postup při vzniku mimořádné události podléhající Mezinárodním zdravotnickým předpisům v souvislosti s výskytem vysoce nakažlivé nemoci ve zdravotnickém zařízení [on line] [cit. 2014-08-15]. Dostupné na: http://www.mzcr.cz/Verejne/obsah/smernice-pro-zdravotnicka-zarizeni_2879_5.html.
31. Ogbu O, Ajuluchukwu E, Uneke CJ. Lassa fever in West African sub-region: an overview. J Vector Borne Dis 2007; 44(1): 1–11.
32. Richmond JK, Baglole DJ. Lassa fever: epidemiology, clinical features, and social consequences. BMJ 2003; 327(7426): 1271–1275.
33. Roddy P, Howard N, Van Kerkhove MD, et al. Clinical manifestations and case management of Ebola haemorrhagic fever caused by a newly identified virus strain, Bundibugyo, Uganda 2007–2008. PLoS One 2012; 7(12): e52986.
34. Ruzek D, Yakimenko VV, Karan LS, et al. Omsk haemorrhagic fever. Lancet 2010; 376(9758): 2104–2113.
35. Solomon T, Thomson G. Viral haemorrhagic fevers. In Cook G, Zumla A. (eds.) Manson’s Tropical Diseases. 22nd Ed., New York: Saunders 2009; 763–785.
36. Vaheri A, Henttonen H, Voutilainen L, et al. Hantavirus infections in Europe and their impact on public health. Rev Med Virol 2013; 23(1): 35–49.
37. Weaver SC, Reisen WK. Present and future arboviral threats. Antiviral Res 2010; 85(2): 328–345.
38. World Health Organization. Global alert and response, diseases outbreak news [on line] [cit. 2014-10-11]. Dostupné na: http://www.who.int/csr/don/en/
39. World Health Organization. Potential new Ebola therapies and vaccines – background document [on line] [cit. 2014-10-11]. Dostupné z: http://www.who.int/csr/disease/ebola/ebola-new-interventions-02-sep-2014.pdf?ua=1
40. Yilmaz GR, Buzgan T, Irmak H, et al. The epidemiology of Crimean-Congo hemorrhagic fever in Turkey, 2002-2007. Int J Infect Dis 2009; 13(3): 380–386.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2015 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Současná léčba pyogenního abscesu jater – zkušenosti Chirurgické kliniky FN Plzeň
- Dopady holokaustu na zdraví přeživších
- Intervence v prevenci pádů seniorů v institucích: přehledová studie
- Změny v hladinách prolinu v moči mohou korelovat s úspěšností operační léčby karcinomu prostaty
- Klostridiová flegmóna břišní stěny u obézní pacientky s Crohnovou chorobou
- Virové hemoragické horečky
-
Josef Štorek, Petr Herle
Urgentní medicína pro všeobecné lékaře -
Křeslo pro Fausta
Rozhovory vedla a k vydání připravila Marie Retková - Jubilanti
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současná léčba pyogenního abscesu jater – zkušenosti Chirurgické kliniky FN Plzeň
- Klostridiová flegmóna břišní stěny u obézní pacientky s Crohnovou chorobou
- Virové hemoragické horečky
- Jubilanti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



