-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
První zkušenosti s využitím zevní pórované PTFE protézy v chirurgii arteriovenózních zkratů
First Experience with PTFE Mesh Prothesis in Surgery of Arteriovenous Access
The authors present their initial experience with implantation of external porous PTFE prosthesis in transpositioning of the basilic vein in brachiocephalic fistules in 5 patients and in the management of radiocephalic fistules in 4 subjects during, operated from October 2006 to April 2007. Implantation of the external porous PTFE prosthesis in venous transpositions to form AVFs is aimed at prevention of pseudoaneurysms formation , as well as at prevention of development of intimal hyperplasias. The external prosthesis implantation is indicated in aneurysmoraphies, where the venous wall is weakened as a result of its suturing, which makes it predisposed for development of a new pseudoaneurysm.
Key words:
AVF – transposition – aneurysmoraphy – PTFE
Autoři: P. Baláž; S. Rokošný; D. Klein; R. Trubač *; M. Adamec
Působiště autorů: Klinika transplantační chirurgie, Institut klinické a experimentální medicíny, Praha přednosta: prof. MUDr. M. Adamec, CSc. ; Anatomický ústav LF MU, Brno *
Vyšlo v časopise: Rozhl. Chir., 2007, roč. 86, č. 9, s. 475-479.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Autoři prezentují první zkušenosti s implantací zevní pórované PTFE protézy při transpozici basilické žíly u brachiobasilické píštěle u 5 pacientů a při ošetření pseudoaneuryzmatu radiocefalické píštěle u 4 pacientů v období 10/2006 – 4/2007. Implantace zevní pórované PTFE protézy při transpozici žil k vytvoření AVF má význam v prevenci vzniku pseudoaneuryzmatu a současně v prevenci vzniku intimální hyperplazie. Implantace zevní protézy je indikována při aneurysmorrhafii, kde je stěna žíly po sutuře oslabená a vzniká tak predispozice ke vzniku nového pseudoaneuryzmatu.
Klíčová slova:
AVF – transpozice – aneuryzmorrhafie – PTFEÚVOD
Pro pacienty v chronickém renálním selhání je život zachraňující hemodialýza nebo úspěšná transplantace ledviny. Pro hemodializační léčbu je nezbytný správně umístněný a funkční cévní přístup, který se nejčastěji získává vytvořením arteriovenózních spojek (AVF). Strategie vytváření AVF je všeobecně známá, jako první volba je zakládání nativních AVF a až poté se přistupuje k zakládání protetických zkratů. Jako jednou z možností vytvoření nativního arteriovenózního zkratu jsou operace spojené s transpozicí žil k vytvoření tepenně-žilního spojení. V této indikaci se často využívá spojení transponované basilické žíly s brachiální tepnou, popsaná Dagherem již v roce 1976 [1]. Výhodou basilické žíly je její dobrá kvalita, protože svým subfasciálním uložením je chráněná před venepunkcemi a kanylacemi. Další možností vytvoření AVF je použít u indikovaných pacientů k vytvoření zkratu existující, pseudoaneuryzmaticky změněný zkrat, který je již nevhodný k aplikaci hemo-dialýzy. Tato technicky náročná operace spočívá v resekci vaku aneuryzmaticky změněné žíly, úpravě jejího průměru a konstrukce nové anastomózy s tepnou.
Obecně průchodnost AVF závisí na mnoha faktorech a podle studie Kallmana na 215 AVF (nativních i protetických) je primární průchodnost za 24 měsíců jen 36 % [2]. Při uzávěru AVF v brzkém období hraje roli především nevhodný průměr použité žíly, ateroskleróza tepny, stenóza v anastomóze a zahájení hemodialýzy na ještě nematurovanou spojku. Dalšími faktory včasného uzávěru jsou koagulační poruchy a celkové onemocnění pacienta. Tyto faktory je možné eliminovat výběrem správné strategie operace a šetrnou technikou operace. Dlouhodobé užívání antiagregační a antikoagulační terapie je diskutabilní. Dlouhodobou průchodnost arteriovenózních píštělí limituje, kromě jiných faktorů (opakované poškozování cévní stěny kanylacemi při hemodialýze), vznik intimální hyperplazie nebo taky označované jako neointima, což zahrnuje migraci a proliferaci hladkých svalových buněk na podnět endogenně produkovaného růstového faktoru přes lamina elastica interna až do medie. Tento proces vede ke ztluštění žilní stěny [3]. Vznik intimální hyperplazie je komplexní multifaktoriální proces, který není ještě dokonale prostudován [4]. Je proto nutné volit vhodnou strategii operace a vynaložit maximální úsilí k záchraně funkce arteriovenózních píštělí. Jedním z příkladů nepoužitelné AVF je mohutné pseudoaneuryzma, které pro své rozměry a křehkou stěnu již nedovoluje aplikaci hemodialýzy. Pseudoaneuryzma má i další atributy, které dělají obtíže pacientovi. Bolest, strach z poranění a v neposlední řadě i neestetický dojem. U většiny těchto pacientů se setkáváme s indikací k odstranění pseudoaneuryzmatu a konstrukce nové píštěle.
Jednou z možností prevence vzniku intimální hyper-plazie v žilním štěpu je ovlivnění hemodynamiky, které je žilní stěna v arteriálním řečišti vystavena [4]. Na trhu je dostupná zevní pórovaná PTFE protéza (ProVena©, fy.B.Braun), která byla vyvinuta k použití na periferní cévní rekonstrukce k ochraně infrainguinálních žilních bypasů. Protéza působí proti tangenciálnímu rozpínání žíly a tím snižuje turbulenci krevního toku, což snižuje tvorbu intimální hyperplazie.
Cílem tohoto sdělení je prezentovat vlastní zkušenosti autorů s implantací zevní pórované PTFE protézy při transpozici basilické žíly u brachiobasilické píštele a při ošetření pseudoaneuryzmatu radiocefalické píštěle.
MATERIÁL A METODY
V období 10/2006 – 4/2007 jsme provedli transpozici basilické žíly s implantací zevní pórované protézy u 5 pacientů a u 4 pacientů po resekci pseudoaneuryzmatu radiocefalické píštěle. Všichni pacienti s průměrným věkem 56 let, 5 mužů, 4 ženy, měli chronické renální selhání s nutností hemodializační léčby.
Technika transpozice basilické žíly
Podstatou operace je preparace a uvolnění basilické žíly z subfasciálního prostoru s vytvořením arteficiálního subkutánního tunelu, kde se žíla transponuje a end-to-side anastomóza s brachiální tepnou.
Operace je většinou vedena v regionální anestezii interscalenického nervového plexu. Při poloze pacienta na zádech je horní končetina v maximálni abdukci a supinaci. Operační pole je tvořeno prostorem od axily až ke kubitě. Z obloukovitého řezu nad mediálním epikondylem humeru preparujeme basilickou žílu a brachiální tepnu. Prodloužením řezu až do axily izolujeme basilickou žílu až k soutoku s brachiální žílou, s ohledem na nervus cutaneus brachii medialis, který probíhá v těsném sousedství s basilickou žílou (Obr. 1). Po izolacicelé basilické žíly podvazujeme pečlivě její odstupy. Následuje její přerušení distálně a šetrná dilatace instilací fyziologického roztoku (Obr. 2). Po změření průměru dilatované žíly implantujeme zevní pórovanou protézu (Obr. 3). Vytvořeným podkožním tunelem takto připravenou žílu transponujeme do podkoží až k místu anastomózy s brachiální tepnou (Obr. 4). Anastomózu typu end-to-side konstruujeme po 4–5mm arteriotomii 6/0 monofilamentním vláknem. Po kontrole hemostázy a funkčnosti píštěle zavádíme Redonův drén a po zašití fascie po odběru žíly uzavíráme operační ránu.
Obr. 1. Vypreparovaná vena basilica Fig. 1. The preparated vena basilica 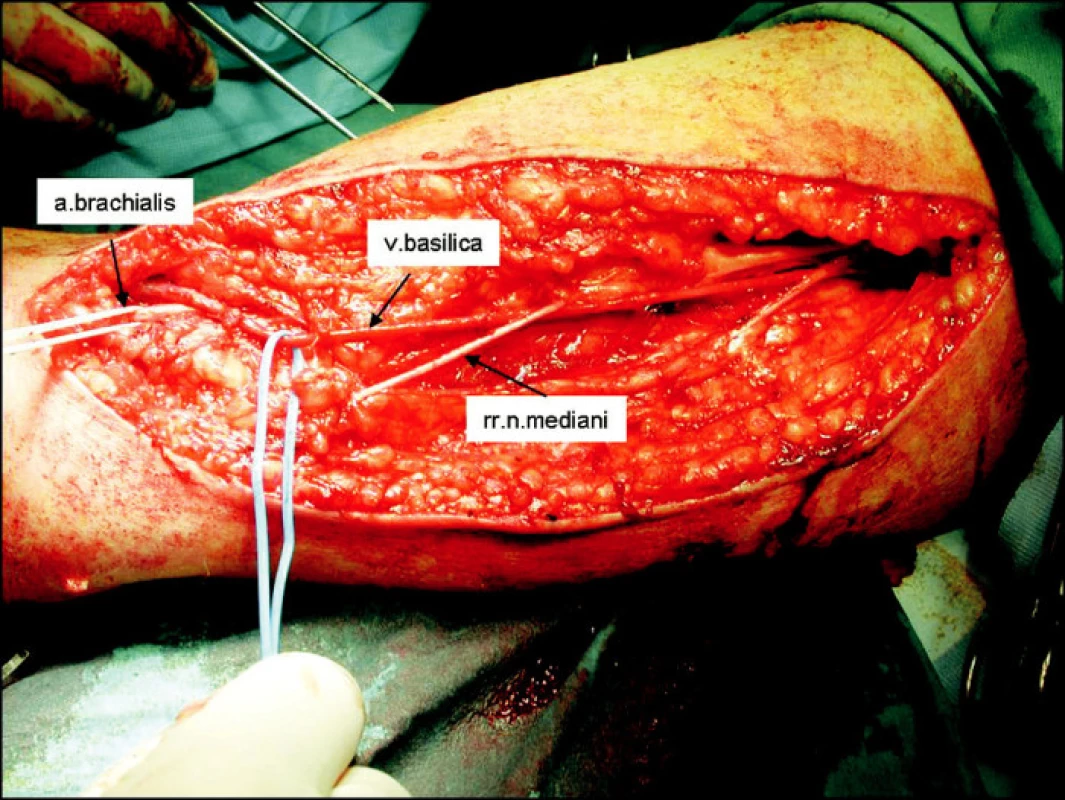
Obr. 2. Hydrodilatace vena basilica Fig. 2. Hydrodilation of the vena basilica 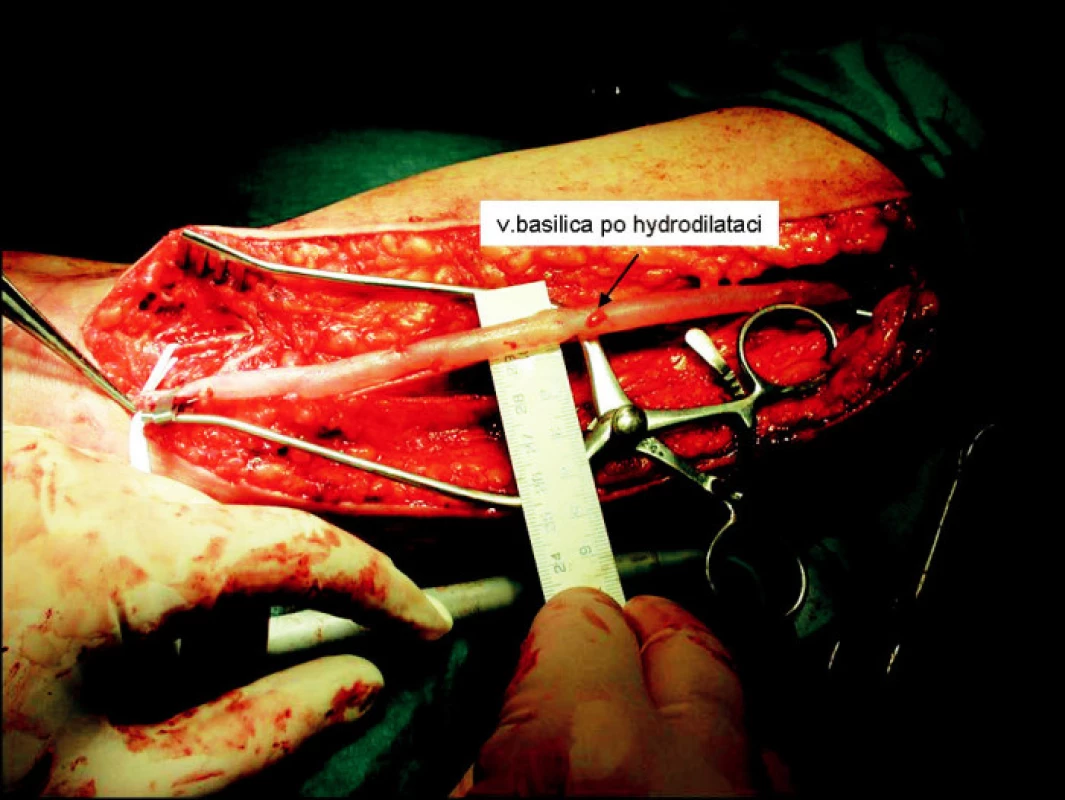
Obr. 3. Aplikace zevní protézy na basilickou žílu Fig. 3. Application of the external prosthesis to the basilic vein 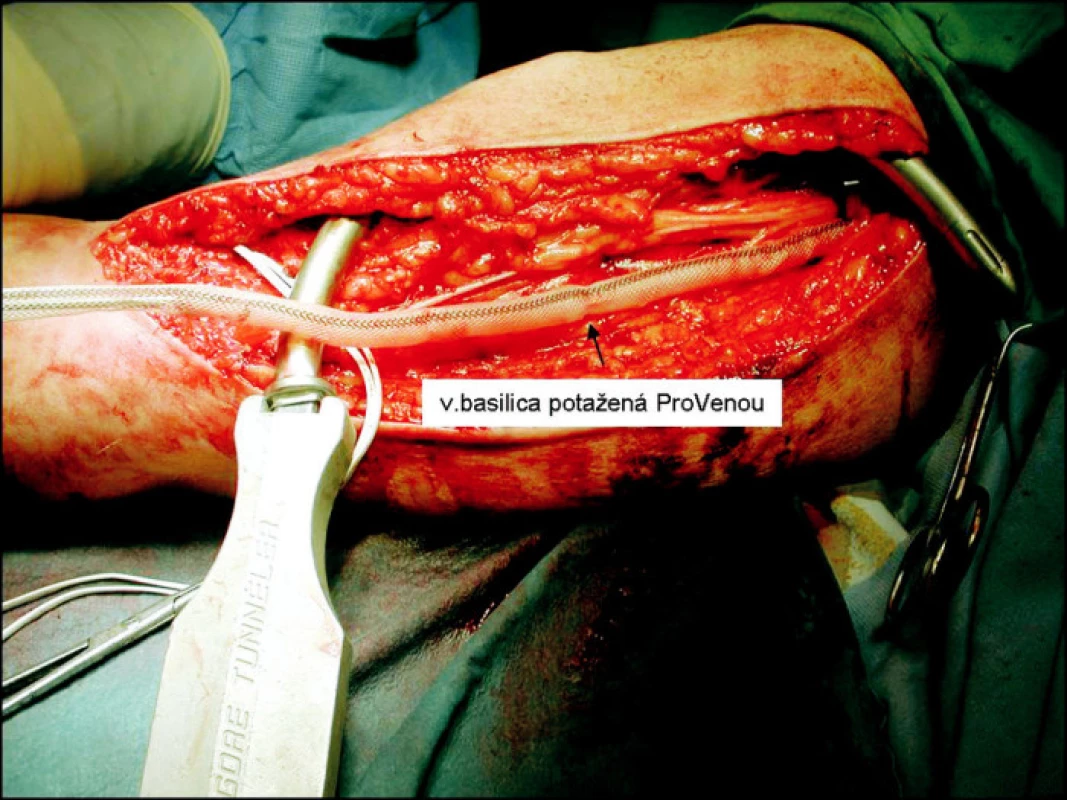
Obr. 4. Anastomóza vena basilica s arteria brachialis Fig. 4. Anastomosis between the vena basilica and arteria brachialis 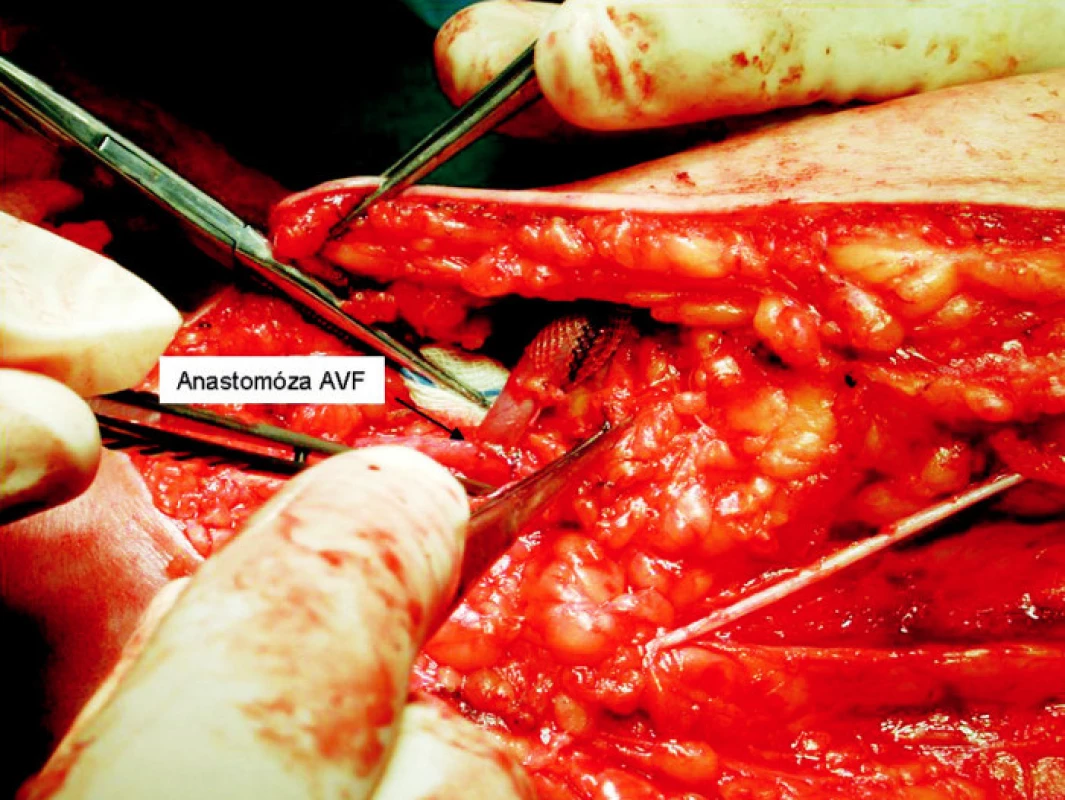
Technika aneurysmorrhafie
Operaci provádíme v regionální anestezii intreskalenického nervového plexu. Poloha pacienta je stejná jak při transpozici vena basilica. Operaci zahájíme preparací v místě arteriovenózní anastomózy (Obr. 5). Po obejití a naložení turniketu vypreparujeme celou pseudovýduť (Obr. 6) až do místa nedilatované části žíly. Při preparaci věnujeme pozornost probíhajícím nervům. Po izolaci celého pseudoaneuryzmatu podáme celkově 5000 – –10000 UI Heparinu a naložíme nejprve svorku na zásobující tepnu, poté na nedilatovanou žílu. Těsně nad anastomózou píštěl přerušíme, aby nám zůstal terč z části pseudovýdutě, který nám ulehčí konstrukci nové anastomózy. Postupně nakládáme svorky na vak vydutě a po kontrole průměru instilací fyziologického roztoku, provadíme její resekci a suturu stěny – aneurysmorrhafii pokračujícím stehem 6/0 (Obr. 7). Takto ošetříme celou aneuryzmaticky změněnou žílu na požadovaný průměr, který by neměl přesáhnout 6mm. Na takto upravenou žílu „navlékneme“ zevní pórovanou protézu postupem uvedeným při transpozici basilické žíly. Konstruujeme novou anastomózu v místě původního spojení. Neutralizujeme heparin adekvátní dávkou protaminsulfátu a po kontrole hemostázy zavedeme Redonův drén a uzavíráme podkoží a kůži (Obr. 8).
Obr. 5. Pseudoaneuryzma radiocefalické píštěle 9 let od založení, šipka znázorňuje místo anastomózy Fig. 5. A pseudoaneurysm of a radiocephalic fistule 9 years following its completion, the anastomosis is marked by an arrow 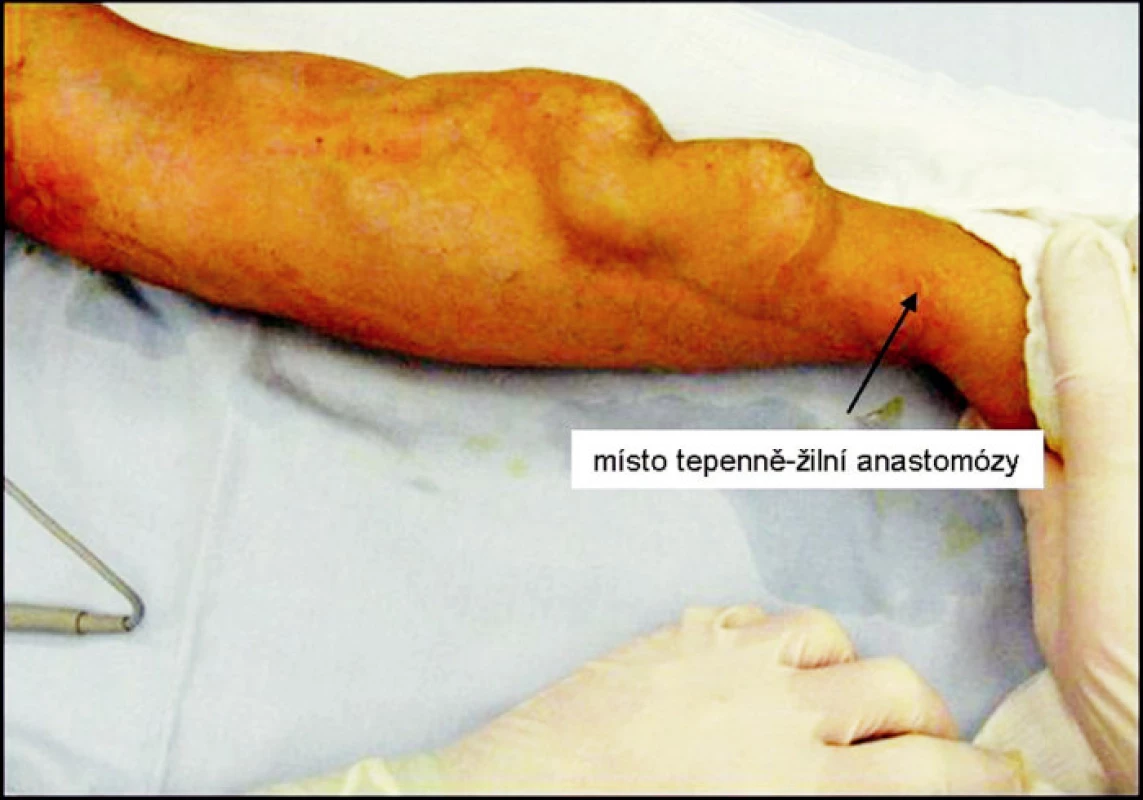
Obr. 6. Preparace pseudoaneuryzmatu Fig. 6. Preparation of the pseudoaneurysm 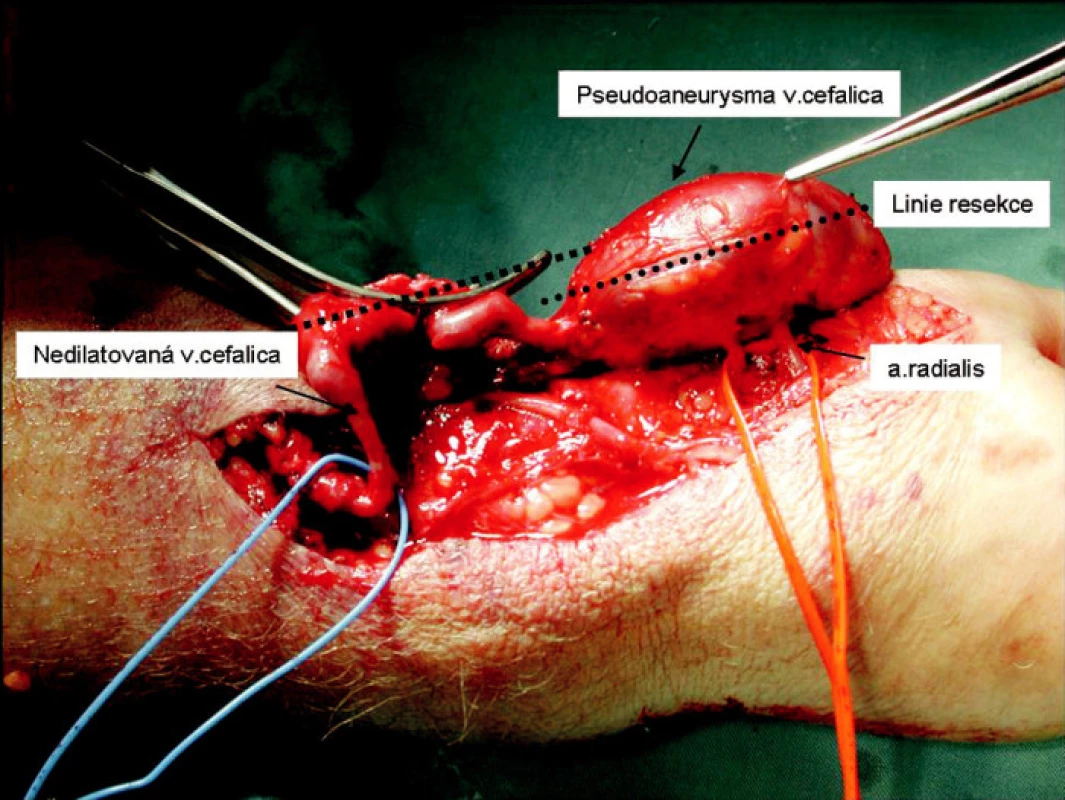
Obr. 7. Aneurysmorrhafia Fig. 7. Aneurysmorrhaphy 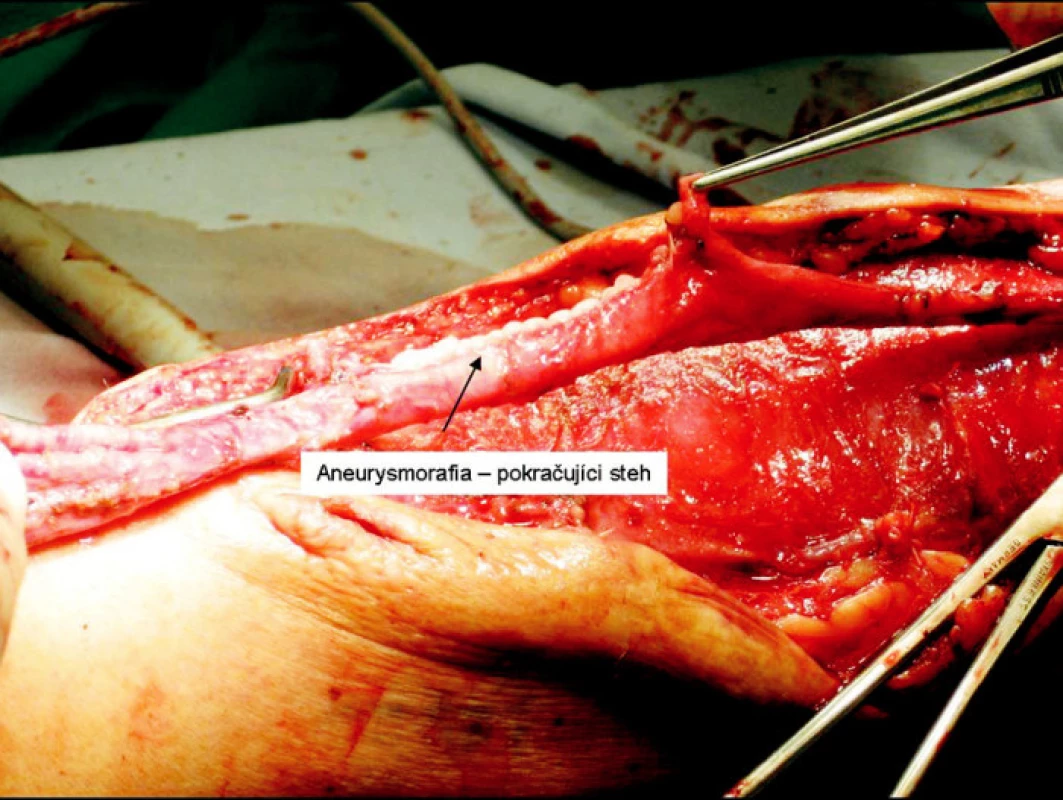
Obr. 8. Nová radiocefalická anastomóza Fig. 8. New radiocephalic anastomosis 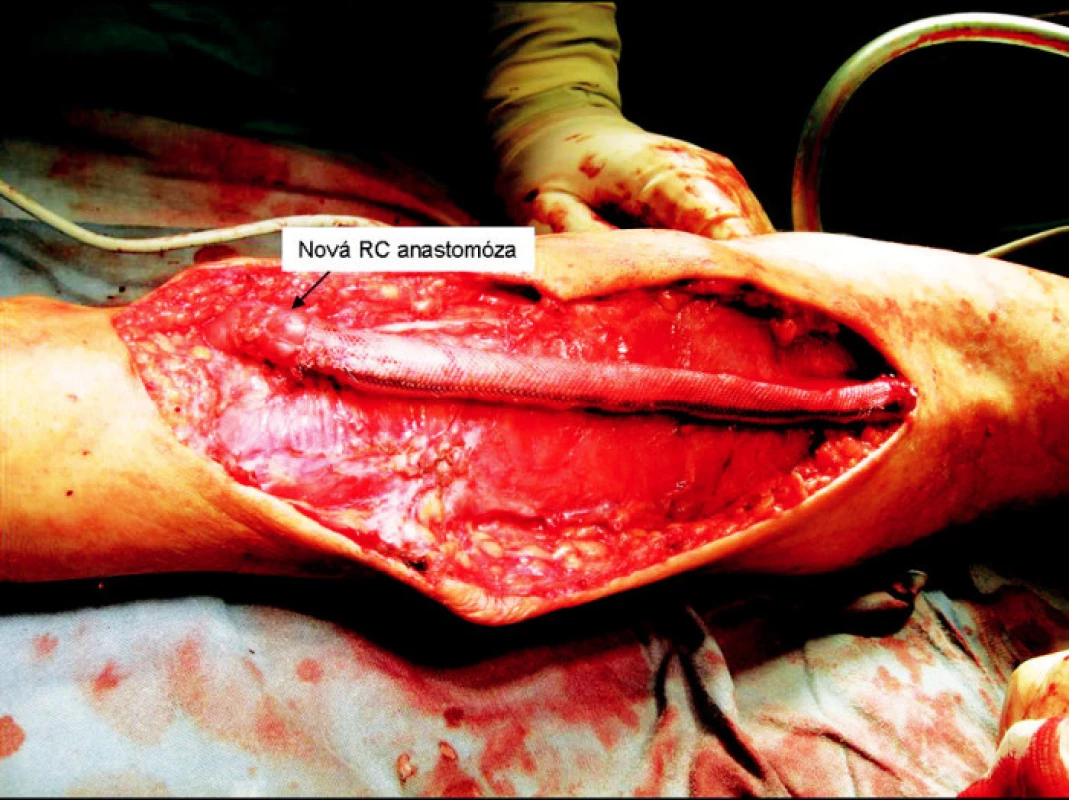
VÝSLEDKY
Včasný pooperační průběh byl bez komplikací u 8 z 9 pacientů. U jednoho pacienta nastalo druhý pooperační den krvácení z resekované časti aneuryzmatické píštěle s hematomem, které si vyžádalo chirurgickou revizi. Vzhledem k podezření na infekci byla odstraněna zevní protéza. Další průběh byl již bez komplikací.
Pozdní komplikací (po 3 měsících) byla u jednoho pacienta stenóza v odstupu transponované bazilické žíly v soutoku s brachiální žílou, způsobená zalomením v místě přechodu do podkoží. Byla indikovaná fistulografie s pokusem o angioplastiku, kde při dilataci řezacím balonkovým katétrem došlo k perforaci žilní stěny. Tato komplikace si vyžádala urgentní chirurgickou revizi s náhradou poškozené žilní stěny protetickým PTFE interpozitem (Obr. 9). U druhého pacienta po transpozici basilické žíly jsme pozorovali v průběhu 2 měsíců pare-stezie v oblasti mediální strany paže, způsobené poškozením větve nervus cutaneus brachii medialis, obtíže spontánně vymizely za 6 týdnů.
Obr. 9. PTFE protézou nahrazená část perforované basilické žíly Fig. 9. A PTFE prosthesis replacing a section of the perforated basilic vein 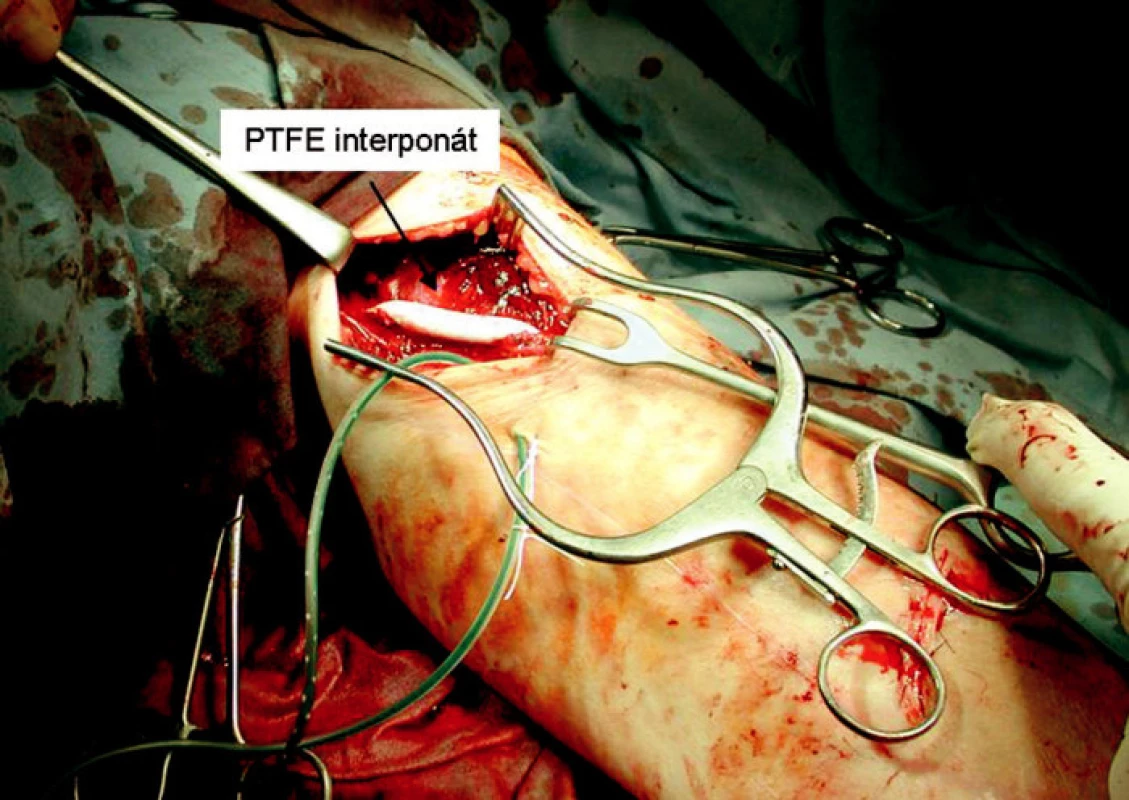
U všech operovaných pacientů byla zahájena hemo-dialyzační léčba vytvořenou AVF s zevní pórovanou PTFE protézou v období 4–6 týdnů od operace.
U žádného pacienta nebyly zaznamenány problémy s hemodialýzou.
DISKUSE
S implantací zevní pórované PTFE protézy při transpozici žil a aneurysmorhafií pro vytvoření arteriovenózního zkratu nejsou v literatuře dostupné žádné informace. Obecně se před transpozičními operacemi upřednostňují protetické arteriovenózní píštěle, pro menší náročnost operace a kratší operační čas.
Při řešení pseuaneuryzmatu se spíše indikuje zrušení zkratu s vytvoření nové píštěle.
Jedním z důvodů uzávěru cévních rekonstrukcí je vznik intimální hyperplazie. Žíla, která je chirurgicky přenesena do arteriálního řečiště, prochází strukturálními změnami vlivem nových hemodynamických poměrů [5]. Etiologie vzniku neointimy je komplexní a multifaktoriální proces jako odpověď na migraci hladko svalových buněk z medie do intimy v kombinací s fyzikálními, celulárními a humorálními faktory, které vedou k dysfunkci endoteliální regulace [6]. Hlavními faktory podílející se na vzniku neointimy jsou kvalita žilního štěpu (chlopně, větve, varikózní změny a abnormalita stěny), poškození žíly při preparaci (disekce, natažení, uchovávaní) a změny hemodynamických poměrů. Zvýšení tlaku krve v žíle vede k zvýšení longitudinálního a tangenciálního-pulzativního napětí a cirkulárním deformacím stěny [7]. Tyto hemodynamické změny mají přímý vliv na proliferaci hladko svalových buněk, jejich migraci do intimy a produkci endogenního růstového faktoru se syntézou endoluminálního matrix, což vede ke ztluštění žilní stěny a zúžení jejího lumen [8]. Minimalizace poškození žilní stěny během operace šetrnou operační technikou redukuje zánětlivou odpověď poškozeného endotelu. Avšak, výsledky se snížením míry vzniku intimální hyperplazie nejsou jednoznačné [9]. Taktéž antilipidová farmakologická léčba je neúspěšná v prevenci dlouhodobého uzávěru žilních štěpů [10]. Na druhé straně deriváty kyseliny acetylsalicylové zlepšují dlouhodobou průchodnost femoro-popliteálních bypasů [11]. Ovlivnění vzniku intimální hyperplazie použitím zevních protetických materiálů se vysvětluje redukcí tangenciálního rozpínání stěny štěpu, snížením turbulentního toku krve a tím snížení poškození endotelu a vzniku nástěnné trombózy [12, 13]. Prvním, který publikoval implantaci zevní protetické síťky na venu safenu byl Barra v roce 1986 u čtyřech pacientů s angiograficky potvrzenou průchodností rekonstrukce dva měsíce [12]. Deriu a kolektiv popsali použití zevní PTFE protézy u třiceti pacientů při cévní periferní rekonstrukci. Histologické post mortem nálezy ukázaly arterializovaný žilní štěp s minimální intimální hyperplazií [14]. Implantace polyesterové síťky na varikózně změněný žilní štěp v koronárních a infrainguinálních cévních rekonstrukcích ukázala dobrou krátkodobou průchodnost rekonstrukcí. Údaje o dlouhodobých výsledcích však chybí [15, 16, 17]. V práci Melliera byl popsán soubor šesti pacientů, kde u poloviny byla implantována PTFE síťka na varikózní úseky velké safény a u druhé poloviny byla implantována dakronová síťka na celý žilní štěp. V průměrném follow up tři roky nebyly zaznamenány žádné komplikace a všechny rekonstrukce byly průchodné [18].
V našem souboru jsme zevní pórovanou PTFE protézu použili u dvou rozdílných skupin pacientů. V první skupině jsme implantovali protézu při transpozici vena basilica k vytvoření brachiobasilické píštele a druhou skupinu tvořili pacienti s pseudoaneuryzmatem radiocefalické píštele, kdy bylo původně indikováno její zrušení a založení nové arteriovenózní spojky. Při transpozičních operacích u pacientů, kde se předpokládá dlouhodobé využívání píštěle a není indikovaná transplantace ledviny pro přítomnost vážných komorbidit, je potřebné vynaložit maximální úsilí o prodloužení průchodnosti vytvořené píštěle. Implantace zevní protézy při transpozici žil k vytvoření AVF má význam v prevenci vzniku pseudoaneuryzmatu a současně v prevenci vzniku intimální hyperplazie. Po aneurysmorrhafii je stěna po sutuře oslabená a poškozená. Tyto faktory tak dávají možnost vzniku nového pseudoaneuryzmatu a urychlují vznik intimální hyperplazie na poškozené části endotelu. V této indikaci je implantace zevní protézy opodstatněné. V budoucnosti nám další sledovaní pacientů přinese podrobné informace o dlouhodobé průchodnosti arteriovenózních píštělí s implantovanou zevní pórovanou PTFE protézou.
MUDr. P. Baláž, Ph. D.
Klinika transplantační chirurgie
IKEM
Vídeňská 1958/4
140 21 Praha 4
e-mail: peter.balaz@ikem.cz
Zdroje
1. Dagher, F., Gerber, R., Ramos, E., et al. The use of basilic vein and brachial Artery as an A-V fistula for long term hemodialysis. J. Surg. Res., 1976, 20, 373–376.
2. Kalmann, P. G., Pope, M., Bhola, C., et al. A practical approach to vascular Access for hemodialysis and predictors of success. J. Vasc. Surg., 199, 30, 727–733.
3. Jeremy, J. Y., Mehta, D., Bryan, A. J., et al. Platelets and saphenous vein graft failure following coronary bypase surgery. Platelets, 1997, 8, 295–309.
4. Vijayan, V., Smith, F., Angelini, R., et al. External support and the prevention of neointima formation in vein grafts. Eur. J. Vasc. Endovasular Surgery, 2002, 24, 13–22.
5. Zubilewicz, T., Wronski, J., Bourriez, A., et al. Injury in vascular surgery – the intimal hyperplastic response. Med. Sci. Monit., 2001, 7, 2, 316–324.
6. Davies, M., Hagen, P. Patofysiology of vein graft failure: a review. Eur. J. Vasc. Endovasc Surg., 1995, 9, 7–18.
7. Powell, J. T., Bowling. M. Molecular and cellular changes in vein grafts: influence of pulsatile stretch. Curr. Opin. Cardiol., 1998, 13, 453–458.
8. Sumpio, B., Banes, A. Response of porcine aortic smooth muscle cells to cyclic tensional deformation. J. Surg. Res., 1998, 44, 696–701.
9. Sayers, R., Watt, P., Muller, S., et al. Endothelial cell ijury secondary to surgical preparation of reserved and in situ saphenous vein bypass grafts. Eur. J. Vasc. Surg., 1992, 6, 354–361.
10. Campeau, L., Hunninghake, D., Knatterud, G., et al. Aggressive cholesterol lowering delays saphenous vein graft atherosclerosis in women, the elderly, and patients with associated risk factors. NHLBI post coronary artery bypass graft clinical trial. Post CABG trial investigators. Circulation, 1999, 99, 3241–3247.
11. Eikelboom, B. C. Efficacy of oral anticoagulants compared with aspirin after infrainguinal bypass surgery (The Dutch bypass oral anticoagulants or aspirin study): a randomised trial. Lancet, 2000, 355, 346–351.
12. Bara, J., Volant, A., Leroy, J., et al. Constrictive perivenous mesh prothesis for preservation of vein integrity . Experimental results and application for coronary bypass grafting. J. Thorac. Cardiovasc. Surg., 1986, 92, 330–336.
13. Meguro, T., Nakashima, H., Kawada, S., et al. Effect of external stenting and systemic hypertension on intimal hyperplasia in rat vein grafts. Neurosurgery, 2000, 46, 963–969.
14. Deriu, G., Ballotta, E., Bonavina, L., et al. Great saphenous vein protection in arterial reconstructive surgery. Eur. J. Vasc. Surg., 1989, 3, 253–260.
15. Moritz, A., Raderer, F., Magometschingg, H., et al. The use of mesh-tube-constricted dilated or varicose veins as arterial bypass conduit. Thorac. Cardiovasc. Surg., 1992, 40, 356–360.
16. Moritz, A., Grabenwoger, F., Raderer, F., et al. Use of varicose veins as arterial bypass graft. Cardiovasc. Surg., 1993, 1, 508–512.
17. Moritz, A., Grabenwoger, F., Raderer, F., et al. Mesh tube-constricted varicose veins used as bypass grafts for infrainguinal arterial reconstruction. Arch. Surg., 1992, 127, 416–420.
18. Melliere, D., LeChevillier, B., Kovarsky, S. Wrapped autologus greater saphenous vein bypass for severe limb ischemia in patients with varicose veins. J. Cardiovasc. Surg., 1995, 36, 117–120.
Štítky
Anestéziológia a resuscitácia Detská chirurgia Detská urológia Chirurgia cievna Chirurgia hrudná Chirurgia maxilofaciálna Chirurgia plastická Chirurgia všeobecná Intenzívna medicína Kardiochirurgia Kardiológia Neurochirurgia Onkológia Ortopédia Popáleninová medicína Protetika Rehabilitácia Sestra Traumatológia Urgentná medicína Urológia Student medicíny
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2007 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
-
Všetky články tohto čísla
- Miniinvazivní videoasistovaná paratyroidektomie – naše první zkušenosti
- Role PET a CT vyšetření v managementu léčby zhoubného onemocnění tlustého střeva a konečníku – review
- Iniciálne skúsenosti terénneho chirurgického pracoviskas miniinvazívnou kolorektálnou chirurgiou
- Obturačný ileus spôsobený črevnou duplikatúrou
- První zkušenosti s využitím zevní pórované PTFE protézy v chirurgii arteriovenózních zkratů
- Symptomatický Meckelov divertikul u detí
- Vaskularizace laterální strany paty ve vztahu k extenzivnímu kožnímu řezu k osteosyntéze zlomeniny kalkanea
- Nepřímý antirefluxní výkon u gastroezofageální refluxní nemoci
- Perkutánní radiofrekvenční ablace renálních tumorů. První klinické zkušenosti miniinvazivní terapie
- Metoda aproximační střevní anastomózy v experimentálním modelu
- Recenze
- Životní jubileum
- Životní jubileum Doc. MUDr. Miroslav Janík, CSc., – sedemdesiatnik
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Životní jubileum Doc. MUDr. Miroslav Janík, CSc., – sedemdesiatnik
- Nepřímý antirefluxní výkon u gastroezofageální refluxní nemoci
- Symptomatický Meckelov divertikul u detí
- Obturačný ileus spôsobený črevnou duplikatúrou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



