-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Perkutánní radiofrekvenční ablace renálních tumorů. První klinické zkušenosti miniinvazivní terapie
Percutaneous Radiofrequency Ablation of the Renal Tumors. Initial Clinical Experience with Minimally Invasive Therapy
Aim of the article:
To evaluate first clinical and interventional radiological features and experience with computed tomography-guided percutaneous radiofrequency ablation of the renal tumors using StarBurst instruments (RITA Medical System, Inc., Mountain View, CA).Methods:
The group of 8 patients with mean age 77.75 ± 4.38 years underwent during a period of 12 months CT-guided RFA treatments for enhancing renal masses, with a mean size 21.78 ± 9.81 mm, using only conscious sedation and local anaesthesia. All patients had multiple medical comorbidities that limited or completely contraindicated surgical treatment. In two cases tumors involved solitary kidney. Patients were hospitalized in urologic department of University hospital, where possible early complications were monitored. Patients were followed with clinical status and renal function studies. Also enhanced imaging (enhanced computed tomography or magnetic resonance in one case) were performed 1 month, 3, 6 and 12 months after initial procedure. Successful ablation was defined as a lack of enhancement of the renal mass eventually with a scar-like retraction of surrounding renal parenchyma.Results:
During a 12-months period (from February 2006 to February 2007) 10 percutaneous CT-guided RFA treatments in 8 patients were performed. In 6 patients (75%) were single treatment successful, 1 had an initial failure and underwent reablation successfully and 1 underwent second treatment for coexisting small tumor in the same kidney. All patients stayed in hospital for a 3 days, none from this group died during this period and none need not to be excluded from this study. We did not reveal any early complication. Average length of the following-up was 5.75 months.Conclusions:
CT-guided percutaneous radiofrequency ablation is a promising therapeutic alternative of surgical methods (nephrectomies or nephron-sparing surgical devices) especially with small renal tumors in patients with multiple medical comorbidities, tumors in solitary kidneys and in rarer indications. The procedure were well tolerated using only conscious sedation and local anaesthesia. None early complication was observed. Other useful informations will be probably captured by following-up this group and by monitoring new patients.Key words:
percutaneous radiofrequency ablation – renal tumors – minimally invasive therapy.
Autoři: P. Hoffmann 1; P. Dvořák 1
; P. Morávek 2; H. Šafránek 2
Působiště autorů: Radiologická klinika LF UK a Fakultní nemocnice v Hradci Králové, přednosta: prof. MUDr. P. Eliáš, CSc. 1; Urologická klinika LF UK a Fakultní nemocnice v Hradci Králové, přednosta: doc. MUDr. P. Morávek, CSc. 2
Vyšlo v časopise: Rozhl. Chir., 2007, roč. 86, č. 9, s. 494-499.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cíl práce:
Zhodnotit první klinické a intervenčně radiologické aspekty a zkušenosti s perkutánní radiofrekvenční ablací renálních tumorů, prováděných pod CT (někdy v kombinaci s ultrasonografickou) kontrolou pomocí StarBurst instrumentária (RITA Medical System, Inc., Mountain View, CA).Materiál a metodika:
Prospektivně byla sledována skupina 8 pacientů, u nichž byla provedena perkutánní radiofrekvenční ablace renálních tumorů pod CT kontrolou. V této skupině pacientů s průměrným věkem 77,75 ± 4,38 let bylo provedeno 10 RFA výkonů v analgosedaci a lokální anestezii pro renální solidní nádorové masy průměrné velikosti 21,78 ± 9,81 mm. Všichni pacienti měli četné komorbidity, limitující až kontraindikující operační terapii. Ve dvou případech se navíc jednalo o nádor solitární ledviny. Po výkonu byli hospitalizováni na standardním oddělení urologické kliniky, byla sledována délka jejich hospitalizace a eventuální časné komplikace. Následná dispenzarizace probíhala v příslušných časových odstupech s klinickým vyšetřením a laboratorní kontrolou renálních funkcí. Zobrazovací metody (CT s bolusem kontrastní látky i.v. nebo v jednom případě magnetická rezonance s podáním kontrastní látky i.v.) byly prováděny 1, 3, 6 a 12 měsíců od úvodního výkonu. Za úspěšnou byla považována ablace s absencí opacifikace po podání bolusu kontrastní látky i.v. s eventuální retrakcí okolní tkáně charakteru jizvy.Výsledky:
Za období 12 měsíců, únor 2006 až únor 2007, bylo ve Fakultní nemocnici v Hradci Králové provedeno 10 perkutánních radiofrekvenčních ablací renálních tumorů pod CT kontrolou. V 6 případech (75 %) byla úspěšná již první ablace, 2 pacienti prodělali ještě druhou RFA proceduru (reRFA). U jedné pacientky pro koincidenci drobného stejnostranného renálního tumoru a u další pacientky pro rozšíření ablace pro reziduální patologicky se opacifikující nádorovou tkáň. Všichni nemocní byli hospitalizováni 3 dny. Nedošlo k žádnému úmrtí, žádný z pacientů nemusel být ze sledovaného souboru vyřazen. Průměrná délka sledování v rámci follow-up byla 5,75 měsíců. Nezaznamenali jsme žádnou časnou komplikaci výkonu.Závěr:
Perkutánní radiofrekvenční ablace prováděná pod CT kontrolou je slibnou alternativou chirurgického řešení malých renálních tumorů především u značně komorbidních nemocných, u pacientů s nádory solitární ledviny a dalších vzácnějších indikovaných případech. Metoda je dobře tolerována v analgosedaci a lokální anestezii. Nebyly zaznamenány žádné časné komplikace výkonů. Další potřebné údaje jistě přinese pokračování ve sledování této skupiny a její postupné rozšiřování o nové pacienty.Klíčová slova:
perkutánní radiofrekvenční ablace – renální tumory – miniinvazivní terapieÚVOD
Incidence Grawitzova karcinomu (v anglickém jazyce a literatuře označovaném jako renal cell carcinoma, RCC) a ostatních renálních malignit u dospělých má vzestupnou tendenci, ročně je v USA nově diagnostikováno okolo 30 000 až 35 000 nových případů [1]. Značná část těchto nových záchytů je incidentálních, v rámci pátrání po jiných chorobách, jako vedlejší nález stále častěji indikovaných zobrazovacích vyšetření [1, 2]. Většina pacientů, jimž je tento nádor v dnešní době diagnostikován, má vysoký věk a mnoho přidružených onemocnění, které často kontraindikují radikální resekční výkon (totální či parciální nefrektomie). Další skupinou jsou nemocní s tumorózním postižením solitární ledviny, u nichž je snaha o zachování přirozených renálních funkcí. Jak jsme již zmínili, stále častěji se setkáváme s nálezy incidentálními. Velikost takto zachycených nádorů je ve srovnání s nádory klinicky se projevujícími signifikantně menší, což je výhodný předpoklad pro léčbu pomocí minimálně invazivních technik [3].
Perkutánní tkáňové destrukční metody procházejí v posledních letech značných rozvojem. Radiofrekvenční ablace (RFA), jako u nás jednoznačně nejrozšířenější tkáňová destrukční technika, prováděná pod kontrolou zobrazovacích metod, je ve světě na mnoha pracovištích již téměř rutinně prováděnou léčebnou alternativou [3–6]. V naší republice dosud není publikován žádný soubor takto ošetřených pacientů, a proto cílem této práce je seznámit odbornou veřejnost s iniciálními klinickými a intervenčně radiologickými aspekty této miniinvazivní techniky.
MATERIÁL A POUŽITÁ METODIKA
Během 12 měsíců (únor 2006 až únor 2007) byla prospektivně byla sledována skupina 8 pacientů (4 muži a 4 ženy, průměrného věku 77,75±4,38 let), u nichž byla provedena perkutánní radiofrekvenční ablace malých renálních tumorů průměrné velikosti 21,78±9,81 mm. Tyto intervenční výkony byly prováděny pod CT a doplňkově též ultrasonografickou kontrolou. Byl kladen důraz na indikace k provedení výkonu, přípravu nemocného, technické aspekty provedení samotného výkonu, možné komplikace a prevenci jejich vzniku a sledování úspěšnosti výkonu. Průměrná doba sledování pacientů byla 5,75 ±3,45 měsíců.
Indikacemi byly renální tumory malých rozměrů u pacientů se solitární ledvinou (2 pacienti, tj. 25 %) a u pacientů s vícečetnými komorbiditami, které nemocné prakticky diskvalifikovaly z radikálního chirugického zákroku (6 pacientů, tj. 75 %) pro výrazně rizikovou celkovou anestezii. Z hlediska uložení se jednalo o expanze exofytické nebo intraparenchymové. Nádory lokalizované v centrálním sinu ledviny jsou pro vysoké riziko komplikací kontraindikovány k tomuto zákroku (Obr. 1).
Obr. 1. Schematické zobrazení vhodné lokalizace tumorů k perkutánní RFA Fig. 1. Ascheme of tumor location suitable for percutaneous RFA 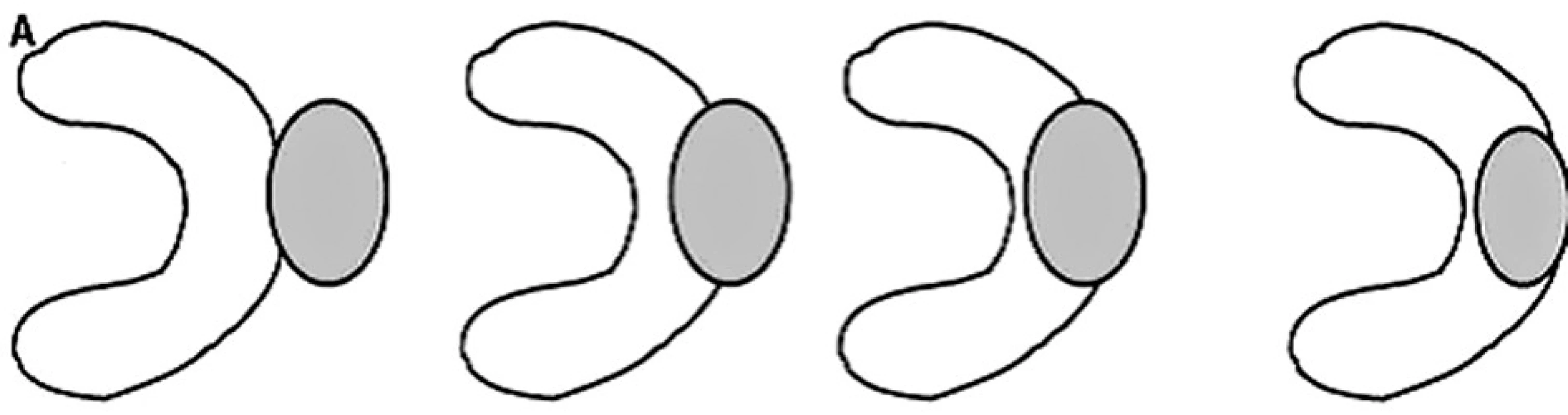
Diagnóza byla stanovena u všech těchto nemocných na základě CT vyšetření břicha s podáním bolusu kontrastní látky i.v., v jednom případě na základě vyšetření magnetickou rezonancí s podáním kontrastní látky i.v., s typickou nehomogenní hypervaskularizací ložiskové expanze. Nebylo přistoupeno k bioptickému ověření diagnózy.
Výkony byly prováděny pomocí StarBurst instrumentária (RITA Medical System, Inc., Mountain View, CA), použity byly instrumenty StarBurst SDE, StarBurst XL a Star - Burst SemiFlex, délky 10, 15 a 25 cm, s expandibilními elektrodami délky 3–7 cm. Tyto instrumenty byly v průběhu výkonu připojeny k RF generátoru RITA 1500X (RITA Medical System, Inc., Mountain View, CA, www.ritamedical.com). Pozice RFA sondy byly kontrolovány a též k následnému sledování pacientů v rámci follow-up byl užit výpočetní tomograf Siemens Somatom Plus 4 (Siemens Medical Solutions, Inc. Mountain View, CA 94043 USA), doplňkově též byl k výkonu použit ultrasonografický přístroj Siemens Sonoline Siena.
Tab. 1. Věk, doba hospitalizace, velikost tumoru a délka sledování v rámci follow-up ve sledované skupině pacientů po perkutánní radiofrekvenční ablaci Tab. 1. Age, duration of hospitalization, tumor size and follow up duration in a group of subjects following percutaneous radiofrequency ablation 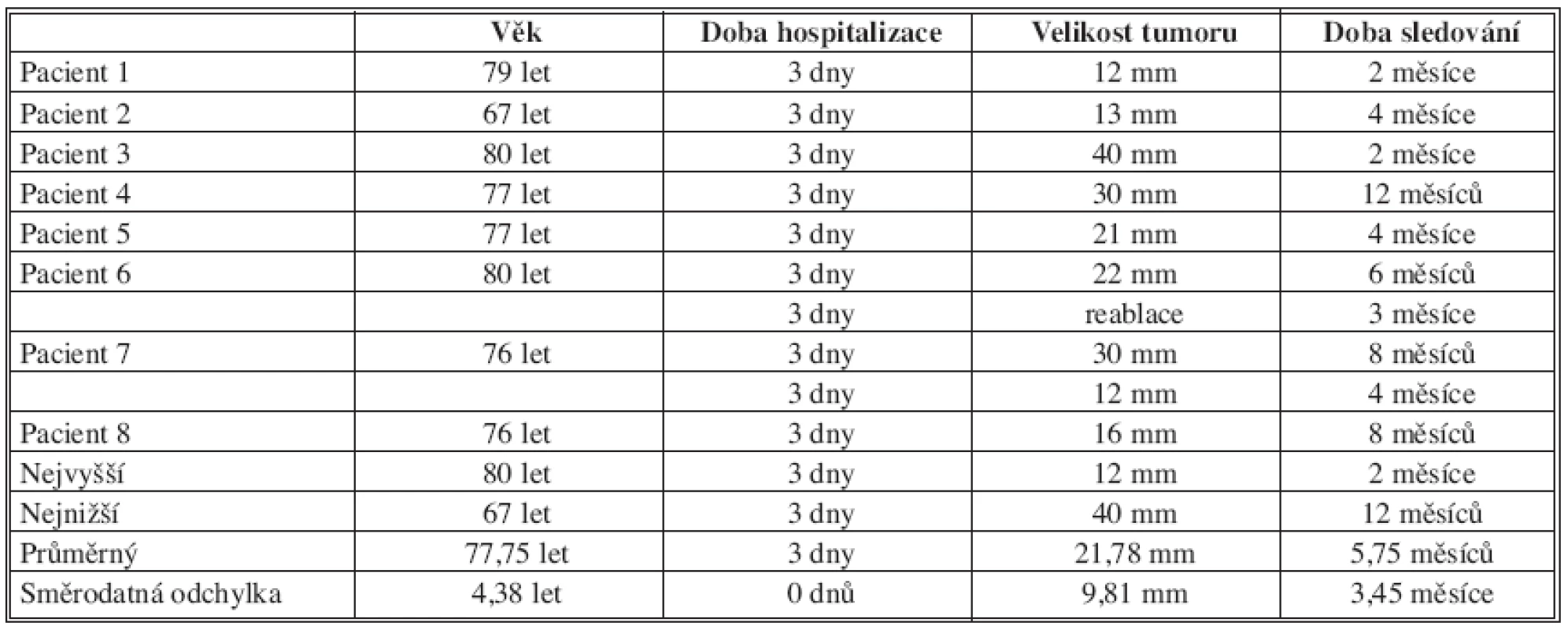
Výkony byly prováděny v analgosedaci a lokální anestezii 1% mezokainem. Před započetím procedury byly sledovány parametry krvácivosti a to hodnoty INR (nižší než 1,3) a APTT (nižší než 1,15). Pacient byl vždy pod trvalou kontrolou lékaře KARIM (Klinika anesteziologie, resuscitace a intenzivní medicíny) naší nemocnice. Jím byly monitorovány vitální funkce jednotlivých pacientů. Po dokončení procedury byla provedena pokaždé série kontrolních nativních CT řezů k vyloučení časných komplikací.
VÝSLEDKY
Během výše uvedeného období jsme na našem pracovišti ve fakultní nemocnici v Hradci Králové provedli 10 perkutánních radiofrekvenčních ablací pro malé renální tumory u 8 pacientů pod kontrolou zobrazovacích metod. Doba trvání celé procedury výkonu nepřekročila včetně všech nezbytných příprav 60 minut, přičemž na dobu analgosedace pacienta nepřipadlo nikdy více než 10 minut z celého časového rozsahu výkonu. Každý výkon byl zakončen tzv. track ablation. Tedy radiofrekvenční ablací punkčního kanálu StarBurst jehly, čímž se zamezuje eventuálnímu rozšíření a zanesení nádorových buněk do retroperitonea či měkkých tkání podkoží. Každý z pacientů byl hospitalizován na urologickém standardním oddělení po dobu necelých 3 dnů.
U 6 pacientů (75 %) byla ablace úspěšná již při prvním sezení (příklad 1.). Jeden pacient prodělal s odstupem 3 měsíců druhý RFA výkon na stejné ledvině pro duplicitní menší expanzi. Tento výkon byl též úspěšný. K inkompletní ablaci během iniciálního výkonu tedy došlo u jednoho nemocného, který podstoupil opět v odstupu 3 měsíců druhý výkon (reRFA) pro zbytkovou patologicky se opacifikující zbytkovou nádorovou tkáň a při následném vyšetření v rámci pokračující follow-up nebyla prokázána recidiva (příklad 2.).
Příklad 1. 77letá pacientka s 22 mm velkým renálním tumorem Case 1. 77-year old female patient with a renal tumor of 22 mm A – CT obraz vaskularizovaného tumoru pravé ledviny (CT s podáním bolusu kontrastní látky i.v.). B, C a D – Zavedení StarBurst jehly pod kontrolou CT do nádorového ložiska (B) a kontrolní skeny po výkonu, které neprokazují časné komplikace jako krvácení (C) nebo pneumotorax (D). Pacientka v poloze na břiše. E a F – Kontrolní CT vyšetření s podáním kontrastní látky i.v. s odstupem jednoho (E) a tří (F) měsíců od výkonu. CT vyšetření prokazuje kompletní výpad opacifikace a postupnou retrakci okolního parenchymu. A – A CT view of a vascularized tumor of the right kidney (CT with intravenous administration of the contrast matter bolus). B, C and D – Introduction of the StarBurst needle into the tumor tissue under a CT control (B) and control scans following the procedure, with negative findings of early complications, including bleeding (C) or pneumothorax (D). The patient is in a prone position. E and F – A control CT scan with intravenous administration of the contrast, one (E) and three (F) months after the procedure. The CT examination confirmed complete loss of opacity and gradual retraction of the surrounding parenchyma. 
Příklad 2. 80letá pacientka s 25 mm velkým renálním tumorem v méně vhodné lokalizaci. Case 2. 80-year old female patient with an extensive renal tumor of 25 mm in a less favourable localization A – CT obraz vaskularizovaného tumoru pravé ledviny (CT s podáním bolusu kontrastní látky i.v.). B – Zavedení Starburst instrumentu hepatorenálním prostorem do oblasti tumoru. Pacientka v poloze na břiše. C – Kontrolní CT vyšetření (s bolusem kontrastní látky i.v.) s odstupem jednoho měsíce prokazuje 18 mm patologicky se opacifikující tkáně a tedy inkompletní ablaci. D – Je přikročeno k druhému výkonu (reRFA). Je zvolena vertikální přístupová cesta. Na snímku D je patrno zavedení jehly, pacientka opět v poloze na břiše. E – Kontrolní CT vyšetření s odstupem jednoho měsíce po druhém výkonu (CT s podáním bolusu kontrastní látky i.v.) je viditelný klínovitý výpadek opacifikace bez přítomnosti reziduální patologické nádorové tkáně. S drobnou ablací tkáně hepatorenálního prostoru. Jedná se tedy o úspěšný výkon provedený ve dvou sezeních. A – A CT view of a vascularized tumor of the right kidney (CT with intravenous administration of the contrast bolus). B – Introduction of the StarBurst instrumentation into the tumor region through the hepatorenal space. The patient is in a prone position.C – Control CT examination (CT with intravenous administration of the contrast bolus) one month later detected tissue of 18 mm with pathological opacities, suggesting incomplete ablation. D – Reoperation (reRFA). Vertical approach is chosen. Fig D shows introduction of a needle, the patient is in a prone position. E – A control CT view, one month after the reoperation (CT with intravenous administration of the contrast bolus). A wedge- shaped loss of opacity with absence of residual pathological tumorous tissue is detectable. Minor ablation of the hepatorenal space tissue. The procedure, performed in two sessions was, therefore, successful. 
V našem souboru pacientů během sledovaného období nedošlo k časným komplikacím výkonu (jako jsou krvácení do retroperitonea, do vývodného systému a hematurie či vznik subkapsulárního hematomu, pneumotorax, perforace přilehlých částí GIT, poškození pouzdra okolních parenchymatozních orgánů zvláště jater či popáleniny kožního povrchu). Žádný z intervenčních výkonů nevyžadoval následnou operační revizi. Všichni pacienti byli propuštěni do domácího ošetřování v dobrém stavu během třetího dne hospitalizace. Nebyly pozorovány do této doby žádné pozdější komplikace (jako jsou abscesy, seromy v ráně či jiné ranné komplikace, urinom, striktury vývodných systémů ledvin, retroperitoneální rozsev či nové objevení se vzdálených metastatických ložisek). Nikdo ze sledovaného souboru nemusel být z této skupiny vyřazen, nikdo v daném časovém úseku nezemřel.
Následná dispenzarizace probíhala v příslušných časových odstupech s laboratorní kontrolou renálních funkcí a zobrazovacími metodami (CT s bolusem kontrastní látky i.v. nebo v jednom případě magnetická rezonance s podáním kontrastní látky i.v.), které byly prováděny v odstupu 1, 3, 6 a 12 měsíců od úvodního výkonu. Za úspěšnou byla považována ablace s absencí opacifikace po podání bolusu kontrastní látky i.v. s eventuální retrakcí okolní tkáně charakteru jizvy.
DISKUSE
Standardní radikální metodou léčby Grawitzova karcinomu ledviny a ostatních renálních malignit je totální či parciální nefrektomie. V posledních letech se dostávají do popředí zájmu ty radikální přístupy, které se snaží co nejvíce zachovávat přirozené pacientovy renální funkce. Radikální chirurgická léčba však u mnoha nemocných není ideálním postupem, především pro jejich přidružené komorbidity, kontraindikující operační zákrok, u tumorů solitární ledviny a při některých vzácnějších případech [7]. Dochází k hledání alternativních technik, které by garantovaly zničení nádoru při zachování fyziologických funkcí [4, 5, 7]. Mezi tyto tzv. tkáňové destrukční metody patří několik modalit jako perkutánní alkoholizace, kryodestrukce (kryoablace), mikrovlnná či laserová ablace, fokusovaný ultrazvukový vysokointenzitní svazek (HIFU, High Intensity Focused Ultrasound) či chemoembolizace [8–13]. Tyto techniky však nenašly v praxi širší uplatnění. Jednoznačně nejrozšířenější a nejpoužívanější destrukční metodou je radiofrekvenční ablace (RFA) [3–7].
Radiofrekvenční ablace využívá elektrického napětí mezi jednotlivými elektrodami zavedenými do patologického ložiska, kde vytváří termickou koagulační nekrózu. Jehla s elektrodami je zavedena do nádorové expanze cíleně, nejlépe pod přímou kontrolou zobrazovací modality, jednoznačně nejčastěji CT (výpočetní tomografie). Kontrola CT je nejužívanější podle odborné literatury po celém světě, stejně tak i na našem pracovišti. Mnohem méně častěji můžeme využít kontrolu ultrasonografickou nebo cílení magnetickou rezonancí, kde je třeba používat speciální instrumentarium [8, 9].
Z hlediska lokalizace nejsou vhodné k radiofrekvenční ablaci nádory uložené v renálním hilu, hlavně pro vysoké riziko vzniku krvácení. Vhodné jsou tedy tumory extrarenálně se vyklenující či intraparenchymové. Pokud je nádorové ložisko v blízkosti jiné abdominální struktury (játra, duodenum či jiná část gastrointestinálního traktu, svaly či nervové svazky) a hrozí-li její poškození, můžeme tuto strukturu separovat instilací vhodného média do preformovaného prostoru (tzv. hydrodissection) [14]. Lze použít fyziologický roztok, 5% roztok dextrózy nebo jsou publikovány práce s použitím CO2 (oxidem uhličitým) či umístěním balonkového katétru [15–17]. Jako bezpečná se dnes považuje vzdálenost tumoru 5–10 mm od nejbližší abdominální struktury [7, 17].
Úspěšnost RFA procedury je relativně značně závislá na velikosti nádorového ložiska. Prakticky všechny dosažitelné literární zdroje udávají téměř 100% úspěšnost výkonu u expanzí menších než 30 mm v největším rozměru [3–7]. Přítomnost reziduální tumorózní tkáně v rámci follow-up u expanzí velikosti 30–50 mm je udávána v rozmezí 31–44 % případů [3, 7]. Jedná se však téměř vždy o drobná rezidua tkáně, která si vyžádají druhé sezení, při kterém intervenční radiolog poměrně snadno provede již kompletní ablaci. Nádory větší než 50 mm (v některých zdrojích nad 35 mm nebo až nad 60 mm) jsou indikovány, samozřejmě při nemožnosti chirurgické intervence, ke kombinovanému RFA výkonu, kterému předchází selektivní chemoembolizace [3, 18, 19]. Ostatní nádorové charakteristiky, jako histologická povaha či míra vaskularizace expanze i obklopujících tkání, podle několika studií nemá na úspěšnost procedury signifikantní vliv [7, 20, 21].
Jasnou výhodou radiofrekvenční ablace je nízká incidence komplikací. Pokud se tato vyvine v úvodních 24 hodinách po výkonu, jde o časnou komplikaci. Sem patří na prvním místě krvácení. Hemoragie může být retroperitoneální, intraparenchymová, subkapsulární nebo do vývodného systému, která má za následek hematurii. Častěji k hemoragiím dochází při RFA centrálně uložených expanzí. Dalšími a méně častými časnými komplikacemi jsou ranné defekty vč. popálenin kožního povrchu a podkoží, urinomy a přechodné bolesti v průběhu lumbálních nervových plexů. Jejich výskyt se pohybuje podle různých zdrojů v rozmezí 7–17 % [3, 7]. V naprosté většině případů postačí symptomatická léčba [3].
Pokud jsou komplikace objeveny v průběhu následných klinických, laboratorních či zobrazovacích kontrol, jde o komplikace pozdní. Sem patří inkompletní ablace, která je definována jako perzistence patologicky se opacifikující tkáně v místě původní expanze a objevení se nových metastatických ložisek Jak již bylo uvedeno výše, pravděpodobnost neúplné nekrotizace nádoru stoupá s velikostí primárního tumoru. Pozdní ranné či hemoragické komplikace jsou velmi vzácné.
Otázka follow-up pacientů po radiofrekvenční ablaci zůstává stále otevřená, většina autorů však používá stejné sledovací schéma jako my, tedy kontrolní zobrazovací vyšetření s podáním kontrastní látky intravenózně (CT nebo MR) v odstupu 1, 3, 6 a 12 měsíců od první procedury. Další odstup vyšetření je dle různých zdrojů 6 nebo až 12 měsíců.
ZÁVĚR
Perkutánní radiofrekvenční ablace renálních tumorů je slibnou dynamicky se rozvíjející intervenčně radiologickou metodou, tvořící alternativu radikálních chirurgických přístupů u pacientů s mnohočetnými komorbiditami, které je prakticky diskvalifikují z elektivního operačního zákroku, u nádorů solitární ledviny a u některých vzácnějších indikací. Metoda je pacienty velmi dobře tolerována, je prováděna pouze v analgosedaci a lokální anestezii. Není zatížena vysokým počtem komplikací, lze ji opakovat poměrně snadno opět za krátkodobé hospitalizace a při úspěšném zvládnutí zachovává nemocným stávající kvalitu života, která by při radikálním výkonu a zařazení do dialyzačního programu byla jistě významně snížená. Další potřebné údaje jistě přinese pokračování ve sledování této skupiny a její postupné rozšiřování o nové pacienty.
MUDr. P. Hoffmann
RDG klinika
Sokolská 581
500 05 Hradec Králové
Zdroje
1 American Cancer Society. Cancer Facts and Figures 2006. Atlanta, Ga: American Cancer Society, 2006.
2. Homma, Y., Kawabe, K., Kitamura, T., et al. Increased incidental detection and reduced mortality in renal cancer: recent retro-spective analysis at eight institutions. Int. J. Urol., 1995; 2 : 77–80.
3. Gervais, D. A., MacGovern, F. J., Arellano, R. S., McDougall, W. S., Mueller, P. R. Radiofrequency Ablation of Renal Cell Carcinoma: Part 1, Indications, Results, and Role in Patient Management over a 6-Year Period and Ablation of 100 Tumors. AJR, July, 2005; 185 : 64–71.
4. Farrell, M. A., Charboneau, W. J., DiMarco, D. S. Imaging-guided radiofrequency ablation of solid renal tumors. AJR, 2003; 180 : 1509–1513.
5. Roy-Choudhury, S. H., Cast, J. E. I., Cooksey, G., Puri, S., Breen, D. J. Early experience with percutaneous radiofrequency ablation of small solid renal masses. AJR, 2003; 180 : 1055–1061.
6. Mayo-Smith, W. W., Dupuy, D. E., Parikh, P. M., Pezzullo, J. A., Cronan, J. J. Imaging-guided percutaneous radiofrequency ablation of solid renal masses: technique and outcomes of 38 treatment sessions in 32 consecutive patients. AJR, 2003; 180 : 1503–1508.
7. Zagoria, R. J., Hawkins, A. D., Clark, P. E., Hall, M. C., et al. Percutaneous CT-guided radiofrequency ablation of Renal neoplasms: Factors influencing Success. AJR, 2004; 183 : 201–207.
8. Sewell, P. E., Howard, J. C., Shingleton, W. B., Harrison, R. B. Interventional magnetic resonance image-guided percutaneous cryoablation of renal tumors. South Med. J., 2003; 96 : 708–710.
9. Shingleton, W. B., Sewell, P. E. Jr. Percutaneous renal tumor cryoablation with magnetic resonance imaging guidance. J. Urol., 2001; 165 : 773–776.
10. Permpongkosol, S., Link, R. E., Kavoussi, L. R., Solomon, S. B. Percutaneous computerized tomography guided cryoablation for localized renal cell carcinoma: factors influencing success. J. Urol., 2006 Nov; 176(5): 1907–1908.
11. Aron, M., Gill, I. S.. Minimally Invasive Nephron-Sparing Surgery (MINSS) for Renal Tumours Part II: Probe Ablative Therapy. Eur. Urol., 2007 Feb; 51(2): 348–357.
12. Koehrmann, K. U., Michel, M. S., Fruhauf, J., Volz, J., Back, W., Gaa, J., et al. High-intensity focused ultrasound for non-invasive tissue ablation in the kidney, prostate and uterus. J. Urol., 2000; 163 (4 Suppl.): 156.
13. Diederich, C. J. Thermal ablation and high-temperature thermal therapy: overview of technology and clinical implementation. Int. J. Hyperthermia, 2005 Dec; 21(8): 745–753.
14. Lee, S. J., Choyke, L. T., Locklin, J. K., Wood, B. J. Use of hydrodissection to prevent nerve and muscular damage during radiofrequency ablation of kidney tumors. J. Vasc. Interv. Radiol., 2006 Dec; 17(12): 1967–1969.
15. Farrell, M. A., Charboneau, J. W., Callstrom, M. R., et al. Paranephric water instillation: A technique to prevent bowel injury during percutaneous renal radiofrequency ablation. Am. J. Roentgenol., 181 : 1315–1317, 2003.
16. Kariya, S., Tanigawa, N., Kojima, H., Komemushi, A., et al. Radiofrequency Ablation Combined with CO2 Injection for Treatment of Retroperitoneal Tumor: Protecting Surrounding Organs Against Thermal Injury. AJR, 2005; 185 : 890–893.
17. Liddell, R. P., Salomon, S. B. Thermal Protection During Radiofrequency Ablation. AJR, 2004; 182 : 1459–1461.
18. Hall, W. H., McGahan, J. P., Link, D. P., deVere White, R. W. Combined embolization and percutaneous radiofrequency ablation of a solid renal tumor. AJR, 2000; 174 : 1592–1594.
19. Yamakado, K., Nakatsuka, A., Kobayashi, S., Akeboshi, M. et al. Radiofrequency Ablation Combined with Renal Arterial Embolization for the Treatment of Unresectable Renal Cell Carcinoma Larger Than 3.5 cm: Initial Experience. J. Card. Vasc. and Int. Rad., 2006 Jun: 389–394.
20. Ponticelli, C., Mihatsch, M. J., Imbasciati. E. Renal biopsy: performance and interpretation. In: Davison, A. M., Cameron, J. S., Grunfeld, J. P., et al., eds. Oxford textbook of clinical Nephrology. 2nd ed. Oxford, England: Oxford University Press, 1998 : 157–171.
21. Maturen, K. E., Nghiem, H. V., Caoili, E. M., Higgins, E. G., et al. Renal Mass Core Biopsy: Accuracy and Impact on Clinical Management. AJR, 2007; 188 : 563–570.
Štítky
Anestéziológia a resuscitácia Detská chirurgia Detská urológia Chirurgia cievna Chirurgia hrudná Chirurgia maxilofaciálna Chirurgia plastická Chirurgia všeobecná Intenzívna medicína Kardiochirurgia Kardiológia Neurochirurgia Onkológia Ortopédia Popáleninová medicína Protetika Rehabilitácia Sestra Traumatológia Urgentná medicína Urológia Student medicíny
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2007 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
-
Všetky články tohto čísla
- Miniinvazivní videoasistovaná paratyroidektomie – naše první zkušenosti
- Role PET a CT vyšetření v managementu léčby zhoubného onemocnění tlustého střeva a konečníku – review
- Iniciálne skúsenosti terénneho chirurgického pracoviskas miniinvazívnou kolorektálnou chirurgiou
- Obturačný ileus spôsobený črevnou duplikatúrou
- První zkušenosti s využitím zevní pórované PTFE protézy v chirurgii arteriovenózních zkratů
- Symptomatický Meckelov divertikul u detí
- Vaskularizace laterální strany paty ve vztahu k extenzivnímu kožnímu řezu k osteosyntéze zlomeniny kalkanea
- Nepřímý antirefluxní výkon u gastroezofageální refluxní nemoci
- Perkutánní radiofrekvenční ablace renálních tumorů. První klinické zkušenosti miniinvazivní terapie
- Metoda aproximační střevní anastomózy v experimentálním modelu
- Recenze
- Životní jubileum
- Životní jubileum Doc. MUDr. Miroslav Janík, CSc., – sedemdesiatnik
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Životní jubileum Doc. MUDr. Miroslav Janík, CSc., – sedemdesiatnik
- Nepřímý antirefluxní výkon u gastroezofageální refluxní nemoci
- Symptomatický Meckelov divertikul u detí
- Obturačný ileus spôsobený črevnou duplikatúrou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



