-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lymfatické mapování a biopsie sentinelových uzlin s použitím kombinované metodiky in vivo aplikace Patentblue a radiokoloidu a ex vivo detekce metastatického postižení lymfatických uzlin u kolorektálního karcinomu
Lymphatic Mapping and Biopsy of Sentinel Lymph Nodes Using Combined Methodology of In Vivo Application of Patentblue and Radionuclide and Ex Vivo Detection of Metastatic Affection of Lymph Nodes in Colorectal Carcinoma
Aim of the study:
to check the new technique of lymphatic mapping and sentinel node biopsy by colorectal cancer surgery and to improve the lymphatic staging.Method:
combined technique of lymphatic mapping via Patentblue and the radiocolloid in vivo applied in the rectal cancer surgery. The lymphatic-mapping technique with Patentblue in the colon cancer surgery. Radically or palliative tumour resection. Ex vivo detection of sentinel and non-sentinel lymph nodes in the specimen and their division into peritumoral, intermedial and central level. Serial sectioning examination and immunohistochemistry examination of detected lymph nodes. Statistic process.Results:
The methods were used for 107 patients. 1985 lymph nodes were examined, out of which 208 was with metastasis. Positive nodes were detected in 56 patients. In average there were 18.5 nodes per patient. 966 sentinel nodes were detected by colouring and radiocolloid marking. Sentinel nodes showed in 97 patients. In 10 patients, the method failed. In 44 patients, sentinel nodes were positive; 117 positive nodes in total. Skip metastases were detected in 6 percent of the patients. The upstaging of metastatic detection was in 3.7 percent.Conclusion:
The technique of lymphatic mapping and sentinel node detection significantly increases the number of detected nodes and selects the marks the sentinel ones for further examination. The greatest amount of findings of nodal metastases is in the area closest to the tumour, therefore, when sentinel nodes are negative there, these can be examined more closely, by the method of serial insections or imunohistochemically, and staging of the disease can be made more accurate.Key word:
colorectal cancer – sentinel lymph node – lymphatic mapping
Autoři: J. Duben 1,2; B. Dudešek 1; L. Hnátek 1,2; P. Vážan 3; J. Bakala 2,4; J. Gatěk 1,2
Působiště autorů: Chirurgické oddělení nemocnice Atlas a. s. Zlín 1; Univerzita Tomáše Bati ve Zlíně 2; Bioptická a cytologická laboratoř, vedoucí lékař MUDr. Josef Velecký 3; Oddělení nukleární medicíny BN Zlín, přednosta prim. MUDr. Jiří Bakala 4
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 11, s. 695-701.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cíl práce:
Ověřit v praxi techniku lymfatického mapování a detekce sentinelové uzliny (SLN) při operaci kolorektálního karcinomu a zlepšit lymfatický staging.Použité metody:
Kombinovaná metodika peroperačního lymfatického mapování pomocí Patentblue a radiokoloidu metodou in vivo u karcinomu rekta. Metodika lymfatického mapování s Patentblue u karcinomu kolon. Radikální či paliativní resekce tumoru. Detekce sentinelových a non sentinelových uzlin na preparátu ex vivo s rozdělením podle etáží. Histopatologické vyšetření uzlin s pomocí seriových řezů a event. imunohistochemie. Statistické zpracování.Výsledky:
Metody jsme použili u 107 pacientů. Celkem bylo vyšetřeno 1 985 lymfatických uzlin, z nichž bylo detekováno 208 uzlin postižených metastázou. Pozitivní uzliny byly detekovány u 56 pacientů. Průměrně jsme vyšetřili 18,5 uzlin na pacienta. Detekovali jsme 966 sentinelových uzlin pomocí barvení a značení radiokoloidem. Sentinelové uzliny se zobrazily u 97 pacientů. U 10 pacientů došlo k selhání metody. Sentinelové uzliny byly pozitivní u 44 pacientů – celkem 117 pozitivních uzlin. Skip metastázy byly detekovány u 6 % pacientů. Upstaging detekcí mikrometastáz v 3,7 %.Závěry:
Technika lymfatického mapování a detekce sentinelové uzliny signifikantně zvyšuje počet vyšetřených uzlin a selektuje sentinelové uzliny k podrobnějšímu vyšetření. Největší záchyt uzlinových metastáz je v nejbližších etážích v těsné blízkosti tumoru, tudíž při negativitě SU v etáží S1 je možno uzliny z této etáže vyšetřit podrobněji (metodou seriových řezů a imunohistochemicky) a zpřesnit staging onemocnění.Klíčová slova:
kolorektální karcinom – sentinelová uzlina – lymfatické mapováníÚVOD
Kolorektální karcinom v našich zemích vykazuje v posledních letech velký nárůst incidence. Výskyt karcinomu nás řadí na přední místa na světě a mezi muži je Česká republika celosvětově na prvním místě. Byl vypracován screeningový program k záchytu časných stadií sporadického kolorektálního karcinomu. Používán je od roku 2000 u osob nad 50 let pravidelný test na okultní krvácení ve stolici. Tento program ve vyspělém zahraničí signifikantně snižuje mortalitu kolorektálního karcinomu o 15–33 % [1, 2]. V našich zemích však zatím nepřinesl požadované výsledky ve formě záchytu časnějších stadií nemoci [3]. Ve vyspělém zahraničí je velký důraz kladen na rozsah resekce a lymfadenektomie u karcinomu kolon [4, 5, 6]. V oblasti chirurgické léčby karcinomu rekta došlo ke změně operační techniky v 90. letech zavedením techniky TME (totální excizi mezorekta). Tato technika i bez použití neoadjuvance či adjuvance dokázala snížit procento lokálních recidiv u karcinomu rekta na 3–4 % [7]. Začaly se používat v určitých indikacích laparoskopické přístupy [8]. V rámci onkologické radikality zůstávají zlatým standardem klasické resekční výkony. Světovým trendem je co nejpodrobnější vyšetření tumoru a lymfatických uzlin z resekátu a stanovení biologické aktivity onemocnění s určením co nejpravděpodobnější prognózy. Určení biologického potenciálu tumoru pak vede k správnému výběru pacientů k následné léčbě, jež signifikantně snižuje počet lokálních recidiv (ca rekta) a prodlužuje dobu přežití. V našich zemích je často věnována malá pozornost peroperační diagnostice postižení lymfatik a proto není správně stanoveno stádium, v němž se choroba nachází [9, 10]. Není stanoveno přesné stadium nemoci podle zásad TNM – není vyšetřen adekvátní počet lymfatických uzlin podle celosvětových doporučení. V této práci se zabýváme stanovením přesného stagingu. Používáme k tomu metodiku lymfatického mapování barvením pomocí lymfotropní látky a u karcinomu rekta v kombinaci s mapováním radiokoloidem.
Pacienti s kolorektálním karcinomem bez přítomnosti uzlinových metastáz jsou klasifikováni podle AJCC jako stadium I a II. [11]. Přesto 20–30 % pacientů z tohoto souboru umírá do 5 let na lokální recidivu nebo vzdálené metastázy [12]. Potenciálním vysvětlením tohoto stavu může být „understaging“ těchto pacientů při rutinním vyšetřování odebraných uzlin. Byly tedy vyvinuty metody ke zlepšení histologického vyšetřování uzlin, tím ke zlepšení stagingu onemocnění a výběru rizikových pacientů – výsledkem je detekce metastáz, mikrometastáz ev. clusterů a případně jednotlivých buněk. Tyto metody zahrnují fat-clearing techniky [13], metodiku sériových řezů [14], imunohistochemické vyšetření [15, 16] a další. Tyto metodiky jsou však finančně a časově náročné pokud jsou prováděny u všech odebraných uzlin. Mapováním sentinelové uzliny u pacientů s kolorektálním karcinomem došlo ke zvýšení stadia onemocnení ze stadia I a II na stadium III v 17–20 % případů [17, 18]. Uzlinové mikrometastázy byly identifikovány v 8–18 % případů při vyšetření metodou sériových řezů a imunohistochemickém vyšetření sentinelových uzlin 17, 18. V těchto případech byla doporučena adjuvantní chemoterapie, jejíž dopad na dlouhodobé přežití bude dále studován.
Obr. 1. Schéma detekce SLN podle etáží Fig. 1. A scheme of sentinel lymph node (SLN) detection in individual levels 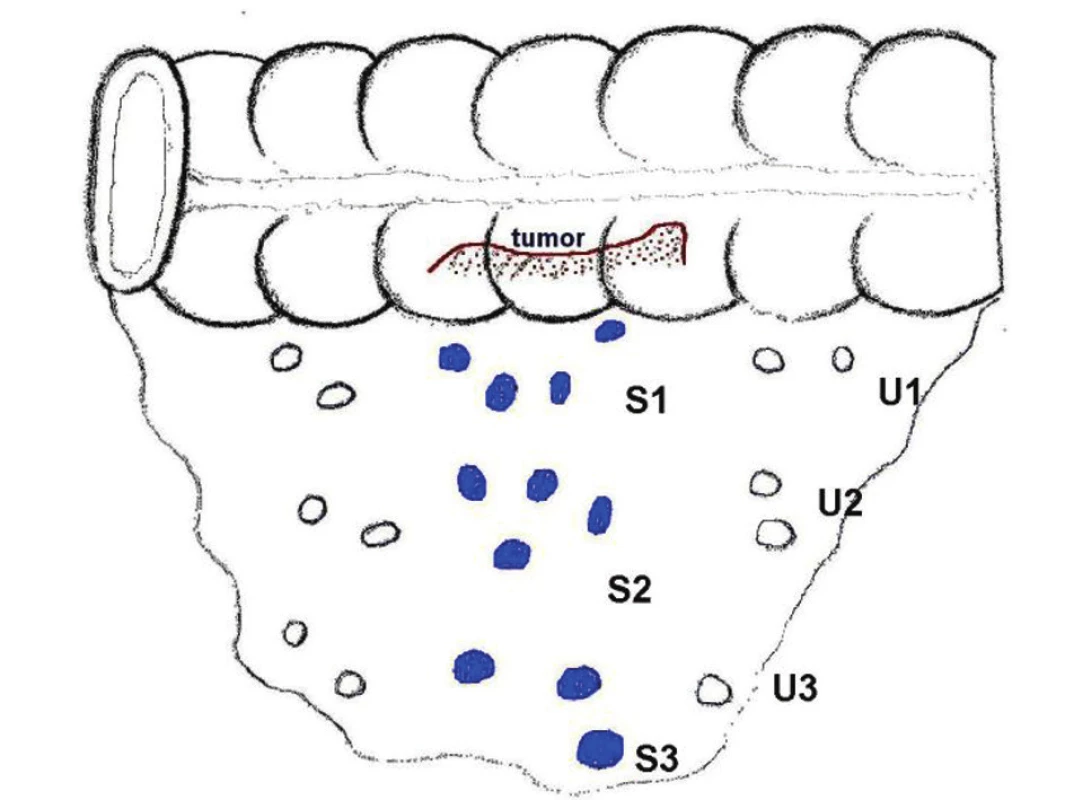
METODA
Lidé (kontrola kvality)
Studie probíhá na chirurgickém oddělení nemocnice Atlas a.s. Zlín. Všichni chirurgové byli seznámeni na počátku s technikou lymfatického mapování u kolorektálního karcinomu. Od roku 1998 je prováděna na chirurgickém oddělení nemocnice Atlas technika lymfatického mapování a biopsie sentinelové uzliny u karcinomu prsu a maligního melanomu [Gatěk, 2000, 2003]. Od roku 2000 do roku 2002 proběhly na našem oddělení první pokusy o aplikaci této techniky u kolorektálního karcinomu. Po zvládnutí techniky byla započata řádná studie v roce 2002. Na studii se podílelo 5 chirurgů s druhou atestací se standardním výcvikem v kolorektální chirurgii a dva patologové mající dlouholeté zkušenosti s vyšetřením kolorektálních tumorů, vyšetřením lymfatických uzlin a vyšetřením sentinelové uzliny včetně imunohistochemického vyšetření [19].
Pacienti – probandi
Do studie byli zařazeni všichni pacienti od 1/2002 s resekabilními tumory kolon či rekta, u nichž byla použita technika lymfatického mapování. Všichni pacienti byli starší 18 let, způsobilí k podpisu informovaného souhlasu. Pacienti byli diagnostikováni endoskopicky biopsií z tumoru. Biopsie byla standardně histopatologicky zpracována. Dále byl proveden předoperační staging tumoru. Podle etáže postižení bylo provedeno sono břicha, RTG plic, CT břicha, CT malé pánve, endosono rekta (od roku 2006). V případě postižení dolních dvou třetin rekta byli indikováni k předoperační neoadjuvanci a byli ve spolupráci s onkologickým oddělením BKN Zlín ozářeni podle protokolu používaném v BKN Zlín, nebo byla aplikována kombinovaná aktino-chemoterapie. Poté byli na našem oddělení po podpisu informovaného souhlasu operováni. Výsledky byly opět konzultovány onkologickým oddělením a pacienti byli poté podle stagingu zařazeni do protokolu adjuvantní léčby. Po operaci jsou pacienti sledováni na naší a onkologické ambulanci. Pacientům jsou prováděna kontrolní vyšetření podle standardu české onkologické společnosti. Výsledky studie, jež stále probíhá, jsou zpracovány do 7/2008. Celkem je zařazeno 107 pacientů.
TECHNIKA APLIKACE
Karcinom kolon
Technika aplikace Patentblue se liší podle lokalizace primárního nádoru. U palpovatelného karcinomu kolon používáme techniku peritumorální aplikace Patentblue. Aplikujeme 1–2 ml peritumorálně subserózně neředěnou Patentblue. U pokročilých tumorů zaujímajících celý obvod střeva aplikujeme Patentblue nad a pod tumor. U méně pokročilých nádorů pak aplikujeme Patentblue cirkulárně z několika vpichů okolo tumoru. U nepalpovatelných tumorů používáme techniku peroperační submukózní endoskopické aplikace Patentblue. Po 5–10 minutách podvazujeme cévy mezokolon a dokončujeme resekční výkon. Na preparátu mezokolon ex vivo preparujeme a oddělujeme zvlášť modře zbarvené uzliny (značíme S) a nenabarvené uzliny (značíme U) vždy podle etáží. Uzliny dělíme zjednodušeně na 3 etáže: peri - a parakolické – 1. etáž, intermediární – 2. etáž a centrální – 3. etáž. Takto ošetřený preparát kolon a uzlin odesíláme na histopatologické vyšetření.
Karcinom rekta
U karcinomu rekta má technika mapování pomocí barvení své limitace. Malé vzdálenosti a malý prostor v pánvi u operace karcinomu rekta v dolní a střední třetině dělají možnost peroperační aplikace barvení a peroperační detekce sentinelové uzliny barvením či gama sondou velmi problematickou. Z těchto důvodů se jeví jako nejlepší možnost aplikace značení radiokoloidem v delším intervalu před operací s následnou detekcí SU ex vivo po oddělení mezorekta od tumoru. Od roku 2004 používáme u tumorů dolní a střední třetiny rekta kombinaci obou metod.
Operace je provedena standardním způsobem jako radikální resekce s TME (totální mezorektální excize) nebo Milesova amputace rekta. Po odstranění preparátu je gama sondou detekována reziduální aktivita v malé pánvi a event. aberantní drenáž tumoru (laterální uzliny). Na preparátu pak ex vivo gama sondou detekujeme sentinelové uzliny, jež odesíláme k podrobnějšímu vyšetření (sériové řezy + imunohistochemie) zvlášť. Mezorektum při detekci uzlin oddělujeme od tumoru, jelikož reziduální aktivita tumoru by mohla vést k falešné negativitě vyšetření. Aktivní uzliny v etáži S1 by mohly být skryty za aktivitou tumoru. Jako pozitivní jsou označeny uzliny, u nichž detekujeme 10násobné zvýšení kvant radioaktivity měřenými gama sondou v 10sekundovém intervalu oproti pozadí.
Histopatologické vyšetření
K histopatologickému vyšetření je dodán resekát střeva s nádorem fixovaný v 10% formaldehydu. Odděleně jsou dodány ex vivo z mezokola vypreparované lymfatické uzliny, podle etáží označené S1-S3 a U1-U3 uložené do 10% formaldehydu. Všechny zjištěné lymfatické uzliny jsou odděleny od tuku a po etážích sečteny. Provádíme podélnou bisekci každé uzliny do bloků k histologickému zpracování. Všechny uzliny jsou blokovány kompletně. Lymfatické uzliny označené jako S1 (sentinelové) jsou podél hilu rozpůleny a podrobeny zpracování v sériových řezech po 50 mikrometrech. Ze dvou úrovní v intervalu 50 mikro odebíráme 2x řezy tloušťky 2–3 mikro, jeden z řezů barvíme hematoxylin-eosinem (H-E) Na druhém řezu ze stejné úrovně je provedeno imunohistochemické vyšetření protilátkou proti cytokeratinu (cytokeratin AE1/AE3,DAKO) k průkazu okultních mikrometastáz. Takto vyšetřené sentinelové uzliny bez přítomnosti metastáz jsou brány jako negativní (pN0). Zjištěné metastázy dělíme na makrometastázy (> 2 mm) a mikrometastázy (< 2 mm). Resekát s tumorem je zpracován podle histopatologických standardů. Z tumoru odebíráme minimálně dva vzorky, jeden z okraje a druhý z centrální části tumoru v místě makroskopicky nejhlubší invaze. V tukové tkáni mezokola (mezorekta) palpačně a pomocí kolmo na osu střeva vedených řezů vyhledáváme v resekátu zbylé nezbarvené lymfatické uzliny.
Statistické zpracování
Operační nález je zaznamenán operatérem do našeho protokolu, kde operatér značí polohu tumoru a etáže nalezených sentinelových uzlin. Histopatologické výsledky jsou zpracovávány s použitím našeho protokolu do databáze v programu Microsoft Access 2000 a data jsou následně statisticky zpracována oddělením statistiky Univerzity T. Bati ve Zlíně.
VÝSLEDKY
Celkové výsledky (107 pacientů)
Charakteristika souboru: od roku 2002 do 7/2008 bylo zařazeno 107 pacientů, z toho bylo 33 žen (30,8 %) a 74 mužů (69,2 %). Průměrný věk v době operace činil 63,3 let. Celkem bylo vyšetřeno 1985 lymfatických uzlin, z nichž bylo detekováno 208 uzlin postižených metastázou. Pozitivní uzliny byly detekovány u 56 pacientů. Průměrně jsme vyšetřili 18,5 uzlin na pacienta. Detekovali jsme 966 sentinelových uzlin pomocí barvení a značení radiokoloidem. Sentinelové uzliny se zobrazily u 97 pacientů. U 10 pacientů došlo k selhání metody. Sentinelové uzliny byly pozitivní u 44 pacientů – celkem 117 pozitivních uzlin.
Distribuce podle etáží
V etáži S1 bylo detekováno 459 uzlin u 93 pacientů, pozitivní byly 82 uzliny u 39 pacientů. V etáži S2 bylo detekováno 292 uzlin u 71 pacientů, z nichž bylo 22 pozitivních u 13 pacientů. V etáži S3 jsme detekovali 204 uzlin u 62 pacientů. 12 uzlin bylo pozitivních u 6 pacientů. U nezbarvených uzlin bylo postižení rozloženo následovně: v etáži U1 bylo detekováno 347 uzlin u 86 pacientů, z nichž bylo 34 pozitivních u 22 pacientů. V etáži U2 bylo detekováno 291 uzlin u 71 pacientů, z nichž bylo 21 pozitivních uzlin u 14 pacientů. V etáži U3 bylo nalezeno 238 uzlin u 73 pacientů, z nichž bylo 9 pozitivních u 7 pacientů. V druhé fázi studie byly patologem nalezeny u 4 pacientů mikrometastázy v sentinelové uzlině. Tento nález vedl k upstagingu (3,7 %). Ostatní detekované mikrometastázy byly detekovány i v etážích U1 nebo U2, ale nevedly k upstagingu tudíž jsme je do výsledků nezapočítávali. Mikrometastázy byly detekovány imunohistochemicky a následně potvrzeny zpětně i v barvení hematoxylin-eosinem. Clustery a nálezy jednotlivých buněk v sentinelových uzlinách nebyly patologem popsány.
Rozbor falešně negativních
V 11 případech (10,2 %) došlo k falešné negativitě nálezu sentinelových uzlin. Jednalo se o případy, u nichž byla detekována lymfatická metastáza(y) v nezbarvených uzlinách etáží U1-U3. Nejčastěji – v 7 případech se jednalo o tumory ve stadiu T3. Ve dvou případech se jednalo o stadium T4 a ve dvou případech o stadium T2. Ve stadiu T2 šlo u obou případů o jedinou lymfatickou metastázu. V prvním případě v etáži U1 a ve druhém případě v etáži U2. U tumorů ve stadiu T3 byly detekovány metastázy v lymfatických uzlinách v etáži U1 u 5 pacientů, u jednoho v etáži U2 a u jednoho v etáži U3. U tumorů stadia T4 byly lymfatické metastázy přítomny opět v etáži U1 a vyšších. V těchto případech falešné negativity vyšetřených sentinelových uzlin byly díky standardnímu vyšetření všech detekovaných uzlin nalezeny metastázy i v nebarvených uzlinách. Na základě vyšetření u těchto pacientů je nutno zdůraznit, že se nelze zcela spolehnout na detekci pouze sentinelových uzlin (zvláště u pokročilých stádií tumoru), jako tomu již v současnosti je v případě karcinomu prsu, ale je nutno dodržet standardní vyšetření všech detekovaných uzlin.
Rozbor skip metastáz
V souboru jsme detekovali skip metastázy u 4 pacientů. První pacient (č. 16) měl jedinou metastázu v nezbarvené uzlině v etáži U3, sentinelové uzliny byly detekovány jen 3 v etáži S1 a S2 a byly negativní (T3N1M0). U druhého pacienta (č. 31) došlo k detekci mikrometastázy v uzlině v etáži S3 – byla to jediná detekovaná mikrometastáza (T2N1miM0). Třetí pacient (č. 55) měl 2 negativní uzliny v etáži S1 a metastázu měl v etáži S2 – 2 uzliny z toho jedna s metastázou (T3N1M0). Čtvrtý pacient (č. 77) měl dvě negativní uzliny v etáži S1 a dvě uzliny v etáži S2 jedna byla pozitivní (T3N1M0). U jednoho pacienta tedy došlo k selhání metodiky mapování, u ostatních byly skip metastázy detekovány v mapovaných uzlinách ve vyšších etážích. Zde se nabízí otázka správného odběru uzlin v první etáži či aberantní drenáže. Celkové procento skip metastáz je velmi nízké (3,7 %) a nemá signifikantní vliv na spolehlivost metodiky. Je v souhlasu se světovými sestavami.
Srovnání s vlastními výsledky
Náš soubor 107 pacientů jsme srovnali se souborem z let 2000–2001 před zahájením studie lymfatického mapování. V kontrolním souboru byli zařazeni všichni pacienti, u nichž bylo možno dohledat řádnou TNM klasifikaci. Dohledali jsme 73 pacientů, jež byli operováni na našem oddělení a u nichž nebyla použita technika lymfatického mapování. V souboru bylo 25 žen (34 %) a 48 mužů (66 %). Průměrný věk v době operace byl 63,1 let.
V grafu je patrný posun ve stagingu ve smyslu zařazení pacientů do vyšších stadií. Snížil se počet pacientů řazených do stadia I a IIB a IV a zvýšil počet pacientů ve stadiích IIA, IIIB a IIIC.
Graf 1. Srovnání souborů Old – New Graph 1. Old – New study group comparison 
Graf 2. Srovnání obou souborů ve studii (1–30 vs. 30–107) Graph 2. Comparison of the two groups in the study (1–30 vs. 30–107) 
Srovnání obou souborů ve studii
Statisticky byly hodnoceny mezi sebou obě skupiny v souboru. Obě skupiny byly vyšetřeny metodikou detekce sentinelových uzlin, druhá skupina měla podrobněji vyšetřeny uzliny první etáže metodikou sériových řezů a imunohistochemicky. Tento postup byl zvolen na základě teorie kontinuálního šíření lymfatických metastáz s nejvyšší předpokládanou četností v etážích peritumorálních. Tato teorie byla potvrzena výsledky první části studie. Byly prokázány statisticky významné rozdíly v relativních četnostech u IIb, IIIa a IIIc, u ostatních kategorií nebyl prokázán významný rozdíl. Podrobnějším vyšetřením uzlin první etáže došlo k dalšímu snížení počtu pacientů ve stadiu II, u něhož není indikována následná chemoterapie. Pacienti byli i v první skupině naší studie podstážováni a došlo k jejich dalšímu přesunu ze stadia II do stadia III. Tito pacienti pak budou profitovat z aplikace chemoterapie delší dobou přežití.
Tab. 1. Srovnání světových sestav [22] Tab 1. Worldwide groups comparison [22] ![Srovnání světových sestav [22]
Tab 1. Worldwide groups comparison [22]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/21ae76e264534e19c6708cc354aee088.png)
DISKUSE
Lymfatické mapování jednoznačně zlepšuje detekci lymfatických uzlin a staging kolorektálního karcinomu. Metodika mapování je jednoduchá a levná. Ve studii používáme metodiky mapování in vivo technikou z důvodu její výhodnosti pro operujícího chirurga, jemuž se přímo během výkonu na operovaném střevě ukáže rozsah lymfatické drenáže tumoru a umožňuje mu v případě lokalizace nádoru na rozhraní drenáže arteriálních splavů rozhodnutí o exaktním rozsahu výkonu. V našem souboru jsme 5x rozšířili původně plánovaný rozsah výkonu na základě in vivo mapování. U karcinomu rekta není technika lymfatického mapování tak spolehlivá z několika důvodů. V případě předoperačního stagingu tumoru T2, T3, nebo N1 je většinou použita neoadjuvance. Tato metodika snižuje četnost lokálních recidiv tumoru, ale poškozuje lymfatickou drenáž rekta. Z tohoto důvodu pak není technika sentinelové uzliny u rekta spolehlivá. V Japonsku je chirurgický výkon primární a je následován onkologickou léčbou. V japonských sestavách tudíž technika sentinelové uzliny neselhává. Druhým problémem je anatomie malé pánve, která znemožňuje peritumorální aplikaci barvení chirurgovi pod kontrolou zraku a je nutná aplikace ve spolupráci s endoskopistou. Třetím problémem je lymfatická drenáž dolního rekta do mezorekta i laterálních uzlin. Tato je v západním světě ovlivněna neoadjuvancí tudíž se metastázy do laterálních uzlin vyskytují velmi zřídka. V Japonsku je tomu jinak, což vyplývá z celkové strategie výkonu. V našem souboru jsme používali u karcinomu rekta kombinaci metodiky barvení a lymfoscintigrafie, která nám umožnila i po provedené neoadjuvanci detekci dostatečného množství uzlin. Dále nám umožňuje kontrolu laterálních uzlin gama sondou a ev. nález postižených uzlin. V našem souboru jsme zatím nezaznamenali výskyt postižení laterálních uzlin, což pravděpodobně souvisí s neoadjuvancí a je tudíž v souhlasu se světovými sestavami.
V literatuře nacházíme dva rozdílné koncepty chápání sentinelové uzliny u kolorektálního karcinomu. Část autorů popisuje sentinelovou uzlinu jako první, která se nabarví po aplikaci modré barvy nebo je aktivní (tento koncept jsme testovali v první fázi u prvních 5 pacientů, ale ustoupili jsme od něj z důvodů narušení další lymfatické drenáže stehem či klipem a také z důvodu nespolehlivosti v případě umístění uzliny těsně peritumorálně a její malé velikosti [20], kdy je možno ji přehlédnout nebo zaměnit především v případě tučného mezokolon). Druhá skupina definuje sentinelové uzliny jako všechny, které se nabarví nebo jsou aktivní. Tyto sentinelové uzliny jsou pak podrobněji vyšetřovány – sériovými řezy, imunohistochemicky atd. Na našem pracovišti jsme vyvinuli originální koncept spojující výhody obou metodik. Jako sentinelové uzliny značíme všechny mapované uzliny, nicméně podrobněji vyšetřujeme metodikou sériových řezů a imunohistochemicky jen uzliny z první etáže S1. K tomuto konceptu jsme dospěli na základě literatury (především prací prof. Czerniho [21], který popsal pravděpodobnost výskytu metastáz ve sloupcích vedených kolmo na osu střeva se snižujícím se výskytem se vzdáleností sloupce od tumoru) a na základě vlastních pozorování v oblasti distribuce metastáz, kdy detekujeme maximum metastáz v etáži nejblíže tumoru. V etáži 1 (nejblíže tumoru) detekujeme 4x více metastáz než v etáži 2, a 10x více metastáz než v etáži 3 (centrálně). Podíl skip metastáz je také velmi nízký – v našem souboru dosahuje jen 6 %. Všechny uzliny v preparátu detekované námi či patologem jsou zpracovány a vyšetřeny minimálně podélnou bisekcí dle standardů péče o kolorektální karcinom. Uzliny sentinelové v etáži S1 pak podrobněji. Tím, že nemusí být vyšetřeny imunohistochemicky všechny mapované uzliny, dochází k výrazné úspoře času patologa i finančních prostředků při zachování maximální senzitivity vyšetření. V porovnání obou souborů ve studii jsme došli k statisticky signifikantním rozdílům. Došlo k přesunu části pacientů ze stadia II do stadia III jen za pomoci podrobnějšího vyšetření uzlin první etáže sériovými řezy a imunohistochemicky. Tím jsme potvrdili naši hypotézu a vylepšili staging. Všichni pacienti s detekovanými mikro a makrometastázami byli indikováni k následné zajišťovací chemoterapii, která signifikantně prodlužuje dobu přežití.
ZÁVĚR
Technika lymfatického mapování a biopsie sentinelové uzliny je novým pokrokem v kolorektální chirurgii. Použití techniky mapování pomocí Patentblau je jednoduchá, levná a obecně aplikovatelná metoda s krátkou učební dobou, s možností provádění na jakémkoli pracovišti. Signifikantně zvyšuje počet vyšetřených uzlin a selektuje sentinelové uzliny k podrobnějšímu vyšetření. In vivo aplikovaná metoda lymfatického mapování dále napomáhá peroperační rozvaze ohledně rozsahu resekce. Je viditelně zobrazena oblast možných lymfatických metastáz, což usnadňuje operujícímu chirurgovi rozhodnutí o rozsahu resekce při postižení rizikových částí střeva na rozhraní cévního zásobení (resekce sigmatu či levostranná hemikolektomie, rozsah resekce při tumoru transversa, tumorů flexur – především lienální). Distribuce metastatického postižení v našem souboru jednoznačně ukazuje maximální četnost uzlinových metastáz v etážích peri a parakolických v blízkosti tumoru. Z toho vyplývá, že uzliny jsou postiženy etážovitě. Lymfatické mapování usnadňuje výběr uzlin, které jsou nejvíce rizikové pro výskyt metastáz. Těmto uzlinám je pak věnována větší pozornost při patologickoanatomickém vyšetření. Další zlepšení stagingu je dosaženo pomocí podrobnějšího vyšetření uzlin v etáži S1. Zde detekujeme s vysokou přesností lymfatické metastázy i u pacientů dříve zařazených do skupiny bez lymfatických metastáz a tudíž detekujeme rizikovou skupinu pacientů, u nichž docházelo dříve k relapsům choroby. U těchto pacientů je pak následně aplikována adjuvantní chemoterapie, jejíž pozitivní vliv na pětileté přežití byl prokázán ve velkých randomizovaných studiích.
Článek je věnován k životnímu jubileu prim. MUDr. Jiřího Gaťka, Ph.D.
Práce byla přednesena na světovém chirurgickém kongresu v Montrealu.
Je výtahem z dizertační práce autora obhájené na LF MU Brno 2009.
MUDr. J. Duben
Chirurgické oddělení nemocnice Atlas a.s.
Třída T. Bati 5135
760 01 Zlín
Zdroje
1. Hadrcastle, J. D., Chamberlain, J., Robinson, M., et al. Randomised control trial of faecal occult blood screening for colorectal cancer. Lancet, 348, 1996, 1472–1477
2. Mandel, J. S., Bond, J. H., Church, T. R., et al. Reducing mortality from colorectal cancer by screening for fecal occult blood. N. Engl. J. Med., 328, 1993, 1365–1371.
3. Žaloudík, J., Vyzula, R., Vorlíček, J. Onkoprevence pro Českou republiku. Klinická onkologie, 19, 2006, 35–36.
4. Lehnert, T., Weitz, J., Schaible, A., Herfart, C. Aktuelle Operationstechnik beim kolorektalen Karzinom, Visceralchirurgie, 35, 2000, 187–194.
5. Hohenberger, W., Merkel, S., Weber, K. Lymphadenektomie bei Tumoren des unteren Gastroitestinaltraktes. Chirurg, 78, 2007, 217–225.
6. Lehnert, Th., Herfarth, Ch. Grundlagen und Wert der Lymphadenektomie beim colorectalen Karcinom. Chirurg, 67, 1996, 889–899.
7. MacFarlane, J. K., Ryall, R. D. H., Heald, R. J. Mesorectal excision for rectal cancer, Lancet, 341, 1993, 457–460.
8. Lacy, A. M., Garciá-Valdecasas, J. C., Delgado, S., et al. Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomized trial. Lancet, 359, 2002, 2224–2229.
9. Coufal, O., Svobodník, A., Žaloudík, J., Šefr, R., Fait, V., Dušek, L., Dorociak, F. Faktory ovlivňující vyšetřování mízních uzlin v resekátech karcinomů kolon a rekta, Klinická onkologie, 17, 3, 2004, 96–100.
10. Coufal, O., Žaloudík, J., Svobodník, A., Šefr, R., Penka, I., Kaplan, Z., Tomášek, J., Fait, V. Standardní klasifikace kolorektálních karcinomů – realita nebo iluze? Klinická onkologie, 6, 2002, 219–225.
11. Fleming, I. D., Cooper, J. S., Henson, D. E., et al. AJCC cancer staging handbook from the AJCC cancer staging manual. 5th ed. Philadelphia: Lippincott Williams and Wilkins, 1998, pp. 81–89.
12. Cohen, A. M., Kelsen, D., Saltz, L., et al. Adjuvant therapy for colorectal cancer. Curr. Prob. Cancer, 22, 1998 : 55–65.
13. Herrera-Omelas, L., Justiniano, J., Castillo, N., et al. Metastasis in small lymph nodes from colon cancer. Arch Surg, 122, 1987 : 1253–1256.
14. Gusterson, B. Are micrometastase clinically relevant? Br. J. Hosp. Med., 47, 1992 : 247–248.
15. Greenson, J. K., Isenhart, C. E., Rice, R., Mojzisik, C., Houchens, D., Martin, E. W. Identification of occcult micrometastases in pericolic lymph nodes of Dukes B colorectal cancer patients using monoclonal antibodies against cytokeratin and CC49. Correlation with long-term survival. Cancer, 73,1994, 563–569.
16. Broll, R., Schauer, V., Schimmelpenning, H., et al. Prognostic relevance of ccult tumor cells in lymph nodes of colorectal carcinomas. Dis. Colon Rectum, 40, 1997 : 1465–1471.
17. Saha, S., Weise, D., Badin, J., et al. Technical details of sentinel lymph node mapping in colorectal cancer and its impact on staging. Ann. Surg. Oncol., 7, 2000 : 120–124.
18. Tsioulias, G. J., Wood, T. F., Morton, D. L., Bilchik, A. J. Lymphatic mapping and focused analysis of sentinel lymph nodes upstage gastroitestinal neoplasms. Arch. Surg., 135, 2000 : 926–932.
19. Vážan, P., Velecký, J., Gatěk, J. Vyšetření sentinelových uzlin u karcinomu prsu pomocí rychlé peroperační biopsie, Čes. - slov. Patol., Praha, 2007, 13–17.
20. Czerni, G. The influence of nodal size on the staging of colorectal carcinomas. J. Clin. Pathol., 55, 2002, 386–390.
21. Czerni, G., Tarján, M., Bori, R. Distance of Lymph Nodes From the Tumor. Arch. Patol. Lab. Med., 125, 2001, 246–249.
22. Saha, S., Patel, M., Bilchik, A., Beutler, T., Zuber, M., Bembenek, A., Kitagawa, Y., Duben, J., Codignola, C., Cserni, G. Validation of sentinel lymph node (SLN) mapping (M) in colon cancer (Cca) over 3 continents: An international experience, ASCO 2007, SSO Annual Meeting Chicago 2008
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Rozloučení
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2010 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Traumatická atlantoaxiálna rotačná fixácia u dieťaťa
- Intratorakální struma – nediagnostikovaná – přece odoperovaná
- Axilárna disekcia v manažmente chirurgickej liečby invazívneho karcinómu prsníka u postmenopauzálnych pacientok
- Torze omenta – neobvyklá příčina náhlé příhody břišní
- Abdominální katastrofa – defekt stěny břišní komplikovaný střevní píštělí – strategie léčby
- Segmentální absence muscularis propria stěny tračníku – vzácná příčina perforace tračníku v těhotenství
- Mucinózní adenokarcinom apendixu – kazuistika
- Intraoperační radioterapie v multimodalitní léčbě lokálně pokročilého karcinomu rekta
- Pětileté sledování nemocných po operaci světlobuněčného karcinomu ledviny
- Lymfatické mapování a biopsie sentinelových uzlin s použitím kombinované metodiky in vivo aplikace Patentblue a radiokoloidu a ex vivo detekce metastatického postižení lymfatických uzlin u kolorektálního karcinomu
- Mapování povrchového žilního systému před a po operaci varixů – literární souhrn specifických aspektů při vyšetřování duplexní sonografií
- Rozloučení
- VÝZNAMNÁ POCTA ČESKÉ CHIRURGII
- Zápis z jednání schůze výboru ČCHS dne 11. 11. 2010
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mucinózní adenokarcinom apendixu – kazuistika
- Abdominální katastrofa – defekt stěny břišní komplikovaný střevní píštělí – strategie léčby
- Pětileté sledování nemocných po operaci světlobuněčného karcinomu ledviny
- Torze omenta – neobvyklá příčina náhlé příhody břišní
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



