-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kolorektální karcinom
Autoři: G. Vepřeková; Š. Suchánek; M. Zavoral
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 1, s. 44-47.
Kategorie: Postgraduální vzdělávání
Epidemiologie
Česká republika (ČR) se nachází na páté, respektive třetí příčce ve světové incidenci a mortalitě kolorektálního karcinomu. Mezi evropskými zeměmi zaujímá v obou těchto epidemiologických ukazatelích třetí místo hned za Slovenskem a Maďarskem [1]. Dle údajů Ústavu zdravotnických informací a statistiky (ÚZIS) byl v roce 2008 v ČR karcinom kolorekta diagnostikován u 8106 osob a 4242 jich na toto zhoubné onemocnění zemřelo. Ve shodném roce byla zaznamenána incidence KRK 79/100 000 obyvatel. I přes rostoucí nemocnost jsou hodnoty mortality dlouhodobě stabilizované na hodnotě cca 40/100 000 obyvatel, což svědčí o dostupné a kvalitní léčebné péči v ČR.
V letech 1999–2008 došlo k signifikantnímu vzestupu počtu nově diagnostikovaných karcinomů rekta a kolon jako druhé metachronní primární malignity u téhož jedince. U 1,1 % případů předcházel diagnóze kolorektální karcinom a u 13,0 % se jednalo o jiné zhoubné onemocnění.
Pro porovnání, v letech 1979–1988 mělo pouze 5,2 % nemocných s KRK v anamnéze jinou malignitu (NOR, ÚZIS ČR). Tento fakt je vysvětlován demografickým stárnutím.
Genetická podstata onemocnění
Neustálá rychlá obměna buněk sliznice tlustého střeva podporuje jejich náchylnost ke kancerogenezi. Nestabilita genomu je základní podmínkou pro vznik nádoru. V současné době jsou známy tři základní cesty vedoucí ke genomické nestabilitě: chromozomální nestabilita (CIN, chromosomal instability), mikrosatelitní nestabilita (MSI, microsatellite instability) a metylace CpG ostrůvků (CIMP, CpG island methylator phenotype). Všechny mechanismy či jejich různé kombinace mohou vést ke vzniku jednoho konkrétního KRK.
Chromozomální nestabilita je detekovatelná u 65–70 % sporadických KRK [2] a pravděpodobně zasahuje do procesu karcinogeneze v časné fázi sekvence adenom-karcinom. Cestou aneuploidie, amplifikace genomu na subchromozomální úrovni a ztráty heterozygozity vede k akumulaci mutací v cílových genech [3], které mají za následek aktivaci onkogenů (př. K-ras, EGFR) a inaktivaci tumor supresorových genů (př. APC, DCC, TP 53) [4]. Tato cesta kancerogeneze trvá 7 až 10 let.
Nádory s mikrosatelitní nestabilitou jsou diploidní na chromozomální úrovni, ale vyznačují se frekventními alteracemi v úsecích mikrosatelitní DNA. Mutací genů pro opravu chybného párování bazí (mutátorových genů) dochází v buňce k hromadění a udržování mutací ve specifických cílových genech, a nádor se tak vyvine mnohem rychleji (cca za 1–3 roky). MSI se vyskytuje u 15 % ze všech KRK [5]. Ve 3 % se jedná o nemocné s vrozenou mutací MMS (mismatch repair) genů s tzv. Lynchovým syndromem [6]. Pro KRK s MSI je typická lokalizace v proximální části tračníku, nízký stupeň diferenciace a histologický nález mucinózního karcinomu či karcinomu z prstenčitých buněk [7]. Tito nemocní mají obecně lepší prognózu, ale horší odpověď na chemoterapii oproti jedincům s KRK bez MSI [8].
Karcinogeneze vycházející z pilovitého adenomu postihuje častěji proximální část tlustého střeva a je spjata s hypermetylací CpG ostrůvků (CIMP), která má za následek poruchu exprese tumor supresorových genů (TP53, p16INK4a). U většiny sesilních pilovitých adenomů je detekována mutace onkogenu BRAF, vedoucí k buněčné proliferaci a inhibici apoptózy [9]. Prognóza nemocných bývá příznivá.
Rizikové faktory – exogenní
Denní konzumace „červeného masa“, úprava potravin smažením, pečením a grilováním, vyšší podíl živočišných tuků v potravě, kouření cigaret a zvýšená konzumace alkoholu patří mezi základní faktory zvyšující riziko KRK [10]. Dalším samostatným rizikovým faktorem je abdominální obezita. Osoby s BMI > 30 kg/m2 mají 3,2krát vyšší riziko vzniku KRK oproti jedincům s BMI < 23 kg/m2. Naopak mezi protektivní faktory patří pravidelná fyzická aktivita, konzumace rybího masa a tuku, příprava pokrmů vařením, dostatečný příjem kalcia a vitaminu D v potravě. Zařazení vyššího podílu ovoce, zeleniny a vlákniny do jídelníčku prokazatelně nesníží riziko KRK. Jejich příznivý vliv lze z hlediska prevence KRK shledat pouze v suplementaci folátu (protektivní množství folátu je 400 μg/den) [10].
Rizikové faktory – endogenní
Hereditární formy KRK
Hereditární formy KRK tvoří níže uvedené dobře definované genetické syndromy:
Familiární adenomatózní polypóza (FAP) je autozomálně dominantně dědičné onemocnění s prevalencí 1/10 000 [11], způsobené zárodečnou mutací genu APC (adenomatous polyposis coli). Typickým fenotypem je kolonoskopický nález mnohočetných adenomových polypů tlustého střeva (až 103). Nemocní mají téměř 100 % riziko vývoje KRK a to již od 3. dekády života. Při podezření na FAP je nezbytné genetické vyšetření nemocného i příbuzných (detekce mutací v APC genu). Při potvrzení FAP je nezbytná pravidelná dispenzarizace nemocných (kolonoskopie, endoskopie horní části trávicího traktu, sonografie štítné žlázy atd.) a dle tíže postižení kolon dříve či později provedení proktokolektomie. U 30 % jedinců vzniká mutace genu ACP de novo, tedy u jedince s negativní rodinnou anamnézou. Z tohoto důvodu by varovné příznaky u mladých pacientů neměly být brány na lehkou váhu a provedení kolonoskopie by mělo být pravidlem.
Hereditární nepolypózní kolorektální karcinom (HNPCC) je autozomálně dominantně dědičné onemocnění s incidencí 1/500, způsobené zárodečnou mutací v tzv. mutátorových genech (MMR – mismatch repair genes: hMSH2, hMSH1, hPMS2), které produkují enzymy opravující chyby vzniklé při replikaci jednotlivých úseků molekuly DNA. Pro HNPCC je charakteristický hereditární výskyt časně vznikajícího KRK bez přítomnosti polypózy a u tzv. Lynchova syndromu navíc i familiárním výskytem maligních nádorů v jiných lokalizacích (karcinom prsu, štítné žlázy, žaludku, nadledvin, kůže aj.). Tzv. mikrosatelitovou nestabilitu (MSI) lze detekovat i v biopsii či v resekátech nádorové tkáně. Při časném výskytu KRK je vhodné provést genetické vyšetření, zaměřené na detekci mutací v MMR genech a na MSI.
Turcotovým syndromem je nazýváno sdružení adenomatózní polypózy tlustého střeva s maligním tumorem mozku (glioblastomem, meduloblastomem, astrocytomem), které je zapříčiněno mutací genů APC a hMSH2.
Gardnerův syndrom je způsoben mutací APC genu, ale na rozdíl od FAP se fenotypicky projevuje ještě desmoidními tumory a osteomy.
Atenuovaná familiární adenomatóza (AAPC) se od FAP liší řádově nižším počtem adenomových polypů kolon (do 100) a pozdějším vývojem KRK.
Hereditární smíšený polypózní syndrom (HMPS) je klinickou kombinací AAPC s juvenilními a hyperplastickými polypy. Nemocní mají 9–13krát vyšší riziko vzniku KRK oproti běžné populaci. Přesná genetická příčina tohoto syndromu není dosud objasněna.
Peutz-Jeghersův syndrom se projevuje četnými hamartomovými polypy celého gastrointestinálního traktu.
Familiární kolorektální karcinom
Familiární KRK se vyskytuje cca u 10 % jedinců s KRK. Jedná se o nemocné s výskytem kolorektální neoplasie u příbuzných 1. stupně, kteří však nesplňují kritéria pro výše uvedené hereditární syndromy. Nemocní mají tzv. vrozenou náchylnost ke vzniku KRK, která má multigenní charakter.
Další endogenní rizikové faktory
Pozdní komplikací idiopatických střevních zánětů (ISZ, ulcerózní kolitidy a Crohnovy choroby) je vznik KRK. Toto riziko signifikantně roste s délkou trvání nemoci, jejím rozsahem, aktivitou zánětu a přítomností primární sklerozující cholangoitidy.
Osoby po kurativní resekci střeva pro karcinom, po endoskopickém snesení adenomového polypu tlustého střeva, ženy s anamnézou karcinomu prsu, ovaria a dělohy a nemocní s ureteroileostomií jsou také zatíženi rizikem vzniku karcinomu kolon či rekta. Všechny výše uvedené skupiny osob označujeme jako skupiny s vysokým rizikem vývoje kolorektálního karcinomu, a proto by měly být pravidelně endoskopicky dispenzarizovány.
Sporadický KRK
Sporadický kolorektální karcinom tvoří 80–85 % všech KRK (Obr. 1).
Obr. 1. Karcinom tlustého střeva 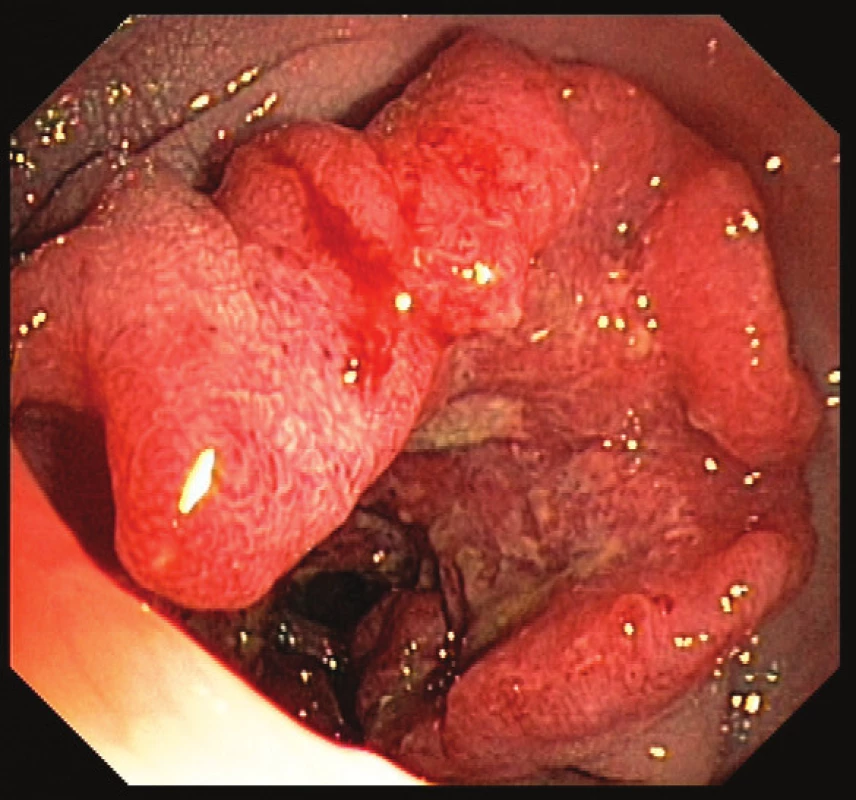
Vzniká na podkladě benigních adenomových polypů. Věk je nejsilnějším endogenním rizikovým faktorem pro vznik sporadického karcinomu tračníku i rekta. Křivka věkově specifické incidence jednoznačně dokládá strmější nárůst diagnostikovaných KRK ve věku nad 50 let. Ve věkové skupině 50–54 let činí 6,3 %, ve věku 55–59 let již 9,9 % a maxima (17,6 %) dosahuje ve věku 70–74 let (ÚZIS).
Rychlost progrese adenomového polypu v karcinom záleží na jeho velikosti a stupni dysplázie. Za tzv. pokročilý adenom považujeme polyp > 10 mm, s vysokým stupněm dysplázie (HGD – high grade dysplasia) a vilózní strukturou. Vývoj karcinomu z polypu s nízkým stupněm dysplázie (LGD – low grade dysplasia) trvá cca 8–11 let, ale při HGD pouze cca 3,5 roku. Toto tvrzení však neplatí pro proximální část tračníku, kde se častěji vyskytuje „rychlejší cesta“ kancerogeneze cestou CIMP a MSI.
Diagnostika
K hlavním varovným anamnestickým údajům patří změna defekačního rytmu, enterorrhagie, bolest břicha a anemický syndrom. Základní diagnostickou metodou k verifikaci KRK je kolonoskopické vyšetření s odběrem cílených biopsií. V rámci stagingu je následně nutné doplnit CT břicha, malé pánve a CT hrudníku a u karcinomů rekta ještě vyšetření endosonografické či zobrazení malé pánve magnetickou rezonancí. V době diagnózy odebíráme onkomarkery (hl. CEA a CA 19–9) k následné monitoraci efektu léčby. Perspektivním nástrojem k dispenzarizaci nemocných s KRK se zdá být detekce cirkulující volné DNA v periferní krvi, která je však zatím využívána pouze v rámci studií [12]. Neinvazivní alternativou kolonoskopie je CT kolonografie s nízkou senzitivitou pro detekci plochých lézí a polypů ≤ 5 mm (65 %), které se v praxi užívá především k dovyšetření střeva po inkompletní kolonoskopii. Miniinvazivní variantou je vyšetření tlustého střeva kolonickou kapslí, která dle recentních studií má 84–89% senzitivitu pro detekci polypů ≥ 6mm [13, 14]. Při pozitivním nálezu je však nezbytné doplnění kolonoskopie k histologické verifikaci a ev. endoskopické intervenci.
Screening kolorektálního karcinomu
Proces karcinogeneze v tlustém střevě probíhá velmi pomalu. V dlouhém desetiletém intervalu lze zasáhnout, adenomový polyp endoskopicky odstranit, a předejít tak vzniku karcinomu nebo diagnostikovat KRK v časném snáze léčitelném stadiu. Populační screening KRK, který byl v České republice zahájen v roce 2000, je zaměřen na časnou diagnostiku kolorektální neoplasie u bezpříznakových jedinců s fyziologickým fyzikálním i laboratorním vyšetřením. Od roku 2009 došlo k úpravě designu programu zavedením primární screeningové kolonoskopie (PSK). I nadále jsou vyšetřováni asymptomatiční jedinci, kteří od 50 do 54 let mohou podstoupit guajakový či imunochemický test na okultní krvácení ve stolici (TOKS) v jednoročním intervalu a při pozitivním výsledku screeningovou kolonoskopii. Od 55 let věku se interval TOKS prodlužuje na dva roky. Alternativou TOKS je od 55 let PSK, kterou je možné zopakovat za 10 let. Shodný design screeningu KRK je zaveden i v dalších evropských zemích (Slovensko, Německo, Rakousko, Řecko a Kypr) [15]. Od roku 2006 do září 2011 bylo v rámci screeningového programu odhaleno 29 743 jedinců s adenomovým polypem. Tyto polypy byly endoskopicky odstraněny a jejich nositelé tak zachráněni před jinak jistou vyhlídkou kolorektálního karcinomu.
V rámci screeningového programu je kladen velký důraz na kontrolu kvality a bezpečnost vyšetření. Za standard je mj. považováno využívání chromodiagnostiky (metylenová modř, krystal violeť, indigo karmín) a vyšetření sliznice tlustého střeva v NBI (narow band imaging), které nám umožní lépe zobrazit patologickou lézi bez použití barviva.
Až 25 % pacientů, kteří podstoupí kolonoskopii, má neadekvátně připravené tlusté střevo [16]. Špatná střevní příprava výrazně zvyšuje riziko přehlédnutí kolorektální neoplázie, nutnosti opakování výkonu či časnější kolonoskopické kontroly. Obecně lze doporučit rozdělení přípravy do dvou dávek a načasování jejího užití tak, aby druhá dávka byla dopita nejdříve 8 hodin a nejpozději 3–4 hodiny před začátkem vyšetření [17, 18, 19]. Při špatné přípravě je vhodné vyšetření opakovat či zkrátit interval kontroly oproti doporučovanému. Screeningovou kolonoskopii se špatnou či velmi špatnou střevní přípravou nelze považovat za konkluzivní [20].
Profylaxe
Optimální farmakologická profylaxe bez významných nežádoucích účinků nebyla dosud vyvinuta, a proto ji nelze rutinně doporučit. Přesto některé vysokorizikové skupiny nemocných mohou z níže uvedených preparátů profitovat. Dlouhodobé užívání kyseliny acetylsalycilové signifikantně sníží riziko vývoje kolorektálního karcinomu s expresí COX-2 [21]. Celecoxib v dávce 400 mg 2krát denně u nemocných bez významného kardiovaskulárního rizika je bezpečným lékem v profylaxi KRK [22]. Sulindac se doporučuje u nemocných s FAP ke zpomalení tvorby a progrese polypů [23]. Hormonální substituční terapie sníží riziko vývoje kolorektální neoplázie, které je však vykoupeno vyšším rizikem vzniku karcinomu prsu a kardiovaskulárních příhod [24].
Léčba
Problematika terapie nemocných s KRK vyžaduje multidisciplinární přístup. O strategii léčby by mělo být rozhodováno na mezioborových seminářích za přítomnosti chirurga, gastroenterologa, onkologa, radiologa a ideálně i patologa. Kromě stagingu, histologické struktury, gradingu a lokalizace karcinomu je vždy třeba zohlednit i celkový stav nemocného, kvalitu života a v neposlední řadě i jeho přání.
Časná stádia kolorektálního karcinomu lze léčit a vyléčit endoskopickou cestou. Dle velikosti a charakteru léze lze k endoskopické terapii užít polypektomii (EPE) endoskopickou kličkou, endoskopickou mukozální resekci (EMR) po podpichu fyziologickým roztokem s adrenalinem a ev. barvou pro lepší orientaci (Obr. 2 a 3) či endoskopickou submukózní disekcí (ESD). Při ESD se pomocí speciálních endoskopických akcesorií (ESD nože) odstraňuje polyp en block i se submukózou. Pro následný postup je důležité určit výši rizika vzniku vzdálených metastáz a postižení lymfatických uzlin. Při nízkém riziku (do 5 %) je karcinom vyléčitelný endoskopickou cestou. Pokud je však karcinom málo diferencovaný, vzdálenost maligních buněk od okraje resekátu je ≤ 1 mm či v histologickém preparátu detekujeme známky invaze do lymfatických cév, nelze endoskopický výkon považovat za suficientní a chirugická resekce je pak nezbytná [25].
Obr. 2. Přisedlý polyp s podpichem Patent Blue 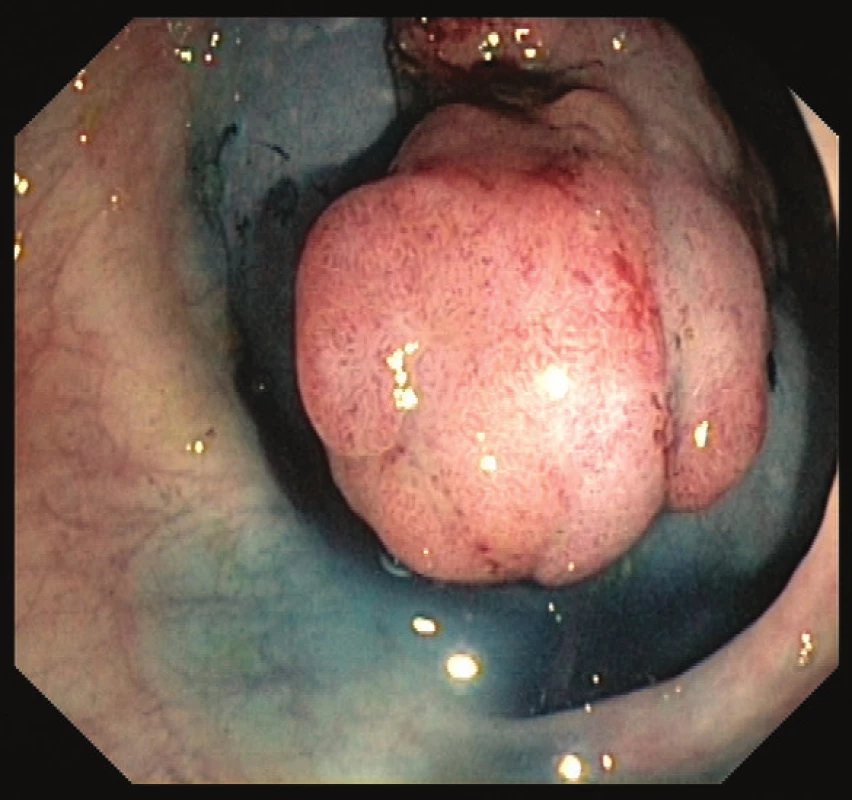
Obr. 3. Spodina po endoskopické mukozální resekci přisedlého polypu 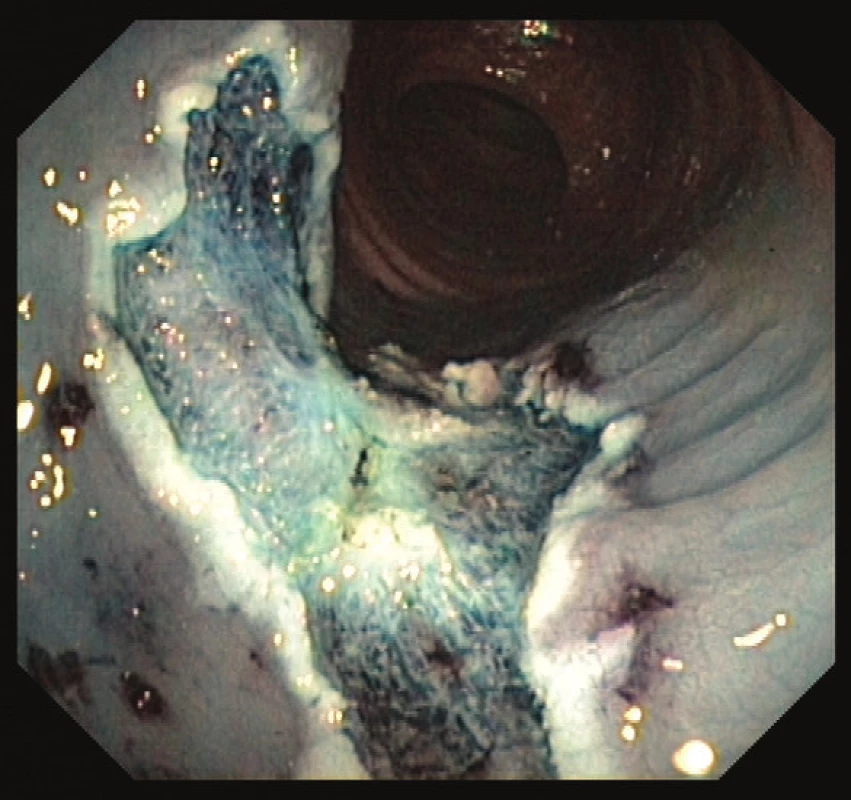
Závěr
Kolorektální karcinom je druhým nejčastějším nádorovým onemocněním jak v evropském měřítku, tak i v České republice, a to navzdory pomalému procesu karcinogeneze, který nám poskytuje dostatek času na rozpoznání přednádorových stadií a zabránění vzniku KRK cestou screeningového programu (TOKS, PSK). Dostatečná primární a sekundární prevence, cílená dispenzarizace vysokorizikových jedinců KRK a adekvátní endoskopická terapie přednádorových a časných nádorových lézí patří mezi základní atributy boje s tímto zhoubným onemocněním. Nutná je však komplexní mezioborová spolupráce všech odborností, které se na péči o pacienty s kolorektálním karcinomem podílejí.
MUDr. Gabriela Vepřeková
Interní klinika 1. LF UK a ÚVN-VFN Praha
U vojenské nemocnice 1200
160 00 Praha 6
e-mail: gabriela.veprekova@uvn.cz
Zdroje
1. Ferlay J, Shin H, Bray F, Forman D, Mathers C, Parkin D. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. International Journal Of Cancer 2010;127(12):2893–2917.
2. Lengauer C, Kinzler K, Vogelstein B. Genetic instabilities in human cancers. Nature 1998;396(6712):643–649.
3. Pino M, Chung D. The chromosomal instability pathway in colon cancer. Gastroenterology 2010;138(6):2059–2072.
4. Fearon E, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell. 1990;61(5):759–767.
5. Popat S, Hubner R, Houlston R. Systematic review of microsatellite instability and colorectal cancer prognosis. Journal Of Clinical Oncology: Official Journal Of The American Society Of Clinical Oncology 2005;23(3):609–618.
6. Hampel H, Frankel W, de la Chapelle A, et al. Screening for the Lynch syndrome (hereditary nonpolyposis colorectal cancer). The New England Journal Of Medicine 2005;352(18):1851–1860.
7. Boland C, Goel A. Microsatellite instability in colorectal cancer. Gastroenterology 2010;138(6):2073–2087.
8. Sinicrope F, Rego R, Witzig T, et al. Prognostic impact of microsatellite instability and DNA ploidy in human colon carcinoma patients. Gastroenterology 2006;131(3):729–737.
9. Leggett B, Whitehall V. Role of the serrated pathway in colorectal cancer pathogenesis. Gastroenterology 2010;138(6):2088–2100.
10. Chan A, Giovannucci E. Primary prevention of colorectal cancer. Gastroenterology 2010;138(6):2029–2043.
11. Jasperson KW, Tuohy TM, Neklason DW, Randall WB. Hereditary and Familial Colon Cancer, Gastroenterology 2010;138(6): 2044–2058.
12. Vepřeková G, Belšánová B, Levý M, Mináriková P, Lipská L, Zavoral M et al: Komplexní prezentace klinických a laboratorních dat u souboru 204 pacientů s KRCA, Gastroenterologie a hepatologie 2011, 65(Suppl 2),534.
13. Eliakim R, Yassin K, Adler S, et al. Prospective multicenter performance evaluation of the second-generation colon capsule compared with colonoscopy. Endoscopy 2009;41(12):1026–1031.
14. Spada C, Hassan C, Munoz-Navas M, et al: Second-generation colon capsule endoscopy compared with colonoscopy. Gastrointest Endosc 2011 Sep;74(3):581–589.
15. Zavoral M, Suchanek S, Fric P, et al. Colorectal cancer screening in Europe. World Journal Of Gastroenterology 2009;15(47): 5907–5915.
16. Seeff LC, Nadel MR, Klabunde CN, et al. Patterns and predictors of colorectal cancer test use in the adult U. S. population. Cancer 2004;100 : 2093–103.
17. Wexner SD, Beck DE, Baron TH, Fanelli RD, Hyman N, Shen B, Wasco KE. A consensus document on bowel preparation before colonoscopy: prepared by a task force from the American Society of Colon and Rectal Surgeons (ASCRS), the American Society for Gastrointestinal Endoscopy (ASGE), and the Society of American Gastrointestinal and Endoscopic Surgeons (SAGES). Surgical Endoscopy 2006; Vol.20 (7),1147–60.
18. Church JM. Effectiveness of polyethylene glycol antegrade gut lavage bowel preparation for colonoscopy—timing is the key! 1998;1223–5.
19. Hendry PO, Jenkins JT, Diament RH: The impact of poor bowel preparation on colonoscopy: a prospective single centre study of 10 571 colonoscopies. Colorectal Disease 2007;9 : 745–748.
20. Atkin W, Valori R, Kuipers EJ et al. Colonoscopic surveillance following adenoma removal. In: Segnan N, Patnick J, von Karsa L. European guidelines for quality assurance in colorectal cancer screening and diagnosis, 1st ed., European Union, 2010 : 274–297.
21. Chan A, Ogino S, Fuchs C. Aspirin and the risk of colorectal cancer in relation to the expression of COX-2. The New England Journal Of Medicine 2007;356(21):2131–2142.
22. Bertagnolli M, Eagle C. Adenoma Prevention with Celecoxib Study I, et al. Five-year efficacy and safety analysis of the Adenoma Prevention with Celecoxib Trial. Cancer prevention research, 2009; 2(4):310–321.
23. Labayle D, Fischer D, Attali P, et al. Sulindac causes regression of rectal polyps in familial adenomatous polyposis. Gastroenterology 1991;101(3):635–639.
24. Rossouw J, Anderson G: Writing Group for the Women’s Health Initiative I, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA: the journal of the American Medical Association 2002; 288(3):321–333.
25. Quirke P, Risio M, Lambert R. Quality assurance in pathology in colorectal cancer screening and diagnosis, In: Segnan N, Patnick J, von Karsa L. European guidelines for quality assurance in colorectal cancer screening and diagnosis, 1st ed., European Union, 2010 : 206–232.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Bodná poranění u dětí
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2012 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Močový katetr jako rizikový faktor vzniku urologických komplikací po TEP kolenního kloubu – retrospektivní analýza
- Farmakorezistentní epilepsie po kraniocerebrálním poranění
- Uzávěr stěny břišní po laparostomii s použitím negativního tlaku pro těžkou peritonitidu pomocí dynamické fasciální sutury – výsledky prospektivní randomizované studie
- Proč je dobré zachránit Rozhledy v chirurgii
- Bodná poranění u dětí
- 15th Annual meeting European society of Surgery
- Kolorektální karcinom v ČR – data minulá a budoucí
- Kolorektální karcinom
- Chirurgická léčba kolorektálního karcinomu
- Pohled na současnou bariatricko-metabolickou chirurgii
- Přínos neoadjuvantní a adjuvantní léčby v léčbě kolorektálního karcinomu
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Uzávěr stěny břišní po laparostomii s použitím negativního tlaku pro těžkou peritonitidu pomocí dynamické fasciální sutury – výsledky prospektivní randomizované studie
- Farmakorezistentní epilepsie po kraniocerebrálním poranění
- Chirurgická léčba kolorektálního karcinomu
- Přínos neoadjuvantní a adjuvantní léčby v léčbě kolorektálního karcinomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



