Metody odběru vzorku na kultivační vyšetření v chirurgické praxi, otiskové metody
Wound microbial sampling methods in surgical practice, imprint techniques
The wound is a damage of tissue. The process of healing is influenced by many systemic and local factors. The most crucial and the most discussed local factor of wound healing is infection. Surgical site infection in the wound is caused by micro-organisms. This information is known for many years, however the conditions leading to an infection occurrence have not been sufficiently described yet. Correct sampling technique, correct storage, transportation, evaluation, and valid interpretation of these data are very important in clinical practice.
There are many methods for microbiological sampling, but the best one has not been yet identified and validated. We aim to discuss the problem with the focus on the imprint technique.
Key words:
wound – infection – microbial sampling – filter paper pad
Autoři:
Z. Chovanec 1; L. Veverková 1
; M. Votava 2; J. Svoboda 2; A. Peštál 2; J. Doležel 1; V. Jedlička 1; M. Veselý 1; J. Wechsler 1; I. Čapov 1
Působiště autorů:
I. chirurgická klinika LF MU a Fakultní nemocnice u svaté Anny v Brně
přednosta: Prof. MUDr. I. Čapov, CSc.
1; Mikrobiologický ústav LF MU a Fakultní nemocnice u svaté Anny v Brně
přednosta: Doc. MUDr. F. Růžička, Ph. D.
2
Vyšlo v časopise:
Rozhl. Chir., 2012, roč. 91, č. 12, s. 654-659.
Kategorie:
Souhrnné sdělení
Souhrn
Rána je narušení soudržnosti tkáně kožního povrchu. Proces hojení je ovlivněn celou řadou celkových a lokálních faktorů, mezi nejzásadnější a nejdiskutovanější je řazena infekce v ráně. Za jakých okolností k infekci rány dojde, není zcela přesně objasněno.
V klinické praxi je velmi důležitý správný odběr vzorku na mikrobiologické zpracování, jeho skladování, transport, vyhodnocení a v neposlední řadě správná interpretace získané informace.
Přes existenci několika možných způsobů odebírání vzorků na kultivační vyšetření není dodnes jednoznačný postup odběru přesně definován. Cílem souhrnného sdělení je přiblížit danou problematiku se zaměřením na otiskovou metodu.
Klíčová slova:
rána – infekce – odběr vzorků – misky s filtračním papírem
ÚVOD
Kdy odebírat vzorky na mikrobiologické zpracování?
Kultivační vyšetření není vhodné provádět u všech pacientů uniformně [1], proto se většina odborníků přiklání k odběru vzorku z rány, která vykazuje známky lokálního zánětu [2]. Jedním z problémů je neexistence zcela objektivních a standardních testů sloužících k identifikaci infikované rány [3], i přes navrhnuté skórovací systémy zabývající se touto problematikou. Jako příklad uvádíme skórovací systém ASEPSIS [4] a systém navržený organizací CDC (Centers for Disease Control and Prevention [5].
Dle World Union of Wound Healing Societies’ Initiative je třeba odebrat vzorek na kultivační vyšetření, je-li splněno jedno z následujících kritérií, a to:
- akutní rána s příznaky infekce,
- chronická rána se znaky šířící se infekce,
- nehojící se chronická rána i po zavedené antimikrobiální terapii
- septický pacient, součastný odběr hemokultur a vzorků z potenciálně rizikových oblastí,
- chronické nehojící se rány u rizikových pacientů, např. diabetiků, pacientů s ICHDKK, imunosuprimovaných pacientů a pacientů léčených kortikoidy (World Union of Wound Healing Societies’ Initiative).
METODIKA
Jak odebírat vzorky?
Vzorky lze odebírat za pomocí invazivních a neinvazivních metod. Tkáňová biopsie a dermabraze jsou řazeny mezi invazivní techniky, kdy je odebírán malý vzorek viabilní tkáně z vyšetřované rány. Jde o poměrně přesné metody, v klinické praxi, málo rozšířené pro svoji bolestivost, invazivitu a náročnost mikrobiologického zpracování.
Stěrové techniky tampony vyrobenými z různorodých materiálů a otiskové metody náležejí mezi neinvazivní techniky. Díky své jednoduchosti je stěr nejpoužívanější vzorkovací metodou v klinické praxi, i přes nízkou validitu získaného výsledku ve srovnání s ostatními odběrovými technikami.
Odběr pomocí tkáňové biopsie
Tkáňová biopsie patří mezi invazivní techniky, jde o poměrně velmi přesnou metodu, v klinické praxi málo rozšířenou pro svoji bolestivost, invazivitu a náročnost při mikrobiologickém zpracování, jak bylo již uvedeno výše [6].
Vzorek je odebírán za aseptických kautel, zvážen, homogenizován a ředěn thioglykolem. Připravený roztok je naočkován na kultivační média. Počet vykultivovaných kolonií je vztažen na jeden gram vyšetřované tkáně. Vzhledem k provádění odečtu za 24–36 hodin od založení kultivace není vhodné tuto metodu používat k diagnostice akutních případů s hrozícím prodlením [7].
Pokud je ale provedena modifikace této metody, jsme schopni získat informaci stran bakteriální nálože do 15 minut od zpracování vzorku v mikrobiologické laboratoři, tato modifikovaná metoda se nazývá „rapid slide method“[8]. Odebraný vzorek z rány je zvážen, naředěn a homogenizován a suspenze o objemu 0,02 ml je nanesena na podložní sklíčko, kde je obarvena dle Grama. Preparát je po obarvení pozorován pod mikroskopem. Pokud jsou viděny mikroby, je bakteriální nálož hodnocena více než 105 na gram tkáně, pokud mikroby viděny nejsou, je bakteriální nálož méně než 105 [9]. V roce 1979 určil Bornside hranici mezi kritickou kolonizací a infekcí rány hodnotou 105 CFU/g nebo CFU/cm2 [10]. CFU (colony-forming unit) vyjadřuje počet životaschopných bakterií, vznikajících pomnožením jedné bakterie nebo shluku dvou či více od sebe neoddělitelných bakterií.
U chronických ran je doporučeno odebírat více vzorků z jedné rány, a to nejlépe z periferní a centrální části [11]. Dow považuje tkáňovou biopsii za „zlatý standard“ odběrových technik i s připuštěním její obtížné proveditelnosti v klinické praxi [12] a Kiernan poukazuje na možnost poranění vzorkované tkáně s možností zavlečení infekce hlouběji do rány a nutnosti určité zručnosti při provádění odběru [13]. Kultivační výsledek tkáňové biopsie je kvantitativní, získáváme informaci ohledně nálože (denzity) mikrobů na gram tkáně.
Odběr pomocí stěrového tamponu
Odběr provedený pomocí stěrového tamponu je řazen mezi neinvazivní, velmi praktickou a nejčastěji používanou metodu odběru vzorku z povrchu rány. Pokud jsou dodrženy správné zásady odběru, je získána informace dostatečně validní, i když není tato metoda řazena mezi nejpřesnější. Teorii získání informace ohledně mikrobiálního osídlení pouze povrchu a nikoliv hloubky rány popírají některé studie, jež zdůrazňují promíchání mikroorganismů v ráně [14]. Nesmíme ale zapomínat na přítomnost biofilmu, strukturovaného mikrobiálního společenství uloženého v mezibuněčné hmotě, na povrchu chronických ran.
V minulosti byly používány stěrové tampony napuštěné živočišným uhlím nebo sérem [15]. Cuzzell a Bowler popisují používání alginátových tamponů. Tampony byly po setření rány přemístěny do předem připraveného roztoku, v němž se rozpustily, a došlo k uvolnění všech mikroorganismů nasáklých během provedeného stěru [16, 17]. Výsledek je plně kvantitativní. Vzhledem k nerutinnímu používání jsou výsledky získané pomocí této stěrové metody přinejmenším diskutabilní [17].
Za standardní stěr je považován stěr provedený pomocí vatového tamponu, který je transportován do mikrobiologické laboratoře v transportním Amisově médiu. Před odběrem je doporučeno ránu očistit pomocí fyziologického roztoku nebo sterilní vody [18]. Vzhledem k přítomnosti NaCl ve fyziologickém roztoku, zvýhodňující přežívání některých mikrobů (zejména stafylokoků), se přikláníme k použití sterilní vody při oplachu rány. Rána je zbavena nečistot a nekrotických částí šetrným débridementem. Ke kvalitnějšímu odběru je doporučeno u suchých ran provést zvlhčení tamponu sterilním roztokem.
Pokud je prováděn odběr u rozsáhlých rán, není nutno stírat celou ránu, minimální plocha odběru je 1 cm2, za současného odběru vzorku z okraje a středu rány. Vzorek je vhodné zpracovat v mikrobiologické laboratoři co nejdříve, ideální je do 4 hodin po provedeném odběru. Výsledek je kvalitativní, získáme informaci ohledně jednotlivých druhů mikroorganismů.
Odběr pomocí aspirace jehlou
Aspirace tenkou jehlou je používána při odběru vzorků z ohraničených ložisek vyplněných tekutinou. Nedochází při ní k výrazné traumatizaci pacienta a je sníženo riziko kontaminace. Jedná se o relativně přesnou metodu, v literatuře popisovanou jako vhodnou k odebrání vzorků určených k anaerobní kultivaci. Johnson nicméně prokázal přesnější výsledky kultivace anaerobů z bércových vředů provedením stěru než jehlovou aspirací [19]. Výsledek kultivačního vyšetření je kvalitativní.
Molekulárně biologické metody
V poslední dekádě došlo k velkému rozmachu využití molekulárně-genetických metod v klinické mikrobiologii. Nejčastěji využívanou metodou je pravděpodobně polymerázová řetězová reakce (PCR) v různých uspořádáních, v reálném čase, s analýzou velikosti produktu na agarózovém gelu, s vyhodnocením hybridizací výsledného produktu atp. Následně se do rutinní diagnostické praxe dostávají i „složitější“ metody, jakými jsou např. sekvenace DNA nebo in situ hybridizace.
Lze zaznamenat, že je molekulárně-genetickým metodám přisuzována větší role, než je z obecně platných zákonitostí oboru možné. Jsou-li těmito metodami prokazovány obligátní patogeny, bývá interpretace výsledků snazší. Pokud však prokazujeme patogeny fakultativní, což reprezentuje převážnou část bakteriologické a mykologické diagnostiky, nemusí být interpretace výsledků snadná. Vždy je nutné vzít v úvahu, že se jedná o vzájemnou interakci dvou (případně více) živých organismů – mikrobiálního agens a hostitele.
Na 1. výročním zasedání Společnosti pro lékařskou mikrobiologii ČLS JEP konaném ve dnech 19. a 20. 6. 2009 byl iniciován vznik pracovní skupiny, která se bude zabývat aplikací molekulárně-genetických metod v klinické mikrobiologii. PSMM – TIDE (Pracovní skupina molekulární mikrobiologie, Taxonomie, Identifikace, Diagnostika, Epidemiologie) [20].
Odběr pomocí otiskové metody
Principem odběru, jak již napovídá název, je provedení otisku z povrchu rány. Otisk může být proveden přímo, a to přímým otisknutím např. plotny s krevním agarem, nebo nepřímo za pomocí transportního média.
V roce 1980 publikoval Craythorn práci srovnávající jednotlivé typy otiskových technik, srovnával výsledky kultivačních nálezů získaných pomocí techniky používající filtrační papír, Rhodac plate techniky, velvet pad imprint techniky, velveteen pad imprint techniky a velvet pad rinse techniky. Výše popisovanými metodami byl prováděn odběr z uměle infikovaného povrchu kmenem Staphyloccocus aureus a Escherichia coli [21].
V následujícím textu bude stručně vysvětlen princip jednotlivých otiskových metod.
Replica plating – volně přeloženo jako „kopie vzniklá pokovováním“. Tato technika byla původně představena bratry Lederbergovými v roce 1952. Jedná se o techniku přenosu mikroorganismů z jednoho povrchu na jiný (na kultivační a selektivní půdy) za použití sterilní bavlněné látky o rozměrech 12x12 cm umístěné na kruhový válec o průměru 9 cm. Látka byla k válci připevněna pomocí kovového kroužku. Nejprve byl proveden otisk látky na vyšetřovací plochu a poté byla látka otisknuta na kultivační médium. Tato metoda sloužila k záchytu mutací kmene E. coli rezistentních k streptomycinu a bakteriofágům a položila základ k vývoji dalších otiskových metod [22].

Rhodac plate (Rhodac misky) - Replicate Organism Detection And Counting. Rhodac misky slouží k současnému pomnožení, identifikaci a počítání kultivovaných mikroorganismů. Většinou se jedná o mírně konvexní plotny s agarem (17 ml základu Columbia agar). Agarové plotny jsou přímo otisknuty na kontaminovaný (vyšetřovaný povrch) na dobu pěti sekund, poté jsou transportovány do mikrobiologické laboratoře a kultivovány za standardních podmínek [23].
Velvet pad a velveteen pad imprint (VPI) – při této technice jsou k otisku použity kousky hedvábí (velvet pad) nebo bavlny (velveteen pad) o velikosti 20x45 mm, které jsou zvlhčeny ponořením do 0,85% roztoku NaCl. Po zbavení přebytečné tekutiny protřepáním jsou přiloženy na vyšetřovanou plochu po dobu pěti sekund a následně přeneseny na kultivační médium (krevní agar) [24]. Poprvé byla tato technika v modifikované podobě použita Gorrillem a Penikettem v roce 1957 [25].
Velvet pad rinse – v roce 1975 publikoval Raahave výsledky svého výzkumu, srovnávajícího techniku „velvet pad rinse technique“ (VPR) s výše popisovanou metodou „velvet pad imprint“ (VPI).
U VPR metody byl hedvábný proužek otisknut na vyšetřovanou plochu a poté přemístěn do 300 ml 0,9% roztoku NaCl v Erlenmeyerově nádobě. Obsah nádoby byl míchán deset minut, poté byl třicet minut centrifugován při 3000 otáčkách/minuta. Supernatant byl odstraněn a sediment nanesen pomocí skleněné tyčinky na krevní agar. Kultivace byla prováděna za standardních podmínek [26]. Po zpracování výsledků byly VPR technikou zachyceny bakterie u 76,7 % na rozdíl od VPI metody, kdy byl mikrobiální záchyt pouze u 24,5 % vzorků.
Membrane filter paper – přenos pomocí sterilní filtrační membrány. Tradičně se membránové filtry využívají k mikrobiální analýze odpadních vod. Při vzorkování vlhkých povrchů, tedy i ran, je filtrační papír umístěn na povrch rány, kdy dochází k nasátí a zachycení mikroorganismů v pórech filtračního papíru. Podíl na zachycení mikroorganismů mají nejen fyzikální, ale i elektrostatické sily. Filtrační papír je na vyšetřovaném povrchu ponechán po dobu pěti sekund a poté umístěn na kultivační médium. Použité filtrační papíry lze dělit dle velikostí pórů, jež se pohybuje v rozmezí (0,45–5 μm) [21].
Craythorn prokázal vyšší citlivost otiskové techniky za použití filtračního papíru ve srovnání s výše popisovanými technikami. Pomocí filtračního papíru bylo zachyceno 90 % mikroorganismů oproti 50 % při použití Rhodac plate techniky, 9 % a 27 % při použití velvet pad imprint a velvet pad rinse techniky. Výsledek získaný pomocí otiskové metody byl dokonce srovnatelný s výsledkem tkáňové biopsie. Oproti biopsii se jedná o odběrově jednodušší a mikrobiologicky snadněji zpracovatelnou metodu [21].
Otisková technika za použití filtračního papíru jako transportního média
Studii popisující srovnání nepřímé otiskové metody za použití filtračního papíru s jinými vyšetřovacími metodami prezentovala Kristine GjŅdsbŅl se svými kolegy v roce 2012. Srovnávala otiskovou metodu za použití filtračního papíru s výtěrovkou (stěrem) a tkáňovou biopsií. Srovnáním a statistickým zpracováním 46 vzorků odebraných z chronických bércových vředů nebyl shledán signifikantní rozdíl v kultivačních nálezech. Nejčastěji vykultivovaným mikrobem byl Staphyloccocus aureus 89,1 %, pak Enterococcus faecalis 56,5 % a jako třetí nejčastější byla P. aeruginosa 47,8 %. Před odběrem bylo provedeno omytí rány sterilní vodou, débridement nebyl prováděn [27].



Rusannen ve své studii srovnával otiskovou metodu za použití filtračního papíru s výtěrovkou při vzorkování sliznice dutiny ústní. Odběr byl proveden u 14 dobrovolníků. Pomocí otiskové metody bylo zachyceno signifikantně více druhů kolonií mikroorganismů nežli při výtěru [28].
V České republice se otiskovou metodou zabývá Dr. Toršová z antibiotického střediska, Zdravotního ústavu v Ostravě, která se podílela na vývoji této vyšetřovací metody a zavedla tuto techniku do praxe v popáleninových centrech ČR i SR v rámci bakteriologického screeningu popálenin, ambulancí cévní chirurgie a specializovaných pracovišť pro léčbu ran [29].
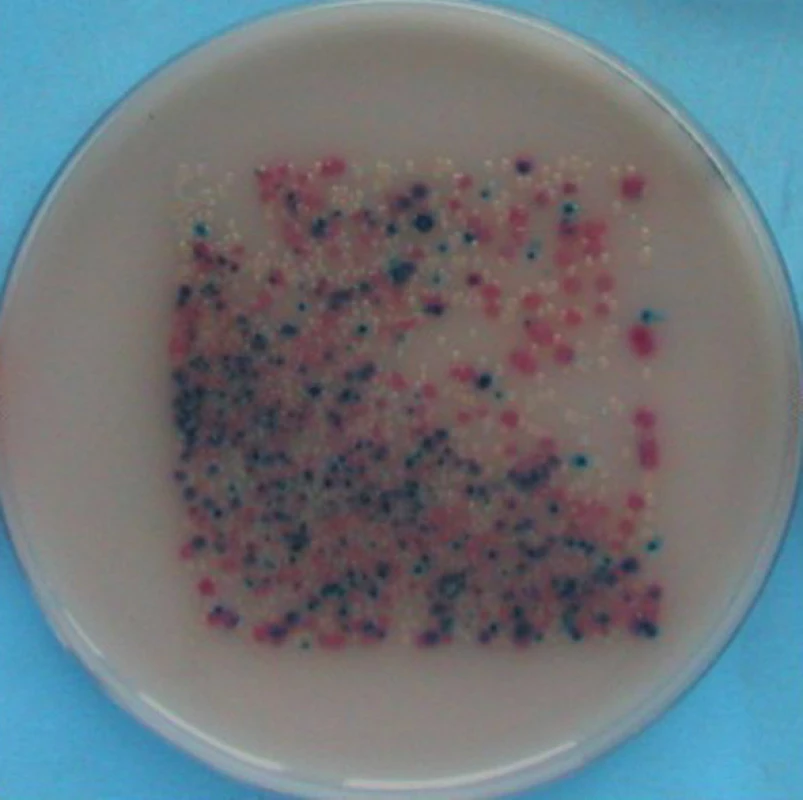
Ve studii provedené na I. CHK FNUSA v letech 2008 až 2012 bylo srovnáno 172 vzorků odebraných z chirurgických ran. Kultivační nález z otiskové metody byl mnohem signifikantnější nežli výsledek získaný pomocí klasické stěrové metody. Nejčastějším kultivačním nálezem byly na otisku Escherichia coli, Pseudomonas aeruginosa a Staphylococcus sp., koaguláza negativní.
Závěr
Velké procento bakterií vyskytujících se v ráně není možno vykultivovat. Selhání izolace bakteriálního kmene z rány je dáno nemožností vytvořit vhodné růstové podmínky. Uměle vytvořená kultivační média mají obvykle nedostatek růstových faktorů a mnohá mohou obsahovat látky, jež působí na některé druhy mikroorganismů inhibičně nebo dokonce toxicky.
V praxi rutinně používaná stěrová technika přináší méně validní informaci ohledně kultivačního nálezu nežli tkáňová biopsie, nicméně díky své jednoduché a rychlé proveditelnosti si dodnes udržuje své výsostné postavení v chirurgické praxi.
Molekulárně-genetické metody našly nezastupitelné místo v diagnostické praxi klinické mikrobiologie, přesto je nutné jejich indikaci s následnou interpretací hodnotit se znalostí veškerých limitů, jako je tomu v případě ostatních mikrobiologických technik. Je nutné brát v potaz také náklady na prováděné vyšetření.
Nevýhodou otiskové metody je nutnost přípravy krevního agaru s filtračním papírem 24 hodin před plánovaným odběrem. Otisk je možno použít maximálně do jednoho měsíce po vydání z mikrobiologické laboratoře, má tedy oproti stěru kratší expirační dobu, k jeho skladování je nutný chladicí box a k provedení odečtu erudovaný mikrobiologický tým. Vzhledem k rozměrům filtračního papíru používaného při otisku není vhodné tuto metodu aplikovat u všech typů ran, nejvhodnější uplatnění má u plošných ran.
Specificita otisku a biopsie je na srovnatelné úrovni, výhoda otisku tkví v jeho neinvazivitě a nebolestivosti při odběru. Získaný výsledek je semikvantitativní, z čehož plyne, že získáváme informaci nejen o druhu vykultivovaných mikroorganismů, ale i jejich množství v ráně, tedy náloži vyjádřené počtem životaschopných kolonií (CFU – colony forming unit). Díky semikvantitativitě jsme schopni sledovat dynamiku mikroorganismů v ráně a v závislosti na výsledku adekvátně reagovat změnou terapie v reálném čase, například změnou lokálních antiseptik. Obzvláště velkou výhodu shledáváme při využití otiskové metody u sekundárně se hojících ran před plánovanou resuturou.
Žádná vzorkovací metoda není stoprocentní a k jednotlivým metodám je třeba přistupovat se znalostí jejich veškerých limitů.
MUDr. Zdeněk Chovanec
Moravská 62
696 11 Mutěnice
e–mail: zdenek.chovanec@fnusa.cz
Zdroje
1. Stryja J. Repetitorium hojení ran. 1. vydání, Semily, GEUM 2008.
2. Cutting KF, White RJ, Mahoney P. Clinical identification of wound infection: a Delphi approach. In: EWMA Position Document. Identifying criteria for wound infection. London, MEP Ltd, 2005.
3. Bruce J, Russell EM, Mollison J et al. The quality of measurement of surgical wound infection as the basis for monitoring: a systematic review. Journal of Hospital Infection 2001; 49(2): 99–108.
4. Wilson APR, Treasure T, Sturridge MF et al. A scoring method (ASEPSIS) for postoperative wound infections for use in clinical trials of antibiotic prophylaxis. The Lancet 1986;1(8476): 311 –313.
5. Horan TC, Gaynes RP, Martone WJ et al. CDC definitions of nosocomial surgical site infections, a modification of CDC definitions of surgical wound infections. American Journal of Infection Control 1992;20(5):271–274.
6. Benbow, M. Wound swabs and chronic wounds. Practice Nurse 2010;39(9):27.
7. Rondon MC. Lessons gleaned from the sport of wound watching. Wound Repair Regeneration 1999;7 : 2–6.
8. Heggers JP, Rondon MC. Quantitative bacteriology: its role in the armamentarium of a surgeon. 1st edition Boca Raton (Florida, USA), CRC Press 1991 : 1–139.
9. Rondon MC. Wound infection. A failure of wound healing caused by an imbalance of bacteria. Surgical Clinic of North America 1997;77 : 637–650.
10. Bornside GH, Bornside BB. Comparison between moist swab and tissue biopsy methods for quantisation of bacteria in experimental incisional wounds. Journal of Trauma 1979;19 : 103–105.
11. Schneider M, Vildozola CW, Brooks S. Quantitative assessment of bacterial invasion of chronic ulcers. Statistical analysis. American Journal of Surgery 1983;145 : 260–262.
12. Dow G, Browne A, Sibbald RG. Infection in chronic wound: controversies in diagnosis and treatment. Osteotomy wound manager 1999;45(8):23–40.
13. Kiernan, M. Role of swabbing in wound infection management. Community Nurse 1998;4(6):45–46.
14. Laing P. Diabetic foot ulcers. American Journal of Surgery 1994;167 : 31–36.
15. Gilchrist B. Wound infection. Sampling bacterial flora: a review of literature. Journal of Wound Care 1996;5 : 386–8.
16. Cuzzell JZ. The right way to culture a wound. American Journal of Nursing 1993;93(5):48–50.
17. Bowler PG, Duerden BI. Armstrong DG. Wound microbiology and associated approaches to wound management. Clinical Microbiology Reviews 2001;14 : 244–269.
18. Thomson PD, Smith DJ. What is infection? American Journal of Surgery 1994;167 : 7–11.
19. Johnson S, Lebahn F, Peterson LR et al. Use of an anaerobic collection and transport swab device to recover anaerobic bacteria from infected foot ulcers in diabetics. Clinical Infection Disease 1995;20 : 289–290.
20. Hrabák J, Bunček M, Denis M et al. Aplikace metod molekulární genetiky v klinické mikrobiologii: Zpráva z jednání Pracovní skupiny molekulární mikrobiologie TIDE. Epidemiologie, Mikrobiologie, Imunologie 2010;59 : 103–106.
21. Craythorn JM, Barbour AG, Matsen JM et al. Membrane Filter Contact Technique for Bacteriological Sampling of Moist Surfaces. Journal of Clinical Mikrobiology 1980;12(2):250–255.
22. Lederberg J, Lederberg EM. Replica plating and indirect selection of bacterial mutants. Journal of Bacteriology 1952;63(3):399.
23. Raahave D. Agar contact plates in evaluatix skin-disinfection. Dan Med Bull 1973;20 : 204–208.
24. Holt RJ. Pad culture studies on skin surface. Appl Bacteriol 1966;29 : 625–630.
25. Gorrill RH, Penikett EJK. New Method of studying the bacterial flora of infected open wounds and burns. Lancet 1957;II: 370–372.
26. Raahave, D. Bacterial density in operation wounds. Acta Chirurgica Scandinavia 1974;140 : 585–593.
27. Gjødsbøl K, Skindersoe ME, Christensen JJ et al. No need for biopsies: comparison of three sample techniques for wound microbiotics determination. Int. Wound Journal 2012;9 : 295–302.
28. Rusanen P, Siikala E, Uittamo J et al. A novel method for sampling the microbiota from the oral mucosa. Clin Oral Investig 2009;13(2):243–6.
29. Toršová V, Piegzova L. Nový pohled na léčbu ran z mikrobiologického hlediska, Kongres s vlídnou tváří, konference sestra v akci, Olomouc 2008, Solen 4–5.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicínaČlánok vyšiel v časopise
Rozhledy v chirurgii

2012 Číslo 12
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
Najčítanejšie v tomto čísle
- Upside down stomach
- STARR operace v léčbě rektokély a intususcepce rekta
- Klasifikace chirurgických komplikací: analýza vlastní skupiny nemocných
- Chirurgická terapie chronické pankreatitidy
