-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
GIST: Novodobé poznatky a léčebné modality
GIST: Current knowledge and treatment modalities
GISTs represent a specific group of mesenchymal tumors with unpredictable biological features. Approximately 30% of newly diagnosed GIST tumors are malignant or have a high potential for malignancy. Currently, GISTs are routinely identified using histological, immunohistochemical, and molecular genetic assays. However, clinical diagnosis, particularly of small or intramural GISTs, might be difficult. Endoscopic examinations and fused PET/CT imaging are the most useful techniques for imaging and monitoring the disease progression.
Surgical treatment is the first-line treatment and the only method that might lead to full remission in patients with primary GISTs. At the present time, there is no consensus on the issues whether to perform resections in patients with positive margins and resections of metastases. Biological therapy with imatinib mesylate is recommended in patients with newly diagnosed, locally advanced, inoperable, or metastasizing gastrointestinal GISTs that express the c-KIT protein. Treatment may reduce a primary tumor to a size small enough for surgical excision. Current research is focused on the development of new therapies for the treatment of advanced disease and/or disease prophylaxis.Key words:
stromal – tumor – morphology – diagnostics – treatment
Autori: J. Páral 1,2; P. Lochman 1,2; H. Kalábová 3; D. Hadži-Nikolov 4
Pôsobisko autorov: Katedra válečné chirurgie, Fakulta vojenského zdravotnictví Hradec Králové, Univerzita obrany Brno, vedoucí katedry: Doc. MUDr. Leo Klein, CSc. 1; Chirurgická klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy v Hradci Králové, přednosta: Prof. MUDr. Alexander Ferko, CSc. 2; Klinika onkologie a radioterapie, Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy, v Hradci Králové, přednosta: Prof. MUDr. Jiří Petera, Ph. D. 3; Fingerlandův ústav patologie, Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy, v Hradci Králové, přednosta: Prof. MUDr. Aleš Ryška, Ph. D. 4
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 4, s. 189-198.
Kategória: Souhrnné sdělení
Súhrn
GIST představují zvláštní skupinu mezenchymálních nádorů s nejistým biologickým chováním. Přibližně 30 % nově diagnostikovaných GIST je maligních nebo s vysokým maligním potenciálem. Stanovení klinické diagnózy, především malých a intramurálně uložených tumorů, může být obtížné. Kromě endoskopických vyšetření je dnes za nejužitečnější zobrazovací vyšetření možné považovat hybridní kombinaci PET/CT vyšetření, a, to i z pohledu sledování vývoje onemocnění. Histologické, imunohistochemické a molekulárně genetické určení GIST je dnes rutinní záležitostí.
U pacientů s primárním GIST je chirurgická léčba metodou první volby a jedinou metodou, která může vést k úplnému vyléčení. Otázka reresekcí v případě pozitivních okrajů a provádění resekcí metastáz není dosud jednoznačně zodpovězena. Biologická léčba imatinibem mesylátem je doporučena u pacientů s nově diagnostikovaným lokálně pokročilým, inoperabilním nebo metastatickým GIST zažívacího traktu s pozitivním c-kit proteinem. Léčba může primární tumor zmenšit natolik, že původně inoperabilní nález může být chirurgicky radikálně odstraněn. Současný výzkum je zaměřen na hledání nových preparátů, které by umožnily léčbu pokročilého onemocnění nebo léčbu profylaktickou.Klíčová slova:
stromální – tumor – morfologie – diagnostika – léčbaÚvod
Do skupiny gastrointestinálních stromálních tumorů (GIST) jsou řazeny neepitelové nádory trávicího traktu tvořené vřetenitými nebo epiteloidními buňkami nebo jejich kombinací. Původ nádorů je předpokládán v progenitorové buňce, tj. v buňce s úzkým diferenciačním potenciálem většinou již bez schopnosti sebeobnovování, která se diferencuje směrem k tzv. Cajalovým buňkám. Cajalovy intersticiální buňky jsou součástí střevní stěny a generují pomalé peristaltické vlny trávicího traktu („peristaltické pacemakery“) [1].
Přestože jsou GIST nejčastějšími mezenchymálními nádory trávicího ústrojí (60 %), z celkového počtu nádorů trávicího traktu představují přibližně jen 2–5 % [2]. Roční incidence se odhaduje na 10 až 20 případů na 10
6 obyvatel. Medián průměrného věku při stanovení diagnózy je 60–69 let [3]. Vzácně se tyto nádory vyskytují u mladých dospělých, u dětí jsou naprosto ojedinělé (< 1 %) [4].
Historický přehled
Historicky byl GIST zpočátku řazen mezi leiomyocelulární nádory a označován jako leiomyom, bizarní leiomyom, leiomyoblastom nebo leiomyosarkom [5]. V roce 1983 byl Mazurem a Clarkem vyčleněn jako samostatná jednotka pod názvem „stromální tumor“ [6]. Tato skupina nádorů zahrnovala mezenchymální tumory trávicího traktu, které nevykazovaly známky neurogenní ani hladkosvalové diferenciace.
Podobnost buněk GIST s Cajalovými buňkami střevní stěny vedla k vzniku hypotézy o původ GIST z těchto buněk [7, 8]. Pro tumory pak byl navržen název GIPACT (Gastro Intestinal Pacemaker Cell Tumor), který se však v literatuře neujal [9].
V roce 1998 byla imunohistochemicky zjištěna pozitivita nádorových buněk GIST na přítomnost KIT proteinu (CD117) [10]. Transmembránový buněčný KIT-protein je cytokinovým receptorem, jehož intracelulární část funguje jako tyrozinkináza. KIT protein je kódován genem kit. KIT byl poprvé izolován jako onkogen v-kit z Hardyho-Zuckermanova retroviru kočičího sarkomu 4 (feline sarcoma viral oncogen v-kit) [11]. Samotný název KIT byl odvozen od anglického slova „kit“ – kotě. Protoonkogen c-kit byl poté prokázán i u člověka. Lidský c-kit je lokalizován na dlouhém raménku 4. chromozomu a sestává z 21 exonů [12].
Poznámka: Protoonkogen je buněčný gen, který může být modifikován tak, že vzniká onkogen způsobující maligní bujení.
V roce 1998 Hirohita a kol. prokázali ve většině GIST přítomnost aktivačních mutací („gain-of-function“) genu KIT (c-kit) [13]. V následujících letech byl termín GIST vyhrazen pouze pro ty tumory, které (kromě obvyklých morfologických znaků) vykazovaly pozitivitu v imunohistochemickém průkazu KIT.
V roce 2003 Heinrich a kol. nalezli u pacientů s GIST bez mutace genu c-kit aktivační mutaci genu PDGFR-α (platelet derived growth factor receptor alpha) [14]. Pozdější studie potvrdily přítomnost těchto mutací ve 30–60 % KIT-imunonegativních tumorů, které splňují histologická kritéria GIST [15]. Imunopozitivita KIT tedy již není považována za podmínku pro stanovení diagnózy GIST.
Dalším historicky významným mezníkem byl rok 2001, kdy byl do léčby metastatického GIST zaveden imatinib mesylát. Imatinib je selektivní inhibitor tyrozinkináz včetně KIT a PDGFR-α a jeho účinnost v léčbě byla již v témže roce prokázána dvěma nezávislými klinickými studiemi [16].
Morfologie
Makroskopický nález
Při lokalizaci v trávicí trubici vycházejí tumory z podslizničních částí gastrointestinální stěny, nejčastěji z muscularis propria, a vyklenují se většinou do lumina, případně na serózní povrch postiženého orgánu. Často dochází k ulceraci přilehlé sliznice. Tumory bývají dobře ohraničené, někdy s tenkou pseudokapsulou, z níž mohou do nádoru vybíhat septa rozdělující jej na pseudolobuly. Konzistence nádorů je většinou elastická. Struktura na řezu bývá homogenní až vláknitá, barva bílá. Sekundárně může být tento obraz změněn regresivními změnami charakteru nekrózy, prokrvácení, kalcifikace nebo pseudocystické přeměny [1]
Mikroskopický nález
Konvenční světelná mikroskopie ve většině případů umožňuje stanovit diagnózu GIST s vysokou mírou jistoty ještě před provedením imunohistochemického vyšetření. GIST se rozdělují na dvě hlavní skupiny: vřetenobuněčné a epiteloidní. Tyto dva druhy buněk mohou být uspořádány fascikulárně, strioformně, difúzně, alveolárně nebo vytvářet organoidní struktury. Tumory také často mají plelomorfní charakter [1, 14].
Vyšetření elektronovou mikroskopií nemá v současné době, při všeobecné dostupnosti imunohistochemického a molekulárně genetického vyšetření, zásadní diagnostický ani prognostický význam [18].
Molekulární genetika
Gen c-kit
Gen c-kit je lokalizován na dlouhém raménku 4. chromozomu a kóduje transmembránovou tyrozinkinázu. Produkt genu c-kit hraje významnou roli ve vývoji mastocytů, melanocytů, kmenových buněk bílé i červené krevní řady, germinálních buněk a Cajalových buněk [19]. Kromě GIST bylo široké spektrum mutací tohoto genu nalezeno u řady jiných neoplastických procesů (myeloproliferativní onemocnění, akutní myeloidní leukemie, mastocytóza, lymfomy nasálních sinů) [13, 20]. Mutace c-kit byla prokázána téměř ve všech GIST menších než 1 cm, což potvrzuje, že jde o časnou onkogenní událost (21). Obecně je mutace genu c-kit u pacientů s GIST nalézána v 75–80 % případů, zejména mutace v exonu 11 (cca 69 %) a v exonu 9 (cca 10 %) [22].
Mutace genu c-kit se vyskytují i v exonech 13 a 17, které kódují doménu s tyrozinkinázovou aktivitou. Receptory pro tyrozinkinázy mohou být terčem pro cílenou terapii jejich specifickými inhibitory. V současné době je z pohledu terapie nejdůležitějším inhibitorem imatinib mesylát, původně vyvinutý pro léčbu chronické myeloidní leukemie. Imatinib mesylát selektivně inhibuje i tyrozinkinázy KIT a PDGFR-α [1, 16].
Gen kódující PDGFR-α
Gen kódující PDGFR-α je lokalizován na dlouhém raménku 4. chromozomu v těsné blízkosti c-kit genu a má s ním velmi podobnou strukturu. Hlavní funkcí proteinu PDGFR-α je zprostředkování proliferace a diferenciace gliových a mezenchymálních buněk. PDGFR-α je in vitro rovněž selektivně inhibován imatinib mesylátem [14, 23]. Aktivující mutace PDGFR-α se nacházejí u 5–10 % GIST [22].
Imunohistochemické vyšetření
Imunohistochemické stanovení KIT proteinu (CD117) metodou ELISA (Enzyme-Linked ImmunoSorbent Assay) je považováno za standard při určování diagnózy GIST, negativita však tuto diagnózu nevylučuje. Vyšetření CD117 je u GIST obecně většinou pozitivní, negativní je asi u 5 % GIST. Mutační analýza známých mutací c-kit a pdgfr-α genů mohou diagnózu GIST potvrdit zejména v těch případech, kdy je CD117 negativní. Kromě diagnostické má mutační analýza také prediktivní a prognostickou hodnotu, takže je doporučeno ji provádět při diagnostice všech GIST [24]. Navíc má výsledek mutační analýzy vliv na stanovení onkologické léčby - dávka 800 mg imatinib mesylátu je doporučena u pacientů s mutací exonu 9, přičemž ve všech ostatních případech se doporučuje dávka 400 mg imatinib mesylátu [24].
Vyšetření mutací c-kit a pdgfr-α se provádí metodou teplotní gradientové gelové elektroforézy nebo metodou přímého sekvenování, tj. určení přímé sekvence nukleotidů DNA. Metoda sekvenování je založena na inkorporaci fluorescenčně značených dideoxynukleotidů, každý dideoxinukleotid má navázaný jiný fluorochrom, který je možné odlišit na základě různých emisních spekter [25].
Pokud má tumor charakteristickou morfologii, není za nezbytnou podmínku diagnózy GIST považována exprese KIT proteinu ani absence mutace genů c-kit a případně pdgfr-α . U těchto nádorů se potom GIST stává diagnózou po vyloučení ostatních mezenchymálních lézí trávicího traktu [1]. Exprese KIT proteinu chybí zhruba u 4–15 % GIST. To může komplikovat diagnózu GIST u pacientů, kteří mohou mít prospěch z léčby receptor inhibitory tyrozinkinázy [26].
V nedávné době byl nalezen nový gen označovaný jako DOG1, který je exprimován většinou GIST. Název „DOG1“ pochází z názvu protilátky proti specifickému GIST-genu, který kóduje hypotetický protein FLJ10261 a který byl pojmenován „Discovered On GIST 1“ (objeven na GIST 1) [27]. DOG1 může mít vliv na vznik a růst GIST, může být diagnostickým markerem i terapeutickým cílem. Pomocí imunohistochemické zkoušky DOG1 za pomoci specifického antiséra a in situ hybridizace bylo prokázáno, že vysokou expresi DOG1 mají netypické, KIT-negativní GISTy [26, 27].
Recentní studie prokázaly, že DOG1 je pro stanovení GIST citlivý imunohistochemický marker srovnatelný s KIT, navíc průkazný u 36 % KIT-negativních GIST. DOG1 je také citlivý ukazatel neobvyklých podskupin GIST, u kterých chybí KIT protein nebo PDGFR-α mutace [26, 27].
Zvláštní klinické varianty GIST
Kromě běžných GIST tumorů, které se vyskytují převážně v dospělém věku, existuje heterogenní skupina nádorů morfologicky identických s GIST, které mají specifický klinický obraz a biologické vlastnosti.
Familiární GIST
Familiární GIST je vzácné, autozomálně dominantně dědičné onemocnění s penetrací téměř 100 % [28]. Postiženými buněčnými populacemi jsou kromě Cajalových buněk také melanocyty a žírné buňky (mastocyty), což má za následek různé kombinace hyperplastických změn a nádorových proliferací. V posledních letech bylo popsáno několik případů rodin postižených familiárním GIST. U postižených byla nejčastěji prokázána dědičná KIT zárodečná mutace. U jedné rodiny s familiárním GIST byla identifikována PDGFR-α dědičná zárodečná mutace [29]. V GIST rodinách bývá postiženo více příbuzných, u nichž se vyskytují vícečetné primární nádory, které se ve srovnání se sporadickým pediatrickým GIST (viz níže) objevují v pozdějším mladším věku. Postižení navíc mívají široké spektrum postižení kůže včetně melanomů, benigních melanocytových névů a dalších různorodých kožních lézí (urticaria pigmentosa, kávové skvrny – „café-au-lait“, periorální hyperpigmentace apod.) [28].
V jedné rodině s familiárním výskytem GIST spojeným s dysfagií byla objevena nová mutace v genu KIT. Členové rodiny trpěli polykacími obtížemi bez prokazatelné mechanické obstrukce nebo dilatace jícnu. Endosonografickým vyšetřením bylo prokázáno hyperechogenní zbytnění v oblasti přechodu jícnu a kardie v prostoru mezi cirkulární a podélnou svalovinou jícnu způsobenou hyperplazií intersticiálních Cajalových buněk myenterického plexu. Jícnová manometrie prokázala nízký klidový tlak dolního svěrače jícnu a abnormální kontrakce jícnu bez přítomnosti normální peristaltiky. Tyto nálezy také prokázaly, že dysfagie postižené rodiny není zapříčiněna achalázií, která může mít podobné klinické projevy [30].
Carneyho trias
Carneyho trias je definováno jako nefamiliární syndrom neznámé etiologie zahrnující přítomnost GIST (většinou lokalizovaného v žaludku), plicního chondromu a extraadrenálního paragangliomu [31]. Většina pacientů nemá toto trias plně vyvinuto, přičemž nejčastější kombinací je GIST a plicní chondrom. Další odchylkou je výskyt adenomu kůry nadledviny a pravděpodobně i leiomyomu jícnu [32].
Carney – Stratakis syndrom
Syndrom Carney – Stratakis (syndrom familiárního paragangliomu – GIST) je nedávno popsané onemocnění. Původně byli dva pacienti s tímto syndromem zahrnuti do souboru 79 pacientů s Carneyho trias, později byli ale vyčleněni a spolu s dalšími zařazeni do souboru dvanácti pacientů z pěti rodin, u nichž se koincidence GIST a paragangliomu od Carneyho triády lišila familiárním výskytem, nepřítomností převahy postižení mladých žen a vyšším zastoupením paragangliomu ve vyšetřovaném souboru [33].
Neurofibromatóza I. typu
Neurofibromatóza I. typu (von Recklinghausenova choroba) je autozomálně dominantně dědičné onemocnění způsobené vrozenou mutací genu nf-1 na 17. chromozomu. Hlavními znaky jsou skvrny barvy bílé kávy na kůži postižených, pigmentované hamartomy duhovky a mnohočetné neurofibromy na různých místech těla. U pacientů se také mohou vyskytovat kostní cysty, meningeomy, gliomy optického nervu a dalších nádorů.
GIST je přítomen u 5–25 % pacientů s neurofibromatózou 1. typu a bývá mnohočetný. Nejčastěji postiženou částí trávicího traktu je tenké střevo [34].
Sporadický pediatrický GIST
GIST vyskytující se u mladých lidí, dětí nebo i novorozenců tvoří zvláštní klinickou skupinu nádorů morfologicky neodlišitelných od GIST dospělého věku. Většinou jde o nádory vyskytující se převážně u dívek v žaludečním antru. Přítomnost mutací genů kódujících proteiny KIT a PDGFRA je vzácná, což odlišuje sporadické pediatrické GIST od forem dospělého věku a umožňuje předpokládat odlišnou patogenetickou cestu vzniku těchto nádorů [35]. Biologické chování je charakterizováno sklonem k metastázování do jater, ale poměrně dlouhou dobou přežívání (více než deset let) i při jaterním postižení.
Lokalizace nádorů a klinický obraz
GIST se mohou nacházet ve většině orgánů trávicího traktu i mimo něj. Největší výskyt nádorů je v žaludku (60–70 %) (Obr. 1), dále v tenkém střevě (20–25 %), tlustém střevě (5 %) a jícnu (<5 %) (20). Méně často se stromální tumory nacházejí mimo trávicí trubici, a to v mezenteriu, omentu a retroperitoneu, vzácně v pankreatu a žlučníku, ojediněle byly popsány primární GIST i v seróze močového měchýře a vagině. Tyto tumory jsou někdy nazývány EGIST (Extra Gastro Intestinal Stromal Tumors). Nádory nejčastěji metastázují do jater, do měkkých částí břišní dutiny (omentum, peritoneum) a do retroperitonea. Generalizace do lymfatických uzlin, plic a skeletu je vzácná [36].
Obr. 1. Rozsáhlý gastrointestinální tumor postihující malou křivinu žaludku (černá šipka), zbytek žaludku je bez makroskopicky patrných změn (bílá šipka) Fig. 1: Bulky GIST affecting the lesser curvature of the stomach (black arrow) while the rest of the stomach shows no macroscopically detectable changes (white arrow) Foto: MUDr. Petr Lochman, Ph.D. 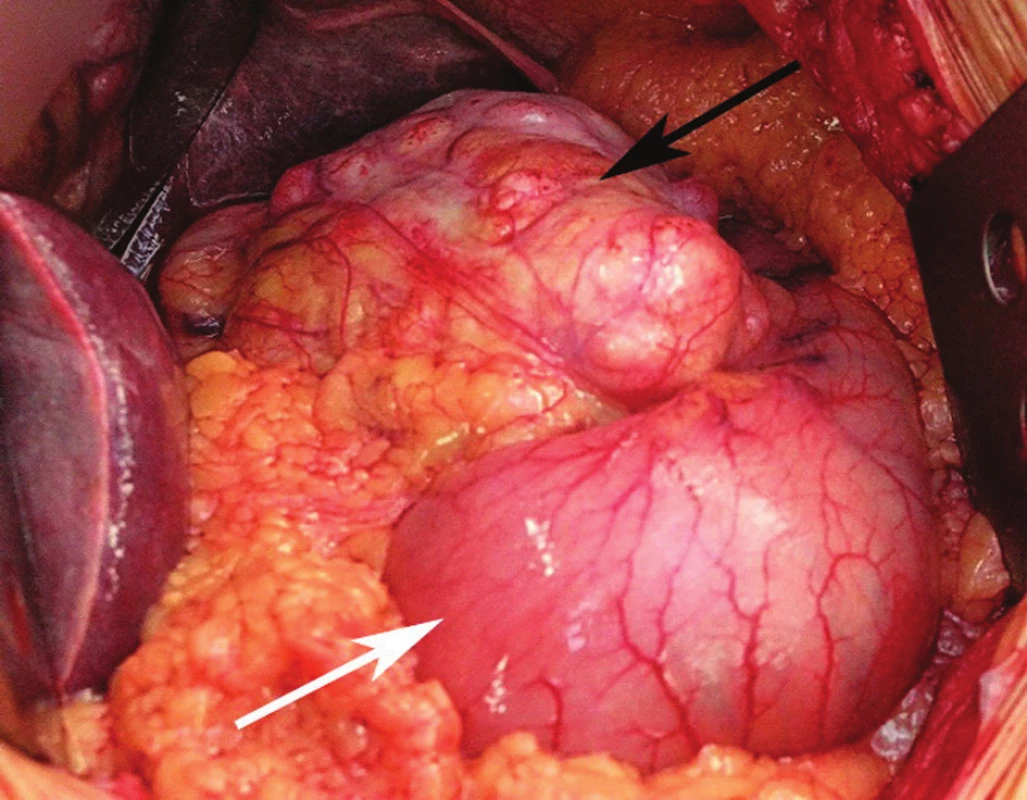
Nejčastějším příznakem onemocnění je krvácení do gastrointestinálního traktu, které se objevuje ve 20–50 % případů [1]. Nádory zpravidla krvácejí intraluminálně, což se (podle lokalizace) projeví hematemézou, enteroragií nebo melénou. Může však také dojít k erozi cév extraluminálně rostoucího tumoru s následným krvácením do břišní dutiny, které se pak projeví náhle vzniklými bolestmi břicha a závažnou anemií, často s nutností urgentní laparotomie [1, 36]. Dalším příznakem bývá chronická abdominální bolest (20–50 %) s případnou hmatnou rezistencí a chronická anemie (10 %). Onemocnění může být provázeno četnými nespecifickými příznaky, jako jsou únava, slabost, anorexie, noční pocení, palpitace, úbytek hmotnosti a paraneoplastická horečka. Asi 20 % pacientů nemá žádné klinické příznaky. Přibližně u 17 % případů je onemocnění rozpoznáno až manifestací metastáz [6].
Klinická diagnostika
Klinická diagnostika se opírá o endoskopická vyšetření a zobrazovací metody. U velkých tumorů lokalizovaných v oblasti žaludku nebo tlustého střeva je základním vyšetřením gastroskopie, resp. kolonoskopie.
Při diagnostice GIST lokalizovaných v oblasti tenkého střeva se stále více uplatňuje dvoubalonová enteroskopie [38]. Při nejasné lokalizaci předpokládaného tumoru v oblasti tenkého střeva je možné provést peroperační invazivní enteroskopii zavedením endoskopu do lumen tenkého střeva cestou enterotomie. Důležitou roli při diagnostice malých intramurálně uložených tumorů, především v oblasti stěny žaludku, hraje endoskopická sonografie. Touto metodou lze dobře zobrazit tumory menší než 2 cm. Limitní velikost pro spolehlivé zobrazení tumorů je průměr kolem 1 cm [39].
Kontrastní spirální CT vyšetření může dobře zobrazit tumory velikosti od 2 cm, zvláště pokud jde o extraluminálně uložené tumory a tumory s kalcifikacemi, nekrózami a dobrou vaskularizací [40] (Obr. 2). Důležitou roli hraje CT vyšetření rovněž při detekci a sledování poléčebné regrese metastáz. Magnetická rezonance může přispět k přesnějšímu určení lokalizace tumoru a jeho resekability [40].
Obr. 2. Spirální CT vyšetření břicha; velký, dobře ohraničený tumor (černá šipka) vyrůstá ze stěny žaludku (bílá šipka) Fig. 2: Spiral CT scan of the abdomen showing a well circumscribed bulky GIST (black arrow) growing from the stomach wall (white arrow) 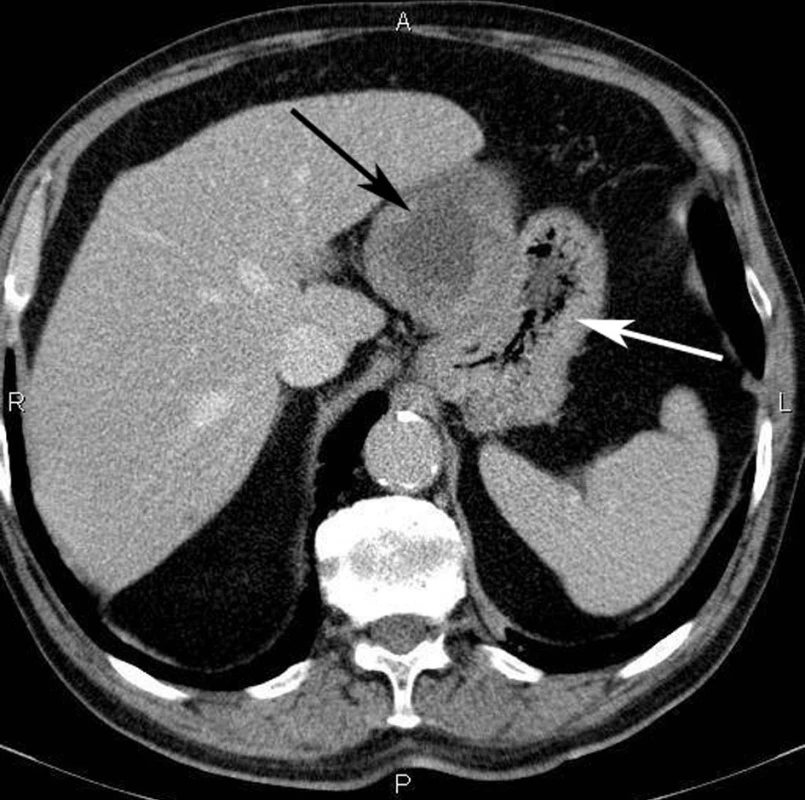
Důležitou roli v diagnostice GIST hraje pozitivní emisní tomografie (PET). PET s podáním fluorin-18-fluorodeoxy glukózy (FDG-PET) má význam jednak z pohledu zobrazení a odlišení metabolicky aktivních tumorů od ostatních tkání, ale především z pohledu hodnocení odpovědi GIST na léčbu imatinib mesylátem. Recentní studie rovněž prokázala, že chudý nález při primárním vyšetření FDG - PET signalizuje primární rezistenci nádoru na léčbou imatinibem [41].
Hybridní kombinace PET/CT vyšetření je v současné době nejužitečnějším zobrazovacím vyšetřením jak z pohledu primární diagnostiky, tak z pohledu pooperačního a při léčbě imatinibem poléčebného sledování a predikce vývoje onemocnění [41].
Chirurgická léčba
U pacientů s primárním GIST je chirurgická léčba metodou první volby a jedinou metodou, která může vést k úplnému vyléčení. U tumorů menších než 10 cm, lokalizovaných v oblasti žaludku a střeva, je chirurgická léčba zatížena nízkou morbiditou [42].
Benefit rozsáhlých resekcí nebyl prokázán. V oblasti žaludku je za dostatečný výkon považována klínovitá resekce, u tenkého střeva resekce segmentální. Chirurgický výkon musí být zaměřen na dosažení mikroskopicky negativních resekčních okrajů (R0 resekce) [43]. Na druhé straně pouhá enukleace tumoru je výkonem nedostatečným. Negativních resekčních okrajů je dosaženo v 70–95 % případů operací pro primární tumor, přičemž primární resekce je možná u 85 % pacientů [43].
Pokud GIST k přilehlým orgánům pevně adheduje, je indikována „en bloc“ resekce. Vzhledem k tomu, že v těchto případech je indikována adjuvantní léčba, měl by být rozsah resekce vždy pečlivě zvažován s důrazem na zachování funkčnosti jednotlivých orgánů tak, aby adjuvantní léčba nebyla v konečném důsledku znemožněna [44].
Pokud je tumor obalen pseudokapsulou, je důležité zachovat její integritu. Nádory jsou často měkké a drolivé, a je proto třeba operovat s obzvláštní pečlivostí tak, aby nedošlo k jejich ruptuře a následnému zvýšení rizika tvorby implantačních metastáz [43].
Mikroskopicky pozitivní resekční okraj má značný vliv na letalitu pacientů. Přežití pacientů s peroperační rupturou tumoru je pak obdobné jako u pacientů s pozitivními resekčními okraji [45].
Laparoskopická resekce GIST je možná a na některých pracovištích preferovaná. Laparoskopický výkon by ale neměl být prováděn, pokud existuje riziko peroperačního porušení celistvosti nádoru. Vždy je nutno dbát na obecná pravidla onkologické chirurgie a v případě, že laparoskopický výkon není pro pacienta jednoznačným benefitem (s ohledem na riziko perforace pseudokapsuly a radikality resekce), je nutné zvolit buď primárně klasickou operaci, nebo provést časnou konverzi výkonu [46]. Z pohledu velikosti nádoru je laparoskopická resekce doporučována u tumorů menších než 2–5 cm v průměru [24, 42, 46].
Metastázování GIST do lymfatických uzlin je vzácné, a proto není indikováno rutinní provádění lymfadenektomie. Spádová lymfadenektomie se provádí jen při jednoznačně předoperačně prokázaném postižení uzlin [37, 47].
Otázka reresekcí v případě pozitivních okrajů a provádění resekcí metastáz není jednoznačně zodpovězena. Při indikací těchto výkonů musí být zohledněna biologická povaha tumoru. Pacienti s dobře diferencovaným tumorem a „disease free“ intervalem delším než jeden rok mohou z těchto výkonů profitovat [48]. V případě radikálně neresekabilních tumorů má smysl kombinace cytoreduktivního chirurgického výkonu a následná adjuvantní terapie [49].
Endoskopická léčba
Několik recentních studií popsalo endoskopickou léčbu jako vhodnou minimálně invazivní metodu určenou pro malé GIST. Endoskopické snesení GIST charakteru polypu je považováno za jednoduchou alternativu tradiční chirurgické léčby [50, 51]. Endoskopická slizniční resekce – EMR (Endoscopic Mucosal Resection) a endoskopická submukózní disekce – ESD (Endoscopic Submucosal Dissection) jsou dalšími pokročilými terapeutickými technikami vhodnými pro odstranění povrchově uložených GIST. Metody byly použity pro odstranění GIST jícnu a žaludku [50, 51].
Použití endoskopických metod je vyhrazeno pro léze bez prokázaných uzlinových metastáz a většinou pro nádory menší než 3 cm. Pokud je GIST za pomocí endoskopické metody zcela odstraněn a histopatologické vyšetření prokáže nízké riziko malignity, není nutná další léčba [50, 51].
Onkologická léčba
Léčba dnes známými chemoterapeutiky je v případě GIST neúčinná. Stejně tak je neúčinná radioterapie. Jedinou dosud známou léčbou se signifikantně pozitivní odpovědí u 40–70 % pacientů s metastatickým nebo inoperabilním onemocněním je biologická léčba imatinibem.
Imatinib mesylát (Glivec EU / Gleevec US, Novartis Pharmaceuticals AG, Basilej, Švýcarsko) inhibuje tyrozinkinázové domény různých receptorů včetně c-kit (CD117) a PDGFR. Receptorové tyrozinkinázy (RTK) jsou transmembránové proteiny skládající se z extracelulární, transmembránové a intracelulární části. Extracelulární část vytváří receptor pro specifický ligand, část intracelulární je nositelem tyrozinkinázové domény, která je aktivována změnami proteinu po vazbě ligandu. Tato aktivace vede k dimerizaci příslušné tyrozinkinázy, autofosforylaci tyrozinových zbytků a stabilizaci vazného místa pro intracelulární signální molekuly [52].
Terapie imatinibem je doporučena k léčbě pacientů s nově diagnostikovaným lokálně pokročilým, inoperabilním nebo metastatickým GIST zažívacího traktu s pozitivním c-kit proteinem. Léčba imatinibem může primární tumor zmenšit natolik, že původně inoperabilní nález může být chirurgicky radikálně odstraněn ([9, 52]. Další indikací léčby imatinibem jsou pacienti po nekompletní chirurgické resekci nebo pacienti, u kterých je z důvodu přítomnosti komorbidit vysoké riziko pooperační morbidity a mortality [52, 53]. Denní dávka imatinibu je 400 mg nebo 800 mg (rozděleno 400 mg ráno a večer). Léčba probíhá dlouhodobě až do případné progrese onemocnění [53].
Zavedením imatinibu do terapie pokročilého GIST prodloužilo období bez progrese onemocnění, zejména však prodloužilo celkovou dobu přežití. Dle rozsáhlé klinické studie III. fáze B2222 se celkové přežití prodloužilo o 57 a podle nejnovějších studií o 64 měsíců ve srovnání s 19 měsíci před érou imatinibu [52, 54]. Další stude (BRF14) prokázala, že při kompletní nebo parciální remisi pokročilého onemocnění znamená pokračování terapie imatinibem jednoznačný přínos pro pacienta. Po přerušení terapie došlo u většiny pacientů k rychlé recidivě onemocnění [55]. V případě progrese onemocnění v průběhu terapie imatinibem v dávce 400 mg denně je možné dávku zvýšit na 800 mg denně s vysokou pravděpodobností další účinnosti [56]. Algoritmus doporučeného léčebného postupu GIST s ohledem na stadium onemocnění zobrazuje Obr. 3.
Obr. 3. Algoritmus doporučeného léčebného postupu při postižení GIST – upraveno dle Gold & DeMateo [54] Fig. 3: Algorithm of the recommended medical treatment for GIST – modified according to Gold & DeMateo [54] ![Algoritmus doporučeného léčebného postupu při postižení GIST – upraveno dle Gold & DeMateo [54]
Fig. 3: Algorithm of the recommended medical treatment for GIST – modified according to Gold & DeMateo [54]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8dfe21e6bf72100f24fb8167092d91cf.jpg)
Několik recentních studií se zabývá hodnocením adjuvantního podání imatinibu po resekci lokalizovaného primárního GIST. Hlavním cílem je oddálení recidivy tumoru, která se objeví až u poloviny pacientů do pěti let od operace. Dle těchto studií adjuvantně podávaný imatinib přispívá k prodloužení intervalu bez známek recidivy onemocnění [53]. Nejsou však zatím zodpovězeny některé další otázky, jako například ideální délka adjuvance, indikace adjuvance z pohledu stupně rizika agresivního chování tumoru apod. [53, 55].
Při další progresi onemocnění je zahájena druhá linie biologické léčby v podobě podání inhibitoru tyrozinových kináz sunitinib malátu (Stutent, Pfizer Inc, New York, USA) v dávce 50 mg denně po dobu čtyř týdnů, s následnou dvoutýdenní pauzou [57]. Sunitinib malát je tyrozinkinázový inhibitor blokující vaskulární endoteliální receptory pro PDGFR-α, PDGFR-, KIT, růstové faktory 1, 2, 3 a některé další receptory (FLT3, RET, CSF-1) [58]. Tento široký rozsah účinku může mít jak účinek antiangiogenní, tak přímé účinky protinádorové, a to v závislosti na subtypu nádoru. Recentní studie popsala alternativní dávkování sunitinibu v množství 37,5 mg denně v dlouhodobém kontinuálním podávání, bez plánovaného přerušení, přičemž prokázala srovnatelný léčebný efekt bez známek vyšší toxicity [59].
V případě další progrese při léčbě imatinibem i sunitinibem je možné podat nové inhibitory tyrozinkinázy, z nichž je nejlépe prozkoumán nilotinib (Tasigna, Novartis Pharma GmbH, Norimberk, Německo) [60]. Nilotinib se ukázal být účinný při léčbě GIST rezistentních na léčbu imatinibem i sunitinibem. Předběžné výsledky však vyžadují potvrzení dalšími studiemi. Přehled léčebných možností po selhání léčby imatinibem a sunitinibem uvádí Tab. 1.
Tab. 1. Přehled léčebných možností po selhání léčby imatinibem a sunitinibem Tab. 1: Overview of treatment options that might follow imatinib and sunitib failure 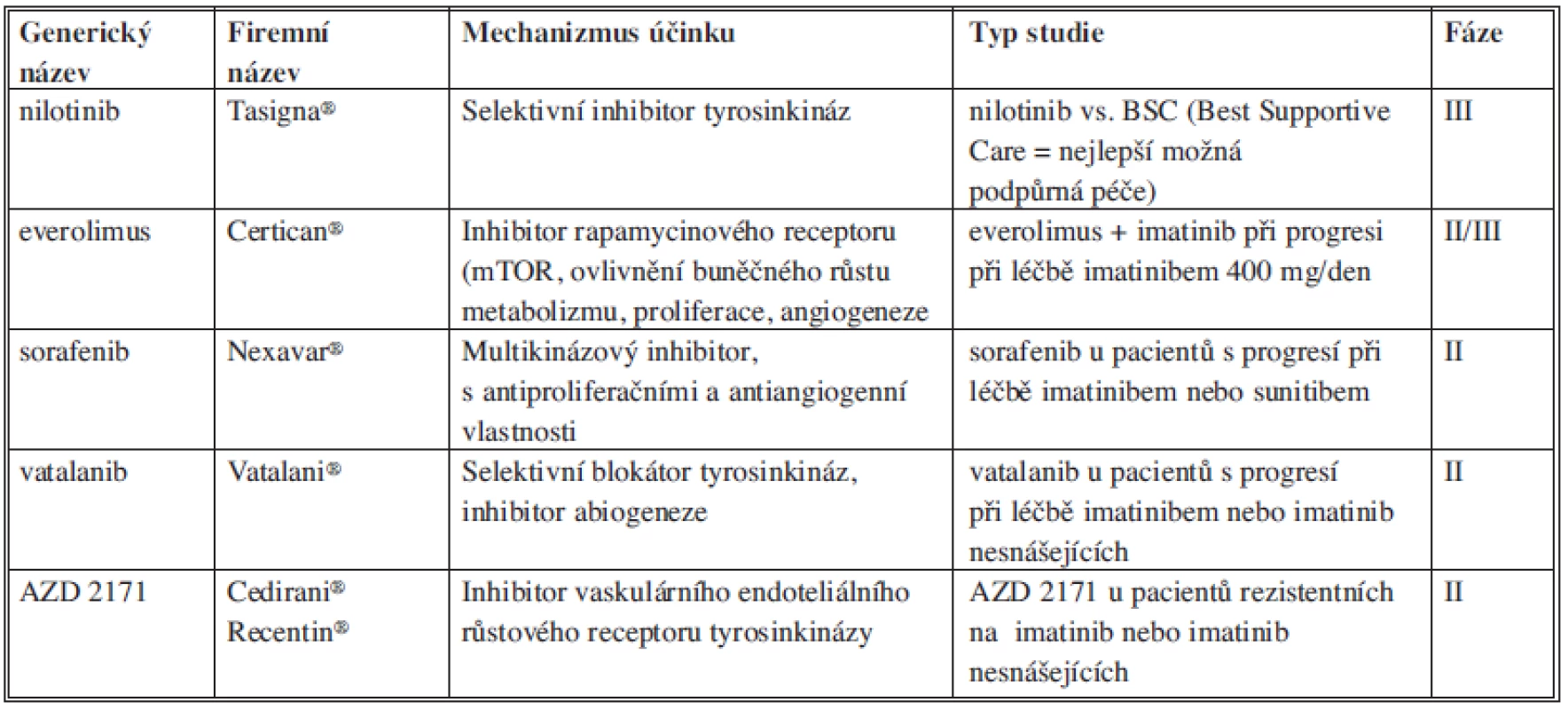
Prognostické faktory chování GIST
V současné době není známo kritérium, které by umožňovalo vyloučit možnost maligního chování GIST. Přibližně 30 % nově diagnostikovaných GIST je jasně maligních nebo má vysoký maligní potenciál [61]. Každý GIST je proto nutné považovat za potenciálně maligní. Na konferenci National Institute of Health v roce 2001 byla stanovena morfologická kritéria, na jejichž základě se stanovuje riziko agresivního chování GIST. V roce 2006 byla navržena nová rozšiřující kritéria, založená na rozsáhlých studiích, zohledňujících odlišné chování stromálních nádorů žaludku a tenkého střeva [62] (Tab. 2).
Tab. 2. Riziko agresivního chování GIST [62] Tab. 2: The risk of malignant behavior of GIST [62] ![Riziko agresivního chování GIST [62]
Tab. 2: The risk of malignant behavior of GIST [62]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/957e0982c7b93085525521c3abfab634.png)
* Mitotický index: počet mitóz v 50 zorných polích velkého zvětšení (HPFs - high power fields) při použití objektivu zvětšujícího 40krát Mezi známky potenciální malignity patří lokalizace nádoru. Nádory žaludku mívají nejlepší prognózu, naopak nádory tenkého střeva a nádory lokalizované mimo trávicí trubici mívají prognózu horší [20, 35]. K negativním faktorům dále patří vysoká celularita, vysoký proliferační index, infiltrativní růst a nekrózy s rozpadem tumoru [63].
Na rozdíl od sporného prognostického významu mutací c-kit a pdgfr-α je všeobecně přijímána jejich úloha v predikci terapeutické odpovědi na imatinib mesylát. Z obecného hlediska jsou považovány tumory s „regulačním typem“ mutace (například exon 11 c-kit nebo exon 12 pdgfr-α) za responzivní, zatímco nádory s „enzymatickým typem“ mutace (například exon 17 c-kit a exon 18 pdgfr-α) za primárně rezistentní [64].
Dosavadní studie prokázaly největší účinnost imatinibu u GIST s mutací v exonu 11 c-kit, na druhém místě v odpovědi je exon 9. U ostatních studovaných mutací (exon 13 a 17 c-kit, exon 18 pdgfr-α) většinou nebylo dosaženo odpovědi, ale pouze stabilizace onemocnění (65).
Poznámka: Exon je část sekvence nukleové kyseliny, DNA či RNA, podle níž se obvykle tvoří v procesu translace bílkovina. Spolu s introny tvoří gen.
Závěr
GIST představují zvláštní skupinu mezenchymálních nádorů s nejistým biologickým chováním. Přibližně 30 % nově diagnostikovaných GIST je maligních nebo s vysokým maligním potenciálem.
Stanovení klinické diagnózy, především malých a intramurálně uložených tumorů, může být obtížné. Kromě endoskopických vyšetření je dnes za nejužitečnější zobrazovací vyšetření možné považovat hybridní kombinaci PET/CT vyšetření, a to i z pohledu sledování vývoje onemocnění.
Histologické, imunohistochemické a molekulárně genetické určení GIST je dnes rutinní záležitostí.
U pacientů s primárním GIST je chirurgická léčba metodou první volby a jedinou metodou, která může vést k úplnému vyléčení. Otázka reresekcí v případě pozitivních okrajů a provádění resekcí metastáz není dosud jednoznačně zodpovězena.
Biologická léčba imatinibem mesylátem je doporučena u pacientů s nově diagnostikovaným lokálně pokročilým, inoperabilním nebo metastatickým GIST zažívacího traktu s pozitivním c-kit proteinem. Léčba může primární tumor zmenšit natolik, že původně inoperabilní nález může být chirurgicky radikálně odstraněn.
Současný výzkum je zaměřen na hledání nových preparátů, které by umožnily léčbu pokročilého onemocnění nebo léčbu profylaktickou.
MUDr. Jiří Páral, Ph.D.
Katedra chirurgie FVZ UO Hradec Králové
Třebešská 1575,
500 01 Hradec Králové
e-mail: paral@pmfhk.cz
Zdroje
1. Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005;29 : 52–68.
2. Goettsch WG, Bos SD, Breekveldt-Postma N, Casparie M, Herings RM, Hogendoorn PC. Incidence of gastrointestinal stromal tumors is underestimated: Results of a nation-wide study. Eur J Cancer 2005;41 : 2868–2872.
3. Nilsson B, Bümming P, Meis-Kindblom JM, Odén A, Dortok A, Gustavsson, Sablinska K, Kindblom LG. Gastrointestinal stromal tumors: The incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era. Cancer 2005;103 : 821–829.
4. Prakash S, Sarran L, Socci N, DeMatteo RP, Eisenstat J, Greco AM, Maki RG, Wexler LH, LaQuaglia MP, Besmer P, Antonescu CR. Gastrointestinal stromal tumors in children and young adults: a clinicopathologic, molecular, and genomic study of 15 cases and review of the literature. J Pediatr Hematol Oncol 2005;27 : 179–187.
5. Stout AP. Bizarre smooth muscle tumors of the stomach. Cancer 1962;15 : 400–409.
6. Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol 1983;7 : 507–519.
7. Sircar K, Hewlett BR, Huizinga JD, Chorneyko K, Berezin I, Riddell RH. Interstitial cells of Cajal as precursors of gastrointestinal stromal tumors. Am J Surg Pathol 1999;23 : 377–389.
8. Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 1998;152 : 1259–1269.
9. Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, Kawano K, Hanada M, Kurata A, Takeda M, Muhammad Tunio G, Matsuzawa Y, Kanakura Y, Shinomura Y, Kitamura Y. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 1998;279 : 577–580.
10. Sarlomo-Rikala M, Kovatich AJ, Barusevicius A, Miettinen M. CD117: a sensitive marker for gastrointestinal stromal tumors that is more specific than CD34. Mod Pathol 1998;11 : 728–34.
11. Besmer P, Murphy JE, George PC, Qiu FH, Bergold PJ, Lederman L, Snyder HW Jr, Brodeur D, Zuckerman EE, Hardy WD. A new acute transforming feline retrovirus and relationship of its oncogene v-kit with the protein kinase gene family. Nature 1986;320 : 415–421.
12. Yarden Y, Kuang WJ, Yang-Feng T, Coussens L, Munemitsu S, Dull TJ, Chen E, Schlessinger J, Francke U, Ullrich A. Human proto-oncogene c-kit: a new cell surface receptor tyrosine kinase for an unidentified ligand. EMBO J 1987;6 : 3341–3351.
13. Hirota S, Ohashi A, Nishida T, Isozaki K, Kinoshita K, Shinomura Y, Kitamura Y. Gain-of-function mutations of platelet-derived growth factor receptor alpha gene in gastrointestinal stromal tumors. Gastroenterology 2003;125 : 660–667.
14. Heinrich MC, Corless CL, Duensing A, McGreevey L, Chen CJ, Joseph N, Singer S, Griffith DJ, Haley A, Town A, Demetri GD, Fletcher CD, Fletcher JA. PDGFR – activating mutations in gastrointestinal stromal tumors. Science 2003;299 : 708–710.
15. Pauls K, Merkelbauch-Bruse S, Thal D, Buttner R, Wardelmann E. PDGFRalpha - and c-kit-mutated gastrointestinal stromal tumors (GISTs) are characterized by distinctive histological and immunohistochemical features. Histopathology 2005;46 : 166–175.
16. Demetri GD, von Mehren M, Blanke CD, Van den Abbeele AD, Eisenberg B, Roberts PJ, Heinrich MC, Tuveson DA, Singer S, Janicek M, Fletcher JA, Silverman SG, Silberman SL, Capdeville R, Kiese B, Peng B, Dimitrijevic S, Druker BJ, Corless C, Fletcher CD, Joensuu H. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002;347 : 472–480.
17. Hemmi A, Inaniwa Y, Ohnop S, Fujii Y, Terada N, Mitsumata M, Nemoto N. Relationship between skeinoid fibers and stromal matrix in gastrointestinal stromal tumors: morphometric analysis with quick-freezing and deep-etching method. Pathol Int 2001;51 : 338–48.
18. Debiec-Rychter M, Pauwels P, Lasota J, Franke S, De Vos R, De Wever, Hagemeijer A, Sciot R. Complex genetic alterations in gastrointestinal stromal tumors with autonomic nerve differentiation. Mod Pathol 2002;15 : 692–698.
19. Vandenbark GR, Decastro CM, Taylor H, Dew-Knight S, Kaufman RE. Cloning and structural analysis of the human c-kit gene. Oncogene 1992;7 : 1259–1266.
20. Miettinen M, Lasota J. Gastrointestinal stromal tumors-definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001;438 : 1–12.
21. Heinrich MC, Rubin BP, Longley BJ, Fletcher JA. Biology and genetic aspects of gastrointestinal stromal tumors: KIT activation and cytogenetic alterations. Hum Pathol 2002;33 : 484–495.
22. Rubin BP, Heinrich MC, Corles CL, Gastrointestinal stromal tumour. Lancet 2007;369 : 1731–1741.
23. Heinrich MC, Corless CL, Demetri GD, Blanke CD, von Mehren M, Joensuu H, McGreevey LS, Chen CJ, Van den Abbeele AD, Druker BJ, Kiese B, Eisenberg B, Roberts PJ, Singer S, Fletcher CD, Silberman S, Dimitrijevic S, Fletcher JA. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol 2003;21 : 4342–4349.
24. Casali PG, Jost L, Reichardt P, Schlemmer M, Blay JY. ESMO Guidelines Working Group. Gastrointestinal stromal tumours: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009;20,(4 Suppl):64–67.
25. Genome sequencing, Humane genome project information, 2009 http://www.ornl.gov/sci/techresources/Human_Genome/faq/seqfacts.shtml. Accessed January 7, 2009.
26. Espinosa I, Lee CH, Kim MK, Rouse BT, Subramanian S, Montgomery K, Varma S, Corless CL, Heinrich MC, Smith KS, Wang Z, Rubin B, Nielsen TO, Setz RS, Ross DT, West RB, Cleary ML, Van De Rijn M. A novel monoclonal antibody against DOG1 is a sensitive and specific marker for gastrointestinal stromal tumors. Am J Surg Pathol 2008;32 : 210–218.
27. West RB, Corless CL, Chen X, Rubin BP, Subramanian S, Montgomery K, Zhu S, Ball CA, Nielsen TO, Patel R, Goldblum JR, Brown PO, Heinrich MC, Van De Rijn M. The novel marker, DOG1, is expressed ubiquitously in gastrointestinal stromal tumors irrespective of KIT or PDGFRA mutation status. Am J Pathol 2004;165 : 107–113.
28. Li FP, Fletcher JA, Heinrich MC, Garber JE, Sallan SE, Curiel-Lewandrowski C, Duensing A, van de Rijn M, Schnipper LE, Demetri GD. Familial gastrointestinal stromal tumor syndrome: phenotypic and molecular features in a kindred. J Clin Oncol 2005;23 : 2735–2743.
29. Chompret A, Kannengiesser C, Barrois M, Terrier P, Dahan P, Tursz T, Lenoir GM, Bressac-De Paillerets B. PDGFRA germline mutation in a family with multiple cases of gastrointestinal stromal tumor. Gastroenterology 2004;126 : 318–321.
30. Hirota S, Nishida T, Isozaki K, Taniguchi M, Nishikawa K, Ohashi A, Takabayashi A, Obayashi T, Okuno T, Kinoshita K, Chen H, Shinomura Y, Kitamura Y. Familial gastrointestinal stromal tumors associated with dysphagia and novel type germline mutation of KIT gene. Gastroenterology 2002;122 : 1493–1499.
31. Carney JA. Gastric stromal sarcoma, pulmonary chondroma, and extra-adrenal paraganglioma (Carney Triad): natural history, adrenocortical component, and possible familial occurrence. Mayo Clin Proc 1999;74 : 543–552.
32. Knop S, Schupp M, Wardelmann E, Stueker D, Horger MS, Kanz L, Einsele H, Kroeber SM. A new case of Carney triad: gastrointestinal stromal tumors and leiomyoma of the oesophagus do not show activating mutations of KIT and platelet-derived growth factor receptor alpha. J Clin Pathol 2006;59 : 1097–1099.
33. McWhinney SR, Pasini B, Stratakis CA. Familial gastrointestinal stromal tumors and germ-line mutations. N Engl J Med 2007;357 : 1054–1056.
34. Takazawa Y, Sakurai S, Sakuma Y, Ikeda T, Yamaguchi J, Hashizume Y, Yokoyama S, Motegi A, Fukayama M. Gastrointestinal stromal tumors of neurofibromatosis type I (von Recklinghausen’s disease). Am J Surg Pathol 2005;29 : 755–763.
35. Miettinen M, Lasota J, Sobin LH. Gastrointestinal stromal tumors of the stomach in children and young adults: a clinicopathologic, immunohistochemical, and molecular genetic study of 44 cases with long-term follow-up and review of the literature. Am J Surg Pathol 2005;29 : 1373–1381.
36. Tran T, Davila JA, El-Serag HB. The epidemiology of malignant gastrointestinal stromal tumors: an analysis of 1458 cases from 1992 to 2000. Am J Gastroenterol 2005;100 : 162–168.
37. DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: Recurrence patterns and prognostic factors for survival. Ann Surg 2000;231 : 51–58.
38. Matsui N, Akahoshi K, Motomura Y, Kubokawa M, Kimura M, Ohuchi J, Honda K, Murata A, Endoh S, Miyazaki M, Oya M, Nakano S, Nakamura K. Endosonographic detection of dumbbell-shaped jejunal GIST using double balloon enteroscopy. Endoscopy 2008;40(2 Suppl):38–39.
39. Lok KH, Lai L, Yiu HL, Szeto ML, Leung SK. Endosonographic surveillance of small gastrointestinal tumors originating from muscularis propria. J Gastrointestin Liver Dis 2009;18 : 177–180.
40. Da Ronch T, Modesto A, Bazzocchi M. Gastrointestinal stromal tumor: spiral computed tomography features and pathologic correlation. Radiol Med 2006,111 : 661–673.
41. Van den Abbeele AD. The lessons of GIST-PET and PET/CT: a new paradigm for imaging. Oncologist 2008;13(2 Suppl):8–13.
42. Otani Y, Furukawa T, Yoshida M, Saikawa Y, Wada N, Ueda M, Kubota T, Mukai M, Kameyama K, Sugino Y, Kumai K, Kitajima M. Operative indications for relatively small (2-5 cm) gastrointestinal stromal tumor of the stomach based on analysis of 60 operated cases. Surgery 2006;139 : 484–492.
43. Hassan I, You YN, Shyyan R, Dozois EJ, Smyrk TC, Okuno SH, Schleck CD, Hodge DO, Donohue JH. Surgically managed gastrointestinal stromal tumors: a comparative and prognostic analysis. Ann Surg Oncol 2008;15 : 52–59.
44. Demetri GD, Benjamin RS, Blanke CD, Blay JY, Casali P, Choi H, Corless CL, Debiec-Rychter M, DeMatteo RP, Ettinger DS, Fisher GA, Fletcher CD, Gronchi A, Hohenberger P, Hughes M, Joensuu H, Judson I, Le Cesne A, Maki RG, Morse M, Pappo AS, Pisters PW, Raut CP, Reichardt P, Tyler DS, Van den Abbeele AD, von Mehren M, Wayne JD, Zalcberg J. NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)-update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 2007; 5(2 Suppl):1–29.
45. Ng EH, Pollock RE, Munsell MF, Atkinson EN, Romsdahl MM. Prognostic factors influencing survival in gastrointestinal leiomyosarcomas. Implications for surgical management and staging. Ann Surg 1992;215 : 68–77.
46. Sexton JA, Pierce RA, Halpin VJ, Eagon JC, Hawkins WG, Linehan DC, Brunt LM, Frisella MM, Matthews BD. Laparoscopic gastric resection for gastrointestinal stromal tumors. Surg Endosc 2008;22 : 258–267.
47. Fong Y, Coit DG, Woodruff JM, Brennan MF. Lymph node metastasis from soft tissue sarcoma in adults. Analysis of data from a prospective database of 1772 sarcoma patients. Ann Surg 1993;217 : 72–77.
48. Chen H, Pruitt A, Nicol TL, Gorgulu S, Choti MA. Complete hepatic resection of metastases from leiomyosarcoma prolongs survival. J Gastrointest Surg 1998;2 : 151–155.
49. Choi WH, Kim S, Hyung WJ, Yu JS, Park CI, Choi SH, Noh SH. Long-surviving patients with recurrent GIST after receiving cytoreductive surgery with imatinib therapy. Yonsei Med J 2009;50 : 437–440.
50. Ledo-Rodríguez A, Ulla-Rocha JL, Baltar-Arias R, Vázquez-Rodríguez S, Díaz-Saa W, González-Carrera V, Ledo-Barro L, Vázquez-Astray E. Endoscopic resection of rectal gastrointestinal stromal tumor (GIST) using band ligation. Rev Esp Enferm Dig 2009;101 : 870–871.
51. Kakushima N, Fujishiro M. Endoscopic submucosal dissection for gastrointestinal neoplasms. World J Gastroenterol 2008;14 : 2962 – –2967.
52. Duffaud F, Le Cesne A. Imatinib in the treatment of solid tumors. Target Oncol 2009;4 : 45–56.
53. DeMatteo RP, Ballman KV, Antonescu CR, Maki RG, Pisters PW, Demetri GD, Blackstein ME, Blanke CD, von Mehren M, Brennan MF, Patel S, McCarter MD, Polikoff JA, Tan BR, Owzar K. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumor: a randomised, double-blind, placebo-controlled trial. Lancet 2009;373 : 1097–1104.
54. Gold JS, DeMatteo RP. Combined surgical and molecular therapy: the gastrointestinal stromal tumor model. Ann Surg 2006; 244 : 176–184.
55. Blay JY, Le Cesne A, Bui B, Duffaud F, Delbaldo C, Adenis A, Viens P, Rios M, Bompas E, Cupissol D, Guillemet C, Kerbrat P, Fayette J, Chabaud S, Berthaud P, Perol D. Prospective multicenter randomized phase III study of imatinib in patients with advanced gastrointestinal stromal tumors comparing interruption versus continuation of treatment beyond 1 year: The French Sarmoma Group. J Clin Oncol 2007;25 : 1107–1113.
56. Van Glabbeke M, Verweij J, Casali PG, Le Cesne A, Hohenberger P, Ray-Coquard I, Schlemmer M, van Oosterom AT, Goldstein D, Sciot R, Hogendoorn PC, Brown M, Bertulli R, Judson IR. Initial and late resistances to imatinib in advanced gastrointestinal stromal tumors are predicted by different prognostic factors: a European Organisation for Research and Treatment of Cancer-Italian Sarcoma Group-Australasian Gastrointestinal Trials Group study. J Clin Oncol 2005;23 : 5795–5804.
57. Demetri GD, Heinrich MC, Fletcher JA, Fletcher CD, Van den Abbeele AD, Corless CL, Antonescu CR, George S, Morgan JA, Chen MH, Bello CL, Huang X, Cohen DP, Baum CM, Maki RG. Molecular target modulation, imaging, and clinical evaluation of gastrointestinal stromal tumor patients treated with sunitinib malate after imatinib failure. Clin Cancer Res 2009;15 : 5902–5909.
58. Chow LQ, Eckhardt SG. Sunitinib: from rational design to clinical efficacy. J Clin Oncol 2007;25 : 884–896.
59. George S, Blay JY, Casali PG, Le Cesne A, Srephenson P, Deprimo SE, Harmon CS, Law CN, Morgan JA, Raycoquard I, Tassell V, Cohen DP, Demetri GD. Clinical evaluation of continuous daily dosing of sunitinib malate in patients with advanced gastrointestinal stromal tumour after imatinib failure. Eur J Cancer 2009;45 : 1959–1968.
60. Demetri GD, Casali PG, Blay JY, von Mehren M, Morgan JA, Bertulli R, Ray-Coquard I, Cassier P, Davey M, Borghaei H, Pink D, Debiec-Rychter M, Cheung W, Bailey SM, Veronese ML, Reichardt A, Fumagalli E, Reichardt P. A phase I study of single-agent nilotinib or in combination with imatinib in patients with imatinib-resistant gastrointestinal stromal tumors. Clin Cancer Res 2009;15 : 5910–5916.
61. Demetri GD, van Oosterom AT, Garrett CR, Blackstein ME, Shah MH, Verweij J, McArthur G, Judson IR, Heinrich MC, Morgan JA, Desai J, Fletcher CD, George S, Bello CL, Huang X, Baum CM, Casali PG. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumor after failure of imatinib: a randomised controlled trial. Lancet 2006;368 : 1329–1338.
62. Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 2006;130 : 1466–1478.
63. Yokoi K, Tanaka N, Shoji K, Ishikawa N, Seya T, Horiba K, Kanazawa Y, Yamashita K, Ohaki Y, Tajiri T. A study of histopathological assessment criteria for assessing malignancy of gastrointestinal stromal tumor, from a clinical standpoint. J Gastroenterol 2005;40 : 467–473.
64. Longley BJ, Reguera MJ, Ma Y. Classes of c-kit activating mutations: proposed mechanisms of action and implications for disease classification and therapy. Leuk Res 2001;25 : 571–576.
65. Debiec-Rychter M, Dumez H, Judson I, Wasag B, Verweij J, Brown M, Dimitrijevic S, Sciot R, Stul M, Vranck H, Scurr M, Hagemeijer A, Van Glabbeke M, van Oosterom AT. Use of c-KIT/PDGFRA mutational analysis to predict the clinical response to imatinib in patients with advanced gastrointestinal stromal tumors entered on phase I and II studies of the EORTC soft tissue and bone sarcoma group. Eur J Cancer 2004;40 : 689–695.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2012 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Budoucnost úrazové chirurgie u nás
- GIST: Novodobé poznatky a léčebné modality
- Kvalita života je důležitým faktorem indikační rozvahy u nemocných s pokročilým karcinomem pankreatu – multicentrická prospektivní studie
- Biomarkery detekce minimální systémové diseminace u nemocných s karcinomem plic
- Prevence parastomální hernie primoimplantací síťky laparoskopicky – první zkušenosti
- Klinické prognostické faktory kolorektálního karcinomu po jeho radikální léčbě
- Laparoskopická adrenalektomie – indikace a selekční kritéria
- Retroperitoneoskopická adrenalektomie dorzálním přístupem
- Překlad knihy Schein´s Common Sense Emergency Abdominal Surgery – Urgentní břišní chirurgie
- Extragastrointestinální stromální tumor (EGIST)
- McKittrick-Wheelockov syndróm: Komplikácia mucinózneho adenómu rekta
- Gastrointestinal Cancers Symposium
- XXI. Jarní setkání Loket – pokroky v léčbě nemocných s karcinomem pankreatu
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- GIST: Novodobé poznatky a léčebné modality
- Laparoskopická adrenalektomie – indikace a selekční kritéria
- Prevence parastomální hernie primoimplantací síťky laparoskopicky – první zkušenosti
- Extragastrointestinální stromální tumor (EGIST)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



