-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam drénů v pankreatické chirurgii
The role of drains in pancreatic surgery
Pancreatic fistula is a significant complication following pancreatic resection. Several methods aimed at lowering the postoperative pancreatic fistula rate were studied in the past. These methods mainly include pharmacological prophylaxis and technical modifications of pancreatic remnant management. Another method which can influence postoperative pancreatic fistula rate is the use of and the manipulation with intra-abdominal drains following pancreatic resection. Recent studies have shown that the use of the drains, the type of drain and manipulation with the drains can influence the outcomes. The aim of this review is to summarize current knowledge about the use of drains in pancreatic surgery.
There are three questions to ask when studying the use of drains in pancreatic surgery:
1) Whether to use the drains at all 2) When to remove the drains? 3) Which type of the drain is more appropriate?
Ad 1) Despite the growing number of studies showing comparable or even better results in patients without intra-abdominal drains following pancreatic resection, the latest randomized study proved that avoiding the use of drains is associated with more clinically significant postoperative complications and higher postoperative mortality. It is also important to consider the risk factors of pancreatic fistula development, especially pancreatic texture and the main pancreatic duct diameter. Currently, pancreatic resection without intra-abdominal drains cannot be routinely recommended.
Ad 2) Two studies addressed the question when to remove the drains after pancreatic resection, and both studies clearly showed that early removal brings better results.
Ad 3) No study has specifically addressed the question whether the type of drain can influence the rate of postoperative pancreatic fistula and of other complications. Gravity drains and closed-suction drains are most commonly used nowadays. The closed-suction drains are more effective due to the active suction. On the other hand, active suction can cause leak of the amylase-rich fluid through the pancreatic anastomosis or suture line and thus promote the development of pancreatic fistula or even worsen its clinical significance. There are no data in the literature so far regarding the type of drain. Therefore, we have commenced a randomized control trial which aims to compare closed-suction drains and closed gravity drains.Key words:
Pancreatic resection – intra-abdominal drainage − gravity drain − closed-suction drain
Autori: F. Čečka 1; B. Jon 1; M. Loveček 2; P. Skalický 2
; Z. Šubrt 1,3; Č. Neoral 2; A. Ferko 1
Pôsobisko autorov: Chirurgická klinika Fakultní nemocnice Hradec Králové a Lékařské fakulty UK v Hradci Králové, přednosta kliniky: prof. MUDr. A. Ferko, CSc. 1; I. chirurgická klinika Fakultní nemocnice Olomouc a Lékařské fakulty Univerzity Palackého Olomouc přednosta kliniky: prof. MUDr. Č. Neoral, CSc. 2; Katedra vojenské chirurgie, Fakulta vojenského zdravotnictví Hradec Králové, Univerzita Obrany Brno vedoucí katedry: doc. MUDr. J. Páral, Ph. D. 3
Vyšlo v časopise: Rozhl. Chir., 2014, roč. 93, č. 9, s. 450-455.
Kategória: Souhrnné sdělení
Podpořeno MZ ČR – RVO ( FNHK, 00179906).
Súhrn
Pankreatická píštěl je závažnou komplikací po resekci pankreatu. V minulosti bylo studováno několik postupů, které měly za cíl snížit četnost pooperační pankreatické píštěle. Mezi tyto postupy patří zejména farmakologická profylaxe a technické modifikace ošetření zbytkového parenchymu pankreatu. Dalším postupem, který může ovlivnit četnost pankreatické píštěle, je použití a manipulace s břišními drény po resekci pankreatu. Poslední studie ukazují, že použití pojistných břišních drénů, volba použitého drénu a manipulace s drény mohou ovlivnit vznik pooperačních komplikací. Cílem tohoto sdělení je shrnout současné poznatky o použití drénů v pankreatické chirurgii.
Při studiu významu drénů v pankreatické chirurgii jsou tři zásadní otázky:
1) Zda drény vůbec používat? 2) Kdy břišní drény odstraňovat? 3) Který typ drénu je vhodnější?
Ad 1) I přes rostoucí počet studií, které uvádějí stejné nebo dokonce lepší výsledky u pacientů bez drénu po resekci pankreatu, poslední randomizovaná studie ukázala, že ve skupině pacientů bez drénu je vyšší četnost klinicky závažných komplikací a vyšší letalita. Samozřejmě je také nutné vzít v úvahu rizikové faktory vzniku pankreatické píštěle po operaci, z nichž nejzávažnější je charakter pankreatické tkáně a průměr pankreatického vývodu. V současné době resekce pankreatu bez použití pojistných drénů nemůže být rutinně doporučena.
Ad 2) Otázkou, kdy drény odstraňovat, se zabývaly dvě studie a obě celkem jednoznačně ukázaly, že časné odstranění drénů má lepší výsledky.
Ad 3) Cíleně se dosud nikdo nezabýval otázkou, zda může typ drénu ovlivnit četnost pooperační pankreatické píštěle a dalších komplikací. Nejčastěji se v současnosti používají uzavřené spádové a uzavřené odsavné drény. Drény s aktivním sáním jsou efektivnější, protože tekutina je z dutiny břišní aktivně nasávána. Na druhou stranu aktivní sání může nasávat tekutinu skrz pankreatickou anastomózu nebo linii sutury pankreatu a tím podpořit vznik pankreatické píštěle, případně poté ještě zhoršit její klinickou závažnost. Stran typu použitého drénu nejsou dosud v literatuře dostupná data. Z tohoto důvodu byla zahájena prospektivní randomizovaná studie, která má za cíl odpovědět na tuto otázku.Klíčová slova:
resekce pankreatu − břišní drény − spádové drény − uzavřené odsavné drényÚvod
Resekce pankreatu je jediná potenciálně kurativní metoda léčby nádorů pankreatu a periampulární oblasti [1]. Jedná se o technicky náročné operační výkony. Nejčastěji se provádějí parciální (cefalická) duodenopankreatektomie nebo levostranná resekce pankreatu, ostatní výkony jsou méně časté [2,3]. Ačkoliv pooperační letalita těchto výkonů v posledních desetiletích klesla, morbidita zůstává vysoká. Nejzávažnější pooperační komplikací je pankreatická píštěl [4,5]. Pankreatická píštěl samotná není ve většině případů život ohrožující komplikací, nicméně prodlužuje dobu hospitalizace, vyžaduje další vyšetřovací a intervenční metody (endoskopie, intervenční radiologie, angiografie, reoperace) a podání antibiotik a enterální či parenterální výživy [6]. Diagnostika a léčba pankreatické píštěle zvyšuje náklady na léčbu a u maligních onemocnění oddaluje podání adjuvantní terapie [7].
Pankreatická píštěl je způsobena exokrinní sekrecí ze zbytkového parenchymu pankreatu, proto se sekrece tekutiny bohaté na amylázy považuje za vymezující znak pankreatické píštěle. Příčinou je porucha hojení pankreatické anastomózy (např. po parciální duodenopankreatektomii) nebo porucha hojení sutury pankreatu (např. po levostranné resekci pankreatu nebo po enukleaci) [8]. Pankreatická šťáva je bohatá na proteázy, ty po aktivaci způsobují natrávení peripankreatické tkáně a její destrukci, dále způsobí dehiscenci anastomózy. Po další autodestrukci peripankreatické a retroperitoneální tkáně se mohou vytvořit peripankreatické tekutinové kolekce, nitrobřišní nebo retroperitoneální abscesy. Dalšími nálezy mohou být hrudní výpotky, zpomalená obnova pasáže nebo zpomalené vyprazdňování žaludku [4].
V různých souborech se udává incidence od 0 % až do 30 % [4,5,9]. Různá incidence je dána především různou definicí píštěle. I ve stejném souboru pacientů je při použití různých definic velice rozdílná incidence pankreatické píštěle [10,11]. Většina definic se opírá o množství sekretu z peroperačně uložených drénů, koncentraci amyláz v této tekutině a dobu trvání sekrece. Kromě množství sekretu a koncentrace amyláz je důležitým faktorem klinická závažnost pankreatické píštěle. V roce 2005 byla formulována a publikována jednotná definice pankreatické píštěle podle ISGPF [8]. International Study Group for Pancreatic Fistula (ISGPF) tvořilo 37 světových expertů z 15 zemí, kteří společně provedli literární rešerši, diskutovali své zkušenosti s pankreatickou píštělí a následně vytvořili novou, univerzálně použitelnou definici pankreatické píštěle. Tato definice je v současné době široce akceptována a používána [11].
Pankreatická píštěl podle ISGPF je definována jako výdej jakéhokoliv měřitelného množství tekutiny peroperačně uloženými drény (nebo drény perkutánně zavedenými následně po operaci) po třetím pooperačním dnu, pokud je koncentrace amyláz v tekutině 3x vyšší, než je normální sérová koncentrace. Zobrazovací metody nejsou k diagnóze pankreatické píštěle nutné [8]. Pankreatická píštěl se dělí do 3 stupňů dle klinické závažnosti (A, B, C) podle těchto faktorů: celkový stav pacienta, nutnost specifické léčby, výsledky zobrazovacích metod, nutnost ponechání drenáže déle než 3 týdny, známky infekce, nutnost další hospitalizace, sepse, reoperace a event. úmrtí v důsledku píštěle. Pankreatická píštěl stupně A je pouze biochemická, nemá žádné klinické dopady. Píštěl stupně B je klinicky málo závažná a píštěl stupně C je velmi závažná, zpravidla vyžaduje hospitalizaci na intenzivní péči, je spojena se sepsí a selháním jednoho nebo více orgánů [12].
V minulosti bylo studováno několik postupů, které měly za cíl snížit četnost pooperační pankreatické píštěle. Mezi tyto postupy patří zejména farmakologická profylaxe a technické modifikace ošetření zbytkového parenchymu pankreatu [13].
- a. Farmakologická profylaxe
Myšlenka farmakologické intervence k prevenci vzniku pooperační pankreatické píštěle byla poprvé popsána v roce 1979. Klempa a kol. popsali snížení četnosti pooperačních komplikací při peroperačním podání infuze somatostatinu [14]. Klinický účinek somatostatinu a jeho derivátů (zejména oktreotidu) byl studován v několika randomizovaných studiích [15]. Nicméně výsledky těchto studií jsou nejednoznačné a často jsou i protichůdné. Proto je nutné pečlivě analyzovat a interpretovat výsledky zmíněných studií, abychom dosáhli validních závěrů. Na základě dostupných informací je možné shrnout, že rutinní podání oktreotidu u všech operací pankreatu není opodstatněné. Spíše je vhodné jeho selektivní podání v případech, kdy je vyšší riziko vzniku pankreatické píštěle, př. menší zkušenosti s resekcemi pankreatu na daném pracovišti, riziková pankreatická žláza (tzv. soft pancreas a průměr pankreatického vývodu do 3 mm), levostranné nebo centrální resekce pankreatu atd. [15].
- b. Technické modifikace ošetření zbytkového pahýlu pankreatu
Jedná se o techniky ošetření pahýlu pankreatu po parciální duodenopankreatektomii a uzávěr pahýlu pankreatu po levostranné resekci. Celkem bylo popsáno zhruba 80 různých možností rekonstrukce po parciální duodenopankreatektomii. Mezi nejčastěji diskutované možnosti patří volba pankreatiko-jejuno anastomózy versus pankreatiko-gastro anastomózy, použití vnitřního nebo zevního stentu do pankreatické anastomózy a v neposlední řadě o jednotlivé modifikace provedení anastomózy [16]. Po levostranných resekcích pankreatu se pahýl nejčastěji ošetřuje přešitím nebo se k transekci pankreatu použije stapler. Rozsáhlá multicentrická randomizovaná studie neprokázala výhodu jedné z těchto operačních technik [17]. Ani ostatní randomizované studie nepřinesly jednoznačné výsledky. Dosud nebyl ustanoven platný konsenzus, která chirurgická technika ošetření zbytkového parenchymu pankreatu je optimální [12].
Dalším postupem, který může ovlivnit četnost pankreatické píštěle, je použití a manipulace s břišními drény po resekci pankreatu. Poslední studie ukazují, že použití pojistných břišních drénů, volba použitého drénu a manipulace s drény může ovlivnit vznik pooperačních komplikací [18]. Cílem tohoto sdělení je shrnout současné poznatky o použití drénů v pankreatické chirurgii.
Specifika drénů v pankreatické chirurgii
Pojistné drény se tradičně používají v chirurgických oborech. Podle tradičních postupů a zkušeností výhody drénů většinou převažovaly nad jejich nevýhodami, proto se břišní drenáž zakládala téměř po každé operaci. Hlavní význam drénů je prevence vzniku nitrobřišních tekutinových kolekcí, časná diagnostika pooperačního krvácení, pankreatické nebo biliární píštěle či dehiscence anastomóz [19]. Navíc po resekci pankreatu může být delší ponechání břišního drénu součástí konzervativní léčby pankreatické píštěle, tzv. vytvoření kontrolované zevní pankreatické píštěle, tj. drén postačí ponechat až do zhojení píštěle a žádná další terapie není potřebná [18].
V posledních letech se ukazuje, že u některých operací není nutné břišní drény používat. Nepoužití drénů může dokonce přinášet výhody pro pacienty. Na mnoha operačních postupech bylo dokázáno, že použití břišní drenáže nezlepšuje výsledky [20], např. cholecystektomie, apendektomie, gastrektomie, resekce tračníku, resekce jater.
Některé studie ukázaly, že rutinní použití břišní drenáže může naopak zpomalit rekonvalescenci, zpomalit obnovu pasáže, prodloužit dobu hospitalizace, a dokonce působit pooperační komplikace způsobovat, např. retrográdní infekci, perforaci orgánů, ztrátu tekutiny a elektrolytů. Drény se mohou navíc dislokovat nebo ucpat a tím ztratit svoji funkci [18].
U resekce pankreatu je situace odlišná od chirurgie ostatních orgánů a konstrukce anastomóz na ostatních orgánech, např. tračníku, žaludku aj. Pankreatická anastomóza není nikdy zcela těsná [21]. Pankreatický leak neboli pankreatickou píštěl je možné snadno diagnostikovat analýzou amyláz ve výdeji z drénů. Molinari et al. ukázali, že první pooperační den jsou amylázy v drénech zvýšené téměř u všech pacientů. Dokonce i u těch pacientů, u kterých se pankreatická píštěl později nevyvine [21]. Tato skupina autorů z Verony analyzovala 137 pacientů a ukázala, že elevace koncentrace amyláz v drénu první pooperační den (nad 5000 IU/L) je prediktorem vzniku pooperační pankreatické píštěle [21]. Podobnou analýzu provedla skupina autorů ze Stockholmu; ukázali, že kombinace elevace amyláz v drénu a CRP nad 202 mg/l třetí pooperační den spolehlivě predikuje vznik pooperační pankreatické píštěle [22].
Zásadní otázkou je, zda je možné nějakými postupy zabránit vzniku klinicky závažné pankreatické píštěle v pooperačním období. Poslední studie ukazují, že v této situaci mají velký význam břišní drény a manipulace s nimi [13,18]. Při studiu významu drénů v pankreatické chirurgii jsou tři zásadní otázky:
- Zda drény vůbec používat?
- Kdy břišní drény odstraňovat?
- Který typ drénu je vhodnější?
Je nutné používat břišní drény po resekci pankreatu?
Břišní drény se tradičně používaly v břišní chirurgii u většiny operací včetně resekce pankreatu. V roce 1992 byla publikována první pilotní studie, ve které bylo analyzováno 22 pacientů, kteří podstoupili parciální duodenopankreatektomii bez břišního drénu [23]. Další dvě studie následovaly na přelomu století [24,25], ale většina studií byla publikována až v posledních čtyřech letech [26−31]. Výsledky těchto studií jsou shrnuty v Tab. 1.
Tab. 1. Výsledky studií porovnávající resekci pankreatu s drénem a bez drénu Tab. 1: Results of studies comparing pancreatic resection with and without drain 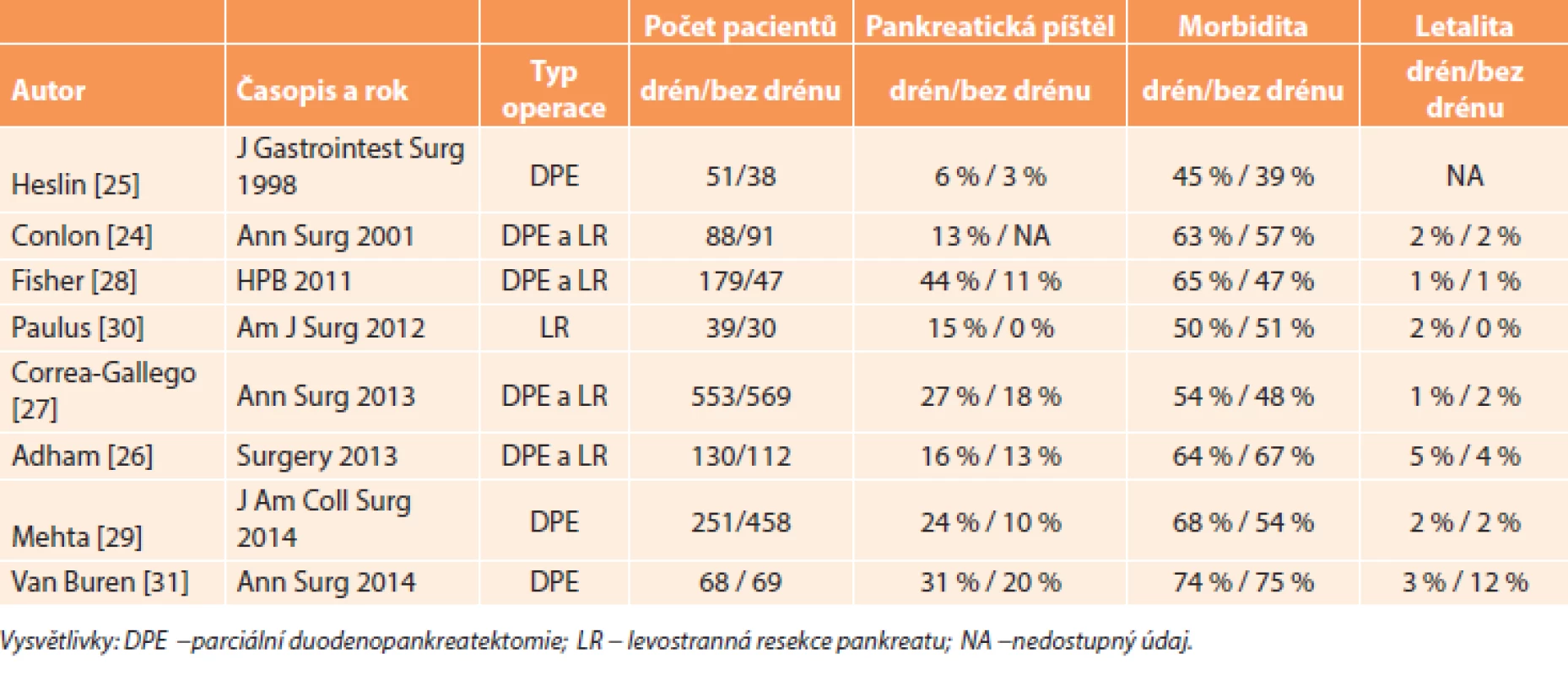
Mezi zastánce resekce pankreatu bez drénu patří zejména dvě pracoviště: Memorial Sloan-Kettering Cancer Center v New Yorku, USA [24,25,27] a DeBakey Department of Surgery v Houstonu, USA [28,31]. Heslin a kol. z prvního zmíněného pracoviště publikovali retrospektivní studii v roce 1998 [25]. Skupiny pacientů s drény i bez drénů měly porovnatelné výsledky (pankreatická píštěl, morbidita, doba hospitalizace). Na základě těchto výsledků autoři zahájili prospektivní randomizovanou studii. Ve skupině pacientů s drénem byla vyšší četnost nitrobřišních abscesů, tekutinových kolekcí a pankreatických píštělí [24]. Třetí práce ze stejného pracoviště byla publikována v roce 2013 [27]. Jednalo se o retrospektivní studii, která zahrnovala největší počet pacientů – celkem 1122. Resekce pankreatu provádělo šest chirurgů, kteří byli rozděleni do tří skupin po dvou: 1) standardně zakládali břišní drenáž, 2) drény používali selektivně, a 3) drény standardně nepoužívali. Pacienti ve skupině bez drénů měli nižší závažnou morbiditu (26 % versus 33 %, p=0,01), kratší dobu hospitalizace (7 versus 8 dní, p<0,01), méně rehospitalizací (20 % versus 27 %, p=0,01) a nižší četnost klinicky závažných pankreatických píštělí (16 % versus 20 %, p=0,05) ve srovnání se skupinou pacientů, u kterých byl použit drén [27]. Ačkoliv se jedná o významné pracoviště a velkou skupinu pacientů, při detailnější analýze je nutné poukázat na několik faktů: 1) I když na stejném pracovišti bylo o 12 let dříve v randomizované prospektivní studii prokázáno, že použití drénů po resekci pankreatu není nutné, stále byla břišní drenáž u poloviny pacientů použita, 2) ve skupině bez drénu byl výrazně kratší operační čas u duodenopankreatektomie (206 minut versus 295 minut, p<0,001) a nižší krevní ztráta (400 ml versus 525 ml, p<0,001) při porovnání se skupinou s drénem, což mohlo znamenat, že ve skupině bez drénu se jednalo o méně náročné, technicky jednodušší operace s hladším průběhem, 3) nejzávažnější skutečností je, že ve skupině bez drénů byla třikrát vyšší pooperační letalita (3 % versus 1 %, p=0,02).
I z pracoviště z Houstonu [28] byla nejprve publikována retrospektivní studie, která ukázala, že ve skupině pacientů s drénem byla vyšší morbidita (65 % versus 47 %, p=0,02) a vyšší četnost zpomaleného vyprazdňování žaludku (24 % versus 9 %, p=0,02), ale na druhou stranu nižší četnost rehospitalizací (9 % versus 17 %, p=0,007) a nižší četnost CT-navigované drenáže nitrobřišních kolekcí (2 % versus 11 %, p=0,001). Pankreatická píštěl byla častější ve skupině s drénem, ale v naprosté většině případů se jednalo pouze o klinicky nezávažnou píštěl stupně A. Klinicky závažné píštěle stupně B/C byly stejně časté v obou skupinách (12 % a 11 %) [28]. Na základě této studie byla v roce 2011 zahájena prospektivní randomizovaná multicentrická studie, která měla za cíl porovnat výsledky resekce pankreatu s drénem a bez drénu. Do studie mělo být zahrnuto celkem 570 pacientů [31]. Nicméně tato studie byla předčasně ukončena po zásahu etické komise, protože ve skupině bez drénu byla neúnosně vysoká pooperační letalita (12 % versus 3 %, p=0,097) i při nižší četnosti pankreatické píštěle (20 % versus 31 %). I v této studii byla naprostá většina případů pankreatické píštěle ve skupině s drénem stupně A, tedy klinicky nevýznamná [31].
Tato poslední studie je v rozporu s výsledky předchozích studií. Na úrovni EBM 1 (evidence-based medicine) ukazuje, že je vhodnější břišní drén po resekci pankreatu použít. Na většině významných světových pracovišť se nitrobřišní drén stále používá [19].
Vyšší četnost pooperační pankreatické píštěle ve skupinách s drénem byla způsobena tím, že se do celkového počtu píštělí započítávaly také píštěle stupně A, tj. biochemická píštěl, která nemá žádný klinický ani jiný dopad [26,28,31]. Další nevýhodou uvedených studií je skutečnost, že byly prováděny ve specializovaných high-volume centrech, která mají zpravidla lepší výsledky. Nicméně z tohoto důvodu výsledky těchto studií nelze obecně přenést na všechna pracoviště, kde se resekce pankreatu provádí. Četnost pankreatické píštěle nelze také porovnávat mezi jednotlivými uvedenými studiemi, protože byly použity různé definice pankreatické píštěle [10].
Situaci v České republice jsme zkoumali pomocí dotazníku, oslovili jsme 29 pracovišť, která se zabývají chirurgií pankreatu. Součástí dotazníku byla i tato otázka: Používáte pojistné břišní drény po resekci pankreatu? Dotazníky byly navráceny z 22 pracovišť (76 %) a všichni respondenti uvedli, že pojistné břišní drény používají vždy.
Kdy je vhodné břišní drény odstranit?
Další závažnou otázkou při manipulaci s drény po resekci pankreatu je, kdy je vhodné drén odstranit. Podle tradičních postupů se drén odstraňoval po snížení objemu sekrece a snížení koncentrace amyláz [30]. Někteří autoři zastávají názor, že je vhodné ponechat břišní drén delší dobu, dokud neklesne sekrece pod 5 ml za 24 hodin [32]. Skupina autorů z Milána publikovala sestavu 123 pacientů, kteří podstoupili levostrannou resekci pankreatu. Pankreatická píštěl se vyvinula u 42 pacientů (34 %), z toho 39 pacientů bylo propuštěno domů s drénem. Průměrná doba ponechání drénu ve skupině s pankreatickou píštělí byla 36±17 dní. Podle autorů tento „velmi opatrný“ postup přináší méně komfortu pro pacienty, ale zároveň méně klinicky závažných komplikací a reoperací [32]. Nicméně v poslední době je spíše tendence k časnějšímu odstranění drénů. Byly publikovány dvě studie. První byla retrospektivní s historickou kontrolní skupinou [33]. Autoři porovnávali odstranění drénů 4. pooperační den s odstraněním 8. pooperační den; ukázali, že ve skupině s časným odstraněním drénů byla nižší četnost pankreatických píštělí a břišních tekutinových kolekcí. Podle autorů delší ponechání drénů způsobuje většinu infekčních komplikací [33].
Druhá studie byla prospektivní randomizovaná [34]. Na sestavě 114 pacientů autoři ukázali, že ve skupině s časným odstraněním drénů (3. pooperační den) je méně pankreatických píštělí (p=0,0001), méně břišních komplikací (p=0,002), a dokonce i méně respiračních komplikací (p=0,007) než při pozdějším odstranění drénů. I přes metodologické problémy obou studií se jasně ukázalo, že časné odstranění drénů přináší lepší výsledky [19,35].
Který typ drénu je vhodnější?
Poslední otázkou v rámci studia drenáže po resekci pankreatu je, který typ drénu je vhodnější. Obecně je možné drenážní systémy rozdělit na otevřené (kapilární drény, Penrosovy drény) a uzavřené. Ty je možné dále rozdělit na drény spádové a odsavné. Obecně se ukazuje, že uzavřený drenážní systém je vhodnější než otevřený systém, méně často dochází k retrográdní infekci. Při porovnání uzavřeného spádového a uzavřeného odsavného drénu je možné říci, že drény s aktivním sáním jsou efektivnější, protože tekutina je z dutiny břišní aktivně nasávána [36]. Na druhou stranu panují obavy, že aktivní sání může nasávat tekutinu skrz pankreatickou anastomózu nebo linii sutury pankreatu a tím podpořit vznik pankreatické píštěle, případně poté ještě zhoršit její klinickou závažnost [37].
Obecně je možné říci, že na americkém kontinentě se spíše používají odsavné drény [24, 27−29,31]. V Evropě a Asii se spíše používají spádové drény [32,33] nebo kapilární drény [21]. Byly publikovány pouze dvě práce, které porovnávaly Penrosův drén a uzavřený odsavný drenážní systém [38,39]. Jednalo se však o retrospektivní analýzy pacientů za velmi dlouhou dobu (17 a 22 let), které porovnávaly typy drénů pouze okrajově a jejich výsledky jsou protichůdné. Cíleně se dosud nikdo nezabýval otázkou, zda může typ drénu ovlivnit četnost pooperační pankreatické píštěle [37]. V souhrnné práci autorů z Heidelbergu bylo konstatováno, že vliv typu drénu na četnost pooperační pankreatické píštěle a další výsledky je nejasný [18].
Na základě těchto výsledků jsme se rozhodli zahájit prospektivní randomizovanou studii, která má za cíl porovnávat typy drénů po resekci pankreatu. Do studie jsou zařazováni všichni pacienti starší 18 let, kteří na spolupracujících pracovištích (FN Hradec Králové a FN Olomouc) podstoupí parciální duodenopankreatektomii nebo levostrannou resekci pankreatu. Vyřazeni budou pacienti, kteří podstoupí totální pankreatektomii, centrální pankreatektomii, enukleaci, resekci pankreatu s resekcí žilního systému a s náhradou graftem, laparoskopickou operaci nebo multiviscerální resekci. Studie byla schválena etickou komisí na obou spolupracujících pracovištích a zaregistrována na portálu www.clinicaltrials.gov. V plánu je do studie zařadit 222 pacientů, aby byly výsledky signifikantní.
Diskuze
Ukazuje se, že význam drénů v pankreatické chirurgii je komplexnější, než se doposud uvádělo. Situace v pankreatické chirurgii je odlišná od chirurgie ostatních orgánů v dutině břišní. Pankreatická anastomóza nebo i resekční linie na pankreatu nejsou vždy zcela těsné; první den po operaci jsou amylázy v drénech zvýšené u většiny pacientů, to svědčí pro únik pankreatické šťávy do dutiny břišní, kde je jímána drény. Ukazuje se, že použití a manipulace s břišními drény může částečně ovlivnit pooperační výsledky. Při studiu významu drénu v pankreatické chirurgii je nutné odpovědět na tři zásadní otázky.
- Zda drény vůbec používat? I přes rostoucí počet studií, které uvádějí stejné nebo dokonce lepší výsledky u pacientů bez drénu po resekci pankreatu, poslední randomizovaná prospektivní studie ukázala, že ve skupině pacientů bez drénu je až trojnásobně vyšší pooperační letalita. Jedna z hypotéz uvádí, že při drobné netěsnosti anastomózy je pankreatická šťáva odvedena drény, vznikne tedy klinicky nevýznamná pankreatická píštěl stupně A. Pokud se však drén nepoužije, může pankreatická šťáva retinovat v retroperitoneu nebo v dutině břišní a tam způsobovat další komplikace (abscesy, sepse, multiorgánové selhání atd.). Samozřejmě je také nutné vzít v úvahu rizikové faktory vzniku pankreatické píštěle po operaci, z nichž nejzávažnější je charakter pankreatické tkáně a průměr pankreatického vývodu. Při resekci pankreatu např. pro chronickou pankreatitidu, kdy je pankreas tvrdý a pankreatický vývod dilatován, je riziko pankreatické píštěle nízké, je možné pojistný drén nepoužít. Na druhou stranu v případě měkkého pankreatu a nedilatovaného vývodu je vysoké riziko pankreatické píštěle, a proto je vhodnější drén použít. V současné době resekce pankreatu bez použití pojistných drénů nemůže být rutinně doporučena.
- Kdy pojistné drény odstraňovat? Touto otázkou se zabývaly dvě studie a obě celkem jednoznačně ukázaly, že časné odstranění drénů je pro pacienty výhodnější.
- Který typ drénu je vhodnější po resekci pankreatu? Touto otázkou se zabývaly dvě studie pouze okrajově, jejich výsledky proto nemusejí být zcela validní. V citovaných studiích byly použity různé typy drénů a dosud není jasné, jak typ drénu ovlivní pooperační výsledky. Z tohoto důvodu byla zahájena prospektivní randomizovaná studie, která má za cíl odpovědět na tuto otázku.
MUDr. Filip Čečka, Ph.D.
Chirurgická klinika FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
e-mail: filip.cecka@seznam.cz
Zdroje
1. Ryska M, Dusek L, Pohnán R, Bunganič B, Bieberová L, et al. Kvalita života je důležitým faktorem indikační rozvahy u nemocných s pokročilým karcinomem pankreatu − multicentrická prospektivní studie. Rozhl Chir 2012;91 : 199−208.
2. Pavlidis TE, Pavlidis ET, Sakantamis AK. Current opinion on lymphadenectomy in pancreatic cancer surgery. Hepatobiliary Pancreat Dis Int 2011;10 : 21−25.
3. Wagner M, Redaelli C, Lietz M, Seiler CA, Friess H, et al. Curative resection is the single most important factor determining outcome in patients with pancreatic adenocarcinoma. Br J Surg 2004;91 : 586−594.
4. Butturini G, Daskalaki D, Molinari E, Scopelliti F, Casarotto A, et al. Pancreatic fistula: definition and current problems. J Hepatobiliary Pancreat Surg 2008;15 : 247−251.
5. Haddad LB, Scatton O, Randone B, Andraus W, Massault PP, Dousset B, et al. Pancreatic fistula after pancreaticoduodenectomy: the conservative treatment of choice. HPB (Oxford) 2009;11 : 203−209.
6. Rudiš J, Ryska M. Ošetření pankreatické pooperační píštěle gastrofistuloanastomózou – soubor kazuistik. Rozhl Chir 2012;91 : 620−624.
7. Čečka F, Jon B, Šubrt Z, Ferko A. Clinical and economic consequences of pancreatic fistula after elective pancreatic resection. Hepatobiliary Pancreat Dis Int 2013;12 : 533−539.
8. Bassi C, Dervenis C, Butturini G, Fingerhut A, Yeo C, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005;138 : 8−13.
9. Buchler MW, Wagner M, Schmied BM, Uhl W, Friess H, et al. Changes in morbidity after pancreatic resection: toward the end of completion pancreatectomy. Arch Surg 2003;138 : 1310−1314,discussion 1315.
10. Bassi C, Butturini G, Molinari E, Mascetta G, Salvia R, et al. Pancreatic fistula rate after pancreatic resection. The importance of definitions. Dig Surg 2004;21 : 54−59.
11. Pratt WB, Maithel SK, Vanounou T, Huang ZS, Callery MP, et al. Clinical and economic validation of the International Study Group of Pancreatic Fistula (ISGPF) classification scheme. Ann Surg 2007;245 : 443−451.
12. Čečka F, Jon B, Šubrt Z, Ferko A. Pankreatická píštěl − definice, rizikové faktory a možnosti léčby. Rozhl Chir 2013;92 : 77−84.
13. Giovinazzo F, Butturini G, Salvia R, Mascetta G, Monsellato D, et al. Drain management after pancreatic resection: state of the art. J Hepatobiliary Pancreat Sci 2011, Epub ahead of print.
14. Klempa I, Schwedes U, Usadel KH. Prevention of postoperative pancreatic complications following duodenopancreatectomy using somatostatin. Chirurg 1979;50 : 427−431.
15. Čečka F, Jon B, Šubrt Z, Ferko A. The effect of somatostatin and its analogs in the prevention of pancreatic fistula after elective pancreatic surgery. Eur Surg 2012;44 : 99−108.
16. Shrikhande SV, Qureshi SS, Rajneesh N, Shukla PJ. Pancreatic anastomoses after pancreaticoduodenectomy: do we need further studies? World J Surg 2005;29 : 1642−1649.
17. Diener MK, Seiler CM, Rossion I, Kleeff J, Glanemann, et al. Efficacy of stapler versus hand-sewn closure after distal pancreatectomy (DISPACT): a randomised, controlled multicentre trial. Lancet 2011;377 : 1514−1522.
18. Diener MK, Tadjalli-Mehr K, Wente MN, Kieser M, Buchler MW, et al. Risk-benefit assessment of closed intra-abdominal drains after pancreatic surgery: a systematic review and meta-analysis assessing the current state of evidence. Langenbecks Arch Surg 2011;396 : 41−52.
19. Buchler MW, Friess H. Evidence forward, drainage on retreat: still we ignore and drain!? Ann Surg 2006;244 : 8−9.
20. Petrowsky H, Demartines N, Rousson V, Clavien PA. Evidence-based value of prophylactic drainage in gastrointestinal surgery: a systematic review and meta-analyses. Ann Surg 2004;240 : 1074–1084,discussion 1084−1085.
21. Molinari E, Bassi C, Salvia R, Butturini G, Crippa S, et al. Amylase value in drains after pancreatic resection as predictive factor of postoperative pancreatic fistula: results of a prospective study in 137 patients. Ann Surg 2007;246 : 281−287.
22. Ansorge C, Nordin JZ, Lundell L, Strommer L, Rangelova E, et al. Diagnostic value of abdominal drainage in individual risk assessment of pancreatic fistula following pancreaticoduodenectomy. Br J Surg 2014;101 : 100−108.
23. Jeekel J. No abdominal drainage after Whipple‘s procedure. Br J Surg 1992;79 : 182.
24. Conlon KC, Labow D, Leung D, Smith A, Jarnagin W, et al. Prospective randomized clinical trial of the value of intraperitoneal drainage after pancreatic resection. Ann Surg 2001;234 : 487–493,discussion 493−484.
25. Heslin MJ, Harrison LE, Brooks AD, Hochwald SN, Coit DG, et al. Is intra-abdominal drainage necessary after pancreaticoduodenectomy? J Gastrointest Surg 1998;2 : 373−378.
26. Adham M, Chopin-Laly X, Lepilliez V, Gincul R, Valette PJ, el al. Pancreatic resection: drain or no drain? Surgery 2013;154 : 1069−1077.
27. Correa-Gallego C, Brennan MF, D‘Angelica M, Fong Y, Dematteo RP, et al. Operative drainage following pancreatic resection: analysis of 1122 patients resected over 5 years at a single institution. Ann Surg 2013;258 : 1051−1058.
28. Fisher WE, Hodges SE, Silberfein EJ, Artinyan A, Ahern CH, et al. Pancreatic resection without routine intraperitoneal drainage. HPB (Oxford) 2011;13 : 503−510.
29. Mehta VV, Fisher SB, Maithel SK, Sarmiento JM, Staley CA, el al. Is it time to abandon routine operative drain use? A single institution assessment of 709 consecutive pancreaticoduodenectomies. J Am Coll Surg 2013;216 : 635-642; discussion 642−634.
30. Paulus EM, Zarzaur BL, Behrman SW. Routine peritoneal drainage of the surgical bed after elective distal pancreatectomy: is it necessary? Am J Surg 2012;204 : 422−427.
31. Van Buren G, 2nd, Bloomston M, Hughes SJ, Winter J, Behrman SW, et al. A randomized prospective multicenter trial of pancreaticoduodenectomy with and without routine intraperitoneal drainage. Ann Surg 2014;259 : 605−612.
32. Balzano G, Zerbi A, Cristallo M, Di Carlo V. The unsolved problem of fistula after left pancreatectomy: the benefit of cautious drain management. J Gastrointest Surg 2005;9 : 837−842.
33. Kawai M, Tani M, Terasawa H, Ina S, Hirono S, Nishioka R, et al. Early removal of prophylactic drains reduces the risk of intra-abdominal infections in patients with pancreatic head resection: prospective study for 104 consecutive patients. Ann Surg 2006;244 : 1−7.
34. Bassi C, Molinari E, Malleo G, Crippa S, Butturini G, Salvia R, et al. Early versus late drain removal after standard pancreatic resections: results of a prospective randomized trial. Ann Surg 2010;252 : 207−214.
35. Yeo CJ. Pancreatic surgery 101: drain, no drain, early drain removal, or late drain removal. What are the data? Where do we go from here? Ann Surg 2010;252 : 215−216.
36. Grobmyer SR, Graham D, Brennan MF, Coit D. High-pressure gradients generated by closed-suction surgical drainage systems. Surg Infect (Larchmt) 2002;3 : 245−249.
37. Strobel O, Buchler MW. Drainage after pancreaticoduodenectomy: controversy revitalized. Ann Surg 2014;259 : 613−615.
38. Schmidt CM, Choi J, Powell ES, Yiannoutsos CT, Zyromski NJ, Nakeeb A, et al. Pancreatic fistula following pancreaticoduodenectomy: clinical predictors and patient outcomes. HPB Surg 2009;2009 : 404–520.
39. Yoshikawa K, Konishi M, Takahashi S, Gotohda N, Kato Y, Kinoshita T. Surgical management for the reduction of postoperative hospital stay following distal pancreatectomy. Hepatogastroenterology 2011;58 : 1389−1393.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Chylózní mezenteriální cysta
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2014 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Poznámka k současnému systému postgraduálního vzdělávání chirurgů v ČR
- Limity chirurgického řešení rakoviny pankreatu
- Význam drénů v pankreatické chirurgii
- Personalizovaná antibiotická terapie na chirurgické jednotce intenzivní péče − přehled současných znalostí a výsledky observační kinetické studie
- Tekutiny, nízká resekce rekta a zase tekutiny…
- Těžká hidradenitis suppurativa
- Chylózní mezenteriální cysta
- Retroperitoneální lymfangiom − laparoskopické řešení
- K životnímu jubileu docenta Zdeňka Slezáka
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chylózní mezenteriální cysta
- Retroperitoneální lymfangiom − laparoskopické řešení
- Význam drénů v pankreatické chirurgii
- Tekutiny, nízká resekce rekta a zase tekutiny…
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



