-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Porovnání perkutánní a otevřené radiofrekvenční ablace metastáz kolorektálního karcinomu ve FN Plzeň v letech 2001−2015
Comparison of percutaneous and open approach to radiofrequency ablation of colorectal liver metastases in Teaching Hospital Pilsen in 2001−2015
Introduction:
Radiofrequency ablation (RFA) is a well-established method for palliative therapy of unresectable liver tumors. We use an open or percutaneous approach for the treatment of colorectal liver metastases (CLM).Method:
Clinical data of patients undergoing percutaneous or open RFA for CLM between January 2001 and January 2015 were included in the retrospective study. We evaluated clinical factors for overall survival (OS), no evidence of disease (NED) and non-ablation in relation to tumor sizes and numbers, type of approach and type of used probes.Results:
147 patients underwent RFA for CLM in this time period. Mean age was 65 years. 168 RFAs were performed in total. OS was influenced by a high number of censors. OS for the first and third years was 93.6% and 61% with no statistical differences between the percutaneous and open approach. NED was significantly shorter in patients with the percutaneous approach. NED was not influenced neither by size nor number of the lesions. A higher risk of non-ablation was observed as statistically significant in patients with percutaneous RFA. A higher, although not statistically significant, risk of non-ablation was also observed for larger metastases. Patients with percutaneous RFA showed a shorter stay in the hospital and fewer complications.Conclusion:
RFA is an alternative approach to the treatment of unresectable CLM. In our study the open approach was associated with a lower risk of non-ablation. Percutaneous RFA showed a lower risk of complications and a shorter stay in the hospital.Key words:
radiofrequency ablation − percutaneous RFA − colorectal liver metastases − CLM − palliative therapy
Autori: J. Brůha 1,2; V. Liška 1,2; R. Pálek 1,2; H. Mírka 2,3; P. Hošek 2; E. Korčáková 3
; K. Bajcurová 2,3; J. Fichtl 1; T. Skalický 1; V. Třeška 1
Pôsobisko autorov: Chirurgická klinika LF Univerzity Karlovy a FN Plzeň přednosta: prof. MUDr. V. Třeška, DrSc. 1; Biomedicínské centrum, LF v Plzni, Univerzita Karlova v Praze vědecký ředitel: doc. MUDr. M. Štengl, Ph. D. 2; Klinika zobrazovacích metod FN Plzeň přednosta: prof. MUDr. B. Kreuzberg, CSc. 3
Vyšlo v časopise: Rozhl. Chir., 2016, roč. 95, č. 3, s. 107-111.
Kategória: Původní práce
Súhrn
Úvod:
Radiofrekvenční ablace (RFA) je etablovaná metoda využívaná k paliativnímu ošetření neresekabilních tumorů jater. Na našem pracovišti využíváme k ošetření metastáz kolorektálního karcinomu (CLM) otevřený či perkutánní přístup.Metoda:
V retrospektivní studii (1/2001−1/2015) jsme vyhodnotili klinická data u pacientů podstupujících perkutánní nebo otevřenou RFA pro neresekabilní CLM. Cílem bylo zhodnotit faktory ovlivňující celkové přežití (OS), bezpříznakové období (NED) a nonablaci ložisek ve vztahu k velikosti a počtu ložisek, typu přístupu a typu použité sondy.Výsledky:
RFA podstoupilo 147 pacientů s průměrným věkem 65 let. Celkem bylo provedeno 168 RFA výkonů. Celkové přežití bylo ovlivněno vysokým počtem cenzorů. Roční a tříleté OS bylo 96,3 % a 61 % bez statisticky významného rozdílu mezi perkutánním a otevřeným přístupem. NED bylo statisticky významně kratší u pacientů s perkutánním výkonem. NED nebylo ovlivněno ani velikostí, ani počtem ložisek. Vyšší riziko nonablace bylo pozorováno u větších ložisek, ale výsledek nebyl statisticky signifikantní. Perkutánní výkony měly kratší dobu hospitalizace a nižší počet komplikací.Závěr:
RFA je alternativní metoda léčby neresekabilních CLM. Otevřený přístup měl v naší studii nižší riziko nonablace. Perkutánní výkony měly nižší riziko komplikací a kratší dobu hospitalizace.Klíčová slova:
radiofrekvenční ablace − perkutánní RFA − metastázy kolorektálního karcinomu do jater − paliativní léčbaÚvod
Radiofrekvenční ablace (RFA) je paliativní metoda využívaná k ošetření neresekabilních nádorů jater. Poprvé byla využita k léčbě hepatocelulárního karcinomu v roce 1996, od roku 2000 se začala využívat i při léčbě metastatického postižení jater [1]. RFA využívá sond, které zavádíme do nádorového ložiska. Lokální působení střídavého proudu o vysoké frekvenci indukuje změnu toku iontů a vznikající tření pak generuje teplo, které vyvolává denaturaci bílkovin s koagulační nekrózou jaterní tkáně a s tím spojenou destrukci nádoru [1,2].
Kolorektální karcinom je nejčastěji metastazujícím tumorem do jater. Pouze 20 % jaterních metastáz kolorektálního karcinomu je primárně resekabilních [3]. V případě, že ani augmentační či etapové výkony (PVE – embolizace portální žíly, ALPPS – Associating liver partition and portal vein ligation for staged hepatectomy) nebo downsizing chemoterapií neumožní resekci, pak RFA nabízí možnost ošetření, a tím i zpomalení progrese onemocnění. RFA využíváme u neresekabilního metastatického postižení jater, a to z důvodů: 1. nedostatečného zbytkového jaterního objemu (FLRV), 2. komorbidit a celkového stavu pacienta, který nepřipouští resekční výkon, 3. počtu a nepříznivého uložení metastáz v jaterním parenchymu [3]. RFA také využíváme v rámci etapových výkonů k přípravě levého jaterního laloku před provedením embolizace či ligace pravé větve portální žíly [2]. RFA lze provést operační cestou, laparoskopicky či perkutánně pod kontrolou zobrazovací metody (zpočátku používaná ultrasonografická (USG) navigace byla dnes ve většině případů nahrazena výpočetní tomografií (CT)). Obecně udávané kontraindikace RFA jsou extrahepatálně uložené metastázy a u perkutánních výkonů pak ložiska jater uložená v periferii, která nesou riziko tepelného poškození orgánů v okolí.
Cílem této studie bylo vyhodnotit klinická data u pacientů, kteří na našem pracovišti podstoupili RFA pro jaterní metastázy kolorektálního karcinomu, a porovnat výsledky mezi skupinou pacientů podstupujících RFA otevřenou a perkutánní cestou.
Metoda
Do studie byli zařazeni pacienti, kteří v období od ledna 2001 do ledna 2015 podstoupili RFA metastáz kolorektálního karcinomu do jater na Chirurgické klinice LF UK a FN Plzeň. Z daného souboru byli vyřazeni pacienti, kteří měli RFA spojenou s resekčním výkonem, nebo kde byla RFA provedena v rámci etapového výkonu. Vyloučeni byli i pacienti s duplicitním tumorem.
RFA prováděl stejný tým jaterních chirurgů či radiologů. Od roku 2001 do 10/2014 byl k RFA použit přístroj RITA 1500X (RITA Medical System, Inc., Mountain View, USA). Od 10/2014 používáme přístroj Covidien Cool type E series (COVIDIEN, Gosport Hampshire, UK). RFA byly provedeny buď operační cestou s peroperační USG kontrolou, nebo ve spolupráci s Klinikou zobrazovacích metod jako perkutánní výkony pod CT nebo USG navigací nebo s využitím CT i USG kontroly současně. Léze do průměru 3 cm byly ošetřeny tzv. single sondami se samostatnou jehlou (Obr. 1), léze nad 3 cm pomocí Cluster sondy − trojjehla (Obr. 2), a to do optimální velikosti 5 cm. Větší léze byly ošetřeny i přes vyšší riziko nonablace vícenásobnou RFA.
Obr. 1. RFA Single sonda Fig. 1. RFA Single probe 
Obr. 2. RFA Cluster sonda Fig. 2. RFA Cluster probe 
K RFA pod CT byli indikováni pacienti, kteří byli v minulosti již po operačních výkonech na játrech a další preparace by v terénu srůstů byla riziková z poranění okolních orgánů a struktur (především tračník, duodenum a hepatoduodenální ligamentum) a polymorbidní pacienti s vysokým rizikem peroperačních a pooperačních komplikací při resekčním výkonu.
Dva dny po provedené RFA jsme provedli CT jater k posouzení nonablace ložisek. Další kontroly s kontrolním USG nebo CT jater následovaly v pravidelných tříměsíčních intervalech.
U sledovaného souboru pacientů byly analyzovány následující klinické faktory: nonablace ložisek, počet a rozměr největšího metastatického ložiska. Také jsme hodnotili typ použité RFA sondy a výskyt komplikací po výkonu. Výše zmíněné klinické faktory byly hodnoceny ve vztahu k celkovému přežití (OS – Overall Survival) a bezpříznakovému období (NED – No Evidence of Disease). Nádorové markery nebyly v této studii sledovány. Získaná data pak byla porovnána mezi skupinou pacientů s operačním a perkutánním výkonem.
Nonablace byla hodnocena jako recidiva při zobrazovacím vyšetření v místě provedené RFA do 6 měsíců od výkonu. Hodnocena byla jen ložiska ošetřená RFA. Nově vzniklé ložisko bylo hodnoceno jako recidiva ovlivňující NED a OS. Pokud byla ložiska ošetřena ve více sezeních, pak bylo hodnocení provedeno od poslední intervence.
Data byla vyhodnocena statistikem v programu STATISTICA (data analysis software system), version 12. Analýza přežití byla provedena pomocí Kaplanovy-Meirovy metody, k ověření statistické významnosti rozdílů pozorovaných mezi skupinami byly použity Gehanův-Wilcoxonův, Coxův-Mantelův a Log-rank test, všechny na hladině významnosti α=0,05. Vliv spojitých nezávislých proměnných byl analyzován pomocí Coxova modelu proporcionálních rizik. Pro posouzení vzájemné závislosti kategorických proměnných byly použity testy významnosti na příslušných kontingenčních tabulkách, a to Chí-kvadrát a Fisherův přesný test. Pro testování významnosti rozdílů kvantitativních veličin mezi dvěma kategoriemi byl použit Mannův-Whitneyův U test.
Výsledky
Za dané období podstoupilo RFA 182 pacientů. Po vyloučení pacientů s duplicitou a RFA provedenou při současné resekci jater nebo v rámci etapového výkonu jsme získali soubor 156 pacientů. Jednalo se o 111 mužů a 45 žen, průměrný věk byl 65 let (38–82 let). V rámci 168 výkonů bylo v souboru provedeno 332 jednotlivých RFA. Otevřeným přístupem jsme provedli 254 RFA výkonů, 78 výkonů provedli radiologové perkutánním přístupem. 210 RFA bylo provedeno pomocí Single sond, 83 RFA pomocí Cluster sond a u 39 RFA byla použita kombinace obou sond. U 95 výkonů jsme ošetřili 1 ložisko, u 73 výkonů jsme ošetřili více ložisek (2 ložiska u 39 výkonů, 3 ložiska u 13 výkonů, 4 ložiska u 12 výkonů a 5 ložisek u 9 výkonů). Celkem bylo ošetřeno 305 ložisek. Single sondou bylo ošetřeno celkem 230 ložisek, Cluster sondou 60 ložisek a 15 ložisek bylo ošetřeno kombinací Cluster a Single sondy. Nejmenší ošetřené ložisko mělo 5 mm v průměru, největší pak 90 mm, průměrná velikost ložisek byla 28,7 mm. U 2 pacientů se údaj o velikosti ložiska nepodařilo dohledat.
Zastoupení mužů a žen v porovnávaných skupinách bylo stejné. Ve skupině otevřených výkonů bylo 72 mužů (71 %) a 30 žen (29 %), ve skupině perkutánních výkonů bylo 39 mužů (72 %) a 15 žen (28 %). U otevřených výkonů bylo v průměru ošetřeno 2,1 ložiska (1−5 ložisek) o průměrné velikosti 30,0 mm (9−80 mm), u perkutánních výkonů radiologové ošetřili v průměru 1,2 ložiska (1−2 ložiska) o průměrné velikosti 26,1 mm (5−90 mm). V případě uvedených maximálních rozměrů ložisek se jednalo o atypické léze, které byly řešeny vícenásobnou RFA.
Vzhledem k zatížení souboru velkým počtem cenzorů (pacienti, kteří se ztratili ze sledování) mohou data pro celkové přežití vykazovat statistickou chybu. 1. rok přežívalo 93,6 % pacientů, 2. rok 77 % a 3. rok 61 % pacientů (Graf 1). Délka OS nebyla ovlivněna velikostí ložiska, rozdíl mezi operačním a perkutánním přístupem byl bez statisticky signifikantních rozdílů (Graf 2).
Graf 1. OS u pacientů podstupujících RFA pro CLM Graph 1. OS in patients undergoing RFA for CLM 
Graf 2. OS pacientů podle typu výkonu Graph 2. OS in relation to the type of procedure 
NED byl kratší u perkutánních výkonů v porovnání s operačním výkonem. Poločas NED je 0,515 roku (6,2 měsíce) (Graf 3), u operačních výkonů 0,553 roku (6,6 měsíce) a u perkutánních výkonů 0,418 roku (5 měsíců) (Graf 4). V naší studii nebylo NED závislé na počtu (Graf 5) ani velikosti největšího ložiska.
Graf 3. NED u pacientů podstupujících RFA pro CLM Graph 3. NED in patients undergoing RFA for CLM 
Graf 4. NED podle typu výkonu Graph 4. NED in relation to the type of procedure 
Graf 5. Závislost NED na počtu ložisek Graph 5. Dependence of NED on the number of lesions 
Statisticky významně vyšší riziko nonablací jsme pozorovali u pacientů podstupujících perkutánní RFA (26,8 %) oproti skupině pacientů s operačním přístupem (13,6 %). Vyšší počet nonablací byl pozorován i u větších ložisek, ale tento trend nebyl statisticky signifikantní (Graf 6). Nonablace ložisek nebyla ovlivněna typem použité sondy.
Graf 6. Velikost metastatického ložiska ve vztahu ke kompletní ablaci a non-ablaci Graph 6. Size of the metastatic lesion in relation to complete ablation and non-ablation 
U pacientů s perkutánně provedenou RFA byla významně kratší doba hospitalizace než u skupiny s operačním výkonem (5,41 ku 8,86 dne) (Graf 7). Perkutánní přístup byl také zatížen významně menším rizikem pooperačních komplikací (5,5 % výkonů u perkutánní RFA a 17,3 % výkonů u operační RFA). Mezi nejčastější komplikace patřily febrilní špičky, bronchopneumonie, abscesy jater (řešené drenáží pod CT) či krvácení (Tab. 1). Operační řešení si vyžádaly 4 komplikace – poranění bránice, mechanická dehiscence v ráně po subkostálním řezu, krvácení a popálenina v místě uložení indiferentní elektrody, která si vyžádala nekrektomii.
Graf 7. Doba hospitalizace ve vztahu k provedenému výkonu Graph 7. Time of hospitalization in relation to performed procedure 
Tab. 1. Shrnutí komplikací podle Clavien-Dindo klasifikace Tab. 1. Overview of complications according to Clavien-Dindo classification 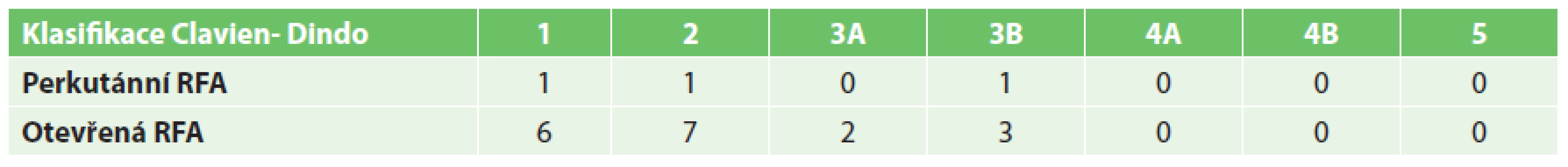
Diskuze
RFA je destruktivní metoda využívaná k paliativní léčbě neresekabilních metastáz kolorektálního karcinomu do jater. V důsledku působení elektrického proudu o vysoké frekvenci vzniká v místě působení teplo a teplem indukovaná koagulační nekróza v okolí. Rizikem této metody je inkompletní ablace a s tím spojená brzká rekurence v místě výkonu. Pětileté přežití u otevřené RFA je v odborné literatuře udáváno mezi 13−40 % (počítané od provedení RFA) [4,5]. První tři roky přežívá 31−57 % (1. rok 81−92 %, 2. rok 65−80 %, 3. rok 31−57 %) [3,5,6]. Medián bezpříznakového období se pohybuje mezi 6−13 měsíci [4], Boame udává medián 8,2 měsíce při využití samotné RFA, v kombinaci s chemoterapií udává medián 13,3 měsíce [7]. Alternativou otevřeného výkonu jsou perkutánní výkony nejčastěji prováděné pod CT kontrolou. Perkutánní výkony jsou většinou využívány u dvou skupin pacientů. První jsou polymorbidní pacienti, u kterých je operační výkon rizikový. Druhou skupinou jsou pacienti s recidivou metastáz do jater, kteří již v minulosti podstoupili operační výkony a u kterých by další operace otevřeným přístupem byla obtížná. Perkutánní RFA je doporučována u relativně malých tumorů [8], obvykle do 3 cm v průměru [9]. 1. rok přežívá 90 % pacientů, 2. rok 66 %, 3. rok 41−48 % a 5leté přežití je 31 %. Medián bezpříznakového období je pak udáván v rozmezí 10−26 měsíců [8,9]. Komplikace u perkutánních výkonů se vyskytly u 23 % pacientů. Nejčastějšími komplikacemi byly pneumothorax, tromboembolická nemoc, pleurální výpotek, bilom či intraparenchymatózní hematom [9].
Ze zmíněných studií je velikost ložiska udávána jako významný prediktor kratšího bezpříznakového období, přičemž ložiska menší než 3 cm v průměru mají toto období delší [9].
Náš soubor pacientů byl ve vztahu k OS zatížen vysokým počtem cenzorů. Předpokládáme tedy, že výsledná čísla u OS budou ve skutečnosti nižší. I přesto jsou získané výsledky srovnatelné s údaji udávanými v odborné literatuře. NED bylo významně kratší u perkutánních výkonů oproti otevřenému přístupu. Tento fakt může být ovlivněn využíváním USG navigace v prvních letech provádění perkutánní RFA. Perkutánní přístup byl oproti otevřené RFA zatížen i vyšším počtem nonablací. Riziko nonablace stoupá s velikostí ložiska. Tento trend jsme pozorovali i u našeho souboru pacientů, i když vzhledem k malému počtu pacientů nebyl statisticky významný (Graf 6). Riziko a rozsah komplikací je u našeho souboru srovnatelný s odbornou literaturou. Nižší procento komplikací bylo u perkutánních výkonů. U perkutánních výkonů byla i kratší doba hospitalizace. Na základě našich výsledků lze vzhledem k nižšímu riziku nonablace doporučit otevřený přístup. Perkutánní přístup je pak vhodný především u polymorbidních a rizikových pacientů nebo u pacientů, kteří již v minulosti prodělali operační výkony na játrech. Perkutánní RFA je též vhodná u pacientů s nutností rychlé rekonvalescence např. z důvodu pokračování v chemoterapii (typické např. u pacientek s jaterními metastázami karcinomu prsu).
Uvážíme-li studie, které porovnávají přežívání pacientů s perkutánním versus otevřeným výkonem, zjistíme, že výsledné přežití je u obou skupin stejné a nezávislé na provedené metodě [10]. Dalším pokrokem u perkutánních výkonů je využití instilace fyziologického roztoku do břišní dutiny u místa výkonu. Tím se oddálí okolní orgány (např. bránice či střevo), a jsou tak chráněny před tepelným poraněním [11,12,13]. Tato metoda tak již umožňuje provádění RFA i v periferii jaterní tkáně s minimálním rizikem poranění okolních struktur.
Riziko nonablací též stoupá, pokud se výkon provádí v blízkosti velkých cév, kdy průtok krve cévou ochlazuje perfundovanou jaterní tkáň. Tím nedosáhneme plného termoablačního účinku v daném místě. U otevřených výkonů může být řešením použití Pringlova manévru, kdy omezíme průtok krve jaterní tkání, ale stoupá zde riziko poranění žlučovodu, který běží v těsné blízkosti cév. V takovéto situaci může být řešením využití ireverzibilní evaporace místo RFA [14].
V minulosti byly zveřejněny i publikace, které udávají stejné přežití pacientů po RFA v porovnání s resekčním výkonem [15]. Nahrazení resekčních výkonů je však stále kontroverzní. Resekční výkon se zachováním R0 hranice v kombinaci s chemoterapií je stále jedinou radikální, a tudíž nejlepší možností léčby metastáz kolorektálního karcinomu [16].
Závěr
Porovnání RFA otevřeným a perkutánním přístupem u našeho souboru pacientů mluví ve prospěch otevřeného přístupu. S velikostí ložiska stoupá i riziko nonablace. Nejlepších výsledků je dosaženo, pokud jsou RFA ošetřeny léze do velikosti 3 cm. RFA je metoda, která by neměla nahrazovat resekční výkony a měla by být využita jen v případě, kdy nejsme schopni provést resekční výkon s dodržením R0 resekční linie.
Práce byla podpořena Výzkumným projektem UK v Praze, PRVOUK – P 36. Studie byla financována z Národního programu udržitelnosti I (NPU I) č. LO1503 poskytovaného Ministerstvem školství, mládeže a tělovýchovy.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. Jan Brůha
alej Svobody 80
304 60 Plzeň - Lochotín
e-mail: bruhaj@fnplzen.cz
Zdroje
1. Jarnagin WR, Belghiti J, Blumgart LH (Editors) Blumgart´s surgery of the liver, biliary tract and pancreas. 5th ed., Philadelphia, Saunders/Elsevier 2012.
2. Stoltz A, Gagniere J, Dupré A, et al. Radiofrequency ablation for colorectal liver metastases. J Visc Surg 2014;151 : 33−44.
3. Abitabile P, Hartl U, Lange J, et al. Radiofrequency ablation permits an effective treatment for colorectal liver metastasis. Eur J Surg Oncol 2007;33 : 67−71.
4. Stang A, Fischbach R, Teichmann W, et al. A systematic review on the clinical benefit and role of radiofrequency ablation as treatment of colorectal liver metastases. Eur J Cancer 2009;45 : 1748–56.
5. Starý L, Klementa I, Zbořil P, et al. Přežívání nemocných po radiofrekvenční ablaci jaterních metastáz kolorektálního karcinomu. Rozhl Chir 2010;12 : 780−3.
6. Babawale SN, Jensen TM, Frøkjær JB. Long-term survival following radiofrequency ablation of colorectal liver metastases: A retrospective study.World J Gastrointest Surg 2015;7 : 33−8.
7. Boame N, Gresham G, Jonker D, et al. Use of chemotherapy and radiofrequency ablation to treat colorectal cancer metastases: a retrospective review of The Ottawa Hospital Cancer Centre over 7 years. Curr Oncol 2014;21 : 557−63.
8. Sofocleous CT, Petre EN, Gonen M, et al. CT-guided radiofrequency ablation as a salvage treatment of colorectal cancer hepatic metastases developing after hepatectomy. J Vasc Interv Radiol 2011;22 : 755−61.
9. Shady W, Petre EN, Gonen M, et al. Percutaneous radiofrequency ablation of colorectal cancer liver metastases: Factors affecting outcomes-A 10-year experience at a single center. Radiology 2015;12 : 142489. [Epub ahead of print].
10. Wong J, Lee KF, Yu SC, et al. Percutaneous radiofrequency ablation versus surgical radiofrequency ablation for malignant liver tumours: the long-term results. HPB (Oxford) 2013;15 : 595−601.
11. Chen EA, Neeman Z, Lee FT, et al. Thermal protection with 5% dextrose solution blanket during radiofrequency ablation. Cardiovasc Intervent Radiol 2006;2 : 1093−6.
12. Bodily KD, Atwell TD, Mandrekar JN, et al. Hydrodisplacement in the percutaneous cryoablation of 50 renal tumors. AJR Am J Roentgenol 2010;194 : 779−83.
13. Lee SJ, Choyke LT, Locklin JK, et al. Use of hydrodissection to prevent nerve and muscular damage during radiofrequency ablation of kidney tumors. J Vasc Interv Radiol 2006;17 : 1967−9.
14. Skalický T, Třeška V, Šnajdauf J, et al. Hepato-pankreato-biliární chirurgie. Praha, Maxdorf Jessenius 2011.
15. Oshowo A, Gillams A, Harrison E, et al. Comparison of resection and radiofrequency ablation for treatment of solitary colorectal liver metastases. Br J Surg 2003;90 : 1240−3.
16. Třeška V, Skalický T, Ferda J, et al. Resekce jater pro metastázy kolorektálního karcinomu – současnost a perspektivy. Colorectal liver metastases surgery – the present and the perspectives. Rozhl Chir 2014;93 : 568−71.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2016 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Lumbálna sympatektómia − prehľad svetovej literatúry za posledných 15 rokov
- Porovnání perkutánní a otevřené radiofrekvenční ablace metastáz kolorektálního karcinomu ve FN Plzeň v letech 2001−2015
- Optimálne načasovanie laparoskopickej cholecystektómie v liečbe akútnej cholecystitídy
- Použití metody endoskopického odběru velké safény v periferní infrainguinální cévní chirurgii – zhodnocení iniciálních zkušeností
- Gigantické aneuryzma abdominální aorty a pánevních tepen
- Atypická, extrapankreatická pseudocysta pankreatu
- Sekundární angiosarkom břišní stěny po adjuvantní radioterapii pacientky s karcinomem dělohy − kazuistika
- Podmínky rozvoje chirurgie anebo pohled pravdě do očí
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Atypická, extrapankreatická pseudocysta pankreatu
- Optimálne načasovanie laparoskopickej cholecystektómie v liečbe akútnej cholecystitídy
- Lumbálna sympatektómia − prehľad svetovej literatúry za posledných 15 rokov
- Gigantické aneuryzma abdominální aorty a pánevních tepen
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



