-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Použití metody endoskopického odběru velké safény v periferní infrainguinální cévní chirurgii – zhodnocení iniciálních zkušeností
Endoscopic harvest of great saphenous vein for infrainguinal arterial bypass: summary of our initial experience
Introduction:
This study was undertaken to determine the feasibility of endoscopic vein harvest (EVH) for infrainguinal arterial bypass surgery. We describe our initial experience and early results of bypasses done using this minimally invasive approach.Method:
From April 2012 to March 2015, 16 patients underwent 16 femoropopliteal bypass operations with great saphenous vein (GSV) being harvested by endoscopic technique. The indication for intervention was critical limb ischemia (Rutherford category “5”) in 7 patients (43.7%) and severe intermittent claudication (Rutherford category “3”) in 9 patients (56.3%). There were 14 male (87.5%) and 2 female (12.5%) patients, with a mean age of 59.9 years. Selection of patients for EVH was based on clinical and duplex ultrasound appearance of GSV. Only patients with adequate GSV were considered for EVH. We collected data regarding patients’ demographics, history, clinical findings, operative procedures and postoperative recovery including complications. Patients were followed at 3, 6, 12, 18 and 24 months postoperatively and yearly thereafter. Patencies were analyzed by Kaplan-Meier method. Statistical analysis was performed using IBM SPSS Statistics 21.0 software (IBM Corp, Armonk, NY).Results:
Endoscopically harvested GSV was utilised for formation of proximal (10; 62.5%) or distal (6; 37.5%) femoropopliteal bypass. One patient underwent conversion to open harvest after endoscopic dissection of the vein. It occurred early in our experience. All other GSV harvests were accomplished endoscopically. 2 patients (12.5%) developed postoperative surgical site infection (SSI) Szilagyi gr. II (1 patient after successful EVH – location: groin; 1 patient after conversion of EVH to open vein harvest – location: groin and vein harvest incision). Mean follow-up was 10.2 months (range 0.3 to 27.0 months). At 1 and 2 years, primary patency was 82.0% and 82.0%, assisted primary patency was 93.8% and 93.8%, and secondary patency was 100.0% and 100.0%. At 1 and 2 years, amputation-free survival was 100.0% and 100.0%. No patient died within the study period (mortality 0.0%).Conclusions:
Endoscopic harvest of GSV is a minimally invasive alternative to a standard open harvest of GSV. It is a feasible option for patients undergoing infrainguinal arterial bypass. In our early experience, patencies of EVH femoropopliteal bypasses are comparable to those achieved using traditional open vein harvest technique. Combination of endoscopic vein harvest with femoropopliteal bypass formation results in a low incidence of surgical site infections.Key words:
endoscopic vein harvest – great saphenous vein – peripheral vascular surgery – femoropopliteal bypass – minimally invasive vascular surgery
Autoři: E. Biroš 1; R. Staffa 1; R. Vlachovský 1; T. Novotný 1; E. Janoušová 2
Působiště autorů: II. chirurgická klinika, Centrum cévních onemocnění, FN u sv. Anny v Brně a LF Masarykovy univerzity přednosta: prof. MUDr. R. Staffa, Ph. D. 1; Institut biostatistiky a analýz, Lékařská fakulta Masarykovy univerzity ředitel: doc. RNDr. L. Dušek, Ph. D. 2
Vyšlo v časopise: Rozhl. Chir., 2016, roč. 95, č. 3, s. 117-122.
Kategorie: Původní práce
Souhrn
Úvod:
Zhodnocení možnosti miniinvazivního odběru žilního graftu (Endoscopic Vein Harvest = EVH) za účelem cévně-chirurgické revaskularizace infrainguinálního tepenného systému končetiny. Zhodnocení našich časných výsledků a zkušeností s uvedenou metodou.Metoda:
V časovém období duben 2012 až březen 2015 podstoupilo 16 pacientů endoskopický odběr velké safény (VSM) v rámci implantace infrainguinálního bypassu. Sedm (43,7 %) pacientů bylo indikováno k operaci pro obraz kritické končetinové ischemie (Rutherford kategorie 5). 9 (56,3 %) pacientů bylo indikováno k výkonu pro těžké intermitentní klaudikace (Rutherford kategorie 3). Průměrný věk pacientů byl 59,9 roku, mužů bylo 14 (87,5 %), ženy 2 (12,5 %). Selekce pacientů k endoskopickému odběru VSM probíhala na základě klinického a sonografického zhodnocení její vhodnosti. U pacientů byla sledována jejich předoperační anamnestická data, klinické nálezy, peroperační a pooperační průběh včetně komplikací. Pacienti byli prospektivně sledováni v časových intervalech 3, 6, 12, 18, 24 měsíců a následně à 1 rok od operačního výkonu. Byla vyhodnocena průchodnost rekonstrukcí pomocí Kaplanovy-Meierovy metody. Statistická analýza souboru byla provedena s použitím softwaru IBM SPSS Statistics 21.0.Výsledky:
U všech pacientů byla odebraná VSM použita k provedení proximálního (10; 62,5 %) nebo distálního (6; 37,5 %) femoropopliteálního bypassu (FPB). Jeden pacient, v časné fázi zavádění metody podstoupil po endoskopické disekci VSM konverzi na otevřený odběr. U 2 pacientů (12,5 %) pooperačně vznikla chirurgická ranná infekce (SSI) Szilagyi gr. II (1 pacient s dokončeným EVH – lokalizace tříslo, 1 pacientka po konverzi EVH – lokalizace tříslo a odběrová rána VSM). Průměrná doba sledování pacientů v souboru činila 10,2 měsíce. Primární, primární asistovaná a sekundární průchodnost po 1. roce sledování byla 82,0 %, 93,8 % a 100,0 %; po 2. roce sledování byla rovněž 82,0 %, 93,8 % a 100,0 %. Amputation-free survival po 1. i 2. roce sledování byl 100,0 %. Žádný pacient v průběhu studie nezemřel – letalita 0,0 %.Závěr:
Endoskopický odběr VSM představuje miniinvazivní alternativu ke klasickému otevřenému odběru VSM u pacientů, kteří podstupují infrainguinální bypass. Naše časné výsledky femoropopliteálních bypassů s použitím metody EVH vykazují srovnatelné výsledky průchodností oproti rekonstrukcím s tradičním otevřeným odběrem VSM. Je současně patrná nízká incidence chirurgických ranných infekcí u takto provedených bypassů.Klíčová slova:
endoskopický odběr žíly – véna saféna magna – periferní cévní chirurgie – femoropopliteální bypass – miniinvazivní cévní chirurgieÚvod
Infrainguinální bypass má i přes překotný rozvoj endovaskulárních technik nadále pevné místo v terapii pacientů s ischemickým onemocněním dolních končetin [1]. Véna saféna magna (VSM) je nadále preferovaná forma náhrady v infrainguinální pozici, která vykazuje nejlepší krátkodobé i dlouhodobé výsledky jak v pozici proximálního („nad koleno“), tak i v pozici distálního („pod koleno“) infrainguinálního bypassu [2,3]. Odběr VSM klasickou otevřenou cestou pomocí jedné incize (Open Vein Harvest = OVH), ale i metodikou „skip“ incizí (několik kožních incizí se zachováním kožních můstků mezi nimi) je zatížen vysokým počtem chirurgických ranných komplikací, které jsou uváděny v rozpětí 17 až 44 % [4,5]. Chirurgické ranné komplikace po infrainguinálních rekonstrukcích jsou příčinou protrahovaných hospitalizací pacientů, ztrát rekonstrukcí a také končetin v případě hlubokých Szilagyi’s grade III infekcí [6].
Endoskopický odběr žíly (Endoscopic Vein Harvest = EVH) představuje miniinvazivní alternativu odběru žilního štěpu pro potřeby infrainguinální rekonstrukce. Tato metoda je schopna nahradit dlouhou incizi v průběhu VSM 2 nebo 3 krátkými, 2−3cm incizemi. Koncept endoskopického odběru žilního graftu rozvinul Lumsden již v roce 1994 [7]. Tato metoda, i když její iniciální rozvoj proběhl na poli periferní cévní chirurgie, zaznamenala úspěch hlavně v oboru kardiochirurgie. Dostupná data hlavně ze severoamerických pracovišť ukazují, že přibližně 70 % všech VSM použitých pro koronární revaskularizaci je odebráno metodikou EVH [8]. K prokázaným výhodám metody EVH na poli kardiochirurgie, ale i periferní cévní chirurgie patří snížení invazivity zákroku a incidence chirurgických ranných komplikací [9,10,11,21].
Na našem pracovišti provádíme EVH od roku 2012. Cílem práce bylo vytvoření vlastní zkušenosti s metodou EVH při chirurgické revaskularizaci pacientů s ischemickým postižením dolních končetin. Sledováním pacientů v čase byl hodnocen vliv EVH na průchodnost rekonstrukcí, výskyt perioperačních i pooperačních komplikací.
Metoda
Všichni pacienti, kteří podstoupili EVH v rámci implantace infrainguinálního bypassu v časovém období duben 2012 až březen 2015, byli zahrnuti do této studie. Celkově se jednalo o 16 pacientů. Indikace pacientů k výkonům probíhala na základě přítomnosti symptomatického aterosklerotického tepenného postižení dolních končetin jak definováno Rutherfordem [16]. Sedm (43,7 %) pacientů bylo indikováno k operaci pro obraz kritické končetinové ischemie (CLI) Rutherford kategorie 5 (3 pacienti s defektem, 4 pacienti s fokální gangrénou). Devět (56,3 %) pacientů bylo indikováno k výkonu pro obraz těžkých intermitentích klaudikací (Rutherford kategorie 3). Průměrný věk pacientů byl 59,9 roku. Zastoupení jednotlivých komorbidit v souboru udává Tab. 1.
Tab. 1. Charakteristika souboru pacientů a zastoupení jednotlivých komorbidit Tab. 1. Patient baseline characteristics and comorbidities 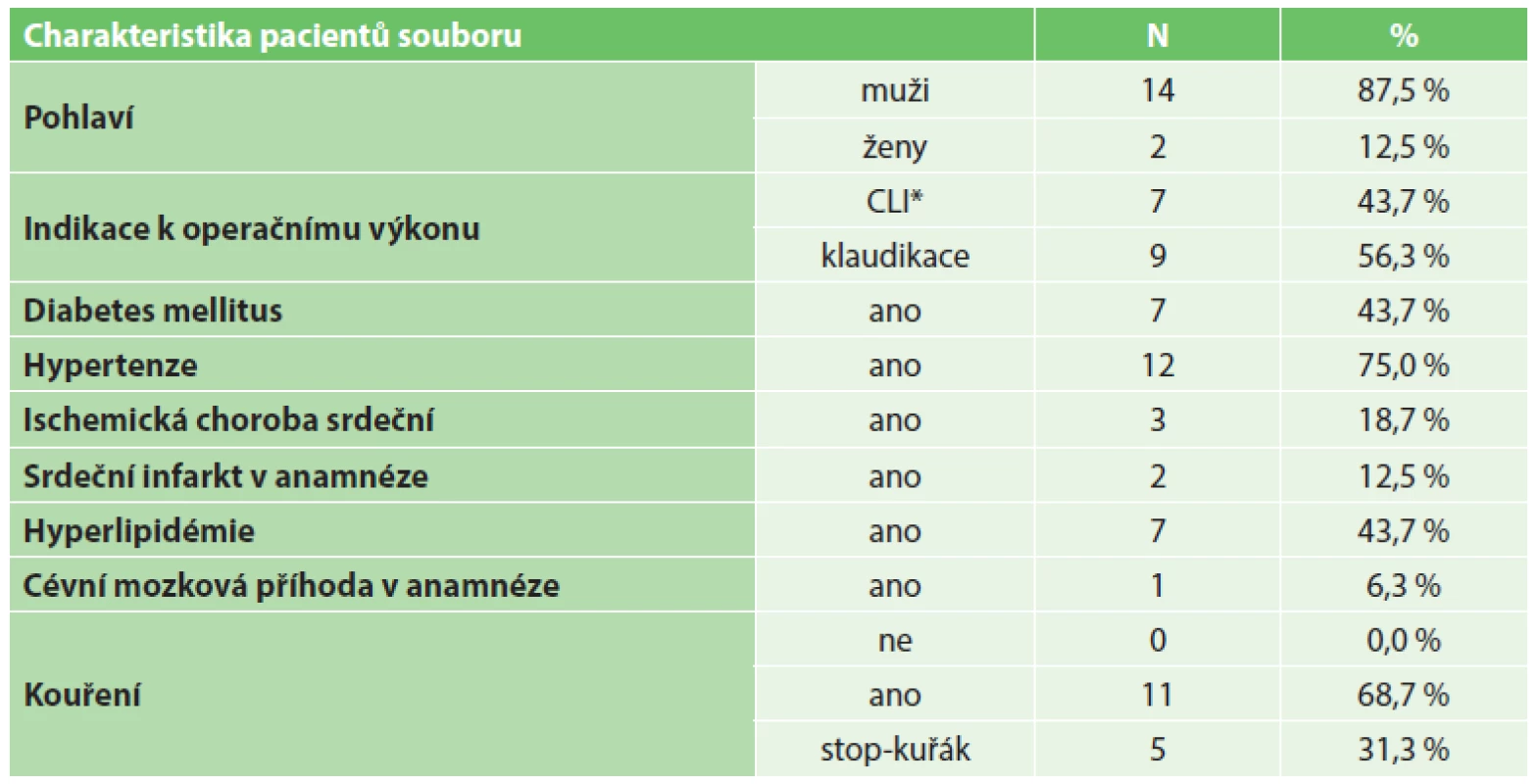
Vysvětlivky: *CLI = kritická končetinová ischémie Výběr pacientů probíhal nerandomizovaně. Jejich pooperační sledování probíhalo prospektivně. U všech pacientů byla získána jejich předoperační anamnestická data, výsledky klinického vyšetření a také předoperačních zobrazovacích vyšetření. Výběr pacientů k EVH probíhal na základě předoperačního klinického a dupplex-sonografického zhodnocení vhodnosti VSM. Jenom pacienti s VSM průměru ≥3,5 mm, jejím průběhem v „safénovém kompartmentu stehna“ [22], bez obrazu insuficience nebo varixů a dostatečné délky za účelem zamýšleného bypassu byli zvažováni k EVH. Pozice VSM byla předoperačně vyznačena v oblasti mediálního kondylu tibie pomocí značkovacího fixu. U pacientů byla sledována časová délka endoskopického odběru žilního graftu, poranění žilního graftu v průběhu EVH a časný výsledek provedené operace. Byly sledovány a zaznamenány pooperační komplikace. Byla vyhodnocena incidence a závažnost pooperačních ranných komplikací klasifikačním systémem podle Szilagyiho [6]. Pacienti byli prospektivně sledováni v časových intervalech 3, 6, 12, 18, 24 měsíců od operačního výkonu a posléze v ročních intervalech. V rámci sledování bylo provedeno vyhodnocení klinického stavu, fyzikálního nálezu u pacienta a dupplex-sonografického obrazu provedené cévní rekonstrukce. U pacientů byly sledovány reintervence potřebné k udržení primární asistované a sekundární průchodnosti. Za celý soubor byla vyhodnocena 1letá a 2letá primární (PP), primární asistovaná (PAP) a sekundární průchodnost (SP) podle standardů definovaných Rutherfordem [16]. Bylo provedeno vyhodnocení amputation-free survivalu za celý soubor ve stejných časových periodách. Statistická analýza byla provedena pomocí počítačového statistického softwaru IBM SPSS Statistics 21.0. Analýza průchodnosti rekonstrukcí a výpočet amputation-free survivalu byly provedeny s použitím Kaplanovy-Meierovy metody.
Metoda endoskopického odběru žilního graftu: Všechny operace s použitím metody EVH byly prováděny v poloze pacienta na zádech. U většiny pacientů byl operační výkon prováděn v epidurální anestezii (epidurální anestezie 14 pacientů, celková anestezie 2 pacienti). Za účelem EVH byl použit systém Vasoview Hemopro Endoscopic Vessel Harvesting System (MAQUET Holding B.V. & Co. KG, Rastatt, Germany) a standardní laparoskopická věž (Olympus®, Olympus Medical Systems Corp., Tokyo, Japan). Operační výkon byl zahájen provedením 2–3cm incize v oblasti mediálního kondylu tibie v místě předtím sonograficky označeného průběhu VSM. Úvodní preparace VSM v rozsahu uvedené incize probíhala otevřeně standardním způsobem. Do této incize byl posléze zasunut trokar s insuflační manžetou. Manžeta trokaru byla naplněna 5–20 ml vzduchu za účelem dosažení „vzduchotěsnosti“ operačního pole. Jednorázový kónický průhledný hrot byl nasazen na konec 7mm optiky, která byla zavedena otvorem trokaru kraniálním směrem. Úvodní endoskopická preparace VSM probíhá po její ventrální nebo dorzální straně v rovině rozhraní žíly a okolní fibro-podkožní tkáně.
Zavedený trokar umožňuje insuflaci podkoží oxidem uhličitým (CO2). Byly použity tlaky do 12 mmHg. Preparace žíly optikou s průhledným hrotem probíhá postupně po její přední, zadní, mediální a laterální ploše. Postranní větve jsou opatrnými pohyby vypreparovány. Tato fáze operace je značně usnadněna a také urychlena probíhající insfulací CO2. Vzhledem k délce optiky vlastní saféno-femorální junkce není obvykle dosažitelná. Po ukončení preparace je trokarem zavedena odběrová kanyla, která umožňuje manipulaci se žílou pomocí „C-ring“-u a koagulaci se současnou transekcí postranních větví pomocí bipolárních termokoagulačních kleští. Koagulace větví probíhá v dostatečné vzdálenosti od vlastního těla VSM. Celá vizualizace odběru probíhá v koaxiálně-lineárním kurzu na rozdíl od klasické triangulace známé z laparoskopické chirurgie. Uvedeným způsobem probíhá stehenní fáze odběru VSM. V případě potřeby odběru VSM z bérce je možné uvedený postup opakovat směrem distálním, podle délky potřebného úseku žilního graftu. Po provedení endoskopické disekce VSM a přerušení postranních větví operace dále pokračuje otevřeným způsobem. Současně je pacientovi podán heparin v dávce 2500 j. i.v. jako prevence formace mikrotrombů v odebírané žíle. Žíla je standardně přerušena až po preparaci a potvrzení místa vtoku a výtoku cévní rekonstrukce. Po vynětí žíly z těla pacienta jsou bez nadměrné distenze graftu podvázány jeho postranní větve, které byly původně ošetřené pomocí bipolárních termokoagulačních kleští. Event. nalezená místa poranění graftu jsou ošetřena pomocí stehů Prolen 7/0. Odběr bércové části VSM může být v případě distálního femoropopliteálního bypassu proveden rovněž otevřeně v rámci přístupu k výtokové tepně rekonstrukce. Další průběh operačního výkonu pak probíhá dle obecných zásad cévní chirurgie a zvyklostí pracoviště. Všechny odebrané VSM byly použity v reverzní konfiguraci se subfasciálním průběhem bypassu. U všech pacientů v našem souboru byla provedena peroperační angiografie za účelem potvrzení průchodnosti distální anastomózy a také výtokového traktu rekonstrukce. Odběrový tunel po EVH nebyl na konci operačního výkonu ošetřen žádným specifickým způsobem, nebyly do něho vloženy drény ani nebyla pooperačně aplikována elastická bandáž končetiny, jak bývá poměrně často zvykem po EVH v souvislosti s aortokoronárním bypassem.
Výsledky
U všech pacientů byla metodou EVH odebrána VSM z ipsilaterální končetiny. 1 pacientka v úvodní fázi našich zkušeností s touto metodou podstoupila konverzi endoskopického odběru na otevřený odběr. Dva pacienti vyžadovali plánované provedení pomocné incize k ošetření nepříznivě probíhající anteriorní větve VSM – opětovně se jednalo o pacienty v úvodní fázi našich zkušeností s EVH. U 3 pacientů (18,8 %) byla nutnost ošetření drobného poranění VSM pomocí stehu Prolen 7/0. Průměrná délka endoskopické části výkonu byla 78 min. se znatelnou tendencí ke zkracování s nabývající zkušeností. Odebraný žilní graft byl vždy použit k provedení zamýšlené cévní rekonstrukce. Odebraná VSM byla vždy použita v reverzní konfiguraci se subfasciálním průběhem bypassu. U 10 pacientů (62,5 %) byl proveden proximální femoropopliteální bypass (FPB), doplněn endarterektomií a žilní plastikou distální AIE a AFC u jednoho z pacientů. U 6 pacientů (37,5 %) byl proveden distální FPB, doplněn endarterektomií a žilní plastikou AFC u 1 pacienta a žilní plastikou proximální anastomózy bypassu u 2 pacientů.
Pooperační letalita v souboru byla 0 %. Pooperační chirurgická ranná infekce (SSI) vznikla u 2 pacientů (12,5 %). V obou případech se jednalo o Szilagyi grade II infekci, která dobře reagovala na lokální terapii. U 1 pacientky po konverzi EVH na otevřený odběr se vyvinula SSI v oblasti třísla a také rány po odběru VSM. U 2. pacienta se vyvinula SSI v oblasti třísla. Nebyly zaznamenány komplikace s podkožním kanálem po endoskopickém odběru VSM. U jednoho pacienta byla zaznamenána pooperačně časná trombóza rekonstrukce 3. pooperační den. Jednalo se o klaudikanta s provedeným proximálním FPB. Byl proveden akutní hybridní výkon ve smyslu trombektomie bypassu, peroperační angiografie a implantace stentu do oblasti distální anastomózy a proximální části arteria poplitea (AP), kde byly peroperačně diagnostikovány „disekované pláty“ pravděpodobně jako důsledek aplikace cévní svorky v průběhu primárního výkonu. Nebyly zaznamenány žádné další pooperační komplikace u pacientů.
U 3 pacientů (18,8 %) byl pooperačně proveden „malý“ amputační výkon na noze. 2x amputace palce, 1x kompletní transmetatarzální amputace prstů chodidla. Šlo o pacienty indikované k operační intervenci pro CLI s obrazem gangrény na noze předoperačně. Hojení amputačních ran bylo příznivé. Žádný další amputační výkon nebyl u pacientů proveden v rámci jejich dalšího sledování.
Průměrná doba sledování pacientů v souboru činila 10,2 měsíce (minimum 0,3; maximum 27 měsíců). U žádné z provedených rekonstrukcí nebyl po dobu sledování diagnostikován pozdní uzávěr. U jednoho pacienta byla sonograficky diagnostikována stenóza v oblasti distální anastomózy 8 měsíců od provedení proximálního FPB, která byla posléze úspěšně endovaskulárně ošetřena. Jednoleté výsledky primární (PP), primární asistované (PAP) a sekundární průchodnosti (SP) byly: 82,0 %, 93,8 % a 100,0 %. Dvouleté výsledky průchodností ve stejném pořadí byly identické: 82,0 %, 93,8 % a 100,0 %. 1leté i 2leté výsledky amputation-free survivalu byly 100,0 %. Grafická prezentace výsledků PP, PAP a SP v Graf 1.
Graf 1. Výsledky primární, primární asistované a sekundární průchodnosti u pacientů po femoropopliteálním bypassu s použitím metody endoskopického žilního odběru (EVH) Graph 1. Results of primary, assisted-primary and secondary patency rates of femoropopliteal bypasses done using endoscopic vein harvest (EVH) technique 
Diskuze
Koncept miniinvazivního endoskopického odběru žilního graftu není nová myšlenka. Průkopnické práce z konce minulého století používaly techniku bez insuflace podkožního tunelu pomocí oxidu uhličitého [7,9] a byly všechny vytvořeny na poli periferní cévní chirurgie. Metoda EVH doznala rychlého etablování hlavně v oboru kardiochirurgie [8,11], kde pozorujeme trend k odběrům i tepenných graftů endoskopickým přístupem [17].
Původní práce průkopníků této metody v periferní cévní chirurgii prokazovaly benefity EVH na průchodnost provedených rekonstrukcí, snížení výskytu chirurgických ranných komplikací, zkrácení délky hospitalizace a nutnosti rehospitalizace pacientů [9,10,12]. Práce z posledního období naopak poukazují na redukci primární průchodnosti při provedení infrainguinálního bypassu s pomocí EVH, zvýšenou potřebu reintervencí u EVH bypassů, zvýšený výskyt stenóz v oblasti „těla“ žilního graftu a nejednoznačné výsledky co do redukce chirurgických ranných infekcí [13,14,15].
Námi dosažené výsledky hodnot 1letých i 2letých PP, PAP a SP jsou zcela srovnatelné s výsledky individuálních i metaanalytických prací, které hodnotí výsledky infrainguinálních bypassů s použitím standardní otevřené metody odběru žilního štěpu [2,18]. Naše výsledky jsou shodné nebo i lepší při porovnání s výsledky starších prací, které hodnotily izolovaně výsledky EVH v rámci jednoho centra (Jordan [9], Erdoes [12]) nebo v rámci jednoho centra porovnávaly výsledky EVH s OVH (Santo [19], Gazoni [10]). Naše výsledky nepotvrzují obavu z negativního vlivu endoskopické manipulace se žilním graftem na výsledky průchodnosti rekonstrukcí. Je pravdou, že na rozdíl od starších prací Jordana [9], Erdoese [12] nebo Gazoniho [10], které hodnotí zkušenost s EVH co do výsledků průchodností i redukce SSI velice pozitivně, jsou nové práce k výsledkům EVH méně optimistické. Soudobé práce Santa [19], Eida [13] a Teixeiru [14] konstatují u EVH bypassů sníženou primární průchodnost, zvýšenou nutnost reintervencí a zvýšenou tendenci vývoje stenóz těla graftu. I přes tato negativa Santo i Eid nadále konstatují srovnatelné výsledky záchrany končetiny a sekundární průchodnosti při porovnání skupin EVH a OVH bypassů, při zachování příznivého vlivu EVH na redukci chirurgických ranných infekcí [19,13]. Naše zkušenost zatím neukazuje na zvýšenou incidenci vývoje stenóz těla graftu, kdy jediná reintervence v našem souboru mimo 30denní pooperační periodu byla zacílená endovaskulárně na oblast distální anastomózy a proximální AP u pacienta 8 měsíců po proximálním FPB.
V současnosti jediná metaanalýza EVH od Jauhariho [15] z roku 2014 prokazuje vliv EVH na redukci primární průchodnosti infrainguinálních bypassů, bez průkazu pozitivního vlivu EVH na redukci SSI. Současně ale Jauhari udává, že dostupná data byla značně heterogenní a je nutno počítat s dalším rozvojem technologie a narůstající zkušeností, které můžou v budoucnu výsledky změnit. Je nutné konstatovat, že většina prací, které pojednávají o využití EVH pro infrainguinální rekonstrukce, pochází ze severoamerických pracovišť, kde endoskopický odběr žilního štěpu často není prováděn cévním chirurgem, ale tvz. „physician assistant“ („asistent lékaře“). Některé práce tuto skutečnost přímo deklarují [10,19]. Je zajímavé, že práce, které konstatují dobré výsledky s metodou EVH v rámci izolovaných sérií [9,12] nebo při přímém porovnání EVH s OVH v rámci jednoho centra [20], deklarují provedení EVH samotným cévním chirurgem.
Frekvence chirurgických ranných infekcí dosáhla v našem souboru hodnoty 12,5 %. Je to hodnota menší než literárně uváděná frekvence SSI po OVH v rozpětí 17 až 44 % [4,5], ale jistě negativně ovlivněna nutností konverze EVH u jedné pacientky, u které se posléze vyvinula Szilagyi grade II infekce v oblasti odběrové rány a také třísla. Ani u jednoho pacienta v našem souboru s úspěšným EVH nevznikla SSI v místě odběrové rány po VSM. Celková incidence SSI po EVH bypassech je v dostupných sděleních udávána v rozpětí 3,4 % až 29 % [14,20]. Většina sdělení se pohybuje na úrovni 7,5−15,4 % [9,10,12,13,19]. Při zohlednění místa SSI – odběrová rána po žilním graftu versus anastomotické místo – je vidět jednoznačný trend směrem k redukci SSI vzniklých v místě odběru žilního graftu, a to až na 0 % [9,13]. Věříme, že narůstající zkušenost s EVH se i v našem případě v budoucnu promítne do další redukce SSI, jak prokazuje práce Erdoese [12].
Hlavním nedostatkem naší studie je chybějící kontrolní skupina pacientů po klasickém otevřeném odběru žilního graftu, která by umožnila přímé srovnání obou metod v rámci našeho centra. Její vytvoření do budoucna plánujeme. Nepředpokládáme, že by bylo možné provést randomizaci mezi oběma rameny studie – EVH versus OVH – vzhledem k předpokladu, že jenom ojedinělý pacient by při možnosti výběru mezi více a méně invazivní metodou souhlasil posléze s OVH. Dalším nedostatkem naší studie je poměrně malá velikost souboru pacientů. Pomalý nábor pacientů je dán skutečností, že metoda je stále v pozici zavádění do rutinní klinické praxe. Věříme, že překonáním tvz. learning-curve, kterou každá nová metoda obnáší, budeme schopni nábor pacientů rozšířit i na jiné formy infrainguinálních rekonstrukcí kromě femoropopliteálních bypassů. Malý počet pacientů v souboru a jejich krátký průměrný interval sledování omezují statistickou relevanci našich výsledků. V rámci studie jsme dosud nesledovali některé více na „pacienta orientované cíle“, jako jsou pooperační bolest, možnost pooperační mobilizace pacienta a délka hospitalizace pacienta, které by mohly být zdrojem nového pohledu na metodu EVH.
Závěr
Endoskopický odběr VSM představuje miniinvazivní alternativu ke klasickému otevřenému odběru VSM u pacientů, kteří podstupují infrainguinální bypass. Naše časné výsledky femoropopliteálních bypassů s použitím metody EVH vykazují srovnatelné výsledky průchodností oproti rekonstrukcím s tradičním otevřeným odběrem VSM. Je současně patrná nízká incidence chirurgických ranných infekcí u takto provedených bypassů. Předpokládáme, že indikačně širší a časově delší zkušenost s uvedenou metodou nám umožní se validně vyjádřit o jejím postavení na poli periferní cévní chirurgie.
Seznam zkratek:
VSM – véna saféna magna
FPB – femoropopliteální bypass
EVH – endoskopický odběr žilního štěpu (Endoscopic Vein Harvest)
OVH – otevřený odběr žilního štěpu (Open Vein Harvest)
SSI – surgical site infection = chirurgické ranné infekce
AIE – arteria iliaca externa
AFC – arteria femoris communis
AP – arteria poplitea
PP – primární průchodnost
PAP – primární asistovaná průchodnost
SP – sekundární průchodnost
CLI – kritická končetinová ischemieKonflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. Ernest Biroš
Újezdy 11
614 00 Brno Obřany
e-mail: ernest.biros@fnusa.cz
Zdroje
1. Bradbury AW. Bypass versus angioplasty in severe ischaemia of the leg (BASIL) trial: What are its implications? Semin Vasc Surg 2009;22 : 267−74.
2. Pereira CE, Albers M, Romiti M, et al. Meta-analysis of femoropopliteal bypass grafts for lower extremity arterial insufficiency. J Vasc Surg 2006;44 : 510−7.
3. Veith FJ, Gupta SK, Ascer E, et al. Six-year prospective multicenter randomized comparison of autologous saphenous vein and expanded polytetrafluoroethylene grafts in infrainguinal arterial reconstructions. J Vasc Surg 1986;3 : 104−14.
4. Wengrovitz M, Atnip RG, Gifford RR, et al. Wound complications of autogenous subcutaneous infrainguinal arterial bypass surgery: predisposing factors and management. J Vasc Surg 1990;11 : 156−61.
5. Kent KC, Bartek S, Kuntz KM, et al. Prospective study of wound complications in continuous infrainguinal incisions after lower limb arterial reconstruction: incidence, risk factors, and cost. Surgery 1996;119 : 378−83.
6. Szilagyi DE, Smith RF, Elliott JP, et al. Infection in arterial reconstruction with synthetic grafts. Ann Surg 1972;176 : 321−32.
7. Lumsden AB, Eaves FF. Subcutaneous, video-assisted saphenous vein harvest. Perspect Vase Surg 1994;7 : 43–55.
8. Zenati MA, Shroyer AL, Collins JF, et al. Impact of endoscopic versus open saphenous vein harvest technique on late coronary artery bypass grafting patient outcomes in the ROOBY (Randomized On/Off Bypass) Trial. J Thorac Cardiovasc Surg 2011;141 : 338–44.
9. Jordan WD, Alcocer F, Voellinger DC, et al. The durability of endoscopic saphenous vein grafts: a 5-year observational study. J Vasc Surg 2001;34 : 434−9.
10. Gazoni LM, Carty R, Skinner J, et al. Endoscopic versus open saphenous vein harvest for femoral to below the knee arterial bypass using saphenous vein graft. J Vasc Surg 2006;44 : 282−8.
11. Williams JB, Peterson ED, Brennan JM, et al. Association between endoscopic vs open vein-graft harvesting and mortality, wound complications, and cardiovascular events in patients undergoing CABG surgery. JAMA 2012;308 : 475−84.
12. Erdoes LS, Milner TP. Encouraging results with endoscopic vein harvest for infrainguinal bypass. J Vasc Surg 2005;42 : 442−8.
13. Eid RE, Wang L, Kuzman M, et al. Endoscopic versus open saphenous vein graft harvest for lower extremity bypass in critical limb ischemia. J Vasc Surg 2014;59 : 136−44.
14. Teixeira PGR, Woo K, Weaver FA, et al. Vein harvesting technique for infrainguinal arterial bypass with great saphenous vein and its association with surgical site infection and graft patency. J Vasc Surg 2015;61 : 1264−71.
15. Jauhari YA, Huges CO, Black SA, et al. Endoscopic vein harvesting in lower extremity arterial bypass: a systematic review. Eur J Vasc Endovasc Surg 2014;47 : 621−39.
16. Rutherford RB, Baker JD, Ernest C, et al. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997;26 : 517−38; erratum J Vasc Surg 2001;33 : 805.
17. Šimek M, Marcian P, Gwozdziewicz M, et al. Endoscopic radial artery harvesting for coronary artery bypass grafting. A single center evolving experience. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2013;157 : 64−9.
18. Taylor LM Jr, Edwards JM, Porter JM. Present status of reversed vein bypass grafting: five-year results of a modern series. J Vasc Surg 1990;11 : 193−205.
19. Santo VJ, Phong TD, Azarbal AF, et al. Open versus endoscopic great saphenous vein harvest for lower extremity revascularization of critical limb ischemia. J Vasc Surg 2014;59 : 427−34.
20. Wartman SM, Woo K, Herscu G, et al. Endoscopic vein harvest for infrainguinal arterial bypass. J Vasc Surg 2013;57 : 1489−94.
21. Šimek M, Němec P, Bruk V, et al. Postoperative and midterm outcomes of minimally invasive and endoscopic great saphenous vein harvesting for coronary artery bypass grafting – A prospective analysis. Thorac Cardiovasc Surg 2007;55 : 428−32
22. Cavezzi A, Labropoulos N, Partsch H, et al. Duplex ultrasound investigation of the veins in chronic venous disease of the lowr limbs – UIP consensus document. Part II. Anatomy. Eur J Vasc Endovasc Surg 2006;31 : 288−99.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2016 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Lumbálna sympatektómia − prehľad svetovej literatúry za posledných 15 rokov
- Porovnání perkutánní a otevřené radiofrekvenční ablace metastáz kolorektálního karcinomu ve FN Plzeň v letech 2001−2015
- Optimálne načasovanie laparoskopickej cholecystektómie v liečbe akútnej cholecystitídy
- Použití metody endoskopického odběru velké safény v periferní infrainguinální cévní chirurgii – zhodnocení iniciálních zkušeností
- Gigantické aneuryzma abdominální aorty a pánevních tepen
- Atypická, extrapankreatická pseudocysta pankreatu
- Sekundární angiosarkom břišní stěny po adjuvantní radioterapii pacientky s karcinomem dělohy − kazuistika
- Podmínky rozvoje chirurgie anebo pohled pravdě do očí
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Atypická, extrapankreatická pseudocysta pankreatu
- Optimálne načasovanie laparoskopickej cholecystektómie v liečbe akútnej cholecystitídy
- Lumbálna sympatektómia − prehľad svetovej literatúry za posledných 15 rokov
- Gigantické aneuryzma abdominální aorty a pánevních tepen
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



