-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Konfokální laserová endomikroskopie v diagnostice onemocnění gastrointestinálního traktu − literární přehled a vlastní zkušenosti
Confocal laser endomicroscopy in the diagnostics of gastrointestinal lesions − literary review and personal experience
Introduction:
Confocal laser endomicroscopy (CLE) is a new method enabling real-time histopathological diagnosis. Two platforms of CLE are used standardly: the so called probe-based CLE in which an endomicroscopic probe is inserted through an endoscope, and so-called needle-based CLE inserted through a needle.
Methods:
CLE enables evaluation of epithelial and subepithelial structures with 1000x magnification in any part of the gastrointestinal system. The main advantage over conventional biopsies can be immediate diagnosis and larger area evaluated. CLE might play a promising role in indeterminate biliary lesions where biopsies are often not sufficient and fail to allow for accurate diagnosis. CLE can also have a promising potential in pancreatic lesions where it is used along with the needle designed for tissue aspiration during endosonography. It is also possible to use CLE in other organ systems and medical specialties, e.g. in pneumology, neurosurgery, ENT and others.
Conclusion:
CLE is a promising diagnostic method; however, it is unlikely to replace standard biopsies currently since these are still considered a gold standard of histopathological diagnosis. High purchase price is a main disadvantage of the method, hampering its expansion in medicine.
Key words:
confocal laser endomicroscopy − CLE − biliary strictures − pancreatic lesions − esophageal carcinoma
Rozhl Chir 2018;97 : 531–538
Autoři: M. Kollár 1; J. Krajčíová 2; R. Husťak 3,4; J. Malušková 1; M. Kment 1; Z. Vacková 2; J. Špičák 2; J. Martínek 2,3
Působiště autorů: Pracoviště klinické a transplantační patologie, Institut klinické a experimentální medicíny, Praha 1; Klinika hepatogastroenterologie, Institut klinické a experimentální medicíny, Praha 2; Interná klinika, Fakultná nemocnica Trnava 3; Katedra laboratórnych vyšetrovacích metód v zdravotníctve, Trnavská univerzita 4
Vyšlo v časopise: Rozhl. Chir., 2018, roč. 97, č. 12, s. 531-538.
Kategorie: Souhrnné sdělení
Souhrn
Úvod:
Konfokální laserová endomikroskopie (CLE) je nová metoda umožňující histopatologickou diagnózu v reálném čase. Aktuálně se využívá tzv. probe-based CLE, kdy je endomikroskopická sonda zavedena k cílové tkáni skrze endoskop či cholangioskop nebo jehlu.
Metoda:
CLE zobrazuje epiteliání a subepiteliální struktury při 1000násobném zvětšení v jakékoliv části trávicího traktu. Výhodou ve srovnání s klasickou histopatologií může být okamžitá diagnóza a vyšetření mnohem větší plochy oproti standardním biopsiím. Slibnou úlohu může CLE hrát u lézí biliárního systému, kde standardní odběr vzorků často nepřináší kvalitní vzorky tkáně umožňující spolehlivou diagnózu. CLE může mít i slibný potenciál při histologické verifikaci lézí slinivky břišní či submukózních útvarů GIT, kde se CLE používá společně s jehlou určenou k aspiraci tkáně při endosonografii. CLE je možné využít i mimo gastrointestinální systém, např. v pneumologii, neurochirurgii, ORL a dalších oblastech medicíny.
Závěr:
CLE je nadějná diagnostická metoda, v současnosti však nenahrazuje standardní biopsii, která je stále považována za zlatý standard histopatologické diagnostiky. Nevýhodou metody, která brání jejímu většímu rozšíření, je vysoká cena.
Klíčové slova:
konfokální laserová endomikroskopie − CLE, biliární striktury − pankreatické léze, karcinomy jícnu
ÚVOD
Konfokální laserová endomikroskopie (Confocal Laser Endomicroscopy − CLE) je endomikroskopická diagnostická metoda umožňující tzv. optickou biopsii v reálném čase bez invazivního způsobu odběru vzorků, která zobrazuje epiteliální i subepiteliální struktury [1,2]. Princip konfokální laserové mikroskopie není nový a dříve byl k dispozici endoskop, ve kterém byla fixně zabudovaná CLE (edoscope-based CLE). Nevýhoda tohoto uspořádání byla zjevná – endomikroskopii bylo možné provést jen v lumen trávicího traktu, tedy v místech, která byla dosažitelná endoskopem. Od výroby a užívání tohoto systému se upustilo [3,4].
V současné době je na trhu systém na bázi tzv. probe-based CLE (pCLE), kdy se tenká sonda přiloží k vyšetřované tkáni a na obrazovce je vidět histologický obraz. Tato sonda může být zavedena skrze endoskop nebo i jednoduše přiložena k cílové tkáni rukou např. při peroperační CLE. Výhodou této technologie je, že se může využít kdekoliv v lidském těle např. při neurochirurgických zákrocích či operacích (zjištění, zda resekční okraje jsou prosty nádoru). Díky tomu, že lze sondu jednoduše zasunout skrze endoskop nebo jehlu určenou k aspirační biopsii např. lézí pankreatu, nabízí metoda slibný potenciál využití u pacientů s četnými gastroenterologickými onemocněními. pCLE (Cellvizio®) je vyráběné Mauna Kea Technologies, Paříž, Francie(název je odvozený od nejvyšší hory Havaje ve Spojených státech amerických, Mauna Kea, 4205 m n. m., na vrcholu které se nachází astronomická observatoř).
Objevitelem pCLE (a zakladatelem Mauna Kea Technologies) je Francouz Sacha Loiseau, který spolu se svými spolupracovníky pracoval na několika projektech pro NASA. Jedním z těchto projektů byl vývoj technologie generující jasné a čisté obrazy nejjemnějších objektů vzdálených miliony kilometrů od Země.
Po naplnění tohoto cíle se pan Loiseau rozhodl (díky svému celoživotnímu zájmu o zobrazovací metody v medicíně) zabývat se vizualizací buněčných struktur u člověka („from telescope to microscope“).
V současné době se pCLE používá ve více než 470 nemocnicích po celém světě (>150 v Severní Americe, >200 v Evropě a >100 v Asii, Austrálii a Oceánii) a v USA ji v určitých indikacích hradí zdravotní pojišťovny.
METODA
CLE využívá fyzikální princip konfokálního mikroskopu, kde zdrojem světla je laser, který osvětluje preparát skrze konfokální clonu. Tímto systémem prochází nejenom světlo, ale i emitované fluorescenční záření odražené od preparátu. V případě konfokální laserové endomikroskopie procházejí laserové paprsky optickými vlákny, která jsou následně zpracována softwarem, který vytváří celkový obraz potřebný k hodnocení histologického obrazu přímo na monitoru.
Při používání pCLE je na vyšetřovně přítomna „věž“ s monitorem, procesorem a tiskárnou (Obr. 1).
Obr. 1. Soustava konfokální laserové endomikroskopie, Cellvizio® v IKEM
Fig. 1: Confocal laser endomicroscopy, Cellvizio® at IKEM
Pro vyšetření jednotlivých orgánů existují specifické sondy, jejich použití je omezeno na 10 až 20 pacientů. Každá sonda má specifické technické parametry a sondy se mezi sebou liší v rozsahu konfokální hloubky a šíře zorného pole (Tab. 1).
Tab. 1. Přehled sond konfokální laserové endomikroskopie používaných v gastroenterologii
Tab. 1: Summary of the probes for confocal laser endomicroscopy used in gastroenterology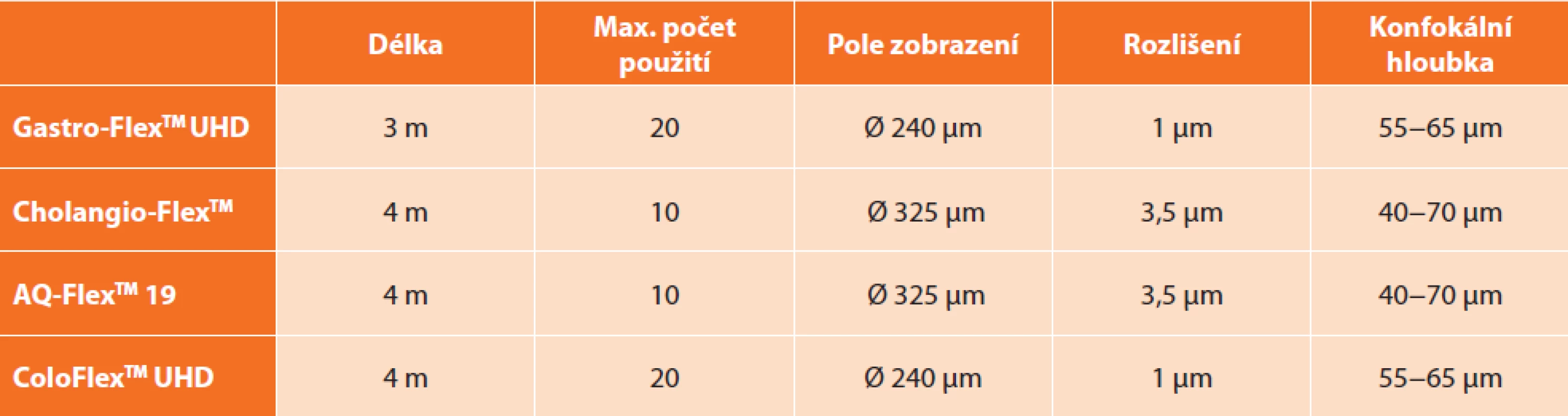
Při každém uvedení do provozu a připojení sondy k přístroji dochází automaticky ke kalibraci.
V případě potřeby je možné provést opakovanou kalibraci sondy, zejména při neostrosti obrazu.
Dvě až tři minuty před CLE vyšetřením se vyšetřovanému pacientovi intravenózně aplikuje fluorescein. Jde o syntetickou organickou látku ve formě tmavě oranžové tekutiny, která se běžně využívá ve fluorescenční mikroskopii jako tzv. fluorescenční značka (absorpční maximum má při 494 nm a světlo emituje při 512 nm). Po aplikaci fluoresceinu je možné začít se snímáním sekvencí CLE. Správná absorpce fluoresceinu a zapojení sondy se pozná podle obrazu na monitoru a podle „blikání“ sondy nazelenalou barvou (Obr. 2).
Obr. 2. Správně kalibrovaná sonda (probe-based CLE) při vyšetření tenkého střeva u pacientky po multiviscerální transplantaci s totální denudací epitelu
Fig. 2: Correct calibration of the probe (probe-based CLE) during endoscopy of the small intestine in a female patient treated by multivisceral transplantation with total denudation of the epithelium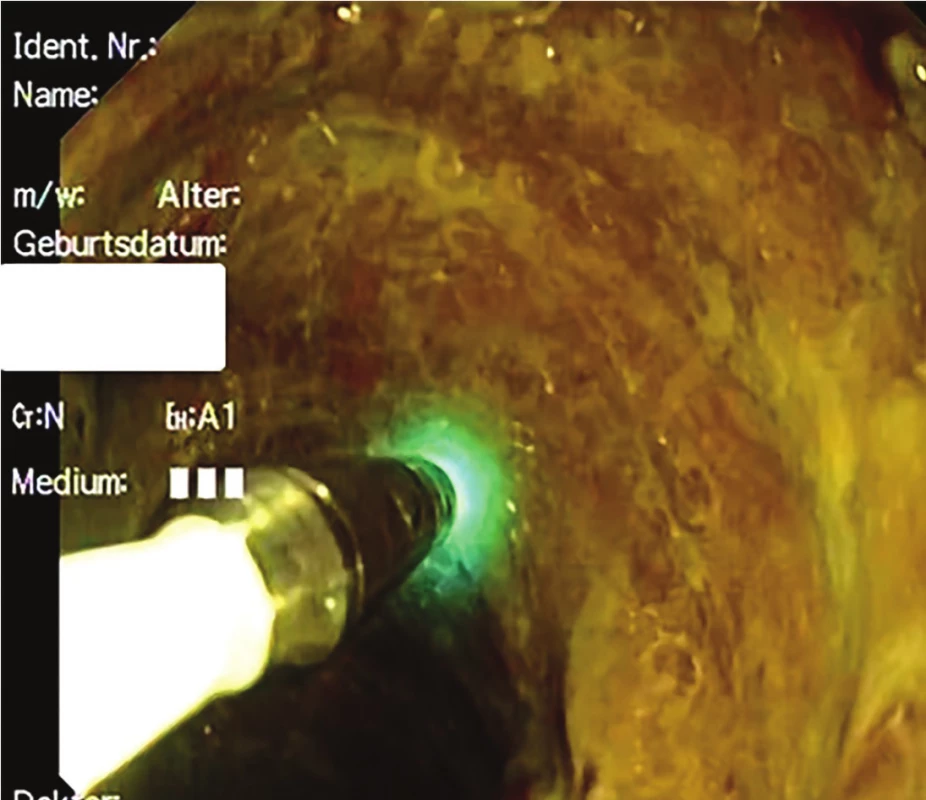
Po použití sondy je nezbytná její dezinfekce. Obraz získaný CLE je možné posoudit v reálném čase, avšak pro detailní a přesnou diagnostiku je potřebné vyhodnocení v softwaru, který má množství funkcí, např. přiblížení, posouvání a mozaikování obrazu, měření velikosti zachycených struktur atd. – je tedy pravděpodobné, že podrobné vyšetření ze záznamu bude spolehlivější než rychlá diagnóza v reálném čase.
Uživatelům systému je dostupné online výukové centrum (www.cellvizio.net), které má jednoduché uživatelské rozhraní a je dostupné pro každého uživatele CLE, k využití je nezbytná registrace.
Indikace konfokální laserové endomikroskopie
Rozsah použití CLE v medicíně narůstá a přibývají práce z různých medicínských oborů o jeho využití.
Indikace v gastroenterologii a hepatologii
Barrettův jícen: CLE je na základě mnoha studií validována k diagnostice a ev. i k surveillance pacientů s Barrettovým jícnem, neboť má vysokou specificitu a senzitivitu v detekci intestinální metaplazie (IM) (Obr. 3) a high-grade dysplazie [5]. Schopnost CLE diagnostikovat low grade dysplazii však zůstává sporná. Hlavní výhodou CLE oproti biopsiím v této lokalitě je mnohem větší vyšetřená plocha, a tudíž větší pravděpodobnost záchytu IM, dysplastických či nádorových změn (Obr. 4). Jelikož je odběr biopsií z jícnu (žaludku a střeva) velmi jednoduchý, je otázkou, zda se CLE v této indikaci prosadí i přes vysokou cenu vyšetření. Sami testujeme možnost využití CLE při surveillance pacientů po endoskopické léčbě neoplazie v terénu Barrettova jícnu.
Obr. 3. Intestinální metaplazie jícnu (Barrettův jícen)
Šipky označují pohárkové buňky ve žlázkách tvořených cylindrickým epitelem.
Fig. 3: Intestinal metaplasia (Barrett’s esophagus).
Arrows show goblet cells in glands formed by columnar epithelium.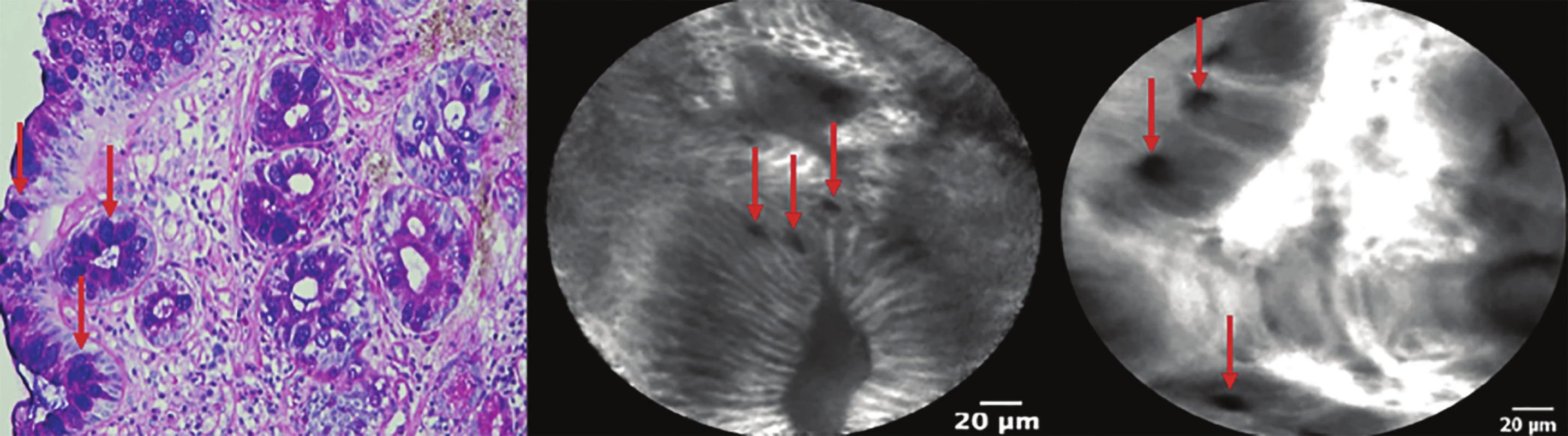
Obr. 4. Dobře až středně diferencovaný adenokarcinom jícnu
Šipky ukazují cytologické změny. Kroužek označuje tubulární a kribriformní struktury karcinomu (znak diferenciace).
Fig. 4: Well to moderately diff erentiated carcinoma of the esophagus
Arrows show cytological atypia. Circle marks tubular and cribriform structures of the carcinoma (character of the differentiation).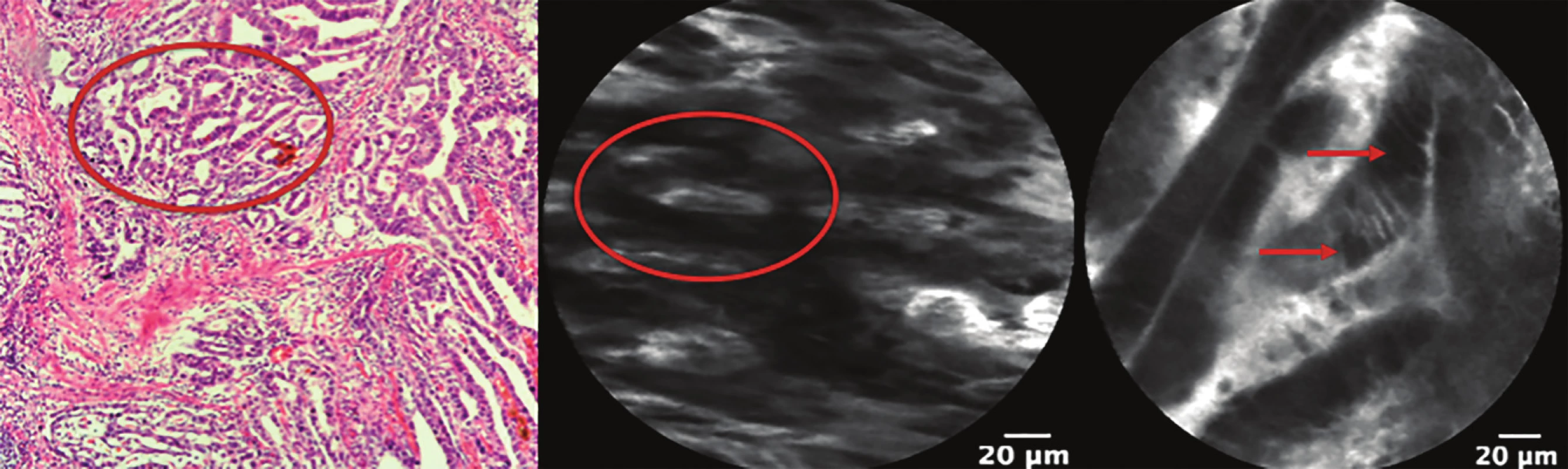
CLE může být vhodnou metodou i v diagnostice spinocelulárních karcinomů, které jsou často lokalizovány v oblasti krčního jícnu, kde je odběr biopsií složitější.
Žaludek, tlusté střevo: Pozitivní přínos CLE se ukazuje také v diagnostice jak polypoidních, tak nepolypoidních lézí žaludku a tlustého střeva. Li et al. [6] hodnotili diagnostický význam CLE ve srovnání s diagnostickým přínosem high-resolution endoskopie v diagnostice superficiálních lézí žaludku ve dvoufázové studii. V 1. fázi studie definovali u 182 pacientů kritéria pro žaludeční intestinální metaplazii (GIM), žaludeční intraepiteliální neoplazii (GIN) a maligní léze; ve 2. fázi u 1572 pacientů použili výše zmíněná kritéria. Senzitivita, specificita a diagnostická přesnost byly signifikantně vyšší ve prospěch CLE (88,9 %, 99,3 % a 98,8 %) vs. high-resolution endoskopie (72,2 %, 95,1 % a 94,1 %). Několik studií ukázalo vysokou senzitivitu a specificitu CLE v diagnostice GIM ve srovnání s high-resolution endoskopií [7,8,9].
Recentní studie ukazují slibné výsledky použití CLE ke stanovení negativity okrajů léze během endoskopického výkonu nebo po výkonu (endoskopická resekce nebo endoskopické submukózní disekce), jelikož až 25 % pacientů má po endoskopické resekci rekurentní neoplazii, která je způsobena neradikálním odstraněním léze. Samotná high-resolution endoskopie s virtuální chromoendoskopií nemusí být ke stanovení okrajů léze dostatečně přesná [10].
Pankreatické cystické léze: Aspirační biopsie z pankreatických lézí má omezenou výtěžnost, neboť materiál je často málo reprezentativní a v zásadě je možné pouze cytologické, nikoli histologické vyšetření.
Brugge W. et al. publikovali studii, do které zařadili 341 pacientů s pankreatickými cystickými lézemi, kteří podstoupili diagnostiku na základě endoskopické sonografie (EUS), aspirační biopsie tenkou jehlou Fine Needle Aspiration Biopsy (FNAB) a CLE, a stanovili jejich diagnostickou přesnost [11]. Diagnostická přesnost byla u CLE (79 %) vs. EUS (51 %) a cytologie FNAB (59 %).
Jiná studie ukázala následek těchto diagnostických nedostatků, kde 4 z 10 pacientů podstoupili zbytečnou chirurgickou resekci pro suspektní maligní lézi, ale definitivní diagnóza z chirurgického resekátu potvrdila lézi benigní [12]. Péče o pacienty s pankreatickými cystickými lézemi, které jsou diagnostikovány standardním EUS s ev. FNAB, často přináší dilema.
Použití CLE v této indikaci proto může přinést další zpřesnění diagnostiky a díky tomu i jednoznačnější indikace k observaci či chirurgickému řešení, eventuálně se lze vyhnout opakování EUS nebo FNAB u pacientů s jednoznačně benigními lézemi [13,14,15].
Probíhající klinické studie sledují diagnostický přínos CLE u solidních pankreatických lézí či u striktur pankreatického vývodu, kde použití CLE může být též výhodné.
Žlučové cesty: Obdobná situace, jaká je u pankreatických lézí, nastává i u biliárních striktur, kde více než 60 % pacientů po ERCP s biopsií (nebo s cytologickým vyšetřením) má tzv. indeterminovanou strikturu bez bližšího diagnostického určení [16]. Někdy musejí být provedeny pro stanovení diagnózy v průměru až 3 ERCP výkony [17]. Není divu, že vzhledem k nevýtěžnosti tkáňového odběru v této lokalitě mnozí pacienti (15−24 %) podstupují chirurgickou intervenci se suspekcí na malignitu, přičemž se ve skutečnosti jedná o lézi benigní, která nemusela být operována a mohla by být vyřešena endoskopicky [18,19]. Použití CLE v této indikaci bylo schváleno v doporučeních Americké společnosti pro gastrointestinální endoskopii (ASGE) k rozlišení maligních a benigních striktur [20]. Autoři Meining et al. poukázali na to, že CLE má vyšší negativní prediktivní hodnotu (97 %) a lepší celkovou diagnostickou přesnost (81 %) ve srovnání s tzv. index pathology − biopsiemi a/nebo brush cytologií (69 %, 75 %) [21].
Přehled některých studií zabývajících se využitím CLE v diagnostice striktur žlučových cest uvádí Tab. 2.
Tab. 2. Literární přehled studií zabývajících se CLE v diagnostice biliárních lézí – porovnání senzitivity, specificity a diagnostické přesnosti
Tab. 2: Review of CLE studies in biliary lesions diagnosis − comparison of sensitivity, specificity and diagnostic accuracy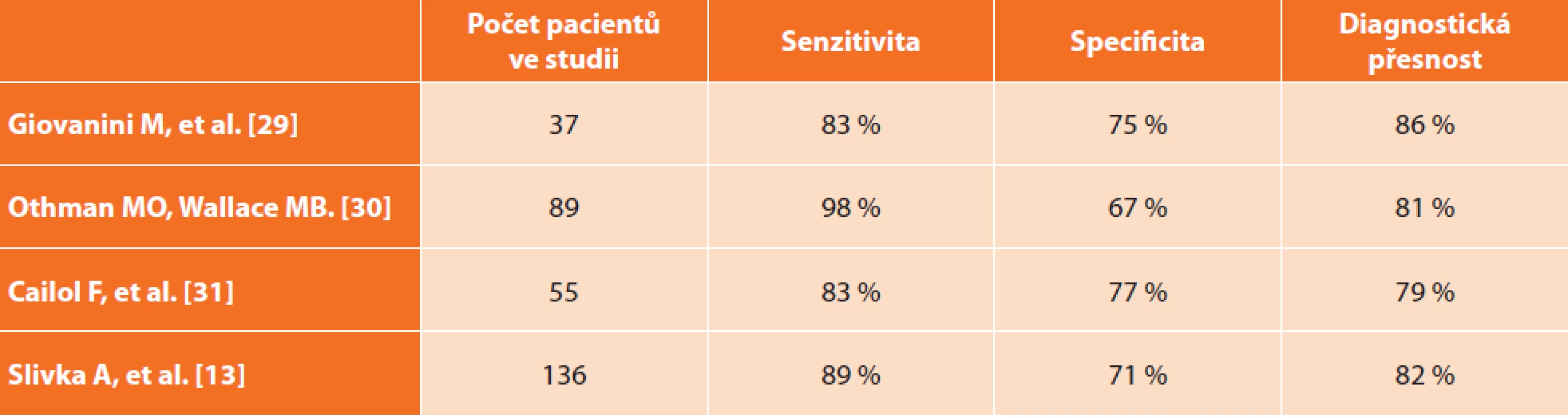
V dosavadních studiích však využívaly CLE pod rentgenovou kontrolou (RTG), kdy přesnost přiložení sondy nemusela být ideální. Velice slibnou se proto zdá kombinace cholangioskopie (např. Spy-glassDSTM) s CLE. Cílený odběr biopsií při cholangioskopii není ideálně vyřešen – bioptické kleště jsou malé a velmi obtížně se zavádějí skrze cholangioskop a při opakovaném odběru je nutné opakovaně zavádět kleště, kdy se výkon prodlužuje, a přesto kvalita vzorků nemusí být dostatečná (Obr. 5). Proto kombinace CLE s cholangioskopií může být v této indikaci velice slibná. Při kombinaci CLE a cholangioskopie totiž stačí jedno zavedení CLE sondy a tuto lze cíleně přiložit na libovolný počet míst ve žlučových cestách. Sami právě tuto kombinaci CLE a cholangioskopie typu Spy-glassDSTM prověřujeme v rámci pilotní studie [22].
Obr. 5. Srovnání materiálu získaného FNAB žlučovodu a CLE
Histologicky zastiženy nevýtěžné fragmenty bez orientace (velikosti 0,5 mm). CLE zachytilo jednoznačné maligní struktury (kroužek).
Fig. 5: Comparison of a specimen taken by FNAB and CLE
Fragments without orientation are not accurate for histopathological diagnosis (size 0.5 mm). CLE detected clear malignant structures (circle).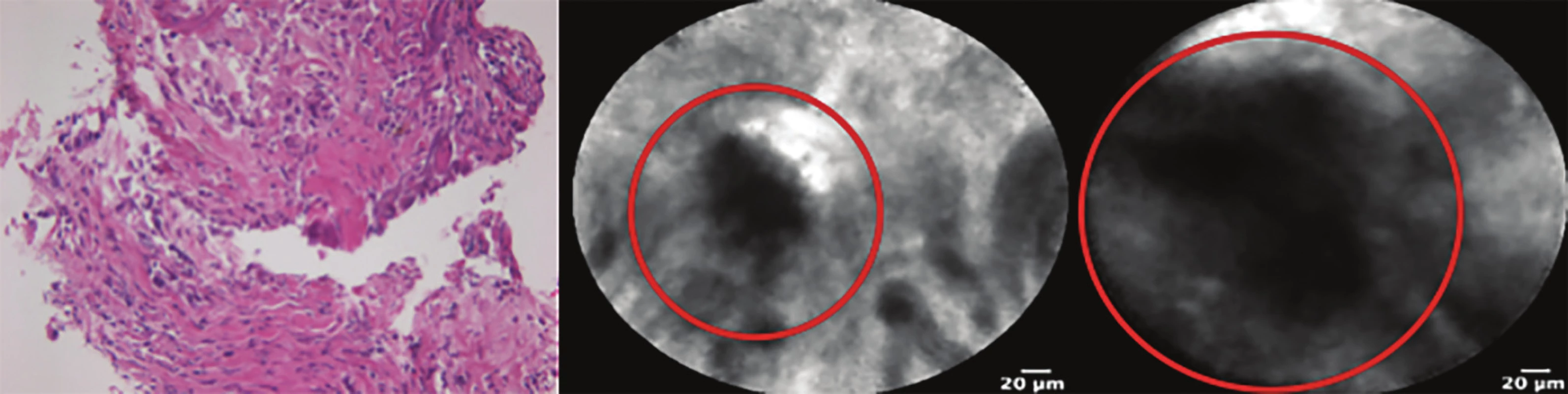
Jiné použití v gastroenterologii a hepatologii: Rozsah využití CLE v gastroenterologii a v medicíně narůstá, proto zde uvádíme výčet dalších indikací využití CLE, u kterých probíhají klinické studie: diagnostika primární sklerozující cholangitidy, detekce metastáz v lymfatických uzlinách, diagnostika a monitorace léčby u pacientů s nespecifickými střevními záněty.
Indikace v jiných medicínských oborech: Slibné výsledky poskytuje CLE i v dalších medicínských oborech, např. v urologii nebo pneumologii, kde se sonda díky svému malému průměru dostane pomocí tzv. „lung navigation system“ až k oblasti terminálních bronchiolů, což doposud nebylo možné vzhledem k jejich velikosti. Některé studie nasvědčují, že by se CLE mohlo používat v diagnostice bronchogenních karcinomů [23], k detekci rejekce u pacientů po transplantaci plic [24], v diagnostice chronické obstrukční plicní choroby [25] či intersticiálních plicních procesů [26].
Neméně slibné je využití CLE v diagnostice nádorů hlasivek, a to zejména tumorů s glotickou lokalizací, které mají horší prognózu. Provedení biopsie v této lokalitě prakticky není možné.
Některá pracoviště v USA využívají CLE k detekci resekčních okrajů během neurochirurgických výkonů při resekci mozkových nádorů, kde je peroperační excize výrazně limitovaná a často v podstatě nemožná. Tato aplikace je zatím výlučně součástí experimentu a není schválena pro standardní použití. V oblasti břišní chirurgie se zkoumá možnost využití CLE k diagnostice negativity/pozitivity resekčních okrajů během operačního zákroku nebo k detekci časných ischemických změn při tvorbě různých anastomóz.
Vlastní zkušenosti
V IKEM jsme začali CLE používat v první polovině roku 2015, od dubna 2016 pak jako součást grantového projektu. Dosud jsme vyšetřili 88 pacientů a provedli jsme 111 CLE vyšetření v následujících indikacích (Tab. 3). CLE jsme použili jako první na světě k detekci ACR u pacientů po transplantaci tenkého střeva jako součást MVTx. Všichni pacienti podstoupili endoskopii horního zažívacího traktu a následně byli vyšetřeni pomocí CLE (u pacientů po MVTx byl endoskop zavedený stomií). U pacienta s pankreatickou lézí byla sonda zavedena skrz jehlu používanou k aspirační biopsii.
Tab. 3. Přehled počtu vyšetření CLE v IKEM (současný stav)
Tab: 3: Total number of CLE examinations in IKEM (current status)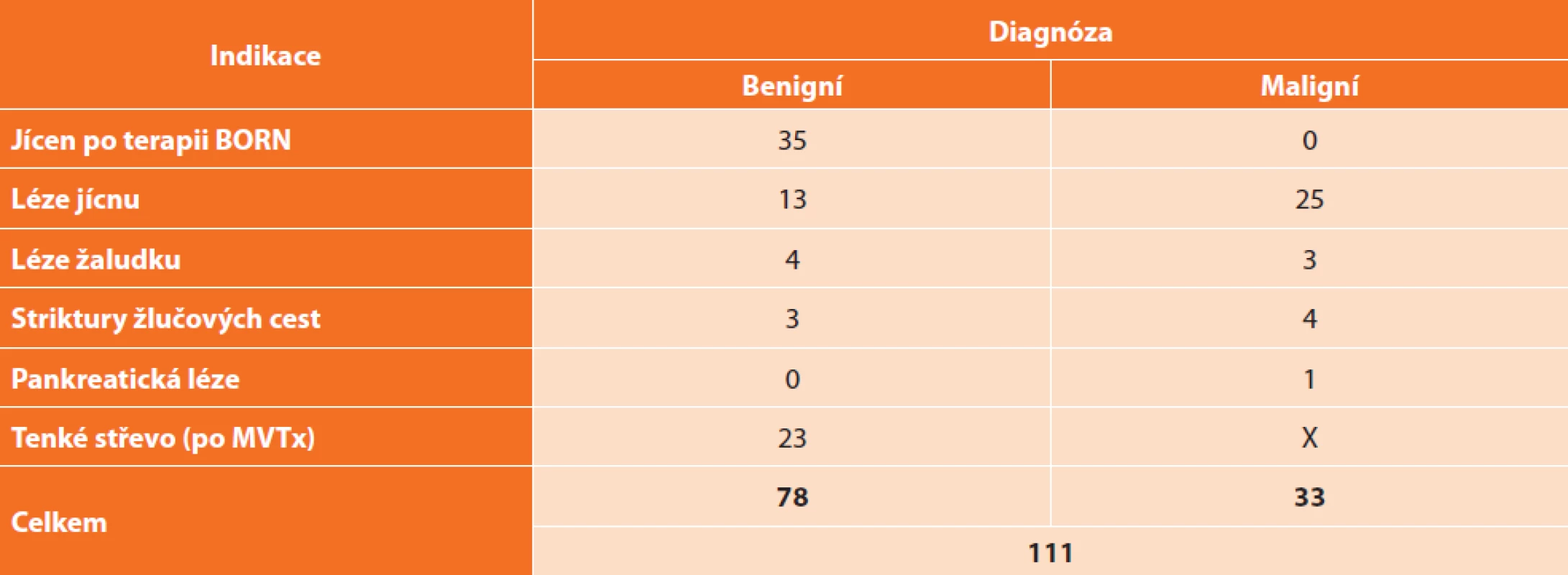
Vysvětlivky: (BORN – Barrett´s Oesophagus Related Neoplasia; MVTx – Multiviscerální Transplantace) Kvalitní obraz (sekvence) CLE je nezbytný pro hodnocení a správnou diagnózu. Kvalita obrazu pak závisí na několika faktorech.
Prvním faktorem je počet vyšetření CLE, které endoskopista provedl. Buchner AM, et al. a Gaddam S, et al. uvádějí tzv. „Cellvizio learning curve“, které činí kolem 30−50 vyšetření [27,28]. Kvalita obrazu se tedy přímo úměrně zvyšuje s počtem provedených vyšetření. Dalším faktorem ovlivňujícím kvalitu obrazu je použití tzv. plastového capu na endoskopu a naklonění sondy k vyšetřované oblasti pod správným úhlem. Neméně důležitá je rovněž learning curve lékaře, který sekvence pořízené CLE hodnotí.
Diagnostická kritéria
Diagnostická kritéria jsou odlišná pro jednotlivé orgány a jejich popis vysoce přesahuje rámec tohoto textu. Lze však mezi nimi najít nějakou spojitost, proto zde uvádíme obecné znaky pro trávicí trubici (Tab. 4). Znaky jsou v podstatě kompletně rozdílné u pankreatických cystických lézí, kde se nehodnotí architektonika a morfologie, ale pro danou jednotku specifické znaky.
Tab. 4. Diagnostická kritéria CLE používaná v diagnostice lézí jícnu a žaludku
Tab. 4: Diagnostic criteria for CLE used in the diagnosis of the lesions of esophagus and stomach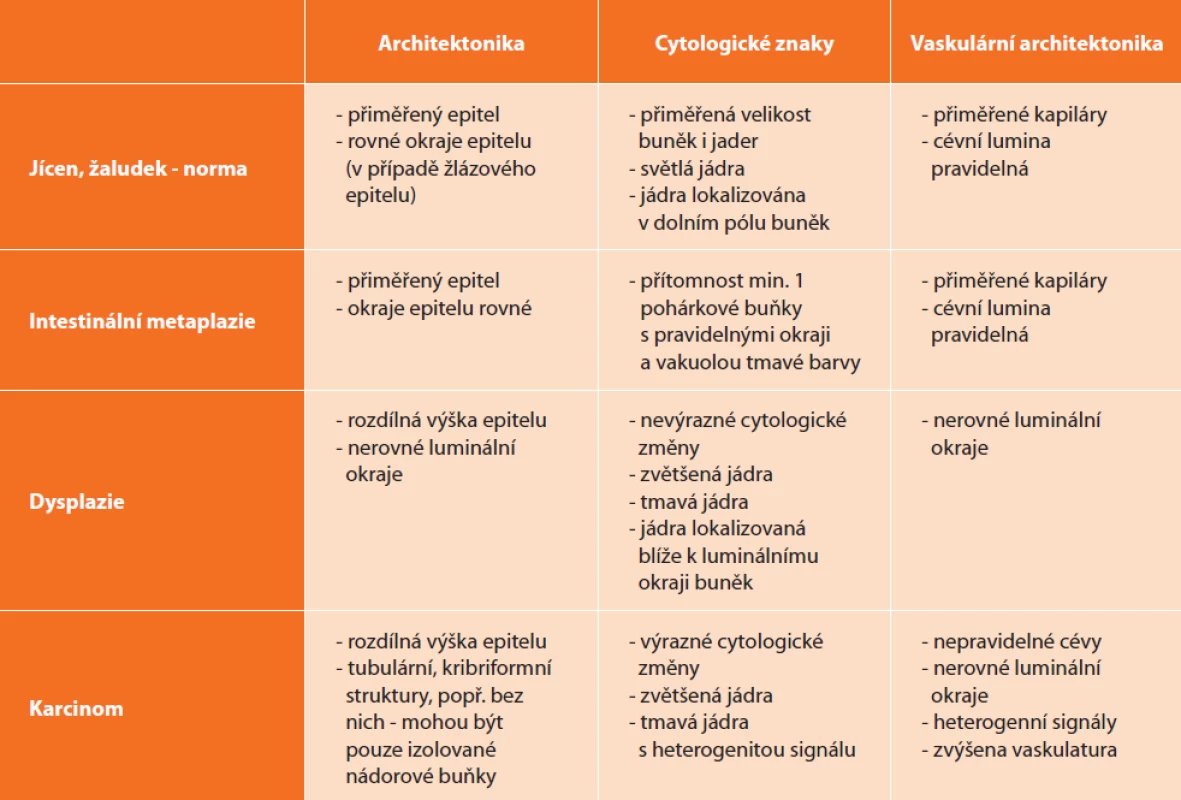
U orgánů trávicí trubice se hodnotí:
- Celková architektonika a morfologie orgánu: typ epitelu, pravidelnost epitelu, v případě žlázového epitelu okraje žlázek, luminální povrch žlázek.
- Cytologické znaky: pravidelnost jader vs. jaderné atypie, uložení jader v buňce, tvar a velikost jader. V případě výskytu buněk, které se v dané tkáni normálně nevyskytují, se hodnotí rovněž tyto buňky podle výše zmíněných znaků a zda splňují diagnostická kritéria pro danou buňku nebo metaplastický epitel (např. intestinální metaplazie je definovaná jako „cylindrický epitel s villiformním vzorem s tmavými pohárkovými buňkami obsahujícími mucin a s kapilárami pravidelného tvaru ve sliznici“).
- Architektonika cév: tvar cév, pravidelnost/nepravidelnost.
Vyhodnocování CLE
Jak bylo uvedeno výše, pankreatické cystické léze a léze žlučovodů může hodnotit gastroenterolog s vynikajícími výsledky (častokrát i v reálném čase), jelikož v těchto indikacích není potřebná histologická či histopatologická znalost morfologie a architektoniky tkání. V hodnocení CLE z jiných oblastí gastrointestinálního systému je stále preferovaný patolog, vzhledem k větší variabilitě obrazů vycházejících z morfologie dané tkáně.
V případě pankreatických cystických lézí se hodnotí lineární struktury, u kterých popisujeme: a) tvar; b) počet vrstev; c) pravidelnost povrchu; d) barvu; e) intenzitu signálu; f) nepřítomnost/přítomnost cév, ev. počet vrstev cév.
U lézí žlučovodu se hodnotí následující znaky: a) tvar; b) tloušťka; c) barva; d) přítomnost cév u jednotlivých struktur.
VÝSLEDKY
Jelikož se jedná o přehledový článek, jehož cílem není publikace výsledků, a většina našich studií stále pokračuje (ongoing studies), uvádíme zde pouze předběžné výsledky studie podporované grantem Ministerstva zdravotnictví ČR.
Projekt A: Cílem tohoto projektu je stanovit diagnostickou přesnost, senzitivitu a specificitu v diagnostice lézí jícnu a žaludku CLE. Vyšetřili jsme 45 lézí (38 lézí jícnu, 7 lézí žaludku) u 41 pacientů. Správná diagnóza byla v 76 % (34/45) a nesprávná v 24 % (11/45). CLE potvrdila maligní lézi v 82 % (23/28) a benigní lézi v 65 % (11/17). Senzitivita, specificita a diagnostická přesnost pro CLE byly 81 % (62–93 %), 91 % (59−99 %) a 84 % (70−93). U jednoho pacienta byla diagnóza spinocelulárního karcinomu středního jícnu stanovena pouze konfokální laserovou endomikroskopií (opakovanébiopsie byly zcela nevýtěžné).
ZÁVĚR
Konfokální laserová endomikroskopie představuje nový typ endomikroskopické metody používané v několika oborech medicíny a její spektrum a indikace se stále rozšiřují. CLE umožňuje zobrazení buněk i subepiteliálních struktur v reálném čase při 1000násobném zvětšení, tzv. optickou biopsii. CLE je možné použít prakticky v kterékoliv části zažívacího traktu.
V našem souboru jsme CLE použili v diagnostice 45 lézí jícnu a žaludku, u 35 pacientů po endoskopické léčbě jícnu k detekci intestinální metaplazie/neoplazie, u 7 pacientů v diagnostice žlučových striktur, u 1 pacientky s pankreatickou lézí a u 4 pacientů k detekci ACR v tenkém střevě po MVTx. V jícnu, žaludku nebo ve střevě je indikace CLE v budoucnosti diskutabilní, jelikož odběr biopsií je v těchto lokalitách jednoduchý. Hlavní výhodou zde zůstává mnohem větší vyšetřená oblast a možnost diagnostiky v reálném čase. Dle našeho názoru se jeví být v budoucnu hlavní indikací CLE v gastroenterologii u pacientů se strikturami žlučových cest a lézemi pankreatu – jak cystických, tak solidních, jelikož odběry tkáně z těchto lokalit nejsou častokrát dostačující. Přidanou hodnotu má zde CLE i proto, že je může hodnotit gastroenterolog. Nutno upozornit na tzv. Cellvizio learning curve, které je u endoskopistů 30 až 50 případů. Nevýhodou CLE je vysoká pořizovací cena přístroje (cca 180 000 USD) a rovněž cena za jedno vyšetření, která se u jednotlivých indikací liší (cca 500 USD při použití gastroflex sondy) [32].
Podpořeno z grantu Ministerstva zdravotnictví ČR s reg. č. 16-27648A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena. Studie je registrována na Clin. Trial. Reg. č. NCT02922049.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Marek Kollár
Pracoviště klinické a transplantační patologie
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha
e-mail: marek.kollar@ikem.cz
Zdroje
- Dunbar BK. Endomicroscopy in Barrett’s esophagus. Gastrointest Endosc Clin N AM 2013;21 : 565−79.
- Wallace BM, Sharma P, Lightdale C, et al. Preliminary accuracy and interobserver agreement for the detection of intraepithelial neoplasia in Barrett’s esophagus with probe-based confocal laser endomicroscopy. Gastrointest Endosc 2010;72 : 19−24.
- Kopáčová M, Bureš J, Österreicher J, et al. Konfokální laserová endomikroskopie u experimentálního prasete. Metodika ex vivo zobrazení. Cas Lek Cesk 2009;148 : 249−53.
- Kopáčová M, Rejchrt S, Tyčová V, et al. Confocal laser scanning endomicroscopy. Initial experience in the Czech Republic. Folia Gastroenterol Hepatol 2007;5 : 20−31.
- Sharma P, Meining AR, Coron E, et al. Realtime increased detection of neoplastic tissue in Barrett’s esophagus with probebased confocal laser endomicroscopy: Final results of a Multicenter Prospective International Randomized Controlled Trial. Gastrointest Endosc 2011;74 : 465−72.
- Li WB, Zuo XL, Li CQ, et al. Diagnostic value of confocal laser endomicroscopy for gastric superficial cancerous lesions. Gut 2011;60 : 299−306.
- Guo YT, Li YQ, Yu T, et al. Diagnosis of gastric intestinal metaplasia with confocal laser endomicroscopy in vivo: a prospective study. Endoscopy 2008;40 : 547−53.
- Lim LG, Yeoh KG, Srivastava S, et al. Comparison of probe-based confocal endomicroscopy with virtual chromoendoscopy and whitelight endoscopy for diagnosis of gastric intestinal metaplasia. Surg Endosc 2013;27 : 4649−55.
- Li Z, Zuo XL, Yu T, et al. Confocal laser endomicroscopy for in vivo detection of gastric intestinal metaplasia: a randomized controlled trial. Endoscopy 2014;46 : 282−90.
- Shadid MW, Buchner AM, Coron E, et al. Diagnostic accuracy of probe based confocal laser endomicroscopy in detecting residual colorectal neoplasia after EMR: A prospective study. Gastrointest Endosc 2012;75 : 525−33.
- Brugge WR, Lewandrowski K, Lee-Lewandrowski E, et al. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterol 2004; 126 : 1330−6.
- Jais B, Rebours V, Malleo G, et al. Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas). Gut 2015;65 : 305−12.
- Konda VJ, Meining A, Jamil LH, et al. A pilot study of in vivo identification of pancreatic cystic neoplasms with needle-based confocal laser endomicroscopy under endosconographic guidance. Endoscopy 2013;45 : 1006−13.
- Nakai Y, Iwashita T, Park DH, et al. Diagnosis of pancreatic cysts: EUS-guided, through the needle confocal laserinduced endomicroscopy and cytoscopy trial: DETECT study. Gastrointest Endosc 2015;81 : 1204−14.
- Napoleon B, Lemaistre Al, Pujol B, et al. A novel approach to the diagnosis of pancreatic serous cystadenoma: needle-needle based confocal laser endomicroscopy. Endoscopy 2015;47 : 26−32.
- Slivka A, Gan I, Jamidar P, et al. Validation of the diagnostic accuracy of probe-based confocal laser endomicroscopy for the characterization of indeterminate biliary strictures: results of a prospective multicenter international study. Gastrointest Endosc 2015;81 : 282−90.
- Shah RJ, Langer DA, Antillon MR, et al. Cholangioscopy and cholangioscopic forceps biopsy in patients with indeterminate pancreatobiliary pathology. Clin Gastroenterol Hepatol 2006;4 : 219−25.
- Gerhards MF, Vos P, van Gulik TM, et al. Incidence of benign lesions in patients resected for suspicious hilar obstruction. Br J Surg 2001;88 : 48−51.
- Varadarajulu S, Eloubeidi MD. The role of endoscopic ultrasonography in the evaluation of pancreatico-biliary cancer. Surg Clin North Am 2010;90 : 251−63.
- Anderson MA, Appalaneni V, Ben-Menachem T, et al. The role of endoscopy in the evaluation and treatment of patients with biliary neoplasia. Gastrointest Endosc 2013;77 : 167−74.
- Meining A, Chen YK, Pleskow D. et al. Direct visualization of indeterminate pancreatobiliary strictures with probe-based confocal laser endomicroscopy: a multicenter experience. Gastrointest Endosc 2011;74 : 961−8.
- Lörincz B, Husťák R, Bošák V, et al. Prvé skúsenosti s katétrovou konfokálnou laserovou endomikroskopiou (pCLE) v biliodigestívnej endoskopii. Gastroent Hepatol 2017;71 : 220−3.
- Fuchs FS, Zirlik S, Hildner K, et al. Confocal laser endomicroscopy for diagnosing lung cancer in vivo. Eur Respir J 2013;41 : 1401−8.
- Keller CA, Erasmus D, Alvarez F, et al. Preliminary observations in the use of confocal alveolar endomicroscopy in recipients of single lung transplantation. Presented at American Thoracic Society 2010 International Conference, New Orleans 2010.
- Newton RC, Camp SV, Yang GZ, et al. Imaging parenchymal lung diseases with confocal endomicroscopy. Am J Respir Crit Care Med 2010;181:A4316.
- Fuchs FS, Zirlik S, Hildner K, et al. Fluoresceinaided confocal laser endomicroscopy of the lung. Respiration 2011;81 : 32−8.
- Buchner AM, Gomez V, Heckman MG, et al. The learning curve of in vivo probe-based confocal laser endomicroscopy for prediction of colorectal neoplasia. Gastrointest Endosc 2011;73 : 556−60.
- Gaddam S, Mathur SC, Singh M, et al. Novel probe-based confocal laser endomicroscopy criteria and interobserver agreement for the detection of dysplasia in Barrett’s Esophagus. Am J Gastroenterol 2011;106 : 1961−9.
- Giovannini M, Bories E, Monges G, et al. Results of a phase I-II study on intraductal confocal microscopy (IDCM) in patients with common bile duct (CBD) stenosis. Surg Endosc 2011;25 : 2247–53.
- Othman MO, Wallace MB. Confocal laser endomicroscopy: is it prime time? J Clin Gastroenterol 2011;45 : 205–6.
- Caillol F, Bories E, Autret A, et al. Evaluation of pCLE in the bile duct: final results of EMID study: pCLE: impact in the management of bile duct strictures. Surg Endosc 2015;29 : 2661−8.
- Karia K, Kahaleh M. A review of probe-based confocal laser endomicroscopy for pancreaticobiliary disease. Clin Endosc 2016;49 : 462–6.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2018 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Vzdělávání chirurgů a kompetence
- Konfokální laserová endomikroskopie v diagnostice onemocnění gastrointestinálního traktu − literární přehled a vlastní zkušenosti
- Infekčné komplikácie súvisiace s operačnou liečbou degeneratívneho ochorenia driekovej chrbtice
- Splenektomie u pacientů starších 65 let – evaluace výsledků jednoho pracoviště
- Cílená axilární disekce a sentinelová biopsie u pacientek s karcinomem prsu po neoadjuvantní chemoterapii – retrospektivní studie
- Současné léčebné postupy při střelných poraněních v mírových podmínkách
- Crohnova choroba apendixu – kazuistika
- Zemřel primář Josef Kalný
- Ortotopická transplantace jater redukovaným a rotovaným štěpem dospělému příjemci se situs inversus: kazuistika a přehled publikovaných případů
- Vzpomínka na primáře Vladimíra Černého
- Zápis z jednání schůze Redakční rady časopisu Rozhledy v chirurgii, konané dne 7. 11. 2018
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současné léčebné postupy při střelných poraněních v mírových podmínkách
- Infekčné komplikácie súvisiace s operačnou liečbou degeneratívneho ochorenia driekovej chrbtice
- Cílená axilární disekce a sentinelová biopsie u pacientek s karcinomem prsu po neoadjuvantní chemoterapii – retrospektivní studie
- Crohnova choroba apendixu – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



