-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Rizikové faktory a pooperační komplikace po resekcích žaludku pro nádorové onemocnění
Risk factors and post-operative complications after gastrectomy for cancer
Introduction:
Gastric resections due to carcinoma belong to the most demanding procedures in visceral surgery. This is due to the requirements for the extent of resection and lymphadenectomy, coupled with the need for functional reconstruction of the digestive tract. The procedure is associated with 18−46% morbidity, which delays administration of adjuvant therapy and worsens oncological results. Identification of risk factors for potential complications may play an important role in the indication and perioperative care. The aim of our study is to (i) evaluate the morbidity a mortality of a patient group with post-gastrectomy complications and to (ii) identify associated risk factors.
Method:
This retrospective analysis comprises patients treated in 2005−2016. Gastric resection was performed in 266 adenocarcinoma patients, 172 men and 94 women (median age 66 years). Early post-operative complications following gastrectomy were observed within 60 days. Complications and their severity were evaluated according to the extended form of the Accordion Severity Grading System. Selected demographic risk factors, operative factors and malignancy-related factors were analyzed. Multivariate regression (orthogonal projections to latent structure) was used for statistical processing.
Results:
Overall morbidity and mortality was 34.6% and 3.4%. Serious complications occurred in 51 operated patients (19.2%). 24 patients had two or three complications (9%). The most common grades of severity were grade 2 in 31 patients (11.7%) and grade 4 in 20 patients (10.9%). The duration of hospital stay correlated with the severity of the complication. Most common surgical complications were: intra-abdominal abscess (16.4%, 17 cases), wound complications (5.3%, 14 cases), pancreatitis (4.9%, 13 cases), anastomotic leakage (3.4%, 9 cases), postoperative ileus (3.4%, 9 cases). Respiratory and cardiac complications were the most common non-surgical complications (8.6%, 23 cases and 3.8%, 20 cases, respectively). In the derived statistical model, BMI, the presence of more comorbidities, lesser surgical experience, the length of hospital stay and hospitalization at ICU were identified as risk factors associated with the grade of complication, morbidity, presence of serious complication and multiple complications.
Conclusion:
Gastrectomy plays a fundamental role in the curative treatment of gastric carcinoma; it is, however, associated with substantial morbidity and mortality. The best management of complications is their prevention. Preoperatively, the greatest attention should be paid to patients with several comorbidities and higher BMI. Resections should be performed by experienced surgeons. During resection, consideration should be given to the extent of resection and lymphadenectomy. In the postoperative period, the length of hospital stay, especially at ICU, should be reduced to minimum. Analyses of these risk factors may decrease the incidence of complications.
Key words:
gastric cancer – gastrectomy − risk factors − complications
Autoři: T. Jínek 1; L. Adamčík 1; R. Vrba 2; M. Duda 1,3; M. Škrovina 1,2
Působiště autorů: Chirurgické oddělení Nemocnice Nový Jičín, a. s., Centrum vysoce specializované onkologické péče pro dospělé Nový Jičín 1; I. chirurgická klinika Lékařské fakulty Univerzity Palackého Olomouc 2; II. chirurgická klinika Lékařské fakulty Univerzity Palackého Olomouc 3
Vyšlo v časopise: Rozhl. Chir., 2018, roč. 97, č. 8, s. 384-393.
Kategorie: Původní práce
Souhrn
Úvod:
Resekce žaludku pro karcinom patří k nejnáročnějším ve viscerální chirurgii. Důvodem jsou požadavky na rozsah resekce a lymfadenektomii a současně provedení funkční rekonstrukce zažívacího traktu. Výkony jsou zatíženy 18−46% morbiditou, která oddaluje podání adjuvantní léčby a zhoršuje onkologické výsledky. Identifikace rizikových faktorů komplikací může mít zásadní vliv při rozhodování o indikaci resekce a na perioperační péči. Cílem práce je zhodnocení (i) morbidity, letality a jednotlivých komplikací souboru a (ii) stanovení rizikových faktorů pro závažnost komplikací, morbiditu a mnohočetné komplikace po gastrektomii.
Metoda:
Do retrospektivní analýzy byli zařazení pacienti z let 2005−2016. Žaludek byl resekován u 266 nemocných s adenokarcinomem, 172 mužů a 94 žen, medián věku 66 let. Byly sledovány časné pooperační komplikace po gastrektomii do 60 dnů. Komplikace a jejich závažnost byly hodnoceny dle rozšířené formy Accordion Severity Grading System. Byly analyzovány zvolené demografické rizikové faktory nemocného, faktory operačního zákroku a nádorového postižení. Ke statistickému zpracování byla využita metoda vícerozměrné regrese (metoda ortogonálních projekcí do latentní struktury, OPLS).
Výsledky:
Celková morbidita byla 34,6 % a letalita 3,4 %. Závažné komplikace se vyskytly u 51 operovaných (19,2 %). 24 operovaných mělo více než 1 komplikaci (9 %). Nejčastějším stupněm závažnosti komplikace byl stupeň 2. u 31 nemocných (11,7 %) a 4. stupeň u 20 operovaných (10,9 %). Celková délka hospitalizace korelovala se stupněm závažnosti komplikace. Z chirurgických komplikací se vyskytl nejčastěji: nitrobřišní absces (17 resekovaných, 6,4 %), komplikace operační rány (14 operovaných, 5,3 %), pankreatitida (13 resekovaných, 4,9 %), anastomotický leak (9 případů, 3,4 %), pooperační ileus (9 resekovaných, 3,4 %). Respirační a kardiální komplikace byly nejčastějšími nechirurgickými komplikacemi (23 případů, 8,6 % a 20 případů, 3,8 %). Pro stupeň závažnosti komplikace, morbiditu, závažnou komplikaci a počet komplikací byly při vytvořeném statistickém modelu nalezeny tyto rizikové faktory: BMI, přítomnost dvou či více komorbidit, menší chirurgická zkušenost, celková doba hospitalizace a hospitalizace na JIP.
Závěr:
Resekce žaludku hrají zásadní roli v kurativní léčbě karcinomu žaludku. Výkony mají nezanedbatelnou morbiditu a letalitu. Nejlepším managementem komplikací je jejich prevence. Předoperačně by si měli zasloužit pozornost nemocní s více komorbiditami a vyšším BMI. Resekce by měly být provedeny zkušeným chirurgem. Během resekce by měl být dán zřetel na rozsah resekce a lymfadenektomii. V pooperačním období by měla být snížena délka hospitalizace zejména na JIP. Analýzy těchto rizikových faktorů mohou vést ke snížení incidence komplikací.
Klíčová slova:
karcinom žaludku – gastrektomie − rizikové faktory − komplikace
ÚVOD
Resekce pro malignitu na horním zažívacím traktu a slinivce patří k nejnáročnějším ve viscerální chirurgii. Důvodem jsou jak onkologické požadavky na rozsah resekce a lymfadenektomii, tak nutnost provedení funkční rekonstrukce zažívacího traktu s dobrou kvalitou života. Vzhledem k náročnosti jsou tyto resekce zatíženy 18−46% morbiditou [1,2,3,4,5]. Komplikace oddalují podání potřebné adjuvantní léčby a zhoršují celkové onkologické výsledky [6,7,8]. Resekce žaludku zůstává pilířem a jedinou nadějí kurativní léčby pokročilých karcinomů i přes pokroky v medicíně za poslední dvě desetiletí [9,10,11].
Ačkoliv celková incidence karcinomu žaludku celosvětově mírně klesá, vzrůstá incidence nádorů kardie a proximální třetiny žaludku zejména v západních zemích [12]. Nemocní jsou diagnostikováni se signifikantním váhovým úbytkem v pokročilém stadiu [13]. Denním chlebem moderního chirurga se stává hodnocení benefitu a rizika operace. Spolu s narůstajícím věkem populace, množstvím komorbidit a omezeným funkčním stavem nemocných je rozhodování o indikaci k operaci nesnadné. Předoperační identifikace rizikových faktorů komplikací se může stát zásadním při rozhodování o indikaci, rozsahu onkochirurgické resekce a průběhu perioperační péče.
Hodnocení chirurgických výsledků vyžaduje určitou konzistenci v referování, aby výsledky mohly být snadně reprodukovatelné a umožnily srovnání. Hlavními parametry jsou referování morbidity a letality společně s incidencí jednotlivých komplikací. Kvalita hodnocení se v minulosti ukázala jako nízká [14]. Studie neobsahovaly definice komplikací a nerozlišovaly jejich stupně závažnosti [15]. Clavien-Dindo a následně Strassberg vytvořili univerzálně akceptované systémy k hodnocení závažnosti pooperační komplikace [16,17]. Accordion Severity Grading Systém (ASGS) vychází ze Strassbergovy analýzy využívání a hodnocení komplikací dle Clavien-Dindovy klasifikace a jeho rozdělení neobsahuje podstupně závažnosti komplikací (3a, 3b a 4a, 4b). Klasifikace ASGS má zkrácenou a rozšířenou formu (Tab. 1).
Tab. 1. Accordion Severity Grading System
Tab. 1: Accordion Severity Grading System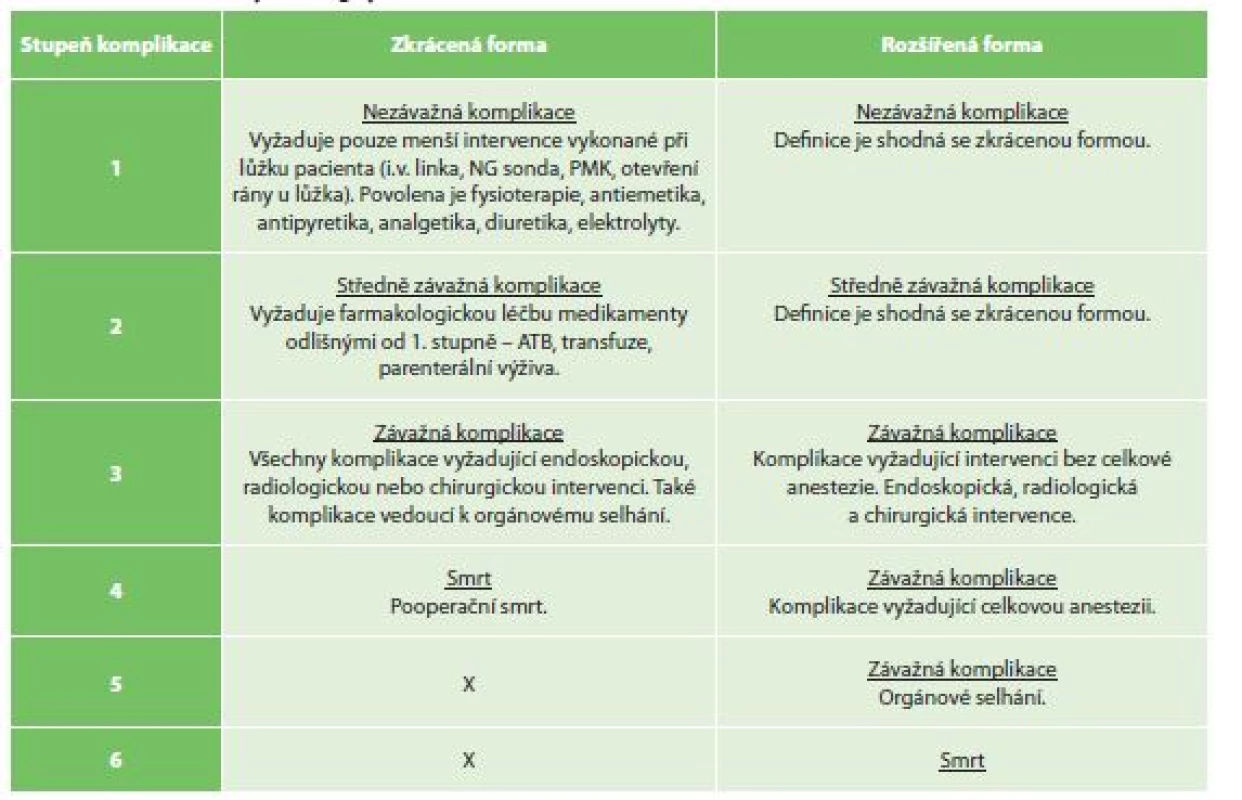
METODA
Do retrospektivní analýzy byli zařazení pacienti, kteří podstoupili resekci žaludku v období let 2005−2016 na chirurgickém oddělení Nemocnice Nový Jičín, a. s. Celkem bylo provedeno 391 primárních operačních výkonů. Data byla získána z nemocniční databáze. Byly sledovány časné pooperační komplikace po gastrektomii do 60 dnů od operace. Nutriční stav nemocných byl hodnocen dle nutričního rizikového skóre (NRS 2002) [18]. Komplikace a jejich závažnost byly hodnoceny dle rozšířené formy ASGS [17]. Jako závažná komplikace byla ohodnocena komplikace se stupněm ASGS ≥3. Do morbidity výkonů byly počítány komplikace ASGS ≥2. K definici dané komplikace a zařazení do stupnězávažnosti ASGS systému se vycházelo z Jungova návrhu definicí a stupňů závažnosti pro komplikace po gastrektomii (Tab. 2) [19].
Tab. 2. Definice časných chirurgických komplikací po gastrektomii dle Junga
Tab. 2: Definition of complications after gastrectomy (Jung 2012)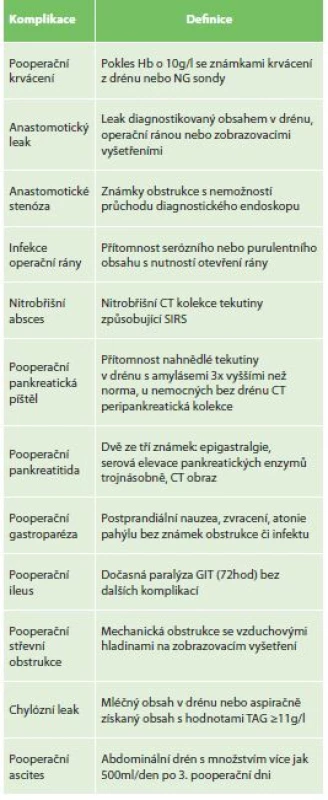
Zvolené rizikové faktory (prediktory) pro komplikace (závislé proměnné) byly rozděleny do tří skupin: rizikové faktory nemocného (Tab. 3), rizikové faktory operace (Tab. 4) a rizikové faktory malignity žaludku (Tab. 5).
Tab. 3. Analyzované demografické rizikové faktory souboru
Tab.3: Patients’ demographic risk factors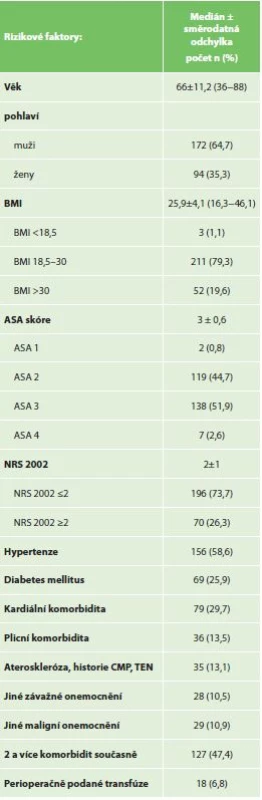
Tab. 4. Analyzované rizikové faktory operace
Tab. 4: Operation risk factors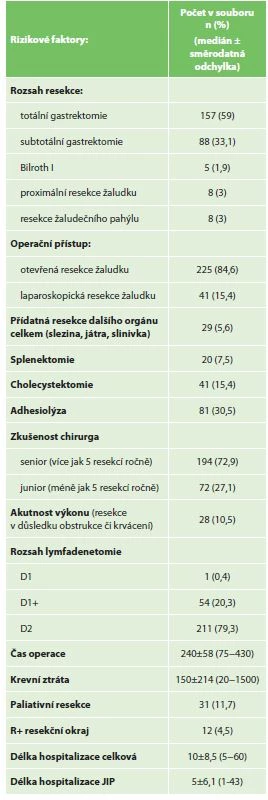
Tab. 5. Analyzované rizikové faktory zhoubného onemocnění
Tab. 5: Risk factors of the malignancy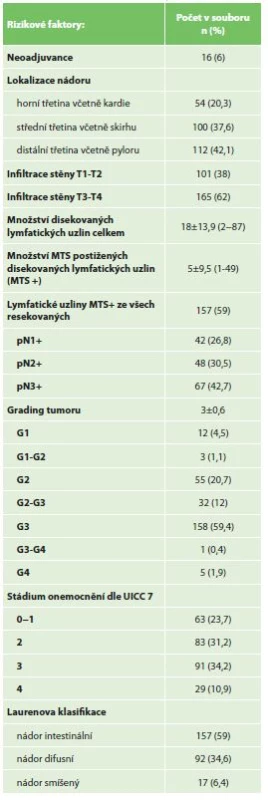
Charakteristika souboru
Celkem byl resekován žaludek u 266 nemocných, 172 mužů a 94 žen, medián věku 66 let (rozmezí 36−88 let). 19,6 % nemocných bylo obézních s BMI >30 a 26,3 % mělo signifikantní váhový úbytek dle NRS 2002 v době diagnózy. 51,9 % operovaných bylo hodnoceno anesteziologem ASA III. Nejčastější komorbiditou byla hypertenze (58,6 %) a u 47,4 % se vyskytly v osobní anamnéze dvě či více komorbidit. Všichni byli resekováni pro adenokarcinom, u 59,4 % nemocných se jednalo o G3 nádor a u 62 % nemocných byl nádor lokálně pokročilý (T3−T4).
Nejčastěji provedenou resekcí byla totální gastrektomie (TG) u 156 pacientů (58 %) a subtotální resekce (STG) u 88 (33,1%). Laparoskopicky asistovaně bylo provedeno 41 resekcí (15,4 %). 10,5 % výkonů bylo provedeno akutně z důvodů obstrukce či krvácení. D2 lymfadenektomie byla provedena u 79,3 % pacientů. Medián operačního času byl 240 min. (75−430) a krevní ztráty 150 ml (20−1500). Medián celkové doby hospitalizace byl 10 dní (5−60) a hospitalizace na JIP 5 dní (1−43).
Statistická analýza
K simultánnímu hodnocení a analýze vztahů mezi prediktory (rizikové faktory) a závisle proměnnými (stupněm závažnosti komplikacemi dle ASGS, morbiditou, závažnou komplikací, počtem komplikací u operovaného) byla využita metoda vícerozměrné regrese (multivariete regression) s redukcí dimenzionality, metoda ortogonálních projekcí do latentní struktury (OPLS) [20]. OPLS je schopna zvládnout problém silné multikolinearity (vysoká vzájemná korelovanost) v matici prediktorů. Multikolinearita v OPLS zvyšuje prediktivitu modelu.
Po vytvoření OPLS modelu je jeho vliv na daný soubor vyjádřen snížením míry variability (explained variability). Relevantní prediktory byly vybrány pomocí statistiky (VIP, variable importance). Míra statistické jistoty daného prediktoru je vyjádřena hodnotou t-statistiky. Míra vlivu daného faktoru v modelu je dána jeho komponentní váhou (CL – component loading). Statistické údaje byly zpracovány v softwaru SIMCA-P v. 12.0 od firmy Umetrics AB (Umeå, Švédsko).
VÝSLEDKY
V souboru resekovaných byla morbidita 34,6 %. Zemřelo 9 nemocných a letalita dosáhla 3,4 %. Závažné komplikace dle ASGS se vyskytly u 51 operovaných (19,2 %). Nejčastějším stupněm závažnosti komplikace byl stupeň 2. u 31 nemocných (11,7 % všech operovaných) a 4. stupeň, vyžadující intervenci v CA, u 20 (10,9 %) operovaných. 166 resekovaných mělo nekomplikovaný pooperační průběh (ASGS 0) a 24 operovaných mělo více než 1 komplikaci (9 %) (Tab. 6). V souboru resekovaných koreluje celková délka hospitalizace se stupněm závažnosti komplikace (Graf 1).
Tab. 6. Komplikace souboru
Tab: 6: Overall complications with grades of severity
Graf 1. Vliv závažnosti komplikace na délku hospitalizace v souboru resekovaných
Graph 1: Influence of the grading of complications on the duration of hospital stay
Z chirurgických komplikací se vyskytl nejčastěji nitrobřišní absces u 17 resekovaných (6,4 %). U 16 operovaných si absces vyžádal operační revizi v celkové anestezii (ASGS ≥4). Komplikace v hojení anastomózy byla v 9 případech (3,4 %). U 1 nemocného byla úspěšně řešena zavedením obdukovaného stentu (ASGS≥3). Ranné komplikace byly u 14 operovaných (5,3 %), ve 3 případech si vyžádaly reoperaci. Respirační komplikace byly nejčastější nechirurgickou komplikací, které se vyskytly ve 23 případech (8,6 %). Nejčastěji se jednalo o pneumonii a hrudní drenáž pro fluidothorax. Kardiální komplikace se vyskytly u 10 nemocných (3,8 %).
1) Analýza rizikových faktorů ke stupni závažnosti komplikace dle ASGS
Při vytvořeném OPLS modelu byla nalezena jako rizikový faktor s nejvyšší statistickou jistotou přítomnost dvou či více komorbidit v anamnéze (CL 0,542, t-statistika 20,33). Dalším statisticky rizikovým faktorem bylo BMI (CL 0,297, t-statistika 6,16), plicní komorbidita (CL 0,247, t-statistika 4,99), diabetes mellitus (CL 0,349, t-statistika 4,97) a menší chirurgická zkušenost (CL -0,246, t-statistika -3,71). Míra variability souboru při modelu klesla o 22,7 % (Tab. 7).
Tab. 7. Vliv rizikových faktorů ke stupni závažnosti komplikace dle ASGS
Tab. 7: Risk factors for complications severity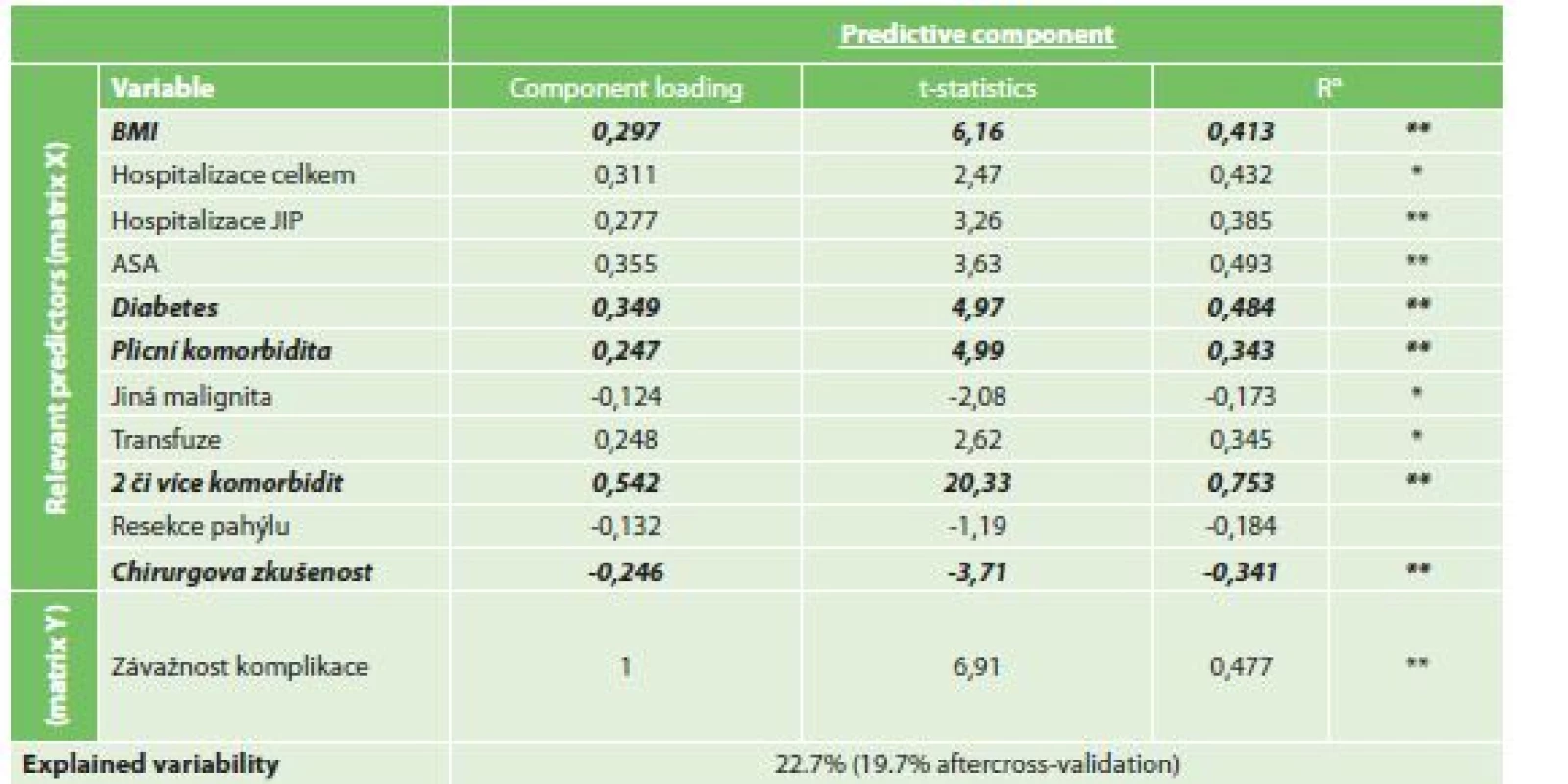
Vysvětlivky: αR…Component loadings expressed as a correlation coefficients with predictive component, *p<0.05, **p<0.01 2) Analýza rizikových faktorů morbidity
Při vytvořeném OPLS modelu byla jako rizikový faktor s nejvyšší statistickou jistotou nalezena délka hospitalizace na JIP (CL 0,503, t-statistika 19,51) a celková délka hospitalizace (CL 0,454, t-statistika 15,33). Mezi dalšími faktory byla přítomnost dvou či více komorbidit (CL 0,406, t-statistika 9,08), BMI (CL 0,198, t-statistika 9,01) a menší chirurgická zkušenost (CL -0,218, t-statistika 6,25). Míra variability souboru při modelu klesla o 30,7 % (Tab. 8).
Tab. 8. Vliv rizikových faktorů na morbiditu resekce žaludku
Tab. 8: Risk factors for overall morbidity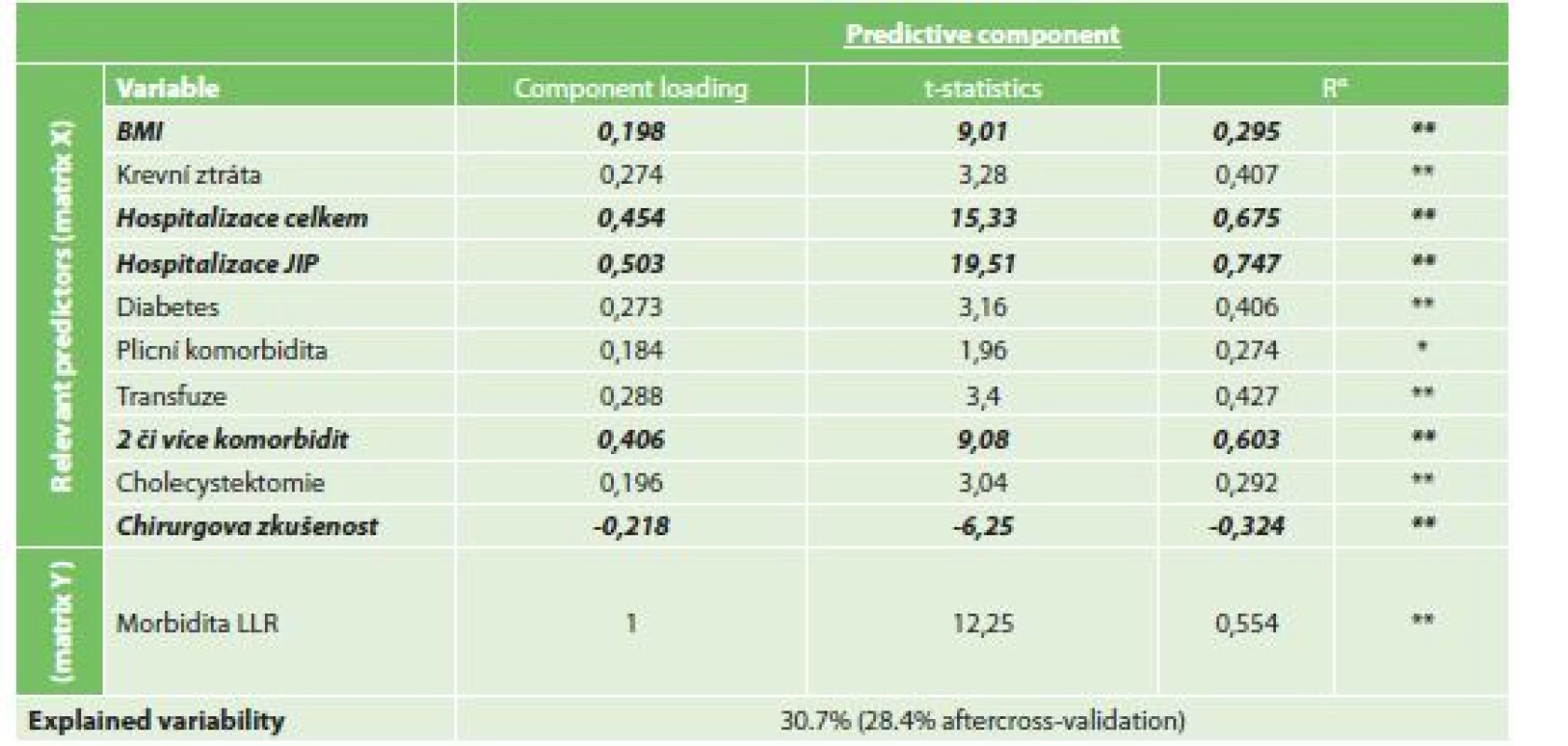
Vysvětlivky: αR…Component loadings expressed as a correlation coefficients with predictive component, *p<0.05, **p<0.01 3) Analýza rizikových faktorů závažné komplikaci dle ASGS (≥3)
Při vytvořeném OPLS modelu byla jako faktor s nejvyšší statistickou jistotou nalezena přítomnost dvou či více komorbidit (CL 0,478, t-statistika 9,76). Mezi dalšími nalezenými statistickými faktory byly celková doba hospitalizace (CL 0,381, t-statistika 6,34), BMI (0,274, t-statistika 4,91) a menší chirurgická zkušenost (CL -0,288, t-statistika -5,21). Míra variability souboru při modelu klesla o 26,1 % (Tab. 9).
Tab. 9. Vliv rizikových faktorů na závažnou komplikaci (ASGS ≥3)
Tab. 9: Risk factors for serious complications (ASGS ≥3)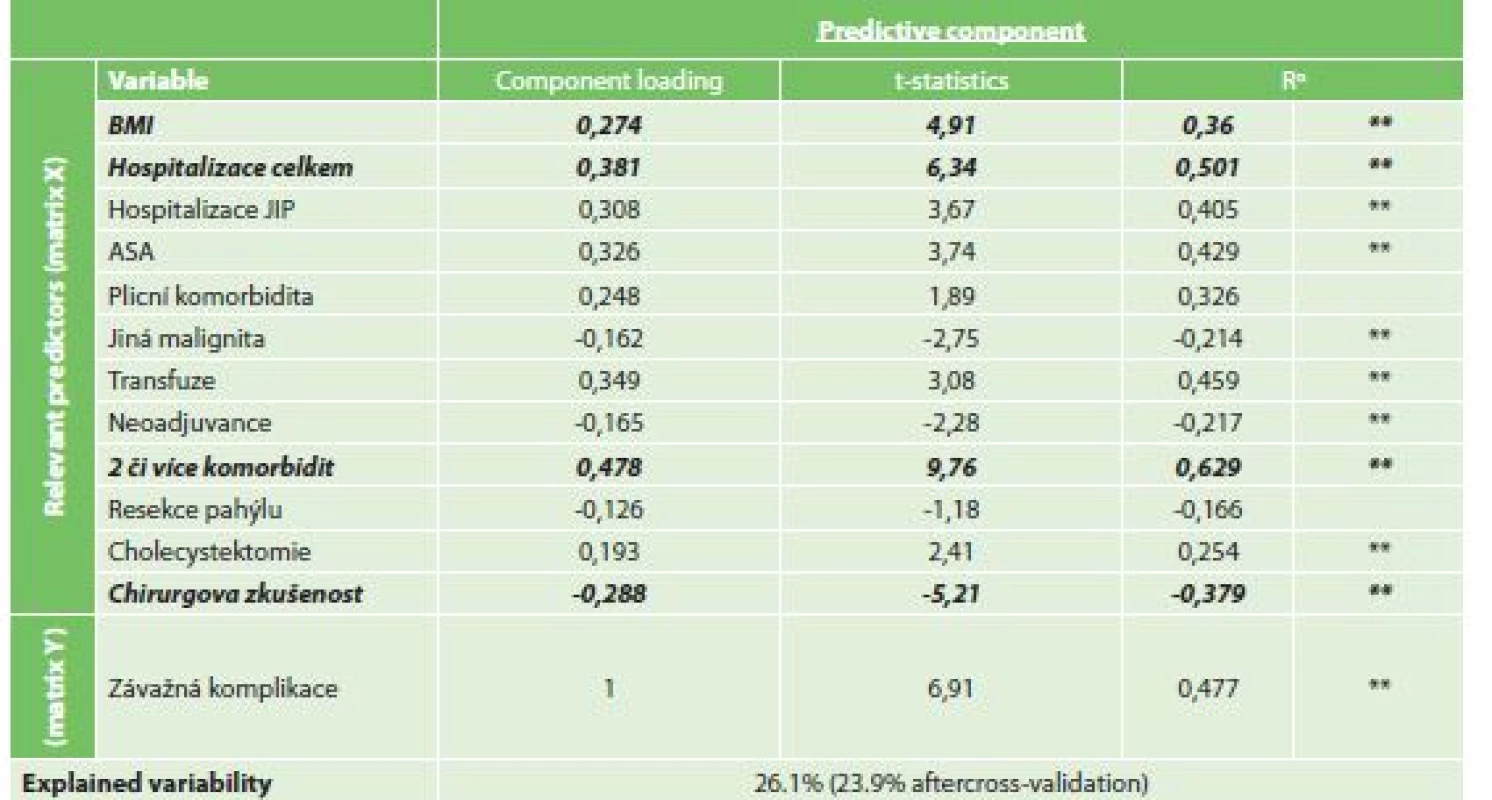
Vysvětlivky: αR…Component loadings expressed as a correlation coefficients with predictive component, *p<0.05, **p<0.01 4) Analýza rizikových faktorů mnohočetných komplikací
Při vytvořeném OPLS modelu byly jako rizikový faktor s nejvyšší statistickou jistotou pro větší počet komplikací nalezeny celková délka hospitalizace (CL 0,589, t-statistika 12,99) a délka hospitalizace na JIP (CL 0,614, t-statistika 12,67). Dalším statisticky nalezeným faktorem byla přítomnost dvou či více komorbidit (CL 0,425, t-statistika 11,06). Míra variability souboru při modelu klesla o 26,1 % (Tab. 10).
Tab. 10. Vliv rizikových faktorů na počet komplikací
Tab. 10: Risk factors for multiple of complications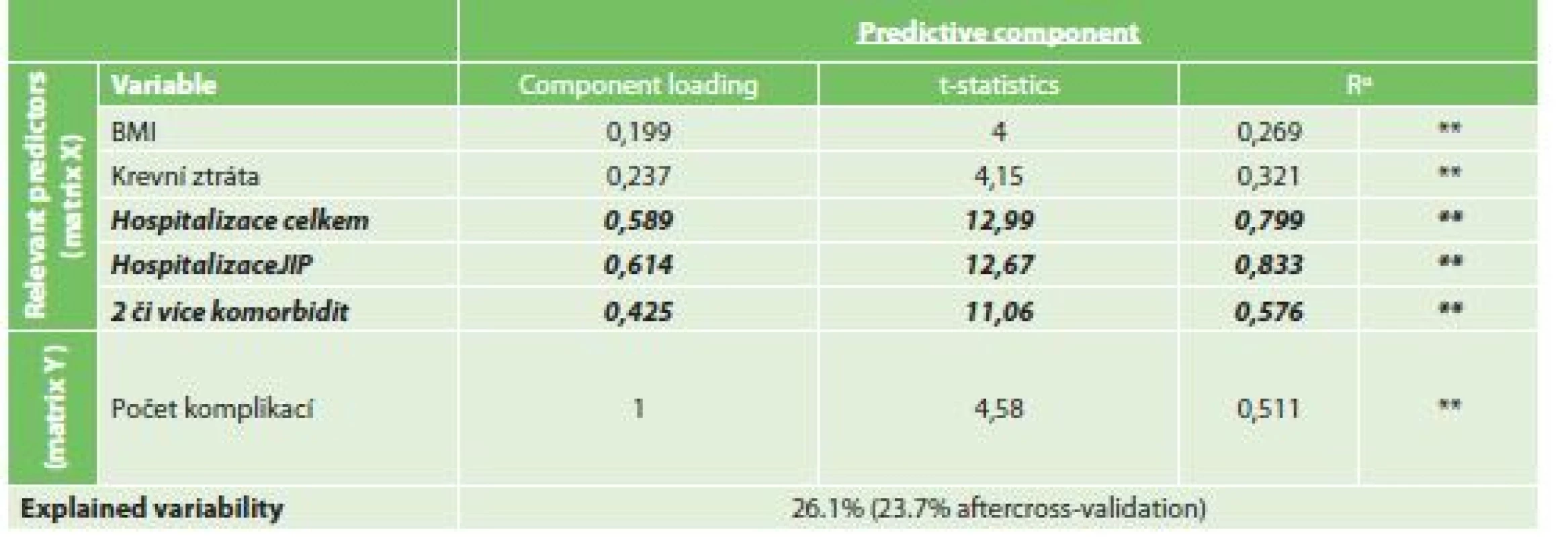
Vysvětlivky: αR…Component loadings expressed as a correlation coefficients with predictive component, *p<0.05, **p<0.01 DISKUSE
Kvalita hodnocení chirurgických výsledků byla v minulosti nekonzistentní a ovlivněna subjektivním pojetím chirurgů. Pro objektivitu hodnocení chirurgické péče je nutné dodržet určité parametry, kterými by měly být sjednocení definic komplikací a jejich závažnosti společně s pravidly v referování. V naší retrospektivní studii jsme shledali kombinaci Jungovy definice komplikací po resekcích žaludku se stupni závažnosti komplikací dle Accordion Severity Scoring System v praxi dobře využitelnou.
V souboru resekovaných byla morbidita 34,6 % a letalita dosáhla 3,4 %. Morbidita a letalita prezentovaného souboru je srovnatelná s výsledky zahraničních center, kde se udává mezi 18−46 % a 1−13 % [1,2,3,4]. Za posledních 20 let došlo k poklesu zejména u letality. Informace o morbiditě a letalitě po gastrektomii můžeme čerpat z národních databází. Americká databáze ACS-NSQIP (American College of Surgeons National Surgical Quality Improvement Program) sbírá 130 proměnných a je vázaná na kódování diagnóz. Sleduje 9 všeobecných pooperačních komplikací [21]. Z ACS-NSQIP databáze 2580 gastrektomií byla v univarietní analýze morbidita spojena s věkem, mužským pohlavím, nízkým performance statusem, kardiální primorbiditou, váhovým úbytkem, ASA a resekcí dalšího orgánu. V univarietní analýze 30denní letality byly shledány rizikem věk, kardiální primorbidita a váhový úbytek [5]. Japonské databáze se zaměřily pouze na letalitu. V modelu s 20 011 pacienty byl shledán jako nejvlivnější faktor u TG ASA skóre. K dalším faktorům patřila předoperační dialýza, přítomnost ascitu a zvýšené hladiny jaterních enzymů či bilirubinu [22]. V modelu distální gastrektomie s 33 197 operovanými měl významný vliv věk, performance status, cerebrovaskulární onemocnění, signifikantní váhový úbytek, ASA vyšší než 3, ascites a stejná laboratorní data jako u TG [23]. Kim ve své retrospektivní multicentrické analýze 1485 laparoskopických resekcí shledal dva signifikantní rizikové faktory, a to přítomnost komorbidity a chirurgovu zkušenost [24]. Obdobné výsledky přinesla i jiná unicentrická retrospektivní data [25,26]. Některé další publikace našly spojení mezi morbiditou, délkou operačního výkonu a podáním transfuze [25,27]. V roce 2012 Lee potvrdil menší výskyt veškerých a také závažných komplikací u laparoskopicky asistované STG v multivarietní analýze [28]. Jung zjistil, že operační čas, kardiovaskulární a plicní komorbidity byly nezávislým faktorem k závažným komplikacím [19].
V našem souboru měla na morbiditu resekcí největší vliv délka hospitalizace na JIP, jejíž medián činil 5 dní. Studie se dosud nezabývaly vlivem tohoto faktoru, ale je jasné, že pobyt na JIP je spojován s pomalejší rehabilitací a přítomnosti četných vstupů do organismu. V našem souboru tak zřejmě tato doba mohla být zkrácena. Celková doba hospitalizace může být zkrácena zavedením konceptu ERAS.
V 90. letech evropské randomizované studie s rozsahem lymfadenektomie nepotvrdily signifikantní zlepšení přežívání u rozšířených výkonů a upozornily na vyšší výskyt morbidity [1,2,3]. Italská multicentrická studie neprokázala rozdíl mezi morbiditou a letalitou mezi STG a TG [29]. Data americké databáze ACS-NSQIP a některé retrospektivní studie prokázaly nižší morbiditu po STG. Tyto poznatky naznačují, že mortalita a letalita jsou závislé jak na rozsahu lymfadenektomie, tak na rozsahu resekce žaludku [4,23,30].
Náročnost resekce žaludku, relativně nízká četnost prováděných resekcí a nutnost návaznosti onkologické léčby navýšily požadavky na dosažení uspokojivých chirurgických výsledků. Trend centralizace onkochirurgických výkonů lze spatřit celosvětově [31]. Studie se zabývají jak možným vlivem perioperační péče, resp. centra, provádějícího resekce (hospital volume), tak vlivem zkušenosti samotného chirurga (surgeon volume). Neexistuje všeobecně akceptovaný a nutný počet resekcí „tzv. high-volume“ nemocnice. Nemocniční vliv na mortalitu je prokázán zejména u ezofagektomie, zatímco u gastrektomie takový vliv potvrzen není [32,33]. Zkušenost chirurga se ukázala být rizikovým faktorem v několika studiích u laparoskopických resekcí [24,26,35]. Definice minimálního počtu resekcí k dosažení zkušenosti není ve studiích konzistentní. Riziko komplikací a reoperace u méně zkušených chirurgů, kteří provedli méně než 50 resekcí, může vzrůst až trojnásobně [24,34]. V naší studii byla zkušenost chirurga (méně než 5 resekcí ročně) rizikem pro morbiditu, závažnou komplikaci a vyšší stupeň závažnosti komplikace.
Vyšší BMI a intraabdominální obezita je mnoha chirurgy brána jako rizikový faktor komplikací z důvodů technické náročnosti provedení výkonu. Intraabdominální obezita způsobuje horší orientaci a zvyšuje riziko poranění anatomických struktur s krvácením. Obézní trpí komorbiditami jako diabetem, hypertenzí a aterosklerotickými změnami. V pooperačním období je rehabilitace pomalejší. Obézní mají větší riziko výskytu nechirurgických pooperačních komplikací jako koronární příhody, trombembolie či pooperační pneumonie [36]. V oblasti chirurgie horního GIT jsou náchylní k vyšší incidenci komplikací operační rány [37]. Existuje diskrepance mezi BMI nemocnými v Asii a na západě. V korejské multicentrické studii činilo průměrné BMI u laparoskopické resekce 23 kg/m2 [24]. V japonské databázi nemocných po TG byl medián BMI 22,4 kg/m2 [22]. V americké databázi byl medián BMI operovaných 26,4 kg/m2 [4]. Li et al. v metaanalýze pacientů s nadváhou (25 studií) potvrdili delší operační čas, vyšší krevní ztrátu, méně disekovaných lymfatických uzlin a delší dobu hospitalizace [38]. V našem souboru bylo BMI rizikovým faktorem morbidity, závažné komplikace a také vyššího stupně závažnosti komplikace.
Vysoká úroveň zdravotní péče a životní podmínky ve vyspělých zemích výrazně zvedly průměrný věk populace, který nese jak riziko zvýšeného výskytu karcinomu žaludku, tak zvýšené prevalence jednotlivých komorbidit. Ve studovaných analýzách nacházíme diabetes mellitus, kardiální, plicní a cerebrovaskulární komorbiditu. Užívané jsou i laboratorní hodnoty jako albumin, CRP a krevní obraz. Nemocní s komorbiditami mají 1,3 až 2,38x vyšší pravděpodobnost výskytu komplikací a 5,6x vyšší riziko reoperace než pacienti bez komorbidit. Pacienti s třemi komorbiditami měli v Kimově multicentrické analýze signifikantní větší výskyt komplikací než pacienti s dvěma nebo žádnou komorbiditou u laparoskopických distálních gastrektomií [24]. V Parkově analýze 300 laparoskopických gastrektomií byly komorbidity shledány jako rizikový faktor komplikací jak v univarietní, tak multivarietní analýze [25].
V našem souboru byla nejčastější komorbiditou hypertenze a kardiální onemocnění. Ve všech analýzách naší práce byla nejčastějším rizikovým faktorem přítomnost dvou či více komorbidit, které měly vztah k vyššímu stupni závažnosti, k morbiditě, k závažnější komplikaci i k vícečetným komplikacím. Nemocní s větším počtem komorbidit si v předoperační přípravě zasluhují větší pozornost.
ZÁVĚR
Resekce žaludku hrají nadále zásadní roli v kurativní léčbě karcinomu žaludku. Jejich morbidita a letalita není nezanedbatelná. Nejlepším managementem komplikací je jejich prevence. Předoperačně by měli mít pozornost nemocní s větším počtem komorbidit a vyšším BMI. Během resekce by měl být brán zřetel na rozsah resekce a rozsah lymfadenektomie se zachováním principů onkochirurgie. Zkušenost chirurga má zásadní roli. V pooperačním období by měla být snížena délka hospitalizace zejména na JIP. Analýzy těchto rizikových faktorů mohou vést k modifikaci perioperační péče a rozsahu resekce, a tak vést ke snížení incidence komplikací a brzké návaznosti adjuvantní léčby.
Seznam zkratek
ACS-NSQIP – American College of Surgeons National Surgical Quality Improvement Program
ASA – American Society of Anesthesiologists
ASGS – Accordion Severity Grading System
BMI – body mass index
CMP – cévní mozková příhoda
ERAS – Enhanced Recovery after Surgery
JIP – jednotka intenzivní péče
NRS – Nutriční rizikové skóre
PMK – permanentní močový katétr
SIRS – systémová zánětlivá reakce organismu
STG – subtotální gastrektomie
TEN – tromboembolická nemoc
TG – totální gastrektomie
Tento článek věnuji mým starším kolegům, chirurgům z Nového Jičína.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Tomáš Jínek
Dvořákova 331/4
741 01 Nový Jičín
e-mail: jinek.tomas@gmail.com
Zdroje
1. Bonenkamp JJ, Hermans J, Sasako M, et al. Extended lymph-node dissection for gastric cancer. N Engl J Med 1999;340 : 908–14.
2. Cuschieri A, Weeden S, Fielding J, et al. Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Br J Cancer 1999;79 : 1522–30.
3. Degiuli M, Sasako M, Ponti A, et al. Randomized clinical trial comparing survival after D1 or D2 gastrectomy for gastric cancer. Br J Surg 2014;101 : 23–31.
4. Papenfuss WA, Kukar M, Oxenberg J, et al. Morbidity and mortality associated with gastrectomy for gastric cancer. Ann Surg Oncol 2014;21 : 3008−14.
5. Adamčík L, Duda M, Škrovina M. et al. Komplikace a rizika chirurgie nádorů horní části zažívacího traktu (Foregut). II. část: Žaludek Rozhl Chir 2013;92 : 530−7.
6. Yoo HM, Lee HH, Shim JH, et al. Negative impact of leakage on survival of patients undergoing curative resection for advanced gastric cancer. J Surg Oncol 2011;104 : 734−40.
7. Li QG, Li P, Tang D, et al. Impact of postoperative complications on long-term survival after radical resection for gastric cancer. World J Gastroenterol 2013;19 : 4060−5.
8. Sierzega M, Kolodziejczyk P, Kulig J, et al. Impact of anastomotic leakage on long-term survival after total gastrectomy for carcinoma of the stomach. Br J Surg 2010;97 : 1035−42.
9. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®), Gastric Cancer, Version 4.2017 – September 21, 2017, Dostupné na: https://www.nccn.org/professionals/physician_gls/pdf/gastric.pdf
10. Šimša J, Šmejkal P. Chirurgická léčba karcinomu žaludku. Rozhl Chir 2012;91 : 446−8.
11. Šimša J. a kol. Karcinom žaludku, současná diagnostika a léčba. Praha, Maxdorf 2012.
12. Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA: A Cancer Journal for Clinicians 2015;65 : 87–108.
13. Epidemiologické analýzy. webový portál Lékařské fakulty Masarykovy Univerzity v Brně. Dostupný na: http://www.svod.cz/
14. Martin RC 2nd, Brennan MF, Jacques DP. Quality of complication reporting in the surgical literature. Ann Surg 2002;235 : 803−13.
15. Mitropoulos D, Artibani W, Graefen M, et al. European Association of Urology Guidelines Panel. Reporting and grading of complications after urologic surgical procedures: an ad hoc EAU guidelines panel assessment and recommendations. Eur Urol 2012;61 : 341−9.
16. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of survey. Ann Surg 2004;240 : 205−13.
17. Strasberg SM, Linehan DC, Hawkins WG. The accordion severity grading system of surgical complications. Ann Surg 2009;250 : 177−86.
18. Maňásek V. Nutriční léčba u onkologických nemocných. Onkol Revue 2017;2−10.
19. Jung MR, Park YK, Seon JW, et al. Definition and classification of complications of gastrectomy for gastric cancer based on the accordion severity grading system. World J Surg. 2012;36 : 2400–11.
20. Trygg J, Wold S (2002) Orthogonal projections to latent structure. J Chemometrics 16 : 119–128.
21. Fuchshuber PR, Greif W, Tidwell CR, et al. The power of the National Surgical Quality Improvement Program--achieving a zero pneumonia rate in general surgery patients. Perm J 2012;16 : 39−45.
22. Watanabe M, Miyata H, Gotoh M, et al. Total gastrectomy risk model: data from 20,011 Japanese patients in a nationwide internet-based database. Ann Surg 2014;260 : 1034−9.
23. Kurita N, Miyata H, Gotoh M, et al. Risk model for distal gastrectomy when treating gastric cancer on the basis of data from 33,917 Japanese patients collected using a nationwide Web-based data entry system. Ann Surg 2015;262 : 295−303.
24. Kim MC, Kim W, Kim HH, et al. Risk factors associated with complication following laparoscopy-assisted gastrectomy for gastric cancer: a large-scale Korean multicenter study. Ann Surg Oncol 15 : 2692–2700.
25. Park JM, Jin SH, Lee SR, et al. Complications with laparoscopically assisted gastrectomy: multivariate analysis of 300 consecutive cases. Surg Endosc 2008;22 : 2133–9.
26. Ryu KW, Kim YW, Lee JH, et al. Surgical complications and the risk factors of laparoscopy-assisted distal gastrectomy in early gastric cancer. Ann Surg Oncol 2008;15 : 1625–31.
27. An JY, Kim KM, Kim YM, et al. Surgical complications in gastric cancer patients preoperatively treated with chemotherapy: their risk factors and clinical relevance. Ann Surg Oncol 2012;19 : 2452–8.
28. Lee JH, Park DJ, Kim HH, et al. Comparison of complications after laparoscopy-assisted distal gastrectomy and open distal gastrectomy for gastric cancer using the Clavien-Dindo classification. Surg Endosc 2012;26 : 1287−95.
29. Bozzetti F, Marubini E, Bonfanti G, et al. Total versus subtotal gastrectomy: surgical morbidity and mortality rates in a multicenter Italian randomized trial. The Italian Gastrointestinal Tumor Study Group. Ann Surg 1997;226 : 613–20.
30. Lee KG, Lee HJ, Yang JY, et al. Risk factors associated with complication following gastrectomy for gastric cancer: retrospective analysis of prospectively collected data based on the Clavien-Dindo system. J Gastrointest Surg 2014;18 : 1269–77.
31. Jensen LS, Nielsen H, Mortensen PB, et al. Enforcing centralization for gastric cancer in Denmark. Eur J Surg Oncol 2010;Suppl 1:S50−4.
32. Fuchs HF, Harnsberger CR, Broderick RC, et al. Mortality after esophagectomy is heavily impacted by center volume: retrospective analysis of the Nationwide Inpatient Sample. Surg Endosc 2017;31 : 2491−7.
33. Kim EY, Song KY, Lee J. Does hospital volume really affect the surgical and oncological outcomes of gastric cancer in Korea? J Gastric Cancer 2017;17 : 246−54.
34. Kim W, Song KY, Lee HJ, et al. The impact of comorbidity on surgical outcomes in laparoscopy-assisted distal gastrectomy: a retrospective analysis of multicenter results. Ann Surg 2008;248 : 793−9.
35. Hwang SH, Park do J, Jee YS, et al. Risk factors for operative complications in elderly patients during laparoscopy-assisted gastrectomy. J Am Coll Surg 208 : 186–92.
36. Abdel-Moneim RI. The hazards of surgery in the obese. Int Surg 1985;70 : 101−3.
37. Hirao M, Tsujinaka T, Imamura H, et al. Osaka Gastrointestinal Cancer Chemotherapy Study Group (OGSG). Overweight is a risk factor for surgical site infection following distal gastrectomy for gastric cancer. Gastric Cancer 2013;16 : 239−44.
38. Li L, Li X, Chu S, et al. Does overweight affect outcomes in patients undergoing gastrectomy for cancer? A meta-analysis of 25 cohort studies. Jpn J Clin Oncol 2014;44 : 408−15.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2018 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Ohlédnutí za letošním kongresem sekce mladých chirurgů
- Radikalita proximální resekce žaludku - přehledový článek
- Kvalita života po proximální resekci žaludku – přehledový článek
- Může vyšetření lymfatických uzlin metodou One-Step Nucleic Acid Amplification zpřesnit staging plicních nádorů?
- Empyém pleurální dutiny – evaluace výsledků jednoho pracoviště
- Rizikové faktory a pooperační komplikace po resekcích žaludku pro nádorové onemocnění
- Tuberkulóza pečene − kazuistika
- Invertovaný Meckelův divertikl: raritní příčina ileo-ileální invaginace a krvácení do dolní části zažívacího traktu
- XVIII. Dny mladých chirurgů profesora Stanislava Čárského
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Rizikové faktory a pooperační komplikace po resekcích žaludku pro nádorové onemocnění
- Radikalita proximální resekce žaludku - přehledový článek
- Kvalita života po proximální resekci žaludku – přehledový článek
- Tuberkulóza pečene − kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



