-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Porucha v regulácii chromatínu ako molekulárny mechanizmus MLL-ENL leukemogenézy
Aberrant chromatin regulation as a molecular mechanism of MLL--ENL leukemogenesis
Chromosomal aberrations that affect the Mixed-Lineage Leukemia gene (MLL, known also as HRX or ALL-1) located at 11q23 are associated with an aggressive type of acute leukemia. Frequent translocations create a diverse set of MLL fusion genes with acquired active transforming potential resulting in leukemic conversion of MLL transcription factor. The normal MLL protein is involved in epigenetic maintenance of homeotic (Hox) gene expression through several rounds of cell division during development and differentiation. Alterations of this process by oncogenic MLL chimeric transcription factors lead to leukemia. This review is intended to provide a coherent view on normal and malignant function of MLL proteins - mainly focusing on MLL-ENL - in our current knowledge. Our own contribution to the field is also summarized in this review.
Key words:
acute leukemia, MLL, translocation, chromatin, epigenetics, transcription
Autoři: S. Takáčová 1; M. Jarošová 2; V. Divoký 1
Působiště autorů: Ústav biologie LF UP Olomouc 1; Hemato-onkologická klinika FN Olomouc 2
Vyšlo v časopise: Transfuze Hematol. dnes,13, 2007, No. 1, p. 16-22.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Chromozomálne aberácie postihujúce gén Mixed-Lineage Leukemia (MLL, známy tiež pod názvami HRX alebo ALL-1) na lokuse 11q23 sú asociované s agresívnym typom akútnej leukémie. Časté translokácie vedú ku vzniku heterogénnej skupiny MLL fúznych génov, ktoré získaním aktívneho transformačného potenciálu spôsobujú leukemickú konverziu MLL transkripčného faktoru. MLL proteín sa zúčastňuje epigenetického procesu udržovania expresie homeotických (Hox) génov v priebehu niekoľkých bunkových delení počas vývinu a diferenciácie buniek. Abnormálne zmeny v tomto procese vedú ku vzniku leukémie. Cieľom tohto súhrnného článku je poskytnúť ucelený prehľad o normálnej a malígnej funkcii MLL proteínov so zameraním predovšetkým na MLL-ENL v rámci súčasných poznatkov. Súhrnný článok zároveň zahŕňa vlastný prínos našej skupiny do danej problematiky MLL leukémií.
Kľúčové slová:
akútna leukémia, MLL, translokácia, chromatín, epigenetika, transkripciaHeterogenita prestavieb MLL génu
Gén MLL sa nachádza v oblasti 11q23 a zúčastňuje sa viacerých typov chromozomálnych aberácií, ktoré spôsobujú konverziu MLL protoonkogénu na aktívny onkogén. Mutácie génu MLL zahŕňajú okrem častých translokácií, aj inverzie, duplikácie, delécie; vo vzácnych prípadoch sa vyskytujú i génové amplifikácie. Najčastejšími mutáciami sú recipročné translokácie (1–3), ktoré sú asociované s agresívnou akútnou leukémiou (AL) v detskom aj v dospelom veku. V ich dôsledku vznikajú chimerické onkoproteíny, u ktorých N-terminálny konec MLL proteínu je fúzovaný s C-terminálnym koncom partnerského proteínu. Zlom v géne MLL najčastejšie nastáva v oblasti zahŕňajúcej exóny 8-14, nazývanej breakpoint cluster region (BCR). Lokalizáciu zlomov DNA do tejto oblasti ako i ich frekvenciu vo veľkej miere ovplyvňuje jej chromatínová štruktúra, ďalej repetitívne sekvencie a rozpoznávacie miesta pre topoizomerázu II, ktoré sa v BCR nachádzajú (4, 5, 6). Nie je preto prekvapením, že prestavby MLL patria medzi najčastejšie abnormality u sekundárnych leukémií po terapii inhibítormi topoizomerázy II.
MLL translokácie sa vyznačujú pozoruhodnou heterogenitou partnerských génov. Bolo popísaných viac než päťdesiat partnerských génových lokusov, ale ich značná časť je neznámeho pôvodu. Atlas genetiky a cytogenetiky v onkológii a hematológii v súčastnosti uvádza tridsaťštyri identifikovaných fúznych MLL partnerov (http://www.infobiogen.fr/services/chromcancer/Genes/MLL.html). Niekoľko nových translokácií bolo identifikovaných a charakterizovaných na HOK v Olomouci (nepublikované výsledky (obr. 1). Napriek veľkej diverzite MLL fúzií platí určitá „zákonitosť“ vo frekvencii ich výskytu. Podľa subcelulárnej lokalizácie normálnych proteínových produktov partnerských génov MLL je možné ich rozdeliť na nukleárne a cytoplazmatické. MLL je translokovaný v 5 % prípadov detských akútnych lymfoblastických leukémií (ALL) (43) a u 80 % kojeneckých ALL, z ktorých najmenej 50 % tvoria dve translokácie zahŕňajúce nukleárnych partnerov: t(4;11), ktorej výsledkom je fúzny onkogén MLL-AF4, a t(11;19), ktorá dáva vznik fúznemu onkogénu MLL-ENL (7, 8). Kým MLL-AF4 špecifikuje výlučne pre-B bunkový fenotyp ALL, MLL-ENL sa vyskytuje aj u akútnych myeloblastických leukémií (AML), u akútnych bifenotypických leukémií (ABL) a v ojedinelých prípadoch u T-bunkovej ALL (1, 7, 9). Okrem toho tvoria MLL translokácie 10 % všetkých mutácií u AML. Sú to najmä fúzie s nukleárnymi partnermi: t(9;11), kódujúca fúzny produkt MLL-AF9, a t(6;11), kódujúca MLL-AF6 (10). Ďalšie MLL fúzne onkogény s nukleárnymi partnermi ako i všetky fúzie s cytoplazmatickými partnermi sa vyskytujú v malých skupinách pacientov a v ojedinelých prípadoch. Skutočnosť, že MLL je častejšie fúzovaný s nukleárnymi proteínmi, poukazuje na to, že tieto chimerické onkoproteíny sa vyznačujú vysokým transformačným potenciálom v porovnávaní s cytoplazmatickými partnermi, a menej vyžadujú kooperáciu ďalších onkogénov v leukemickej transformácii krvotvorných buniek. Nezávisle na fenotype leukémie, výskyt MLL mutácií u pacientov vždy zhoršuje prežitie a je spojený s veľmi zlou prognózou.
Obr. 1. Schematické znázornenie mapovania a určovania lokalizácie zlomu na chromozóme X u detskej pacientky s ALL asociovanou s prestavbou 11q23. Pomocou FISH sa potvrdila translokácia génu MLL s partnerským X chromozómom (nie je ukázané). A. Výsledok FISH s BAC sondou RP11-298A8, ktorá mapuje do oblasti Xq27 a je značená zeleným fluorochrómom, a zároveň s centromerickou sondou CEPX (Abbott-Vysis), ktorá je značená červeným fluorochrómom. Lokalizácia BAC sondy na X chromozóme potvrdzuje, že zlom nenastal v pruhu q27. B. Mapovanie oblasti Xq28 pomocou BAC sondy RP11- 1085P10 značenej zeleným fluorochrómom a centromerickej sondy CEPX (Abbott-Vysis) značenej červeným fluorochrómom. Lokalizácia signálu BAC sondy na inom chromozóme (chromozóm 11) potvrdzuje zlom X chromozómu v pruhu q28. C. Mapa X chromozómu znázorňuje zlom v pruhu q28. Fúzia MLL génu s Xq28 nebola doteraz popísaná. 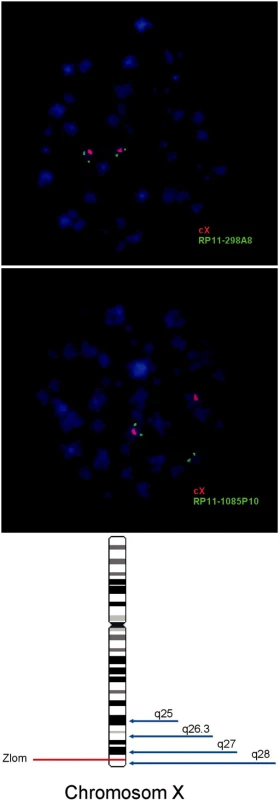
Normálna funkcia MLL
MLL proteín je transkripčný faktor, ktorý sa zapája do udržiavania „transkripčnej pamäte“ počas embryogenézy, dozrievania a vývinu mnohých typov buniek. MLL je proteín s vysokou molekulovou hmotnosťou (skladá sa z 3968 aminokyselinových jednotiek), ktorý sa v bunke proteolyicky štiepi na C-koncový (MLLC) a N-koncový (MLLN) fragment. Po translokácií do jadra sa fragmenty spoja do jedného proteínového komplexu (44, 45, 46). Zjednodušená štruktúra proteínu MLL a funkčné domény jednotlivých fragmentov sú znázornené na obrázku 2.
Obr. 2. Schematické znázornenie štruktúry MLL proteínu a jeho konverzie na onkogénny transkripčný faktor MLL-ENL. Po fúzii s ENL N-terminálna časť MLL proteínu je zachovaná a podieľa sa na väzbe DNA. MLL ale stráca transaktivačnú a H3K4 metylačnú aktivitu na C-konci. MLL-ENL chimerický onkoproteín získa histón H3-väzobnú funkciu na N-terminálnom konci ENL a transaktivačný potenciál sprostredkovaný s Cterminálnou doménou ENL. Táto doména sa zúčastňuje proteín-proteínových interakcií s ďalšími MLL partnermi AF5q31 a AF4 v rámci elongačného komplexu. Súčasné vedecké poznatky dokazujú, že táto doména je potrebná a dostačujúca k leukemickej transformácii krvotvorných progenitorov (29). Na obrázku je znázornený aj BCR a bodfúzie MLL s ENL. 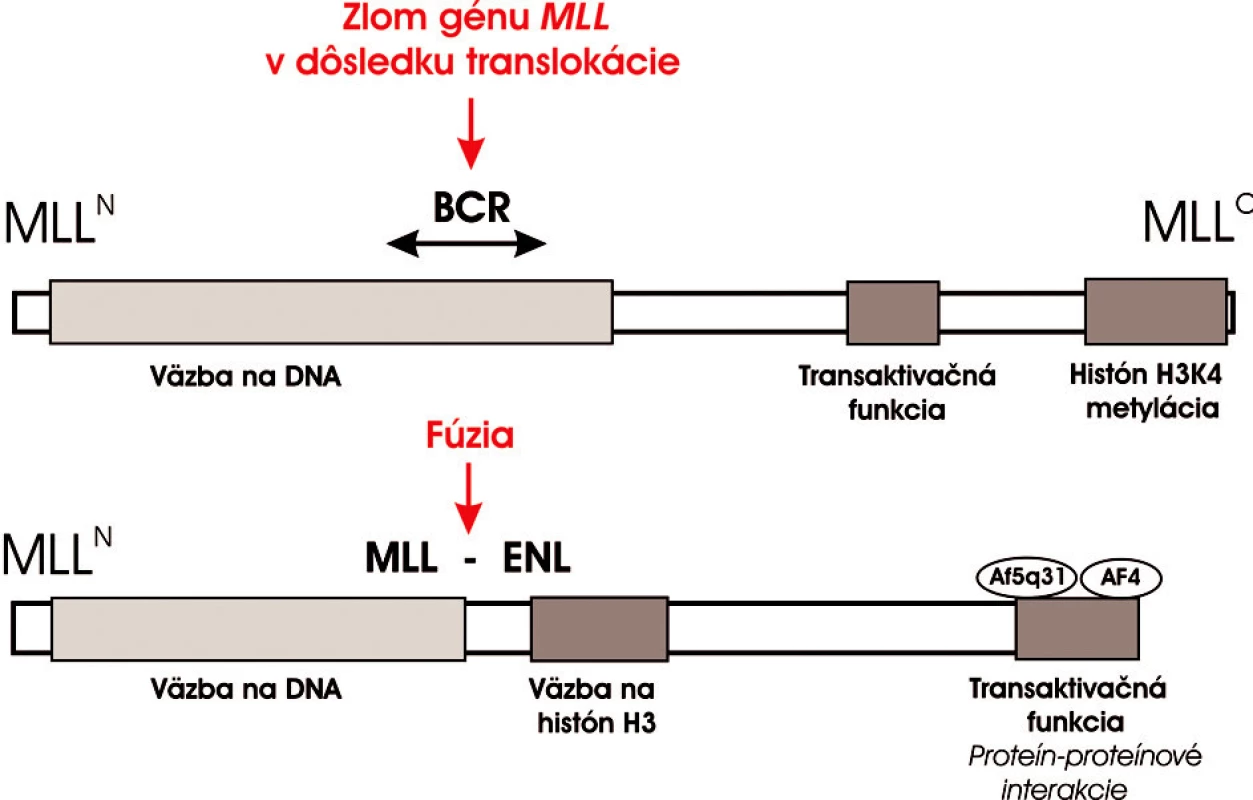
Transkripčná pamäť umožňuje bunke zapamätať si, akým je bunkovým typom, a zabezpečuje zachovanie a prenos daného genetického programu zakódovaného v podobe histónových modifikácií chromatínu do ďalšej generácie počas niekoľkých bunkových delení. To znamená, že daný histónový kód určuje, ktoré gény sa majú zapínať v danom vývinovom štádiu, ako dlho majú byť udržiavané v aktívnom stave a kedy ich treba vypnúť.
Heterozygótny stav straty funkcie MLL u myší vedie ku skeletálnym transformáciam a posteriornému posunu profilu expresie Hox génov. Expresia Hox génov sa normálne aktivuje u myších embryí s úplnou deficienciou MLL, ale nie je udržovaná počas celého vývinu, čo má letálny efekt v skorom štádiu embryogenézy. Tieto výsledky poukázali nato, že kľúčovými cieľovými génmi MLL sú Hox gény kódujúce transkripčné faktory s dôležitou úlohou v regulácii embryonálneho vývinu, bunkového delenia, líniovej špecifikácie a diferenciácie buniek (20, 32, 33).
Leukemická konverzia transkripčného faktoru MLL
Translokáciou na partnerský lokus transkripčný faktor MLL stráca C-terminálnu časť, ktorá je zodpovedná za transaktiváciu cieľových génov a poskytuje schopnosť modifikovať chromatín. Doterajšie práce dokazujú, že skrátená N-terminálna časť MLL nemá leukemogénne vlastnosti, avšak pomocou fúzneho partnera nadobúda transformačný potenciál in vitro (11–16) a spôsobuje leukémiu u myši (17–19). Skoršie hypotézy naznačovali, že MLL leukemogenéza by mohla byť výsledkom dvoch mechanizmov - získavania nových funkcií MLL onkogénu, ktorý dominantne negatívnym spôsobom potláča účinok normálnej alely, a zároveň straty funkcie jednej alely MLL. Súčasný pohľad na vznik a vývin MLL leukémií skôr podporuje mechanizmus nadobúdania nových onkogénnych funkcií, čo je v súlade s už dávno známym faktom, že heterozygótna deficiencia MLL nevedie k vývinu leukémie u myší (20). Jarošová a kol. popísali prípad „skrytej“ fúzie MLL-AF10 u pacienta s AML, ktorá vznikla duplikáciou 5‘ časti MLL a jej následnou inzerciou do oblasti 10p12. Ďalším zaujímavým zistením bolo, že nedošlo k recipročnej translokácii, a preto obidve alely MLL zostali zachované. Tento predtým nikdy nepopísaný mechanizmus vzniku MLL fúzií poskytuje ďalší dôkaz o tom, že strata jednej alely MLL neprispieva k leukemogenéze (21). Molekulárna podstata leukemickej konverzie MLL proteínu spočíva v nadobúdaní nových funkcií prostredníctvom fúznych partnerov. Jedným z mechanizmov je priama fúzia MLL s transaktivačnou doménou nukleárnych partnerských proteínov. Konverzia proteínu MLL na onkogénny transkripčný faktor je schematicky znázornená na príklade vzniku MLL-ENL fúzneho onkoproteínu na obrázku 2.
Viac partnerov-jedna funkcia?
Charakteristickým rysom MLL leukémií je ich rozmanitý fenotyp. Na rozdiel od iných leukemických onkogénov, ktoré sú zväčša asociované s jedinou špecifickou hematopoetickou líniou, jednotlivé MLL onkogény vykazujú tendenciu určovať leukemický fenotyp. Napriek vysokej heterogenite MLL fúznych onkoproteínov, nevykazujú MLL leukémie výrazne odlišný profil expresie génov v súvislosti s jednotlivými partnermi, ale MLL translokácie sa skôr zoskupujú na základe fenotypu leukemickej línie (22, 23). So všetkými prestavbami MLL génu je dominantne asociovaná vysoká hladina expresie Hox génov, čo poukazuje na to, že deregulácia Hox génov môže byť spoločným mechanizmom leukemickej transformácie MLL onkogénmi (23). Na základe týchto faktov si treba položiť otázku, ako môžu natoľko odlišné, nepríbuzné proteíny dávať vznik onkogénnym MLL chiméram, ktoré transformujú hematopoetickú bunku podobným mechanizmom – nadmernou expresiou Hox génov. Novšie štúdie sa domnievajú, že najčastejšie nukleárne partnerské proteíny MLL fúzií sú súčasťou siete proteínových interakcií, ktorá ich pravdepodobne spája do jedného hypotetického multiproteínového komplexu nazývaného „MLL-web“. V ňom sú jednak pospájané interakciami medzi sebou, a jednak fyzicky a funkčne interagujú s transkripčným aparátom a transkripčnou elongáciou. V strede „MLL-web“ komplexu ležia MLL fúzni partneri dvoch proteínových rodín: ENL rodina a AF4 rodina. Proteíny ENL rodiny, ENL a AF9 obsahujú evolučne konzervovanú histón H3–väzobnú doménu na N-konci, transaktivačnú doménu na C-konci a spájajú „MLL-web“ komplex s chromatínovým templátom. Zároveň interagujú s proteínmi druhej rodiny, AF4 a AF5q31. AF5q31 priamo interaguje s komponentami transkripčného aparátu počas elongácie, čo naznačuje hypotézu, že proteínový komplex MLL fúznych partnerov podporuje priebeh transkripčnej elongácie (obr. 3) (24–26).
Obr. 3. „MLL-web“. Najčastejšie nukleárne partnery MLL tvoria hypotetický proteínový komplex, v ktorom sú pospájané medzi sebou pomocou vzájomných interakcií. ENL zabezbečuje kontakt medzi komplexom a chromatínom. AF5q31 interaguje s elongačným komplexom (modifikované podľa 25). 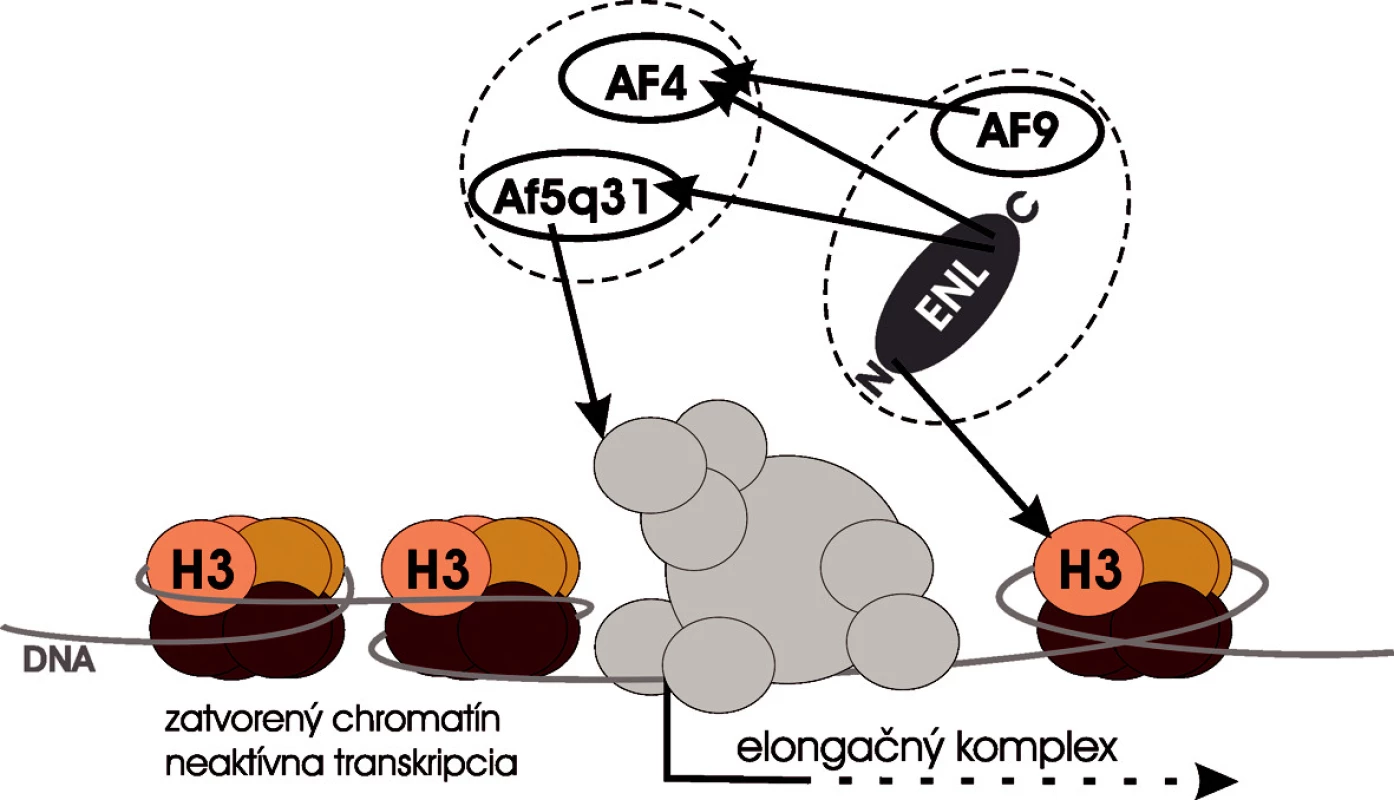
Aspekty MLL-ENL leukemogenézy
Leukemická konverzia MLL transkripčného faktoru je prvou udalosťou mnohokrokového procesu – „evolúcie“ akútnej leukemogenézy. Účinok MLL-ENL onkoproteínu v leukemogenéze spočíva vo zvýšení kapacity sebaobnovovania krvotvornej kmeňovej bunky (HKB) (abnormálna expanzia HKB) alebo znovu navodením týchto vlastností v determinovaných progenitoroch. Zároveň má MLL-ENL schopnosť zablokovať diferenciáciu krvotvorných buniek. Kombinácia týchto dvoch aspektov je potrebná k vytvoreniu preleukemického štádia, v ktorom sú bunky prístupné akumulácii ďalších mutácií, čo vedie k úplnej leukemickej transformácii a vzniku AL (27, 28). Obrázok 4 znázorňuje hierarchiu onkogénnych zásahov potrebných pre vývin AL.
Bunkové modely s indukovateľným onkogénom MLL-ENL ukázali, že leukemická transformácia indukovaná aktívnym MLL-ENL je reverzibilná. Na udržanie imortalizácie vyžadujú primárne krvotvorné bunky kontinuálnu aktivitu MLL-ENL. Po „vypnutí“ onkogénu strácajú myeloblasty proliferačný potenciál a začnú terminálne diferencovať do neutrofilov a makrofágov (29, 30). Myeloidné bunky imortalizované onkogénom MLL-ENL vykazujú závislosť na rastových faktoroch a zároveň citlivosť na apoptózu. Pôsobením G-CSF došlo k zvratu imortalizácie a indukcii terminálnej diferenciácie myeloidných buniek. To znamená, že MLL-ENL transformuje krvotvorné progenitory zvýšením alebo navodením sebaobnovovania a reverzibilného diferenciačného bloku. Na vytvorenie ireverzibilného diferenciačného bloku vyžaduje MLL-ENL kooperáciu c-myc proto-onkogénu (31).
Transformácia aktívnym MLL-ENL onkoproteínom koreluje so zvýšením expresie Hox génov, ktoré sú pod kontrolou transkripčného faktoru MLL. Po deaktivácii MLL-ENL dochádza k poklesu ich expresie, čo naznačuje, že MLL-ENL priamo udržuje expresiu týchto génov (30). Tieto pozorovania boli ďalej potvrdené „microarray“ analýzou, ktorá odhalila zvýšenú expresiu génov Hoxa9, Hoxa7 a génov Meis-1, Pbx3 (ich produkty podporujú transaktivačnú funkciu Hox proteínov), ktorá korelovala so zastavením diferenciácie vplyvom aktívneho onkoproteínu MLL-ENL. Ďalej sa ukázalo, že Hoxa9 v kooperácii s Meis-1 majú schopnosť nahradiť transformačnú aktivitu MLL-ENL onkogénu, čo poskytuje priamy dôkaz, že koexpresia týchto dvoch molekúl je kľúčovým molekulárnym mechanizmom MLL-ENL leukemogenézy (29).
Abnormálna elongácia ako kľúčový mechanizmus leukémie
MLL je počas krvotvorby exprimovaný na konštantnej úrovni, expresia Hox génov sa mení: na vysokej hladine sú exprimované v skorých štádiách krvotvorby, t.j. v HKB a multipotentných progenitoroch, a ich expresia klesá počas diferenciácie na zrelé krvné bunky (obr. 4).
Obr. 4. Akútna leukémia vzniká v priebehu mnohokrokového evolučného procesu postupnou akumuláciou genetických a epigenetických zmien v genóme. A. Normálna krvotvorba. HKB je jedinou bunkou, ktorá je schopná sebaobnovovania a zároveň diferenciácie do všetkých bunkových typov krve. B. MLL-ENL je prvou mutáciou, ktorá môže zasiahnuť buď HKB a zosilniť jej potenciál sebaobnovovania alebo determinované progenitory, v ktorých aktivuje tento program. Zároveň vedie k zablokovaniu bunkovej diferenciácie v preleukemickom štádiu, a získavaním ďalších mutácií dochádza k úplnej leukemickej transformácii a vzniku AL (modifikované podľa 27). 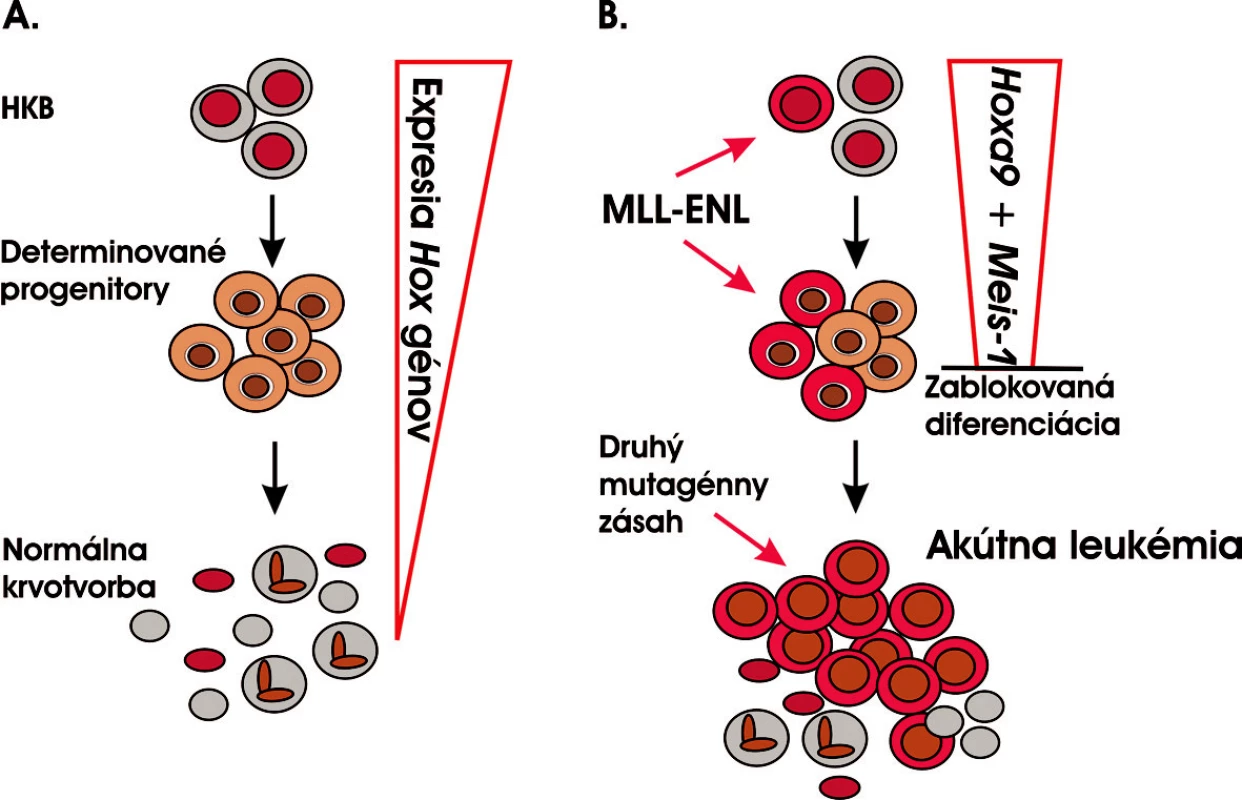
Ako MLL udržuje expresiu Hox génov v krvotvorných bunkách? MLL z funkčného hľadiska je histón-metyltransferáza, ktorá sa podieľa na „zapisovaní“ histónového kódu na sekvenciách Hox génov špecifickou metyláciou aminokyseliny lyzín v pozícii štyri na molekule histónu H3 (H3K4) (34, 35). MLL ako transkripčný faktor má schopnosť naviazať sa na DNA v preaktivovaných promótorových oblastiach (regulačné sekvencie) Hox génov a posúvaním sa po celom génovom lokuse vkladá metylačný marker na histón H3 (36–38). V dôsledku označenia chromatínu markerom H3K4 dochádza k odpojeniu DNA molekuly od histónových proteínov, a tým sa DNA stáva prístupnou pre väzbu bazálneho transkripčného aparátu, ktorý je fyzicky asociovaný s MLL proteínom. MLL udržuje chromatín v aktívnom stave, a tým umožňuje elongáciu transkripcie (kontinuálnu expresiu) Hox génov počas vývinu krvotvorných buniek aj po niekoľkých bunkových deleniach, kým nedôjde k odpojeniu MLL zo sekvencií Hox génov (obr. 5) (37–39). Potlačením ich expresie krvotvorné progenitory začnú diferencovať na zrelé krvné bunky.
Obr. 5. Súčasný model úlohy MLL v transkripčnej regulácii. MLL proteín sa viaže na promótory Hox génov a pomocou C-koncovej domény metyluje histón H3 na lyzíne štyri. Otvorená chromatínová štruktúra sa propaguje v smere transkripcie génu posúvaním MLL spolu s elongačným komplexom po génovom lokusu. 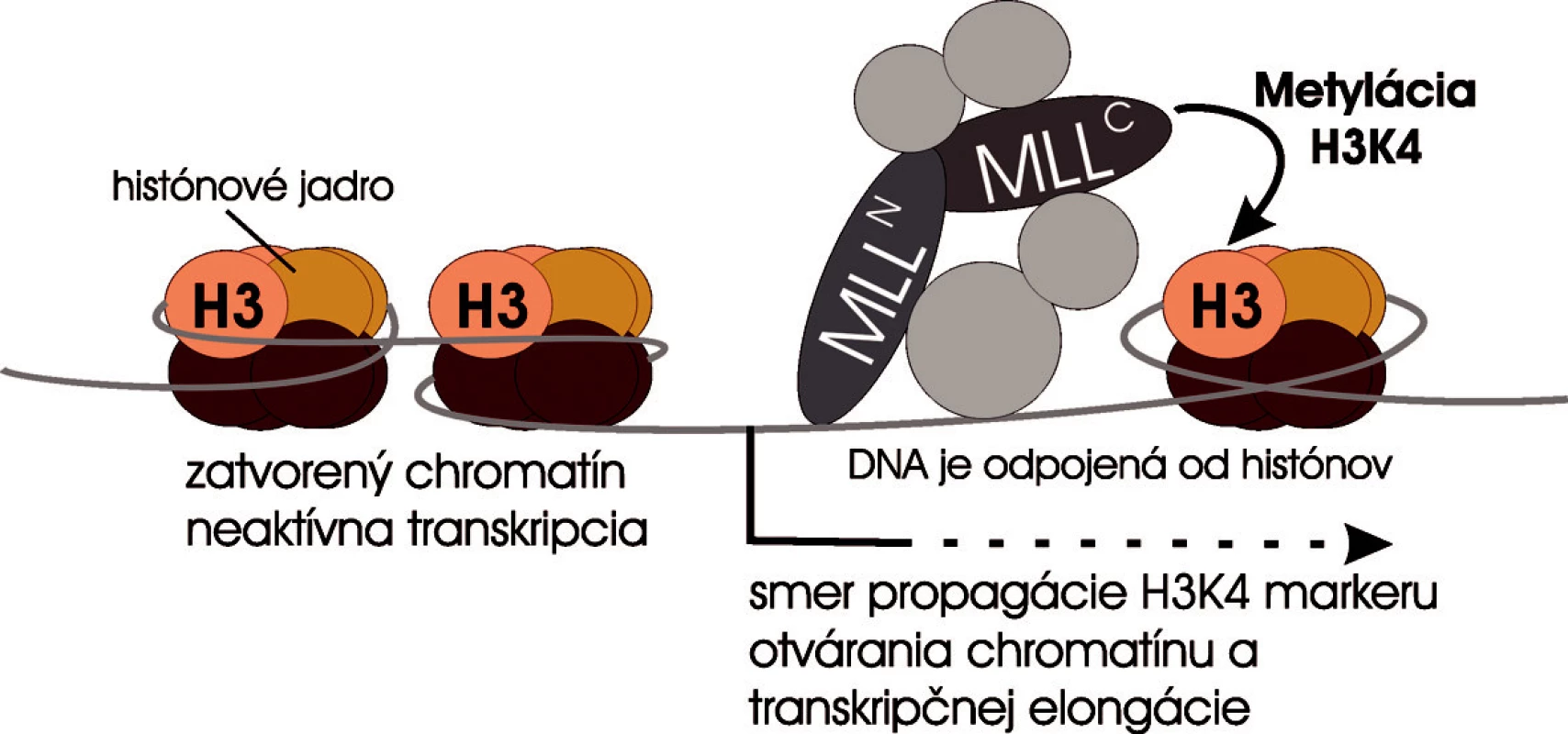
V prípade MLL-ENL onkoproteínu sa ukázalo, že sa viaže na promótory Hox génov v komplexe s normálnym MLL proteínom. V prítomnosti aktívneho MLL-ENL onkoproteínu sa zvyšujú aktivačné markery na chromatíne Hox génov, ktoré spôsobujú abnormálne zmeny v histónovom kóde. Podľa súčasného modelu krvotvorné progenitory konštitutívne udržujú aktívny stav chromatínu na sekvenciách Hox génov v dôsledku chybného čítania histónového kódu a spúšťajú abnormálny transkripčný program – konštitutívnu elongáciu Hox génov (40). Následná nadprodukcia kľúčových molekúl Hoxa9, Meis-1 dáva signál k zablokovaniu terminálnej diferenciácie krvotvorných progenitorov, ktorá sa stáva kritickým krokom v akútnej leukemogenéze (obr. 4).
Reverzibilita leukémie – bunkové a myšie modely budúcej generácie
Na základe súčasného pohľadu, onkogénny transkripčný faktor MLL-ENL konvertuje prechodne aktivované promótory kľúčových Hox génov na konštitutívne aktivované pomocou abnormálnych zmien v epigenetickom kóde, pôvodne vytvorenom normálnym MLL proteínom. To je prvou onkogénnou udalosťou, ktorá sa v bunke odohráva, a spôsobuje zastavenie diferenciácie. Rýchlo proliferujúce preleukemické bunky s vysokou pravdepodobnosťou akumulujú ďalšie genetické a epigenetické zmeny, ktoré vo funkčnej kooperácii vedú k vývinu AL. Avšak molekulárna podstata MLL-ENL leukemogenézy zostáva naďalej v mnohých aspektoch nejasná. Zdá sa, že MLL-ENL nemá schopnosť riadiť a udržiavať všetky aspekty leukemickej transformácie. Doteraz nie je známe, koľko ďalších, po sebe nasledujúcich zásahov je potrebných pre úplnu leukemickú transformáciu a aký je ich biologický vzťah k iniciačnej mutácii MLL-ENL.
Zaujímavou otázkou je, či dochádza k aktivácii obranných bunkových mechanizmov po stimulácii onkogénom MLL-ENL. Táto myšlienka sama o sebe nie je nová. Dávno je známe, že bunka spúšťa dráhy vedúce k zastaveniu bunkového cyklu alebo apoptóze ako odpoveď na onkogénny stres. Avšak v súčasných štúdiách sa ukázalo, že tieto dva základné tumor-supresorové mechanizmy sú aktivované v skorých pre-neoplastických štádiách rakoviny ako tzv. „bariéra“ proti malígnej konverzii (41). Kľúčovým regulátorom týchto mechanizmov je tumor-supresorový proteín p53, ktorý má za úlohu zabrániť genetickej instabilite. Zatiaľ nie je známe, či dochádza k aktivácii rovnakých mechanizmov aj v preleukemických bunkách. Súčasné štúdie odhalili ďalšiu funkciu MLL fúznych proteínov, okrem iných aj MLL-ENL. Tieto onkogény inhibujú transkripčnú aktivitu p53, a tým potláčajú ochrannú odpoveď bunky na poškodenie DNA indukované ionizujúcim žiarením (42). Na modele EK buniek, ktoré sú prirodzene imortalizovanými bunkami s rýchlou proliferačnou aktivitou sa ukázalo, že aktívny onkogén MLL-ENL zvyšuje prežitie buniek po ionizujúcim žiarení (vlastné predbežné výsledky). Na základe týchto faktov je možné sa domnievať, že MLL-ENL môže mať antiapoptický účinok, ktorý spočíva v inhibícii p53, alebo potláčaním bariérových mechanizmov v preleukemickom štádiu urýchľuje progresiu leukemickej transformácie bunky. Myší model s indukovateľným onkogénom MLL-ENL (nepublikovaný vlastný experiment) umožňuje v budúcnosti študovať túto hypotézu in vivo a objasniť dôležité otázky MLL-ENL leukemogenézy. Využitie tohto modelu spočíva hlavne v štúdiu molekulárneho mechanizmu potenciálnej reverzibility leukemickej transformácie in vivo a objasnení kľúčovej otázky, či inaktivácia jedinej (iniciačnej) mutácie je dostačujúca k návratu evolúcie leukémie aj v neskorých štádiách ochorenia, v ktorých dochádza ku kooperácii viac mutácií.
Veľkou výzvou do budúcnosti je odhalenie a pochopenie podrobného mechanizmu transkripčnej deregulácie nielen s onkogénom MLL-ENL, ale aj s ďalšími onkogénnymi variantami MLL, čo je predpokladom potencionálneho vývinu špecifických inhibítorov na cieľenú terapiu MLL leukémií. Štúdium úlohy a funkcie génu MLL v normálnej aj malígnej hematopoéze prispieva k objasneniu základných biologických mechanizmov bunky: regulácie transkripcie, diferenciácie a bunkového rastu.
Zoznam použitých skratiek
ABL = Akútna bifenotypická leukémia
AF4 = Associated factor 4
AF5q31 = Associated factor 5
AF6 = Associated factor 6
AF9 = Associated factor 9
AML = Akútna myeloidná leukémia
AL = Akútna leukémia
ALL = Akútna lymfoblastická leukémia
BCR = Breakpoint cluster region
c-myc = Myelocytomatosis oncogene
C-terminus = Karboxyterminálny koniec proteínu
DNA = Deoxyribonucleic acid
dsDNA = dvojvláknová (double strand) DNA
EK bunky = Embryonálne kmeňové bunky
ENL = Eleven-nineteen leukemia
FISH = Fluorescent in situ hybridization
G-CSF = Granulocytic colony stimulating factor
HKB = Hematopoetická kmeňová bunka
HOK = Hemato-onkologická klinika
Hox = Homeobox
H3K4 = Histón H3 metylovaný na lyzíne 4
LF UP = Lekárska fakulta Univerzity Palackého
Meis-1 = Mouse ecotropic integration site 1
MLL = Mixed lineage leukemia
N-terminus = Aminoterminálny koniec proteínu
Pbx3 = Pre-B-cell leukemia transcription factor 3
Vysvetlivky vybraných termínov
Chromatín – stavebná hmota chromozómov v jadre eukaryotickej bunky a skladá sa z dsDNA a proteínov. Proteíny chromatínu sa delia na históny a proteíny nehistónovej povahy. dsDNA sa otáča okolo histónového jadra a špiralizáciou sa vbalí do vyšších organizačných štruktúr chromatínu. Bunka dokáže regulovať expresiu génov rozbalením a opätovným vbalením príslušného úseku DNA do chromatínu.
Chromatínový marker – znak v podobe chemickej skupiny (napr. metylová), ktorá sa pripája na molekuly histónov kovalentnou chemickou väzbou a spôsobuje zmenu stavu a funkcie chromatínu.
Epigenetika (epigenetická dedičnosť) – prenos znakov a zmien, ktoré ovplyvňujú expresiu a funkciu génov do ďalšej generácie (buniek, organizmu) cez bunkový cyklus mimo genetickej informácie zakódovanej v podobe sekvencie DNA.
Transkripcia – začiatočný proces vyjadrenia genetického kódu, počas ktorého sa genetická informácia prepíše z DNA do RNA a vedie k jej prekladu do funkčných proteínových molekúl.
Elongácia – postupné predĺžovanie RNA reťazca počas transkripcie.
Ďakujeme Mgr. Zuzane Koledovej (Ústav biologie LF UP Olomouc) za asistenciu pri konečnej úpravy rukopisu. Grantová podpora: IGA NR7849; MSM 6198959205 a MSM 6198959216.
Mgr. Sylvia Takáčová
Ústav biologie LF UP
Hněvotínská 3
775 15 Olomouc
Došlo do redakce: 23. 6. 2006
Přijato: 3. 11. 2006
Zdroje
1. Gu Y, Nakamura T, Alder H, et al. The t(4;11) chromosome translocation of human acute leukemias fuses the ALL-1 gene, related to Drosophila trithorax to the AF-4 gene. Cell 1992; 71 : 701-708.
2. Djabali M, Selleri L, Parry P, Bower M, Young BD, Evans GA. A trithorax-like gene is interrupted by chromosome 11q23 translocations in acute leukemias. Nat Genet 1992; 2 : 113–118.
3. Tkachuk DC, Kohler S, Cleary M. Involvement of a homolog of Drosophila trithorax by 11q23 chromosomal translocations in acute leukemias. Cell 1992; 71 : 691–700.
4. Gu Y, Alder H, Nakamura T, Schichman SA, Prasad R, Canaani O, Saito H, Croce CM, Canaani E. Sequence analysis of the breakpoint cluster region in the ALL-1 gene involved in acute leukemia. Cancer Res 1994; 54 : 2326–2330.
5. Strout M, Marcucci G, Bloomfield CD., Caligiuri MA. The partial tandem duplication of ALL-1 (MLL) is consistently generated by Alu-mediated homologous recombination in acute myeloid leukemia. Proc Natl Acad Sci USA 95, 2390–2395 (1998).
6. Strissel P, Strick R, Rowley JD, Zeleznik-Le NJ. An in vivo topoisomerase II cleavage site and a DNase I hypersensitive site colocalize near exon 9 in the MLL breakpoint cluster region. Blood 1998; 92 : 3793–3803.
7. Ayton PM, Cleary ML. Molecular mechanisms of leukemogenesis mediated by MLL fusion proteins. Oncogene 2001; 20 : 5695–5707.
8. Gilliland DG, Jordan CT, Felix CA. The molecular basis of leukemia. Hematology (Am Soc Hematom Educ Program) 2004; 80–97.
9. Ferrando AA, Armstrong SA, Neuberg DS, Sallan SE, Silverman LB, Korsmeyer SJ, Look AT. Gene expression signatures in MLL-rearranged T-lineage and B-precursor acute leukemias: dominance of HOX dysregulation. Blood 2003; 102 : 262–268.
10. Hess J. MLL: a histon methyltransferase disrupted in leukemia. Trends in Mol Med 2004; 10 : 500–507.
11. Lavau C, Szilvassy SJ, Slany R, Cleary ML. Immortalization and leukemic transformation of a myelomonocytic precursor by retrovirally transduced HRX-ENL. EMBO J 1997; 16 : 4226–4237.
12. Slany RK, Lavau C, Cleary ML. The oncogenic capacity of HRX-ENL requires the transcriptional transactivation activity of ENL and the DNA binding motifs of HRX. Mol Cell Biol 1998; 18 : 122–129.
13. So CW, Cleary ML. MLL-AFX requires the transcriptional effector domains of AFX to transform myeloid progenitors and transdominantly interfere with forkhead protein function. Mol Cell Biol 2002; 22 : 6542–6552.
14. Lavau C, Luo RT, Du C, Thirman MJ. Retrovirus-mediated gene transfer of MLL-ELL transforms primary myeloid progenitors and causes acute myeloid leukemias in mice. Proc Natl Acad Sci USA 2000; 97 : 10984–10989.
15. Lavau C, Du C, Thirman M, Zeleznik-Le N. Chromatin-related properties of CBP fused to MLL generate a myelodysplastic-like syndrome that evolves into myeloid leukemia. EMBO J 2000; 19 : 4655–4664.
16. DiMartino JF, Ayton PM, Chen EH, Naftzger CC, Young BD, Cleary ML. The AF10 leucine zipper is required for leukemic transformation of myeloid progenitors by MLL-AF10. Blood 2002; 99 : 3780–3785.
17. Corral J, Lavenir I, Impey H, Warren AJ, et al. An MLL-AF9 fusion gene made by homologous recombination causes acute leukemia in chimeric mice: A method to create fusion oncogenes. Cell 1996; 85 : 853–861.
18. Dobson CL, Warren AJ, Pannell R, Forster A, et al. The MLL-AF9 gene fusion in mice controls myeloproliferation and specifies acute myeloid leukemogenesis. EMBO J 1999; 18 : 3564–3574.
19. Forster A, Pannell R, Drynan LF, et al. Engineering de novo reciprocal chromosomal translocations associated with Mll to replicate primary events of human cancer. Cancer Cell 2003; 3 : 449–458.
20. Yu BD, Hess JL, Horning SE, Brown GA, Korsmeyer SJ. Altered Hox expression and segmental identity in Mll-mutant mice. Nature 1995; 378 : 505–508.
21. Jarosova M, Takacova S, Holzerova M, et al. Cryptic MLL-AF10 fusion caused by insertion of duplicated 5’ part of MLL into 10p12 in acute leukemia: a case report. Cancer Genet Cytogenet 2005; 162 : 179–182.
22. Kohlmann A, Schoch C, Dugas M, Schnittger S, Hiddemann W, Kern W, Haferlach T. New insights into MLL gene rearranged acute leukemias using gene expression profiling: shared pathways, lineage commitment, and partner genes. Leukemia 2005; 19 : 953–964.
23. Ferrando AA, Armstrong SA, Neuberg DS, Sallan SE, Silverman LB, Korsmeyer SJ, Look AT. Gene expression signatures in MLL-rearranged T-lineage and B-precursor acute leukemias: dominance of HOX dysregulation. Blood 2003; 102 : 262-268.
24. Erfurth F, Hemenway CS, de Erkenez AC, Domer PH. MLL fusion partners AF4 and AF9 interact at subnuclear foci. Leukemia 2004; 18 : 92–102.
25. Zeisig DT, Bittner CB, Zeisig BB, Garcia-Cuellar MP, Hess JL, Slany RK. The eleven-nineteen-leukemia protein ENL connects nuclear MLL fusion partners with chromatin. Oncogene 2005; 24 : 5525–5532.
26. Slany RK. When epigenetics kills: MLL fusion proteins in leukemia. Hematol Oncol 2005; 23 : 1–9.
27. Jamieson CH, Weissman IL and Passeque E. Chronic versus acute myelogenous leukemia: A question of self-renewal. Cancer Cell 2004; 6 : 531–533.
28. Cozzio A, Passegue E, Anton PM, Karsunky H, Cleary ML, Weissman IL. Similar MLL-associated leukemias arising from self-renewing stem cells and short-lived myeloid progenitors. Genes Dev 2003; 17 : 3029–3035.
29. Zeisig BB, Milne TA, Garcia-Cuellar MP, et al. Hoxa9 and Meis1 are key targets for MLL-ENL-mediated cellular immortalization. Mol Cell Biol 2004; 24 : 617–628.
30. Horton SJ, Grier DG, McGonigle GJ, Thompson A, Morrow M, De Silva I, Moulding DA, Kioussis D, Lappin TRJ, Brady HJM, Williams O. Continuous MLL-ENL expression is necessary to establish a “Hox code” and maintain immortalization of hematopoietic progenitor cells. Cancer Res 2005; 65 : 9245–9252.
31. Schreiner S, Birke M, Garcia-Cuellar MP, Zilles O, Greil J, Slany RK. MLL-ENL Causes a Reversible and myc-dependent Block of Myelomonocytic Cell Differentiation. Cancer Res 2001; 61 : 6480–6486.
32. Hanson RD, Hess JL, Yu BD, Ernst P, van Lohuizen M, Berns A, van der Lugt NMT, Shashikant CS, Ruddle FH, Seto M, Korsmeyer SJ. Mammalian Trithorax and Polycomb-group homologues are antagonistic regulators of homeotic development. Proc Natl Acad Sci USA 1999; 96 : 14372–14377.
33. Yu BD, Hanson RD, Hess JL, Horning SE, Korsmeyer SJ. MLL, a mammalian trithorax-group gene, functions as a transcriptional maintenance factor in morphogenesis. Proc Natl Acad Sci USA 1998; 95 : 10632–10636.
34. Milne TA, Briggs SD, Brock HW, et al. MLL targets SET domain methyltransferase activity to Hox gene promoters. Mol Cell 2002; 10 : 1107–1117.
35. Nakamura T, Mori T, Tada S, et al. ALL-1 is a histone methyltransferase that assembles a supercomplex of proteins involved in transcriptional regulation. Mol Cell 2002; 10 : 1119–1128.
36. Dou Y, Milne AT, Tackett AJ, et al. Physical Association and Coordinate Function of the H3 K4 Methyltransferase MLL1 and the H4 K16 Acetyltransferase MOF. Cell 2005; 121 : 873–885.
37. Milne TA, Dou Y, Martin ME, Brock HW, Roeder RG, Hess JL. MLL associates specifically with a subset of transcriptionally active target genes. Proc Natl Acad Sci USA 2005; 102 : 14765–14770.
38. Guenther MG, Jenner RG, Chevalier B, et al. Global and Hox-specific roles for the MLL1 methyltransferase. Proc Natl Acad Sci USA 2005; 102 : 8603–8608.
39. Slany RK. Chromatin control of gene expression: Mixed-lineage leukemia methyltransferase SETs the stage for transcription. Proc Natl Acad Sci USA 2005; 102 : 14481–14482.
40. Milne TA, Martin ME, Brock HW, Slany RK, Hess JL. Leukemogenic MLL fusion proteins bind across a broad region of the Hoxa9 locus, promoting transcription and multiple histone modifications. Cancer Res 2005; 65 : 11367–11374.
41. Bartkova J, Horejsi Z, Koed K, et al. DNA damage response as a candidate anti-cancer barrier in early human tumorigenesis. Nature 2005; 434 : 864–870.
42. Wiederschain D, Kawai H, Shilatifard A, Yuan ZM. Multiple mixed lineage leukemia (MLL) fusion proteins suppress p53-mediated response to DNA damage. J Biol Chem 2005; 26 : 24315–24321.
43. Pui Ch, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med 2004; 15 : 1535–1548.
44. Hsieh JJ, Cheng EH, Korsmeyer SJ. Taspase1: a threonine aspartase required for cleavage of MLL and proper HOX gene expression. Cell 2003; 115 : 293–303.
45. Yokohama A, Kitabayashi I, Ayton PM, Cleary ML, Ohki M. Leukemia proto-oncoprotein MLL is proteolytically processed into 2 fragments with opposite transcriptional properties. Blood 2002; 100 : 3710–3718.
46. Hsieh JJ, Ernst P, Erdjument-Bromage H, Tempst P, Korsmeyer SJ. Proteolytic cleavage of MLL generates a complex of N - and C-terminal fragments that confers protein stability and subnuclear localization. Mol Cell Biol 2003; 23 : 186–194.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2007 Číslo 1- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Vztah sérových hladin volných lehkých řetězců imunoglobulinu ke stupni pokročilosti mnohočetného myelomu
- Zprávy o knihách
- Porucha v regulácii chromatínu ako molekulárny mechanizmus MLL-ENL leukemogenézy
- Výsledky a komplikace splenektomie u pacientů s těžkou trombocytopenií při ITP rezistentní na úvodní konzervativní léčbu – zkušenosti centra
- Zprávy o knihách
- Od monitorovania hladiny fúzneho génu Bcr/Abl u pacienta s chronickou myeloidnou leukémiou k odhaľovaniu rezistencie k imatinibu – kazuistika
- ÚVODNÍK
- Kaposiho sarkom po alogenní transplantaci periferních krvetvorných buněk s nemyeloablativní přípravou – kazuistika
- 4. ČESKO – SLOVENSKÁ MEZIOBOROVÁ KONFERENCE LÉKAŘSKÉ MYKOLOGIE
- Doporučení Sesterské sekce České Hematologické Společnosti ČSL JEP na obsazení hematologických jednotek intenzivní péče, respektive center pro transplantace krvetvorných buněk, nelékařským personálem.
- Zprávy o knihách
- K osmdesátinám prof. MUDr. Ladislava Chrobáka, CSc.
- Novinky v terapii folikulárního lymfomu
- Dr. Adolf Georg Gadhof, Frankfurt am Main
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Výsledky a komplikace splenektomie u pacientů s těžkou trombocytopenií při ITP rezistentní na úvodní konzervativní léčbu – zkušenosti centra
- Vztah sérových hladin volných lehkých řetězců imunoglobulinu ke stupni pokročilosti mnohočetného myelomu
- Od monitorovania hladiny fúzneho génu Bcr/Abl u pacienta s chronickou myeloidnou leukémiou k odhaľovaniu rezistencie k imatinibu – kazuistika
- Novinky v terapii folikulárního lymfomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



