Alogenní transplantace krvetvorných buněk po přípravném režimu redukované intenzity v léčbě lymfoproliferací (výsledky ÚHKT 1999–2005)
Allogeneic Stem Cell Transplantation after Reduced-Intensity Conditioning for Lymphoproliferative Disease (UHKT 1999–2005)
Many patients (pts) with lymphoid malignancies can be cured by (immuno)-chemotherapy including high dose therapy with autologous stem cell transplantation (ASCT). If these approaches are failing and the patients are eligible, the allogeneic stem cell transplantation (alloSCT) with graft versus leukemia/lymphoma (GVL) effect can be considered as the next step. Reduction of toxicity associated with the procedure can be achieved by reduced intensity conditioning (RIC). Here we report our experience with this approach.
Patients and Methods:
Twenty pts with median age 52 years and diagnosis of lymphoma (FCL n = 3; MCL n = 1, ALCL n = 1, HL n = 4, CLL/SLL n = 11) were transplanted between June 1999 and May 2005. Median of previous chemotherapy lines was 3 (range, 1–6) and 6 pts had previously received ASCT. Eight pts were in remission (CR or PR) and ten had resistant or progressive disease at transplantation. RIC regimens were based on fludarabine in 18 cases (14x Flu/Bu/ATG, 4x Flu-Mel, 1x FLU/CFA, 1x Flu/TBI). Nine patients were transplanted from HLA identical sibling, 3 patients from MUD and 8 were transplanted from unrelated donor with 1–2 alelic mismatches. Results: With a median follow-up of 29 months (range, 4–55 months) of living patients, the actuarial overall survival (OS) rates at 3 years were 60 %. Seven patients developed acute GVHD grade 1–2, one patient developed chronic GVHD after donor lymphocyte infusion (DLI) used for treatment of relapse, no aGVHD gr 3–4 was observed. The 100-day and 1-year transplant-related mortality (TRM) rates were 25 % and 30 %. The major cause of death was infection during neutropenia (5 out of 7 deaths). DLI was used in one patient for relapse and CR was achieved. Four out of ten patients transplanted in resistant or progressive disease achieved remission (CR or uCR) and are still alive.
Conclusion:
RIC alloSCT is a feasible approach for the treatment of patients with lymphoproliferative disease with GVL effect demonstrated in chemo-resistant subgroup of pts. The TRM in this heterogenic group was however higher than expected, but it was not linked directly to GVHD and was associated with chemo-resistant disease and previous ASCT. The proper patients selection, the early identification of those who are unlikely to profit from immuno-chemotherapy only and earlier use of alloSCT with GVL effect needs to be explored.
Key words:
non-Hodgkin’s lymphoma, allogeneic, hematopoietic stem cell transplantation, GVHD
Autoři:
V. Válková; K. Benešová; A. Vítek; J. Schwarz; M. Marková; D. Pohlreich; Z. Siegelová; P. Cetkovský
Působiště autorů:
Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise:
Transfuze Hematol. dnes,13, 2007, No. 2, p. 67-72.
Kategorie:
Souhrnné práce, původní práce, kazuistiky
Souhrn
Východiska:
Řada nemocných s maligním lymfoproliferativním onemocněním může být vyléčena kombinací (imuno)chemoterapie eventuálně s následnou autologní transplantací krvetvorných buněk (ASCT). Pacienty, u kterých selže standardní terapie, je možné indikovat k alogenní transplantaci krvetvorných buněk (alloSCT), kde předpokládáme především uplatnění imunologického efektu reakce štěpu proti leukemii/lymfomu (GVL efekt). Snížení toxicity alogenních transplantací můžeme dosáhnout podáním režimů redukované intenzity (RIC alloSCT). Podáváme přehled našich zkušeností s touto terapií.
Pacienti a metodika:
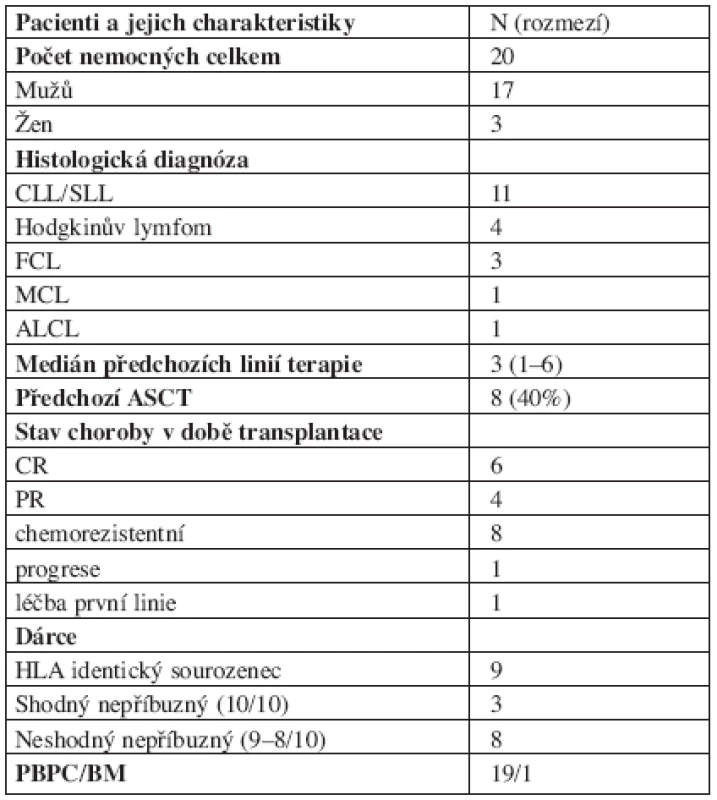
Od června 1999 do května 2005 bylo transplantováno 20 pacientů s mediánem věku 52 let a diagnózou lymfomu (folikulární lymfom, FCL, n = 3; anaplastický velkobuněčný lymfom, ALCL, n = 1; lymfom z plášťových buněk MCL, n = 1; Hodgkinův lymfom, HL, n = 4; chronická lymfatická leukemie/malobuněčný lymfom, CLL/SLL, n = 11). Medián linií terapie před alloSCT byl 3 (1–6). U 8 pacientů se jednalo o relaps po autologní transplantaci (ASCT). 11 pacientů bylo transplantováno v remisi (kompletní-CR/nebo parciální-PR) a u 9 pacientů se jednalo o rezistentní nebo progredující chorobu. Základem všech přípravných režimů byl fludarabin (14 x FLU/BU/ATG (Fludarabin/Busulfan/antithymocytární globulin), 4x FLU/Mel (Melfalan), 1x FLU/2GyTBI a 1x FLU/CFA Cyklofosfamid). 9 pacientů bylo transplantováno od HLA identického sourozence, 3 nemocní od shodného nepříbuzného dárce a 8 nemocných bylo transplantováno od nepříbuzného dárce s 1–2 alelickými neshodami.
Výsledky:
V mediánu sledování 32 měsíců (1–57) byla pravděpodobnost přežití (OS) ve 3 letech 60 %. Akutní reakce štěpu proti hostiteli (aGVHD) grade 1–2 se vyskytla u 7 pacientů, pouze u 1 nemocného se rozvinula chronická GVHD. U žádného z nemocných nebyla zaznamenána aGVHD gr. 3–4. Peritransplantační mortalita do 100 dní resp. do 1 roku byla 25 % resp. 30 %. Nejčastější příčinou úmrtí byly infekční komplikace (5 ze 7 úmrtí). Dárcovské lymfocyty byly z důvodu relapsu použity u 1 nemocného a bylo dosaženo CR. Z celkem 9 pacientů transplantovaných ve fázi progresivní či rezistentní choroby bylo u 4 dosaženo CRu/CR, která trvá (CRu nepotvrzená kompletní remise).
Závěry:
Na základě našich zkušeností lze uzavřít, že RIC alloSCT je možné použít k léčbě lymfoproliferativních malignit. Dosažené CR u nemocných se chemorezistentním onemocněním svědčí pro GVL efekt. Bude nutné vytypovat skupiny pacientů, u kterých je přínosné časné provedení RIC allo-SCT.
Klíčová slova:
Non-Hodgkinský lymfom, alogenní, transplantace krvetvorných buněk, GVHD
Úvod
Nové terapeutické přístupy (včetně vysokodávkované chemoterapie a terapie monoklonálními protilátkami) představují v současné době kurativní přístup u řady nemocných s maligním lymfoproliferativním onemocněním. Nicméně existuje skupina nemocných (ať už ve vysokém riziku daném biologickými faktory onemocnění či nepříznivým vývojem s opakovanými relapsy), u kterých standardní metody léčby včetně autologní transplantace krvetvorných buněk (ASCT) selhávají. Pro tuto skupinu nemocných představuje naději alogenní transplantace krvetvorných buněk (alloSCT), především využitím imunologického efektu reakce štěpu proti leukemii/lymfomu. Standardní allo - SCT je stále zatížena vysokou peritransplantační mortalitou (TRM), dle některých prací až 20–50 % (1–3), proto se v posledních letech dostávají do popředí transplantace tzv. nemyeloablativní (resp. po přípravě režimem redukované intenzity – reduced intensity conditioning (RIC). Důvodem pro hledání těchto méně toxických přístupů je vyšší věk nemocných, často s dalšími chorobami, které představují limitaci pro transplantaci myeloablativní.
Podle recentních prací, zvláště pro skupinu nízkomaligních lymfoproliferací se zdá, že se TRM u RIC alloSCT podařilo významně snížit (7, 16–20). V tomto sdělení předkládáme naše zkušenosti u prvních 20 nemocných s diagnózou lymfoproliferací, léčených RIC alloSCT.
Soubor a použité metodiky
Pacienti
V období od června 1999 do května 2005 bylo na ÚHKT provedeno celkem 20 RIC alloSCT u pacientů s maligním lymfoproliferativním onemocněním. Jednalo se o 17 mužů a 3 ženy. Věkové rozmezí 20–64 let (medián 52 let). Histologické subtypy byly následující: 11x chronická lymfatická leukemie nebo lymfocytární lymfom (CLL/SLL), 3x folikulární lymfom (FCL), 4x Hodgkinův lymfom (HL), 1x anaplastický velkobuněčný lymfom (ALCL) a 1x lymfom z plášťových buněk (MCL). 8 pacientů (40 %) prodělalo ASCT, medián předchozích linií terapie byl 3 (1–6). U 11 nemocných se jednalo o chemosenzitivní onemocnění (CR/PR), 9 pacientů (45 %) bylo transplantováno ve fázi chemorezistentní choroby. 9 pacientů bylo transplantováno od HLA identického sourozence, 3 nemocní od shodného nepříbuzného dárce a 8 nemocných bylo transplantováno od nepříbuzného dárce s 1–2 alelickými neshodami.
Medián počtu převedených CD34+ buněk byl 7,6x106/kg (2,0–16,9). 19 pacientů bylo transplantováno periferními kmenovými buňkami, 1 pacient dostal kostní dřeň.
Použité přípravné režimy

Podpůrná péče a infekční profylaxe
Všichni nemocní dostávali již od začátku „conditioningu“ profylaktické dávky acykloviru, kotrimoxazolu a perorálních (p.o.) azolů (itrakonazol nebo fluconazol) dle protokolu pracoviště. Podobně intravenózní (i.v.) antibiotická profylaxe či léčba febrilní neutropenie byla prováděna u všech nemocných s nástupem neutropenie podle aktuálně platných antibiotických pravidel. Všechny transfuzní přípravky byly podávány ozářené a deleukotizované.
GVHD profylaxe
Všichni pacienti dostávali cyklosporin A(CSA) ode dne -1 v dávce 3 mg/kg v kontinuální i.v. infuzi, s přechodem na p.o. podávání po stabilním přihojení a toleranci p.o. medikace. 12 nemocných po přípravě ATG dostávalo pouze CSA, u 5 nemocných byla použita kombinace CSA + mykofenolát mofetil (MMF) v dávce 15 mg/kg i.v. nebo p.o. (ode dne +1), u 2 pacientů byla použita kombinace CSA + metotrexát (MTX) v dávce 15 mg/m2 D+1, 10 mg/m2 D +3, 6, 11, a u 1 nemocného byla použita kombinace CSA + prednison. Akutní a chronická GVHD byla skórována podle konsenzuálních kritérií (4).
Metodiky
Chimerismus
Vyšetření chimerismu bylo prováděno metodou kvantitativní genotypizace informativních DNA polymorfismů typu VNTR (variable number of tandem repeats) a STR (short tandem repeats) a sex specifických lokusů. Kompletní chimerismus byl definován jako absence detekce předem definovaného příjemcova specifického peaku v STR-PCR, smíšený chimerismus jako současná detekce příjemcova i dárcova specifického peaku.
Definice a statistika
Přežití nemocných (OS) bylo definováno jako interval od transplantace do úmrtí. Období bez známek progrese (PFS) bylo definováno jako interval od transplantace do relapsu či úmrtí. Medián sledování byl stanoven u žijících nemocných.
Přihojení v granulocytární linii bylo definováno jako první den, po němž následovaly nejméně 3 dny, během nichž hodnota granulocytů převyšovala hladinu 0,5x109/l. Přihojení v megakaryocytární linie bylo definováno jako první den, kdy bylo dosaženo hodnoty trombocytů alespoň 20x109/l po týdnu bez nutnosti substituce.
Odpověď na terapii byla u nemocných s lymfomem hodnocena na základě kritérií dle Chesona (6), u nemocných s CLL dle kritérií NCI (21). Křivky analýzy přežití byly zpracovány Kaplan-Meierovou metodou.
Výsledky
Přihojení a peritransplantační toxicita
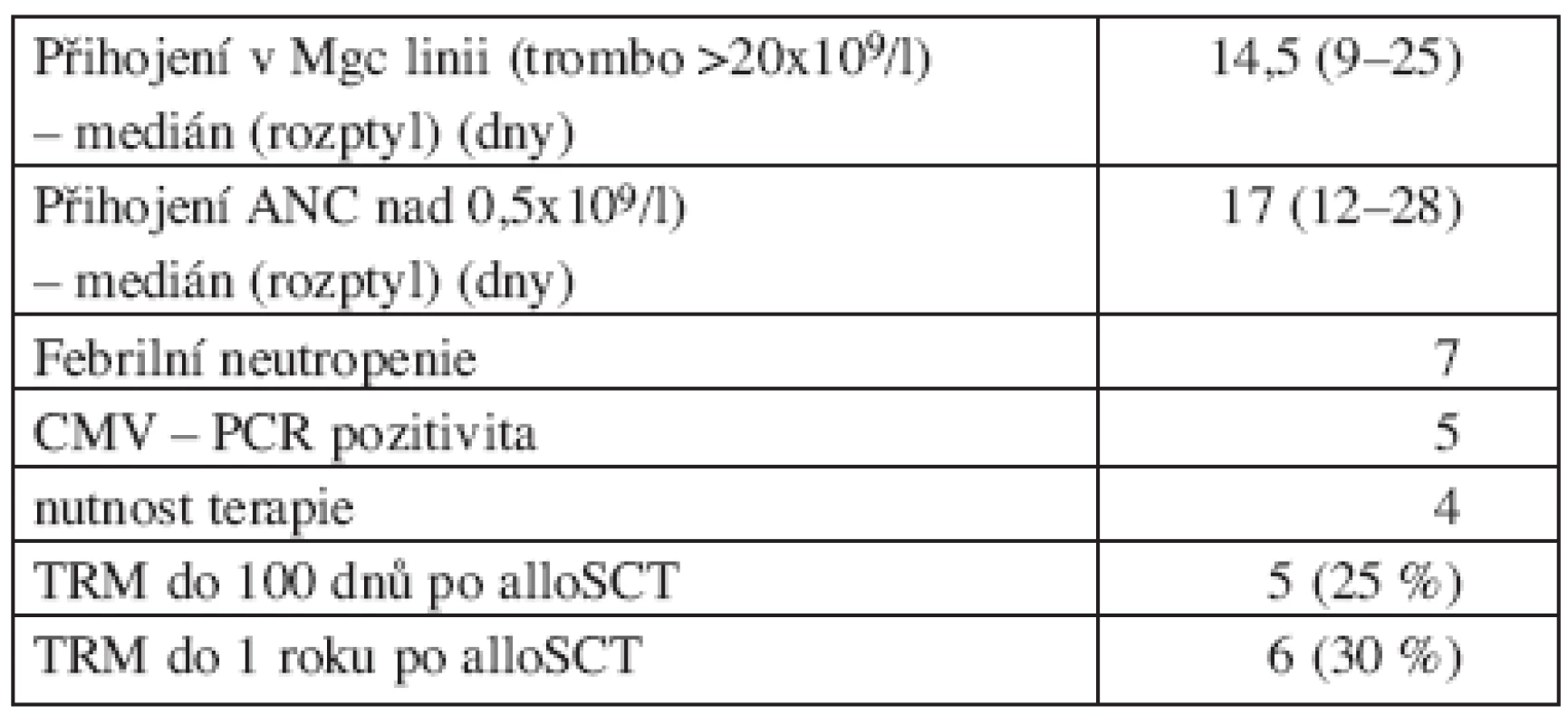
K přihojení v granulocytární linii došlo u všech pacientů, u žádného nebylo zaznamenáno pozdní selhání štěpu. Medián přihojení v granulocytární linii byl 17 dnů (12–28). V megakaryocytární linii došlo k přihojení u 18 pacientů, 2 pacienti zemřeli časně bez známek přihojení. Medián přihojení v megakaryocytární linii byl 14,5 dne (9–25) u 16 hodnotitelných pacientů (u 2 pacientů došlo k přihojení později, během ambulantního sledování).
U 7 pacientů došlo k rozvoji febrilní neutropenie, 5 z nich posléze na bakteriální infekční komplikace zemřelo před dnem 100 po alloSCT. Z celkem 20 nemocných bylo 16 (po zavedení jako rutinní praxe) pravidelně monitorováno na CMV (cytomegalovirus) a EBV (EB virus) infekci pomocí PCR. U 4 nemocných došlo k reaktivaci CMV infekce, která byla přeléčena gancyklovirem. V tomto souboru jsme nezaznamenali žádnou signifikantní PCR pozitivitu EBV infekce.
5 nemocných zemřelo na infekční komplikace před dnem +100, 1 nemocný zemřel na infekci do 1 roku po alloSCT.
GVHD
Incidence a závažnost GVHD byla nízká, pravděpodobně v důsledku provádění in vivo T-deplece pomocí ATG u většiny nemocných, podobně též referováno při použití režimu s Campathem (7–9). Akutní GVHD (pouze grade 1 nebo 2) se rozvinula u 7 (35 %) nemocných. Extenzivní forma chronické GVHD byla zaznamenána pouze u 1 (6,3 %) pacienta po podání DLI pro relaps.
Chimerismus
U všech nemocných byl sledován chimerismus, sledování bylo u všech nemocných prováděno v den +14, 21 a 28 po transplantaci a posléze průběžně při pravidelných kontrolách dle stavu pacientů. U 14 (70 %) nemocných byl detekován kompletní dárcovský chimerismus v mediánu 1,5 měsíce (1–12 měsíců). U 6 nemocných přetrvával smíšený chimerismus (5 z nich časně zemřelo a 1 je v hematologické remisi) (graf 1).

Odpověď na léčbu a sledování
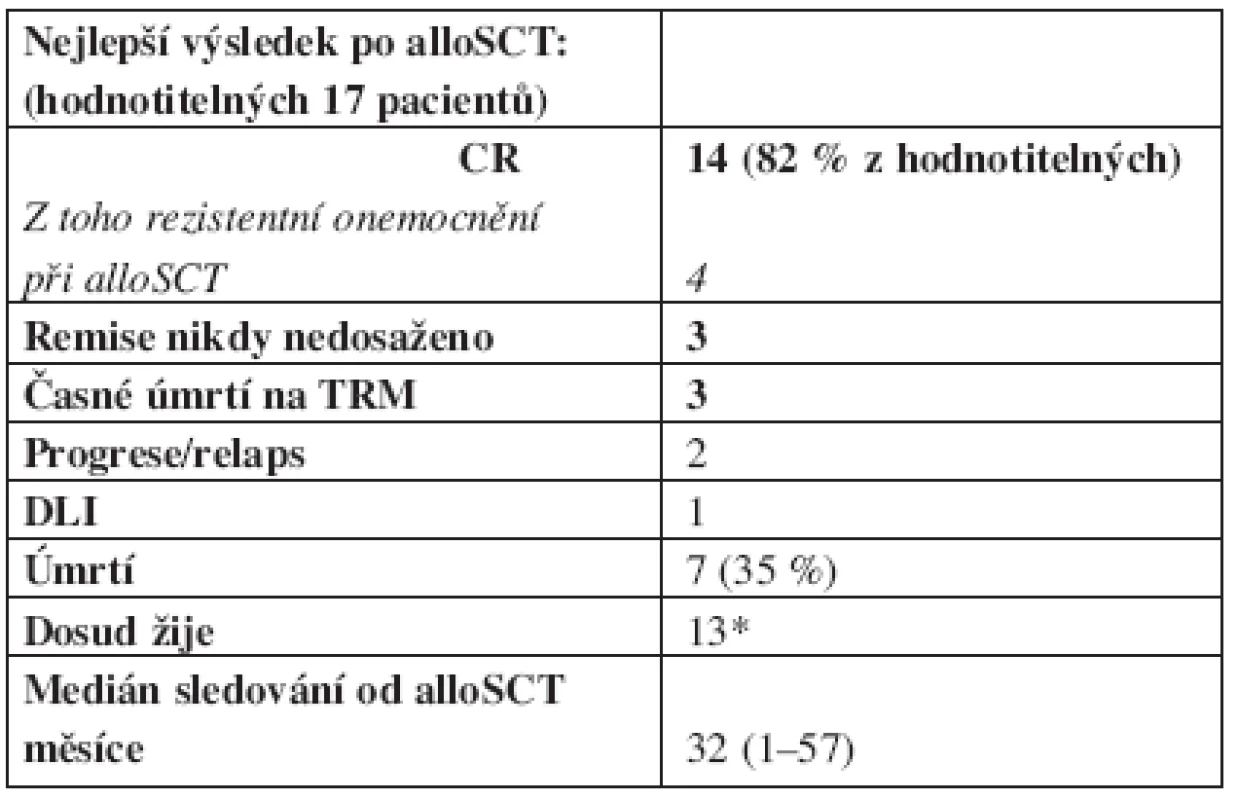
Z hlediska odpovědi na transplantaci bylo hodnotitelných 17 pacientů (85 %). 3 nemocní zemřeli časně po alloSCT a odpověď na terapii nebyla hodnotitelná.
Celkem 14 (82 % z hodnotitelných) nemocných dosáhlo po transplantaci kompletní nebo nepotvrzené kompletní remise (CR/CRu dle Chesona), z nichž u 4 nemocných bylo onemocnění v době transplantace hodnoceno jako chemorezistentní. 3 nemocní remise nedosáhli (2 zemřeli do D+100 a 1 do 1 roku po alloSCT). Zemřelo celkem 7 (35 %) nemocných, 13 pacientů žije a k datu posledního sledování (5/05) byli všichni v remisi.
Analýza úmrtí
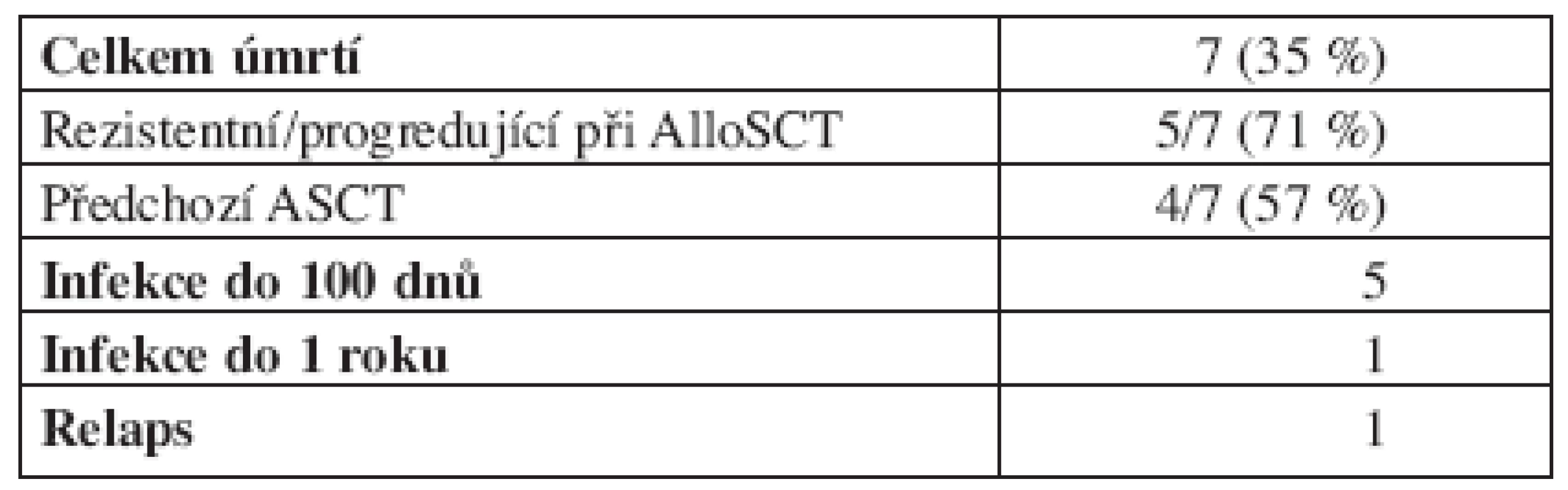
Zemřelo celkem 7 pacientů, 5 (71 %) z nich mělo v době transplantace refrakterní či progredující onemocnění a 4 (57 %) byli po předchozí ASCT.
5 pacientů zemřelo na infekční komplikace do 100 dnů po alloSCT, 1 pacient zemřel na infekční komplikaci v průběhu prvního roku po alloSCT. 1 nemocný zemřel na relaps onemocnění 4 měsíce po transplantaci. Peritransplantační mortalita do 100 dnů byla tedy 25 %, do 1 roku 30 %.
Nebyl zaznamenán rozdíl v TRM u nemocných transplantovaných od sourozence a od nepříbuzného dárce.
Z pohledu faktorů souvisejících s TRM byl pozorován trend k vyššímu počtu úmrtí u nemocných s chemorezistentním onemocnění a u nemocných, kteří absolvovali ASCT (p = 0,07). U nemocných, kteří dosáhli kompletní remise po alloSCT byl pozorován v uvedeném mediánu sledování 32 měsíců pouze 1 relaps, po aplikaci DLI opět dosaženo kompletní remise.
Analýza přežití
Medián sledování žijících nemocných byl 32 měsíců (1–57 měsíců).
U 12 nemocných, kteří dosáhli kompletní remise v době sledování nedošlo k relapsu. Jeden pacient dosáhl kompletní remise, poté pro relaps podáno DLI s dosažením další kompletní remise.
Pravděpodobnost celkového přežití ve 3 letech je 63,1 % s 95% intervalem spolehlivosti (CI95%, 40,6 %–85,6 %). Přežití bez známek progrese ve 3 letech je 57,4 % (CI 95%, 34,9 %–79,9 %).
Diskuse
AlloSCT představují potenciálně kurativní přístup pro rizikové nemocné s lymfomem s prokazatelně nižším procentem relapsů než transplantace autologní (EBMT data 2003, IBMTR/ABMTR 2003) (10, 11), jsou však spojeny s vysokou peritransplantační mortalitou (12–14).
Tento fakt, stejně tak jako vyšší věk nemocných často s dalšími komorbiditami, je důvodem hledání méně toxických přístupů. Tuto možnost nabízejí tzv. transplantace nemyeloablativní resp. po přípravě režimem redukované intenzity, tzv. RIC-alloSCT. Hodnocení výsledků nemyeloablativních transplantací u lymfomů je dosud značně problematické, jelikož existuje jen velmi málo větších souborů, a pokud existují, jedná se o retrospektivní data. Dosud největší publikovaný soubor (188 pacientů) pochází z dat EBMT-Lymphoma Working Party (15), který referuje OS ve 2 letech 50 %, TRM 12,8 resp. 25,5 % do 100 dnů resp. 1 roku, se signifikantně horší prognózou pro nemocné s agresivním/MCL lymfomem, ve fázi chemorezistentní choroby. Problémem při interpretaci těchto výsledků je však značná heterogenita těchto souborů co se týče různého zastoupení jednotlivých histologických subtypů, tak různé míry předléčení a v neposlední řadě stavu choroby v době transplantace. Navíc jsou použity různé přípravné režimy a různě intenzivní imunosuprese. Řada recentních studií referuje povzbudivější výsledky pro lépe definované skupiny (7, 16–20).
Náš soubor má díky extremní heterogenitě jak jednotlivých histologických subtypů, tak fázi onemocnění a stupně chemosenzitivity, stejně i použitých přípravných režimů, převážně charakter kazuistického sdělení. Přesto však naše výsledky potvrzují proveditelnost této metody i ve skupině těžce předléčených nemocných a její použitelnost i v případě selhání mnoha linií předchozí chemoterapie včetně autologní transplantace.
Za zajímavé nicméně považujeme několik pozorování. Výsledky celkového přežití v našem souboru jsou relativně dobré, přestože téměř polovinu tvořily nepříbuzenské transplantace (pro malé počty nemocných nelze provést statistické porovnání s příbuzenskými). Hlavní příčinou úmrtí a relativně vysoké TRM lze v našem souboru považovat infekční (bakteriální) příčiny. Lze předpokládat podíl předchozího předléčení, resp. chemorezistence jako faktoru souvisejícího s nižší tolerancí transplantační léčby. Tento faktor, stejně jako předchozí použití ASCT však nedosáhl v našem souboru statistické významnosti. Předpokládaný podíl GVHD nebyl pozorován, nízký výskyt aGVHD souvisí pravděpodobně s použitím ATG u většiny nemocných. Rovněž za poněkud překvapivé lze označit praktické chybění cGVHD, které rovněž nejspíše souvisí s intenzitou imunosuprese. Za významné lze považovat pozorování, že nemocní transplantovaní od nepříbuzného dárce nedosahují horší výsledky ve srovnání s příbuzným dárcem. Při diskusi o různé intenzitě přípravného režimu a jejího významu pro kontrolu nemoci se i v našem souboru podařilo potvrdit fakt, že lze dosáhnout kompletní remise při použití RIC a následné allo-SCT u nemocných jinak chemorezistentních.
Toto pozorování, lze použít jako nepřímý doklad pro GVL. Jako přímý doklad lze použít naše pozorování léčebné odpovědi po podání DLI u nemocného, který zrelaboval.
Naše prvé výsledky je možné považovat za povzbudivé, nicméně je zapotřebí hledat cesty k dalšímu snížení toxicity a optimalizovat výběr přípravného režimu stejně tak jako typ použité imunosuprese. Významnou roli rovněž hraje selekce pacientů, jinými slovy nalezení místa pro allo-SCT v léčebném algoritmu pro jednotlivé choroby, kde by poměr benefitu a rizika byl co nejvýhodnější.
K definitivnímu zhodnocení jsou nezbytné prospektivní randomizované studie.
Závěr
RIC alloSCT může být úspěšná i u části nemocných s lymfoproliferativním chemorezistentním onemocněním (pravděpodobně jen ve skupině nízkomaligních onemocnění).
Relativně vysoká TRM v našem souboru je pravděpodobně dána skupinou těžce předléčených nemocných s chemorezistentní chorobou. Proto bude nutné stanovit skupinu pacientů, u které bude indikováno RIC alloSCT v časné fázi léčby.
Podpořeno grantem IGA MZČR NR/8223-3
MUDr. Veronika Válková, CSc.
U nemocnice 1
128 00 Praha 2
e-mail: Veronika.valkova@uhkt.cz
Došlo do redakce: 9. 2. 2006
Přijato: 20. 3. 2007
Zdroje
1. Chopra R, Goldstone A, Pearce R, et al. Autologous versus allogeneic bone marrow transplantation for non-Hodgkin’s lymphoma: a case controlled analysis of European Bone Marrow Transplant Group Registry data. J Clin Oncol 1992; 10 : 1690–1695.
2. Verdonck LF, Dekker AW, Lokhorst HM, Petersen EJ, Nieuwenhuis HK. Allogeneic versus autologous bone marrow transplantation for refractory and recurrent low-grade non-Hodgkin’s lymphoma. Blood 1997; 90 : 4201–4205.
3. van Besien KW, Khouri IF, Giralt SA, et al. Allogeneic bone marrow transplantation for refractory and recurrent low-grade lymphoma: the case for aggressive management. J Clin Oncol 1995; 13 : 1096–1102.
4. Przepiorka D, Weisdorf D, Martin P, et al. 1994 Consensus Conference on Acute GVHD Grading. Bone Marrow Transplant 1995; 15 : 825–828.
5. Touch-down reverse transcriptase-PCR detection of IgV(H) rearrangement and Sybr-Green-based real-time RT-PCR quantitation of minimal residual disease in patients with chronic lymphocytic leukemia. Mol Diagn 2005; 9(1): 23–34.
6. Cheson BD, Horning S, Coiffier B, et al. Report of an International Workshop to Standardize Response Criteria for non-Hodgkin’s lymphomas: NCI Sponsored International Working Group. J Clin Oncol 1999; 17 : 1244–1253.
7. Morris E, Thomson K, Craddock C, et al. Outcomes after alemtuzumab - containing reduced-intensity allogeneic transplantation regimen for relapsed and refractory non-Hodgkin lymphoma. Blood 2004; 104(13): 3865–71.
8. Chakraverty R, Peggs K, Chopra R, et al. Limiting transplantation - related mortality following unrelated donor stem cell transplantation by using a nonmyeloablative conditioning regimen. Blood 2002; 99 : 1071–1078.
9. Peggs KS, Mackinnon S, Williams CD, et al. Reduced-intensity transplantation with in vivo T-cell depletion and adjuvant dose-escalating donor lymphocyte infusions for chemotherapy-sensitive myeloma: limited efficacy of graft-versus-tumor activity. Biol Blood Marrow Transplant 2003; 9 : 257–265.
10. An EBMT registry matched study of allogeneic stem cell transplants for lymphoma: allogeneic transplantation is associated with a lower relapse rate but a higher procedure-related mortality rate than autologous transplantation. Bone Marrow Transplant 2003; 31(8): 667–78.
11. Syngeneic hematopoietic stem-cell transplantation for non-Hodgkin’s lymphoma: a comparison with allogeneic and autologous transplantation — The Lymphoma Working Committee of the International Bone Marrow Transplant J Clin Oncol 2003; 21(20): 3744–53.
12. Allogeneic bone marrow transplantation for low-grade lymphoma. Blood 1998; 92(5): 1832–6.
13. Allogeneic bone marrow transplantation in patients who relapse after autologous transplantation. Bone Marrow Transplant 1997; 20(10): 859–63.
14. Toze CL, Galal A, Barnett BJ, et al. Myeloablative allografting for chronic lymphocytic leukemia: evidence for a potent graft-versusleukemia effect associated with graft-versus-host disease. Bone Marrow Transplant 2005; 36(9): 825–30.
15. Robinson SP, Goldstone AH, Mackinnon S, et al. Lymphoma Working Party of the European Group for Blood and Bone Marrow Transplantation: chemoresistant or aggressive lymphoma predicts for a poor outcome following reduced-intensity allogeneic progenitor cell transplantation: an analysis from the Lymphoma Working Party of the European Group for Blood and Bone Marrow Transplantation. Blood 2002; 100 : 4310–4316.
16. Allogeneic hematopoietic cell transplantation after fludarabine and 2 Gy total body irradiation for relapsed and refractory mantle cell lymphoma. Blood 2004; 104(12): 3535–42.
17. Khouri IF, Lee MS, Saliba RM, et al. Nonablative allogeneic stem-cell transplantation for advanced/recurrent mantle-cell lymphoma. J Clin Oncol 2003; 21 : 4407–4412.
18. Khouri IF, Saliba RM, Giralt SA, et al. Nonablative allogeneic hematopoietic transplantation as adoptive immunotherapy for indolent lymphoma: low incidence of toxicity, acute graft-versus-host disease, and treatment-related mortality. Blood 2001; 98 : 3595–3599.
19. Clinical evidence of a graft-versus-Hodgkin’s-lymphoma effect after reduced-intensity allogeneic transplantation. Lancet 2005; 365(9475): 1934–41.
20. Reduced-intensity allogeneic stem cell transplantation in relapsed and refractory Hodgkin’s disease: low transplant-related mortality and impact of intensity of conditioning regimen. Bone Marrow Transplant 2005; 35(10): 943–51.
21. National Cancer Institute-sponsored Working Group guidelines for chronic lymphocytic leukemia: revised guidelines for diagnosis and treatment. Blood 1996; 87(12): 4990–7.
Štítky
Hematológia Interné lekárstvo OnkológiaČlánok vyšiel v časopise
Transfuze a hematologie dnes

2007 Číslo 2
- Nejasný stín na plicích – kazuistika
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Aktuálne možnosti terapie chronickej zápalovej demyelinizačnej polyradikuloneuropatie (CIDP)
- Když se ve střevech děje něco nepatřičného...
Najčítanejšie v tomto čísle
- Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
- Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
- Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
- Chronická B-lymfocytární leukemie Část IV: Možnosti léčby s použitím monoklonálních protilátek alemtuzumabu a rituximabu

