-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunoterapie rituximabem v kombinaci s dexametazonem následovaná podáním 90Y - ibritumomab tiuxetanu u předléčených nemocných s relabovaným folikulárním lymfomem
Rituximab immunotherapy combined with dexamethasone followed by 90Y-ibritumomab tiuxetan radioimmunotherapy in pretreated patients with relapsed follicular lymphoma
The introduction of monoclonal antibody therapy has provided hope for the patients with follicular lymphoma (FL) that their prognosis may be improved. Rituximab (anti-CD20 chimeric monoclonal antibody, MabThera®) has proven to be highly effective and non-toxic targeted treatment of FL. The response rate and therapeutic benefit of monoclonal antibodies seems to be enhanced by the use of radioisotope-labelled antibody therapy. 90Y-ibritumomab tiuxetan (Zevalin®) was the first radioimmunotherapy (RIT) approved for the treatment in relapsed or refractory FL and many clinical trials demonstrated its efficacy and safety even in patients with advanced stage disease. According to new studies, RIT should be preferably used as consolidation treatment after tumor debulking. We report 3 patients with relapsed FL treated with four weekly doses of rituximab (375 mg/m²) and dexamethasone (20 mg/m²) with respect to their age, previous therapy, concomitant diseases or some concerns about chemotherapy complications. All patients responded to rituximab, but residual disease was demonstrated in each of them. Therefore, it was decided to treat them with 90Y-ibritumomab tiuxetan RIT in a dose of 14,8 MBq/kg in two patients and 11,1 MBq/kg in one patient (with platelet counts 125x109/l). Hematological nadirs were reached 4–6 weeks later, with one grade 3 neutropenia, one grade 4 and one grade 3 thrombocytopenia, respectively. Two patients had minor infection complications (acute bronchitis and enteritis). From 2 to 3 months after radioimmunotherapy, the 18F-fluoro-deoxy-glucose positron emission tomography (18F-FDG PET) analysis proved no accumulation of 18F-FDG in any lymph node (LN) and computed tomography (CT) scans documented LN with the maximum size of 2x1 cm in two patients (one CR, two CRu). Eleven, nine and seven months after RIT, the patients were subjectively well, clinically in durable disease remission without any late complications.
Key words:
folicullar lymphoma, 90Y-ibritumomab tiuxetan, rituximab, positron emission tomography, remission
Autoři: T. Papajík 1; T. Szotkowski 1; V. Procházka 1
; Z. Kubová 1; V. Heinzová 2; M. Brejcha 3; J. Drymlová 4; E. Buriánková 4; P. Koranda 4; M. Mysliveček 4; L. Kučerová 5; K. Indrák 1
Působiště autorů: Hemato-onkologická klinika FNO a LF UP v Olomouci, 2Hematologické a transfúzní oddělení nemocnice Opava 1; Onkologické centrum J. G. Mendela Nový Jičín, 4Klinika nukleární medicíny FNO a LF UP v Olomouci 3; Oddělení patologie FNO a LF UP v Olomouci 5
Vyšlo v časopise: Transfuze Hematol. dnes,13, 2007, No. 4, p. 209-215.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Zavedení léčby monoklonálními protilátkami (MoAb) přineslo naději na zlepšení prognózy nemocných s folikulárním lymfomem (FL). Rituximab (anti-CD20 chimérická monoklonální protilátka, MabThera®) byl první vysoce efektivní a netoxickou cílenou léčbou pomocí MoAb u FL. Další zvýšení účinku MoAb bylo dosaženo jejich spojením s radioizotopem. 90Y-ibritumomab tiuxetan (Zevalin®) je prvním představitelem nového léčebného směru - radioimunoterapie (RIT), který byl registrován pro standardní klinické použití u relabujících a refrakterních nemocných s FL. Řada klinických studií prokázala jeho účinnost a bezpečnost i u nemocných v pokročilém stadiu choroby. Podle nejnovějších dat se jeví jako optimální použít RIT jako konsolidační léčbu poté, co vhodnou předchozí terapií redukujeme nádorovou masu. V našem sdělení popisujeme případy 3 nemocných s relabovaným FL, kteří byli léčeni monoterapií – 4 dávkami rituximabu (375 mg/m²) a dexametazonu (20 mg/m²) v týdenním intervalu. Důvodem indikace monoterapie rituximabem byl vyšší věk nemocných, jejich předléčenost, přidružené choroby nebo obavy pacienta z následků chemoterapie. Všichni nemocní dosáhli po rituximabu léčebnou odpověď, kterou ale nebylo možno hodnotit jako kompletní remisi – u všech byla prokázána zbytková choroba. Proto byl jako konsolidační léčba indikován 90Y-ibritumomab tiuxetan (Zevalin®) v dávce 14,8 MBq/kg u dvou pacientů a 11,1 MBq/kg u jednoho nemocného s nižším výchozím počtem trombocytů (125x109/l). Nadiru hematologických parametrů bylo dosaženo za 4–6 týdnů od podání RIT. Neutropenie stupně 3 byla zaznamenána u jednoho, trombocytopenie stupně 4, respektive stupně 3 u dvou pacientů. U dvou pacientů byly léčba 90Y-ibritumomab tiuxetanem provázena infekčními komplikacemi (akutní bronchitida a enteritida). V odstupu 2–3 měsíců od RIT bylo u všech nemocných provedeno kombinované vyšetření pozitronovou emisní tomografií a počítačovou tomografií (PET/CT), které neprokázalo akumulaci 18F-fluoro-deoxy-glukózy (18F-FDG) v žádné z dříve postižených lymfatických uzlin. Na CT snímcích byly u 2 nemocných zjištěny uzliny o maximální velikosti 2x1 cm. Léčebná odpověď u nich byla hodnocena jako nepotvrzená kompletní remise (CRu) choroby. U třetí nemocné byl stav hodnocen jako kompletní remise (CR). 11, 9 a 7 měsíců po podání RIT jsou všichni nemocní v remisi choroby a bez výskytu pozdních komplikací léčby.
Klíčová slova:
folikulární lymfom, 90Y-ibritumomab tiuxetan, rituximab, pozitronová emisní tomografie, remiseÚvod
Folikulární lymfom (FL) představuje druhý nejčastější podtyp nehodgkinského lymfomu (NHL). Obecně platí, že z velké části jde o pomalu postupující lymfoproliferativní onemocnění, často označované jako “nízce maligní”, u něhož kombinovaná chemoterapie sice vede k ústupu choroby, ale jen výjimečně k vyléčení pacienta. U drtivé většiny nemocných se choroba po různě dlouhém bezpříznakovém intervalu znovu objeví a vyžaduje další léčbu (1). Zavedení monoklonálních protilátek do léčby relabovaných FL výrazně zlepšilo možnosti volby účinné a přitom šetrné terapie pro tuto skupinu – často starších a předléčených pacientů s dalšími chorobami. Rituximab (anti-CD20 chimerická monoklonální protilátka) prokázal svou účinnost v monoterapii relabovaného FL, když u 60 % nemocných byla konstatována objektivní léčebná odpověď, jejíž medián trvání přesahoval 1 rok (2). Ve snaze dále zlepšit léčebné výsledky a prodloužit jejich trvání, byla na jedné straně imunoterapie úspěšně kombinována s chemoterapií (3), na straně druhé se objevily snahy spojit (konjugovat) monoklonální protilátky s dalšími účinnými látkami. Monoklonální protilátka by v tomto případě jednak sama, resp. ve spolupráci s imunitním systémem organismu narušila metabolické děje nádorové buňky, ale zároveň by přímo k nádoru dopravila další lék, jež by nádor relativně cíleně a účinně ničil. Vhodnými látkami se pro toto použití ukázaly být některé z radioizotopů, a to díky svým fyzikálním vlastnostem a také vzhledem k tomu, že lymfomy jsou výrazně radiosenzitivní nádory (4). Atraktivním radioizotopem se stalo ytrium 90 (90Y), které je čistý beta-zářič, produkujícím energii 2,3 mV na vzdálenost 5 mm (v měkké tkáni) s poločasem rozpadu 64 hodin (5). Tento radionuklid byl po řadě experimentů kovalentně navázán pomocí chelatační techniky a molekuly tiuxetanu na ibritumomab, myší IgG1 anti-CD20 protilátku. Tímto bioinženýrským krokem se významně usnadnilo cílené podávání radionuklidu do nádorové tkáně a takto připravený lék (90Y-ibritumomab tiuxetan) se stal úspěšným představitelem nové léčebné modality – radioimunoterapie (RIT) (6). Fáze I/II klinické studie s 90Y-ibritumomab tiuxetanem prokázala bezpečnost a efektivitu podání léku, když u nemocných s relabovanými a refrakterními lymfomy bylo dosaženo 67 % léčebných odpovědí (26 % kompletních remisí [CR] a 41 % parciálních remisí [PR]). U skupiny nemocných s nízce maligními lymfomy byla úspěšnost léčby ještě vyšší (82 % léčebných odpovědí, 26 % CR a 56 % PR) (7). Neméně důležitý byl také průkaz bezpečnosti rutinního podání 90Y-ibritumomab tiuxetanu bez nutnosti hospitalizace nemocného a popis reverzibilní hematologické toxicity, jež má přece jen mírně odlišnou kinetiku – na rozdíl od běžného útlumu krvetvorby po kombinované chemoterapii. Ve fázi III randomizované klinické studie byla pak u nemocných s relabovaným či refrakterním nízce maligním lymfomem nebo s transformovaným lymfomem srovnávána účinnost léčby 90Y-ibritumomab tiuxetanem s podáním rituximabu. Počet léčebných odpovědí a CR byl významně vyšší v rameni s RIT (počet odpovědí 83 % vs 56 %, p = 0,002; CR 30 % vs 16 %, p = 0,004). Trend k delšímu trvání léčebné odezvy byl zaznamenán u nemocných s folikulárním lymfomem (18,5 měsíců vs 12,1 měsíců, p = 0,371) (8). I když se doba celkového přežití nemocných v obou léčebných větvích statisticky nelišila, dlouhodobý příznivý efekt po RIT 90Y-ibritumomab tiuxetanem byl popsán zejména u nemocných v CR (9). Novější práce poukazují také na to, že další zlepšení výsledků přináší časnější zařazení 90Y-ibritumomab tiuxetanu do léčby relabovaných nemocných s FL. Tento léčebný postup nevylučuje zařazení další cytostatické nebo transplantační léčby (10, 11), ale na druhé straně lze RIT bezpečně podat i relabovaným nemocným po vysoce dávkované terapii s autologní transplantací krvetvorných buněk (12).
V naší práci demonstrujeme úspěšné sekvenční podání 4 dávek rituximabu v kombinaci s dexametazonem s následnou konsolidační terapií 90Y-ibritumomab tiuxetanem u třech nemocných s předléčeným relabovaným folikulárním lymfomem.
Soubor nemocných a metody
Diagnóza relapsu FL byla u všech tří nemocných potvrzena histologicky z extirpované uzliny. V imunohistochemické diagnostice povrchových znaků nádorové populace byl použit panel monoklonálních protilátek (anti-CD20, CD 79a, CD5, CD3, bcl-2 a Ki-67). Všechny vzorky tkáně byly hodnoceny dvěma nezávislými hemato-patology.
U všech nemocných byla při relapsu vyšetřena kostní dřeň získaná jednak aspirací a jednak pomocí trepanobiopsie. Aspirát kostní dřeně byl vedle morfologie vyšetřen pomocí monoklonálních protilátek průtokovou cytometrií a byla provedena i standardní vyšetření krve a séra nemocného zvykle používaná při stážování a před zahájením terapie maligních lymfomů. Všichni nemocní byli při relapsu vyšetřeni pomocí celotělové integrované pozitronové emisní tomografie s použitím 18F-fluoro-deoxy-glukózy a počítačovou tomografií (18F-FDG PET/CT) s podáním perorální a intravenózní kontrastní látky. U každého nemocného bylo vypočítáno skóre Mezinárodního prognostického indexu (IPI) a Mezinárodního indexu pro FL (FLIPI), jak bylo již dříve popsáno v literatuře (13, 14).
Popis 1. nemocného
Žena ve věku 65 let, FL patologického stupně II diagnostikován v červnu 1998. Klinické stadium v době diagnózy IIIA, IPI 1, FLIPI 1. Chemoterapie CHOP 6 cyklů byla komplikována iritací pankreatu, hmotnostním úbytkem 18 kg, výsevem herpes zoster, akutními exacerbacemi chronické bronchitidy. Léčbou 1. linie byla dosažena CR choroby s dobou trvání léčebné odpovědi 6 měsíců. Pro relaps s útlakem cévních struktur pravé dolní končetiny byla podána kombinovaná terapie fludarabinem, mitoxantronem a dexametazonem, celkem 4 cykly. Chemoterapie byla komplikována dyspepsií horního typu, bakteriálními infekty horních cest dýchacích, výraznou úzkostí a depresemi. Proto byla dále indikována radioterapie do celkové dávky 40 Gy na původní uzlinovou masu v pravém třísle. Touto léčbou bylo dosaženo CRu. Druhá léčebná odpověď trvala 64 měsíců. Na podzim 2005 došlo k 2. relapsu choroby, který byl histologicky ověřen v lednu 2006 z uzliny na krku. Byla potvrzena CD20 pozitivita buněk FL, nebyla prokázána histologická transformace FL. V době druhého relapsu bylo klinické stadium hodnoceno na základě vyšetření PET-CT jako IIIA; IPI2, FLIPI3. Kostní dřeň nebyla FL postižena. Přidružené choroby – hypertenze st. II dle WHO, chronická ischemická choroba srdeční, chronická bronchitida, hyperlipidemie, chronická pankreatitida, chronická pyelo-nefritida, diabetes mellitus II. typu na dietě. Další chemoterapii v té době již 73letá polymorbidní nemocná odmítla. Byla proto indikována k imunoterapii rituximabem v kombinaci s dexametazonem.
Popis 2. nemocné
Žena ve věku 48 let, diagnóza FL v listopadu 2002, patologický stupeň IIIa, velká nádorová masa v retroperitoneu (mnohočetné pakety uzlin, největší z nich 4x8 cm), postižení plic, jater, sleziny a kostní dřeně, klinické stadium IVB, IPI3, FLIPI 4. Nemocná podstoupila 6 cyklů intenzivní sekvenční chemoterapie (PACEBO a režim s použitím cytosin-arabinosidu a metotrexátu) s následnou stimulací a sběrem periferních kmenových krvetvorných buněk. Vysoce dávkovanou terapií BEAM s následnou autologní transplantací v 1. PR v květnu 2003 bylo dosaženo CRu. Následně byly podány 4 cykly imunoterapie rituximabem s dosažením CR, dále indikována udržovací terapie interferonem-alfa. Relaps choroby byl diagnostikován po 30 měsících (leden 2006) a ověřen histologicky. Byla potvrzena CD20 pozitivita nádorové tkáně, nebyl prokázán přechod v agresivnější lymfom a nebyla zjištěna infiltrace kostní dřeně. Klinické stadium v době relapsu bylo na základě vyšetření PET-CT hodnoceno jako IIIA, IPI 1, FLIPI 2. Pro lokální komplikace v oblasti extirpované uzliny v pravém třísle a pomalou progresi růstu lymfomové tkáně byla nemocná indikována k terapii 2. linie rituximabem v kombinaci s dexametazonem.
Popis 3. nemocného
Muž ve věku 59 let, FL patologického stupně I diagnostikován v dubnu 2000. Klinické stadium IVA, IPI 1, FLIPI 1. Vzhledem k aktivitě choroby bylo podáno 6 cyklů kombinované chemoterapie mitoxantron, chlorambucil a prednizon. Léčbou bylo dosaženo CR, která trvala 27 měsíců. 1. relaps choroby byl léčen v rámci klinické studie rituximabem a interferonem-gama. Touto léčbou bylo opět dosaženo CR onemocnění, která trvala 26 měsíců. 2. relaps choroby byl diagnostikován v červenci 2006. Histologicky bylo verifikováno, že se jedná o FL, patologický stupeň II. V krevním obraze dominovala trombocytopenie (118x109/l), která byla pravděpodobně imunitní etiologie (vyšetření protilátek proti trombocytům bylo pozitivní). Klinické stadium jsme hodnotili jako IVA, IPI 1, FLIPI 2 (provedeno PET-CT). V kostní dřeni byla imunocytologicky prokázána počínající infiltrace dřeně klonem CD20+ lymfocytů. Velké uzlinové masy v obou tříslech hrozily uzávěrem cévních struktur. Nemocný navíc trpěl chronickou obstrukční bronchitidou s opakovanými exacerbacemi (silný kuřák), chronickou maxilární sinusitidou, chronickou žilní insuficiencí na dolních končetinách s komplikovanými varikozitami a hypertenzní chorobou. Jako léčba 3. linie byl u v té době 67letého nemocného s výraznou komorbiditou indikován rituximab v kombinaci s dexametazonem.
Aplikace rituximabu
Rituximab (MabThera®, Roche) byl podáván formou pomalé intravenózní infuze, vlastní množství účinné látky bylo ředěno ve fyziologického roztoku chloridu sodného. Jednotlivá dávka rituximabu byla 375 mg/m2, interval mezi jednotlivými dávkami byl jeden týden, celkem byly podávány 4 dávky u každého nemocného. Nemocní byli před každou infuzí premedikováni 1000 mg paracetamolu perorálně (p.o.) a 10 mg cetirizinu p.o. Před každou dávkou rituximabu byl aplikován dexametazon 20 mg/m2 intravenózní formou. Rychlost první infuze rituximabu byla během první hodiny 50 mg účinné látky/h, při dobré snášenlivosti byla postupně zvyšována o 50 mg/h každých 30 minut až na 400 mg/h. Pokud první aplikace rituximabu nebyla provázena závažnějšími komplikacemi (stupeň III a IV dle WHO škály), činila celková doba následující infuze 90 minut (20 % dávky léku v prvních 30 minutách, zbylých 80 % léku během dalších 60 minut).
Aplikace90Y-ibritumomab tiuxetanu
V den 1 byla podána nitrožilní infuze rituximabu v dávce 250 mg/m2 a o týden později (den 8) byla aplikována stejná dávka rituximabu následovaná krátkým (10 minut trvajícím) intravenózním podáním 90Y-ibritumomab tiuxetanu (Zevalin®, Bayer Schering Pharma) v dávce 14,8 MBq/kg (u 2 pacientů s počtem trombocytů nad 150x109/l) nebo 11,1 MBq/kg (u pacienta s počtem trombocytů 125x109/l). Horní hranice maximální dávky90Y-ibritumomab tiuxetanu pro pacienta činila 1200 MBq (32 mCi). RIT byla podána na ambulanci Kliniky nukleární medicíny FN Olomouc.
Hodnocení léčebné odpovědi
Léčebná odpověď byla hodnocena podle kritérií publikovaných Chesonem a kolegy v roce 1999 (15). Byla použita kritéria CR, nepotvrzené CR (CRu), PR, stabilní choroby (SD), progresivní choroby (PD) a relapsu choroby.
Léčebná odpověď byla hodnocena po aplikaci 4 dávek rituximabu a nejdříve za 60 dní od podání 90Y-ibritumomab tiuxetanu. U všech nemocných bylo provedeno integrované PET/CT vyšetření s podáním 18F-FDG, perorální a intravenózní kontrastní látky standardně používané pro CT vyšetření. Hodnocení výsledných snímků bylo nezávisle na sobě provedeno radiologem (CT snímky) a lékařem nukleární medicíny (PET skeny). Vyšetření kostní dřeně (aspirace, průtoková cytometrie a trepanobiopsie) bylo provedeno jen v případě, že nemocný měl před zahájením léčby kostní dřeň infiltrovanou buňkami FL.
Výsledky
Terapie rituximabem v kombinaci s dexametazonem byla velmi dobře tolerována a nebyly zaznamenány žádné nežádoucí příhody či orgánová toxicita stupně III a IV dle škály WHO. U první nemocné bylo po ukončení léčby rituximabem provedeno integrované PET/CT vyšetření a byla konstatována PR s průkazem konsumpce 18F-FDG, resp. hypermetabolismu glukózy v nádorových buňkách zvětšených lymfatických uzlin retroperitonea. U zbylých dvou nemocných byla hodnocena léčebná odezva po aplikaci rituximabu fyzikálním a ultrazvukovým vyšetřením, jelikož patologické uzliny byly těmito metodami dobře měřitelné. U obou nemocných byla rovněž po léčbě rituximabem stanovena částečná léčebná odpověď. U všech 3 nemocných byla po zvážení poměru přínosu a rizika indikována RIT. Aplikace 90Y-ibritumomab tiuxetanu proběhla bez jakýchkoliv časných komplikací a nemocní byli ve stabilizovaném stavu a po řádném poučení propuštěni z ambulance Kliniky nukleární medicíny FN Olomouc v den podání léku. Další sledování nemocných probíhalo na ambulanci Hemato-onkologické kliniky FN Olomouc, u dvou nemocných ve spolupráci s regionálními hematologickými pracovišti v Opavě a Novém Jičíně.
U všech nemocných došlo k poklesu v základních řadách krevních buněk. Jejich nadir jsme zaznamenali mezi 4.–6. týdnem od podání RIT. Nejnižší hodnoty uvádíme v tabulce 1. Nebyly zaznamenány žádné epizody klinicky významného či život ohrožujícího krvácení. Do 60. dne od podání RIT jsme zaznamenali u 2 pacientů 2 infekční příhody. U jednoho nemocného došlo k akutní exacerbaci chronické bronchitidy, která byla zvládnuta kombinovanou antibiotickou terapií. U jedné nemocné byla dokumentována febrilní neutropenie následovaná mukositidou zejména v oblasti střeva. Stav byl na chirurgickém pracovišti mylně diagnostikován jako akutní apendicitida a byla provedena laparotomie s normálním nálezem na apendixu. Rána po laparotomii se hojila poměrně komplikovaně, a nemocná proto musela být opakovaně léčena intravenózní antibiotickou terapií.
Tab. 1. Nejnižší hodnoty parametrů krevního obrazu u nemocných po terapii 90Y-ibritumomab tiuxetanem. 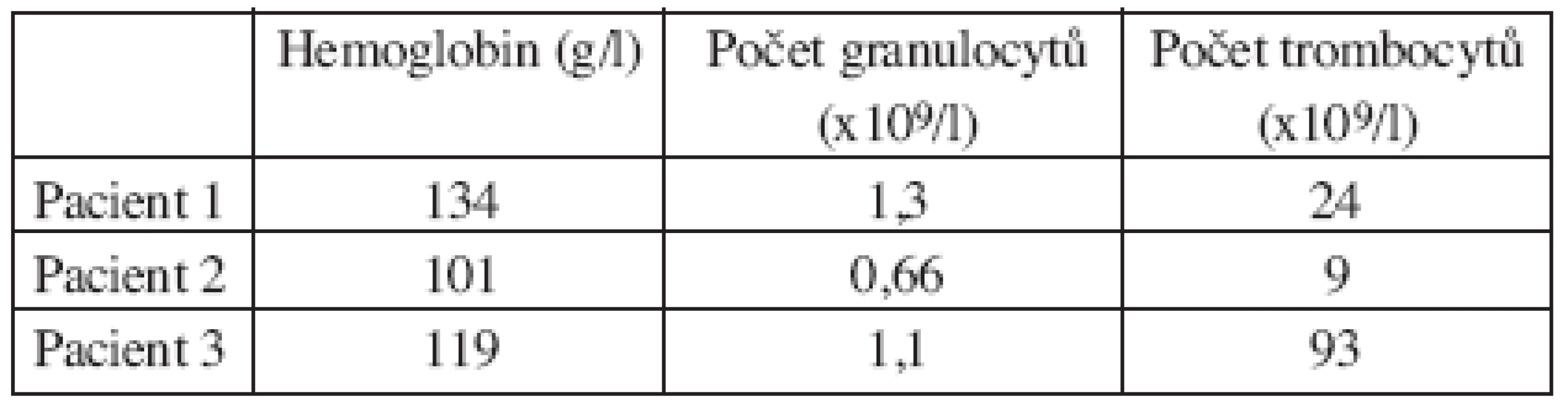
Integrované 18F-FDG PET/CT vyšetření neprokázalo u žádného z nemocných patologickou akumulaci fluoro-deoxy-glukózy v oblastech dříve zvětšených a 18F-FDG PET pozitivních uzlin. U 1 nemocného s probíhající akutní bakteriální bronchitidou bylo prokázáno drobné ložisko akumulace 18FDG v horním plicním poli vpravo o velikosti 1x1 cm, které bylo po detailní analýze současně provedených CT snímků hodnoceno jako ložisko zánětlivé (obr. 1). Na kontrolním vyšetření provedeném v časovém odstupu po infekční epizodě léčené kombinací antibiotik již toto ložisko nalezeno nebylo. U 2 nemocných byly na CT skenech vyšetření pozorovány dříve postižené uzliny, které byly i po léčbě větší než 1 cm (u obou nemocných maximálně do rozměru 2x1 cm). Léčebnou odpověď jsme proto u nich hodnotili jako CRu s PET-negativním obrazem. U 1 nemocné vymizely patologické uzliny zcela a mohlo tak být konstatováno dosažení CR choroby s dokumentovanou PET-negativitou (obr. 2, 3, 4). 11, resp. 9 a 7 měsíců po RIT jsou všichni 3 pacienti v dobrém stavu a z klinického hlediska v trvající remisi onemocnění.
Obr. 1. Srovnání snímků pozitronové emisní tomografie (s použitím 18F-fluoro-deoxy-glukózy) (a) a integrované pozitronové emisní tomografie s počítačovou tomografií (b) po skončení léčby 90Y-ibritumomab tiuxetanem u třetího pacienta s folikulárním lymfomem a nálezem ložiska v plicním parenchymu. 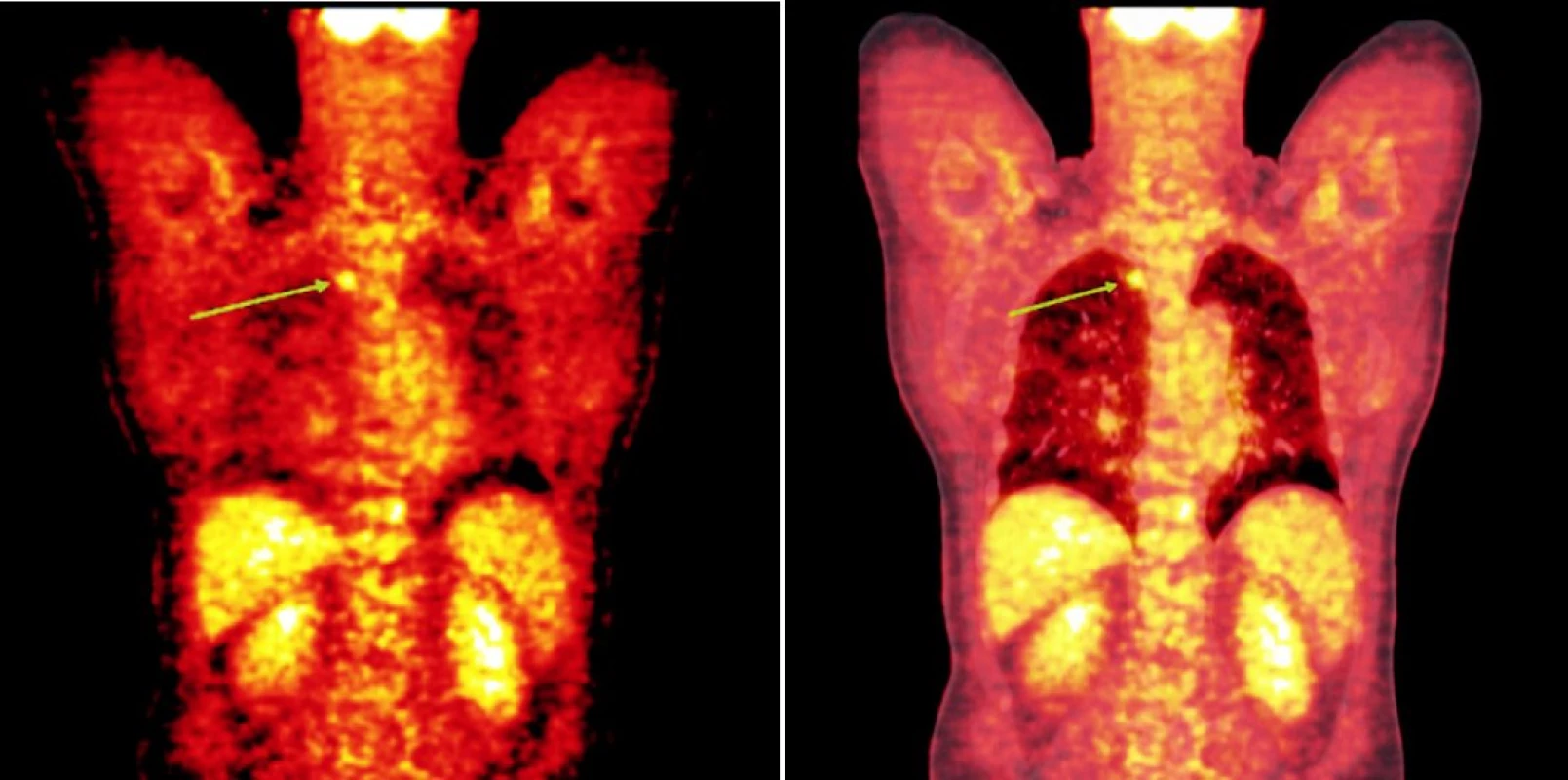
Obr. 2. Srovnání snímků integrované pozitronové emisní tomografie (s použitím 18F-fluoro-deoxy-glukózy) a počítačové tomografie při relapsu (a) a po skončení léčby 90Y-ibritumomab tiuxetanem (b) u prvního pacienta s folikulárním lymfomem. 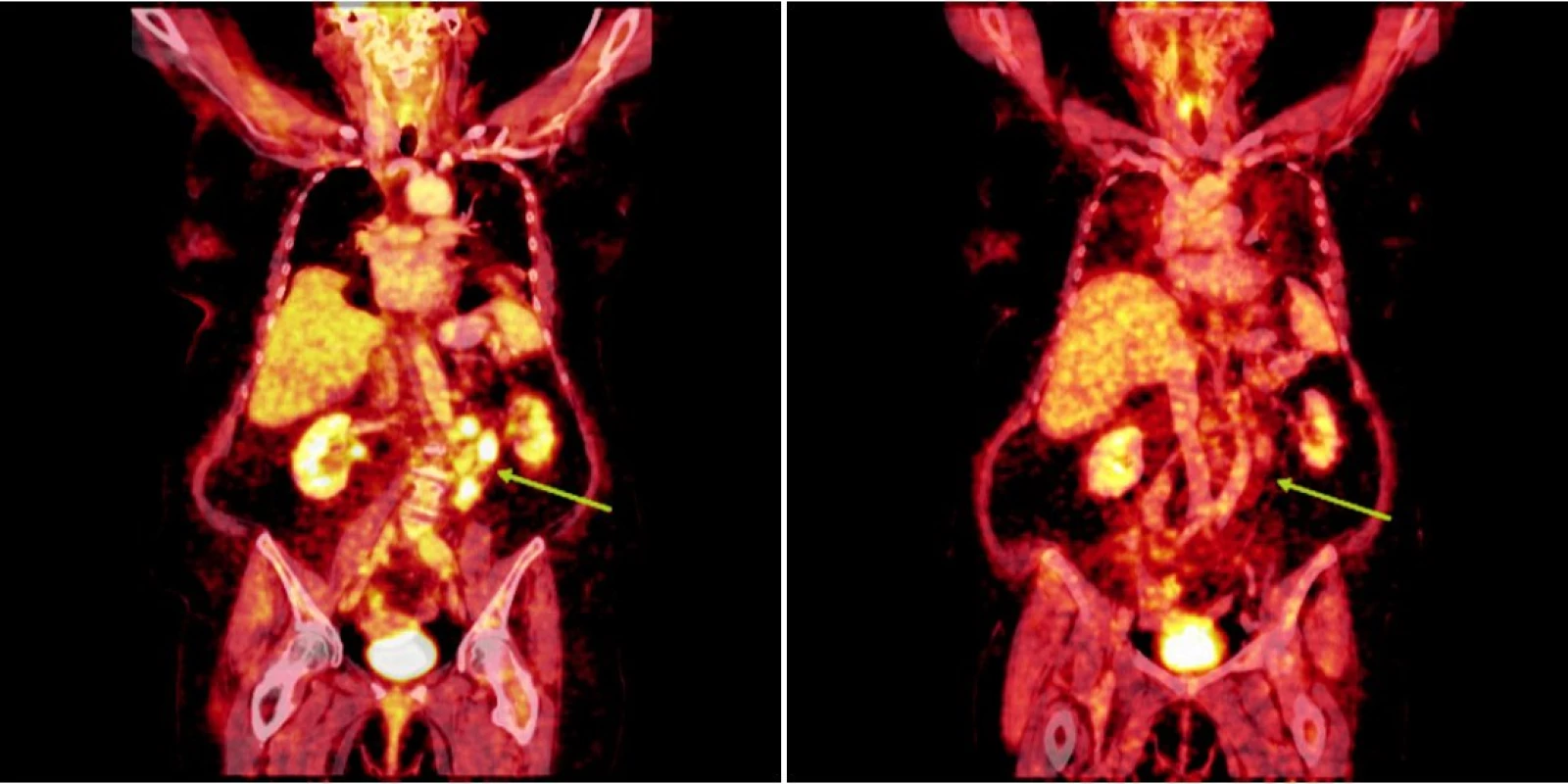
Obr. 3. Srovnání snímků integrované pozitronové emisní tomografie (s použitím 18F-fluoro-deoxy-glukózy) a počítačové tomografie při relapsu (a) a po skončení léčby 90Y-ibritumomab tiuxetanem (b) u druhého pacienta s folikulárním lymfomem. 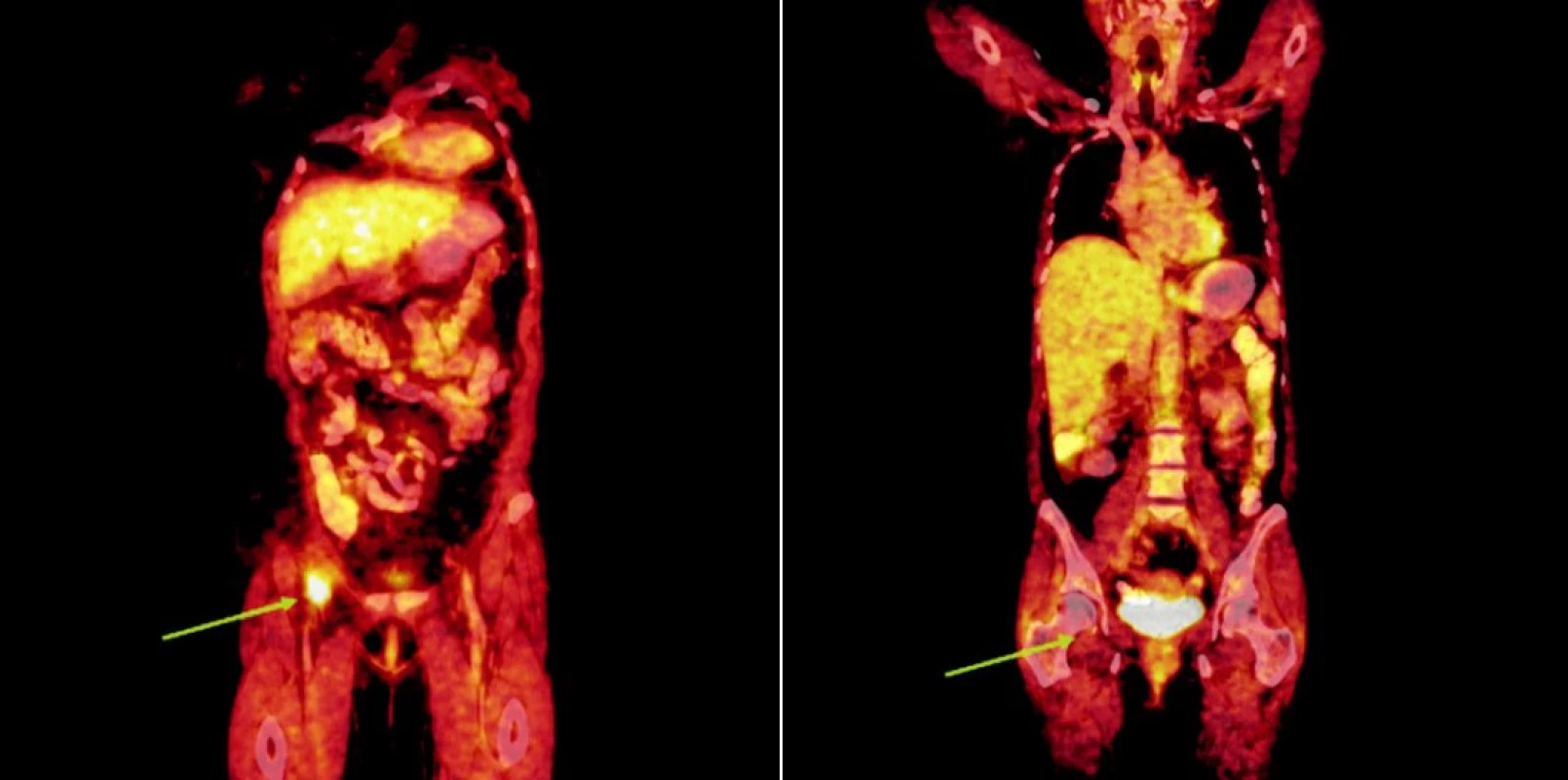
Obr. 4. Srovnání snímků integrované pozitronové emisní tomografie (s použitím 18F-fluoro-deoxy-glukózy) a počítačové tomografie při relapsu (a) a po skončení léčby 90Y-ibritumomab tiuxetanem (b) u třetího pacienta s folikulárním lymfomem. 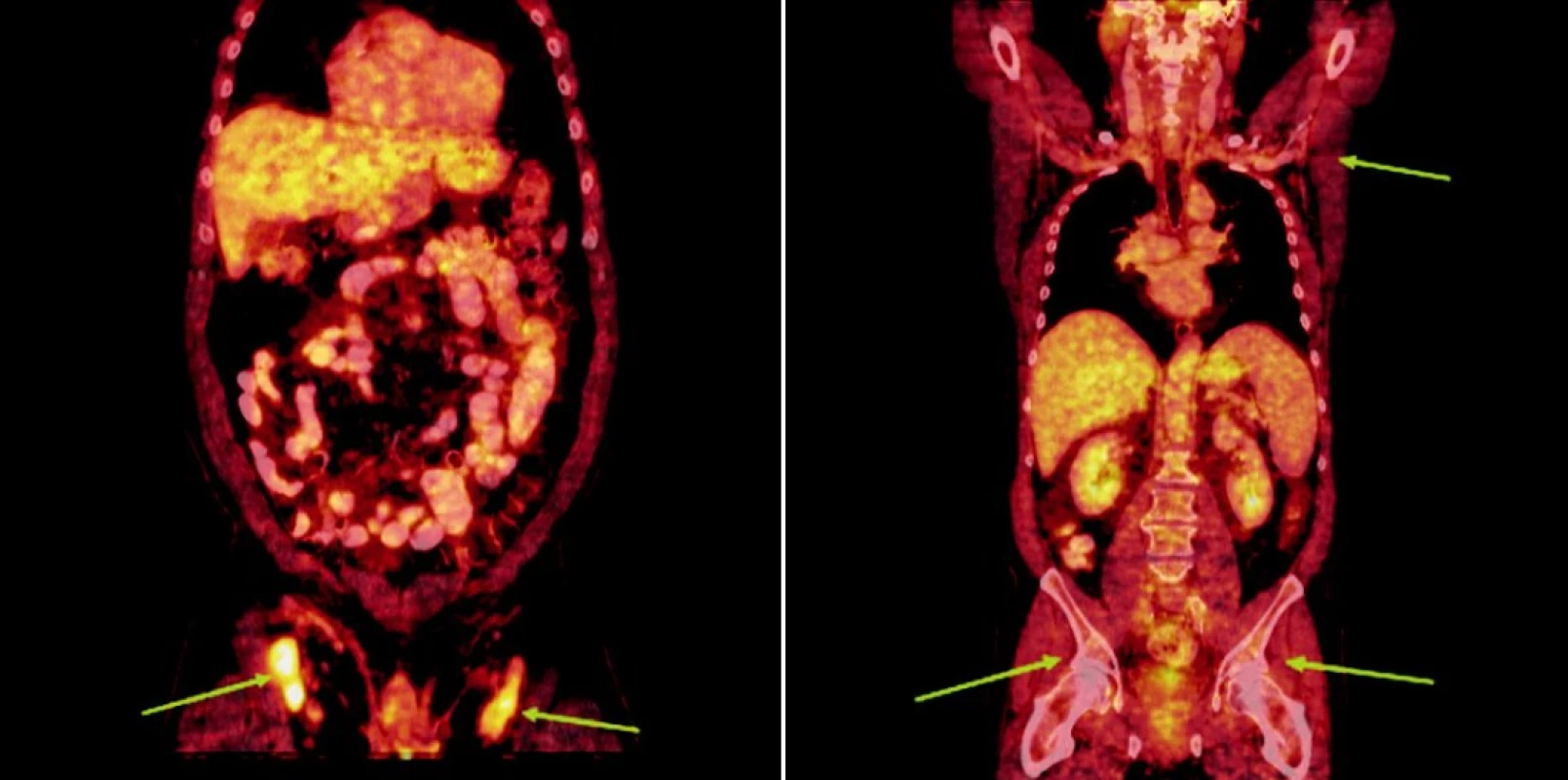
Diskuse
Ačkoliv většina nemocných s FL na prvotní protinádorovou chemoterapii nebo imunochemoterapii dobře reaguje, téměř u každého z nich onemocnění po kratším či delším bezpříznakovém období znovu propuká (relabuje). Léčba relapsů bývá často problematická, zejména u nemocných ve vyšším věku a s dalšími přidruženými chorobami. Pokud je dosaženo remise onemocnění, pak délka jejího trvání bývá vždy kratší než u předchozí léčby a dříve či později se vyvine rezistence k jakékoliv terapii. Folikulární lymfom se pak často histologicky transformuje v agresivní lymfoproliferaci s velmi špatnou prognózou. Monoklonální protilátky podstatně rozšířily léčebné možnosti u nemocných s FL. Konjugace anti-CD20 protilátky s radionuklidem 90Y zvýšila účinnost samotné imunoterapie a vedla ke zvýšení počtu léčebných odpovědí a trvání remise u senzitivních pacientů s FL. Výhody podání 90Y-ibritumomab tiuxetanu spočívají v kombinaci cílené léčby s vlastnostmi radioizotopu, jež byly zmíněny v úvodu práce. Beta záření, jež izotop produkuje, je účinné na vzdálenost asi 100–200 průměrů nádorové buňky FL a dovoluje tak ničit buňky uvnitř lymfomových mas, k nimž se protilátka s radio-izotopem přímo nedostane. Tento účinek byl nazván efektem křížové palby (cross-fire effect) a umožňuje také destrukci buněk, resp. nádorových klonů, jež na svém povrchu nenesou cílový antigen – v tomto případě CD20. Díky fyzikálním vlastnostem izotopu a jeho krátkému poločasu rozpadu, je možné podat 90Y-ibritumomab tiuxetan dobře vyškoleným personálem oddělení nukleární medicíny ambulantně a propustit nemocného do domácí péče téměř bezprostředně po aplikaci léku. Vzhledem k tomu, že beta záření je téměř kompletně pohlceno tkáněmi nemocného, nedochází k riziku ozáření pro osoby, které se s ním po podání 90Y-ibritumomab tiuxetanu dostanou do bezprostředního styku (ošetřující personál či rodinní příslušníci). Také tělní tekutiny a exkrementy obsahují v prvních hodinách a dnech po podání jen zanedbatelné stopy radioaktivní látky.
Řada dat z poslední doby dokumentovala zlepšení léčebných výsledků 90Y-ibritumomab tiuxetanu při podání nemocným v prvním relapsu onemocnění nebo jako konsolidaci zbytkové choroby po předchozí léčbě, a to dokonce v první terapeutické linii. Národní konsensus německých hemato-onkologů doporučuje podat lék po předchozí redukci nádorové masy vhodnou terapií (11, 16–18). Dále bylo prokázáno, že 90Y-ibritumomab tiuxetan lze bezpečně podat u nemocných s relapsem FL po autologní transplantaci krvetvorných buněk a také to, že následná kombinovaná chemoterapie nemocných s relapsem FL po podání RIT není zatížena nadměrným počtem závažných nežádoucích příhod či toxicity pro pacienty (10, 12).
V předložené práci hodnotíme podání 90Y-ibritumomab tiuxetanu u nemocných s relabujícím FL, které jsme z důvodů věku, předléčenosti, přidružených chorob či jejich obav z následků další chemoterapie léčili 4 standardními dávkami rituximabu v kombinaci s dexametazonem v týdenních odstupech. Kombinace rituximabu s glukokortikoidem byla zvolena mimo výše uvedené důvody i pro jejich prokázaný vzájemný synergní antiproliferativní a proapoptotický efekt na buňky různých typů lymfomu (19). Léčba byla dobře tolerována, nicméně vedla jen k redukci nádorové tkáně a přítomnost zbytkové choroby signalizovala vysokou pravděpodobnost brzké progrese lymfomu. Na základě vlastních zkušeností a s přihlédnutím k nejnovějším zprávám z mezinárodních literárních zdrojů (16–18) jsme indikovali tyto nemocné k podání 90Y-ibritumomab tiuxetanu. RIT byla všemi nemocnými excelentně tolerována a nebyly zaznamenány žádné časné komplikace. Pečlivě byla sledována dynamika následného útlumu krvetvorby, jež se obecně projevuje s delší latencí, než bývá pozorováno např. po kombinované chemoterapii. V souladu s literárními údaji bylo dosaženo nadiru hematologických parametrů u všech pacientů za 4–6 týdnů od podání RIT, u jednoho nemocného byla dokumentována granulocytopenie stupně 4 dle WHO škály a u 2 nemocných si zánětlivá komplikace vyžádala antibiotickou terapii (mukositida/enteritida, bronchitida). U všech nemocných se objevila trombocytopenie, nebyly však zaznamenány žádné krvácivé komplikace. V odstupu nejméně 60 dní po aplikaci Zevalinu prokázalo integrované PET/CT vyšetření výbornou léčebnou odpověď po RIT. Všichni nemocní byli hodnoceni jako 18F-FDG PET negativní. Vzhledem k tomu, že CT vyšetření nalezlo u 2 nemocných uzliny větší než 1 cm (u obou maximálně do velikosti 2x1 cm), hodnotili jsme léčebnou odpověď u těchto nemocných jako CRu. Zajímavým nálezem na PET-CT vyšetření byla podezřelá minimální léze v plicním parenchymu u 1 nemocného. Ta byla detailní analýzou CT snímků označena jako zánětlivá (pacient prodělal v době před vyšetřením akutní bronchitidu) a na kontrolním vyšetření po léčbě zánětu již nebyla patrná. Tato epizoda dokumentuje přínos integrovaného PET/CT vyšetření a jeho schopnost odhalit 18F-FDG PET pozitivní, ale nenádorové léze (infekční fokusy, záněty, aj.). Všichni nemocní zůstávají v ambulantním sledování a klinicky jsou stále v remisi choroby, mají dobrou kvalitu života bez jakýchkoliv pozdních následků léčby.
Závěr
Radioimunoterapie 90Y-ibritumomab tiuxetanem dnes představuje standardní, bezpečnou a účinnou možnost léčby nemocných s relabovanými folikulárními lymfomy. Lék je v současné době v České republice registrován pro léčbu dospělých nemocných s CD20 pozitivním folikulárním lymfomem, který zrelaboval po předchozí léčbě obsahující rituximab nebo byl k této léčbě refrakterní. Před podáním 90Y-ibritumomab tiuxetanu je nutné vyšetřit parametry krevního obrazu a provést vyšetření kostní dřeně. Počet neutrofilních granulocytů před léčbou nesmí poklesnout pod 1,5x109/l, počet krevních destiček pod 100x109/l a počet patologických lymfocytů v kostní dřeni nesmí překročit 25 %. Nemocní by neměli v minulosti absolvovat zevní ozáření, které by zahrnovalo více jak 25 % plochy aktivní kostní dřeně, opatrnosti je rovněž zapotřebí u pacientů, kterým byla dříve provedena transplantace kmenových buněk, i když data o bezpečnosti léčby 90Y-ibritumomab tiuxetanem po autologní transplantaci kmenových buněk již byla publikována (12). Zařazení RIT do terapeutického schématu v časném období choroby (1. či 2. relaps) nebo její použití v rámci konsolidace předchozí léčby může přinést další zlepšení výsledků a významné prodloužení trvání remise u nemocných s FL. Výsledky nejnovějších klinických studií ukazují, že RIT se zřejmě brzy stane také standardní součástí některých přípravných režimů k autologní transplantaci nebo součástí léčebných schémat u dalších typů CD20 pozitivních lymfomů.
Podpořeno grantem IGA MZ ČR No. NR/9502-3 a VZ MŠM 619 895 9205
MUDr. Tomáš Papajík, CSc.
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: tomas.papajik@fnol.cz
Zdroje
1. Hiddeman W, Buske C, Dreyling M, et al. Treatment Strategies in Follicular Lymphomas: Current Status and Future Perspectives. J Clin Oncol 2005; 23 : 6394-6399.
2. McLaughlin P, Grillo-Lopez AJ, Link BK, et al. Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: Half of patients respond to a 4-dose treatment program. J Clin Oncol 1998; 16 : 2825–2833.
3. Czuczman MS, Grillo-López AJ, White CA, et al. Treatment of patients with low-grade B-cell lymphoma with the combination of chimeric anti-CD20 monoclonal antibody and CHOP chemotherapy. J Clin Oncol 1999; 17 : 268–276.
4. Cheson BD. Radioimmunotherapy of non-Hodgkin’s lymphoma. Blood 2003; 101 : 391–398.
5. DeNardo GL, O’Donnell RT, Shen S, et al. Radiation dosimetry for 90Y-2IT-BAD-Lym-1 extrapolated from pharmacokinetics using 111In-2IT-BAD-Lym-1 in patients with non-Hodgkin’s lymphoma. J Nucl Med 2000; 41 : 952–958.
6. Gordon LI, Witzig TE, Wiseman GA, et al. Yttrium 90 ibritumomab tiuxetan radioimmunotherapy for relapsed or refractory low-grade non-Hodgkin’s lymhoma. Sem Oncol 2002; 29 (Suppl 2): 87–92.
7. Witzig TE, White CA, Wiseman GA, Gordon LI, Emmanouilides C, Raubitschek A, et al. Phase I/II trial of IDEC-Y2B8 radioimmunotherapy for treatment of relapsed or refractory CD20+ B-cell non-Hodgkin’s lymphoma. J Clin Oncol 1999; 17 : 3793–3803.
8. Witzig TE, Gordon LI, Cabanillas F, Czuczman MS, Emmanouilides C, Joyce R, et al. Randomized controlled trial of yttrium-90-labeled ibritumomab tiuxetan radioimmunotherapy versus rituximab immunotherapy for patients with relapsed or refractory low-grade, follicular, or transformed B-cell non-Hodgkin’s lym-phoma. J Clin Oncol 2002; 20 : 2453–2463.
9. Gordon LI, Molina A, Witzig T, Emmanouilides C, Raubtischek A, Darif M, et al. Durable responses after ibritumomab tiuxetan radioimmunotherapy for CD20+ B-cell lymphoma: long-term follow-up of a phase 1/2 study. Blood 2004; 103 : 4429–4431.
10. Ansell SM, Ristow KM, Hanermann TM, et al. Subsequent chemotherapy regimens are well tolerated after radioimmunotherapy with yttrium-90 ibrituomomab tiuxetan fo non-Hodgkin’s lymphoma. J Clin Oncol 2002; 20 : 3885–3890.
11. Emmanoulides C, Witzig TE, Gordon LI, et al. Treatment with yttrium 90 ibritumomab tiuxetan at early relapse is safe and effective in patients with previously treated B-cell non-Hodgkin’s lymphoma. Leuk Lymphoma 2006; 47 : 629–636.
12. Jacobs SA , Vidnovic N, Joyce J, et al. Full-dose 90Y ibritumomab tiuxetan therapy is safe in patients with prior myeloablative chemotherapy. Clin Cancer Res 2005; 11 : 7146–7150.
13. Shipp MA, Harrington DP, Anderson JR, et al. A predictive model for aggressive non-Hodgkin’s lymphoma. N Engl J Med 1993; 329 : 987–994.
14. Solal-Céligny P, Roy P, Colombat P, et al. Follicular lymphoma prognostic index. Blood 2004; 104 : 1258–1265.
15. Cheson BD, Horning SJ, Coiffier B, et al. Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomnas. J Clin Oncol 1999; 17 : 1244–1253.
16. Shipley DL, Spigel DR, Carell DL, et al. Phase II trial of rituximab and short duration chemotherapy followed by 90Y ibritumomab tiuxetan as first-line treatment for patients with follicular lymphoma: a Minnie Pearl Cancer Research Network phase II trial. J Clin Oncol ASCO Annual Meeting Proceedings 2004; 22 (Suppl 14): 6519.
17. Jurczak WJ, Szostek MS, Giza AG, et al. Consolidation of chemotherapy response in mantle cell lymphoma (MCL) patients with 90Y-ibritumomab tiuxetan (90Y-Zevalin®) radioimmunotherapy (RIT). Haematologica 2006 : 91 (Suppl. 1): 188.
18. Dreyling M, Trümper L, von Schilling C, et al. Results of national consensus workshop: therapeutic algorithm in patients with follicular lymphoma – role of radioimmunotherapy. Ann Hematol 2007; 86 : 81–87.
19. Rose AL, Smith B, Maloney DG. Glucocorticoids and rituximab in vitro: synergistic direct antiproliferative and apoptotic effects. Blood 2002; 100 : 1765 – 1773.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2007 Číslo 4- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
- Vyšetrovacie metódy krvných doštičiek – stručný prehľad
- Vybrané odborné akce v roce 2008
- Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
- Vzdělávací akce IPVZ
- Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
- Vzdělávací akce IPVZ
- Imunoterapie rituximabem v kombinaci s dexametazonem následovaná podáním 90Y - ibritumomab tiuxetanu u předléčených nemocných s relabovaným folikulárním lymfomem
- Gratulujeme
- XV. ČESKO-SLOVENSKÝ HEMATOLOGICKÝ A TRANSFUZIOLOGICKÝ SJEZD 6.- 9. 9. 2008 IX. ČESKO–SLOVENSKÁ KONFERENCE LABORATORNÍ HEMATOLOGIE 5.- 6. 9. 2008
- Co se děje u našich sousedů v transfuzní službě
- OBSAH ROČNÍKU 13/2007 Transfuze a hematologie dnes
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
- Vyšetrovacie metódy krvných doštičiek – stručný prehľad
- Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
- Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



