Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
The impact of the various blood collection methods and the leukodepletion on the quality of the cryopreserved red blood cells
The article has summarized partial results of the project of evaluation and implementation method for collection and long-term storage packed red cells (RBC) for strategic, special and therapeutic findings of the Army of the Czech Republic as well as the state. The aim of the study was quality and stability evaluation of cryopreserved RBCs collected by different methods. The source of studied RBCs was double erytrocytapheresis (Group A), whole blood collection with buffy-coat removing (Group B), double erytrocytapheresis with in-line leukofiltration (Group C) and whole blood collection with in-line leukofiltration (Group D). This study compares “non-leukodepleted” RBCs (Group A and B) and “leukodepleted” RBCs (Group C and D). Tested RBCs were frozen in 40% glycerol and stored at minimum -65°C for at least 30 days, thawed, deglycerolized, and stored for 21 days at 4±2°C. Glycerolization and deglycerolization were performed with functionally closed system using the Haemonetics ACP 215 machine. In-vitro haematological and biochemical variables were tested on day 0-7-14-21 after deglycerolization. The observed changes of studied haematological and biochemical parameters could be most probably consistent with gradual degradation of non-survival RBCs after freeze-thaw-wash-reconstitution process. Some variables (such as 2,3-DPG, phosphate levels, pH and osmolality) indicate the equilibrium establishment in RBCs during the first 7 days after reconstitution. The results suggest the superior stability of leukodepleted cryopreserved RBCs, collected from whole blood or apheresis, reconstituted in AS-3 after reconstitution related to the non-leukodepleted RBCs, obtained by use of the both methods. It is confirmed by the slow haemolysis and supernatant haemoglobin growth in dependence of storage time. Reconstituted leukodepleted RBCs exhibit significantly higher time stability. No change of 2,3-DPG variable was observed between non-leukodepleted and leukodepleted RBCs. It could be supposed, that this variable is the physiological function of survival RBCs. In contrast to the leukodepletion, the primary source of red blood cells collection (apheresis or whole blood) does not affect stability a quality of RBCs units reconstituted in AS-3. The study demonstrate the superiority of leukodepleted RBCs obtained by apheresis or from whole blood over the non-leukodepleted RBCs (non-filtrated RBCs), reconstituted in AS-3, for extended storage up to 21 days at temperature of 2–6 °C.
Key words:
cryopreservation of red cell, deep frozen blood, reconstitution, glycerolisation, deglycerolisation, crisis blood policy, Nutricel, AS-3, double erythrocytapheresis
Autoři:
M. Bohoněk; M. Petráš; I. Turek; J. Urbanová; T. Hrádek; V. Staropražská; J. Koštířová; D. Horčičková; S. Duchková
Působiště autorů:
Oddělení hematologie, biochemie a krevní transfuze, Ústřední vojenská nemocnice Praha
Vyšlo v časopise:
Transfuze Hematol. dnes,13, 2007, No. 4, p. 200-208.
Kategorie:
Souhrnné práce, původní práce, kazuistiky
Souhrn
Práce je dílčím výsledkem projektu, jehož cílem byl vývoj a zavedení metodiky získávání a dlouhodobého skladování erytrocytů pro strategické, speciální a léčebné potřeby Armády České republiky a státu. Cílem studie bylo zhodnocení kvality a stability různým způsobem připravených kryokonzervovaných erytrocytů ve smyslu vstupního meziproduktu před zmražením. Předmětem zkoumání byly erytrocyty s jen sníženým obsahem leukocytů, jednak získané z dvojité erytrocytaferézy, tj. erytrocyty z aferézy (EAR, skupina A) nebo erytrocyty bez buffy-coatu získané z odběrů plné krve, tj. erytrocyty bez buffy-coatu (EBR, skupina B) a dále erytrocyty deleukotizované, též připravené z dvojité erytrocytaferézy – erytrocyty z aferézy deleukotizované (EAD, skupina C) nebo erytrocyty deleukotizované z plné krve (ERD, skupina D). Zkoumané erytrocyty byly zmražené ve 40% glycerolu, skladované při -65 °C po minimální dobu 30 dní a po rozmražení rekonstituované v Nutricelu a skladované ve 4±2 °C maximálně 21 dní. Glycelorizace a deglycerolizace byla prováděna v uzavřeném systému prostřednictvím zařízení Haemonetics ACP 215. Zkoumány byly in vitro hematologické a biochemické parametry ve dnech 0-7-14-21 po deglycerolizaci. Změny sledovaných parametrů pravděpodobně souvisí především s rozpadem nevitálních erytrocytů poškozených v průběhu procesu zmražení a rozmražení. Některé z nich (např. 2,3-DPG, fosfor, pH a osmolality) ukazují na vytváření rovnováhy v prvních 7 dnech po rekonstituci. Výsledky sledovaných parametrů prokazují vyšší stabilitu kryokonzervovaných EAD/ERD po rekonstituci, ve srovnání s EAR/EBR. U EAD/ERD je patrný pomalejší vývoj hemolýzy s nižší hodnotou hemoglobinu v supernatantu v závislosti na délce skladování. Rekonstituované deleukotizované erytrocyty vykazují významně vyšší časovou stabilitu. Žádné změny mezi EAD/ERD a EAR/EBR nebyly pozorovány v hladině 2,3-DPG parametru, což bude pravděpodobně ukazatel fyziologické funkce přežívajících erytrocytů. Na rozdíl od vlivu deleukotizace na kvalitu rekonstituovaných erytrocytů nebyl pozorován vliv typ odběru (aferéza nebo odběr plné krve). Studie tedy prokazuje lepší vlastnosti zmražených, rekonstituovaných a následně skladovaných až 21 dnů při 2–6 °C erytrocytů deleukotizovaných ve srovnání s erytrocyty bez buffy-coatu.
Klíčová slova:
kryokonzervace erytrocytů, hluboko zmražená krev, rekonstituce, glycerolizace, deglycerolizace, krizová krevní politika, Nutricel, AS-3, dvojitá erytrocytaferéza
Úvod
Náhrada krve a zásobování krví a transfuzními přípravky je stálým strategickým a logistickým problémem zdravotnické služby armád celého světa, který vyplývá z podstaty krve jako léčiva, tj. biologického přípravku, který má omezenou dobu použitelnosti, specifické a omezující podmínky přepravy, skladování a aplikace pacientům (1–5). Stejně problematickou zůstává i tzv. krizová krevní politika státu, kdy při zachování obvyklých a běžně používaných postupů je obtížné zajistit dostatečné zásoby krve pro případ náhlého napadení státu, teroristického útoku nebo hromadného neštěstí.
Zabezpečení armády krví je řešeno systémem distribuce z vojenského transfuzního centra, které přímo zásobuje krví rozvinuté zdravotnické etapy. Pro náhle vzniklou potřebu je nutné mít k dispozici kdykoli mobilizovatelnou zásobu erytrocytů univerzální krevní skupiny 0. Tomuto požadavku nejlépe odpovídá strategický sklad kryokonzervovaných erytrocytů (1, 4, 6).
V České republice byla zavedena metodika kryokonzervace erytrocytů ve 40% glycerolu při -80 °C a skladování při -65 °C a po rozmrazení jejich rekonstituce v Nutricelu, kdy byly ověřeny vyhovující parametry kvality při skladování min. 21 dní při teplotě 2–6 °C (6, 7). Základním zkoumaným přípravkem byly erytrocyty resuspendované získané z dvojité erytrocytaferézy (EAR). Studie je součástí výzkumného projektu obranného výzkumu Ministerstva obrany ČR prováděném na Oddělení hematologie, biochemie a krevní transfúze Ústřední vojenské nemocnice Praha, jehož cílem je optimalizace metodiky na výrobu erytrocytů pro dlouhodobé skladování pro strategické, speciální a terapeutické potřeby Armády České republiky a státu (1, 6–9).
Aby znalost parametrů kvality a vitality erytrocytů nebyla omezena jen na tento jeden způsob výroby erytrocytů, bylo v následné studii v rozšířeném in vitro testování přistoupeno ke zhodnocení parametrů kvality erytrocytů resuspendovaných získaných z odběrů plné krve (erytrocyty resuspendované bez buffy-coatu, EBR), dále erytrocytů deleukotizovaných z aferézy (EAD) a z plné krve (ERD). Spolu se skupinou EAR tak byly posuzovány celkem 4 skupiny erytrocytů zmražených ve 40% glycerolu a následně rekonstituovaných v Nutricelu a skladovaných při chladničkové teplotě po dobu 21 dní a vyhodnoceny jejich vlastnosti z pohledu vitality na základě stanovených in vitro laboratorních hematologických a biochemických parametrů. Cílem studie tedy bylo zhodnotit kvalitu a stabilitu různých erytrocytárních přípravků, lišících se kvalitou i způsobem odběru a výroby, které byly zmraženy ve 40% glycerolu a následně rekonstituovaných (tj. rozmraženy, deglycerolizovány a resuspendovány) v roztoku AS-3 (Nutricel).
Materiál a metodika
Metoda přípravy kryokonzervovných a rekonstituovaných erytrocytů
Pro získání erytrocytů byly použity čtyři metody: 1. výroba EAR metodou dvojité erytrocytaferézy na separátoru krevních komponent Haemonetics MCS+ (použitý set Haemonetics Single Donor Red Cell Apheresis Set, REF 942), 2. výroba EBR z odběrů plné krve (použitá odběrová souprava Baxter 3-OPTIPAC REF JGR8333B), 3. výroba EAD metodou dvojité erytrocytaferézy na separátoru krevních komponent Haemonetics MCS+ a následnou in-line filtrací (použitý set Haemonetics 2 Units RBC w/RC2H Filter (SDR) REF 948F) 4. výroba ERD z odběrů plné krve (použitá odběrová souprava Baxter 4-OptiPure WB REF KGR8469B). Odebrané erytrocyty byly následně převedeny do vaků určených pro hluboké zmražení (Baxter, Cryocyte) a přidána příměs 40% glycerolu. Pro napojování vaků byla použita sterilní svářečka vaků. Vlastní proces glycerolizace byl řízený a prováděný na automatickém zařízení Haemonetics ACP-215. Jednotky erytrocytů po glycerolizaci byly ihned zmraženy v mechanickém mrazicím boxu Jouan VX-80 při -80 °C, kde byly ponechány po dobu nejméně 24 hodin (1, 6, 7, 10–14).
Následně byly erytrocyty skladovány alespoň 30 dní při teplotě -65 °C. Rozmrazení erytrocytů se provádělo 30 min. ve vodní lázní při 37 °C v rozmrazovacím agitátoru Tool s následným 25 min. vytemperováním na pokojovou teplotu. Proces deglycerolizace a promytí rozmražených erytrocytů probíhal plně automatizovaně na zařízení Haemonetics APC 215 za použití 12% roztoku NaCl pro počáteční odstranění glycerolu z erytrocytárních korpuskulí a dále roztoku 0,9% NaCl + 0,2% dextrózy k vymytí nadbytečného glycerolu z erytrocytární suspenze. Promyté erytrocyty byly resuspendovány v roztoku AS-3 (Nutricel). Objem rekonstituovaných erytrocytů byl v rozmezí 200 až 300 ml. Rekonstituované erytrocyty byly následně skladovány při teplotě 4±2 °C 7, 14, resp. 21 dní.
Uspořádání studie a vzorkování
Ve všech čtyřech skupinách vyrobených erytrocytů byly hodnoceny hematologické a biochemické parametry měřené v časech 0-7-14-21 dnů po rekonstituci. Vzorkování bylo prováděno sterilním uzavřeným způsobem z originálních jednotek erytrocytů ve stanovených časech měření a v průběhu skladování při teplotě 2-6 °C, vyjma skupiny A, kdy byla použita data z předchozí otevřené klinické studie (6, 7). V této skupině byl každý vzorek původní, tj. měl svou transfuzní jednotku (nepárové vzorkování v časové posloupnosti).
Výsledky měření jsou popsány a uspořádány do těchto čtyř skupin (tab. 1):
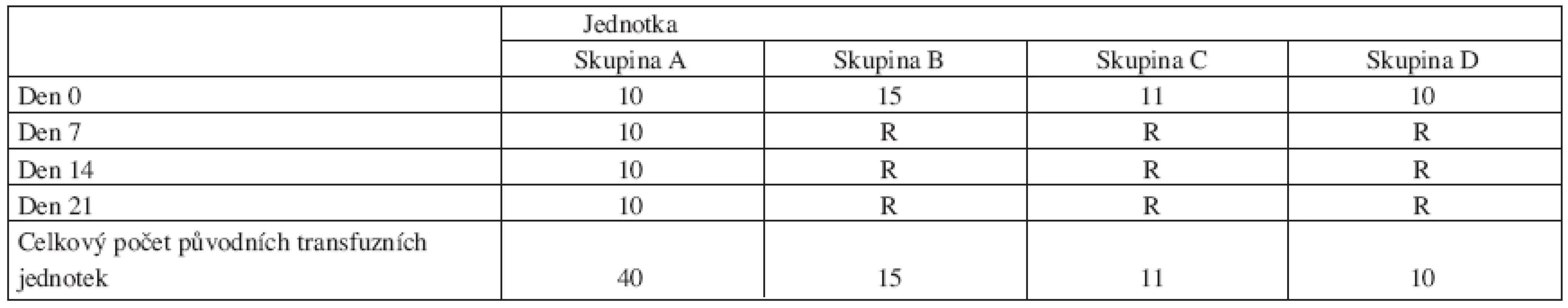
Skupina A: EAR (erytrocyty z aferézy resuspendované)
Skupina B: EBR (erytrocyty bez buffy-coatu z plné krve)
Skupina C: EAD (erytrocyty z aferézy deleukotizované)
Skupina D: ERD (erytrocyty deleukotizované z plné krve)
Měření in vitro parametrů
Byly hodnoceny následující vybrané hematologické a biochemické parametry: Hematologie: hematokrit (l/l) a hodnota celkového hemoglobinu v přípravku (g/l) – fotometrie, Advia 120, Bayer, koncentrace hemoglobinu v supernatantu – spektrofotometrie Konelab 60i, Kone, objem erytrocytů v přípravku – přepočet ze stanovené hmotnosti, ACP 215 Haemonetics, % hemolýzy – výpočtem z hodnoty celkového hemoglobinu v supernatantu a celkového hemoglobinu v erytrocytech, počet leukocytů – mikroskopicky v Nageottově komůrce.
Biochemie: osmolalita – osmometr Fiske 2400, Advanced Instruments, pH – pH meter Beckmann, draslík – ISE nepřímá potenciometrie Konelab 60i, Kone, fosfor – spektrofotometrie Vian, amoniak – Ammonia, Dialab, ATP– bioluminiscence ATP Bioluminescence Assay Kit CLS I Roche, 2,3-DPG – fotometrie v UV Roche, LDH – fotometrie UV Biocon.
Statistické analýzy
Pro srovnání parametrů uvnitř skupiny A i mezi skupinami (A-B-C-D) byl použit nepárový t-test (Mann-Whitney U-test) nebo Kruskal-Wallis test (neparametrická ANOVA). K porovnání rozdílů uvnitř skupin B-C-D byl navíc použit Wilcoxonův párový test. Výpočty byly prováděny statistických softwarem StatMate společnosti GraphPad (verze 1.01i, 16/1/1998) určený k biostatistickým výpočtům klinických studií.
Výsledky
Erytrocyty rekonstituované v Nutricelu (AS-3) vykazovaly pozvolný nárůst hemolýzy. Rychlejší růst hemolýzy byl pozorován u EBR (Skupina B), zatímco nárůst hemolýzy v ostatních skupinách (Skupina A-C-D) byl pomalejší. Rozdíly hodnot hemolýzy mezi všemi čtyřmi skupinami erytrocytů nebyl statisticky významný během prvních 14 dní po rekonstituci. Trend nárůstu hemolýzy byl potvrzen statisticky významnými rozdíly mezi hodnotami v čase 0. a 21. den po rekonstituci.
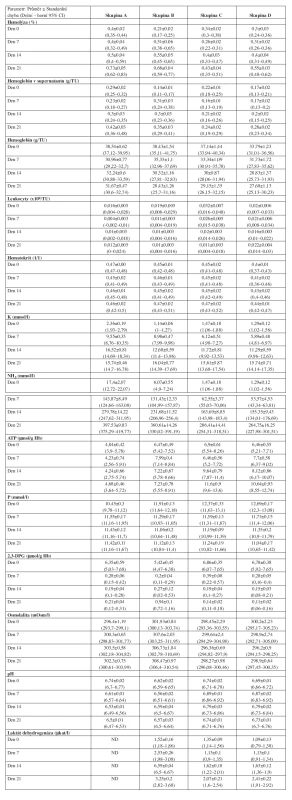
Tomuto trendu odpovídal i vývoj hemoglobinu v supernatantu. Hodnoty hemoglobinu v supernatantu dosahují významně nižších hodnot u EAD/ERD (Skupina C-D), ve srovnání s EAR/EBR (skupina A-B).
Hodnota celkového hemoglobinu v jednotce erytrocytů se ve všech skupinách během skladování významně snižovala během skladování po rekonstituci. Pouze u EAR (Skupina A) byly pozorovány proměnlivé hodnoty během sledované doby skladování (a to díky nepárovému vzorkování). Rozdíly mezi skupinami B-C-D (párové vzorkování) nebyly pozorovány (p > 0,05).
S časem uchovávání rekonstituovaných erytrocytů se rychlost poklesu hemoglobinu zpomalovala. V žádné ze skupin (Skupina A-B-C-D) nebyly pozorovány statisticky významné rozdíly v hodnotách hematokritu v závislosti na době skladování (0-21 dní). Hodnoty hemoglobinu a hematokritu v erytrocytech byly relativně nižší (<36 g/TU a <0,65/TU) vzhledem k objemovým hodnotám erytrocytů v primárním odběrovém vaku (200 ml/TU).
Hodnoty leukocytů ve všech skupinách rekonstituovaných erytrocytů nevykazovaly žádné statisticky významné změny během celé sledované doby skladování (0-21 dní), tj. lze je považovat za konstantní. Částečnou výjimkou byly EAD (skupina C), kdy počty leukocytů v den 21 po rekonstituci byly významně nižší než ve dnech 0-7-14, což lze pravděpodobně vysvětlit chybou měření. Rozdíly mezi průměrnými hodnotami počtu leukocytů ve všech sledovaných skupinách A-B-C-D nebyly shledány, protože proces zmražení a rozmražení jako takový snižuje hodnoty celých leukocytů na minimum.
Hodnota extracelulárního draslíku ve všech rekonstituovaných erytrocytech (Skupina A-B-C-D) se postupně zvyšovala a to statisticky významně v závislosti na době skladování ve dnech 0-7-14-21. Určitá odchylka v této tendenci byla zaznamenána pouze u EAR (Skupina A) ve 14. dni skladování, kdy navíc v této skupině byly hodnoty extracelulárního draslíku významně vyšší od počátku ve srovnání s ostatními skupinami (B-C-D). Tento jev souvisí s největší pravděpodobností s nepárovým vzorkováním u skupiny A.
Hodnoty amoniaku vykazovaly v rekonstituovaných erytrocytech lineární růst v závislosti na době skladování. Významně nižší hodnoty byly pozorovány u EAD/ /ERD (Skupina C-D) ve srovnání s EAR/EBR (Skupina A-B) a to ve 14. a 21. dni. Rovněž vzestupná tendence hodnot amoniaku byla významně vyšší u EAR/EBR (Skupina A-B).
U všech skupin erytrocytů (skupina A-B-C-D) byl změřen průměrně shodný úbytek 2,3-DPG v prvních 7 dnech skladování po rekonstituci. V následné periodě (7-14-21 dní) byly hodnoty 2,3-DPG již konstantní ve všech skupinách, vyjma v den 21 u skupiny B. V tomto případě se průměrná hodnota 2,3-DPG významně zvýšila vůči předešlým hodnotám v časové posloupnosti měření téže skupiny i vůči hodnotám ostatních skupin ve stejnému časovém bodě. Zda se jedná o náhodný jev nebo jev závislý na kvalitě erytrocytů, nelze z těchto údajů odhadnout a bude třeba proměřit tento parametr v delším časovém období uchovávání (tj. v čase > 21 dní po rekonstituci).
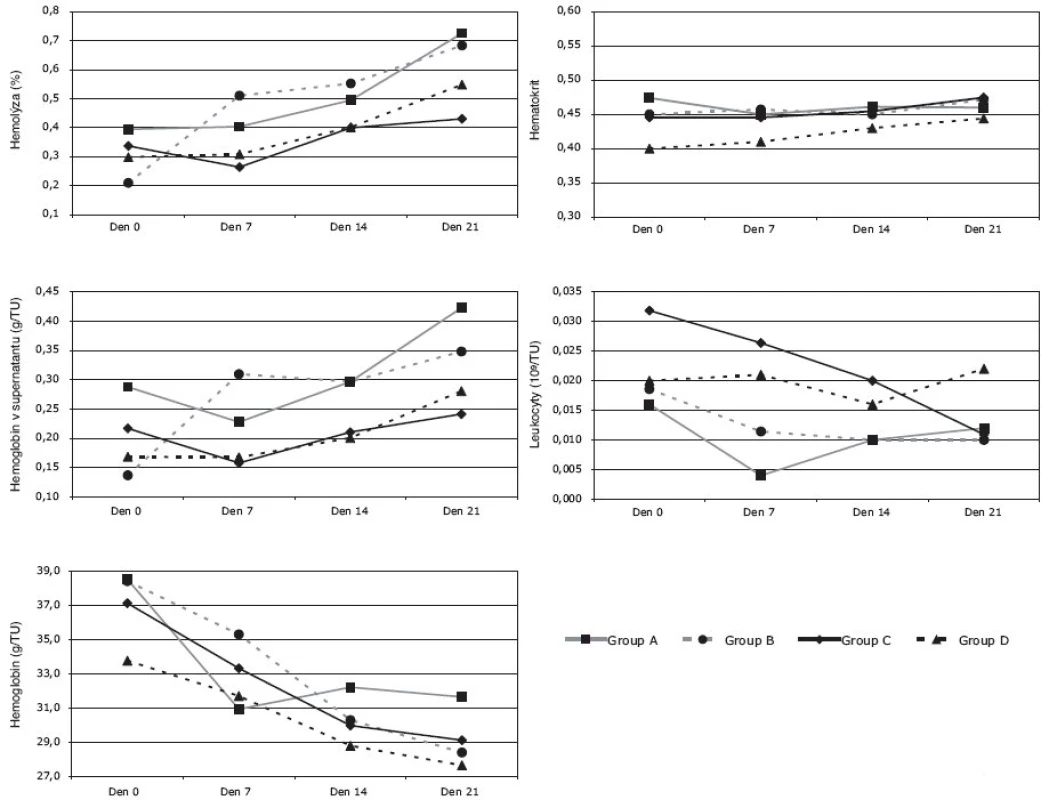
Osmolalita, jako bezpečnostní parametr kvality indikující dostatečné vymytí glycerolu, vykazovala jen nepatrný nárůst, více v prvních 14 dnech po rekonstituci, pravděpodobně v souvislosti s uvolňováním zbytkového vázaného glycerolu. Tyto změny byly zřejmé u EAR/EBR (Skupina A-B), zatímco v obou skupinách EAD/ERD (Skupina C-D) byla osmolalita během celé doby skladování po rekonstituci (0-21 dní) konstantní. Naměřené rozdílné tendence v hodnotách osmolality u EAR/EBR a EAD/ERD byly podpořeny výsledky statistické analýzy.
Hodnoty pH po počátečním mírném snížení u EAR/EBR (Skupina A-B) se stabilizovaly na 6,50 až 6,57 při nejdelší době skladování, tj. den 21. Naproti tomu hodnoty pH u EAD/ERD (Skupina C-D) se zvýšily v prvních 7 dnech a následně se postupně snižovaly (den 7-14-21). Ačkoli počáteční hodnota pH (6,6-6,7) v den 0 je obdobná u všech skupin erytrocytů (skupina A-B-C-D), tj. bez statisticky významného rozdílu, tak na konci měření (tj. den 21 po rekonstituci) bylo pH EBR (skupina A-B) významně nižší (skupina A: 6,50, Skupina B: 6,57) než pH ERD (Skupina C: 6,73, Skupina D: 6,74).
Hodnoty anorganického fosforu se snižovaly v prvních 14 dnech po rekonstituci (den 7-14) u všech skupin. Následně nebyly shledány signifikantní rozdíly ve změně hodnot hladin fosforu (p > 0,05), tj. nastal rovnovážný stav. Statisticky signifikantní nižší hodnoty hladin fosforu u skupiny A na začátku měření (den 0) odpovídají náhodnému jevu, vycházejícího z nepárového vzorkování měření.
Hladina ATP u rekonstituovaných EAR/EBR (skupina A-B) se neměnila během skladování, zatímco u EAD/ERD (skupina C-D) rostla od dne 7 po rekonstituci. V den 0 a 7 nebyl pozorován významný rozdíl v hladinách ATP mezi jednotlivými skupinami A-B-C-D.
Měření LDH nebylo provedeno u erytrocytů skupiny A, protože výsledky této skupiny byly přejaty z jiné studie, kde tento parametr nebyl stanoven. Nicméně rozdíly hodnot LDH mezi EBR a EAD/ERD byly statisticky významné, vyjma hodnoty LDH měřené hned po rekonstituci (den 0). U EBR (Skupina B) se hodnota LDH zvyšuje od počátku skladování a jsou patrné významné rozdíly v naměřených hodnotách v dnech 7-14-21. Naopak statisticky nevýznamné hodnoty LDH byly zjištěny u EAD/ERD (tj. mezi skupinami C a D). Obě tyto skupiny vykazovaly pomalejší nárůst hladiny LDH od 7. dne skladování po rekonstituci.
Diskuse
Výsledky této studie přinášejí ucelený pohled na změnu hematologických a biochemických parametrů ve vztahu ke stabilitě erytrocytární suspenze po rekonstituci v roztoku AS-3 (Nutricel), které předcházelo jejich hluboké zmražení.
Na základě literárních údajů a výsledků vlastní studie (6, 7) prováděné in vivo a in vitro, včetně výsledků této studie se lze domnívat, že vitální rekonstituované erytrocyty po kryokonzervaci dlouhodobě v AS-3 přežívají, tj. minimálně 21 dní, při teplotě 2–6 °C. Tuto domněnku potvrzují zjištěné hodnoty 24hodinové přežití erytrocytů a index terapeutické účinnosti (3, 11, 15).
Ukazuje se, že pozvolný nárůst volného hemoglobinu stejně jako rostoucí hemolýza v rekonstituovaných erytrocytech s největší pravděpodobností souvisí s rozpadem nevitálních erytrocytů. Potvrzují to i studie, které ukazují, že hodnoty hemolýzy nemají vliv na přežívání značených erytrocytů v oběhu (6, 7, 11, 16).
Tomuto vysvětlení odpovídá i parametr 2,3-difosfo-glycerát, který bez ohledu na způsob přípravy erytrocytů před kryokonzervací se po rozmražení a rekonstituci volně vyplaví (tj. jeho hladiny jsou relativně vysoké) a následně se během prvních 7 dní reverzibilně naváže na deoxygenovaný hemoglobin. Vzhledem k tomu, že jeho hodnoty jsou v období 7.–21. den uchovávání rekonstituovaných erytrocytů téměř konstantní, lze předpokládat, že se váže pouze na fyziologicky aktivní erytrocyty, jejichž počet je v tomto období rovněž konstantní (dokladem toho jsou konstantní hodnoty 24hodinového přežívání erytrocytů v celém rozmezí sledování 0–21 dní po rekonstituci). Zdá se tedy, že tento parametr by mohl v praxi představovat možnost stanovení aktivity vitálních erytrocytů a pomoci zvýšit kvalitu jištění transfuzní jednotky. Množství volného 2,3-DPG parametru by s největší pravděpodobností mohlo odpovídat množství nevitálních erytrocytů, které se v minimální míře vytvářejí převáženě v důsledku kryokonzervace a rekonstituce (9, 13, 17–21) .
Hematologické a biochemické parametry ve všech čtyřech skupinách erytrocytů (tj. EAR, EBR, EAD a ERD) byly sledovány při shodných podmínkách skladování v roztoku AS-3 při 2–6 °C. Z naměřených výsledků převažuje vyšší porekonstituční stabilita kryokonzervovaných EAD/ERD (skupina C-D) vzhledem k EAR/EBR (skupina A-B). To potvrzuje mimo jiné i pomalejší hemolýza EAD/ERD a stejně jako pozvolnější nárůst hodnot hladiny hemoglobinu v supernatantu v závislosti na době skladování po rekonstituci. Kromě toho rekonstituované EAD/ERD vykazují časově stálou a významně nižší osmolalitu než EAR/EBR, danou zřejmě jejich nižší afinitou ke glycerolu, což zvyšuje bezpečnost transfuzní jednotky.
Přítomnost leukocytárních reziduí (látky uvolněné z leukocytárních granulí po jejich rozpadu) v rekonstituovaných EAR/EBR (skupiny A-B) ovlivňuje hodnoty ATP (p < 0,05) a pH (p < 0,001) při delší době skladování, jak potvrzují statisticky významné rozdíly hodnot EAR/EBR (skupina A-B) vůči EAD/ERD (skupina C-D) v 21. dni po rekonstituci. U EAR/EBR se udržuje téměř konstantní hodnoty pH a hladina ATP po celou dobu skladování. Přitom hodnoty pH jsou u EAR/ERB nižší ve srovnání s hodnotami pH EAD/ERD. Naopak u EAD/ERD byl zjištěn významný pozvolný nárůst hodnot ATP v závislosti na čase uchovávání. Zdá se tedy, že přítomnost leukocytárních reziduí u EAR/ERB tlumí uvolňování ATP. Naopak na hodnoty amoniaku, extracelulárního draslíku a LDH nemá přítomnost těchto reziduí vliv, i když rychlost změny je poněkud pomalejší u EAD/ERD. Tyto parametry podobně jako ostatní více odpovídají degradaci nevitálních erytrocytů a absence leukocytárních zbytků v transfúzní jednotce jejich hodnoty neovlivňuje nebo jen v nevýznamné míře.
Výsledky a závěry této studie naznačují, že příprava erytrocytů z odběru plné krve nebo metodou aferézy nemá významný vliv na sledované hematologické a biochemické parametry. Způsob odběru krve tedy na rozdíl od deleukotizace neovlivňuje stabilitu a kvalitu získaných erytrocytů, kryokonzervovaných a následně rekonstituovaných v roztoku AS-3 (Nutricel).
Závěrem lze konstatovat, že po odstranění leukocytů lze u kryokonzervovaných a následně rekonstituovaných erytrocytů očekávat příznivější hematologické a biochemické vlastnosti charakterizující kvalitu a stabilitu výsledného přípravku. Studie prokazuje výhodnost deleukotizace erytrocytů určených ke kryokonzervaci, bez ohledu na způsob odběru (z plné krve nebo aferézou), které jsou rekonstituovány v AS-3 (Nutricelu) a skladovány v prodloužené době až 21 dnů při teplotě 2–6 °C.
Grant
Výsledky této práce vychází z projektu výzkumu Ministerstva obrany České republiky, “Kryokonzervace erytrocytů – vybudování banky na dlouhodobou úschovu krve: Strategická krevní banka“, číslo 030121387.
pplk. MUDr. Miloš Bohoněk
Oddělení hematologie, biochemie a krevní transfuze
Ústřední vojenská nemocnice
U vojenské nemocnice 1200
160 00 Praha 6 – Střešovice
e-mail: milos.bohonek@uvu.cz
Zdroje
1. Hess JR, Thomas MJ. Blood use in war and disaster: lessons from the past century. Transfusion 2003 Nov; 43(11): 1622-33.
2. Bohoněk M, Chmátal P, Černohous M. Laboratoř a transfúzní služba 7. polní nemocnice, Trans hemat dnes 2003; 9(4): 185–8.
3. Chmátal P, Bohoněk M, Hašek R, Černohous M, Dobiášová M. 7. polní nemocnice AČR v jižním Iráku: Statistika odborné práce, aspekty zahraniční mise. Rozhl v chir 2004; 86(1): 37–40.
4. Bohoněk M. Vojenská transfúzní služba, Válečné vnitřní lékařství – Vybrané kapitoly z válečného vnitřního lékařství pro pregraduální studium, Učební texty FVZ UO, 2005, Svazek 341:17–34.
5. Chmátal P, Bohoněk M, Dobiášová M, Černohous M, Hašek R. A humanitarian mission in southern Iraq: utilization of the 7th Field Hospital of the Army of the Czech Republic—a report on its medical activities and working conditions, Mil Med 2005; 170(6): 473–5.
6. Bohoněk M, Petráš M, Turek I, et al. Parametry kvality kryokonzervovaných erytrocytů rekonstituovaných v roztoku AS-3 (Nutricel). Trans Hemat dnes 2006; 12(4): 208–216.
7. Nepublikovaná data ze Závěrečné zprávy: „Otevřené klinické hodnocení účinnosti erytrocytů z aferézy kryokonzerovaných rekonstituovaných v Nutricelu nebo SAG-M u zdravých dobrovolníků“, 18.8.2005
8. Hess JR. Red cell freezing and its impact on the supply chain. Transfus Med 2004; 14(1): 1–8. Review.
9. Valeri CR, Ragno G, Pivace LE, et al. An experiment with glycerol–frozen red blood cells store at -80 degrees C for up to 37 years. Vox Sang 2000; 79(3): 168–74.
10. Valeri CR, Ragno G, Pivacek LE, Srey R, Hess JR, Lippert LE, Mettille F, Fahie R, O’Neill EM, Szymanski IO. A multicenter study of in vitro and in vivo values in human RBCs frozen with 40-percent (wt/vol) glycerol and stored after deglycerolization for 15 days at 4 degrees C in AS-3: assessment of RBC processing in the ACP 215. Transfusion 2001; 41(7): 933–9.
11. Valeri CR., Pivacek LE., Cassidy GP., Ragno G. In vitro and in vivo measurements of human RBCs frozen with glycerol and subjected to various storage temperatures before deglycerolization and storage at 4°C for 3 days. Transfusion 2001; 41(3): 401–5.
12. Valeri CR, Ragno G, Pivacek L, O’Neill EM. In vivo survival of apheresis RBCs, frozen with 40-percent (wt/vol) glycerol, deglycerolized in the ACP 215, and stored at 4 degrees C in AS-3 for up to 21 days. Transfusion 2001; 41(7): 928–32.
13. Bandarenko N, Hay SN, Holmberg J, Whitley P, Taylor HL, Moroff G, Rose L, Kowalsky R, Brumit M, Rose M, Sawyer S, Johnson A, McNeil D, Popovsky MA. Extended storage of AS-1 and AS-3 leukoreduced red blood cells for 15 days after deglycerolization and resuspension in AS-3 using an automated closed system. Transfusion 2004; 44(11): 1656–62.
14. Valeri CR, Srey R, Tilahun D, Ragno G. The in vitro quality of red blood cells frozen with 40 percent (wt/vol) glycerol at -80 degrees C for 14 years, deglycerolized with the Haemonetics ACP 215, and stored at 4 degrees C in additive solution-1 or additive solution-3 for up to 3 weeks. Transfusion 2004; 44(7): 990–5.
15. Grose HL, Byrne KM, Salata JM, Rentas FJ, Stroncek DF. In vitro variables of red blood cell components collected by apheresis and frozen 6 and 14 days after collection. Transfusion 2006; 46(7): 1178–83.
16. Valeri CR, Pivacek LE, Cassidy GP, Ragno G. 24-hour 51Cr post-transfusion survival, 51Cr life span and haemolysis of red blood cells stored at 4 degrees C for 56 days in AS-3. Vox Sang 2001; 80(1): 48–50.
17. Gibson JG, Tullis JL, Tinch RJ, Ryan WR, Forte SD. The Post-thaw Viability of Ted Blood Cells of ACD and CPD Blood Preserved in the Frozen State with and without Added Adenine. Transfusion 1972; 12(3): 198–207.
18. Valeri CR, Valeri DA, Anastasi J, Vecchione JJ, Dennis RC, Emerson CP. Freezing in the primary polyvinlchloride Plastic Collection Bag: A New system for Preparing and Freezing Nonrejuvenated and Rejuvenated Red Blood Cells, Transfusion 1981; 21(2): 138–49.
19. Valeri CR, Pivace LE, Cassidy GP, Rango G. The survival, function, and hemolysis of human RBCs stored at 4°C in additive slution (AS-1, AS-3, or AS-5) for 42 days and then bochemimically modifie, frozen, thawe, washed, and stored at 4°C in sodium chloride and glucose solution for 24 hours. Transfusion 2000; 40(11): 1341–5.
20. Lecak J, Scott K, Young C, Hannon J, Acker JP. Evaluation of red blood cells stored at –80 degrees C in excess of 10 years. Transfusion 2004; 44(9): 1306–13.
21. Hess JR, Kagen LR, van der Meer PF, et al. Interlaboratory comparison of red-cell ATP, 2,3-diphosphoglycerate and haemolysis measurements. Vox Sang 2005; 89(1): 44–8.
22. Hess JR, Hill HR, Oliver CK, Lippert LE, Greenwalt TJ. The effect of two additive solutions on the postthaw storage of RBCs. Transfusion 2001; 41(7): 923–7.
23. Valeri CR, Pivacek LE, Cassidy GP, Ragno G. Posttransfusion survival (24-hour) and hemolysis of previously frozen, deglycerolized RBCs after storage at 4 degrees C for up to 14 days in sodium chloride alone or sodium chloride supplemented with additive solutions. Transfusion 2000; 40(11): 1337–40.
24. Valeri CR, Pivacek LE, Cassidy GP, Ragno G. In vitro and in vivo measurements of gamma-radiated, frozen, glycerolized RBCs. Transfusion 2001; 41(4): 545–9.
25. Dirk de Korte, Kleine M, Verhoeven A. Storage of red cell concentrates with maintenance of both 2,3-DPG and ATP, Poster, XXVIIIth. Congress of the International Socety of Blood Transfusion, Edinburgh 11-15th July 2004.
26. Lelkens CC, Noorman F, Koning JG, Truijens-de Lange R, Stekkinger PS, Bakker JC, Lagerberg JW, Brand A, Verhoeven AJ. Stability after thawing of RBCs frozen with the high- and low-glycerol method. Transfusion 2003; 43(2): 157–64.
27. Soli M, Blanco L, Riggert J, Martinez-Clavel A, Lucas C, Lunghi M, Belloni M, Wolf C, van Waeg G, Antoon M. A multicentre evaluation of a new filtration protocol for leucocyte depletion of high-haematocrit red blood cells collected by an automated blood collection system. Vox Sang 2001; 81(2): 108–12.
Štítky
Hematológia Interné lekárstvo OnkológiaČlánok vyšiel v časopise
Transfuze a hematologie dnes

2007 Číslo 4
- Nejasný stín na plicích – kazuistika
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
Najčítanejšie v tomto čísle
- Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
- Vyšetrovacie metódy krvných doštičiek – stručný prehľad
- Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
- Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
