-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pokroky v léčbě Ph pozitivní akutní lymfoblastické leukemie dospělých
Advances in treatment of Ph-positive adult acute lymphoblastic leukaemia
Philadelphia chromosome-positive (Ph+) acute lymphoblastic leukaemia (ALL) is the most common subtype of ALL in adults. The prognosis of adult patients with Ph+ ALL treated only with chemotherapy is poor, with a less than 10% probability of long-term survival. Therefore, allogeneic stem cell transplantation performed during the first remission is the recommended therapy. Recently, the availability of imatinib mesylate and other tyrosine kinase inhibitors and small molecules that affect the BCR-ABL signaling pathways has introduced a new therapeutic opportunity, and could change the treatment paradigm and prognosis for these patients.
Key words:
acute lymphoblastic leukemia, Philadelphia chromosome, treatment
Autoři: M. Doubek 1; J. Maaloufová 2; P. Žák 3; F. Folber 1; P. Cetkovský 2; J. Mayer 1
Působiště autorů: Kooperující pracoviště České leukemická skupiny – pro život (CELL, The Czech Leukemia Study Group – for Life) *; Interní hematoonkologická klinika LF MU a FN Brno, 2Ústav hematologie a krevní transfuze Praha *; 2. Interní klinika - oddělení klinické hematologie FN Hradec Králové 3
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 2, p. 55-61.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Akutní lymfoblastická leukemie (ALL) s pozitivním filadelfským chromozomem (Ph+) je nejčastějším podtypem ALL u dospělých. Prognóza dospělých pacientů s Ph+ ALL léčených pouze chemoterapií je velmi špatná. Dlouhodobě přežívá méně než 10 % těchto nemocných. Z tohoto důvodu je všem nemocným, u nichž je to možné, doporučována alogenní transplantace krvetvorných buněk v první kompletní remisi. Větší naději na vyléčení nemocným s Ph+ ALL dává kombinovaná léčba chemoterapií a imatinibem. Prognózu nemocných s Ph+ ALL by mohly zlepšit i další tyrozinkinázové inhibitory a malé molekuly, které ovlivňují Bcr-Abl signální dráhy.
Klíčová slova:
akutní lymfoblastická leukemie, filadelfský chromozom, léčbaÚvod
Akutní lymfoblastická leukemie (ALL) s filadelfským chromozomem (Ph+) tvoří u dospělých 20–30 % ALL (1). Translokace (9;22)(q34;q11), která je podstatou Ph chromozomu, je tak nejčastější chromozomální aberací u ALL. Incidence Ph+ ALL přibývá s věkem nemocných. U pacientů nad 50 let tvoří Ph+ ALL nad 50 % všech ALL (1, 2), zatímco u dětí s ALL lze Ph chromozom najít jen ve 3–4 % případů (3).
Přítomnost Ph chromozomu výrazně snižuje vyhlídky nemocného na dlouhodobé přežití, což je jednou z příčin, proč výsledky léčby ALL u dospělých nedosahují ani zdaleka příznivých výsledků léčby ALL jako u dětí (3).
Ph pozitivní ALL
Ph pozitivita je nalézána téměř výhradně jen u prekurzorových ALL nesoucích antigen CD10, tedy u common B-ALL a pre-B-ALL. Raritní zprávy o Ph pozitivních T-ALL prezentují spíše případy lymfoblastických zvratů chronické myeloidní leukemie než skutečné Ph+ ALL (2). Blasty Ph+ ALL na svém povrchu nesou kromě již zmíněného znaku CD10 ještě antigeny CD19, CD34 a často i některý myeloidní marker: CD13 či CD33 (2).
U Ph+ ALL hrozí, že během terapie nemoci dojde k infiltraci centrálního nervového systému (CNS), i když při stanovení diagnózy Ph+ ALL není infiltrace CNS nalézána častěji než u jiných ALL (4).
Prognóza pacientů s Ph+ ALL, kteří jsou léčeni pouze chemoterapií, je velmi špatná (5). Dlouhodobě přežívá méně než 10 % všech nemocných, i když dlouhodobé přežití všech pacientů s ALL je lepší a pohybuje se kolem 29–53 % (3, 6–9). To bylo ověřeno i pracemi českých autorů (10, 11). Medián celkového přežití nemocných s Ph+ ALL kolísá mezi 9–16 měsíci (2, 5, 12, 13), ačkoliv po indukční léčbě se dostane do kompletní hematologické remise 60–90 % pacientů, což je jen nepatrně menší počet ve srovnání s ostatními ALL (2, 5, 13). Zajímavé je, že prognóza common B-ALL bez Ph pozitivity je relativně dobrá, zatímco s Ph pozitivitou, jak vyplývá z výše uvedeného, nesmírně špatná. Celkové přežití Ph+ALL nepříznivě ovlivňuje vstupní leukocytóza nad 30x109/l. Věk nad 70 let snižuje přežití bez příznaku nemoci a procento kompletních remisí (12).
Obr. 1. Přežití bez příznaku nemoci (DFS) pacientů s Ph pozitivní akutní lymfoblastickou leukemií (ALL) po alogenní transplantaci krvetvorby. Srovnání pacientů transplantovaných v 1. kompletní remisi, ve 2. a 3. kompletní remisi a pacientů s refrakterní ALL. P = 0,0001. Převzato z Cornelissen a kol., 2001 (20). 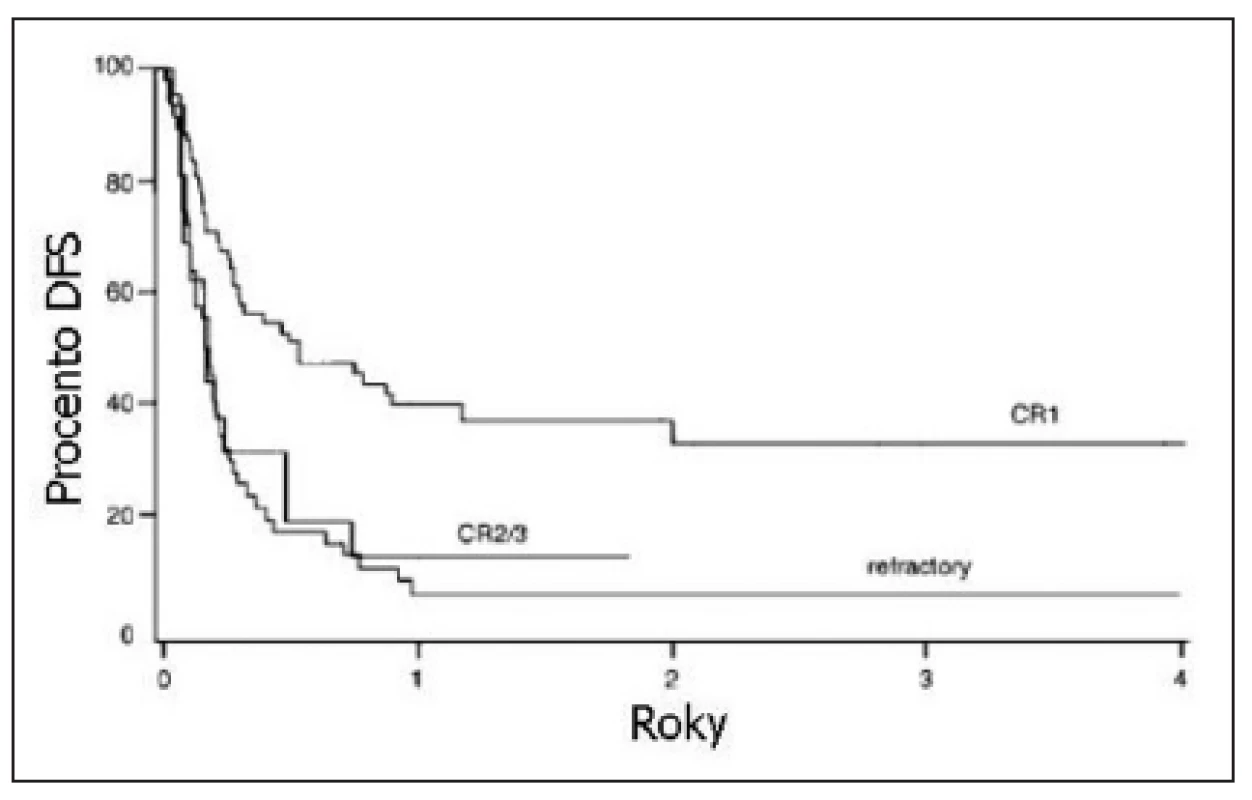
Ph chromozom je výsledkem translokace (9;22) (q34;q11), která vede ke vzniku fúzního genu BCR-ABL. Ten tvoří mRNA o 8,5 kb, z níž vzniká protein o 210 kDa, nebo mRNA o 7,5 kb, z níž vzniká protein o 190 kDa. p190 podtyp Ph+ ALL tvoří 70–75 % této leukemie, p210 podtyp zbylých 25–30 % (5, 14). Měření hladiny Bcr-Abl transkriptu je vynikajícím nástrojem ke sledování zbytkové nemoci u Ph+ ALL (15).
Pacienti s Ph+ ALL a transkriptem p190 mají prognózu lepší, než pacienti s transkriptem p210, i když procento kompletních remisí je po indukční terapii u obou skupin nemocných stejné. Pacienti s transkriptem p190 mají při diagnóze nižší počty leukocytů v periferní krvi a vyšší zastoupení exprese znaků CD34 a CD33 (16).
Transplantace krvetvorných buněk (HSCT) a Ph pozitivní ALL
Vzhledem k neuspokojivým výsledkům léčby konvenční chemoterapií, by měli být pacienti s Ph+ ALL konsolidováni alogenní HSCT už v 1. kompletní remisi. Bohužel ale jen asi 30 % nemocných s Ph+ ALL má dárce nebo může alogenní HSCT podstoupit (17). Dlouhodobě podle různých prací přežívá 27–68 % pacientů s Ph+ ALL, kteří byli alogenně transplantováni v 1. kompletní remisi (17, 18, 19, 20). Je-li HSCT provedena ve 2. kompletní remisi nebo u nemocných s floridním onemocněním, pohybuje se pravděpodobnost dlouhodobého přežití mezi 5–17 % (20, 21). Většina úmrtí po alogenní HSCT ale nejde na vrub relapsu nemoci (jen 30 % úmrtí souvisí s relapsem), nýbrž na toxicitu spojenou s transplantační léčbou (20). Větší intenzita přípravného transplantačního režimu nevede u Ph+ ALL k významnému zlepšení výsledků HSCT (22).
Autologní HSCT s následnou perorální udržovací terapií nebo bez ní, jako alternativa transplantace alogenní, dává 1/3 až 1/2 pacientů s Ph negativní ALL, nemají-li alogenního dárce, relativně dobrou naději na vyléčení onemocnění (10, 23–25). Proto byla autologní HSCT zkoušena i v konsolidační léčbě Ph+ ALL. Německá data hovoří až o 22 % dlouhodobě přežívajících (medián 52 měsíců) nemocných s Ph+ ALL po autologní transplantaci čištěné kostní dřeně nebo krvetvorných buněk z periferní krve (26). Z dlouhodobého hlediska ale nejsou výsledky autologních HSCT u Ph+ ALL dobré (2), ačkoliv španělská pracovní skupina neprokázala u vysoce rizikových ALL lepší přežití při konsolidaci alogenní transplantací ve srovnání s konsolidací autologní transplantací nebo léčbou udržovací chemoterapií (27). V současné době nicméně není autologní HSCT léčbou, která by jakkoliv zlepšovala prognózu pacientů s Ph+ ALL (2). Teoreticky by tato léčba mohla mít význam u pacientů s Ph+ALL, kteří dosáhli terapií imatinibem nebo jiným inhibitorem BCR-ABL molekulární remise a jejichž autologní štěp je odebrán v době této remise. Nicméně zatím jde pouze o spekulace.
Imatinib a Ph pozitivní ALL
Nesmírně povzbudivé výsledky léčby chronické myeloidní leukemie (CML) imatinibem vedly u pacientů s refrakterní nebo relabovanou Ph+ ALL k iniciování řady studií fáze I a II (28, 29).
Imatinib v monoterapii je schopen u pacientů s Ph+ ALL navodit vysoké procento kompletních remisí (CR), ale tyto remise trvají jen krátkou dobu. Podle Ottmanna a kol. dochází k progresi onemocnění u pokročilých Ph+ ALL (refrakterních na klasickou terapii nebo relabovaných) po léčbě imatinibem v mediánu 2,2 měsíce. Medián celkového přežití je jen 4,9 měsíce (29). Zajímavé je, že imatinib je v monoterapii účinnější u myeloblastického zvratu CML ve srovnání se zvratem lymfoblastickým a s Ph+ ALL (28) (obr. 2). Výsledky léčby Ph+ ALL monoterapií imatinibem především starších nemocných, shrnuje tabulka 1. Pouze nemocní, kteří po dosažení remise imatinibem podstoupí alogenní HSCT, mají větší naději na vyléčení. Wassmannová a kol. (32) publikovali, že po léčbě imatinibem a následné alogenní transplantaci krvetvorby provedené v kompletní remisi po imatinibu, bylo 9měsíční přežití bez příznaku nemoci 51 %. Práce zabývající se alogenní transplantací krvetvorby po léčbě imatinibem u Ph+ ALL ukazuje tabulka 2.
Obr. 2. Doba do relapsu nemoci pacientů s myeloblastickým zvratem chronické myeloidní leukemie a pacientů s lymfoblastickým zvratem chronické myeloidní leukemie či Ph pozitivní akutní lymfoblastickou leukemií. Převzato z Druker a kol., 2001 (28). 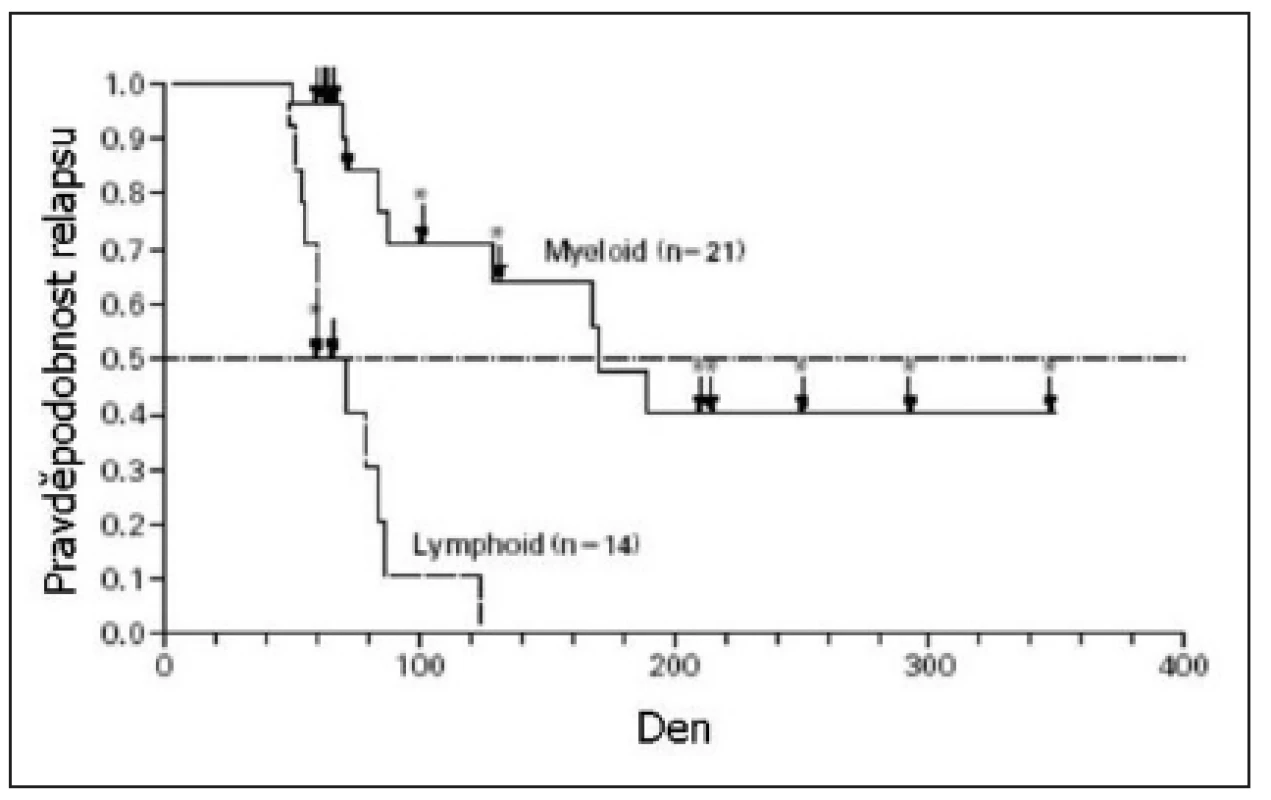
Tab. 1. Imatinib v monoterapii v léčbě Ph pozitivní akutní lymfoblastické leukemie dospělých. CR – kompletní remise, SCT – transplantace krvetvorných buněk. 
Tab. 2. Imatinib v monoterapii s následnou alogenní transplantací krvetvorby u Ph pozitivní akutní lymfoblastické leukemie dospělých. 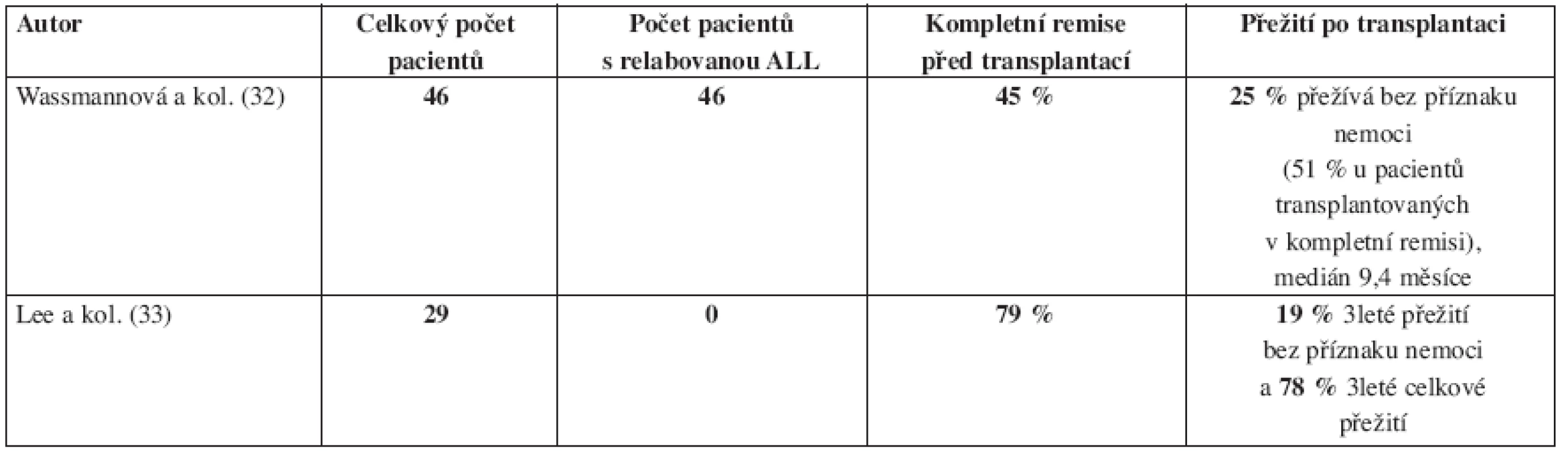
Vzhledem k těmto nedobrým výsledkům, srovnáme-li je s efektem imatinibu u CML, byly zahájeny studie kombinující imatinib s chemoterapií. Výsledky těchto prací, publikované v nedávné době, jsou daleko povzbudivější (tab. 3). Většina prací jasně ukazuje, že imatinib má s chemoterapií synergický účinek a snižuje rozvoj sekundárních rezistencí (34–36). Velmi povzbudivé výsledky, 84 % přežívajících 2 roky od stanovení diagnózy, prezentuje především japonská pracovní skupina pro léčbu ALL (JALSG) (35). Pouze britská studijní skupina UKALL/-/ECOG neprokázala lepší přežití pacientů léčených imatinibem s chemoterapií při srovnání s historickými kontrolami. Výsledky jsou ale zkresleny vysokou transplantační mortalitou alogenně transplantovaných pacientů, kteří byli po léčbě imatinibem a chemoterapií následně alogenně transplantováni (37). Také JALSG udává horší přežívání nemocných konsolidovaných po kombinované léčbě imatinibem s chemoterapií alogenní transplantací krvetvorby ve srovnání s netransplantovanými (52 % versus 84 % ve dvou letech) (35). Přes tyto celkově optimistické výsledky zatím nelze říci, jaké je optimální schéma kombinující chemoterapii s imatinibem (2). Otazníky provázejí také podávání imatinibu v konsolidační léčbě ALL. Některé práce prokazují, že imatinib je účinný zejména v indukční léčbě, zatímco imatinib podaný během konsolidace už nezvyšuje procento kompletních molekulárních remisí (38).
Tab. 3. Imatinib v kombinaci s chemoterapií v léčbě Ph pozitivní akutní lymfoblastické leukemie dospělých. Studie velkých světových pracovních skupin na akutní lymfoblastickou leukemii. CR – kompletní remise, SCT – transplantace krvetvorných buněk. 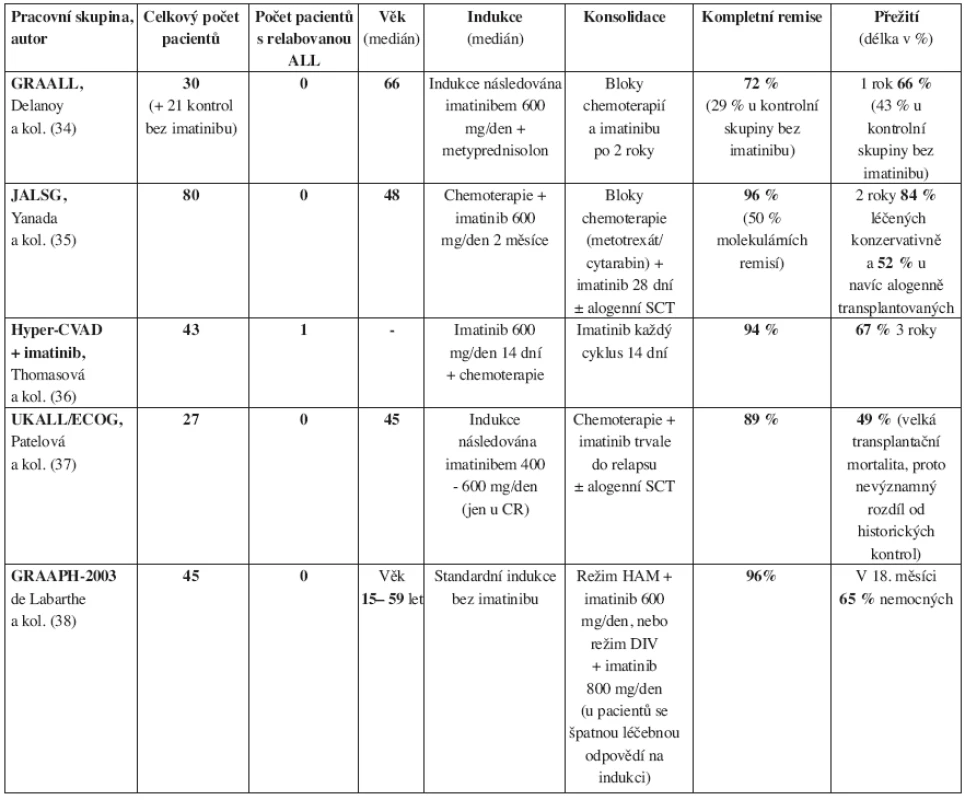
Primární rezistence na imatinib je definována jako nedosažení kompletní remise při léčbě imatinibem. Sekundární rezistence je definována jako relaps po dosažení CR i přes pokračující léčbu imatinibem. Mechanismů vzniku rezistence je mnoho. Sekundární rezistence je často spojena se vznikem bodové mutace tyrozinkinázové domény Bcr-Abl. Při relapsu Ph+ ALL po imatinibu se v mnoha případech objevuje mutace Bcr-Abl T315I (2, 39).
Pro léčebnou strategii má u Ph+ ALL význam detekce minimální zbytkové nemoci (MRD) v průběhu terapie (15). Pozitivita MRD u pacientů s Ph+ ALL po léčbě je spojená s velmi vysokou pravděpodobností relapsu. Ve studii Radicha a kol. (40) relabovalo z 23 nemocných, u kterých se po transplantaci krvetvorby vyskytla aspoň 1 PCR pozitivita Bcr-Abl, 10 pacientů v mediánu 94 dní od prvního výskytu pozitivity MRD, zatímco ve skupině 13 nemocných, u nichž nebyla přítomnost MRD prokázána, relabovali jen 2. Sledování MRD se tak jeví jako jeden z nejdůležitějších nástrojů k posouzení výsledků terapie. Pokud je u pacientů detekována pozitivita MRD po léčbě nebo transplantaci, je možné ji ovlivnit aplikací imatinibu nebo podáním lymfocytů dárce. Studie fáze II, která zkoušela imatinib v léčbě molekulárních relapsů po alogenní transplantaci krvetvorby prokázala, že imatinib v dávce 400 mg denně vedl u 14 (52 %) nemocných z 27 k opětovnému vymizení Bcr-Abl pozitivity v mediánu 1,5 měsíce. Šlo o dlouhodobé remise. Žádný z pacientů nezrelaboval po celou dobu podávání imatinibu. Zajímavé je, že tato studie neprokázala efekt podání lymfocytů dárce (DLI) na oddálení relapsu nemoci. Nicméně DLI bylo podáno jen 5 nemocným (41). Výsledky studie shrnuje obrázek 3. Na druhou stranu je nutno říci, že byly publikovány i ojedinělé zprávy o efektu DLI u pacientů s relabovanou Ph+ ALL po alogenní transplantaci (42). Pokles hladiny Bcr-Abl transkriptu v periferní krvi pod 10-4po 2 týdnech léčby imatinibem a v kostní dřeni po 4 týdnech léčby imatinibem na hodnoty pod 10-2 má pozitivní prediktivní význam pro příznivý výsledek terapie (43).
Obr. 3. Celkové přežití (OS) a přežití bez příznaku nemoci (DFS) u alogenně transplantovaných pacientů s Ph+ ALL, u nichž došlo po transplantaci k molekulárnímu relapsu nemoci, který byl léčen imatinibem. Převzato z Wassmannová a kol., 2005 (41). 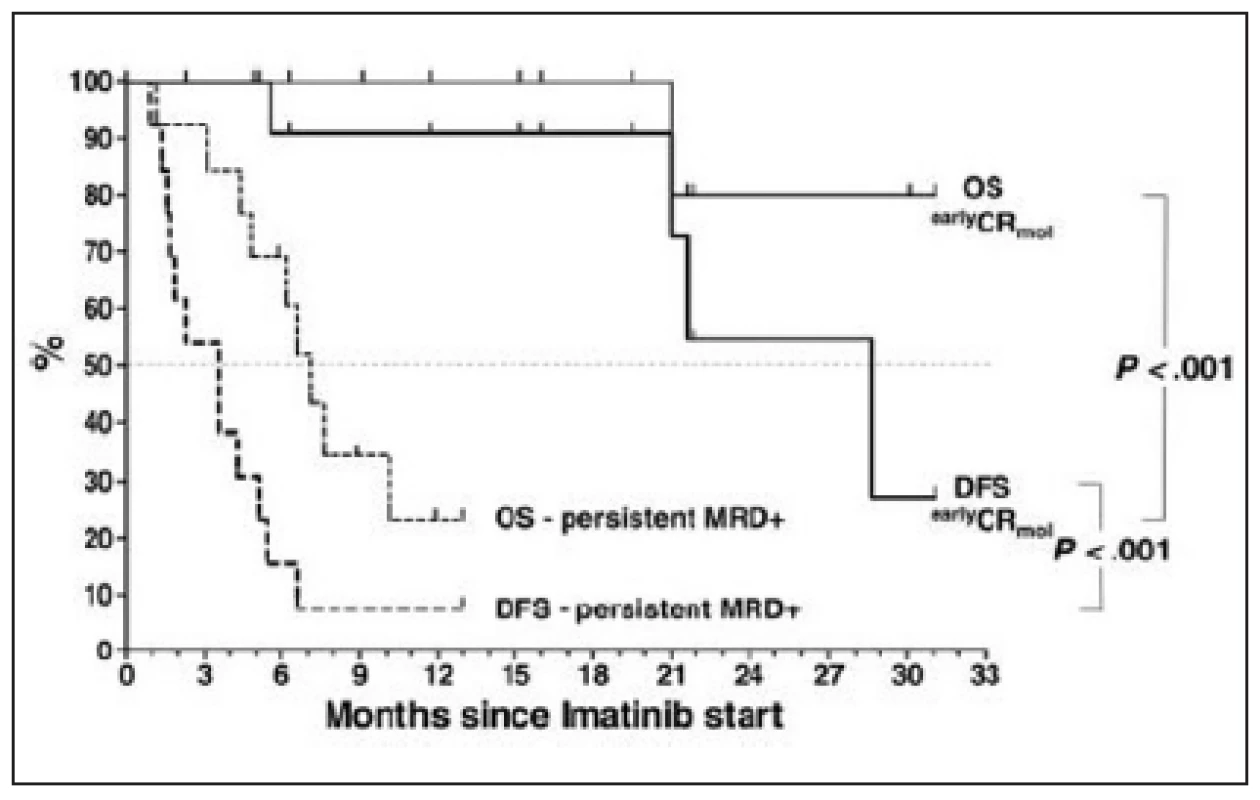
Léčba Ph pozitivní ALL podle současných protokolů Německé pracovní skupiny pro léčbu ALL
Německá pracovní skupina pro léčbu ALL (GMALL) je skupinou, která se léčbě ALL dospělých věnuje nepřetržitě už více než 25 let. Jde o skupinu, která na poli ALL publikovala řadu originálních a prvotních poznatků, které jsou dnes již rutinní součástí léčby ALL v celosvětovém měřítku. GMALL je také vůdčím subjektem v rámci Evropské pracovní skupiny pro ALL (EWALL). Z tohoto důvodu si dovolujeme popsat pohled GMALL na léčbu Ph+ ALL dospělých.
Podle posledního protokolu GMALL pro léčbu Ph+ ALL jsou pacienti randomizováni do dvou větví. V první větvi dostávají klasické indukční a konsolidační chemoterapie podle protokolu na léčbu ALL dospělých doplněnou o imatinib v dávce 600 mg denně po celou dobu terapie až do provedení alogenní transplantace. Pacienti ve druhé větvi jsou léčeni klasickými indukčními a konsolidačními cykly bez imatinibu. Imatinib se nasazuje až po provedení alogenní transplantace. Je-li u těchto pacientů po transplantaci MRD pozitivní, pacienti by měli být léčení imatinibem v dávce 400 mg denně 6 týdnů, nedojde-li k vymizení MRD pak následujících 6 týdnů v dávce 600 mg, a pokud i po dalších 6 týdnech MRD nevymizí, měl by být imatinib zvýšen na 800 mg denně a přidáno DLI. Je-li po alogenní transplantaci negativní MRD a pacienti nemají známky nemoci štěpu proti hostiteli stupně III a IV, mělo by následovat třikrát podání DLI (44).
Léčba relapsu Ph pozitivní ALL a léčba postižení CNS
Relaps Ph+ ALL je jednou z nejhůře řešitelných situací v hematologii. Pokud je to možné, měli by být alogenně transplantováni všichni nemocní s relabovanou Ph+ ALL, byť alogenní transplantace dovoluje vyléčit jen menšinu nemocných (2). K úspěchu alogenní transplantace je třeba, aby byla dosažena kompletní hematologické remise ještě před provedením transplantace (32). Čím později dojde k relapsu Ph+ ALL, tím lepší výsledky lze očekávat od záchranné chemoterapie (2).
V minulosti byl k udržení remise Ph+ ALL po autologní HSCT nebo jako součást standardní udržovací terapie k posílení remise podáván interferon alfa (IFNα) (45). Visani a kol. (46) dosáhli u pacienta ve třetím relapsu Ph+ ALL rezistentním na imatinib kompletní molekulární remisi kombinací IFNα (3x týdně 1 MU podkožně) s imatinibem. Wassmannová a kol. (47) referovali o 6 nemocných, kteří nemohli podstoupit alogenní transplantaci krvetvorby a kterým byl k terapii imatinibem přidán IFNα. Všichni nemocní měli pozitivní MRD, jeden byl refrakterní na imatinib. 2 z pacientů dosáhli kompletní hematologickou a molekulární remisi.
Jak už bylo řečeno, u Ph+ ALL hrozí, že během terapie nemoci dojde k infiltraci CNS, i když při stanovení diagnózy Ph+ ALL není infiltrace CNS nalézána častěji než u jiných ALL (4). Koncentrace imatinibu v mozkomíšním moku dosahují jen 1–2 % koncentrací v séru, nedosahují tedy terapeutických hodnot (48). Intratekální profylaxe relapsů v CNS je proto u Ph+ ALL nezbytnou součástí terapie (2).
Další tyrozinkinázové inhibitory a nové léčebné možnosti u Ph pozitivní ALL
V roce 2006 byla publikována data studií fáze II, ve kterých byl u relabovaných a refrakterních Ph+ ALL a blastických zvratů CML zkoušen dasatinib (BMS354825) a nilotinib (AMN107).
Dasatinib v dávce 15–240 mg denně u Ph+ ALL a v lymfoblastickém zvratu CML navodí 70 % kompletních hematologických remisí a 30 % kompletních cytogenetických remisí. Medián doby do progrese nemoci je při této léčbě asi 120 dní (49). Nilotinib v dávce 400–800 mg denně navodil dřeňovou remisi u 1 z 9 léčených nemocných s lymfoblastickým zvratem CML rezistentním na imatinib. U nemocného v hematologické remisi bylo dosaženo i kompletní cytogenetické remise (50).
V léčbě Ph+ ALL jsou dále zkoušeny inhibitory farnesyltransferázy (51) a inhibitory fosfatidylinositol-3 kinázy (52). Nemocní s Ph+ ALL a mutací T315I by mohli profitovat z aplikace nového kinázového inhibitoru MK-0457 (53).
Závěr
V současnosti je imatinib (v dávce 600 mg denně) kombinovaný s chemoterapií léčbou první volby u Ph+ ALL. Po navození kompletní remise by měli být všichni mladší nemocní, mají-li dárce kostní dřeně, alogenně transplantováni. V případě molekulárního relapsu nemoci po předešlém dosažení kompletní molekulární remise je imatinib lékem první volby.
Došlo do redakce: 30. 1. 2008
Přijato: 10. 3. 2008
Doc. MUDr. Michael Doubek, PhD.
Interní hematoonkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail: mdoubek@fnbrno.cz
Zdroje
1. Radich JP. Philadelphia chromosome-positive acute lymphoblastic leukemia. Hematol Oncol Clin North Am 2001; 15 : 21–36.
2. Ottmann OG, Wassmann B. Treatment of Philadelphia chromosome-positive acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program 2005; 118–122.
3. Pui Ch-H, Evans WE. Treatment of acute lymphoblastic leukemia. N Engl J Med 2006; 354 : 166–178.
4. Hoelzer D, Gökbuget N. Recent approaches in acute lymphoblastic leukemia in adults. Crit Rev Oncol Hematol 2000; 36 : 49–58.
5. Dombret H, Gabert J, Boiron JM, et al. Outcome of treatment in adults with Philadelphia chromosome-positive acute lymphoblastic leukemia - results of the prospective multicenter LALA-94 trial. Blood 2002; 100(7): 2357–2366.
6. Annino L, Vegna ML, Camera A, et al. Treatment of adult acute lymphoblastic leukemia (ALL): long-term follow-up of the GIMEMA ALL 0288 randomized study. Blood 2002; 99 : 863–871.
7. Linker C, Damon L, Ries C, Navarro W. Intensified and shortened cyclical chemotherapy for adult acute lymphoblastic leukemia. J Clin Oncol 2002; 20 : 2464–2471.
8. Kantarjian H, Thomas D, O’Brien S, et al. Long-term follow-up results of hyperfractionated cyclophosphamide, vincristine, doxorubicin, and dexamethasone (Hyper-CVAD), a dose-intensive regimen, in adult acute lymphoblastic leukemia. Cancer 2004; 101 : 2788–2801.
9. Larson RA, Dodge RK, Burns P, et al. A five-drug remission induction regimen with intensive consolidation for adults with acute lymphoblastic leukemia: cancer and leukemia group B study 8811. Blood 1995; 85 : 2025–2037.
10. Doubek M, Mayer J, Kořístek Z, et al. Terapie akutní lymfoblastické leukemie dospělých kombinací sedmi chemoterapeutik v indukční léčbě, intenzivní konzolidací s autologní transplantací kmenových buněk krvetvorby nebo bez ní a s následnou udržovací léčbou. Čas Lék Česk 2002; 141(4): 122–126.
11. Maaloufová J, Pytlík R, Gregora E, Procházka B, Kozák T. Léčba akutních lymfoblastických leukémií u dospělých: možnost intenzifikace protokolu CALGB 8811 vysokodávkovaným cytosinarabinosidem a metotrexátem. Trans Hemat dnes 2002; 8 : 4–12.
12. Houot R, Tavernier E, Le QH, et al. Philadelphia chromosome-positive acute lymphoblastic leukemia in the elderly: prognostic factors and treatment outcome. Hematology 2004, 9 : 369–376.
13. Kantarjian HM, O’Brien S, Smith TL, et al. Results of treatment with hyper-CVAD, a dose-intensive regimen, in adult acute lymphocytic leukemia. J Clin Oncol 2000; 18(3): 547–561.
14. Shtivelman E, Gale RP, Dreazen O, et al. Bcr-Abl RNA in patients with chronic myelogenous leukemia. Blood 1987; 69 : 971–973.
15. Trka J, Zuna J, Haškovec C, et al. Detekce BCR/ABL, MLL/AF4 a TEL/AML1 hybridních genů a monitorování minimální zbytkové nemoci u pediatrických pacientů s akutní lymfoblastickou leukemií. Čas lék česk 1999; 138 : 12–17.
16. Cimino G, Pane F, Elia L, et al. The role of BCR/ABL isoforms in the presentation and outcome of patients with Philadelphia-positive acute lymphoblastic leukemia: a seven-year update of the GIMEMA 0496 trial. Haematologica/Hematol J 2006; 91 : 377–380.
17. Avivi I, Goldstone AH. Bone marrow transplant in Ph+ ALL patients. Bone Marrow Transplant 2003; 31(8): 623–632.
18. Attal M, Blaise D, Marit G, et al. Consolidation treatment of adult acute lymphoblastic leukemia: a prospective, randomized trial comparing allogeneic versus autologous bone marrow transplantation and testing the impact of recombinant interleukin-2 after autologous bone marrow transplantation. Blood 1995; 86 : 1619–1628.
19. Dunlop LC, Powels R, Singhal S, et al. Bone marrow transplantation for Philadelphia chromosome-positive acute lymphoblastic leukemia. Bone Marrow Transplant 1996; 17 : 365–369.
20. Cornelissen JJ, Carston M, Kollman C, et al. Unrelated marrow transplantation for adult patients with poor-risk acute lymphoblastic leukemia: strong graft-versus-leukemia effect and risk factors determining outcome. Blood 2001; 97(6): 1572–1577.
21. Camera A, Annino L, Chiurazzi F, et al. GIMEMA ALL – rescue 97: a salvage strategy for primary refractory or relapsed adult acute lymphoblastic leukemia. Haematologica 2004; 89 : 145–153.
22. Kröger N, Krüger W, Wacker-Backhaus G, et al. Intensified conditioning regimen in bone marrow transplantation for Philadelphia chromosome-positive acute lymphoblastic leukemia. Bone Marrow Transplant 1998; 22 : 1029–1033.
23. Doney K, Buckner CD, Fisher L, et al. Autologous bone marrow transplantation for acute lymphoblastic leukemia. Bone Marrow Transplant 1993; 12 : 315–321.
24. Wiesdorf DJ, Billett AL, Hannan P, et al. Autologous versus unrelated allogeneic marrow transplantation for acute lymphoblastic leukemia. Blood 1997; 90 : 2962–2968.
25. Powels R, Mehta J, Singhal S, et al. Autologous bone marrow or peripheral blood stem cell transplantation followed by maintenance chemotherapy for adult acute lymphoblastic leukemia in first remission: 50 cases from a single center. Bone Marrow transplant 1995; 16 : 241–247.
26. Martin H, Atta J, Klein SA, et al. Autologous BMT/PBSCT in 40 patients with Bcr-Abl positive acute lymphoblastic leukemia: long-term follow-up of a GMALL study. Hematol J 2001; I: 187.
27. Ribera J-M, Oriol A, Bethencourt C, et al. Comparison of intensive chemotherapy, allogeneic or autologous stem cell transplantation as post-remission treatment for adult patients with high-risk acute lymphoblastic leukemia. Results of the PETHEMA ALL-93 trial. Haematologica 2005; 90 : 1346–1353.
28. Druker BJ, Sawyers CL, Kantarjian HM, et al. Activity of a specific inhibitor of the BCR–ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med 2001; 344 : 1038–1042.
29. Ottmann OG, Druker BJ, Sawyers CL, et al. A phase 2 study of imatinib in patients with relapsed or refractory Philadelphia chromosome-positive acute lymphoid leukemias. Blood 2002; 100 : 1965–1971.
30. Pfeifer H, Ottmann O, Goekbuget N, et al. A randomized phase II study of a single-agent imatinib versus chemotherapy in elderly patients with Philadelphia-positive acute lymphoblastic leukemia (Ph+ALL) including analysis of resistance patterns. Blood 2005; 106(11): Abstract# 1824.
31. Vignetti M, Fazi P, Meloni G, et al. Dramatic improvement in CR rate and CR duration with imatinib in adult and elderly Ph+ ALL patients: results of the GIMEMA prospective study LAL0201. Blood 2004; 104: Abstract# 2739.
32. Wassmann B, Pfeifer H, Scheuring U, et al. Therapy with imatinib mesylate (Glivec) preceding allogeneic stem cell transplantation (SCT) in relapsed or refractory Philadelphia-positive acute lymphoblastic leukemia (Ph+ ALL). Leukemia 2002; 16 : 2358–2365.
33. Lee S, Kim YJ, Min CK, et al. The effect of first-line imatinib interim therapy on the outcome of allogeneic stem cell transplantation in adults with newly diagnosed Philadelphia chromosome-positive acute lymphoblastic leukemia. Blood 2005; 105(9): 3449–3457.
34. Delanoy A, Delabesse E, Lheritier V, et al. Imatinib and methylprednisolone alternated with chemotherapy improve the outcome of elderly patients with Philadelphia-positive acute lymphoblastic leukemia: results of the GRAALL AFR09 study. Leukemia 2006; 20(9): 1526–1532.
35. Yanada M, Takeuchi J, Sugiura I, et al. High complete remission rate and promising outcome by combination of imatinib and chemotherapy for newly diagnosed BCR-ABL-positive acute lymphoblastic leukemia. Blood 2005; 106(11): Abstract# 1827.
36. Thomas DA, Faderl S, Cortes J, et al. Outcome with the hyper-CVAD and imatinib mesylate regimen in Philadelphia (Ph) positive acute lymphocytic leukemia (ALL). Blood 2005; 106(11): Abstract# 1830.
37. Patel B, Goldstone AH, Ross P, et al. The impact of imatinib therapy on adult Philadelphia positive acute lymphoblastic leukemia (ALL): early results from the UKALL12/ECOG 2993 study. Blood 2005; 106(11): Abstract# 1839.
38. de Labarthe A, Rousselot P, Huguet-Rigal F, et al. Imatinib combined with induction or consolidation chemotherapy in patients with de novo Philadelphia chromosome-positive acute lymphoblastic leukemia: results of the GRAAPH-2003 study. Blood 2007; 109(4): 1408–1413.
39. Hofmann WK, Komor M, Hoelzer D, Ottmann OG. Mechanisms of resistance to STI571 (imatinib) in Philadelphia-chromosome positive acute lymphoblastic leukemia. Leuk Lymphoma 2004; 45 : 655–660.
40. Radich J, Gehly G, Lee A, Avery R, et al. Detection of Bcr-Abl transcripts in Philadelphia chromosome-positive acute lymphoblastic leukemia after marrow transplantation. Blood 1997; 89(7): 2602–2609.
41. Wassmann B, Pfeifer H, Stadler M, et al. Early molecular response to posttransplantation imatinib determines outcome in MRD+ Philadelphia-positive acute lymphoblastic leukemia (Ph+ ALL). Blood 2005; 106(2): 458–463.
42. Keil F, Kalhs P, Haas OA, et al. Relapse of Philadelphia chromosome positive acute lymphoblastic leukemia after marrow transplantation: sustained molecular remission after early and dose-escalating infusion of donor leucocytes. Br J Haematol 1997; 97 : 161–164.
43. Scheuring UJ, Pfeifer H, Wassmann B, et al. Early minimal residual disease (MRD) analysis during treatment of Philadelphia chromosome/Bcr-Abl-positive acute lymphoblastic leukemia with the Abl-tyrosine kinase inhibitor imatinib (STI571). Blood 2003; 101 : 85–90.
44. Ottmann OG, Gökbuget N, Wassmann B, Hoelzer D. An open phase II-study to determine the safety and efficacy of imatinib (STI571) in conjunction with induction chemotherapy in patients with newly diagnosed Ph+/BCR-ABL+ acute lymphoblastic leukemia (Ph+ ALL) or with minimal residual disease (MRD) after stem cell transplantation. Protocol GMALL-STI571/MRD-01/01. Amendment 3, version 01.02.2005
45. Visani G, Martinelli G, Piccaluga P, et al. Alpha-interferon improves survival and remission duration in P-190BCR-ABL positive adult acute lymphoblastic leukemia. Leukemia 2000; 14 : 22–27.
46. Visani G, Isidori A, Malagola M, et al. Efficacy of imatinib mesylate (STI571) in conjunction with alpha-interferon: long-term quantitative molecular remission in relapsed p190 BCR-ABL positive acute lymphoblastic leukemia. Leukemia 2002; 16 : 2159–2160.
47. Wassmann B, Scheuring U, Pfeifer H, et al. Efficacy and safety of imatinib mesylate (Glivec) in combination with interferon-alpha (IFN-alpha) in Philadelphia chromosome-positive acute lymphoblastic leukemia (Ph+ALL). Leukemia 2003;17(10):1919–1924.
48. Pfeifer H, Wassmann B, Hofmann WK, et al. Risk and prognosis of central nervous system leukemia in patients with Philadelphia chromosome-positive acute leukemias treated with imatinib mesylate. Clin Cancer Res 2003; 9(13): 4674–4681.
49. Talpaz M, Shah NP, Kantarjian HM, et al. Dasatinib in imatinib-resistant Philadelphia chromosome-positive leukemias. N Engl J Med 2006; 354 : 2531–2541.
50. Kantarjian HM, Giles F, Wunderle L, et al. Nilotinib in imatinib-resistant CML and Philadelphia chromosome-positive ALL. N Engl J Med 2006; 354 : 2542–2551.
51. Hoover RR, Mahon FX, Melo JV, Daley GQ. Overcoming STI571 resistance with the farnesyl transferase inhibitor SCH66336. Blood 2002; 100 : 1068–1071.
52. Klejman A, Rushen L, Morrione A, Slupianek A, Skorski T. Phosphatidylinositol-3 kinase inhibitor enhance the anti-leukemia effect of STI571. Oncogene 2002; 21 : 5868–5876.
53. Giles F, Cortes J, Jones D, et al. MK-0457, a novel kinase inhibitor, is active in patients with chronic myeloid leukemia or acute lymphocytic leukemia with the T315I BCR-ABL mutation. Blood 2006, First Edition Paper, DOI 10.1182/blood-2006-05-025049.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2008 Číslo 2- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Potenciál inhibitorů deacetyláz histonů (HDACi) v léčbě dětské TEL/AML1 pozitivní akutní lymfoblastické leukemie
- Pokroky v léčbě Ph pozitivní akutní lymfoblastické leukemie dospělých
- Esenciální trombocytemie v dětském věku
- Analýza záznamů Národního onkologického registru z období let 1977–2002 o akutních leukemiích ve světle dat klinického registru akutních leukemií (ALERT) Leukemické sekce ČHS ČLS JEP a literárních údajů
- Aktuální pohled na udržovací terapii rituximabem („rituximab-maintenance“) u folikulárního lymfomu
- Kontroly správné výrobní praxe v krevních bankách
- Transientní antigenemie HBsAg po očkování vakcínou proti hepatitidě B u dárkyně krve
- Doporučení České myelomové skupiny (CMG) pro zajištění časné diagnostiky mnohočetného myelomu v podmínkách ambulantní klinické praxe
- Výběr z tisku a zprávy o knihách
- Gratulujeme
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Esenciální trombocytemie v dětském věku
- Transientní antigenemie HBsAg po očkování vakcínou proti hepatitidě B u dárkyně krve
- Kontroly správné výrobní praxe v krevních bankách
- Pokroky v léčbě Ph pozitivní akutní lymfoblastické leukemie dospělých
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



