-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Denzita exprese cílového antigenu CD20 a CD52 ve vztahu k terapii monoklonální protilátkou u pacientů s chronickou lymfocytární leukemií
Level of expression of target antigens CD20 and CD52 in relation to the therapy with monoclonal antibodies in patients with chronic lymphocytic leukemia
Introduction:
The treatment with monoclonal antibodies represents an effective treatment of chronic lymphoproliferative diseases. Most often, rituximab (anti-CD20 monoclonal antibody) and alemtuzumab (anti-CD52 monoclonal antibody) are used in the treatment of CLL. Based on in vitro tests and clinical response of malignancies with high level of antigen expression (e.g. CD20 in follicular lymphoma or CD52 in T-prolymphocytic leukemia) it was suggested that the level of target antigen expression is one of the important factors for therapeutic response to monoclonal antibodies. In this article, we describe the patients with diagnosis of CLL who were treated at our Department and in whom the levels of expression of CD20 and CD52 antigens were determined.Patients and methods:
Samples of peripheral blood of 8 patients were analyzed by quantitative flow cytometry. The expression of CD20 and CD52 antigens was expressed in MESF units. Patients were treated with related monoclonal antibodies and the response was evaluated according to NCI-WG criteria.Results:
In the group of patients with CD20 expression below 43 000 MESF (median value determined for CLL in our previous work) either the therapeutic response was not reached or it was short lasting. In patients with CD20 expression above this level, three of them reached therapeutic response. Of the three patients with determined CD52 expression, only the patient with CD52 above 445 000 MESF (median value for CLL) reached the complete response.Conclusions:
Because of small pilot group of patients and complexity of the problem, we cannot draw any definitive conclusions supported by statistical analysis. However, the possible relation of levels of target antigens with the therapeutic outcome of treatment with particular monoclonal antibody will require further research.Key words:
chronic lymphocytic leukemia, quantitative flow cytometry, CD20, CD52, rituximab, alemtuzumab
Autoři: M. Klabusay; M. Pevná; V. Nováková; Y. Brychtová; J. Mayer
Působiště autorů: Interní hematoonkologická klinika, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 1, p. 17-22.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod:
Léčba monoklonálními protilátkami představuje účinnou součást léčby chronických lymfoproliferativních nemocí. K nejvíce využívaným monoklonálním protilátkám u chronické lymfocytární leukemie patří rituximab (anti-CD20 protilátka) a alemtuzumab (anti-CD52 protilátka). Na základě in vitro testů a klinických zkušeností ukazujících na vysokou léčebnou odpověď u hematologických malignit s vysokou expresí cílového antigenu jako je folikulární lymfom (CD20) nebo T-prolymfocytární leukemie (CD52) se předpokládá, že míra exprese cílového antigenu může být jedním z faktorů určujícím úspěšnost terapie monoklonální protilátkou. Z tohoto důvodu bylo cílem naší práce analyzovat míru exprese antigenů CD20 a CD52 u pacientů s chronickou lymfocytární leukemií a porovnat ji s terapeutickou odpovědí na imunoterapii.Pacienti a metodika:
Vzorky periferní krve 8 pacientů byly analyzovány na průtokovém cytometru a kvantitativní analýzou byla stanovena denzita exprese antigenů CD20 a CD52 v jednotkách MESF. Pacienti podstoupili léčbu monoklonální protilátkou a léčebná odpověď byla hodnocena dle kritérií „National Cancer Institute – Sponsored Working Group“.Výsledky:
Ve skupině pacientů s denzitou exprese CD20 pod 43 000 MESF (medián stanovený pro dg. CLL v naší předchozí práci) tito nemocní buď nedosáhli léčebné odpovědi, nebo tato odpověď byla velmi krátce trvající. Ve skupině pacientů s expresí CD20 nad tuto hodnotu u tří pacientů bylo dosaženo léčebné odpovědi. Ze tří pacientů se stanovenou denzitou exprese CD52 jedině pacient s expresí nad 445 000 MESF (medián stanovený pro dg. CLL) dosáhl kompletní remise.Závěr:
Vzhledem k dosud malému pilotnímu souboru pacientů a složitosti problému nemůžeme zatím výsledky statisticky hodnotit. Možný vztah mezi mírou exprese cílového antigenu a terapeutickou odpovědí na monoklonální protilátku bude nepochybně vyžadovat další výzkum.Klíčová slova:
chronická lymfocytární leukemie, kvantitativní průtoková cytometrie, CD20, CD52, rituximab, alemtuzumabÚvod
Chronická lymfocytární leukemie (CLL) je nejčastější leukemií dospělých v Evropě a Severní Americe, kde tvoří 25–30 % všech leukemií. Její incidence v Evropě je 3/100 000 (1). Přestože je CLL stále onemocnění nevyléčitelné chemoterapií ve standardních dávkách (s výjimkou alogenní transplantace krvetvorných buněk), pacienti nicméně díky novým lékům odpovídají na léčbu lépe a prodlužuje se doba přežití, zejména u pacientů, kteří dosáhli kompletní remise. Purinový analog fludarabin v první linii léčby se ukázal jako účinnější než starší chemoterapeutické režimy (chlorambucil, CAP, CHOP) v dosažení kompletní remise a prodloužení doby do progrese (progression-free survival, PFS) (2, 3). Dalšího zlepšení léčebných výsledků bylo dosaženo kombinací fludarabinu s cyklofosfamidem (FC) (4). Preklinické studie ukazují, že fludarabin in vitro inhibuje DNA opravné enzymy po vystavení buněk alkylačním účinkům cyklofosfamidu (5). Navzdory těmto úspěchům, většina pacientů vyvíjí rezistenci k následujícím chemoterapiím. Navíc, progresivní cytopenie a imunosuprese komplikuje často další léčbu myelosupresivními léky.
Podávání terapeutických monoklonálních protilátek je formou pasivní imunoterapie, spočívá v cíleném zásahu nádorem exprimovaných antigenů a šetří hematopoetické kmenové buňky. Několik klinických studií ukázalo, že alemtuzumab (anti-CD52 protilátka) v monoterapii má klinicky signifikantní aktivitu u fludarabin-refrakterní CLL, s celkovými odpověďmi pohybujícími se mezi 33 až 55 % (6, 7). U pacientů bez předchozí léčby celková odpověď na terapii alemtuzumabem přesahuje 80 % (8, 9). Tyto léčebné odpovědi se jeví obdobně vysoké jako odpovědi dosažené purinovými analogy jako fludarabin v první linii léčby (2). Naproti tomu monoterapie rituximabem (anti-CD20 protilátka) je méně efektivní u předléčených pacientů (10) a v první linii léčby dosahuje odpovědi u 51 % pacientů (11). Dramatické zlepšení výsledků přinesla kombinace rituximabu s fludarabinem a cyklofosfamidem (FCR) (12, 13). Fludarabin má s rituximabem in vitro na buňkách CLL aditivní cytotoxický efekt (14, 15).
V předchozích pracích jsme kvantitativní analýzou hodnotili hladiny exprese CD20 a CD52 na buňkách nehodgkinských lymfomů a CLL (16, 17). Cílem naší současné práce je analyzovat hladiny exprese cílového antigenu spolu s terapeutickou odpovědí na monoklonální protilátku na pilotním souboru pacientů.
Soubor pacientů a použité metody
Pacienti
V této práci byly vyhodnoceny vzorky periferní krve osmi pacientů se stanovenou diagnózou CLL (tab. 1). U pacientů 2, 3, 4, 5 a 8 byly vzorky periferní krve odebrány při stanovení diagnózy a u pacientů 1, 6 a 7 bezprostředně před zahájením léčby. Diagnóza byla stanovena na základě klinických a laboratorních nálezů, buněčné morfologie a imunofenotypizace. Pacienti léčení monoterapií rituximabem dostávali eskalované dávky z 375 mg/m2 na 500 mg/m2 a v rámci chemoimunoterapie 375 mg/m2 rituximabu na počátku každého cyklu. Alemtuzumab byl podáván podkožně s eskalací dávek z 3 mg na 30 mg v prvním týdnu a dále 30 mg 3 týdně, pokud si nežádoucí účinky (např. trombocytopenie) nevyžádaly redukci dávek. Klinické odpovědi na terapii byly hodnoceny podle kritérií „National Cancer Institute – Sponsored Working Group“ (18).
Tab. 1. Prognostické znaky a denzita cílových antigenů. 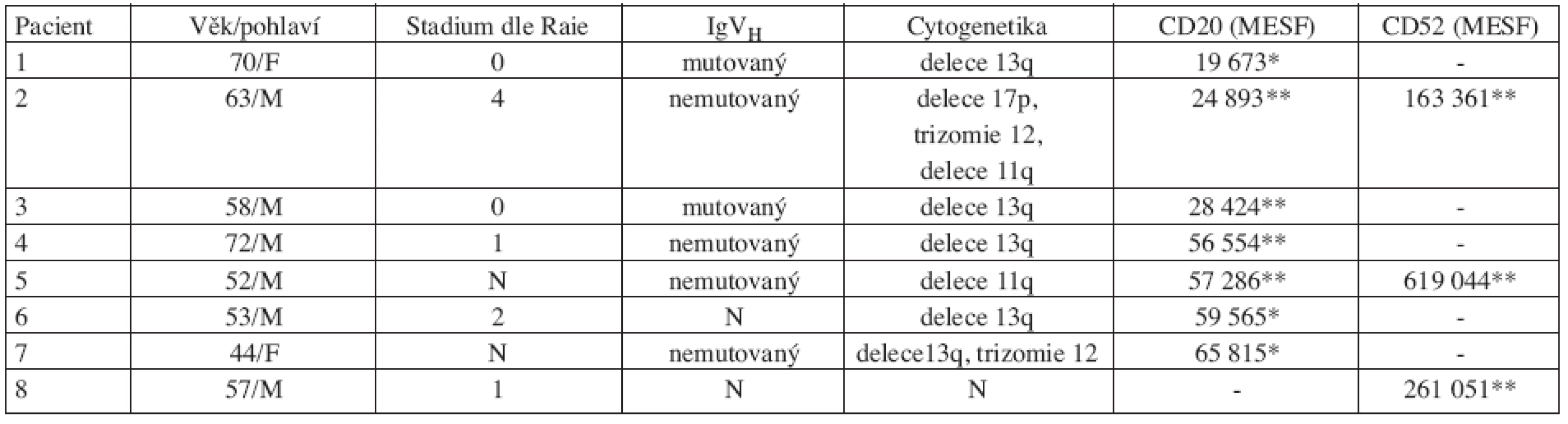
N….neurčeno, nevyšetřeno *…..stanovení před počátkem terapie **…stanovení při diagnóze Příprava vzorku
Každý vzorek periferní krve byl inkubován s kombinací příslušných primárních monoklonálních protilátek po dobu 15 minut ve tmě. Pro detekci exprese antigenu CD20 nebo CD52 byly použity monoklonální protilátky anti-CD20 nebo anti-CD52 konjugované s fluorescein-isothiokyanátem (FITC); (Invitrogen Corp., USA). Nádorová populace byla značena kombinací monoklonálních protilátek anti-CD19 konjugované s R-phycoerythrinem (R-PE) a anti-CD5 konjugované s R-phycoerythrinem-Cy5 (PE-Cy5) (Invitrogen Corp., USA). Po inkubaci byly zlyzovány erytrocyty pomocí kyseliny mravenčí a poté byla obnovena osmolalita podle publikované metodiky (16). Ke každému vzorku byly přidány částice QuantumTMFITC (Bangs Laboratories, Inc., USA) (obr. 1).
Obr. 1. Kalibrační mikročástice na histogramech z flowcytometru. Gating mikročástic byl prováděn na histogramu forward vs. side scatter (FS/SS) (gate H). Střední hodnoty intenzity fluorescence byly měřeny na jednoparametrovém histogramu. Z hodnot intenzity fluorescence a standardizovaných hodnot v MESF jednotkách pro jednotlivé skupiny mikročástic o různé intenzitě fluorescence byla sestavena kalibrační křivka. 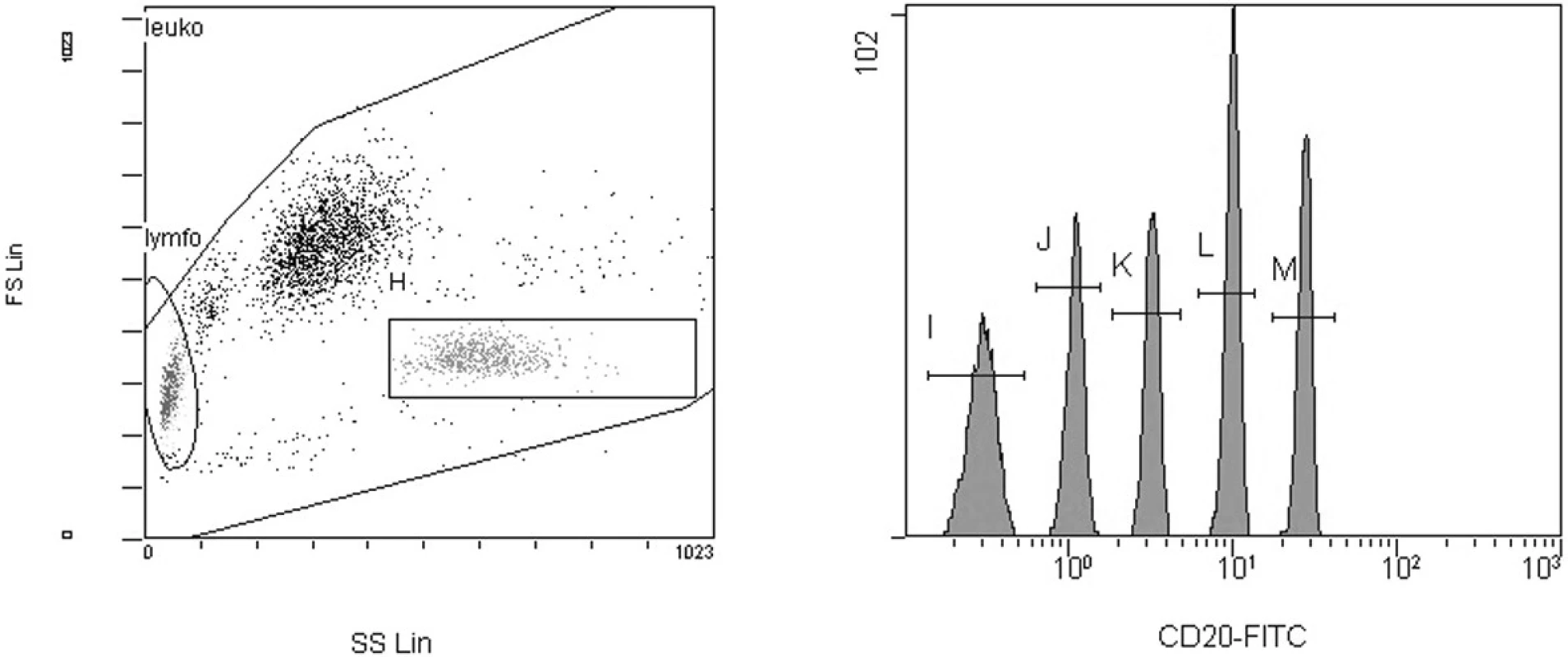
Kvantitativní průtoková cytometrie
Vzorky byly analyzovány na průtokovém cytometru CytomicsTM FC500 (Beckman Coulter, USA). U každého vzorku bylo vyhodnoceno minimálně 10 000 částic v gate lymfocytů. Denzita antigenu CD20 nebo CD52 byla hodnocená u pacientů na nádorové populaci CD5+19+ buněk. Střední hodnoty intenzity fluorescence byly převedeny do jednotek MESF pomocí software QuickCal® (Bangs Laboratories).
Výsledky
Pacienti 1, 2 a 3 léčení terapií zahrnující monoklonální protilátku rituximab vykazovali exprese CD20 nižší než 43 000 MESF (odpovídající mediánu exprese u CLL podle naší předchozí práce (17). U pacienta 2 léčeného rovněž alemtuzumabem je uvedena denzita antigenu CD52 (tab. 1), která je nižší než 445 000 MESF (medián u CLL námi dříve uvedený (16). Pacientka 1 s diagnózou CLL od roku 2000 byla dlouhodobě léčena pouze kortikoidy pro autoimunitní hemolytickou anémii. Pro progresi anémie bez pozitivity antierytrocytárních protilátek byla poprvé nasazena chemoimunoterapie R-CHOP na konci září 2008, po 3 cyklech však choroba zůstala bez odpovědi na léčbu (stable disease, SD). Pacient 2 s CLL diagnostikovanou v roce 2005 a s nepříznivými prognostickými známkami (delece p53, nemutovaný IgVH) byl iniciálně léčen pro progresi trombocytopenie (TP) na konci roku 2005 dvěma cykly FC, ale po přechodné mírné úpravě TP nastal během terapie další pokles trombocytů (autoimunitní etiologie). Terapie chemorezistentního onemocnění byla změněna na monoklonální protilátku alemtuzumab začátkem roku 2006 s efektem parciální remise (PR) na úpravu počtu trombocytů (ostatní kritéria NCI-WG by odpovídala kompletní remisi) a tato léčebná odpověď se s podporou kortikoidy udržovala 14 měsíců. Pacient znovu podstoupil terapii alemtuzumabem pro progresi TP současně s rapidním vzestupem lymfocytózy s efektem PR (limitováno úpravou počtu trombocytů), která trvala pouze 3 měsíce. Po následné monoterapii rituximabem s eskalací dávek pacient dosáhl léčebné odpovědi (PR), ale tato léčebná odpověď byla krátce trvající (3 měsíce) a progrese autoimunitní trombocytopenie vyžadovala brzy další terapii. Při následující terapii opět rituximabem nastal rapidní vzestup lymfocytózy (progrese). V terapii byl opět zaveden alemtuzumab, ale do dvou měsíců od ukončení léčby nastala progrese břišní lymfadenopatie a vzestup lymfocytózy (obr. 2). Pacient 3 s CLL diagnostikovanou v roce 2003 byl poprvé léčen v roce 2007 dvěma cykly chemoimunoterapie R-COP (první infuze komplikována zimnicí a třesavkou), která byla přerušena pro dřeňový útlum a po které přetrvávala masivní infiltrace kostní dřeně s lymfocytózou v periferní krvi a stacionární splenomegalie (efekt SD).
Obr. 2. Kinetika absolutního počtu lymfocytů u pacienta 2. Šipky označují počátek jednotlivých terapií (A…alemtuzumab, R…rituximab). Po jednotlivých terapiích alemtuzumabem je velmi dobře patrné zkracování intervalů do progrese lymfocytózy. 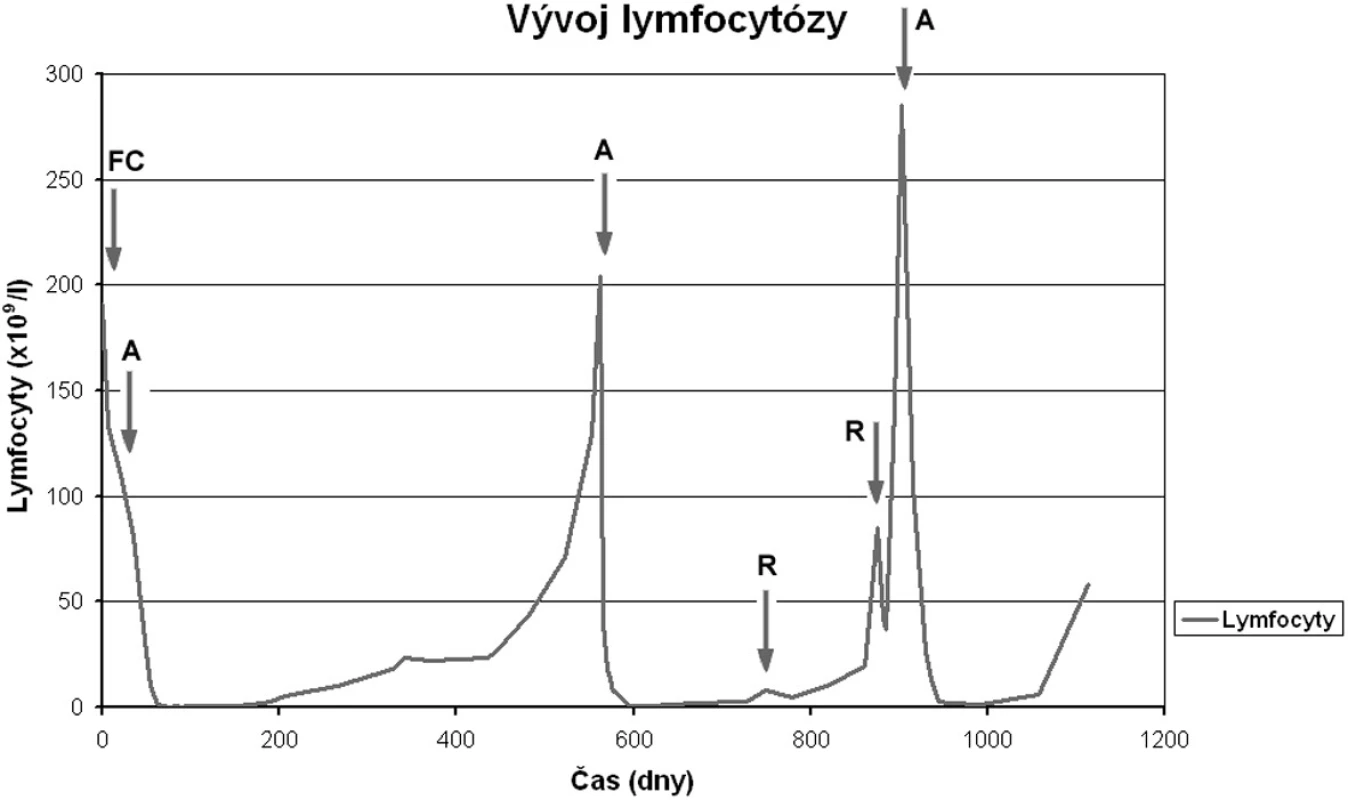
Pacienti 4, 5, 6 a 7 vykazovali hladinu exprese CD20 vyšší než 43 000 MESF (17). U pacienta 5 léčeného rovněž alemtuzumabem je uvedena denzita antigenu CD52 vyšší než 445 000 MESF (tab. 1). Pacient 4 s diagnózou CLL od roku 2005 byl léčen kortikoidy pro autoimunitní trombocytopenii. Monoterapie rituximabem v eskalovaných dávkách byla počata v roce 2005 s efektem na úpravu autoimunitních fenoménů, ale lymfocyty neklesly pod 4x109/L (PR). Následoval pozvolný vzestup lymfocytózy s progresí lymfadenopatie a potřeba další terapie nastala za 22 měsíců (FC s efektem CR). Autoimunitní fenomény si záhy vyžádaly další terapii rituximabem s odpovědí SD, ale došlo ke stabilizaci hodnot hemoglobinu a trombocytů a postupnému mírnému zlepšení. Pacient 5 s CLL diagnostikovanou od roku 2000 byl předléčený četnými chemoterapiemi a imunoterapie alemtuzumabem byla nasazena pro masivní lymfadenopatii v roce 2005 s efektem kompletní remise (CR), která trvala 12 měsíců (obr. 3). Pro progresi trombocytopenie (nebyla imunitní etiologie) byl léčen režimem FCR s efektem SD. Při terapii ofatumumabem (plně humánní anti-CD20 monoklonální protilátka vázající se na odlišný epitop CD20 antigenu oproti rituximabu) nastala transformace do velkobuněčného lymfomu. Pacient 6 s CLL diagnostikovanou v roce 2008 byl iniciálně léčen chemoimunoterapií FCR pro progresi lymfadenopatie a masivní splenomegalii, CR bylo dosaženo po prvním cyklu. Pacientka 7 s diagnózou CLL stanovenou v roce 2000 byla iniciálně léčena v roce 2008 pro rapidní nárůst lymfocytózy režimem FCR, ale rituximab byl z léčby následně vypuštěn pro těžkou febrilní reakci s hypotenzí po první infuzi.
Tab. 2. Klinické a laboratorní nálezy před zahájením léčby. 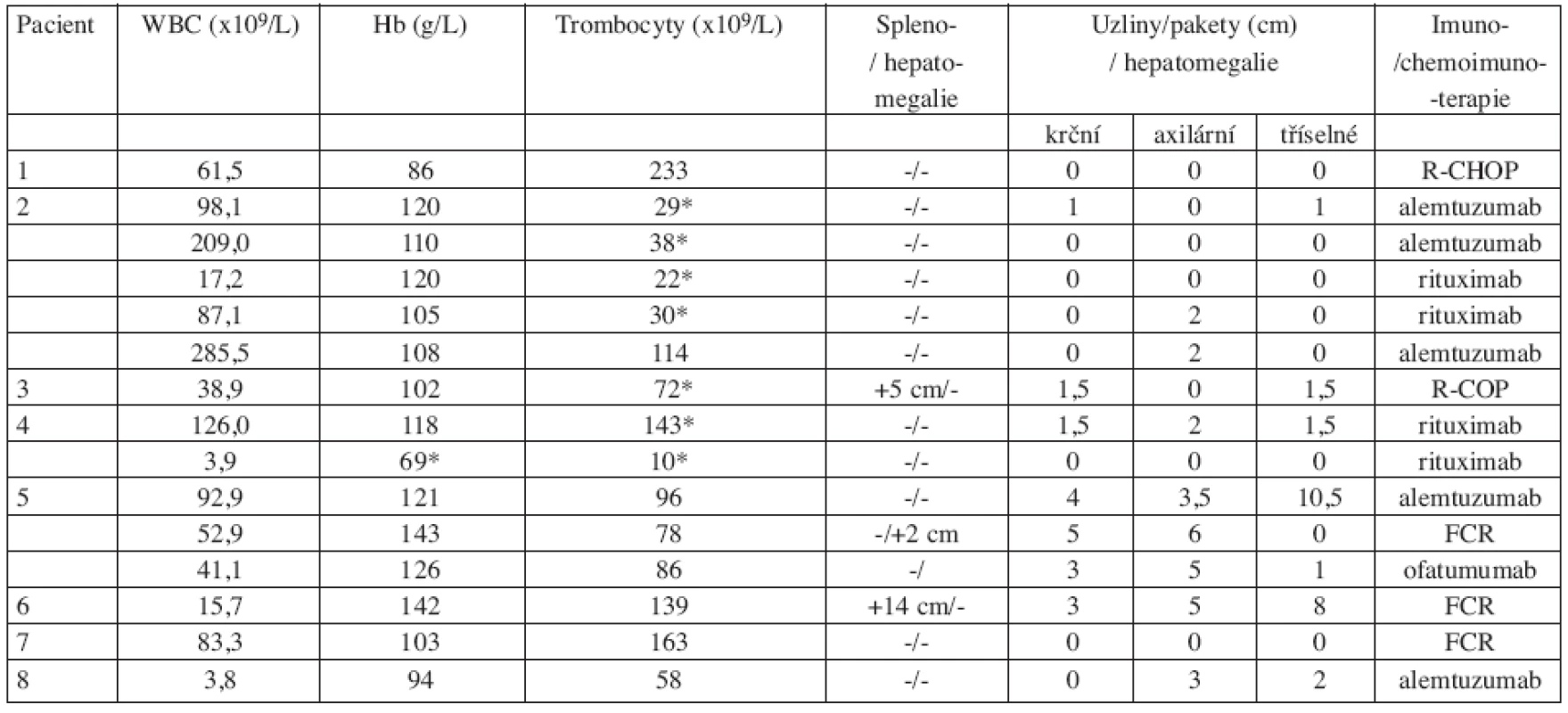
* autoimunitní etiologie Tab. 3. Hodnocení klinické odpovědi na terapii monoklonální protilátkou. 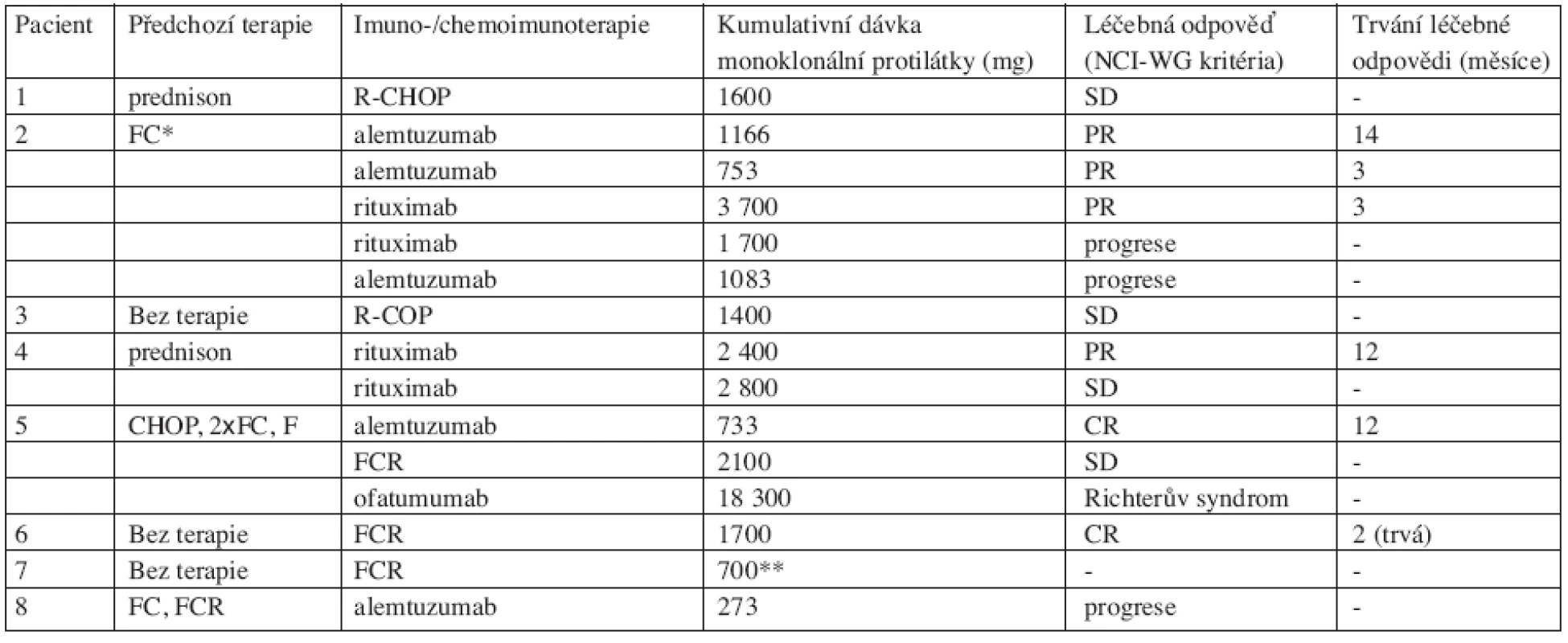
* chemorezistence ** předčasně ukončeno pro těžkou febrilní reakci s hypotenzí Obr. 3. Efekt Campath-1H na velikost uzlin u pacienta 5. Šipka označuje počátek terapie alemtuzumabem. Je vidět rychlý ústup lymfadenopatie. Pacient dosáhl kompletní remise. 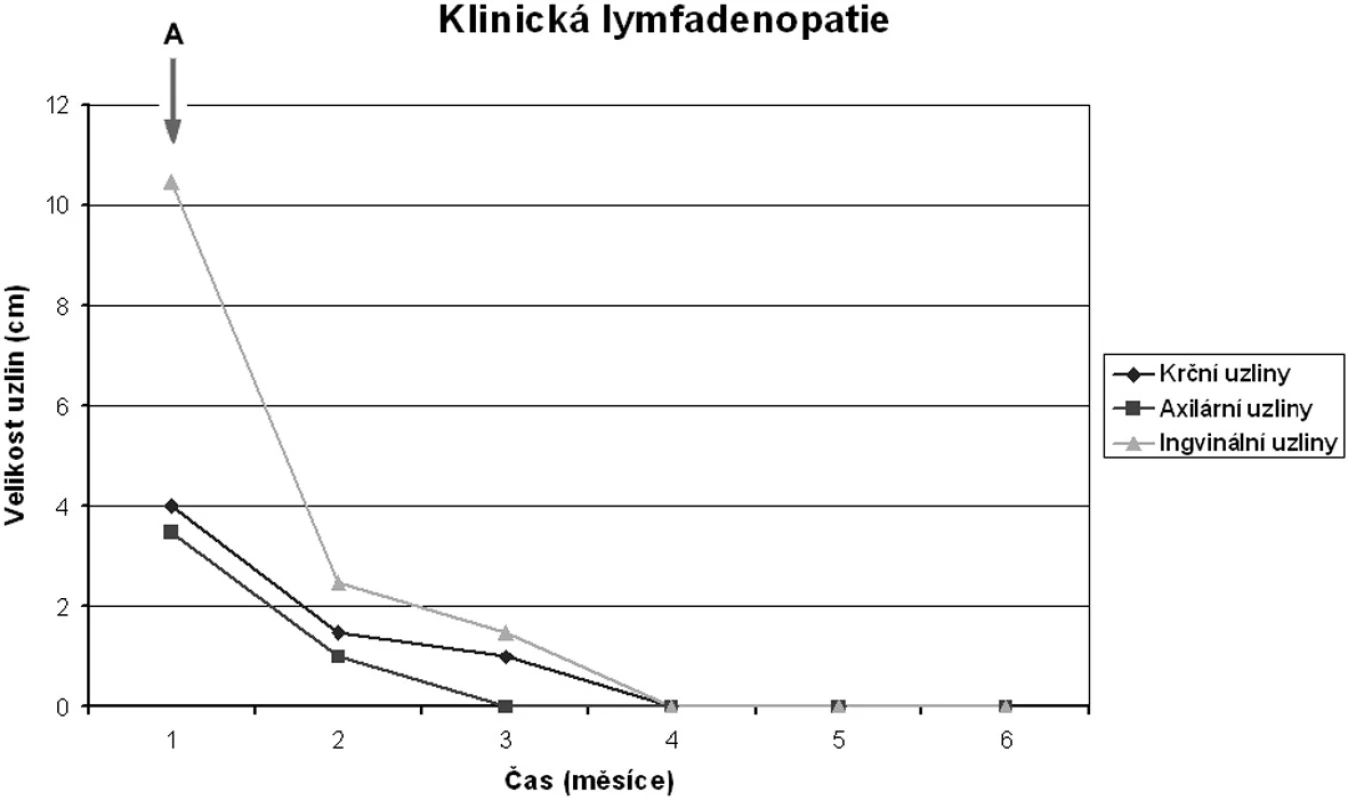
Pacient 8 s diagnózou CLL od roku 2004 s denzitou exprese CD20 nižší než 445 000 MESF a předléčený chemoterapiemi FC a 2xFCR progredoval po léčbě alemtuzumabem, která byla předčasně přerušena pro febrilní neutropenii.
Diskuse
Rituximab byl iniciálně schválen jak americkými tak evropskými úřady (1997 a 1998) pro léčbu indolentních non-hodgkinských lymfomů. Originální dávkovací schéma bylo 375 mg/m2 týdně pro 4 následující týdny, které bylo vybráno na základě předchozích studií pro jeho bezpečnost, nízkou toxicitu a demonstrovatelnou terapeutickou aktivitu.
Snaha korelovat léčebnou odpověď na terapii monoklonální protilátkou s hladinou exprese cílových antigenů naráží na více problémů. Jednak je to spontánní variabilita hladiny exprese v čase. Rossman et al. (19) opakovaným měřením denzit u pacientů se stabilní chorobou v odstupu 4 a 8 týdnů zjistili značnou variabilitu u CD20 antigenu na buňách CLL oproti kontrolní skupině B-buněk zdravých dárců. Obdobně se ukázala variabilita v expresi znaku CD52 na CLL buňkách. Manshouri et al. (20) dále prokázali, že plazma pacientů s CLL oproti zdravým dárcům ukazuje vysoké hladiny cirkulujícího CD20 antigenu (sCD20). Pacienti ve stadiu Rai 3–4 měli signifikantně vyšší hladiny sCD20 než pacienti ve stadiu 1–2. Plazmatický sCD20 kompetituje s povrchovým CD20 ve vazbě s rituximabem. Denzita povrchového antigenu není jediným determinujícím biologickým faktorem určujícím efekt léčby. Například, mantle cell lymfom vykazuje srovnatelnou nebo vyšší expresi CD20 než folikulární lymfom, ale nižší procento léčebných odpovědí na monoterapii rituximabem (21, 22).
V současné době se předpokládá, že rituximab působí následujícími mechanismy: (1) ADCC – buněčná cytotoxicita závislá na protilátce, (2) CDCC – komplement dependentní buněčná cytotoxicita, (3) přímá indukce apoptózy. Není zcela jasné, pro který z těchto biologických účinků hraje hladina exprese CD20 dominantní roli. In vitro bylo dokázáno, že komplementem zprostředkovaná lýza CLL buněk vysoce korelovala se střední intenzitou fluorescence (mean fluorescence intensity, MFI) CD20 (23). Komplement je též zodpovědný za vedlejší účinky vztažené k infuzi rituximabu, zejména u pacientů s vysokým počtem cirkulujících maligních buněk (24). Pacientka 7 měla těžkou febrilní reakci s hypotenzí po první infuzi a vedle lymfocytózy bychom mohli spekulovat o tomto vedlejším účinku v souvislosti s vysokou expresí antigenu CD20.
Monoterapie rituximabem je méně účinná u předléčených pacientů (10), jako iniciální terapie CLL dosahuje léčebné odpovědi u 51 % pacientů (11), ale v kombinaci s fludarabinem a cyklofosfamidem představuje nyní nejefektivnější terapii CLL jako terapie v první linii, tak i u pacientů po předchozí léčbě (12, 13). Pacienti 1, 2 a 3 s nižší denzitou exprese CD20 buď nedosáhli léčebné odpovědi vůbec (SD, pacienti 1 a 3 po chemoimunoterapii), nebo léčebná odpověď byla krátce trvající (PR, pacient 2 po monoterapii rituximabem). Pacient 4 léčený monoterapií rituximabem, ale s vyšší denzitou exprese CD20, dosáhl rok trvající parciální remise.
Pacienti 2 a 8 vykazovali nižší hladinu exprese CD52 než pacient 5. U všech třech předcházely chemoterapie (tedy předléčení pacienti) před terapií alemtuzumabem, ale pacient 5 s vysokou expresí CD52 dosáhl kompletní remise trvající 12 měsíců, přestože před terapií měl pakety uzlin v tříslech a alemtuzumab je při větší lymfadenopatii méně efektivní. Ginaldi et al. (25) korelovali terapeutickou odpověď na Campath s hladinou exprese CD52 na leukemických buňkách pacientů s CLL. Skupina pacientů odpovídajících na Campath (CR + PR) vykazovala vyšší střední hodnotu CD52 MESF, než skupina pacientů bez terapeutické odpovědi, ač rozdíl nebyl statisticky významný.
Pro účely mezilaboratorního srovnání se doporučuje pracovat s jednotkami antibody binding kapacity (ABC), které vyjadřují přímo standardizovaný počet epitopů na jedné buňce. Přepočet na tyto jednotky pro CD52 antigen uvádíme v naší předchozí práci (16). Měření v MESF jednotkách je však technicky jednodušší a pro účely prezentace naší pilotní skupiny pacientů jej považujeme za dostačující.
Náš soubor pacientů je zatím velmi malý pro krátkou periodu, po kterou jsou nemocní po stanovení denzity antigenu a zahájení léčby sledováni a nedovoluje učinit žádné statisticky významné závěry. Proto jsou výsledky uvedeny ilustrativní formou shrnující naměřené údaje o expresi antigenů CD20 a CD 52 a popisující klinický průběh nemoci a léčebnou odpověď. Kvantitativní flowcytometrie je metodou, která umožňuje na rozdíl od obvyklého kvalitativního měření velmi přesně kvantifikovat expresi sledovaných antigenů, a to nejen uvedených dvou. Možný vztah mezi mírou exprese cílového antigenu a terapeutickou odpovědí na příslušnou monoklonální protilátku bude moci ověřit až další systematický výzkum této problematiky.
Seznam zkratek
CLL – chronická lymfocytární leukemie
CAP – cyklofosfamid + doxorubicin + prednison
CHOP – cyklofosfamid + doxorubicin + vinkristin + prednison
FC – fludarabin + cyklofosfamid
FCR – fludarabin + cyklofosfamid + rituximab
R-CHOP – rituximab + cyklofosfamid + doxorubicin + vinkristin + prednison
R-COP – rituximab + cyklofosfamid + vinkristin + prednison
SD – stable disease
PR – parciální remise
CR – kompletní remise
sCD20 – cirkulující CD20 antigen
Poděkování
Tato práce byla podpořena grantem Interní grantové agentury Ministerstva zdravotnictví ČR číslo NR9023-3.
Doc. MUDr. Martin Klabusay, Ph.D.
Interní hematoonkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: mklabus@fnbrno.cz
Doručeno do redakce: 9. 1. 2009
Přijato: 27. 1. 2009
Zdroje
1. Adam Z, Vorlíček J, Doubek M. Chronická B lymfocytární leukémie. In: Adam Z, Vorlíček J a kolektiv. Hematologie II. 1. vyd. Praha, Grada, 2001; 311-338.
2. Rai KR, Peterson BL, Appelbaum FR, et al. Fludarabine compared with chlorambucil as primary therapy for chronic lymphocytic leukemia. N Engl J Med 2000; 343 : 1750-1757.
3. Leporrier M, Chevret S, Cazin B, et al. Randomized comparison of fludarabine, CAP, and ChOP in 938 previously untreated stage B and C chronic lymphocytic leukemia patients. Blood 2001; 98 : 2319–2325.
4. Eichhorst BF, Busch R, Hopfinger G, et al. Fludarabine plus cyclophosphamide versus fludarabine alone in first line-therapy of younger patients with chronic lymphocytic leukemia. Blood 2006; 107 : 885–891.
5. Yamauchi T, Nowak BJ, Keating MJ, et al. DNA repair initiated in chronic lymphocytic leukemia lymphocytes by 4-hydroperoxycyclophosphamide is inhibited by fludarabine and clofarabine. Clin Cancer Res 2001; 7 : 3580–3589.
6. Keating MJ, Flin I, Jain V, et al. Therapeutic role of alemtuzumab (Campath-1H) in patients who have failed fludarabine: results of a large international study. Blood 2002; 99 : 3554–3561.
7. Moreton P, Kennedy B, Lucas G et al. Eradication of minimal residual disease in B-cell chronic lymphocytic leukemia after alemtuzumab therapy is associated with prolonged survival. J Clin Oncol 2005; 23 : 2971–2979.
8. Lundin J, Kimby E, Bjorkholm M, et al. Phase II trial of subcutaneous anti-CD52 monoclonal antibody alemtuzumab (Campath-1H) as first-line treatment for patients with B-cell chronic lymphocytic leukemia (B-CLL). Blood 2002; 100 : 768–773.
9. Osterborg A, Fassas AS, Anagnostopoulos A, et al. Humanized CD52 monoclonal antibody Campath-1H as first-line treatment in chronic lymphocytic leukaemia. Br J Haematol 1996; 93 : 151–153.
10. Huhn D, von Schilling Ch, Wilhelm M, et al. Rituximab therapy of patients with B-cell chronic lymphocytic leukemia. Blood 2001; 98 : 1326–1331.
11. Hainsworth JD, Litchy S, Barton JH, et al. Single-agent rituximab as first-line and maintenance treatment for patients with chronic lymphocytic leukemia or small lymphycytic lymphoma: a phase II trial of the Minnie pearl cancer research network. J Clin Oncol 2003; 21 : 1746–1751.
12. Keating MJ, O’Brien S, Albitar M, et al. Early results of chemoimmunotherapy regimen of fludarabine, cyclophosphamide, and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol 2005; 23 : 4079–4088.
13. Wierda W, O’Brien S, Wen S, et al. Chemoimmunotherapy with fludarabine, cyclophosphamide, and rituximab for relapsed and refractory chronic lymphocytic leukemia. J Clin Oncol 2005; 23 : 4070–4078.
14. Di Gaetano N, Xiao Y, Erba E, et al. Synergism between fludarabine and rituximab revealed in a follicular lymphoma cell line resistant to the cytotoxic activity of either drug alone. Br J Haematol 2001; 114 : 800–809.
15. Alas S, Emmanouilides C, Bonavida B. Inhibition of interleukin 10 by rituximab results in down-regulation of bcl-2 and sensitization of B-cell non-Hodgkin’s lymphoma to apoptosis. Clin Cancer Res 2001; 7 : 709–723.
16. Klabusay M, Sukova V, Coupek P, et al. Different levels of CD52 antigen expression evaluated by quantitative fluorescence cytometry are detected on B-lymphocytes, CD34+ cells and tumor cell of patients with chronic B-cell lymphoproliferative diseases. Cytometry Part B(Clinical cytometry) 2007; 72B: 363–370.
17. Suková V, Klabusay M, Čoupek P, et al. Denzita exprese antigenu CD20 na populaci nádorových buněk u pacientů s chronickými lymfoproliferacemi B-lymfocytární řady. Čas Lék Česk 2006; 145 : 712–716.
18. Cheson BD, Bennett JM, Grever M, et al. National Cancer Institute-sponsored Working Group guidelines for chronic lymphocytic leukemia: revised guidelines for diagnosis and treatment. Blood 1996; 87 : 4990–4997.
19. Rossmann ED, Lundin J, Lenkei R, et al. Variability in B-cell antigen expression: implications for treatment of B-cell lymphomas and leukemias with monoclonal antibodies. Hematol J 2001; 2 : 300–306.
20. Manshouri T, Do K, Wang X, et al. Circulating CD20 is detecable in the plasma of patients with chronic lymphocytic leukemia and is of prognostic significance. Blood 2003; 101 : 2507–2513.
21. Maloney DG, Grillo-López AJ, White ChA, et al. IDEC C2B8 (rituximab) anti-CD20 monoclonal antibody therapy in patients with relapsed low-grade non-Hodgkin’s lymphoma. Blood 1997; 90 : 2188–2195.
22. Foran JM, Cunningham D, Coiffier B, et al. Treatment of mantle-cell lymphoma with rituximab (chimeric monoclonal anti-CD20 antibody): analysis of factors associated with response. Ann Oncol 2000; 11 : 117–121.
23. Golay J, Lazzari M, Facchinetti V, et al. CD20 levels determine the in vitro susceptibility to rituximab and complement of B-cell chronic lymphocytic leukemia: further regulation by CD55 and CD59. Blood 2001; 98 : 3383–3389.
24. Van der Kolk LE, Grillo-Lopéz AJ, Baars JW, et al. Complement activation plays a key role in the side-effects of rituximab treatment. Br J Haematol 2001; 115 : 807–811.
25. Ginaldi L, De Martinis M, Matutes E, et al. Levels of expression of CD52 in normal and Leukemic B and T cells: correlation with in vivo therapeutic response to Campath-1H. Leukemia Research 1998 22 : 185–191.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek ÚVODNÍKČlánek Systémová mastocytóza
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2009 Číslo 1- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Exprese reverzní telomerázy u pacientů s chronickou B-lymfocytární leukemií
- Mukozitida dutiny ústní po alogenní transplantaci krvetvorných buněk s přípravou fludarabinem a melfalanem FLU/MEL
- Denzita exprese cílového antigenu CD20 a CD52 ve vztahu k terapii monoklonální protilátkou u pacientů s chronickou lymfocytární leukemií
- Léčba invazivní aspergilózy – doporučení odborných společností
- Léčba invazivních mykotických infekcí u imunoalterovaných nemocných – doporučení odborných společností
- Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie nemoci v Jihomoravském kraji
- Systémová mastocytóza
- XVI. ČESKO-SLOVENSKÁ KONFERENCE O HEMOSTÁZE A TROMBÓZE s mezinárodní účastí
- Vývoj oboru klinické hematologie dospělých v Brně do devadesátých let minulého století (Vzpomínky klinického hematologa)
- Za prof. MUDr. Jaroslavem Vaňáskem, CSc., dr. h. c.
- O spolupráci mezi lékařskou odbornou veřejností a inovativním farmaceutickým průmyslem
- ÚVODNÍK
- 2009 – rok zásadních změn ve WHO nomenklatuře HLA systému
- Léčba invazivní kandidózy - doporučení odborných společností
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Systémová mastocytóza
- Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie nemoci v Jihomoravském kraji
- Léčba invazivní aspergilózy – doporučení odborných společností
- Léčba invazivní kandidózy - doporučení odborných společností
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



