-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba invazivní kandidózy - doporučení odborných společností
Guidelines for the treatment of invasive candidiasis
National working group representing clinicians (hematologists, oncologists, infection diseases and ICU specialists...), microbiologists, and different special medical societies and working groups prepared evidence-based guidelines for the treatment established fungal infection – invasive candidiasis in the adult hematology and ICU patients. These guidelines updated those published in the Czech Republic in 2003/2004. Evidence criteria of the Infectious Diseases Society of America (IDSA) were used for assessing the quality of clinical trials, and EORTC/MSG Consensus Group for definitions of invasive fungal disease.
Key words:
invasive candidiasis, candidemia, treatment guidelines
Autoři: J. Haber 1; Z. Ráčil 2; J. Mayer 2; N. Mallátová 3; M. Kouba 4; P. Sedláček 5; E. Faber 6; I. Herold 7; P. Múdrý 8; L. Drgoňa 9; I. Kocmanová 10; M. Karas 11; V. Buchta 12; J. Vydra 13; M. Kolář 14
; J. Trupl 15; V. Marešová 16; H. Rozsypal 16; O. Nyč 17; K. Cwiertka 18
Působiště autorů: I. interní klinika - klinika hematologie, 1. LF UK v Praze a VFN Praha, 2Interní Interní hematoonkologická klinika FN Brno a LF MU v Brně, 3Laboratoř lékařské parazitologie a mykologie, Centrální laboratoře, Nem. České Budějovice a. s., 4Ústav hematologie 1
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 1, p. 7-16.
Kategorie: Doporučené postupy
Souhrn
Předkládaný text shrnuje současné poznatky o léčbě invazivní kandidózy a kandidemie. Shrnuje výsledky klinických studií a na základě jejich zhodnocení formuluje doporučené postupy. Zahrnuje dospělé hematologické pacienty a nemocné na jednotkách intenzivní péče. Při hodnocení kvality studií byla použita celosvětově uznávaná kritéria IDSA (Infectious Diseases Society of America) a pro definice invazivní mykotické infekce aktualizované konsenzuální závěry skupiny EORTC/MSG. Současné doporučené postupy jsou rozšířenou a aktualizovanou verzí těch, které byly publikovány v letech 2003/2004.
Práce je výsledkem týmu odorníků z oblasti hematologie, onkologie, infekce, intenzivní medicíny, mikrobiologie, kteří reprezentovali příslušné odborné společnosti a pracovní skupiny.Klíčová slova:
invazivní kadidóza, kandidemie, léčba, doporučené postupy, antimykotikaObsah
1. Vývoj epidemiologie kandidózy
2. Změna spektra kandid - ovlivnění léčebných postupů
3. Léčba hematogenní kandidové infekce (kandidemie) a invazivního kandidového onemocnění (akutní diseminované kandidózy)
3.1. Nefarmakologická léčba kandidemie - odstranění centrálního nitrožilního katétru
3.1.1. Diagnostika katétrové kandidemie
3.2. Farmakologická léčba hematogenní kandidózy (kandidemie) a invazivního kandidového onemocnění (akutní diseminované kandidózy).
3.2.1. Amfotericiny
3.2.2. Amfotericiny na tukovém nosiči
3.2.3. Triazoly
3.2.4. Echinokandiny
3.3. Délka léčby invazivní kandidózy a kandidemie
3.4. Význam kultivačních vyšetření a stanovení citlivosti (MIC) na antimykotika
4. Doporučení a závěr
4.1. Postup při časné léčbě hematogenní infekce před určením druhu kandidy
4.2. Postup při časné léčbě hematogenní kandidové infekce způsobené Candida albicans, C. glabrata, nebo C. krusei.
4.3. Obvyklé dávkování antimykotik
5. Závěr
Literatura
1. Vývoj epidemiologie kandidózy
Invazivní kandidová infekce je stále nejčastější oportunní mykotickou infekcí a negativně ovlivňuje morbiditu i mortalitu v hematoonkologických centrech a na jednotkách intenzivní péče (JIP) (1). Vzestupný trend incidence kandidemie a invazivní kandidózy začal v 80. letech 20. století a incidence dosahovala až 8 % (2–6). Od 90. let 20. století, po širokém zavedení flukonazolu do profylaxe, incidence kandidemie v hematologických a transplantačních centrech (tj. u neutropenických nemocných) postupně poklesla (7–14). Na jednotkách intenzivní péče (tj. převážně u non – neutropenických nemocných) se naopak kandidóza stává závažným problémem (15) s neměnnou nebo stoupající incidencí (5, 6, 16, 17). Výskyt kandidemie se liší podle charakteru jednotky (18) a v současné době jsou kandidy na JIP čtvrtou nejčastější hematogenní infekcí s nejvyšší mortalitou (19). Incidence kandidemie v Evropě se pohybuje se mezi 2,2 – 4,3 na 100 000 obyvatel (20–22) s nejvyšším výskytem ve velkých univerzitních nemocnicích (23–25). U novorozenců se udává až 32,6 na 100 000 narozených dětí (26). V ČR nejsou globální epidemiologická data k dispozici.
S poklesem celkové incidence kandidózy klesá od počátku 90. let také celková mortalita na kandidózu (27–29). V souvislosti se zlepšující se komplexní péčí zejména o pacienty s hematologickými malignitami a po transplantaci kostní dřeně je pokles mortality na kandidózu nejvíce patrný u této skupiny nemocných (30). Tomu odpovídá i pokles kandid v sekčním materiálu (13, 31). Přes celkový pokles mortality se však úmrtí na rozvinutou infekci zásadně ovlivnit nepodařilo a i přes nové léčebné postupy mortalita na kandidózu dosahuje stále 40–50 % (dříve až 60 %) (11, 22, 32), a to jak na hematologických pracovištích, tak na jednotkách intenzivní péče (19). Souhrnný přehled o vývoji mortality na kandidózu recentně prezentoval Pfaller (33). Konstatuje, že za posledních 20 let je mortalita na invazivní kandidózu prakticky neměnná, kolem 0,4 úmrtí na 100 000 obyvatel.
2. Změna spektra kandid – ovlivnění léčebných postupů
V posledních dvou desetiletích dochází ke změně i v zastoupení jednotlivých druhů kandid izolovaných z hemokultur. Při absolutním poklesu C. albicans na cca 50 % významně stoupá relativní zastoupení non-albicans kandid (4, 12, 13, 16–18, 32, 34–38). A to jak u neutropenických nemocných s hematologickými malignitami, či po transplantaci kostní dřeně (12, 30), kde bývají častěji infekce způsobené současně více druhy kandid (39), tak u non-neutropenických nemocných na jednotkách intenzivní péče (JIP) (16, 17, 40, 41). Údaje z rozsáhlých prospektivních observačních epidemiologických studií v USA (u dospělých i dětí) (16) a z Evropy (42) jsou uvedeny v tabulce 1,stejně tak i údaje o nejčastějších kmenech kandid v České a Slovenské republice (43–47).
3. Léčba hematogenní kandidové infekce (kandidemie) a invazivního kandidového onemocnění (akutní diseminované kandidózy)
3.1 Nefarmakologická léčba kandidemie – odstranění centrálního nitrožilního katétru
Odstranění centrálního žilního katétru je prvotní součástí léčby kandidemie. Jde o zásadní režimové opatření a při podezření na katétrový zdroj kandidemie je časné (do 48 hodin) odstranění katétru, kdykoli je to možné, absolutně indikováno (48–56). Stejný postup platí i u dětí (57) a novorozenců (58). I když v této oblasti neexistují randomizované srovnávací studie, zhodnocení dosavadních studií (59), doporučení (56, 60–62) a názory expertů (51, 56) opřené o řadu prací tento postup zásadně doporučují. Mortalita nemocných, dospělých, dětí i novorozenců, kterým při hematogenní kandidové infekci byl ponechán katétr in situ, byla statisticky významně vyšší i přes adekvátní antimykotickou léčbu (57, 58, 63–65). Okamžité vynětí katétru při kandidémii vedlo naopak ke snížení mortality (22, 26, 66, 67).
Původ kandidemie je prakticky vždy endogenní, primárním zdrojem je převážně trávicí trakt (68), jen výjimečně je zdroj exogenní, z kůže – to zpravidla při nesprávném ošetření katétru. U neutropenických nemocných je v některých případech však obtížné stanovit, zda primárním zdrojem kandidemie je skutečně GIT, nebo je zdrojem kandidemie katétr (69). Některé zkušenosti uvádějí jako primární zdroj GIT v 60 % a katétr ve 27 % (70), jiné udávají katétrový zdroj nižší – 17 % (57, 71). Bez ohledu na to však stále platí základní imperativ vynětí katétru. Určité váhání může nastat v případě, že instalace nového katétru by byla velkým rizikem, např. při hluboké trombocytopenii. Při průkazu C. parapsilosis, která bývá jako původce katétrové kandidemie izolována nejčastěji, však platí zásadní doporučení okamžité odstranění katétru (7, 72).
3.1.1 Diagnostika katétrové kandidemie
Diagnóza katétrové kandidemie je založena na (semikvantitativním) průkazu téhož patogena z odběru krve z katétru a současně z periferní žily (73) s vyšším kvantitativním nálezem kandid v katétru proti periferní krvi v poměru více než 5 : 1 (74).K rozpoznání napomůže časový rozdíl kultivační pozitivity hemokultury z katétru a z periferní žíly, kdy při katétrové infekci se kultivační pozitivita vzorku získaného z katétru objeví o hodiny (nejméně o dvě) dříve, než ze vzorku krve získaného z periferní žíly (69, 74, 75). Tento postup má v určení katétrového původu kandidemie 100% specificitu a 96,4% senzitivitu, praktické využití však může mít význam jen při nemožnosti okamžitého odstranění katétru. Možnosti diagnostiky s katétrem ponechaným in situ uvádí některé dřívější práce (76), souhrnný přehled aktuálně uvádí Bouza (77, 78). Srovnává kultivační nálezy z kůže v místě zavedeného katétru s kultivačním nálezem z „hrdla“ katétru, dále výsledky hemokultury z odběru z katétru a současně z periferní žíly a nakonec časové rozdíly kultivačních pozitivit periferní a katétrové krve. Dodává však, tento postup, tj. bez vynětí katétru, je možné zkusit jen u nemocných bez neutropenie a bez hematologické malignity, u kterých je katétr zaveden jen krátce (48 hodin) a kteří jsou hospitalizováni na JIP. Definitivní průkaz kolonizace katétru však získáme až po jeho vynětí. Nejčastěji se používá semikvantitativní kultivační metoda podle Maki (špička odstraněného katétru se „roluje“na kultivační půdě) (79). Kvantitativní kultivační metody pomocí např. sonikace (80), nebo vortexování zachytí kolonizaci nejen exoluminální, ale i endoluminalní, v celkovém srovnání diagnostického přínosu těchto metod pro klinickou praxi však není rozdíl (78).
Tab. 1. Zastoupení jednotlivých kmenů kandid v hemokultuře. Údaje z Evropy, USA (děti i dospělí), situace v České a Slovenské republice. 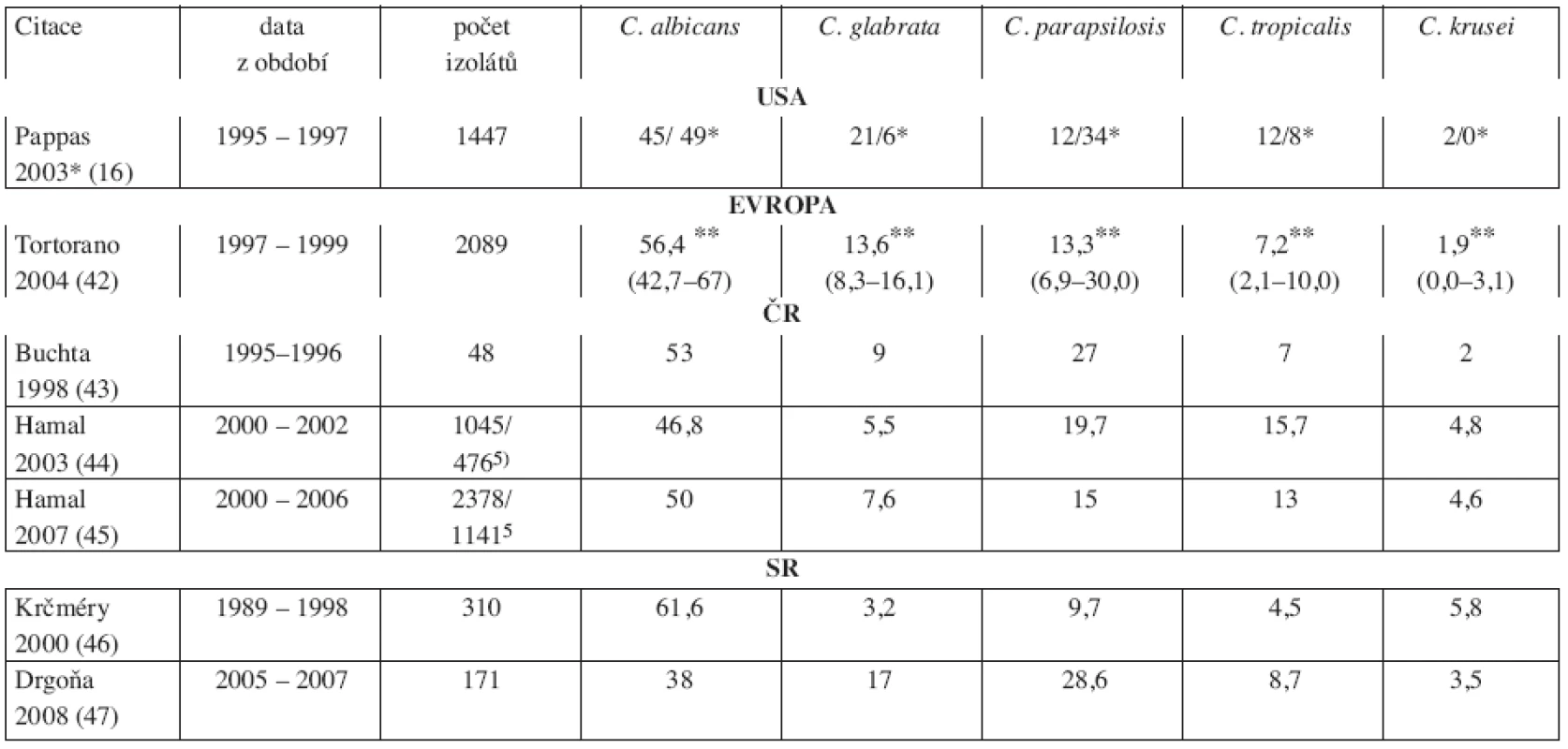
* dospělí/ děti; ** evropská studie, v závorce rozpětí výskytu 3.2 Farmakologická léčba hematogenní kandidózy (kandidemie) a invazivního kandidového onemocnění (akutní diseminované kandidózy)
Léčbu kandidemie je nutné zahájit co nejdříve, každý den prodlení zvyšuje mortalitu o více než 10 % (81, 82). Proto je nutná včasná diagnostika a u nejrizikovějších nemocných je doporučeno již v den odběru hemokultur zahájit empirickou léčbu (82). Délka léčby by měla trvat nejméně 14 dní po klinické stabilizaci a vymizení pozitivního kultivačního nálezu (83, 84).
V současné době je nabídka léků pro léčbu invazivní kandidózy a kandidemie širší než v případě invazivní aspergilózy. Patří mezi ně polyeny (amfotericin B a formy vázané na tukové vehikulum), triazoly (flukonazol, itrakonazol, vorikonazol) a echinokandiny (kaspofungin, anidulafungin, mikafungin). Postavení jednotlivých antimykotik v doporučení pro léčbu kandidózy je založeno na důkazech – na prokázané účinnosti ve srovnávacích studiích, a na kvalitě těchto studií hodnocených podle objektivních kritérií (85). Stejným způsobem byla publikována řada „guidelines“ (49, 56, 86–89). Význam formulování doporučených léčebných postupů dokladují studie, ze kterých vyplývá, že nestandardní léčba je spojena s vyšší mortalitou (90) a že v některých případech je rozdíl v mortalitě statisticky významný (91).
Nejvíce studií bylo publikováno s konvenčním amfotericinem B (c-AmB), který byl do 90. let 20. století jediným lékem volby invazivní kandidózy a kandidemie. Většina srovnávacích studií byla prováděna u nemocných bez neutropenie. Studie, které se staly základem hodnocení a postavení jednotlivých léčiv, byly jednak prospektivní, srovnávací nezaslepené (83, 92–94), jednak prospektivní studie observační (63, 95, 96), jednak retrospektivní (72) a také studie prospektivní randomizované zaslepené (97–99).Nejvýznamnější z nich jsou uvedeny v tabulce 2.
Tab. 2. Randomizované kontrolované srovnávací studie 1. linie léčby invazivní kandidózy a kandidemie 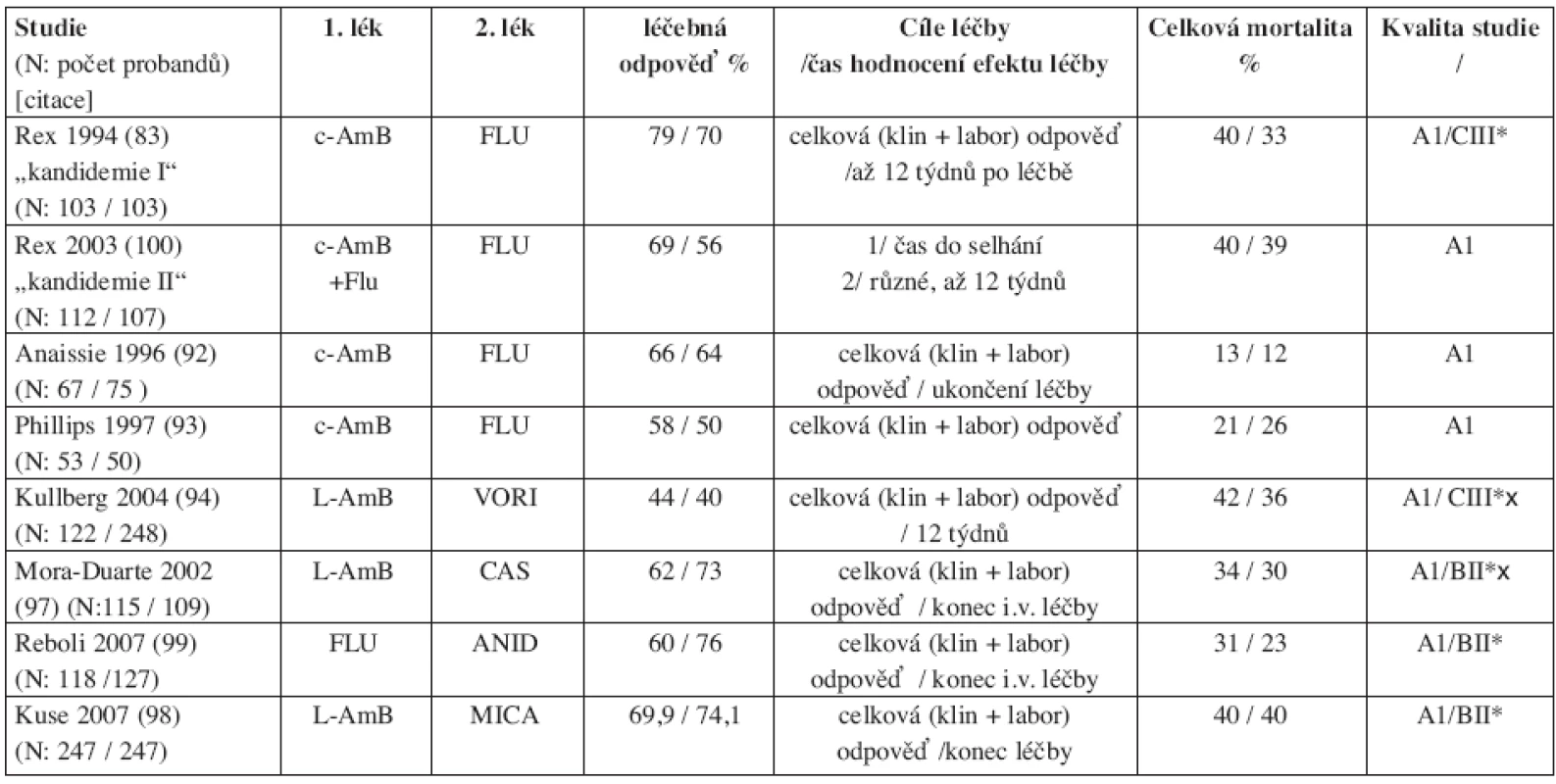
FLU: flukonazol; c-AmB: konvenční amfotericin B; CAS: kaspofungin; VORI: vorikonazol; L-AmB: liposomální amfotericin B, ANID: anidulafungin; MICA: mikafungin; x: nemocní s neutropenií N: počet probandů léčených 1. lékem / počet probandů léčených 2. (srovnávaným) lékem; *: hodnocení pro neutropenické pacienty; x hodnocení pro infekce způsobené C. krusei a C. glabrata 3.2.1 Amfotericiny
První srovnávací studii (tzv. kandidemie I) konvenčního amfotericinu B (c-AmB) (N = 103) versus flukonazol (N = 103) v léčbě kandidemie u non-neutropenických nemocných, publikoval Rex (83). Kritériem úspěšné léčby bylo úplné odeznění klinických známek infekce a negativita kultivačního nálezu, což de facto splňuje kritéria kompletní odpovědi. Výsledky léčby nebyly statisticky rozdílné (tab. 2), rozdílný nebyl ani počet selhání, ani procento úmrtí. Jediný rozdíl byl v menší toxicitě flukonazolu (37 % vs 2 %). Podobně ani v dalších studiích (92, 93, 100) nebyl zjištěn rozdíl v účinnosti mezi c-AmB a flukonazolem. Za zdůraznění stojí druhá studie Rexe (100), tzv. kandidemie II, ve které byla řešena jednak otázka vyšších dávek flukonazolu (800 mg/den, tj. cca 10 mg/kg) (101) a jednak efekt kombinace flukonazolu s c-AmB. Autoři nezjistili antagonismus kombinace flukonazolu s c-AmB, naopak z hlediska klinického hodnocení léčby byla tato kombinace blízko statistické významnosti úspěšnější jak v klinickém hodnocení léčby, tak i ve vyšším procentu a dřívější eradikaci infekce.
Roli konvenčního amfotericinu B ve srovnání s tehdy novým flukonazolem shrnuje metaanalýza (102) celkem 826 epizod kandidemie u nemocných bez neutropenie ze šesti prospektivních randomizovaných a observačních studií z let 1996–1999 (63, 83, 92, 93, 95, 96). Metaanalýza prokazuje stejnou účinnost obou preparátů s výrazně nižší toxicitou flukonazolu. Limit těchto studií spočívá v tom, že nebyli zařazeni nemocní s infekcí a C. krusei (primární rezistence na flukonazol) a C. glabrata (získaná rezistence na flukonazol 0–80 %).
3.2.2 Amfotericiny na tukovém nosiči
Amfotericiny na tukovém nosiči v žádné ze studií neprokázaly lepší účinnost než c–AmB (103–105). Jejich zásadní výhodou je omezení rizika nefrotoxicity, většinou i snížení incidence a intenzity akutních nežádoucích účinků vázaných na aplikaci infuze (třesavka, horečka, hypotenze...). Indikace lipidových forem AmB je preferována, i když víme, že při lege artis podaném c-AmB (106–109), s dostatečně dlouhou aplikací infuze, s dostatečnou hydratací a suplementací iontů je možné riziko nefrotoxicity omezit (110–115) a při řádné premedikací omezit i výskyt akutních nežádoucích účinků.
Účinnost lipidového komplexu amfotericinu B (ABLC) u invazivní kandidózy a kandidemie v rámci CLEAR (116) byla hodnocena celkem u 979 nemocných s kandidózou – jde o největší kohortu nemocných s kandidózou léčených jedním lékem. Z toho bylo 207 nemocných s kandidemií (N = 123), s invazivní kandidózou (N = 58) nebo kombinací obou (N = 26). Soubor byl stratifikován a hodnocen podle různých kritérií, včetně infekcí způsobené C. albicans vs non-albicans, kde byly výsledky v zásadě obdobné – bylo dosaženo klinické odpovědi mezi 55 % –67 %. Ani u neutropenických nebyly výsledky rozdílné, i když významně horší, mezi 20–25 %. Anaissie (117) prezentoval v roce 1995 na ICAAC srovnávací studii ABLC (N = 153) vs c-AmB (N = 78). Výsledky byly v obou skupinách také obdobné, jak v dosažení klinické odpovědi (ABLC vs c-AmB: 65 % vs 61 %), tak i v procentu mortality (40 % vs 49 %), eradikaci infekce (88 % vs 87 %), tak i u nemocných s neutropenií (27 % vs 33 %) či bez neutropenie (70 % vs 66 %). Práce však nebyla dále publikována.
Zkušenosti s koloidní disperzí amfotericinu B AmB (ABCD) v léčbě invazivní mykózy jsou shrnuty v souboru s 220 nemocnými (data byla získána retrospektivně z pěti nekomparativních studií) po transplantaci kostní dřeně (167 alogenní, 53 autologní), z nichž 100 mělo kandidovou infekci (118). ABCD byl podáván převážně ve 2. linii, po selhání předchozí léčby, nebo s projevy intolerance nebo nefrotoxicity po předchozí léčbě c-AmB. Hodnoceni byli jen nemocní s prokázanou infekcí, kteří dostali ABCD nejméně 7 dní a žádná další antimykotika do kombinace. S invazivní kandidózou bylo proto hodnoceno jen 46 nemocných. Klinické odpovědi (kompletní + parciální) dosáhlo celkem 65 % (30/46) z nich, z toho 64 % (21/33) nemocných po alogenní transplantaci kostní dřeně a 69 % (9/13) po autologní transplantaci. Zemřelo 54 % (25/46) nemocných s kandidózou, autoři uvádějí vyšší procento úmrtí po alogenní transplantaci, ale bez bližšího rozdělení. Podobně jako při léčbě ABLC, i v případě ABCD nedocházelo u preexistujícího renálního poškození ke vzestupu kreatininu. Údaje ze stejné databáze jsou publikovány i v další práci Noskina (119).
Liposomální amfotericin B (Ambisome) není v ČR registrován, nejsou s ním významnější zkušenosti, proto v tomto textu klinické studie ani neuvádíme.
Indikace lipidových amfotericinů byly v zásadě formulovány již dříve (120). Rozhodujeme se pro ně zejména 1/ po selhání předchozí léčby c-AmB, 2/ při projevech nefrotoxicity po předchozí léčbě c-AmB 3/ při výrazných projevech akutní toxicity po c-AmB, 4/ při preexistujícím renálním poškození 5/ při současné léčbě nefrotoxickými léky.
3.2.3. triazoly
Výsledky studií s flukonazolem byly uvedeny výše, jsou podkladem zařazení flukonazolu mezi léky 1. volby léčby invazivní kandidózy a kandidemie u nemocných bez neutropenie, s výjimkou infekcí způsobených C. krusei a C. glabrata (tab. 2).
Vorikonazol, triazol 2. generace byl v prospektivní randomizované otevřené studii srovnáván proti konvenčnímu postupu c–AmB + flukonazol (AmB/Flu) v primární léčbě kandidemie u non-neutropenických nemocných (94). V primární analýze, po skončení léčby, v celkové mortalitě, v čase dosažení mykologické eradikace patogena v hemokultuře bylo dosaženo stejných výsledků, rozdíly nebyly statisticky signifikantní. Vorikonazol tak rozšířil léky 1. linie v léčbě invazivní kandidózy a kandidemie u nemocných bez neutropenie (tab. 2)
Itrakonazol nemá validní studii v 1. linii léčby invazivní kandidózy, pouze na malém souboru (N = 37) byl srovnáván s flukonazolem (N = 44). Výsledky, které byly v obou skupinách stejné (92 % vs 91 %) byly prezentovány jen formou příspěvku na symposiu intenzivistů (121). Posakonazol dosud nemá studii invazivní kandidózy a kandidemie, proto není v uvedené indikaci hodnocen.
3.2.4 Echinokandiny
Významnou skupinou antimykotik jsou echinokandiny, které prokázaly velmi dobrý účinek při léčbě invazivní kandidózy. První z nich, kaspofungin, rozšířil spektrum léků 1. volby v roce 2002. Ve dvojitě slepé studii (97) invazivní kandidózy a kandidemie byl srovnáván kaspofungin (CAS) (n = 109) proti c-AmB (n = 115) (tab. 2). Soubor nemocných byl stratifikován podle skóre APACHE II, podle neutropenie (< 0,5 x 109/l CAS vs c-AmB: 12,8 % (14/109) vs 8,7 % (10/115), podle kandidemie, podle účinnosti u C. albicans a non-albicans a dalších kritérií. V globálním hodnocení souboru, ve kterém byli hodnoceni nemocní s prokázanou infekcí a s alespoň jednou dávkou antimykotika, dosáhl kaspofungin celkově podobných výsledků jako c-AmB (celková odpověď 73,4 % vs. 61,7 %). V globálním hodnocení nebyly zásadní rozdíly ani v podskupinách podle APACHE II skóre >20 (CAS 57,1 %; 12/21 vs AmB 43,5 %; 10/23) a podle neutropenie (CAS vs c-AmB 50 %; 7/14 vs 40 %, 4/10), ani ve výsledcích léčby kandidemie (71,7 % vs 62,8 %), ani v mortalitě.
Další echinokandin – anidulafungin – je v ČR v roce 2008 aktuálně registrován. Jeho účinnost byla ověřována v léčbě invazivní kandidózy ve dvojitě slepé randomizované studii proti flukonazolu. Anidulafungin v této studii prokázal lepší výsledky a dosáhl tak nejen cíle studie, noninferiority (99), ale statisticky významně lepších výsledků, tj.superiority. Soubor nemocných byl stratifikován kromě dalších kriterií také podle APACHE II skóre, podle neutropenie, vyloučeni byli, kromě jiných kritérií, nemocní, kteří dostávali 30 dní před studií profylakticky jakékoli azoly po dobu 7 dní, nemocní s předchozí rezistentní kandidovou infekcí a s prokázanou infekcí Candidakrusei. Celková odpověď, hodnocená na konci nitrožilní léčby, byla ve skupině léčených anidulafunginem významně lepší (75,6 % vs 60,2 %; rozdíl: 15,4 %; P = 0,01). Při hodnocení na konci léčby byly výsledky obdobné 74 % vs 56,8 %, stejně tak 2 týdny po skončení léčby (64,6 % vs 49,2 %) a po 6 týdnech po skončení léčby (55,9 % vs 44,1 %). U nemocných s izolovanou kandidemií dosáhlo příznivé odpovědi 75,9 % vs 61,2 % (P = 0,02). Ve skupině anidulafunginu zemřelo méně nemocných 22,8 % vs 31,4 %. Medián času do úmrtí byl 21 dní versus 14 dní. Celkově výsledky anidulafunginu jsou obdobné, jako ve studii kaspofungin vs amfotericin (97), výsledky dosažené flukonazolem jsou obdobné jako ve studii Rexe (100).
Mikafungin, další echinokandin, se má objevit na trhu v ČR na podzim 2008. Velmi dobrou účinnost u kandidemie prokázal jak v nekomparativní studii (122), tak ve dvojitě zaslepené srovnávací studii mikafungin s liposomálním amfotericinem (98) v primární léčbě kandidemie a invazivní kandidózy. Hodnoceni byli – s cílem posouzení non-inferiority – všichni nemocní s nejméně jednou dávku léčby (MICA: N = 247, L-AmB N = 247). Terapeutickou účinnost (úplná a částečná klinická odpověď + laboratorní eradikace patogena) hodnotila nezávislá „zaslepená“ komise na konci léčby, bez časového limitu, nemocní byli sledováni 12 týdnů. Celkový úspěch léčby se mezi oběma skupinami nelišil, MICA (74,1 %, 183/247) vs L-AmB (69,9 %; 172/247), a to ani v dosažení kompletní odpovědi (64,4 % vs 60,7 %). Rozdíl nebyl ani v podskupinách podle neutropenie (59,4 % vs 56 %), nebo primární lokalizace infekce, podle druhu infekce (C. albicans vs non-albicans), ani podle APACHE II, či v procentu selhání laboratorní eradikace, ani v mortalitě (18 % vs 17 %), resp. 40 % na konci léčby v obou skupinách.
Ke skupině echinokandinů je nutné zdůraznit, že žádná ze studií nemá dostatečnou sílu důkazu k doporučení pro léčbu neutropenických nemocných (C III) (tab. 3), neboť ve studiích byl hodnocen jen malý počet nemocných. Proto i výsledky jsou zatíženy chybou malých čísel.
Tab. 3. Srovnání studií s echinokandiny u invazivní kandidózy a kandidemie: počty nemocných s neutropenií (leu < 0,5) a výsledky léčby. 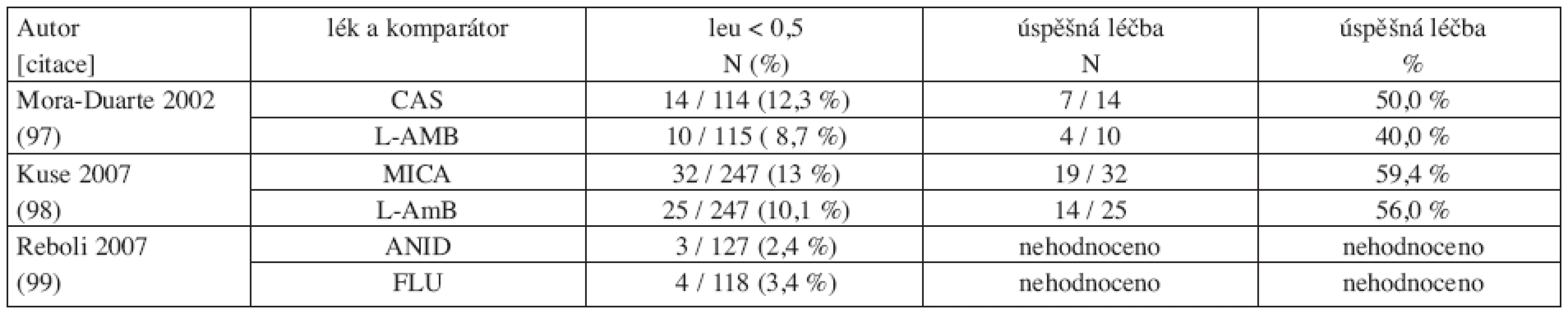
N: počet neutropenických nemocných / celkový počet nemocných ve studii, (%): procento neutropenických nemocných z celkového počtu nemocných ve studii 3.3 Délka léčby invazivní kandidózy a kandidemie
Současná doporučení pro délku léčby kandidózy a kandidemie u pacienta bez neutropenie je 14 dní po posledním pozitivním kultivačním nálezu za předpokladu vymizení odeznění všech klinických známek infekce (56, 87), prodloužení léčby se předpokládá při orgánové kandidóze, při hepatosplenické formě nejméně 6 týdnů až několik (12) měsíců, resp. do vymizení nebo do kalcifikace lézí v orgánech (89).
3.4 Význam kultivačních vyšetření a stanovení citlivosti (MIC) na antimykotika
Skupina autorů ECIL doporučuje vyšetřovat citlivost na antimykotika u hematologických pacientů. Znalost výsledků umožní korelovat klinický efekt léčby s laboratorní eradikací infekce ev. zjistit příčinu selhání léčby. Současně umožní v některých případech kvalifikovaně přejít z nitrožilní léčby na perorální antimykotikum.
4. Doporučení a závěr
Většina klinických studií léčby invazivní kandidózy a kandidemie se týkala nemocných bez neutropenie. Při přípravě doporučených postupů jsme vycházeli z práce skupiny ECIL (European Conference on Infection in Leukemia: ECIL 1 a ECIL 2) (84, 89), jejíž koncepce respektovala doporučení pro podskupinu nemocných bez neutropenie a pro nemocné s neutropenií, tj. především pro hematologické malignity.
Epidemiologická data svědčí pro absolutní pokles výskytu C. albicans a vzestup non-albicans kmenů kandid, zejména C. krusei (123-125), C. glabrata (126, 127), C. parapsilosis (128). Ty mají obecně nižší citlivost vůči flukonazolu, některé jsou primárně rezistentní na flukonazol (C. krusei), některé rezistenci získají (C. glabrata) (127–131).
4.1 Postup při časné léčbě hematogenní infekce před určením druhu kandidy
U rizikových (neutropenických) nemocných je proto nevhodné před určením druhu kandidy podat flukonazol, ten je indikován jen v případě, že jsou splněna kritéria pro aplikaci flukonazolu tj. „nerizikových“ nemocných (= bez neutropenie, klinicky stabilizovaný nemocný normální TK, P, klinicky trend ke zlepšení, bez komplikujících komorbidit) (86). U rizikových nemocných se rozhodujeme v první linii pro echinokandiny, amfotericiny resp. lipidové formy a triazoly (vorikonazol) mají určité limity. V klinických studiích nemocných bez neutropenie však uvedené skupiny léků prokázaly stejnou efektivitu, proto byly označeny stupněm A I (tab. 4). Limitem c-AmB je nefrotoxicita, proto je nelze doporučit (stupeň D III) při současné léčbě (86) nefrotoxickými léky a zásadně nedoporučit (E III) při renální insuficienci. Indiace vorikonazolu je omezena na infekce Candida krusei.
Tab. 4. Kvalita důkazů a síla doporučení podle CDC pro antimykotika u nemocných před identifikací druhu kandidy. Podle Herbrecht (84, 89). 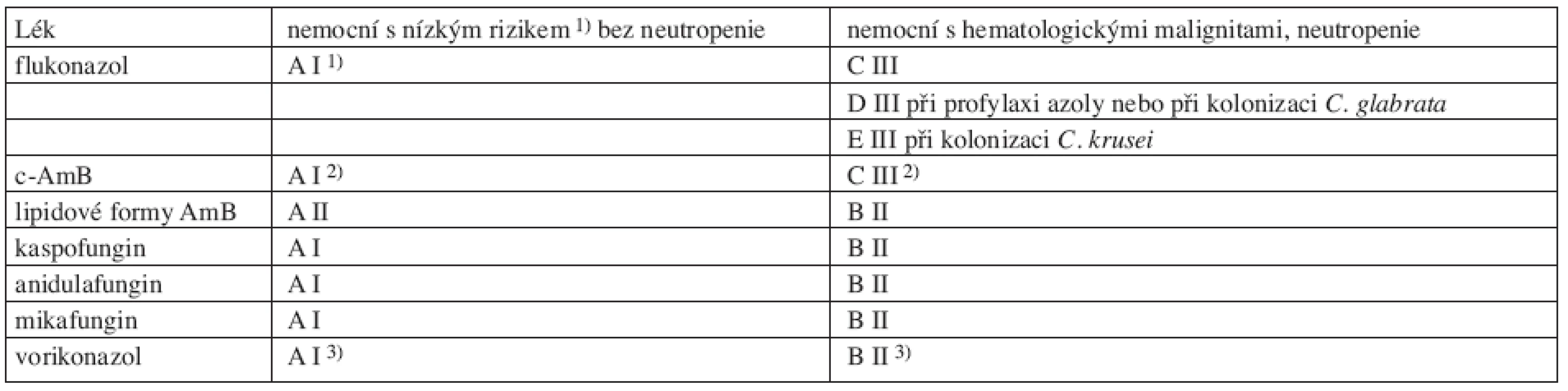
c-AmB: konvenční amfotericin B, 1): hemodynamicky stabilizovaný, bez závažných komorbidit, klinicky tendence ke zlepšení; 2) DIII při současné léčbě nefrotoxickými léky a E III při renální insuficienci 3):pokud nejsou azoly v profylaxi 4.2 Postup při časné léčbě hematogenní kandidové infekce způsobené Candida albicans, C. glabrata, nebo C. krusei
Lékem volby jsou echinokandiny (tab. 5), ve výsledcích klinických studií není mezi nimi rozdíl (tab. 2, 3), volbu mezi jednotlivými preparáty lze zvažovat jen v mezních situacích (jaterní nebo renální selhání...). Pozice c-AmB je oslabena průvodní nefrotoxicitou, vorikonazol je alternativou pro infekci C. krusei, jinak se doporučuje jej spíše ponechat pro léčbu invazivní aspergilózy, kde je lékem první volby (132).
Tab. 5. Kvalita důkazů a síla doporučení podle CDC pro antimykotika nemocných hematologickými malignitami s kandidemií při infekci C. albicans, C. glabrata, C. krusei. Podle Herbrecht (84, 89). 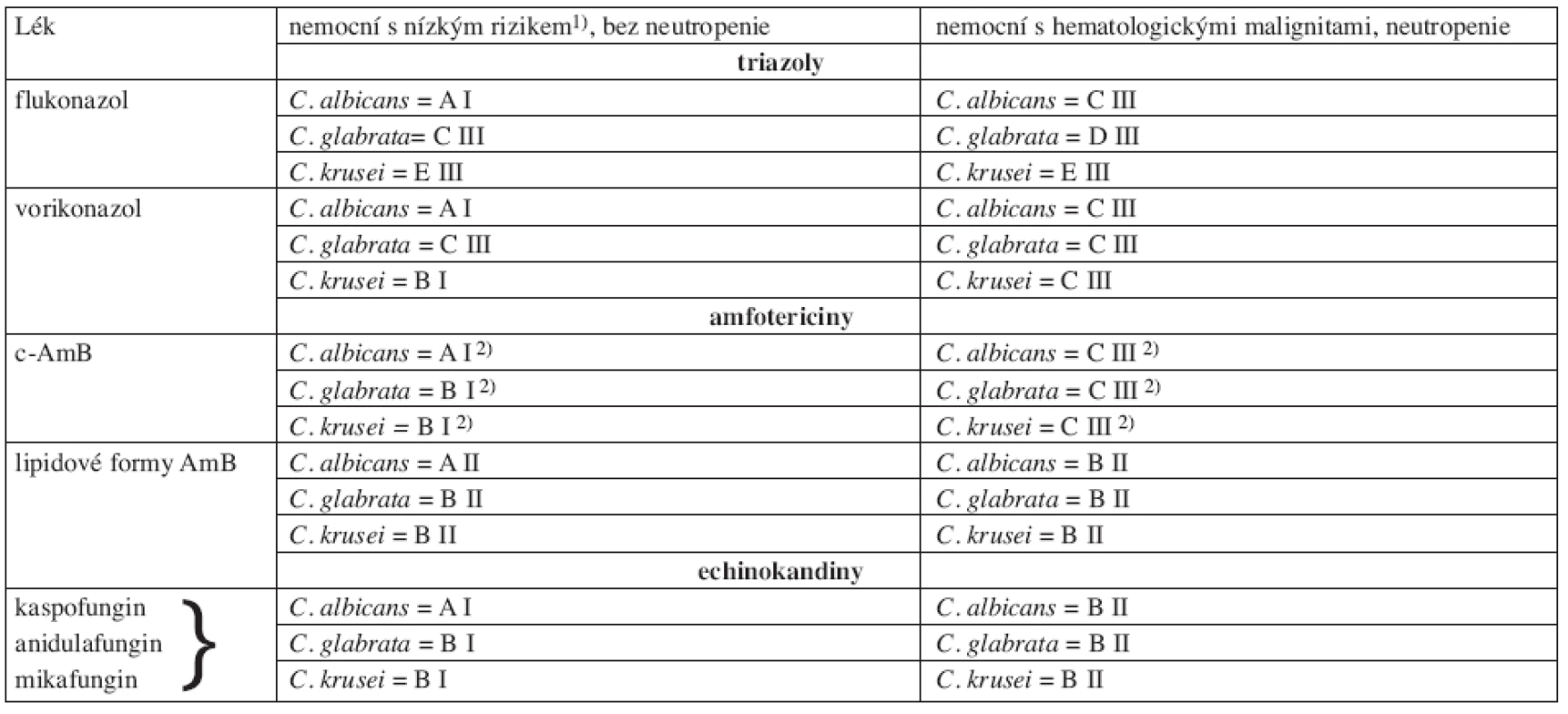
c-AmB: konvenční amfotericin B, 1) hemodynamicky stabilizovaný, bez závažných komorbidit, klinicky tendence ke zlepšení; 2) DIII při současné léčbě nefrotoxickými léky a EIII při renální insuficienci 4.3 Obvyklé dávkování antimykotik
Tab. 6.
Tab. 6. Obvyklé dávkování antimykotik. 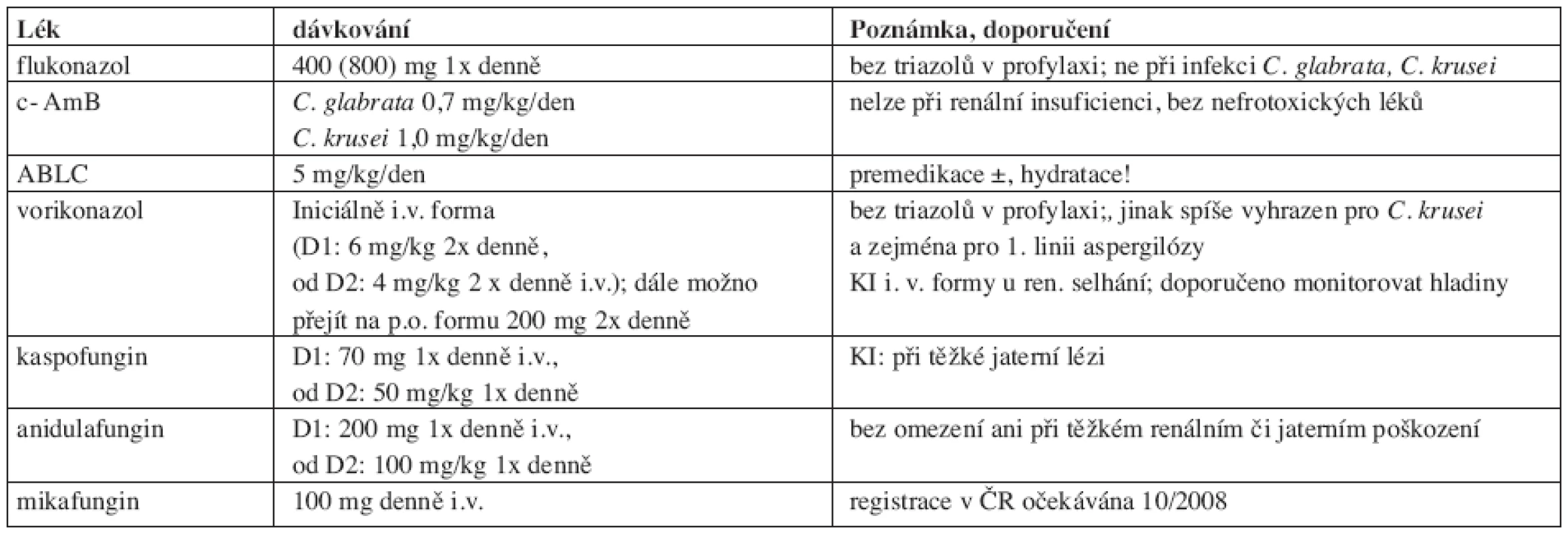
c- AmB: konvenční amfotericin B; ABLC: lipidový komplex amfotericinu B 5. Závěr
Závěrem chceme zdůraznit, že tato léčebná doporučení je nutné brát jen jako zásadní informaci, která je časově omezená a kterou nelze mechanicky aplikovat v klinické praxi. Všichni víme, že v případě konkrétního pacienta, při rozhodování u lůžka, je potřeba komplexní posouzení celkového stavu nemocného, což znamená zejména zhodnocení základního onemocnění, zvážení farmakologických vlastností antimykotik, současné medikace a dalších faktorů. Až pak se kvalifikovaně rozhodujeme pro lék 1. volby. Širší nabídka antimykotik také umožňuje využít sekvenční léčby, kdy po neúspěchu jedné skupiny antimykotik lze pokračovat v léčbě jinou, stejně tak je možné zvážit kombinaci antimykotik.
Vydáno se svolením redakční rady Vnitřního lékařství. Publikováno ve Vnitř. Lék. 2008; 54(12): 1174–1184.
Zdroje
1. Morgan J, Meltzer MI, Plikaytis BD et al. Excess mortality, hospital stay, and cost due to candidemia: a case-control study using data from population-based candidemia surveillance. Infect Control Hosp Epidemiol 2005; 26 : 540-547.
2. Pfaller M, Wenzel R. Impact of the changing epidemiology of fungal infections in the 1990s. Eur J Clin Microbiol Infect Dis 1992; 11 : 287–291.
3. Beck-Sague C, Jarvis WR. Secular trends in the epidemiology of nosocomial fungal infections in the United States, 1980–1990. National Nosocomial Infections Surveillance System. J Infect Dis 1993; 167 : 1247–1251.
4. Kao AS, Brandt ME, Pruitt WR et al. The epidemiology of candidemia in two United States cities: results of a population-based active surveillance. Clin Infect Dis 1999; 29 : 1164–1170.
5. Diekema DJ, Messer SA, Brueggemann AB et al. Epidemiology of candidemia: 3-year results from the emerging infections and the epidemiology of Iowa organisms study. J Clin Microbiol 2002; 40 : 1298–1302.
6. Hajjeh RA, Sofair AN, Harrison LH et al. Incidence of bloodstream infections due to Candida species and in vitro susceptibilities of isolates collected from 1998 to 2000 in a population-based active surveillance program. J Clin Microbiol 2004; 42 : 1519–1527.
7. Abi-Said D, Anaissie E, Uzun O et al. The epidemiology of hematogenous candidiasis caused by different Candida species. Clin Infect Dis 1997; 24 : 1122–1128.
8. Goodman JL, Winston DJ, Greenfield RA et al. A controlled trial of fluconazole to prevent fungal infections in patients undergoing bone marrow transplantation. N Engl J Med 1992; 326 : 845–851.
9. Laverdiere M, Rotstein C, Bow EJ et al. Impact of fluconazole prophylaxis on fungal colonization and infection rates in neutropenic patients. The Canadian Fluconazole Study. J Antimicrob Chemother 2000; 46 : 1001–1008.
10. Junghanss C, Marr KA. Infectious risks and outcomes after stem cell transplantation: are nonmyeloablative transplants changing the picture? Curr Opin Infect Dis 2002; 15 : 347–353.
11. Gudlaugsson O, Gillespie S, Lee K et al. Attributable mortality of nosocomial candidemia, revisited. Clin Infect Dis 2003; 37 : 1172–1177.
12. Marr KA. The changing spectrum of candidemia in oncology patients: therapeutic implications. Curr Opin Infect Dis 2000; 13 : 615–620.
13. Kami M, Machida U, Okuzumi K et al. Effect of fluconazole prophylaxis on fungal blood cultures: an autopsy-based study involving 720 patients with haematological malignancy. Br J Haematol 2002; 117 : 40–46.
14. Sendid B, Cotteau A, Francois N et al. Candidaemia and antifungal therapy in a French University Hospital: rough trends over a decade and possible links. BMC Infect Dis 2006; 6 : 80.
15. Eggimann P, Garbino J, Pittet D. Epidemiology of Candida species infections in critically ill non-immunosuppressed patients. Lancet Infect Dis 2003; 3 : 685–702.
16. Pappas PG, Rex JH, Lee J et al. A prospective observational study of candidemia: epidemiology, therapy, and influences on mortality in hospitalized adult and pediatric patients. Clin Infect Dis 2003; 37 : 634–643.
17. Ostrosky-Zeichner L, Pappas PG. Invasive candidiasis in the intensive care unit. Crit Care Med 2006; 34 : 857–863.
18. Trick WE, Fridkin SK, Edwards JR et al. Secular trend of hospital-acquired candidemia among intensive care unit patients in the United States during 1989–1999. Clin Infect Dis 2002; 35 : 627–630.
19. Wisplinghoff H, Bischoff T, Tallent SM et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Infect Dis 2004; 39 : 309–317.
20. Asmundsdottir LR, Erlendsdottir H, Gottfredsson M. Increasing incidence of candidemia: results from a 20-year nationwide study in Iceland. J Clin Microbiol 2002; 40 : 3489–3492.
21. Poikonen E, Lyytikainen O, Anttila VJ, Ruutu P. Candidemia in Finland, 1995–1999. Emerg Infect Dis 2003; 9 : 985–990.
22. Almirante B, Rodriguez D, Park BJ et al. Epidemiology and predictors of mortality in cases of Candida bloodstream infection: results from population-based surveillance, barcelona, Spain, from 2002 to 2003. J Clin Microbiol 2005; 43 : 1829–1835.
23. Sandven P, Bevanger L, Digranes A et al. Constant low rate of fungemia in norway, 1991 to 1996. The Norwegian Yeast Study Group. J Clin Microbiol 1998; 36 : 3455–3459.
24. Sandven P, Bevanger L, Digranes A et al. Candidemia in Norway (1991 to 2003): results from a nationwide study. J Clin Microbiol 2006; 44 : 1977–1981.
25. Richet H, Roux P, Des Champs C et al. Candidemia in French hospitals: incidence rates and characteristics. Clin Microbiol Infect 2002; 8 : 405–412.
26. Rodriguez D, Almirante B, Park BJ et al. Candidemia in neonatal intensive care units: Barcelona, Spain. Pediatr Infect Dis J 2006; 25 : 224–229.
27. McNeil MM, Nash SL, Hajjeh RA et al. Trends in mortality due to invasive mycotic diseases in the United States, 1980–1997. Clin Infect Dis 2001; 33 : 641–647.
28. Hobson RP. The global epidemiology of invasive Candida infections-is the tide turning? J Hosp Infect 2003; 55 : 159–168; quiz 233.
29. Marr KA, Seidel K, Slavin MA et al. Prolonged fluconazole prophylaxis is associated with persistent protection against candidiasis-related death in allogeneic marrow transplant recipients: long-term follow-up of a randomized, placebo-controlled trial. Blood 2000; 96 : 2055–2061.
30. Marr KA. Invasive Candida infections: the changing epidemiology. Oncology (Williston Park) 2004; 18 : 9–14.
31. Chamilos G, Luna M, Lewis RE et al. Invasive fungal infections in patients with hematologic malignancies in a tertiary care cancer center: an autopsy study over a 15-year period (1989–2003). Haematologica 2006; 91 : 986–989.
32. Peman J, Canton E, Gobernado M. Epidemiology and antifungal susceptibility of Candida species isolated from blood: results of a 2-year multicentre study in Spain. Eur J Clin Microbiol Infect Dis 2005; 24 : 23–30.
33. Pfaller MA, Diekema DJ. Epidemiology of invasive candidiasis: a persistent public health problem. Clin Microbiol Rev 2007; 20 : 133–163.
34. Nguyen MH, Peacock JE, Jr., Morris AJ et al. The changing face of candidemia: emergence of non-Candida albicans species and antifungal resistance. Am J Med 1996; 100 : 617–623.
35. Antoniadou A, Torres HA, Lewis RE et al. Candidemia in a tertiary care cancer center: in vitro susceptibility and its association with outcome of initial antifungal therapy. Medicine (Baltimore) 2003; 82 : 309–321.
36. Marchetti O, Bille J, Fluckiger U et al. Epidemiology of candidemia in Swiss tertiary care hospitals: secular trends, 1991–2000. Clin Infect Dis 2004; 38 : 311–320.
37. Martin D, Persat F, Piens MA, Picot S. Candida species distribution in bloodstream cultures in Lyon, France, 1998–2001. Eur J Clin Microbiol Infect Dis 2005; 24 : 329–333.
38. Richardson MD. Changing patterns and trends in systemic fungal infections. J Antimicrob Chemother 2005; 56 Suppl 1: i5–i11.
39. Boktour MR, Kontoyiannis DP, Hanna HA et al. Multiple-species candidemia in patients with cancer. Cancer 2004; 101 : 1860–1865.
40. Tortorano AM, Caspani L, Rigoni AL et al. Candidosis in the intensive care unit: a 20-year survey. J Hosp Infect 2004; 57 : 8–13.
41. Dimopoulos G, Karabinis A, Samonis G, Falagas ME. Candidemia in immunocompromised and immunocompetent critically ill patients: a prospective comparative study. Eur J Clin Microbiol Infect Dis 2007; 26 : 377–384.
42. Tortorano AM, Peman J, Bernhardt H et al. Epidemiology of candidaemia in Europe: results of 28-month European Confederation of Medical Mycology (ECMM) hospital-based surveillance study. Eur J Clin Microbiol Infect Dis 2004; 23 : 317–322.
43. Buchta V, M. K, Bergerová T. Výskyt potenciálně patogenních kvasinek v krvi a moči pacientů ve velkých nemocnicích v české republice. Klin Mikrobiol Inf Lék 1998; 4 : 10–17.
44. Hamal P, Dobiášová S, Kocmanová I. Candidemia in large Czech hospitals, 2000 – 2002: An epidemiological study. 15th Congress of the International Society for Human and Animal Mycology. San Antonio, 2003; 463.
45. Hamal P, Kocmanová I, Jedličková A, et a. Epidemiological analysis of candidemia in Czech tertiary care hospitals in 2000 – 2006. J Chemother 2007; 19(suppl.3): S61–S62.
46. Krcmery V, Jr., Kovacicova G. Longitudinal 10-year prospective survey of fungaemia in Slovak Republic: trends in etiology in 310 episodes. Slovak Fungaemia study group. Diagn Microbiol Infect Dis 2000; 36 : 7–11.
47. Drgona L, Trupl J, Roidova A, et al. Fungaemia in Slovakia: a prospective, national study. ECCMID 2008, Barcelona. 2008.
48. Rex JH, Bennett JE, Sugar AM et al. Intravascular catheter exchange and duration of candidemia. NIAID Mycoses Study Group and the Candidemia Study Group. Clin Infect Dis 1995; 21 : 994–996.
49. Rex JH, Walsh TJ, Sobel JD et al. Practice guidelines for the treatment of candidiasis. Infectious Diseases Society of America. Clin Infect Dis 2000; 30 : 662–678.
50. Luzzati R, Amalfitano G, Lazzarini L et al. Nosocomial candidemia in non-neutropenic patients at an Italian tertiary care hospital. Eur J Clin Microbiol Infect Dis 2000; 19 : 602–607.
51. Walsh TJ, Rex JH. All catheter-related candidemia is not the same: assessment of the balance between the risks and benefits of removal of vascular catheters. Clin Infect Dis 2002; 34 : 600–602.
52. Viudes A, Peman J, Canton E et al. Candidemia at a tertiary-care hospital: epidemiology, treatment, clinical outcome and risk factors for death. Eur J Clin Microbiol Infect Dis 2002; 21 : 767–774.
53. Fatkenheuer G, Buchheidt D, Cornely OA et al. Central venous catheter (CVC)-related infections in neutropenic patients-guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 2003; 82 Suppl 2: S149–157.
54. Fatkenheuer G, Cornely O, Seifert H. Clinical management of catheter-related infections. Clin Microbiol Infect 2002; 8 : 545–550.
55. Maki DG, Crnich CJ. Line sepsis in the ICU: prevention, diagnosis, and management. Semin Respir Crit Care Med 2003; 24 : 23–36.
56. Pappas PG, Rex JH, Sobel JD et al. Guidelines for treatment of candidiasis. Clin Infect Dis 2004; 38 : 161–189.
57. Pasqualotto AC, de Moraes AB, Zanini RR, Severo LC. Analysis of independent risk factors for death among pediatric patients with candidemia and a central venous catheter in place. Infect Control Hosp Epidemiol 2007; 28 : 799–804.
58. Karlowicz MG, Hashimoto LN, Kelly RE, Jr., Buescher ES. Should central venous catheters be removed as soon as candidemia is detected in neonates? Pediatrics 2000; 106: E63.
59. Nucci M, Anaissie E. Should vascular catheters be removed from all patients with candidemia? An evidence-based review. Clin Infect Dis 2002; 34 : 591–599.
60. Mermel LA, Farr BM, Sherertz RJ et al. Guidelines for the management of intravascular catheter-related infections. Clin Infect Dis 2001; 32 : 1249–1272.
61. O‘Grady NP, Alexander M, Dellinger EP et al. Guidelines for the prevention of intravascular catheter-related infections. Infect Control Hosp Epidemiol 2002; 23 : 759–769.
62. Vescia S, Baumgartner AK, Jacobs VR et al. Management of venous port systems in oncology: a review of current evidence. Ann Oncol 2008; 19 : 9–15.
63. Nguyen MH, Peacock JE, Jr., Tanner DC et al. Therapeutic approaches in patients with candidemia. Evaluation in a multicenter, prospective, observational study. Arch Intern Med 1995; 155 : 2429–2435.
64. Lecciones JA, Lee JW, Navarro EE et al. Vascular catheter-associated fungemia in patients with cancer: analysis of 155 episodes. Clin Infect Dis 1992; 14 : 875–883.
65. Nucci M, Colombo AL, Silveira F et al. Risk factors for death in patients with candidemia. Infect Control Hosp Epidemiol 1998; 19 : 846–850.
66. Kibbler CC, Seaton S, Barnes RA et al. Management and outcome of bloodstream infections due to Candida species in England and Wales. J Hosp Infect 2003; 54 : 18–24.
67. Aliyu SH, Enoch DA, Abubakar, II et al. Candidaemia in a large teaching hospital: a clinical audit. Qjm 2006; 99 : 655–663.
68. Nucci M, Anaissie E. Revisiting the source of candidemia: skin or gut? Clin Infect Dis 2001; 33 : 1959–1967.
69. Blot F, Schmidt E, Nitenberg G et al. Earlier positivity of central-venous - versus peripheral-blood cultures is highly predictive of catheter-related sepsis. J Clin Microbiol 1998; 36 : 105–109.
70. Raad I, Hanna H, Maki D. Intravascular catheter-related infections: advances in diagnosis, prevention, and management. Lancet Infect Dis 2007; 7 : 645–657.
71. Pasqualotto AC, Severo LC. The importance of central venous catheter removal in patients with candidaemia: time to rethink our practice? Clin Microbiol Infect 2008; 14 : 2–4.
72. Anaissie EJ, Rex JH, Uzun O, Vartivarian S. Predictors of adverse outcome in cancer patients with candidemia. Am J Med 1998; 104 : 238–245.
73. Pearson ML. Guideline for prevention of intravascular device-related infections. Hospital Infection Control Practices Advisory Committee. Infect Control Hosp Epidemiol 1996; 17 : 438–473.
74. Seifert H, Cornely O, Seggewiss K et al. Bloodstream infection in neutropenic cancer patients related to short-term nontunnelled catheters determined by quantitative blood cultures, differential time to positivity, and molecular epidemiological typing with pulsed-field gel electrophoresis. J Clin Microbiol 2003; 41 : 118–123.
75. Blot F, Nitenberg G, Chachaty E et al. Diagnosis of catheter-related bacteraemia: a prospective comparison of the time to positivity of hub-blood versus peripheral–blood cultures. Lancet 1999; 354 : 1071–1077.
76. Kite P, Dobbins BM, Wilcox MH, McMahon MJ. Rapid diagnosis of central-venous-catheter-related bloodstream infection without catheter removal. Lancet 1999; 354 : 1504–1507.
77. Bouza E, Alvarado N, Alcala L et al. A randomized and prospective study of 3 procedures for the diagnosis of catheter-related bloodstream infection without catheter withdrawal. Clin Infect Dis 2007; 44 : 820–826.
78. Bouza E, Alvarado N, Alcala L et al. A prospective, randomized, and comparative study of 3 different methods for the diagnosis of intravascular catheter colonization. Clin Infect Dis 2005; 40 : 1096–1100.
79. Maki DG, Weise CE, Sarafin HW. A semiquantitative culture method for identifying intravenous-catheter-related infection. N Engl J Med 1977; 296 : 1305–1309.
80. Sherertz RJ, Raad, II, Belani A et al. Three-year experience with sonicated vascular catheter cultures in a clinical microbiology laboratory. J Clin Microbiol 1990; 28 : 76–82.
81. Morrell M, Fraser VJ, Kollef MH. Delaying the empiric treatment of candida bloodstream infection until positive blood culture results are obtained: a potential risk factor for hospital mortality. Antimicrob Agents Chemother 2005; 49 : 3640–3645.
82. Garey KW, Rege M, Pai MP et al. Time to initiation of fluconazole therapy impacts mortality in patients with candidemia: a multi-institutional study. Clin Infect Dis 2006; 43 : 25–31.
83. Rex JH, Bennett JE, Sugar AM et al. A randomized trial comparing fluconazole with amphotericin B for the treatment of candidemia in patients without neutropenia. Candidemia Study Group and the National Institute. N Engl J Med 1994; 331 : 1325–1330.
84. Herbrecht R, Flückiger U, Gachot B et al. 2007 update of the ECIL-1 guidelines for Antifungal therapy in leukemia patients. In 2nd European Conference on Infections in Leukemia, Edition Juan-les-Pins-France: 2007.
85. Kish MA. Guide to development of practice guidelines. Clin Infect Dis 2001; 32 : 851–854.
86. Edwards JE, Jr., Bodey GP, Bowden RA et al. International Conference for the Development of a Consensus on the Management and Prevention of Severe Candidal Infections. Clin Infect Dis 1997; 25 : 43–59.
87. Bohme A, Ruhnke M, Buchheidt D et al. Treatment of fungal infections in hematology and oncology-guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 2003; 82 Suppl 2: S133–140.
88. Slavin MA, Szer J, Grigg AP et al. Guidelines for the use of antifungal agents in the treatment of invasive Candida and mould infections. Intern Med J 2004; 34 : 192–200.
89. Herbrecht R, Fluckiger U, Gachot B et al. Treatment of invasive Candida and invasive Aspergillus infections in adult haematological patients. European Journal of Cancer Supplements 2007; 5 : 49–59.
90. Horn D, Neofytos D, Fishman J et al. Use of the PATH Alliance database to measure adherence to IDSA guidelines for the therapy of candidemia. Eur J Clin Microbiol Infect Dis 2007; 26 : 907–914.
91. Patel M, Kunz DF, Trivedi VM et al. Initial management of candidemia at an academic medical center: evaluation of the IDSA guidelines. Diagn Microbiol Infect Dis 2005; 52 : 29–34.
92. Anaissie EJ, Darouiche RO, Abi-Said D et al. Management of invasive candidal infections: results of a prospective, randomized, multicenter study of fluconazole versus amphotericin B and review of the literature. Clin Infect Dis 1996; 23 : 964–972.
93. Phillips P, Shafran S, Garber G et al. Multicenter randomized trial of fluconazole versus amphotericin B for treatment of candidemia in non-neutropenic patients. Canadian Candidemia Study Group. Eur J Clin Microbiol Infect Dis 1997; 16 : 337–345.
94. Kullberg BJ, Sobel JD, Ruhnke M et al. Voriconazole versus a regimen of amphotericin B followed by fluconazole for candidaemia in non-neutropenic patients: a randomised non-inferiority trial. Lancet 2005; 366 : 1435–1442.
95. Anaissie EJ, Vartivarian SE, Abi-Said D et al. Fluconazole versus amphotericin B in the treatment of hematogenous candidiasis: a matched cohort study. Am J Med 1996; 101 : 170–176.
96. Nolla-Salas J, Sitges-Serra A, Leon-Gil C et al. Candidemia in non-neutropenic critically ill patients: analysis of prognostic factors and assessment of systemic antifungal therapy. Study Group of Fungal Infection in the ICU. Intensive Care Med 1997; 23 : 23–30.
97. Mora-Duarte J, Betts R, Rotstein C et al. Comparison of caspofungin and amphotericin B for invasive candidiasis. N Engl J Med 2002; 347 : 2020–2029.
98. Kuse ER, Chetchotisakd P, da Cunha CA et al. Micafungin versus liposomal amphotericin B for candidaemia and invasive candidosis: a phase III randomised double-blind trial. Lancet 2007; 369 : 1519–1527.
99. Reboli AC, Rotstein C, Pappas PG et al. Anidulafungin versus fluconazole for invasive candidiasis. N Engl J Med 2007; 356 : 2472–2482.
100. Rex JH, Pappas PG, Karchmer AW et al. A randomized and blinded multicenter trial of high-dose fluconazole plus placebo versus fluconazole plus amphotericin B as therapy for candidemia and its consequences in nonneutropenic subjects. Clin Infect Dis 2003; 36 : 1221–1228.
101. Graninger W, Presteril E, Schneeweiss B et al. Treatment of Candida albicans fungaemia with fluconazole. J Infect 1993; 26 : 133–146.
102. Kontoyiannis DP, Bodey GP, Mantzoros CS. Fluconazole vs. amphotericin B for the management of candidaemia in adults: a meta-analysis. Mycoses 2001; 44 : 125–135.
103. Barrett JP, Vardulaki KA, Conlon C et al. A systematic review of the antifungal effectiveness and tolerability of amphotericin B formulations. Clin Ther 2003; 25 : 1295–1320.
104. Kleinberg M. What is the current and future status of conventional amphotericin B? Int J Antimicrob Agents 2006; 27 Suppl 1 : 12–16.
105. Torrado JJ, Espada R, Ballesteros MP, Torrado-Santiago S. Amphotericin B formulations and drug targeting. J Pharm Sci 2008; 97 : 2405–2425.
106. Eriksson U, Seifert B, Schaffner A. Comparison of effects of amphotericin B deoxycholate infused over 4 or 24 hours: randomised controlled trial. BMJ 2001; 322 : 579–582.
107. Furrer K, Schaffner A, Vavricka SR et al. Nephrotoxicity of cyclosporine A and amphotericin B-deoxycholate as continuous infusion in allogenic stem cell transplantation. Swiss Med Wkly 2002; 132 : 316–320.
108. Imhof A, Walter RB, Schaffner A. Continuous infusion of escalated doses of amphotericin B deoxycholate: an open-label observational study. Clin Infect Dis 2003; 36 : 943–951.
109. Peleg AY, Woods ML. Continuous and 4 h infusion of amphotericin B: a comparative study involving high-risk haematology patients. J Antimicrob Chemother 2004; 54 : 803–808.
110. Wingard JR, Kubilis P, Lee L et al. Clinical significance of nephrotoxicity in patients treated with amphotericin B for suspected or proven aspergillosis. Clin Infect Dis 1999; 29 : 1402–1407.
111. Bates DW, Su L, Yu DT et al. Mortality and costs of acute renal failure associated with amphotericin B therapy. Clin Infect Dis 2001; 32 : 686–693.
112. Bates DW, Su L, Yu DT et al. Correlates of acute renal failure in patients receiving parenteral amphotericin B. Kidney Int 2001; 60 : 1452–1459.
113. Mayer J, Doubek M, Doubek J et al. Reduced nephrotoxicity of conventional amphotericin B therapy after minimal nephroprotective measures: animal experiments and clinical study. J Infect Dis 2002; 186 : 379–388.
114. Mayer J, Doubek M, Vorlicek J. Must we really fear toxicity of conventional amphotericin B in oncological patients? Support Care Cancer 1999; 7 : 51–55.
115. Johnson JR. Reduction of nephrotoxicity associated with amphotericin B deoxycholate. Clin Infect Dis 2004; 38 : 303; author reply 306–307.
116. Ito JI, Hooshmand-Rad R. Treatment of Candida infections with amphotericin B lipid complex. Clin Infect Dis 2005; 40 Suppl 6: S384–391.
117. Anaissie EJ, White MH, Uzun O et al. Amphotericin B Lipid Complex vs Amphotericin B for Treatment of invasive Candidiasis: A Prospective, Randomized Multicenter Trial. In ICAAC 35th, Interscience Conference on Antimicrobial Agents and Chemotherapy, Edition San Francisco: 1995.
118. Noskin G, Pietrelli L, Gurwith M, Bowden R. Treatment of invasive fungal infections with amphotericin B colloidal dispersion in bone marrow transplant recipients. Bone Marrow Transplant 1999; 23 : 697–703.
119. Noskin GA, Pietrelli L, Coffey G et al. Amphotericin B colloidal dispersion for treatment of candidemia in immunocompromised patients. Clin Infect Dis 1998; 26 : 461–467.
120. Walsh TJ, Hiemenz JW, Seibel NL et al. Amphotericin B lipid complex for invasive fungal infections: analysis of safety and efficacy in 556 cases. Clin Infect Dis 1998; 26 : 1383–1396.
121. Tuil. O, Cohen. Y. Itraconazole IV solution in the treatment of candidemia in non-neutropenic patients. Critical Care Medicine 2003; 7: P131–P132.
122. Ostrosky-Zeichner L, Kontoyiannis D, Raffalli J et al. International, open-label, noncomparative, clinical trial of micafungin alone and in combination for treatment of newly diagnosed and refractory candidemia. Eur J Clin Microbiol Infect Dis 2005; 24 : 654–661.
123. Abbas J, Bodey GP, Hanna HA et al. Candida krusei fungemia. An escalating serious infection in immunocompromised patients. Arch Intern Med 2000; 160 : 2659–2664.
124. Safdar A, Chaturvedi V, Cross EW et al. Prospective study of Candida species in patients at a comprehensive cancer center. Antimicrob Agents Chemother 2001; 45 : 2129–2133.
125. Safdar A, van Rhee F, Henslee-Downey JP et al. Candida glabrata and Candida krusei fungemia after high-risk allogeneic marrow transplantation: no adverse effect of low-dose fluconazole prophylaxis on incidence and outcome. Bone Marrow Transplant 2001; 28 : 873–878.
126. Bodey GP, Mardani M, Hanna HA et al. The epidemiology of Candida glabrata and Candida albicans fungemia in immunocompromised patients with cancer. Am J Med 2002; 112 : 380–385.
127. Safdar A, Chaturvedi V, Koll BS et al. Prospective, multicenter surveillance study of Candida glabrata: fluconazole and itraconazole susceptibility profiles in bloodstream, invasive, and colonizing strains and differences between isolates from three urban teaching hospitals in New York City (Candida Susceptibility Trends Study, 1998 to 1999). Antimicrob Agents Chemother 2002; 46 : 3268–3272.
128. Safdar A, Perlin DS, Armstrong D. Hematogenous infections due to Candida parapsilosis: changing trends in fungemic patients at a comprehensive cancer center during the last four decades. Diagn Microbiol Infect Dis 2002; 44 : 11–16.
129. Bennett JE, Izumikawa K, Marr KA. Mechanism of increased fluconazole resistance in Candida glabrata during prophylaxis. Antimicrob Agents Chemother 2004; 48 : 1773–1777.
130. Pfaller MA, Messer SA, Boyken L et al. Geographic variation in the susceptibilities of invasive isolates of Candida glabrata to seven systemically active antifungal agents: a global assessment from the ARTEMIS Antifungal Surveillance Program conducted in 2001 and 2002. J Clin Microbiol 2004; 42 : 3142–3146.
131. Panackal AA, Gribskov JL, Staab JF et al. Clinical significance of azole antifungal drug cross-resistance in Candida glabrata. J Clin Microbiol 2006; 44 : 1740–1743.
132. Herbrecht R, Denning DW, Patterson TF et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 2002; 347 : 408–415.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Systémová mastocytózaČlánek ÚVODNÍK
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2009 Číslo 1- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Exprese reverzní telomerázy u pacientů s chronickou B-lymfocytární leukemií
- Mukozitida dutiny ústní po alogenní transplantaci krvetvorných buněk s přípravou fludarabinem a melfalanem FLU/MEL
- Denzita exprese cílového antigenu CD20 a CD52 ve vztahu k terapii monoklonální protilátkou u pacientů s chronickou lymfocytární leukemií
- Léčba invazivní aspergilózy – doporučení odborných společností
- Léčba invazivních mykotických infekcí u imunoalterovaných nemocných – doporučení odborných společností
- Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie nemoci v Jihomoravském kraji
- Systémová mastocytóza
- XVI. ČESKO-SLOVENSKÁ KONFERENCE O HEMOSTÁZE A TROMBÓZE s mezinárodní účastí
- Vývoj oboru klinické hematologie dospělých v Brně do devadesátých let minulého století (Vzpomínky klinického hematologa)
- Za prof. MUDr. Jaroslavem Vaňáskem, CSc., dr. h. c.
- O spolupráci mezi lékařskou odbornou veřejností a inovativním farmaceutickým průmyslem
- ÚVODNÍK
- 2009 – rok zásadních změn ve WHO nomenklatuře HLA systému
- Léčba invazivní kandidózy - doporučení odborných společností
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Systémová mastocytóza
- Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie nemoci v Jihomoravském kraji
- Léčba invazivní aspergilózy – doporučení odborných společností
- Léčba invazivní kandidózy - doporučení odborných společností
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



