-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hemoterapie
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 3 - Supplementum, p. 38-45.
051 Edukační přednáška
INDIKACE TRANSFUZNÍCH PŘÍPRAVKŮ
Černá Michaela
HTO Přerov, HTO Svitavy
Není pochyb o tom, že transfuze krve zachraňují životy, např. u pacientů se závažnými traumaty nebo u žen s poporodním krvácením. Umožňují některé chirurgické výkony, u pacientů se selháním funkce kostní dřeně zlepšují kvalitu i délku jejich života. Transfuze krve byly mnoho let častěji používány v chirurgických oborech u pacientů s traumaty a při operacích, ale v posledních asi 5 letech je větší použití v interních oborech, hlavně u selhání erytropoézy nebo krvácení z GIT. Důvodem této změny jsou lepší operační techniky, „cell salvage“, nižší cílová hladina Hb u chirurgických pacientů, naopak vyšší věk populace s větší komorbiditou vede k zvýšenému použití v interních oborech. Počet TU transfuzí roste s věkem, podle statistik je např. ve skupině lidí mezi 40–50 lety aplikováno méně než 20 TU na 1000 lidí ročně, ovšem více než 200 TU na 1000 lidí ročně ve skupině nad 80 let. Transfuze krve se aplikují u akutní anémie k zabránění úmrtí a orgánového poškození, ke zlepšení hemostázy, u chronické anémie, která nelze jinak korigovat, k udržení kvality života, aktivity, k odstranění symptomů anemického syndromu, event. k přípravě na operaci. Transfuze krve jsou tedy indikovány hlavně na jednotkách intenzivní péče, u onkologicky nemocných, po traumatech a operacích.
V minulém století byly transfuze krve považovány za proceduru s klinickým benefitem. V posledních 20 letech se začaly objevovat pochybnosti. Důvodem jsou obavy z infekcí přenesených transfuzemi včetně variantní Creutzfeldt-Jakobovy nemoci, bakteriální kontaminace, imunomodulačního vlivu transfuzí krve díky efektu proinflamatorního a imunosupresivního, vyšší incidence infekcí po operacích a také vyšší incidence rekurence nádorů, TRALI, TA-GVHD, hemolytických reakcí. Mezi nevýhody transfuzí patří také jejich limitovaná dostupnost a vysoká cena. Navíc, podle mnoha provedených studií bylo zjištěno, že i kriticky nemocní pacienti se zdravým srdcem tolerují akutní anémii velmi dobře bez nutnosti transfuze krve. U pacientů s onemocněním koronárních tepen jsou naopak lepší výsledky přežití při vyšší hladině Hb.
V retrospektivní studii s 1958 pacienty (Carson, 1996), kteří odmítli z náboženských důvodů transfuze, nebyla prokázána vyšší mortalita, pokud pokles hladiny Hb během operace byl méně než 20 g/l. Celková mortalita byla 3,2 %, u hladiny Hb před operací nad 120 g/l 1,3 %, u hladiny Hb pod 60 g/l až 33,3 %. Při anémii před operací s hladinou Hb mezi 60–70 g/l a poklesu Hb během operace do 20 g/l bylo OR pro úmrtí 1,4, při existujícím kardiovaskulárním onemocnění ovšem 12,3. U hladiny Hb mezi 100–110 g/l pak bylo OR 1,1, u nemocných s kardiovaskulární onemocněním 2,3. Při větším poklesu hladiny Hb 20–40 g/l se zvýšilo OR pro úmrtí u pacientů s hladinou Hb před operací 60–70 g/l na 24,1 a u nemocných s kardiovaskulárním onemocněním až na 216,1.
V prospektivní randomizované studii 838 „kriticky nemocných pacientů“ (Hebert, 1999, TRICC trial) byla 30. den po přijetí do nemocnice mortalita nižší v restriktivní skupině s hladinou Hb 70–90 g/l než v liberální skupině s hladinou Hb 100–120 g/l (19 % vs. 23 %, ne statisticky signifikantně), mortalita během hospitalizace byla nižší v restriktivní skupině (22 % vs. 28 %, již statisticky signifikantně). Při analýze byla mortalita v podskupině pacientů do 55 let signifikantně nižší v restriktivní skupině (6 % vs. 13 %), stejně jako u pacientů s APACHCE skóre pod 20 (9 % vs. 16 %). U pacientů po traumatu nebo na umělé ventilaci nebyl benefit liberálního přístupu. V liberální skupině byla vyšší incidence edému plic, infarktu myokardu a ARDS. Pacienti s ICHS měli naopak horší výsledky v restriktivní skupině, ne statisticky signifikantně. V prospektivní studii s 3534 „kriticky nemocnými pacienty“ (Vincent, 2002, ABC studie) byla vyšší mortalita u pacientů, kteří dostali transfuze než u těch, kteří je nedostali (29 % vs. 15 %). Podobně v další studii s 4892 „kriticky nemocnými pacienty“ (Corwin, 2004, CRIT studie) byla u nemocných po transfuzích prokázán vyšší morbidita a mortalita, delší délka pobytu v nemocnici.
V systematické revizi 6 prospektivních randomizovaných klinických studií s 1568 pacienty (Carson, 2002) 787 pacientů s cílovou hladinou 90–100 g/l dostalo průměrně 4,4 TU, 781 pacientů s cílovou hladinou 70–90 g/l 2,3 TU. Mortalita 30. den byla 15,2 % vs. 12,2 %, restriktivní přístup byl tedy asociován s lepším klinickým výsledkem.
Ke zjištění efektu a rizik transfuzí byla provedena (Marik, Corwin, 2008) systematická analýza celkem 45 studií s 272 596 dospělými pacienty, kde byla sledována mortalita, infekce, ARDS po transfuzích (bez deleukotizace). Překvapivě ve 42 studiích rizika přivážily benefit, ve 2 studiích bylo riziko neutrální a v 1 studii benefit byl větší než rizika, jednalo se ale o starší pacienty s AIM a Hct pod 0,30. Transfuze erytrocytů byly nezávislým prediktorem úmrtí, OR 1,7, nezávislým prediktorem infekce OD 1,8 a ARDS OR 2,5.
Ve prospektivní studii s 2358 pacienty s akutním infarktem myokardu IM (Aronson, 2008) dostalo 192 pacientů aspoň 1 transfuzi. Mortalita po 6 měsících byla vyšší u pacientů, kteří transfuzi dostali (28 % vs. 12 %), HR pro mortalitu bylo 1,9 u transfundovaných pacientů. V analýze bylo zjištěno, že u pacientů s hladinou Hb pod 80 g/l byl protektivní efekt transfuze, naopak u pacientů s hladinou Hb 80 g/l bylo přežití horší.
V nedávno publikované studii (Foss, 2009) bylo hodnoceno 120 pacientů ve věku nad 65 let po TEP kyčle, kdy liberální přístup po operaci měl cílovou hladinu Hb 100 g/l, restriktivní 80 g/l. Nebyl prokázán rozdíl v délce pobytu v nemocnici a v rehabilitaci, v liberální skupině bylo ovšem méně kardiovaskulárních komplikací (2 % vs. 10 %) a úmrtí (0 % vs. 8 %). Naopak byl trend k vyšší incidenci infekce operační jizvy v liberální skupině (5 % vs. 0 %).
Je známo, že za fyziologických podmínek je více než 98 % kyslíku vázáno na Hb, 2 % je rozpuštěno v plazmě. V případě anémie s Hb 30 g/l s umělou ventilací může byt v plazmě rozpuštěno téměř 100% kyslíku. Přenos kyslíku DO2 (800–1200 ml/min.) do tkání, který je dán srdečním výdejem a obsahem kyslíku v tepnách (vázaného na Hb i volného), je za fyziologických podmínek asi 4x vyšší než spotřeba kyslíků ve tkáních VO2 (200–300 ml/min). Proto izolovaná redukce hladiny Hb nemusí vést k nedostatečnému přenosu kyslíku do tkání. Byla provedena analýza celkem 18 studií ke zjištění efektu transfuzí erytrocytů (Hebert, 2004). Ve 4 studiích nedošlo ani k vzestupu DO2, ve 14 studiích sice došlo k vzestupu DO2, ale u 9 studií z nich nedošlo k vzestupu VO2, tudíž nebylo možno prokázat efekt transfuze se zlepšením oxygenace.
Extrakce kyslíku je za fyziologických podmínek jen 20–30 %, v různých tkáních je různá, např. kůže a ledviny do 10 %, mozek asi 30 %, srdce 60 %. Při tkáňové hypoxii může být extrakce zvýšena, výjimkou je srdce, kde je zvýšení extrakce možné jen minimálně, kompenzace hypoxie je dána zvýšením průtoku koronárními tepnami. U normovolemických pacientů (v případě akutního krvácení je proto nutná korekce krevních ztrát krystaloidy a koloidy) dochází ke kompenzačním mechanismům: k posunu disociační křivky doprava (větší produkce 2,3 DPG) s poklesem afinity Hb ke kyslíku a snadnějším uvolňováním kyslíku ve tkáních, zvýšení srdečního výdeje (zesílení srdečních kontrakcí a kompenzační tachykardie – ne u pacientů v celkové anestézii) díky stimulaci sympatiku a poklesu viskozity krve, redistribuce krve do srdce a mozku. Pokles viskozity krve má za následek pokles vaskulární rezistence a pokles afterloadu, dále zvýšení venózního návratu a zvýšení preloadu. Změny v cirkulaci jsou tedy na úrovni centrální (zvýšení CO), regionální i v mikrocirkulaci.
American Society of Anesthesiologists doporučuje, aby transfuze erytrocytů nebyly indikovány jenom podle cílové hladiny Hb, ale i podle rizika rozvoje komplikací z neadekvátní oxygenace u konkrétního pacienta. Indikace transfuzí je jednoznačná u hladiny Hb pod 60 g/l nebo v případě vyšší hladiny Hb u známek neadekvátní oxygenace. K těm patří: hemodynamická nestabilita, ischemie myokardu, extrakce kyslíku nad 50 %, nové ST deprese nad 0,1 mV nebo nové ST elevace nad 0,2 mV, nové abnormality pohybu stěny myokardu na transesofageální echokardiografii.
Doporučení v USA i Kanadě říkají, že transfuze krve je třeba posuzovat podle parametrů závažnosti onemocnění, podle pacientovy klinické situace. Obecně je nyní uznáván názor, že u hemodynamicky stabilních pacientů na JIP, po traumatech či operacích jsou indikovány až při poklesu Hb pod 70 g/l.
Doporučení ve Francii (Agence francaise de securite sanitaire des produits de sante) jsou poměrně podrobně vypracovaná. Doporučená hladina Hb je 80 g/l, event. včetně současné léčby erytropoetinem. V případě chirurgického krvácení při hladině Hb nad 100 g/l výjimečně, při hladině Hb mezi 80–100 g/l dle klinického stavu, kapacity adaptace pacienta, etiologie, možností alternativ a dle zvážení benefitu a rizika. U chronické anémie, pokud je dobře tolerována, až při poklesu hladiny Hb pod 60 g/l, u hladiny Hb mezi 60–100 g/l opět dle klinické tolerance. Důležitá je etiologie s event. substitucí karence Fe, B12, folátů, při renální insuficienci aplikace erytropoetinu, vysazení hematotoxických léků, léčba zánětu. V onkohematologii jsou indikovány ke zlepšení kvality života pacientů, ke zlepšení přežití pacientů s MDS.
Dle doporuční v Austrálii jsou indikovány transfuze krve při hladině Hb pod 70 g/l. U hladiny Hb mezi 70–100 g/l pak u chirurgických výkonů s většími krevními ztrátami nebo u pacientů se známkami poruchy transportu kyslíku. U hladiny Hb nad 100 g/l ne, kromě specifických indikací. Cílová hladina Hb nad 80 g/l u symptomatických pacientů chronicky transfundovaných při chemoterapii.
Ve Finsku doporučují v případě chronické anémie transfuze krve u hladiny Hb pod 70 g/l, u pacientů s kardiovaskulárním onemocněním s Hb pod 100 g/l. Dále v případě pacientů s chronickou anémií nebo s anémií při malignitě za předpokladu, že se zlepší pacientova kondice, nezávislost na okolí. V případě akutních ztrát, iniciálně volumexpandéry, hladina Hb je pouze jedno z kritérií rozhodování o transfuzi krve, v případě prolongovaného krvácení včetně trombocytů a plazmy.
Nejen na cílovou hladinu Hb u alogenních transfuzí se v posledních letech změnil názor. Bylo zjištěno, že ani autotransfuze nejsou zcela bez rizika (vyšší počet reakcí po vlastním odběru autotransfuzí, potransfuzní reakce mohou být i po autotransfuzích, klinický efekt není velký, větší finanční náklady). Navíc, dle několika provedených studií se cca 40 % odebraných autologních odběrů vůbec nepoužije. Autotransfuze samozřejmě snižují počet alogenních transfuzí, ale zvyšují počet celkových aplikovaných transfuzí. Dle doporučení z Anglie z roku 2006, autotransfuze by měly být indikovány u žen s hladinou Hb 130–145 g/l a u mužů s Hb 110–145 g/l, a to pouze u pacientů se vzácnými KS, u dětí se skoliózou nebo u pacientů, kteří alogenní transfuze odmítají.
Mezi alternativy transfuzí alogenní krve u chirurgických pacientů patří: před operací odběr autotransfuze a aplikace erytropoetinu, během operace akutní normovolemická hemodiluce, cell salvage, antifibrinolytika, anestetické a chirurgické techniky, brzy snad i arteficiální přenašeče kyslíku, akceptování nízkých hladin Hb, po operaci pak opět cell salvage, anntifibrinolytika, akceptování nízkých hladin Hb. U pacientů s krvácením je iniciálně důležitá aplikace krystaloidů a koloidů k udržení normovolemie.
Závěrem lze tedy shrnout, že průměrná cílová hladina u pacientů na JIP je kolem 80–85 g/l, ovšem u pacientů bez přítomného kardiovaskulárního onemocnění je možná hladina kolem 70 g/l. Aplikace transfuzí by měly být u pacientů s akutním krvácením, s příznaky anemického syndromu při normovolemii. U pacientů s akutním IM nebo nestabilní AP by cílová hladina Hb měla být vyšší. Transfuze krve by měly být indikovány vždy individuálně, hladina Hb by měla být jedním z vodítek, saturace tkání kyslíkem pak dalším z nich. Znalost rizik a alternativ transfuze krve je nezbytná. Nelze opomenout, že kvalita transfuzí má vliv na nežádoucí účinky transfuze (EBR vs. ERD).
Již od 50. let minulého století byla prokázána redukce mortality z důvodů krvácení u pacientů s akutní leukemií díky transfuzím trombocytů. Jsou důležitou součástí léčby nádorových onemocnění včetně hematologických malignit, selhání kostní dřeně nebo při transplantaci kostní dřeně. Indikace transfuzí trombocytů je možné rozdělit na profylaktické a terapeutické. Profylakticky u pacientů s rizikem krvácení a trombocytopenií, většinou při poklesu trombocytů pod 10 x 109/l, v případě přídatných rizikových faktorů, např. febrilie, sepse, aplikace ATB či antimykotik, současná koagulopatie) pod 20 x 109/l. Terapeuticky pak při krvácení spojeném s trombocytopenií nebo trombocytopatií. Vzhledem k existujícím kontraindikacím aplikace trombocytů by zjištění příčiny trombocytopenie mělo pokud možno vždy předcházet jejích podání. Vždy je nutné zvažovat i jiné příčiny krvácení, např. současná aplikace léků s protidestičkovým účinkem, chirurgická příčina, koagulopatie.
V chirurgických oborech transfuze trombocytů umožňují provedení invazivních výkonů, kdy doporučené hodnoty trombocytů k výkonu jsou u extrakce zubů trombocyty nad 30–40 x 109/l včetně použití tkáňového lepidla, u malých invazivních výkonů např. epidurální anestézie, punkce jater, gastroskopie s biopsií, transbronchiální biopsie, laparotomie, operační porod (sectio Caesarea) trombocyty nad 50 x 109/l, u operace prostaty pak trombocyty nad 70 x 109/l, při operacích CNS či očí trombocyty nad 100 x 109/l. Po chirurgických výkonech nutné udržovat počty trombocytů nad 50 x 109/l ještě několik dní po výkonu, ideálně do zhojení. V případě HELLP syndromu nebo v případě krvácení při trombocytopenii je doporučeno aplikovat trombocyty při jejich poklesu pod 50 x 109/l, event. při poklesu pod 100 x 109/l u poranění CNS či polytraumatu. Také u DIC s krvácivými projevy nebo u masivních transfuzí erytrocytů je doporučená aplikace trombocytů při jejich poklesu pod 50 x 109/l .
V hematoonkologii se často aplikují transfuze trombocytů preventivně u primárního či sekundárního selhání kostní dřeně, většinou při poklesu trombocytů pod 10 x 109/l, v případě přídatných rizik. faktorů (viz výše, dále mukositis po chemoterapii) při poklesu pod 20 x 109/l. Při léčbě akutní promyelocytární leukemie s velkým rizikem krvácivých projevů díky přítomné koagulopatii již při poklesu trombocytů pod 50 x 109/l během indukční léčby, následně při poklesu trombocytů pod 20 x 109/l. U klinicky stabilní trombocytopenie bez současné chemoterapie a rizikových faktorů (např. aplastická anémie, myelodysplastický syndrom) při poklesu trombocytů pod 5 x 109/l (prevence aloimunizace a vzniku refrakterity při opakovaných podáních). Při krvácivých projevech s trombocytopenií způsobené selháním kostní dřeně, při primární trombocytopatii (např. Glanzmanova trombastenie) nebo při sekundární trombocytopatii (léky) aplikace trombocytů při poklesu pod 50 x 109/l. V případě imunní trombocytopenie pouze u život ohrožujícího krvácení. Provedení sternální punkce je možné i při těžké trombocytopenii, ale trepanobiopsii je lépe provádět s trombocyty nad 20 x 109/l.
Mezi kontraindikace aplikace trombocytů patří trombotická trombocytopenická purpura (TTP) s výjimkou život ohrožujícího krvácení, hemolyticko-uremický syndrom (HUS) s výjimkou život ohrožujícího krvácení, heparinem indukovaná trombocytopenie (HIT) s výjimkou život ohrožujícího krvácení, ITP a potransfuzní purpura s výjimkou život ohrožujícího krvácení. V metaanalýze 10 randomizovaných studií s 1137 pacienty (Heddle, 2008) byl srovnáván efekt a nežádoucí účinky trombocytů z aferézy a trombocytů z buffy-coatu. U nedeleukotizovaných trombocytů byla nižší incidence akutních reakcí (febrilních nehemolytických) po trombocytech z aferézy, u deleukotizovaných trombocytů již nebyl rozdíl. Byl vyšší vzestup trombocytů (CCI) po trombocytech z aferézy po 1 hodině i po 18–24 hodinách. Žádná ze studií nesledovala krvácivé komplikace, také rozdíl v aloimunizaci a refrakteritě nebylo možné zjistit pro velkou heterogenitu. V další metaanalýze 5 randomizovaných studií s celkem 442 pacienty (Cid, Lozano, 2007) byla sledována optimální profylaktická dávka trombocytů. Průměrný obsah trombocytů byl 134 x 109/l u skupiny s nižším množstvím trombocytů a 310 x 109/l s vyšším obsahem trombocytů. Statisticky signifikantně byl vyšší vzestup trombocytů po transfuzi s vyšším obsahem trombocytů stejně jako prodloužení intervalu k další transfuzí o 1,04 dne. Zajímavé bylo, že byla vyšší incidence krvácivých komplikací ve skupině s vyšší obsahem trombocytů.
Použití plazmy je striktně rezervováno pro situace, které to nesporně vyžadují. Při závažných koagulopatiích s konsumpcí všech koagulačních faktorů, velkém krvácení s globálním deficitem faktorů, při deficitu faktorů, které nejsou jinak k dispozici, u mikroangiopatií. Konkrétně u krvácení nebo u kombinované koagulační poruchy při diseminované intravaskulární koagulaci, při získaném nedostatku koagulačních faktorů z poruch jejich tvorby např. při hepatopatii, při těžkém život ohrožujícím krvácení při deficitu K vitaminu nebo při působení antagonistů vitaminu K, také v případě masivních transfuzí (hrazení masivních krevních ztrát iniciálně koloidními a krystaloidními roztoky), na 3–4 TU erytrocytů 1 TU plazmy. Dále je plazma indikována při přípravě na chirurgický výkon u nemocných s vrozeným deficitem koagulačních faktorů v případě, že ní dostupná léčba koncentráty příslušného koagulačního faktoru. Jednoznačná indikace plazmy je u mikroangiopatických trombocytopenií – trombotická trombocytopenická purpura, hemolyticko-uremický syndrom, HELLP syndrom a další podobné stavy) a to přímo nebo jako substituce při výměnné plazmaferéze. Ve Francii doporučují plazmu také při indukční léčbě akutní promyelocytární leukemie z lýzy leukemických buněk při chemoterapii.
Aplikace plazmy by se měla především řídit výsledky koagulačních testů. Krvácení nevysvětlitelné chirurgickou příčinou zpravidla bývá při poklesu fibrinogenu pod 1 g/l (a při poklesu trombocytů pod 50x 109/l, při prodloužení PT na 1,5násobek, při prodloužení aPTT na 1,5–1,8násobek. Mezi kontraindikace plazmy patří využití jako náhradního roztoku při absenci koagulačního deficitu, využití jako zdroje imunoglobulinů, při deficitu faktorů, je-li dostupný specifický virově inaktivovaný produkt, při intoleranci plazmatických bílkovin, relativní kontraindikací je hypervolemie. Dávka plazmy je iniciálně 10–15 ml/kg (např. 70 kg pacient, dávka 700–1000 ml, to je vždy více než 1 TU plazmy) a dále dle klinického stavu a dle výsledků koagulačních vyšetření.
V letech 1972–1985 byl prokázán mírný benefit transfuzí granulocytů u těžce neutropenických pacientů s infekcí či febriliemi, problém byl se získáním transfuzních přípravků granulocytů s dostatečným počtem buněk od dárců. V létech 1985–1995 bylo od transfuzí granulocytů více méně upuštěno. Důvodem byla nová a účinnější antibiotika a zlepšení podpůrné péče, dále obava před nežádoucími účinky granulocytů při jejich nevelkém klinickém efektu. Po roce 1995 se objevil zvýšený zájem díky zvýšení výtěžnosti granulocytárních koncentrátů (dostupnost centrifugačních metod pro kontinuální aferézy, používání sedimentačního činidla např. HES, aplikace kortikoidů a/nebo G-CSF ke stimulaci dárců. Klinický efekt je závislý na dávce transfundovaných granulocytů, kdy kortikoidy samotné mají nejmenší výtěžnost cca 1,5–3,0 x 1010/l, G-CSF pak 4,0–6,0 x 1010/l a největší má jejich kombinace 7,0–8,0 x 1010/l. V provedených studiích byla potvrzena jejich normální funkce G-CSF stimulovaných granulocytů s baktericidní schopností, chemotaktickou schopností, fungicidní aktivitou i schopností migrovat extravaskulárně do místa infekce (pomocí In111-značených granulocytů). Pokrok v léčbě hematoonkologicky nemocných pacientů s následnou neutropenií má velké riziko rozvoje bakteriální či mykotické infekce, i přes moderní antimikrobiální a další podpůrnou péči. Transfuze granulocytů mají za cíl zkrátit dobu neutropenie a napomoci regresi infekce. Doporučená dávka je 2 x 1010/m2, většinou 3–5 dní po sobě, ale možno i déle. K terapeutickým indikacím patří chemosenzitivní onemocnění s neutrofily pod 0,5 x 109 /l (0,2 x 109) nebo poruchou funkce neutrofilů a sepsí nebo lokální infekcí (bakteriální či mykotickou) při adekvátní ATB či antimykotické terapii alespoň 48 hodin trvající, s předpokladem obnovení funkce kostní dřeně v příštích 2 týdnech, ale ne dříve než za 5 dní. Ve světě (USA, Austrálie) se aplikují také profylakticky po allogenních transplantacích s cílem zkrácení délky neutropenie, redukce febrilií a délky ATB terapie.
Literatura
- Cetkovský et al., Intenzivní péče v hematologii, Galén 2004, 169-189
- WHO, Klinické použití krve, Grada 2002, 21-58
- Transfusion guidelines for neonates and older children, British Journal of Haematology, 2004, 124, 433-453
- Guidelines for the clinical use of red cell transfusions. British Commitee for Standards in Haematology. British Journal of Haematology, 2001, 113, 24-31
- Transfusion de globules rouges homologues: Produits, Indications, Alternatives. Recommandations. Agence Franaise de Sécurité Sanitaire des Produits de Santé, aout 2002
- Carson et al, Effect of anemia and cardiovascular disease on surgical mortality and morbidity. Lancet, 1996, 348, 1055-1060
- Hebert et al, A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care, A Engl J Med, 1999, 340, 409-417
- Vincent et al, Anemia and blood transfusion in critically ill patients. JAMA 2002, 288, 1499-1507
- Billote et al, A prospective randomised study of preoperative autologous donation in hip replacement surgery, Journal of Bone and Joint Surgery, 2002, 84, 1299-1304
- Carson et al, Transfusion triggers: a systematic review of literature. Transfus Med Rev 2002, 16, 187-199
- Corwin et al, Anemia and blood tranfusion in the critically ill – Current clinical practice in the United States, Crit Care Med, 2004, 32, 39-52
- Fakhry, Fata, How low is too low? Cardiac risks with anemia, Critical Care 2004, 8, S11-S14, Review
- Hebert et al, Clinical consequences of anemia and red cell transfusion in the critically ill. Crit Care Clin 2004, 20, 225-235
- Gou@zec et al, Les indications des produits sanguins labiles et la physiologie de la transfusion en médecine, Transfusion Clinique et Biologique 12, 2005, 169-176
- Madjdpour et al, Risks, benefits, alternatives and indications of allogenic blood transfusions, Minerva Anestesiol 2006, 72, 283-298
- Chang, Blood substitues based on nanobiochenololy, Trends in Biotechnology, 2006, 24, 8, Review
- Boulton, James, Guidelines for policies on alternatives to allogeneic blood transfusion. Predeposit autologous blood donation and transfusion, Transfusion Medicine, 2007, 17, 354-365
- Marik, Corwin, Efficacy of red blood cell transfusion in the critically ill: A systematic review of the literature, 2008, 36, 9, 266—2674, Review
- Zou et al, Transfusion Transmission of Human Prion Diseases, Transfusion Medicine Reviews, 22, 2008, 58-69
- Wallis, Red cell transfusion triggers, Transfusion and Apheresis Science 39, 2008, 151-154
- Practice guidelines for perioperative blood transfusion and adjuvant therapies. An Updated report by the American Siciety of Anesthesiologists Task Force on Perioperative Blood Transfusion and Adjuvant Therapies. Anesthesiology 2008, 105, 198-208
- Chang, Blood substitues based on nanobiotechnology, 2006, TRENDS in Biochnology, 24,8
- Renaudier, Transfusion en hématologie, Transfusion Clinique et Biologique 15, 2008, 228-235
- Alter, Klein, The hazards of blood transfusion in historical perspective, Blood, 2008, 112, 7, 2617-2624
- Aronson et al, Impact of Red Blood Cell Transfusion on Clinical Outcomes in Patients With Acute Myocardial Infarction, Am J Cardiol, 2008, 102, 115-119
- Guidelines for red blood cell and plasma transfusion for adults and children. Expekr Workong Group. Can Med Assoc Journal 2008, 156, S1-S24
- Foss et al., The effects of liberal versus restrictive transfusion tresholds on ambulation after hip fracture surgery, Transfusion, 2009, 49, 227-234
- Guidelines for the use of platelets transfusions. British Commitee for Standards in Haematology. British Journal of Haematology, 2003, 122, 10-23
- Transfusion de plaquettes: Produits, Indications. Recommandations. Agence Franaise de Sécurité Sanitaire des Produits de Santé, juin 2003
- Samama, Perioperative platelet transfusion. Recommendations of French Health Products Safety Agency 2003, Minerva Anestesiol 2006, 72, 447-452
- Cid, Lozano, Lower or higher doses for prophylactic platelet transfusions : results of meta-analysis of randomized contrelled trials, Transfusion 2007, 47, 464-470
- Greeno et al, Platelet utilization and the transfzsion trigge : a prospective analysis, Transfusion, 2007, 47, 201-205
- Cameron et al, Evaluation of platelet transfusion triggers in tertiary-care hospital, Transfusion, 2007, 47, 206-211
- Stroncek, Rebulla, Plateles transfusions, Lancet 2007, 370, 427-438
- Heddle et al, Comparing the efficacy and safety of apheresis and whole blood-derived platelet transfusions : a systematic review, Transfusion 2008, 48, 1447-1458
- Bierling, Transfusion de concentrés plaquettaires, Transfusion Clinique et Biologique 2009, 16, 190-194
- Andreu, transfusion de plaquettes : produits, indications, dose, seuil, efficacité, Transfusion Clinique et Biologique 2009, 16, 118-133
- Guidelines for the use of Fresh Frozen Plasma, Cryoprecipitate and Cryosupernatant. British Commitee for Standards in Haematology. British Journal of Haematology, 2004, 126, 11-28
- Transfusion de plasma frais congelé: Produits, Indications. Recommandations. Agence Franaise de Sécurité Sanitaire des Produits de Santé, aout 2002
- Ketchum et al, Indications for Early Fresh Frosen Plasma, Cryoprecipitate and Platelet transfusion in trauma, The Journal of trauma, Ijury, Infection, and Critical Care, 2006, 60, 6, S51-S58
- Gonzales et al., Fresh Frosen plasma Should be Given Earlier to Patients Requiring Massive Transfusion, The Journal of trauma, Ijury, Infection, and Critical Care, 2007, 62, 1, 112-119
- Iorio et al, The good use of plasma. A critical analysis of five international guidelines, Blood Transfus 2008, 6, 18-24
- Transfusion de granulocytes: Produits, Indications. Recommandations. Agence Franaise de Sécurité Sanitaire des Produits de Santé, juin 2003
- Strauss RG, Therapeutic granulocyte infusion, Blood, 1993, 81, 1675-1678
- Hesler et al., Collection and transfusion of granulocyte concentrates from donors primed with granulocyte stimulating factor and response of myelosupressed patients with established infection, J Clin Apher, 1995, 10,188-193.
- Vamvakas EC et al., Meta-analysis of clinical studies of the efficacy of granulocyte transfusions in the treatment of bacterial sepsis, J Clin Apher, 1996, 11, 1-9
- Adkins et al., Transfusion of granulocyte-colony stimulating factor-mobilised granulocyte components to allogeneic transplant recipients:analysis of kinetics and factors determining posttransfusion neutrophis and platelet count, Transfusion 1997, 37, 737-748
- Liles WG et al., A comparative trial of granulocyte colony-stimulating factor and dexamethasone, separately and in combination, for the mobilization of neutrophils in the peripheral blood of normal volunteers, Transfusion 1997, 37, 2, 182-187.
- Adkins et al., Indium labeled white blood cells apheresed from donor receiving G-CSF localeze to sites of inflamation when infused into allogeneic bone marrow transplant recipients, Bone Marrow Transplant,1997, 19, 809-812
- Price TH et al., Phase I/II trial of neutrophil transfusion from donors stimulated with G-CSF and dexame-thasone for treatment of patients with infections in hemopoetic stem cell transplantation, Blood 2000, 95, 3302-3309
- Adkins et al., Effect of leucocyte compatibility on neutrophil increment after transfusion of granulocyte colony-stimulating factor-mobilised prophylactic granulocyte transfusion and on clinical outcomes after stem cell transplantation, Blood 2000, 95, 3605-3612
- Dale DC et al., Kinetics and function of neutrophils mobilised with granulocyte concentrat es collected from donors after repeated G-CSF stimulation, Transfusion 2002
- Bux J, Tolerance of granulocyte donors towards granulocyte colony-stimulating factor stimulation and of patients towards granulocyte transfusions: results of multicentre study. Vox Sanguinis 2003, 85, 322-325
- Bishton M., Chopra R., The role of granulocyte transfusion in neutropenic patients, British Journal of Hematology 2004, 127, 501-508. Review.
- Einsele H et al., Granulocyte transfusion, Vox sanguinis 2004, 87,S205-S208
- Hubel K et al., Effective storage of granulocytes collected by centrifugation leukapheresis from donors stimulated with granulocyte-colony-stimulating factor, Transfusion 2005, 45,1876-89
- Price TH, Granulocyte transfusion therapy: it@s time for an answer, Transfusion 2006, 46, 1-5
- Ozier, Transfusion du traumatisé grave et methodes d@épargne, Transfusion Clinique et Bioloqicue 2005, 15, 240-245
- Heier HE, Turek P, Walterová L., European School of Transfusion Medicine, Clinical Transfusion Medicine, Liberec 2006
- www.nhmrc.gov.au/guidelines/health_guidelines.htm
- www.guideline.gov
- www.bloodservices.ca
- www.transfusionguidelines.org.uk
- www.afssaps.fr
052
KLINICKÝ AUDIT K HODNOCENÍ EFEKTIVITY HEMOTERAPIE
Galuszková D.1, Galuszka J.2, Sklář B.3, Rous T.3
1Transfuzní oddělení FNOL, 2I. interní klinika FNOL, 3STAPRO
Úvod: Transfuzní lékařství má těsnou vazbu na řadu klinických medicínských oborů. Bezpečnost hemoterapie závisí na řadě faktorů, jež musí být splněny jak na straně výrobce transfuzních přípravků, tak i na straně lékařů, kteří tyto přípravky indikují a aplikují k léčbě nemocných.
Vzhledem k tomu, že v České republice nejsou platná jednotná celostátní doporučení k hemoterapii, má Fakultní nemocnice Olomouc (FNOL) vytvořené vlastní doporučení. Pro kontrolu dodržování tohoto standardu a s cílem zvýšení bezpečnosti hemoterapie byla provedena analýza hemoterapie za první pololetí roku 2008.
Cíl: Rozbor hemoterapie za prvních šest měsíců roku 2008 v jednotlivých klinických oborech FNOL. Zároveň byla provedena kontrola vykazování hemoterapie do zdravotních pojišťoven.
Metodika: Jedná se o klinický audit na základě spojení dat uvedených v informačním systému transfuzního oddělení (TO) – výdej transfuzních přípravků (TP) na konkrétního pacienta, laboratorních výsledků v nemocničním informačním systému (NIS) v den aplikace transfuzního přípravků a dat vykázaných pojišťovně. Jako neindikované podání je hodnocena aplikace bez opory v laboratorních vyšetřeních (krevní obraz, INR, APTT); u erytrocytárních přípravků aplikace při hladině hemoglobinu (Hb) nad 130 g/l, aplikace plazmy při normálních hodnotách INR a APTT.
V této části auditu není hodnocen klinický stav pacienta.
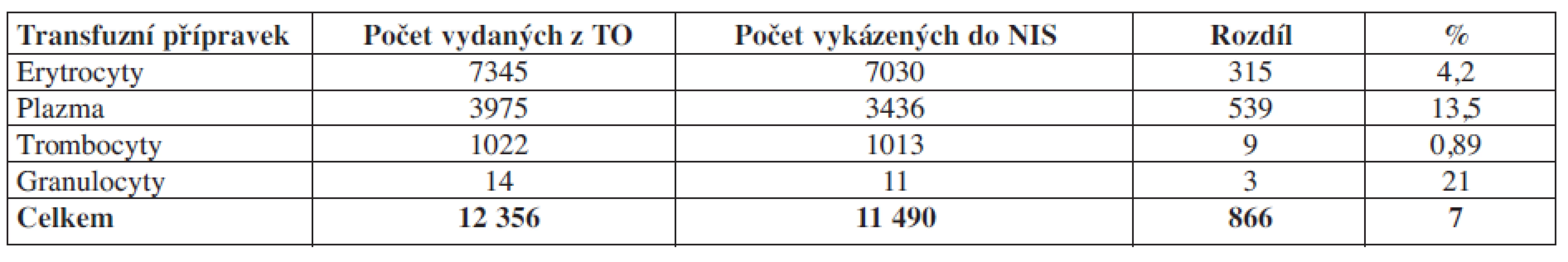
Výsledky: Tab. 1. Počty vydaných TP z TO a vykázaných TP do NIS za první pololetí roku 2008 v TU.
Komentář: Auditem prokazujeme, že 7 % aplikovaných transfuzních přípravků není vykázáno na pojišťovnu.
Tab. 2. Hladina hemoglobinu u příjemců erytrocytárních koncentrátů v den aplikace před podáním transfuze. 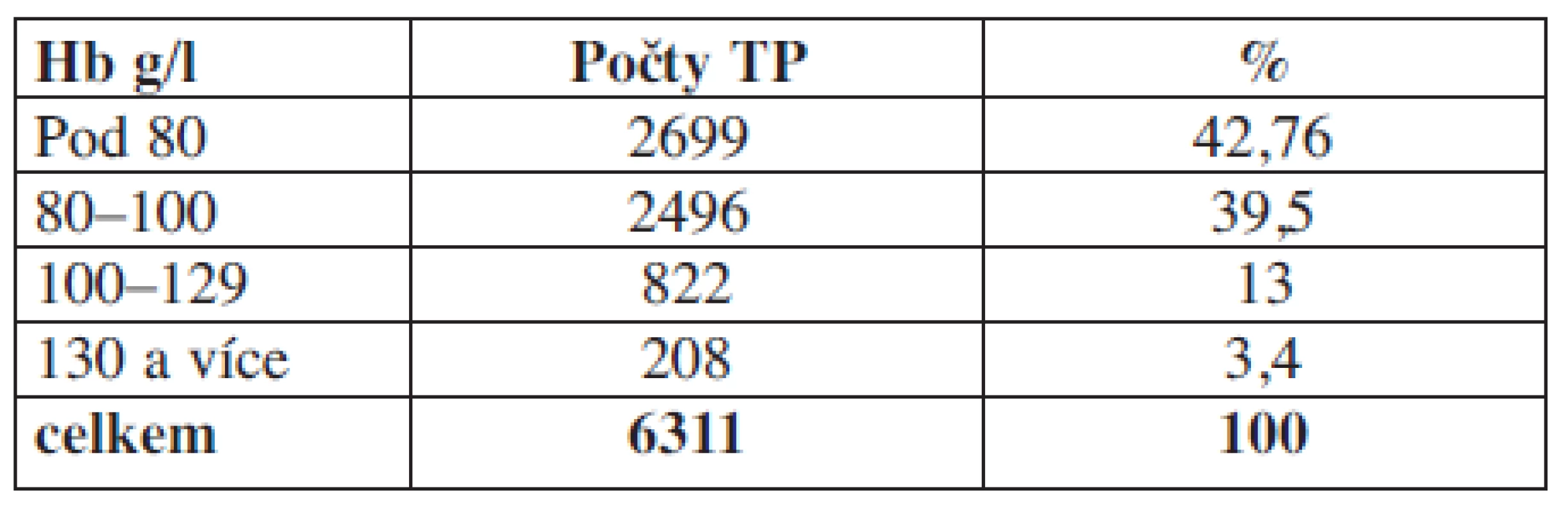
Komentář: Analýzou prokazujeme, že 208 pacientů tj. 3,8 % mělo v den aplikace hodnotu Hb nad 130 g/l. Tato skupina není indikována k aplikaci erytrocytárních transfuzních přípravků.
Tab. 3. Hladina trombocytů u příjemců trombocytárních koncentrátů v den aplikace před podáním transfuze. 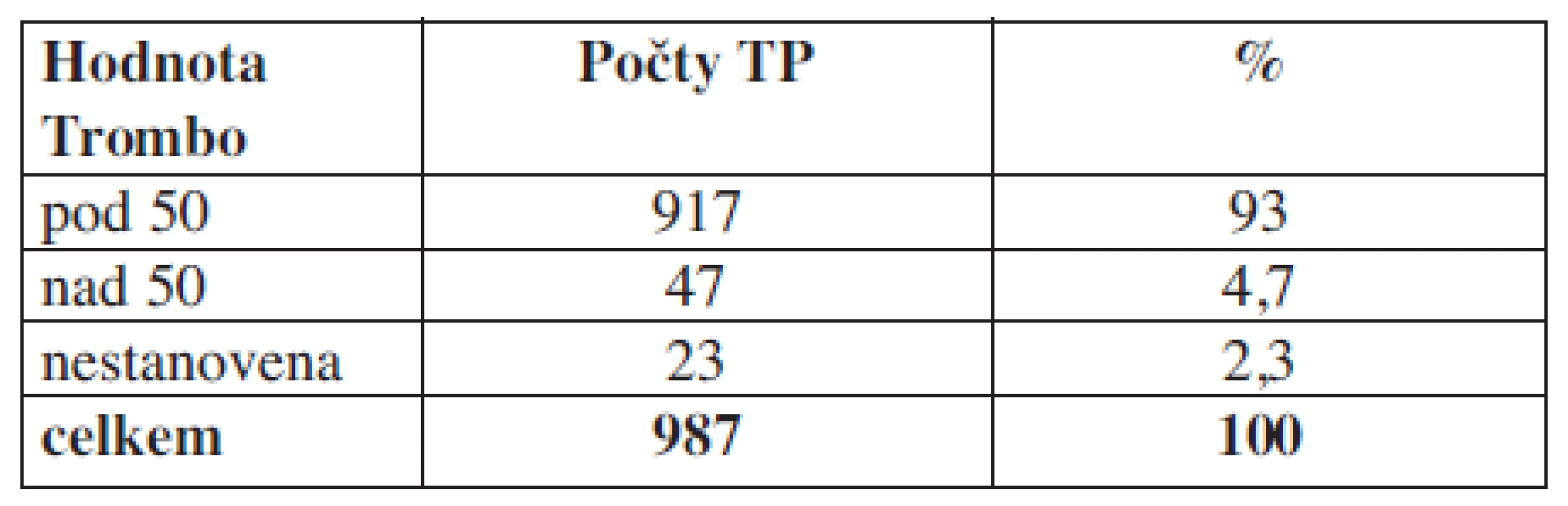
Komentář: Zjišťujeme, že v den aplikace trombocytárních koncentrátů 2,3 % pacientů nemají aktuální laboratorní hodnotu.
Tab. 4. Hodnocení aplikace plazmy. 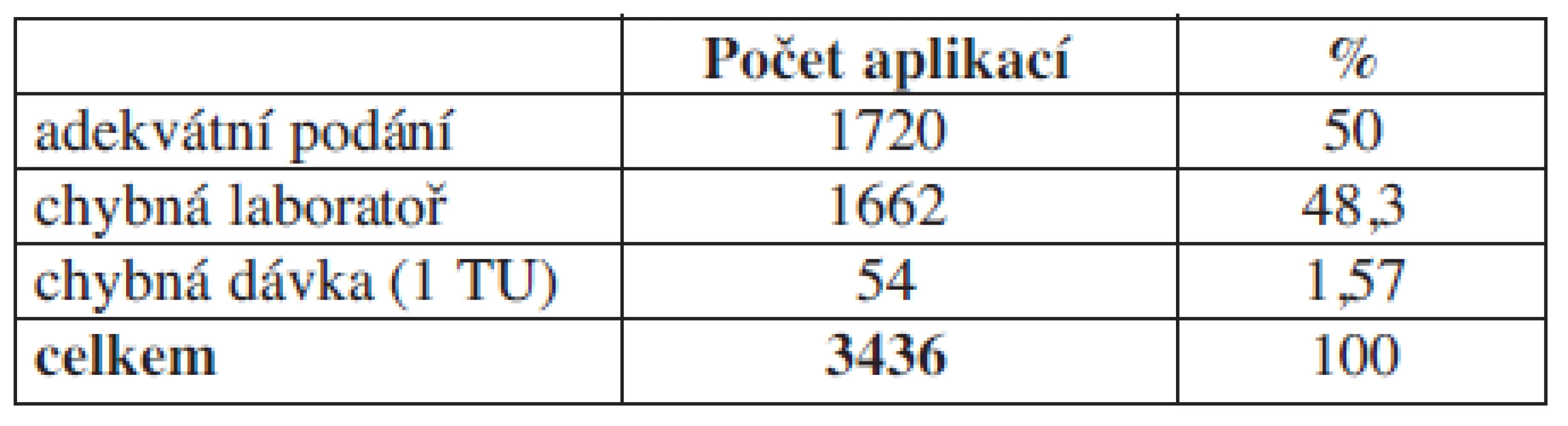
Komentář: Analýzou zjišťujme, že u 50 % pacientů je indikace k aplikaci plazmy sporná.
Tab. 5. Laboratorní výsledky v den aplikace plazmy. 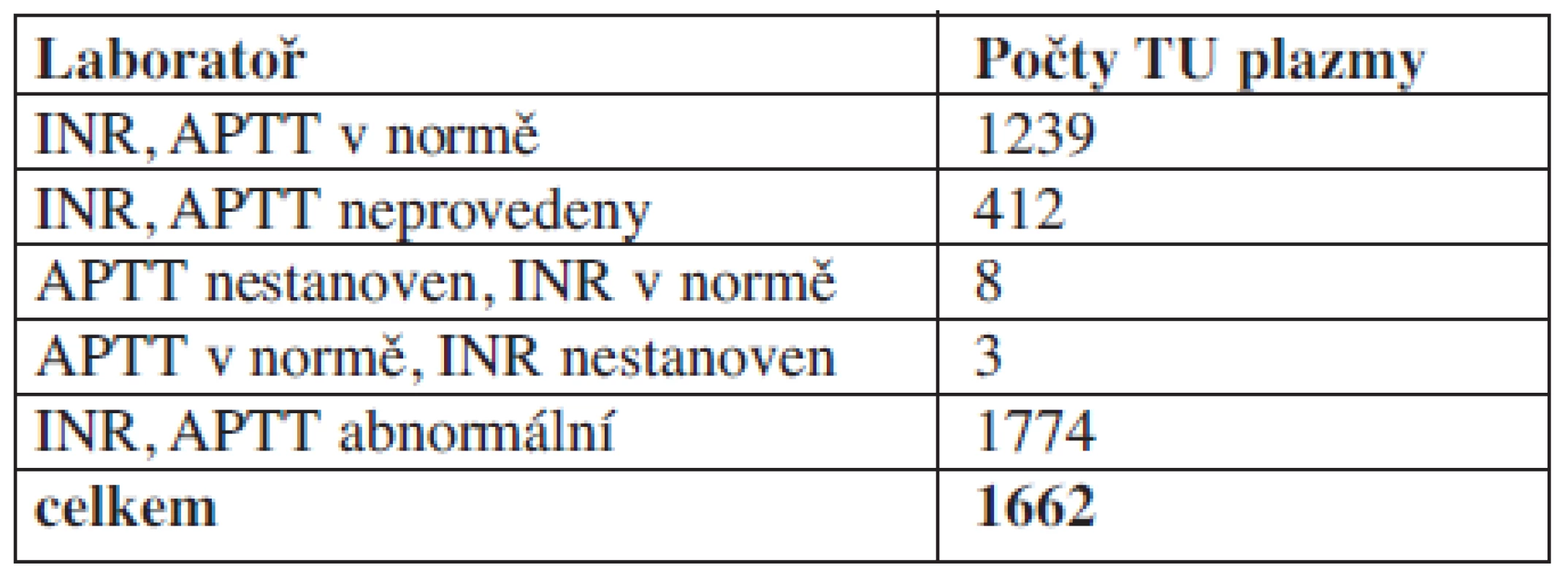
Komentář: Při auditu je zjištěno, že v den aplikace velká část pacientů nemá proveden nebo má v normě koagulační laboratorní screening.
Závěr: Získané výsledky je nutné konzultovat s jednotlivými klinickými pracovišti. Závěr auditu je předložen komisi účelné hemoterapie a ta navrhuje další doporučení do klinického provozu. Takto provedený audit napomůže k eliminaci nesprávně indikovaných transfuzních přípravků a tím ke snížení počtu nepříznivých reakcí po jejich aplikaci. Nepřímo dojde taktéž ke zlepšení ekonomických parametrů pracoviště a ke kontrole správnosti vykazování transfuzních přípravků zdravotním pojišťovnám.
053
VELKÉ MASIVNÍ TRANSFUZE – ZÁTĚŽOVÝ TEST PRO KREVNÍ BANKU
Biederman P.1, Mokráček A2, Kovářík A.2
1Transfuzní odd. Nemocnice Č. Budějovice, 2Kardiocentrum Nemocnice Č. Budějovice a.s.
Masivní transfuze jsou definovány jako substituce u a) ztráty krevního objemu v průběhu 24 hodin – u dospělého ekvivalent cca 10 T.U. erytrocytů (Mollison a kol. 1997), b) ztráty objemu 50 % objemu krve během 3 hodin, c) pokračující krevní ztráty přesahující objem 150/min. (Fakhry a Sheldon, 1994). Bývají podávány nejčastěji v důsledku život ohrožujícího krvácení u polytraumatu, aneuryzmatu aorty, porodnické či chirurgické komplikace. Jejich zabezpečení ze strany krevní banky je velice náročné.
Hlavními terapeutickými cíli jsou udržení tkáňové oxygenace a perfuze restaurací krevního objemu a dostatečnou hodnotou Hb, dosažení chirurgické kontroly krvácení s podporou koagulace, korekce hypotermie, acidózy a ostatních parametrů systémové hemostáze.
Z hlediska hemoterapie bývá mimo obvyklé podání transfuzních přípravků často nutná i aplikace koncentrátů koagulačních faktorů a dle dynamiky poruchy koagulace i jiných léčiv například antifibrinolytik, hemostyptik, tkáňových lepidel.
Kazuistika
Je popsán případ aplikace velkých masivních transfuzí u pacientky s komplikovaným pooperačním průběhem po operaci aorty. 52leté nemocné krevní skupinou A1Rh poz. byla provedena resekce výdutě a náhrada ascendentní aorty s aortální chlopní bioprotézou pro významnou aortální rerurgitaci. Chirurgický výkon proběhl bez komplikací. Několik minut po příjezdu na pooperační oddělení došlo k opakované zástavě srdeční nejasné etiologie. Po úspěšné resuscitaci byla provedena urgentní reoperace s našitím žilních bypassů na art.cor.dxt. a zavedena mechanická podpora levé komory. Po reoperaci přetrvávalo zhruba necelé 2 dny difuzní krvácení z operačního pole vyžadující následně další 2 chirurgické revize. Došlo k výraznému poklesu normálních výchozích hodnot krevního obrazu až na hodnoty Hb na 52 g/l, ery 1,68 x 1012 /l , Htc 0,147, trombo 72 x 109 /l. Globální koagulační testy APTT, PT vykazovaly prodloužení zhruba na 1,5násobek normy. Nejnižší hodnota firbinogenu byla 1,8 g/l, AT III 60 %, hodnoty D-dimerů kolísaly mezi 300–500 ng/ml. Během 32 hodin bylo podáno celkem 67 T.U. EBR, 78 T.U. plazmy, 8 léčebných dávek trombocytů. Dále byl aplikován Dicynone, Fibrinogen, antifibrinolytikum Exacyl, koncentrát faktorů protrombinového komplexu – Prothromplex, rekombinantní aktivovaný f VII NovoSeven. 3. den po základní operaci mohla být po stabilizaci stavu provedena odložená sutura sterna a odstraněna mechanická srdeční podpora. Další větší podání transfuzních přípravků 6 T.U. Ery, 12 T.U. plazmy bylo 16. pooperační den pro krvácení z částečně rozpuštěné sternotomie, jehož příčinou byl defekt žilního bypassu, který byl při chirurgické revizi zaslepen. Definitivní uzavření rány bylo provedeno 41. den po operaci. Během hospitalizace bylo pacientce podáno 75 T.U. EBR, 90 T.U. plazmy, 14 léčebných dávek trombocytů . V dalším sledovaném období 9 měsíců u pacientky nebyly zjištěny erytrocytární aloprotilátky či HLA protilátky I. třídy. Zdravotní stav pacientky, která je sledována v kardiologické ambulanci, je dobrý.
Závěr: Horní hranice masivních transfuzí není stanovena. Pro krevní banku ve zdravotnických zařízeních se specializovanou zdravotní péčí může nastat krizová situace při souběhu zabezpečení substituce pro více kritických pacientů zvláště ve dnech pracovního volna, u pacientů s málo frekvenční krevní skupinou či klinicky významnými protilátkami. Nezbytností je koordinovaná spolupráce mezi klinickými a transfuzním odd. a dalším komplementem. Důležitým faktorem je průběžný stav zásob krevní banky a rychlost mobilizace dárců. Nelze se spoléhat externí pomoc jiných zařízení. Stále více vzrůstá význam bezkrevní chirurgie a farmakologické léčby.
054
SYNDROM TWIN-TO-TWIN TRANSFUZE
Pejchalová A., Řehulová L.
Transfuzní oddělení a krevní banka, FN Brno
Úvod: Twin-to-twin transfuzní syndrom (TTTS) je závažná komplikace gravidity monochoriálních dvojčat. Většina plodů postižených TTTS umírá bez léčby před 26. gestačním týdnem. Příčinou syndromu je nerovnováha v krevním řečišti monochoriální placenty mezi oběma plody, která vede k hypervolemii a polyhydramnionu u recipienta a hypovolemii a oligohydramnionu u donora.
Pozorování: V souvislosti s TTTS jsme zajišťovali hemoterapii pro novorozená monochoriální biamniální dvojčata. U hypervolemického recipienta s polyglobulií, narůstajícím ikterem a dalšími známkami hemolýzy při mikroangiopatické hemolytické anemii byla provedena výměnná transfuze, po které došlo ke korekci původních hodnot hemoglobinu a bilirubinu. Při těžkém postižení mozku a srdce dítěte však následovalo zhoršení a nakonec selhání jeho životních funkcí. Výrazně anemický donor, kterému s ohledem na náplň krevního řečiště nebylo zpočátku možné odebrat vzorek k předtransfuznímu vyšetření, přijal opakovaně substituční transfuze a jeho zdravotní stav se velmi rychle upravil.
Závěr: Komplexní poporodní léčba TTTS u obou monochoriálních dvojčat byla úspěšná u donora, jehož stav byl s výjimkou dvoudenní intenzivní péče v inkubátoru stabilizovaný a umožnil po měsíční hospitalizaci dimisi. Recipient se známkami postižení více orgánů přes veškerou poskytnutou léčbu po dvanácti hodinách života zemřel.
055
ROZDÍLY V ZAJIŠTĚNÍ HEMOTERAPIE U CHRONICKY SUBSTITUOVANÝCH PACIENTŮ A U NEMOCNÝCH S AKUTNÍ ZTRÁTOU KRVE
Sláviková M., Holusková I., Galuszková D.
Transfuzní oddělení FN Olomouc
Úvod: Prezentace je zaměřena na úskalí při řešení problematiky zajišťování hemoterapie pro pacienty, kteří jsou dlouhodobě závislí na pravidelném podávání transfuzních přípravků, a pro pacienty vyžadující akutní hemosubstituci.
Souhrn: S dlouhodobou závislostí na podávání transfuzních přípravků se nejčastěji setkáváme u hematoonkologických pacientů (nemocní s myelodysplastickým syndromem, aplastickou anémií, srpkovitou anémií, thalasemií, atd.). Naopak mezi nemocnými vyžadující akutní podání transfuzních přípravků jsou nejčastěji polytraumatizovaní pacienti, pacientky s poporodními komplikacemi, pacienti po velkých cévních operacích a během nich a rovněž kardiochirurgičtí pacienti. Pravděpodobnost erytrocytární aloimunizace u dlouhodobě substituovaných pacientů je velmi vysoká, její incidence se pohybuje v rozmezí 7–76 %. Pravděpodobnost aloimunizace se zvyšuje v závislosti na objemu podaných transfuzí a také na rostoucí době pravidelného podávání transfuzí pacientovi. Zajištění hemoterapie pro tyto nemocné vyžaduje, zejména v případě, došlo-li již k aloimunizaci pacienta, výběr vhodného transfuzního přípravku bez antigenů, proti kterým jsou antierytrocytární aloprotilátky namířeny (a dle fenotypu pacienta). Proto je nezbytná organizace pravidelného typování vhodných dárců a event. (v případě nedostatku vhodného transfuzního přípravku na skladě transfuzního oddělení) i následné zvaní otypovaných dárců krve k odběru do rezervy pro tyto pacienty. Zároveň je nutné sledovat a pravidelně provádět záchyt možných nově se tvořících nepravidelných tepelných antierytrocytárních aloprotilátek, které mohou vznikat na podkladě dlouhodobého antigenního stimulu podávanými erytrocytárními transfuzními přípravky.
Naopak u nemocných s akutní krevní ztrátou je riziko aloimunizace podstatně menší vzhledem k rychlému podání velkého množství transfuzních přípravků během krátké doby a tím i krátkodobé expozici erytrocytárních antigenů imunitnímu systému pacienta.
Závěr: Vzhledem k uvedeným skutečnostem je nezbytné dostatečné zajištění transfuzních přípravků jak pro nemocné vyžadující akutní náhradu krevních ztrát, tak i dostatečného množství otypovaných erytrocytárních přípravků pro dlouhodobě substituované pacienty.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Dárcovské a léčebné aferézyČlánek Krví přenosné chorobyČlánek ImunohematologieČlánek Sekce v angličtiněČlánek Sekce nelékařských profesíČlánek Dárcovství, hemovigilanceČlánek Sekce v angličtiněČlánek PosteryČlánek Rejstřík autorů
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2009 Číslo 3 - Supplementum- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Transfuzní služba - historie a současnost
- Dárcovské a léčebné aferézy
- Krví přenosné choroby
- Slavnostní Janského přednáška
- Imunohematologie
- Sekce v angličtině
- Sekce nelékařských profesí
- Výroba transfuzních přípravků, kontrola jakosti
- Hemoterapie
- Sekce v angličtině
- Postery
- Rejstřík autorů
- Dárcovství, hemovigilance
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Krví přenosné choroby
- Hemoterapie
- Výroba transfuzních přípravků, kontrola jakosti
- Transfuzní služba - historie a současnost
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy