-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cievny endotelový rastový faktor u osôb s diabetom 2. typu
Vascular endothelial growth factor in persons with type 2 diabetes
Aim of the study was to investigate the relationship between the serum vascular endothelial growth factor concentration and parameters of endothelial injury and/or dysfunction in persons with type 2 diabetes mellitus with normo - or microalbuminuria.
Patients and methods:
Eighty-four persons with type 2 diabetes were divided in two subgroups (n = 42 each): normoalbuminuric and microalbuminuric. Forty-two blood donors were in control group. Serum vascular endothelial growth factor and the plasma concentrations of von Willebrand factor, soluble thrombomodulin, plasminogen activator inhibitor type 1, thrombin-activatable fibrinolysis inhibitor and tissue plasminogen activator were measured using enzyme-linked immunosorbent assay (ELISA) in all subjects.Results:
The vascular endothelial growth factor concentration was significantly higher in normoalbuminuric diabetic group compared to controls (338.5, 202-432 pg/mL vs. 182, 124-211 pg/ml, p = 0.0443). The difference between microalbuminuric diabetic group and controls was not statistically significant.Conclusions:
Serum vascular endothelial growth factor could be a more sensitive predictor of renal vascular changes in persons with diabetes mellitus type 2 than microalbuminuria.Key words:
vascular endothelial growth factor, diabetes mellitus type 2, microalbuminuria, endothelial dysfunction, endothelial markers
Autoři: J. Staško 1; P. Chudý 1; D. Mištuna 3; P. Galajda 2; M. Mokáň 2; P. Kubisz 1
Působiště autorů: Národné centrum hemostázy a trombózy, Klinika hematológie a transfuziológie Jesseniovej lekárskej fakulty Univerzity Komenského (JLF UK) a Martinskej fakultnej nemocnice (MFN), Martin, SR 1; I. interná klinika JLF UK a MFN, Martin, SR 2; I. chirurgická klinika JLF UK a MFN, Martin, SR 3
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 3, p. 152-157.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Cieľom klinickej štúdie bolo preskúmať vzťah medzi sérovými koncentráciami cievneho endotelového rastového faktora a parametrami endotelového poškodenia a dysfunkcie u osôb s diabetom 2. typu s normo - a mikroalbuminúriou.
Pacienti a metódy:
Do štúdie bolo zaradených 84 osôb s diabetom 2. typu, ktorí boli rozdelení do 2 podskupín: normoalbuminurickej (n = 42) a mikroalbuminurickej (n = 42). V kontrolnej skupine bolo 42 zdravých darcov krvi. U všetkých jedincov boli vyšetrené sérové koncentrácie cievneho endotelového rastového faktora a plazmatické koncentrácie von Willebrandovho faktora, solubilného trombomodulínu, inhibítora plazminogénového aktivátora, trombínom aktivovateľného inhibítora fibrinolýzy a tkanivového aktivátora plazminogénu metódou enzýmovej imunoanalýzy (ELISA).Výsledky:
Koncentrácie cievneho endotelového rastového faktora boli významne vyššie v podskupine diabetikov s normoalbuminúriou v porovnaní s kontrolnou skupinou (338,5, 202–432 pg/ml vs. 182, 124–211 pg/ml, p = 0,0443). Medzi koncentráciami cievneho endotelového rastového faktora v podskupine diabetikov s mikroalbuminúriou a kontrolnou skupinou nebol zistený štatisticky významný rozdiel.Záver:
Sérový cievny endotelový rastový faktor by mohol byť citlivejším predpovedným faktorom obličkových cievnych zmien u pacientov s diabetes mellitus 2. typu než mikroalbuminúria.Kľúčové slová:
cievny endotelový rastový faktor, diabetes mellitus 2. typu, mikroalbuminúria, endotelová dysfunkcia, endotelové markeryÚvod
Cievny endotelový rastový faktor (vascular endothelial growth factor, VEGF) je endotelovo špecifický rastový faktor, ktorý stimuluje proliferáciu, diferenciáciu a prežívanie endotelových buniek, umožňuje vazodilatáciu závislú na endotele, navodzuje mikrovaskulárnu hyperpermeabilitu, zúčastňuje sa remodelácie intersticiálnej matrix a reguluje tvorbu kolaterál pri ischémii (1, 2).
VEGF zvyšuje aj permeabilitu glomerulov pre makromolekuly, čím vedie k zvýšenej proteinúrii, albuminúrii a extravazácii plazmatických bielkovín. Predpokladá sa, že tento mechanizmus má dôležitú úlohu v rôznych patologických stavoch, medzi ktoré patrí aj rozvoj endotelovej dysfunkcie pri diabetes mellitus (DM) (3). Zistilo sa, že inhibícia VEGF má priaznivé účinky na funkčné a štrukturálne poškodenia navodené diabetickým procesom, čo nasvedčuje na účasť VEGF v patofyziológii diabetickej nefropatie (1).
Vzťah medzi plazmatickými koncentráciami VEGF a diabetickými mikrovaskulárnymi komplikáciami, ako sú diabetická retinopatia a nefropatia u DM typu 1 a 2, sledovalo niekoľko štúdií (4–13). V experimentálnych štúdiách na zvieracom modeli ako aj v klinických štúdiách u osôb s DM typu 1 a 2 boli plazmatické hladiny VEGF zvýšené už vo včasnom štádiu diabetickej nefropatie (6–9, 14).
Von Willebrandov faktor (vWF) je známy marker aktivácie endotelu. V niektorých štúdiách sa zistili zvýšené koncentrácie vWF už u osôb s DM 2. typu s normoalbuminúriou alebo pri porušenej glukózovej tolerancii, zatiaľčo iní autori pozorovali zvýšené koncentrácie vWF až u mikroalbuminurických diabetikov (16–18).
Solubilný trombomodulín (sTM) je markerom poškodenia endotelu. sTM dobre koreluje s mikroalbuminúriou a jeho koncentrácie nie sú zvýšené u osôb s diabetom pri neprítomnosti cievnych komplikácií. Mikroalbuminúria je ako symptóm generalizovanej endotelovej dysfunkcie sprevádzaná zmenami koncentrácií sTM u osôb s diabetom, pričom zvýšenie koncentrácie sTM koreluje so stupňom exkrécie albumínu (19–21).
Trombínom aktivovateľný inhibítor fibrinolýzy (TAFI) tvorí dôležité spojenie medzi fibrinolýzou a koagulačnou kaskádou. Zvýšené plazmatické koncentrácie TAFI boli zistené u osôb s DM 2. typu, obezitou, inzulínovou rezistenciou a hypercholesterolémiou (22). U osôb s diabetom 2. typu s mikroalbuminúriou boli popísané významne vyššie plazmatické koncentrácie TAFI než u osôb s diabetom s fyziologickými koncentráciami albumínu v moči. Niektorí autori predpokladajú, že zvýšené koncentrácie TAFI u osôb s DM typu 2 majú úlohu nielen v mechanizme fibrinolýzy, ale aj pri endotelovom poškodení (22).
Inhibítor aktivátora plazminogénu-1 (PAI-1) je viackompartmentový proteín, ktorého plazmatické koncentrácie sa zvyšujú pri poškodení endotelu. U osôb s inzulínovou rezistenciou a DM boli popísané zvýšené plazmatické koncentrácie PAI-1. Leurs et al. zistil, že exkrécia albumínu koreluje u osôb s diabetom s aktivitou PAI-1 v moči (23).
Tkanivový aktivátor plazminogénu (tPA) je uvoľňovaný z endotelu a patrí medzi markery dysfunkcie a poškodenia endotelu. Zistilo sa, že koncentrácie tPA boli významne vyššie u osôb s DM 2. typu s normoalbuminúriou a s mikroalbuminúriou v porovnaní so zdravou kontrolnou skupinou (24).
Fragmenty protrombínu 1+2 (F1+2) sú priamym markerom generácie trombínu a aktivácie koagulácie. Fragmenty F1+2 boli významne zvýšené u osôb s DM oproti zdravej kontrolnej skupine tej istej vekovej kategórie (25).
V literatúre je málo informácií o možnej úlohe VEGF ako markera endotelopatie a mikrovaskulárnych komplikácií u osôb s DM 2. typu s obličkovým poškodením.
Cieľom práce bolo posúdiť úlohu VEGF ako možného včasného markera endotelovej dysfunkcie. Z tohto dôvodu boli v štúdii osôb s DM 2. typu vyšetrené sérové koncentrácie VEGF a plazmatické koncentrácie vybraných endotelových markerov (vWF, sTM) a markerov fibrinolýzy, ktoré majú vzťah k endotelovej dysfunkcii (TAFI, PAI-1, tPA).
Pacienti a metódy
Do štúdie bolo zaradených 84 osôb s DM 2. typu. Kritériá pre výber osôb s diabetom boli: vek >18 rokov, metabolická kompenzácia diabetu, neprítomnosť neskorých komplikácií diabetu, kontrolovaná artériová hypertenzia, neprítomnosť pridruženého nádorového, iného metabolického alebo zápalového ochorenia, neprítomnosť manifestného obličkového alebo pečeňového ochorenia a informovaný súhlas s účasťou v štúdii. Všetky osoby s diabetom boli vyšetrené na nefrologickej ambulancii I. internej kliniky JLF UK a MFN. Zaradené osoby s DM 2. typu boli bez klinických a laboratórnych príznakov manifestnej diabetickej nefropatie a nemali ani klinické prejavy iných mikrovaskulárnych komplikácií DM (retinopatia, neuropatia). Osoby s diabetom boli rozdelení do 2 podskupín (v každej 42 osôb) podľa prítomnosti mikroalbuminúrie (> 30 a < 300 mg/24 hodín) na podskupinu s normoalbuminúriou (NAU) (≤ 30 mg/24 hodín) a podskupinu s mikroalbuminúriou (MAU) (> 30 mg/24 hodín). Kontrolnú skupinu tvorilo 42 zdravých darcov krvi.
Demografické údaje, trvanie DM 2. typu a klinické a laboratórne charakteristiky osôb v oboch diabetických podskupinách sú uvedené v tabuľke 1.
Tab. 1. Demografické údaje, trvanie diabetu, klinické a laboratórne charakteristiky podskupín osôb s diabetom 2. typu. 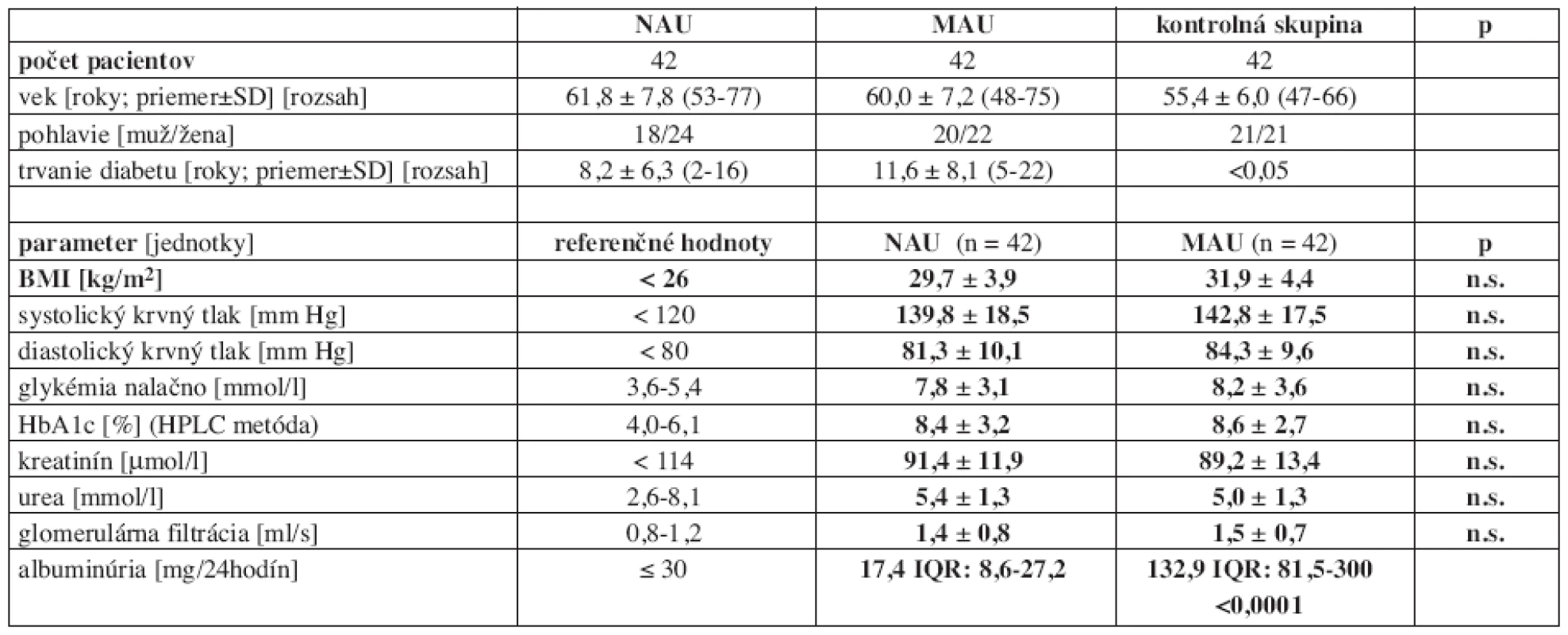
NAU = normoalbuminurická diabetická podskupina, MAU = mikroalbuminurická diabetická podskupina, BMI = body mass index, HbA1c = glykovaný hemoglobín A1, HPLC = high pressure liquid chromatography; výsledky sú uvedené ako priemer ± SD, albuminúria je uvedená ako medián (IQR: dolný kvartil – horný kvartil), SD = smerodajná odchýlka, IQR = interkvartilový rozptyl, p = významnosť, n.s. = nevýznamný Štúdia bola schválená inštitucionálnou Etickou komisiou a všetky osoby zaradené do štúdie podpísali informovaný súhlas s účasťou v štúdii. Diagnóza DM 2. typu bola stanovená na základe kritérií a odporúčaní the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus (26). Dvadsaťpäť osôb s DM 2. typu bolo kompenzovaných na diéte, 32 diabetikov bolo nastavených na perorálne antidiabetiká (13 osôb – biguanidy, 12 osôb – deriváty sulfonylurey, 5 osôb – kombinované prípravky, 2 osoby – tiazolidíndióny), 20 diabetikov bolo liečených inzulínom a 7 diabetikov bolo na kombinácii inzulínu a PAD. Sedemdesiatosem osôb s DM malo hypertenziu a boli liečené antihypertenzívami (36 v NAU skupine a 42 v MAU skupine). Na liečbe jedným antihypertenzívom boli traja diabetici z NAU skupiny a 12 diabetikov z MAU skupiny. Ostatní diabetici mali kombináciu antihypertenzív. Pri porovnaní oboch podskupín diabetikov (NAU a MAU) neboli medzi nimi výraznejšie rozdiely v zastúpení antidiabetickej a antihypertenzívnej liečby (tab. 2).
Tab. 2. Antidiabetická, antihyperlipidemická a antihypertenzívna liečba osôb v oboch diabetických podskupinách. 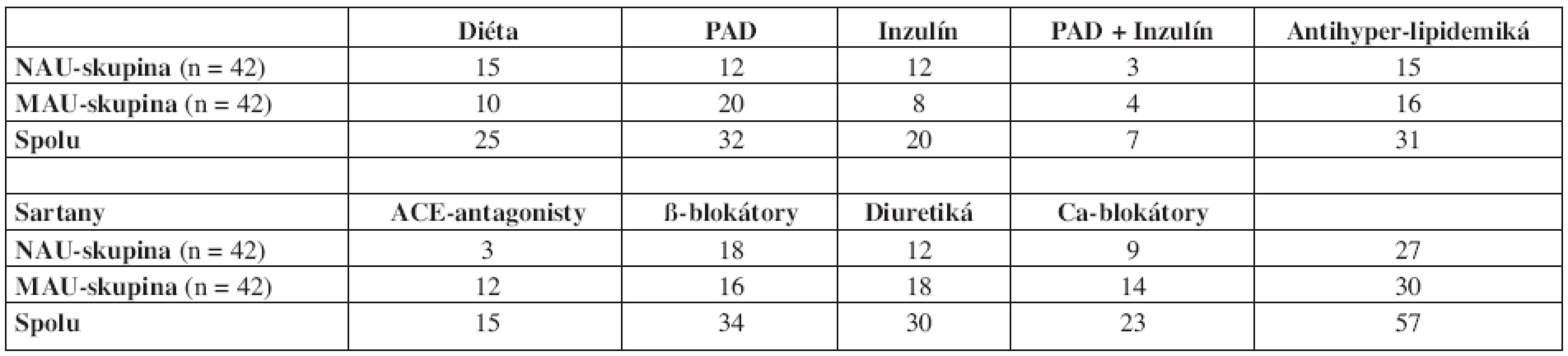
NAU = normoalbuminurická diabetická podskupina, MAU = mikroalbuminurická diabetická podskupina, PAD = perorálne antidiabetiká, ACEantagonisty = antagonisty angiotenzín konvertujúceho enzýmu Vzorky na vyšetrenie zo žilovej krvi boli odobraté ráno na lačno. Pred odberom boli osoby s diabetom a zdraví jedinci najmenej 20 minút bez fyzickej aktivity. Vzorky séra a plazmy získané po scentrifugovaní boli zamrazené pri -70 °C až do času vyšetrenia. Sérové koncentrácie VEGF a plazmatické koncentrácie vWF, sTM, TAFI, PAI-1, tPA a F1+2 boli vyšetrené metódou enzýmovej imunoanalýzy (ELISA) použitím komerčne dostupných kitov. Sérový VEGF bol vyšetrený kitom Quantikine VEGF (R&D Systems Inc., Minneapolis, MN, USA). Plazmatické koncentrácie vWF, sTM, TAFI, PAI-1 a tPA boli stanovené kitmi Asserachrom (Diagnostica Stago, Asnieres, Francúzsko) a fragmenty protrombínu F1+2 boli merané kitom Enzygnost F1+2 (Dade Behring, Marburg, SRN). 24-hodinová albuminúria bola vyšetrená rádioimunoanalýzou (Immunotech, Praha, Česká republika) a glykovaný hemoglobín (HbA1c) bol stanovený metódou vysokotlakovej kvapalinovej chromatografie (HPLC). Ostatné hematologické a biochemické parametre boli merané štandardne používanými metódami laboratórií Kliniky hematológie a transfuziológie a Ústavu klinickej biochémie JLF UK a MFN.
Výsledky vyšetrení VEGF a sledovaných endotelových markerov boli vyjadrené vo forme: medián a interkvartilový rozptyl (IQR). Štatistické vyhodnotenie bolo urobené softvérom SPSS 12.0 pre Windows (SPSS Inc., Chicago, IL, USA) a na porovnanie parametrov v hodnotených skupinách bol použitý Kruskal-Wallisov test (modifikácia testu podľa Dwass-Steel-Chritchlow-Fligner). Korelácie boli hodnotené Spearmanovým koeficientom. Za štatisticky významné bolo považované p < 0,05.
Výsledky
Koncentrácie VEGF v sére a koncentrácie endotelových markerov v plazme sú uvedené v tabuľke 3 a zobrazené v grafoch 1–6.
Tab. 3. VEGF a endotelové markery v podskupinách osôb s diabetom 2. typu a v zdravej kontrolnej skupine. 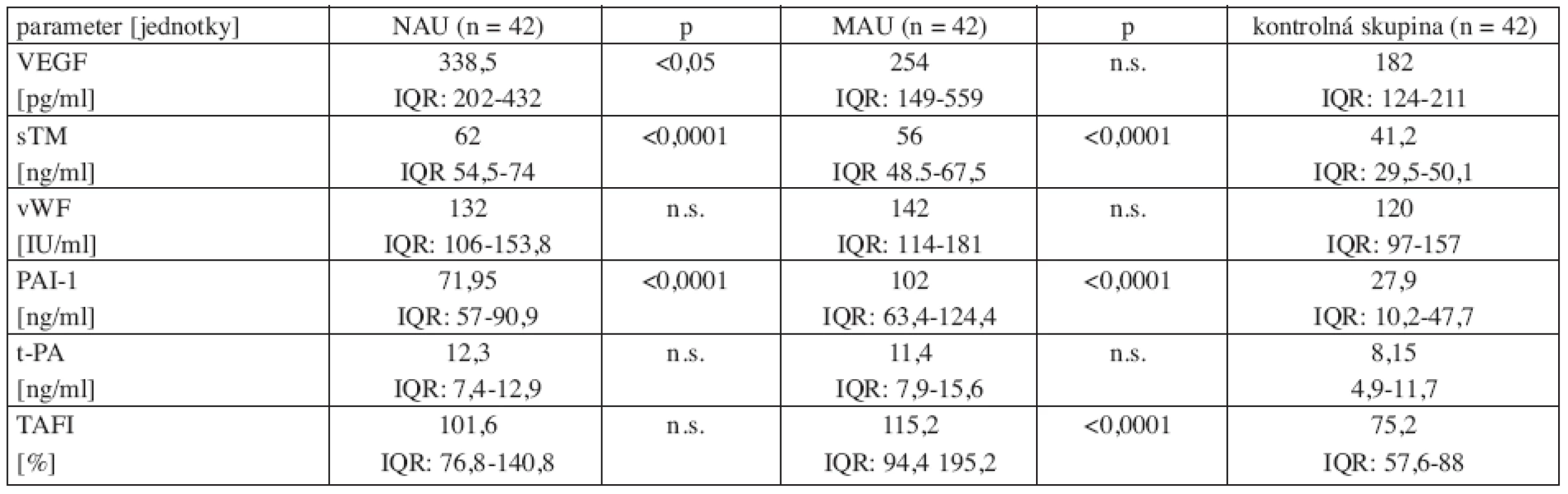
NAU = normoalbuminurická diabetická podskupina, MAU = mikroalbuminurická diabetická podskupina, VEGF = cievny endotelový rastový faktor, sTM = solubilný trombomodulín, vWF = von Willebrandov faktor, PAI-1 = inhibítor aktivátora plazminogénu, tPA = tkanivový aktivátor plazminogénu, TAFI = trombínom aktivovateľný inhibítor fibrinolýzy; výsledky sú uvedené ako medián (IQR: dolný kvartil – horný kvartil), IQR = interkvartilový rozptyl, p = významnosť, n.s. = nevýznamný VEGF v sére bol vyšší v NAU diabetickej podskupine v porovnaní so zdravými kontrolami (p = 0,0443). Nebol zistený významný rozdiel medzi VEGF v sére v MAU diabetickej podskupine a zdravej kontrolnej skupine (p = 0,0941) (tab. 3, graf 1).
Graf 1. VEGF = cievny endotelový rastový faktor, C = kontrolná skupina, NAU = normoalbuminurická diabetická podskupina, MAU = mikroalbuminurická diabetická podskupina, n.s. = nevýznamný, p = významnosť bola vypočítaná pre každú diabetickú podskupinu v porovnaní ku kontrolám 
Koncentrácie sTM a PAI-1 v plazme boli zvýšené v oboch diabetických podskupinách v porovnaní so zdravou kontrolnou skupinou (sTM: p < 0,0001 NAU, p < 0,0011 MAU; PAI-1: p < 0,0001 v oboch diabetických podskupinách) (tab. 3, graf 2, 3).
Graf 2. sTM = solubilný trombomodulín, C = kontrolná skupina, NAU = normoalbuminurická diabetická podskupina, MAU = mikroalbuminurická diabetická podskupina, p = významnosť bola vypočítaná pre každú diabetickú podskupinu v porovnaní ku kontrolám 
Graf 3. PAI-1 = inhibítor aktivátora plazminogénu, C = kontrolná skupina, NAU = normoalbuminurická diabetická podskupina, MAU = mikroalbuminurická diabetická podskupina, p = významnosť bola vypočítaná pre každú diabetickú podskupinu v porovnaní ku kontrolám 
Koncentrácie vWF v plazme v oboch diabetických podskupinách neboli zvýšené v porovnaní so zdravou kontrolnou skupinou (vWF: p = 0,8320 NAU, p= 0,2008 MAU) (tab. 3, graf 4).
Graf 4. vWF = von Willebrandov faktor, C = kontrolná skupina, NAU = normoalbuminurická diabetická podskupina, MAU = mikroalbuminurická diabetická podskupina, n.s. = nevýznamný, p = významnosť bola vypočítaná pre každú diabetickú podskupinu v porovnaní ku kontrolám 
Koncentrácie TAFI v plazme boli zvýšené len v MAU podskupine v porovnaní s kontrolnou skupinou (p < 0,0005 MAU, p = 0,1690 NAU) (tab. 3, graf 5).
Graf 5. TAFI = trombínom aktivovateľný inhibítor fibrinolýzy, C = kontrolná skupina, NAU = normoalbuminurická diabetická podskupina, MAU = mikroalbuminurická diabetická podskupina, n.s. = nevýznamný, p = významnosť bola vypočítaná pre každú diabetickú podskupinu v porovnaní ku kontrolám 
Koncentrácie F1+2 v plazme boli významne zvýšené v oboch diabetických podskupinách oproti kontrolnej skupine (p = 0,0001 v NAU aj MAU podskupine) (tab. 3, graf 6).
Graf 6. F1+2 = fragmenty protrombínu 1+2, C = kontrolná skupina, NAU = normoalbuminurická diabetická podskupina, MAU = mikroalbuminurická diabetická podskupina, p = významnosť bola vypočítaná pre každú diabetickú podskupinu v porovnaní ku kontrolám 
V rámci oboch diabetických podskupín neboli zistené žiadne iné významné rozdiely v koncentráciách VEGF v sére a v koncentráciách endotelových markerov v plazme.
Pri hodnotení diabetických podskupín neboli nájdené ani žiadne korelácie medzi VEGF a endotelovými markermi s výnimkou slabej pozitívnej korelácie VEGF v sére a TAFI v plazme (r = 0,434; p < 0,005) v MAU podskupine. Významná bola aj pozitívna korelácia TAFI a F1+2 v plazme (r = 0,427; p = 0,001), opäť v MAU podskupine.
Pri zohľadnení koncentrácií HbA1c a krvného tlaku nebol zistený významný rozdiel vo VEGF v sére medzi diabetikmi s normálnym a zvýšeným HbA1c a medzi diabetikmi s hypertenziou a bez hypertenzie (tab. 4).
Tab. 4. VEGF v sére u osôb s diabetom typu 2 v závislosti od glykovaného hemoglobínu a od krvného tlaku. 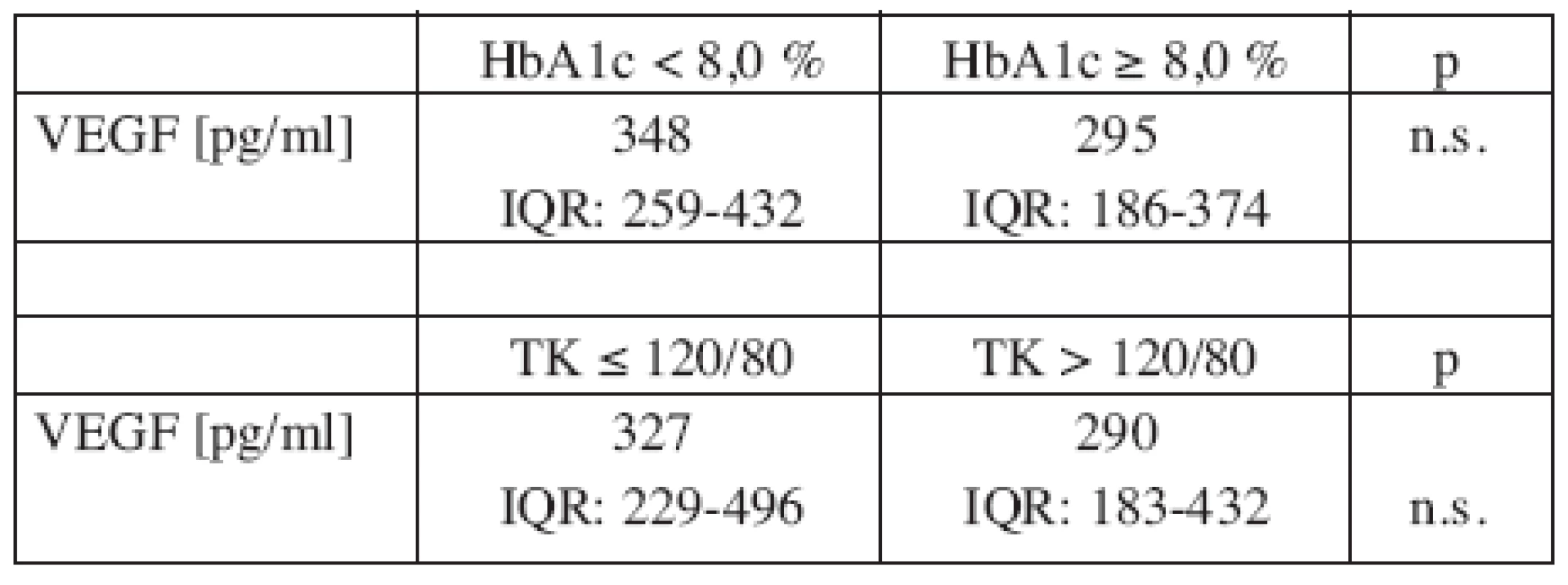
VEGF = cievny endotelový rastový faktor, HbA1c = glykovaný hemoglobín A1, TK = krvný tlak; výsledky sú uvedené ako medián (IQR: dolný kvartil – horný kvartil), IQR = interkvartilový rozptyl, p = významnosť, n.s. = nevýznamný Diskusia
Kim et al. (13, 14) vyšetril plazmatické a močové koncentrácie VEGF u 107 osôb s DM 2. typu a u 47 zdravých kontrol. Osoby s diabetom rozdelil podľa pomeru močový albumín/kreatinín (ACR) do diabetickej normoalbuminurickej skupiny (n = 37), diabetickej mikroalbuminurickej skupiny (n = 37) a diabetickej skupiny so zjavnou proteinúriou (n = 33). V tejto štúdii sa VEGF v moči zvyšoval proporcionálne k močovej exkrécii albumínu, zatiaľ čo koncentrácie VEGF v plazme zostali nezmenené (13, 14). Naše výsledky sú čiastočne rozdielne od štúdie Kima et al., pretože naši diabetici s normoalbuminúriou mali významne vyššie koncentrácie VEGF v sére v porovnaní s kontrolnou skupinou. Zvýšené koncentrácie VEGF v plazme popísal u osôb s DM 2. typu aj Blann et al., ale len u diabetikov s aterosklerózou (11). Wasada et al. (10) zistil, že koncentrácie VEGF v plazme boli u osôb s DM 2. typu vyššie než u kontrol a súčasne mali sklon stúpať so zvýšením exkrécie albumínu v moči. Aj keď naše výsledky svedčia pre významný rozdiel VEGF v sére medzi normoalbuminurickými osobami s diabetom a zdravými kontrolami, nezistila sa závislosť zvýšenia VEGF v sére u diabetikov 2. typu na stupni mikroalbuminúrie. Naše výsledky a výsledky Kima et al. sú v súlade so závermi Shimadu et al. (12), ktorý zistil, že koncentrácie VEGF v plazme nekorelovali u osôb s DM 2. typu so stupňom albuminúrie.
U prepubertálnych, pubertálnych a mladých dospelých diabetikov 1. typu boli zistené tiež zvýšené koncentrácie VEGF v sére už pred manifestáciou nefropatie (6, 8, 27). U osôb s DM 1. typu boli tiež zistené významne zvýšené koncentrácie VEGF v sére u tých diabetikov, ktorí mali prítomnú retinopatiu alebo nefropatiu oproti diabetikom, ktorí tieto komplikácie nemali. Chiarelli et al. (6) potvrdil významne zvýšené koncentrácie VEGF v sére u diabetikov 1. typu s nedostatočnou glykemickou kontrolou oproti diabetikom, ktorí boli adekvátne liečení. Na rozdiel od výsledkov týchto štúdií u osôb s DM 1. typu u našich diabetikov 2. typu neboli významné rozdiely koncentrácií VEGF v sére medzi skupinou diabetikov s normoalbuminúriou a mikroalbuminúriou, čo je v súlade s inými štúdiami u DM 2. typu (12–14). U našich diabetikov 2. typu taktiež nebola zistená závislosť medzi VEGF v sére a inými rizikovými faktormi diabetických mikrovaskulárnych komplikácií (glykemickou kontrolou, hypertenziou, trvaním DM a vekom) (12–14, 28, 29).
V štúdii osôb s DM 1. typu Santilli et al. (8) považuje zvýšené sérové koncentrácie VEGF za včasný marker generalizovanej dysfunkcie endotelu. Naše výsledky u diabetikov s normoalbuminúriou potvrdzujú významné zvýšenie VEGF v sére už v čase, keď sa niektoré známe endotelové markery (vWF) ešte významne nezvyšujú. VEGF v sére však v našej štúdii nekoreloval so žiadnym endotelovým markerom (s výnimkou TAFI v podskupine diabetikov s MAU), a teda nemôže byť podľa týchto výsledkov považovaný za včasný marker dysfunkcie/poškodenia endotelu u osôb s DM 2. typu.
Záver
V súčasnosti je zrejmé, že VEGF má nepriaznivú úlohu v obličkovej fyziológii, čo bolo potvrdené množstvom experimentálnych štúdií a štúdií in vitro. Úloha VEGF v sére/plazme ako predpovedného ukazovateľa mikrovaskulárnych a endotelových zmien u osôb s DM 2. typu je však ešte stále nejasná a výsledky klinických štúdií sú nejednoznačné. Rozdiely vo výsledkoch klinických štúdií môžu byť spôsobené heterogenitou študovaných populácií a rozdielnym dizajnom štúdií. Naše výsledky svedčia o tom, že VEGF v sére by mohol byť citlivejším a včasnejším predpovedným ukazovateľom obličkových vaskulárnych zmien než mikroalbuminúria. VEGF v sére však podľa našich výsledkov nie je spoľahlivým ukazovateľom progresie obličkového poškodenia. V súvislosti s tým zatiaľ nemožno jednoznačne zodpovedať otázku, či by VEGF v sére/plazme mohol byť spoľahlivým markerom endotelovej dysfunkcie/poškodenia a jeho progresie u osôb s DM 2. typu.
Poďakovanie
Práca bola podporená projektmi Vega 1/3381/06 a 1/00067/08 a projektmi UK 77/2007 a 421/2008.
Doc. MUDr. Ján Staško, Ph.D.
Klinika hematológie a transfuziológie JLF UK a MFN
Kollárova č. 2
036 59 Martin
Slovensko
e-mail: stasko@jfmed.uniba.sk
Doručeno do redakce: 31. 3. 2009
Přijato: 1. 6. 2009
Zdroje
1. Schrijvers BF, Flyvbjerg A, De Vriese AS. The role of vascular endothelial growth factor (VEGF) in renal pathophysiology. Kidney Int 2004; 65 : 2003–2017.
2. Clayton JA, Chalothorn D, Faber JE. Vascular endothelial growth factor-A specifies formation of native collaterals and regulates collateral growth in ischemia. Circ Res 2008; 103 : 1027–1036.
3. Wolf G, Ziyadeh FN. Cellular and molecular mechanisms of proteinuria in diabetic nephropathy. Nephron-Physiology 2007; 106 : 26–31.
4. Khamaisi M, Schrijvers BF, De Vriese AS, Raz I, Flyvbjerg A. The emerging role of VEGF in diabetic kidney disease. Nephrol Dial Transplant 2003; 18 : 1427–1430.
5. Flyvbjerg A. Putative pathophysiological role of growth factors and cytokines in experimental diabetic kidney disease. Diabetologia 2000; 43 : 1205–1223.
6. Chiarelli F, Spagnoli A, Basciani F, et al. Vascular endothelial growth factor (VEGF) in children, adolescents and young adults with type 1 diabetes mellitus: relation to glycaemic control and microvascular complications. Diabetes UK. Diabet Med 2000; 17 : 650–656.
7. Knöbl P, Schernthaner G, Schnack C, et al. Thrombogenic factors are related to urinary albumin excretion rate in type 1 (insulin-dependent) and type 2 (non-insulin-dependent) diabetic patients. Diabetologia 1993; 36 : 1045–1050.
8. Santilli F, Spagnoli A, Mohn A, et al. Increased vascular endothelial growth factor serum concentrations may help to identify patients with onset of type 1 diabetes during childhood at risk for developing persistent microalbuminuria. J Clin Endocrinol Metab 2001; 86 : 3871–3876.
9. Hovind P, Tarnow L, Oestergaard PB, Parving HH. Elevated vascular endothelial growth factor in type 1 diabetic patients with diabetic nephropathy. Kidney Int 2000; 57 (Suppl 75): S56–S61.
10. Wasada T, Kawahara R, Katsumori K, Naruse M, Omori Y. Plasma concentration of immunoreactive vascular endothelial growth factor and its relation to smoking. Metabolism 1998; 47 : 27–30.
11. Blann AD, Belgore FM, McCollum CN, Silverman S, Lip PL, Lip GY. Vascular endothelial growth factor (VEGF) and its receptor, Flt-1, in the plasma of patients with coronary or peripheral atherosclerosis, or type II diabetes. Clin Sci 2002; 102 : 187–194.
12. Shimada K, Baba T, Neugebauer S, et al. Plasma vascular endothelial growth factor in Japanese Type 2 diabetic patients with and without nephropathy. J Diabetes Complications 2002; 16 : 386–390.
13. Kim NH, Kim KB, Kim DL, et al. Plasma and urinary vascular endothelial growth factor and diabetic nephropathy in type 2 diabetes mellitus. Diabetes UK. Diabet Med 2004; 21 : 545–551.
14. Kim NH, Oh JH, Seo JA, et al. Vascular endothelial growth factor (VEGF) and soluble VEGF receptor FLT-1 in diabetic nephropathy. Kidney Int 2005; 67 : 167–177.
15. Cha DR, Kang YS, Han SY, et al. Vascular endothelial growth factor is increased during early stage of diabetic nephropathy in type II diabetic rats. J Endocrinol 2004; 183 : 183 – 194.
16. Heywood DM, Mansfield MW, Grant PJ. Levels of von Willebrand factor, insulin resistance syndrome, and a common vWF gene polymorphism in non-insulin-dependent (type 2) diabetes mellitus. Diabet Med 1996;13 : 720–725.
17. Collier A, Rumley A, Rumley AG, et al. Free radical activity and hemostatic factors in NIDDM patients with and without microalbuminuria. Diabetes 1992; 41 : 909–13.
18. Schmitz A, Ingerslev J. Haemostatic measures in type 2 diabetic patients with microalbuminuria. Diabet Med 1990; 7 : 521–525.
19. Gabat S, Keller C, Kempe HP, et al. Plasma thrombomodulin: a marker for microvascular complications in diabetes mellitus. Vasa 1996; 25 : 233–241.
20. Inukai T, Fujiwara Y, Tayama K, Aso Y, Takemura Y. Clinical significance of measurements of urinary and serum thrombomodulins in patients with non-insulin-dependent diabetes mellitus. Diabetes Res Clin Pract 1996; 33 : 99–104.
21. Nilsson TK, Hellsten G, Amiral J. Plasma thrombomodulin concentrations in relation to cardiovascular risk factors in a population sample. Blood Coagul Fibrinolysis 1993; 4 : 455–458.
22. Yano Y, Kitagawa N, Gabazza EC, et al. Increased plasma thrombin-activatable fibrinolysis inhibitor levels in normotensive type 2 diabetic patients with microalbuminuria. J Clin Endocrinol Metab 2003; 88 : 736–741.
23. Leurs PB, Stolk RP, Hamulyak K, Van Oerle R, Grobbee DE, Wolffenbuttel BH. Tissue factor pathway inhibitor and other endothelium-dependent hemostatic factors in elderly individuals with normal or impaired glucose tolerance and type 2 diabetes. Diabetes Care 2002; 25 : 1340–1345.
24. Kario K, Matsuo T, Kobayashi H, Matsuo M, Sakata T, Miyata T. Activation of tissue factor-induced coagulation and endothelial cell dysfunction in non-insulin-dependent diabetic patients with microalbuminuria. Arterioscler Thromb Vasc Biol 1995; 15 : 1114–1120.
25. Gruden G, Cavallo-Perin P, Romagnoli R, Olivetti C, Frezet D, Pagano G. Prothrombin fragment 1 + 2 and antithrombin III-thrombin complex in microalbuminuric type 2 diabetic patients. Diabet Med. 1994; 11 : 485–488.
26. Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Report. Diabetes Care 2003; 26 (Suppl 1): S5–S20.
27. McLaren M, Elhadd TA, Greene SA, Belch JJ. Elevated plasma vascular endothelial cell growth factor and thrombomodulin in juvenile diabetic patients. Clin Apll Thromb Haemost 1999; 5 : 21–24.
28. Chaturvedi N, Fuller JH, Pokras F, Rottiers R, Papazoglou N, Aiello LP. EUCLID Study Group. Circulating plasma vascular endothelial growth factor and microvascular complications of type 1 diabetes mellitus: the influence of ACE inhibition. Diabet Med 2001; 18 : 288–294.
29. Sharp PS, Al-Mrayat M, Valabhji J, Kearney TM, Wright D. Serum levels of vascular endothelial growth factor in diabetic subjects: the relationship with blood pressure. Diabetologia 1998; 41 : 984–985.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Vzdělávací akce IPVZČlánek Bude syntetická lidská krev?
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2009 Číslo 3- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Detekce mutace JAK2V617F u myeloproliferativních onemocnění – přehled a vlastní zkušenosti
- Úspěšná léčba časného molekulárního relapsu variantní formy sekundární akutní promyelocytární leukemie oxidem arsenitým
- Cievny endotelový rastový faktor u osôb s diabetom 2. typu
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u ne-hodgkinských lymfomů. Část II.: Hodnocení léčebné odpovědi
- Vzdělávací akce IPVZ
- Warfarínom indukovaná kožná nekróza: kazuistika a prehľad literatúry
- Činnost nemocniční transfuzní služby v České republice v roce 2008
- XXIII. Olomoucké hematologické dny s mezinárodní účastí
- Bude syntetická lidská krev?
- Paroxysmal nocturnal hemoglobinuria: natural history of disease subcategories
- Pegylated interferon-alfa-2a induces complete hematologic and molecular responses with low toxicity in polycythemia vera
- Sirolimus is associated with veno-occlusive disease of the liver after myeloablative allogeneic stem cell transplantation
- Thalidomide and rituximab in Waldenstrom macroglobulinemia
- Aktuální informace k nomenklatuře HLA systému
- Autotransfuze v České republice v roce 2008
- MUDr. Libuše Novosadová čestnou členkou České hematologické společnosti ČLS JEP
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Detekce mutace JAK2V617F u myeloproliferativních onemocnění – přehled a vlastní zkušenosti
- Úspěšná léčba časného molekulárního relapsu variantní formy sekundární akutní promyelocytární leukemie oxidem arsenitým
- Warfarínom indukovaná kožná nekróza: kazuistika a prehľad literatúry
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u ne-hodgkinských lymfomů. Část II.: Hodnocení léčebné odpovědi
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



