-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Alogenní transplantace krvetvorných buněk po režimu s redukovanou intenzitou ve složení busulfan, fludarabin a antithymocytární globulin (ATG Fresenius): dlouhodobé výsledky
Brychtová Y., Krejčí M., Doubek M., Tomíška M., Navrátil M., Ráčil Z., Dvořáková D., Horký O., Lengerová M., Pospíšilová S., Mayer J.: Long-term results of allogeneic hematopoietic stem cell transplantation after a reduced-intensity conditioning busulfan, fludarabine, and antithymocyte globulin
Reduced-intensity conditioning (RIC) is being widely used for allogeneic stem cell transplantation (SCT). Here we present our long-term experience with RIC regimen consisting of fludarabine (6x30 mg/m2), busulfan (2x4 mg/kg) and antithymocyte globulin (ATG Fresenius, 4x10 mg/kg) (Flu-Bu-ATG) at cohort of 71 patients (pts) with various hematological malignancies, 65 pts had unrelated donor, 6 related donor. Patients were transplanted in period 1998-2008, aim of our work was to evaluate effectivity and toxicity of RIC Flu-Bu-ATG. Median age was 50 years. Overall response rate was 87%; 83% of pts achieved complete and 4% partial response. The incidence of acute and chronic GVHD was 35% and 52%. The cumulative incidence of non-relapse mortality after 1 year and 4 years were 8% and 14%, respectively. With median follow-up of 55.0 months after SCT, 2 - and 4-year event-free survival (EFS) was 49.0% and 40.3%, overall survival (OS) was 73.2% and 62.6%. Gender, age at SCT, type of donor, disease status at SCT, previous autologous transplantation, achievement of complete chimerism to day +100 did not significantly influence EFS and OS. On multivariate analysis, no presence of chronic GVHD (p = 0.029, HR:2.5), other diagnosis than CML (p = 0.018, HR:4.6) and dose of CD34+ cells lower than 5x106/kg (p = 0.010, HR:2.8) are statistically significant for shorter OS. In conclusion, the Flu-Bu-ATG protocol can be considered as a RIC regimen combining effective disease control and acceptable toxicity profil.
Key words:
reduced-intensity conditioning, fludarabine, busufan, antithymocyte globulin
Autoři: Y. Brychtová; M. Krejčí; M. Doubek; M. Tomíška; M. Navrátil; Z. Ráčil; D. Dvořáková; O. Horký; M. Lengerová; S. Pospíšilová; J. Mayer
Působiště autorů: Interní hematoonkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta Masarykova Univerzita Brno
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 1, p. 12-19.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
V současné době jsou jako přípravné režimy před alogenní transplantací krvetvorných buněk (SCT) často používány režimy s redukovanou intenzitou (RIC). Cílem naší práce bylo vyhodnotit efektivitu, toxicitu a dlouhodobé výsledky RIC režimu ve složení fludarabin (6 x 30 mg/m2), busulfan (2 x 4 mg/kg) a antithymocytární globulin (ATG Fresenius, 4 x 10 mg/kg) ve skupině 71 pacientů s různými hematologickými malignitami transplantovaných v období 1998-2008, 65 nemocných mělo příbuzného dárce, 6 nepříbuzného dárce, medián sledování od provedení SCT byl 55 měsíců. Medián věku byl 50 let. Celková léčebná odpověď byla 87 %; 83 % pacientů dosáhlo kompletní a 4 % parciální léčebné odpovědi po alogenní transplantaci. Incidence akutní a chronické reakce štěpu proti hostiteli (GVHD) byla 35 % a 52 %. Kumulativní incidence mortality z jiné příčiny než relaps nemoci v 1 roce a ve 4 letech od transplantace byla 8 % a 14 %. Přežití bez relapsu onemocnění (EFS) ve 2 a 4 letech od SCT bylo 49 % a 40 %, celkové přežití (OS) ve 2 a 4 letech od SCT bylo 73 % a 63 %. Pohlaví, věk v době transplantace, typ dárce, stav onemocnění v době transplantace, předchozí autologní transplantace a dosažení kompletního chimérismu do dne +100 neměly statisticky významný vliv na EFS a OS. V multivariantní analýze, nepřítomnost chronické GVHD (p = 0,029, HR: 2,5), jiná diagnóza než CML (p = 0,018, HR: 4,6) a dávka CD34+ < 5x106/kg (p = 0,010, HR: 2,8) byly statisticky významné faktory pro kratší OS. Režim s redukovanou intenzitou Flu-Bu-ATG lze hodnotit jako efektivní režim dosahující vysoké léčebné odpovědi s akceptovatelnou toxicitou.
Klíčová slova:
režim s redukovanou toxicitou, fludarabin, busulfan, antithymocytární globulinÚvod
Alogenní transplantace krvetvorných buněk představuje možnost vyléčení pro značné spektrum maligních a nemaligních onemocnění. Relapsy onemocnění jsou však časté, zvláště v případě pokročilých stadií nemoci v době transplantace (1). Snaha zlepšit výsledky transplantací zvýšením intenzity přípravného režimu nepřineslo efekt, sice poklesl počet relapsů, ale došlo k nárůstu toxicity, takže nedošlo ke zlepšení celkového přežití (2). Již před lety bylo prokázáno, že například radiační dávka, nezbytná ke zničení reziduálních leukemických buněk, není v klinické praxi dosažitelná (3). Na druhé straně bylo publikováno, že transplantované buňky imunitního systému jsou schopny eliminovat nádorové buňky (4, 5) a tyto studie po čase vedly k použití infuzí dárcovských lymfocytů (donor lymphocyte infusion, DLI) (6). Lepší pochopení biologie reakce štěpu proti nádoru (graft-versus-tumor, GvT) umožnilo rozvoj přípravných režimů s redukovanou toxicitou (reduced-intensity conditioning, RIC) na konci 90. let (7-9). Na rozdíl od klasických myeloablativních přípravných režimů jsou tyto režimy primárně imunosupresivní a jejich efekt podstatně závisí na imunitních buňkách štepu.
Dosud byla publikována celá řada nemyeloablativních režimů a režimů s redukovanou intenzitou (10, 11). Jsou většinou založené na nízké nebo střední dávce celotělového ozáření (total body irradiation, TBI), na podání chemoterapie nebo kombinaci obojího. Efekt různých přípravných režimů je jen zřídka srovnáván v prospektivních studiích. Zkušenosti s RIC režimy jsou často založeny na výsledcích retrospektivních analýz nebo vycházejí z dat transplantačních registrů (12-14). Dle některých prací jsou klinicky významné rozdíly mezi různými přípravnými režimy s redukovanou intenzitou (12-14). Pouze několik režimů s redukovanou intenzitou bylo opakovaně publikováno a diskutováno v medicínské literatuře tak, abychom měli dostatečné informace o jejich efektu a vedlejších účincích (15-17). Přípravný režim fludarabin, busulfan a antithymocytární globulin (ATG), původně publikovaný v roce 1998 (8), patří mezi nejčastěji používané režimy s redukovanou intenzitou (10, 13). Prací zaměřených na dlouhodobou efektivitu a toxicitu toho režimu je poměrně málo.
V tomto sdělení předkládáme detailní analýzu dat 71 pacientů léčených tímto přípravným režimem, s důrazem na údaje o akutní toxicitě, chimérismu, oportunních infekcích, GVHD, relapsech a dlouhodobých výsledcích kontroly nemoci.
Pacienti a metody
Pacienti
V letech 1998–2008 bylo léčeno71 pacientů (medián věku 50 let; rozmezí 15-65) s různými hematologickými malignitami alogenní transplantací krvetvorných buněk (stem cell transplantation, SCT) po režimu RIC fludarabin, busulfan a ATG na Interní hematoonkologické klinice Fakultní nemocnice Brno. Diagnózy pacientů byly následující: chronická myeloidní leukemie (CML, n = 24), akutní myeloidní leukemie (AML, n =19), nehodgkinský lymfom (NHL, n = 17), Hodgkinův lymfom (HL, n = 3), mnohočetný myelom (MM, n = 3), myelodysplastický syndrom (MDS, n = 3), a primární idiopatická myelofibróza (n = 2).
Téměř polovina pacientů (49 %, n = 35) měla pokročilé stadium onemocnění v době SCT. Pokročilost nemoci byla definována jako primárně refrakterní či relabující nemoc, druhá a další CR či PR hematologické malignity vyjma CML nebo druhá a další fáze u CML, případně dosud neléčené onemocnění (18). Časná fáze nemoci byla definována jako CR1/CP1 (18) a představovala v tomto souboru 51% pacientů (n = 36).
Důvody volby RIC-SCT v našem souboru pacientů (n= 71) jsou následující: věk > 50 let (n = 40, 56 %), přítomnost komorbidity (n = 9), předchozí extenzivní terapie jako například autologní SCT (n =12) a dále volba pacienta po podrobném vysvětlení a diskusi o rozdílech mezi RIC a myeloablativní SCT (n = 10). Vylučovacími kritérii pro provedení RIC-SCT byly infekce HIV, aktivní hepatitida B nebo C, těžké poškození renálních či jaterních funkcí, těžké kardiální postižení, Karnofsky index méně než 60 %. Všichni pacienti podepsali informovaný souhlas před provedením RIC-SCT.
Medián intervalu od diagnózy do SCT byl 201 dní (rozmezí 61–4520). Pacienti dostali nemanipulovaný štěp periferních kmenových buněk (peripheral blood stem cells, PBSC) (n = 68) nebo kostní dřeň (n = 3) od HLA identických příbuzných dárců (n = 65), shodných nepříbuzných dárců (n = 3) nebo nepříbuzných dárců s 1 neshodou (n = 3). Za HLA kompatibilního nepříbuzného dárce byl považován dárce s úrovní shody 10/10 či 9/10.
Nejdůležitější charakteristiky pacientů jsou shrnuty v tabulkách 1 a 2.
Tab. 1. Diagnózy, n= 71 pacientů. 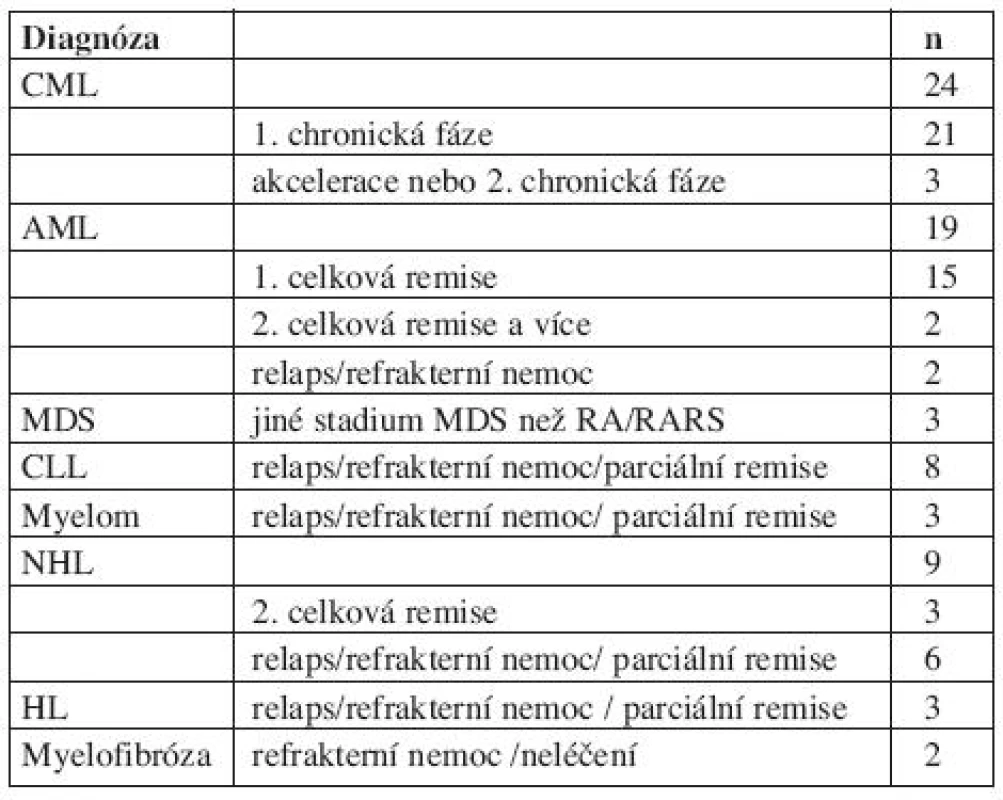
Tab. 2. Charakteristika pacientů a dárců. 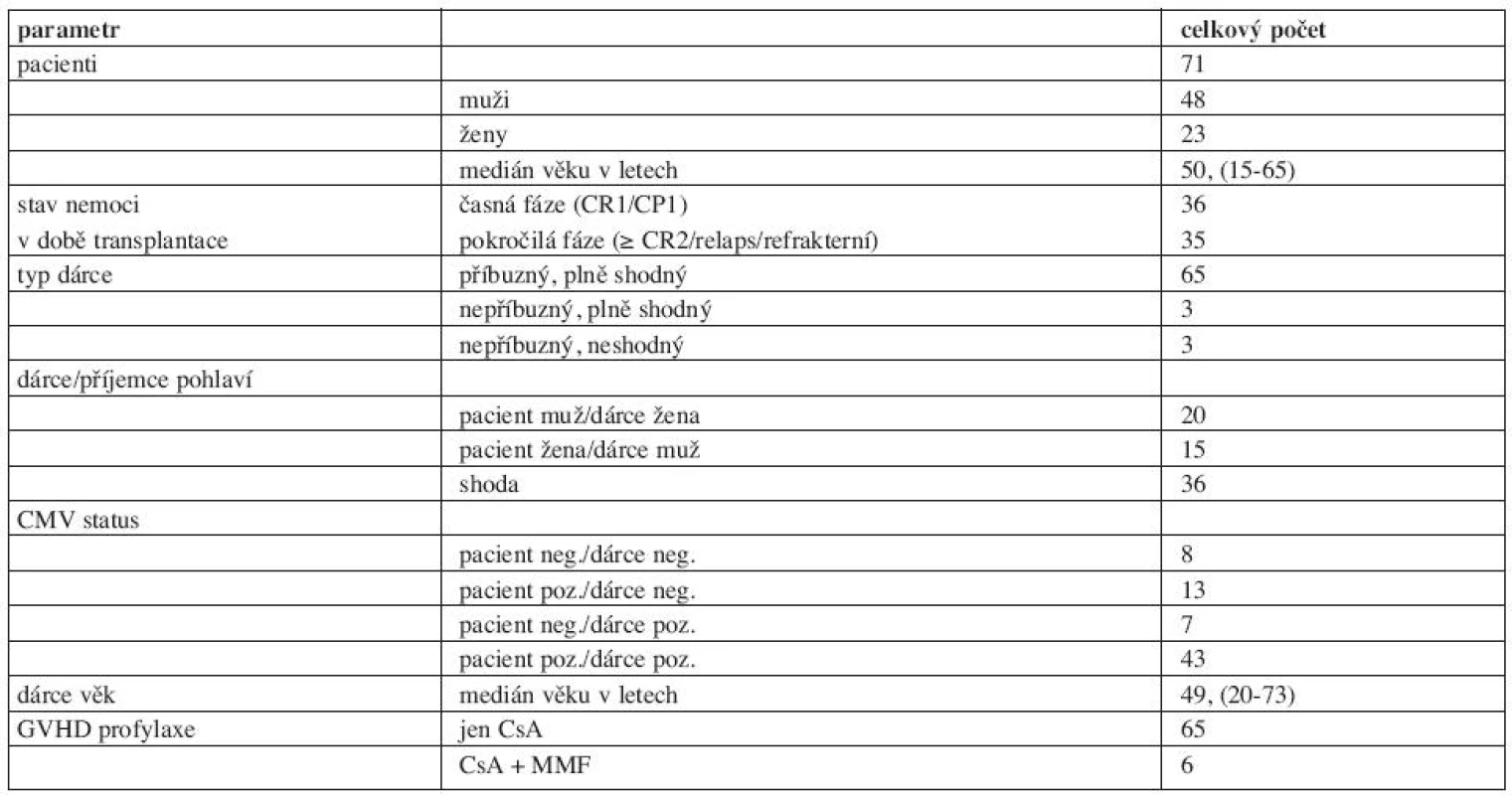
Medián počtu podaných CD34+ buněk ve štěpu byl 6,59 x 106/kg (rozmezí: 1,62–28,78 x 106/kg).
Přípravný režim, reakce štěpu proti hostiteli graft-versus-host disease, GVHD) – profylaxe a terapie
Přípravný režim se skládal z intravenózního podání fludarabinu 30 mg/m2/den, ve dnech –10 až –5, perorálního busulfanu (4 mg/kg/den) dva po sobě následující dny (den –6 a –5) a ATG Fresenius 10 mg/kg/den, 4 po sobě následující dny (–4 až –1) (Flu-Bu-ATG), jak bylo dříve publikováno (8, 19).
Pro profylaxi GVHD byl použit cyklosporin A (CsA) u pacientů s příbuznými dárci (n = 65) nebo CsA a mykofenolát mofetil u nemocných s nepříbuznými dárci (n = 6). Dávka CsA byla snižována individuálně od druhého nebo třetího měsíce po transplantaci podle dynamiky chimérismu (20), stavu nemoci a GVHD. Podpůrná léčba, antimikrobiální profylaxe a terapie byla prováděna v souladu s mezinárodními doporučeními. Pokud jde o antimikrobiální profylaxi, od startu přípravného režimu po dobu prvních 6 měsíců od SCT byl podáván trimethoprim 80 mg / sulfamethoxazol 400 mg 1x denně a aciclovir 4x800 mg denně, dále do známek přihojení štěpu byl podáván fluconazol 2 x 200mg denně.
Akutní GVHD (aGVHD) byla hodnocena dle kritérií Przepiorky (21), chronická GVHD (cGVHD) byla definována jako GVHD po dni +100 a více po SCT a hodnocena jako žádná, limitovaná nebo extenzivní (22).
Akutní GVHD byla nejprve léčena steroidy (2 mg/ /kg/den), a v případě nedostatečné odpovědi byl podáván pulzní cyklofosfamid, dále ATG, mykofenolát mofetil nebo jiná imunosupresivní terapie druhé linie. Chronická GVHD byla léčena cyklosporinem A Ī steroidy Ī mykofenolátem mofetilem (23). Analýza chimérismu a jeho kvantifikace byla prováděna z periferní krve před transplantací a pravidelně po SCT.
Statistická analýza
Data byla analyzována k 31. 12. 2009. Statistické výpočty byly provedeny programem STATISTICA®verze 8.1 a SAS verze 8. Celkové přežití (overall survival, OS) bylo počítáno od data transplantace do úmrtí z jakéhokoliv důvodu. Přežití bez události (event-free survival, EFS) je definováno jako doba od transplantace do relapsu nebo úmrtí z jakékoliv příčiny. Úmrtí pacientů bez známek relapsu nebo progrese nemoci je považováno za úmrtí bez souvislosti s relapsem (non-relapse mortality, NRM). Vztah mezi množstvím transplantovaných CD34+ buněk a přihojením neutrofilů a trombocytů bylo kvantifikováno dle Pearsonova a Spearmanova korelačního koeficientu.
Pro předpokládanou pravděpodobnost EFS a OS byla použita Kaplan-Meierova metoda, s porovnáním rozdílů pomocí log-rank testu. Všechny statistické analýzy byly dvoustranné s hladinou významnosti 5 %. Multivariantní analýza byla provedena pro parametry, které vyšly signifikantní z univariantní analýzy (Coxova regrese).
Výsledky
Toxicita přípravného režimu
Přípravný režim byl dobře tolerovaný. Stupeň 4 nehematologické toxicity dle kritérií Světové zdravotnické organizace (World Health Organization, WHO) byl zaznamenán pouze v 1 případě (plicní toxicita). Stupeň 3 nehematologické toxicity byl sledován v 6 případech (mukositida = 1, kardiální toxicita = 1, gastrointestinalní a jaterní toxicita = 2, plicní toxicita = 2). Nejčastější nehematologickou toxicitou stupně 1+2 byla mukositida (n = 43), gastrointestinální toxicita (n = 20), jaterní toxicita (n = 22), a renální toxicita (n = 15).
Mortalita do dne +100 po SCT byla 10 % (7/71 pacientů). Důvody úmrtí byly septikemie (n = 1), krvácení (n = 1), GvHD (n = 1), progrese hematologické malignity (n = 4).
Přihojení štěpu a chimérismus
Medián přihojení trombocytů (> 20 x 109/l) byl 13 dní (rozmezí: 8-27 dní), přihojení neutrofilů (> 0,5 x 109/l) bylo dosaženo v mediánu 16 dní (rozmezí: 9+28 dní). Přihojení štěpu dosáhlo 69 pacientů (97 %), 2 pacienti zemřeli na krvácení do plic a fulminantní progresi nemoci den +2 a +15 ještě před přihojením štěpu. Sekundární selhání štěpu bylo u 3 pacientů a všichni tito pacienti dostali autologní štěp PBSC k obnově hematopoezy s dobrým efektem. Byla statisticky významná korelace mezi množstvím podaných CD34+ buněk a parametry přihojení (dny do dosažení absolutního počtu neutrofilů > 0,5 x 109/l, p = 0,003; dny do hodnoty trombocytů > 50 x 109/l, p < 0,001).
Dárcovský chimérismus byl vyšetřován u části souboru fragmentační analýzou a od roku 2005 také pomocí polymerázové řetězové reakce v reálném čase (RQ-PCR).
Kompletního chimérismu dosáhlo ve dnech +30, +60, +100 po SCT 19 (27 %), 23 (32 %) a 31 (44 %) pacientů. Kompletního dárcovského chimérismu dosáhlo 57 (80 %) pacientů v mediánu 118 dní po SCT.
Léčebná odpověď a přežití
Ve skupině 69 pacientů s přihojeným štěpem po RIC-SCT dosáhlo kompletní remise 57 pacientů (83 %), další 3 pacienti měli parciální remisi, celková léčebná odpověď byla 87 % (60/69).
Stabilní onemocnění měli 2 pacienti (3 %) a progrese byla u 7 pacientů (10 %). Kumulativní incidence NRM po 100 dnech, 1 roce, 2 letech a 4 letech byla 4 %, 8 %, 10 % a 14 %.
Při mediánu sledování 55,0 měsíců po SCT, 40 (56 %) pacientů žije v celkové remisi nemoci a další 4 (6 %) pacienti žijí v progresi/relapsu nemoci. Celkem 17 (24 %) pacientů zemřelo na progresi nemoci a 10 (14 %) zemřelo na NRM. Příčiny úmrtí po SCT jsou shrnuty v tabulce 3.
Celkem 32 (46 %) pacientů mělo progresi nebo relaps nemoci po SCT (AML = 13, CML = 9, další diagnózy = 10). Další remise dosáhlo po léčbě relapsu/progrese po SCT 12 pacientů (AML = 2, CML = 8, další diagnózy = 2). Při léčbě relapsu/progrese onemocnění po SCT byly u pacientů s CML podávány DLI a/nebo tyrosinkinázové inhibitory, u ostatních pacientů DLI a/nebo chemoterapie.
Medián EFS od transplantace byl 23,0 měsíců a medián OS od transplantace dosud nebyl dosažen při mediánu sledování 55,0 měsíců (graf 1). Jednoleté, 2leté a 4leté celkové přežití v celé skupině 71 pacientů bylo 74,7 %, 73,2 % a 62,6 %, EFS ve stejných časových obdobích bylo 63,4 %, 49,0 % a 40,3 %.
Graf 1. EFS a OS v souboru 71 pacientů transplantovaných po přípravném režimu Flu-Bu-ATG. 
Faktory ovlivňující EFS a OS po SCT: univariantní a multivariantní analýza
Výsledky univariantní analýzy jsou shrnuty v tabulce 4. Pohlaví, věk v době SCT, typ dárce, stav nemoci v době SCT, předchozí autologní SCT, dosažení kompletního chimérismu do dne +100 neměly statisticky významný vliv na EFS nebo OS v naší skupině pacientů.
Tab. 4. Ovlivnění EFS a OS: univariantní analýza. 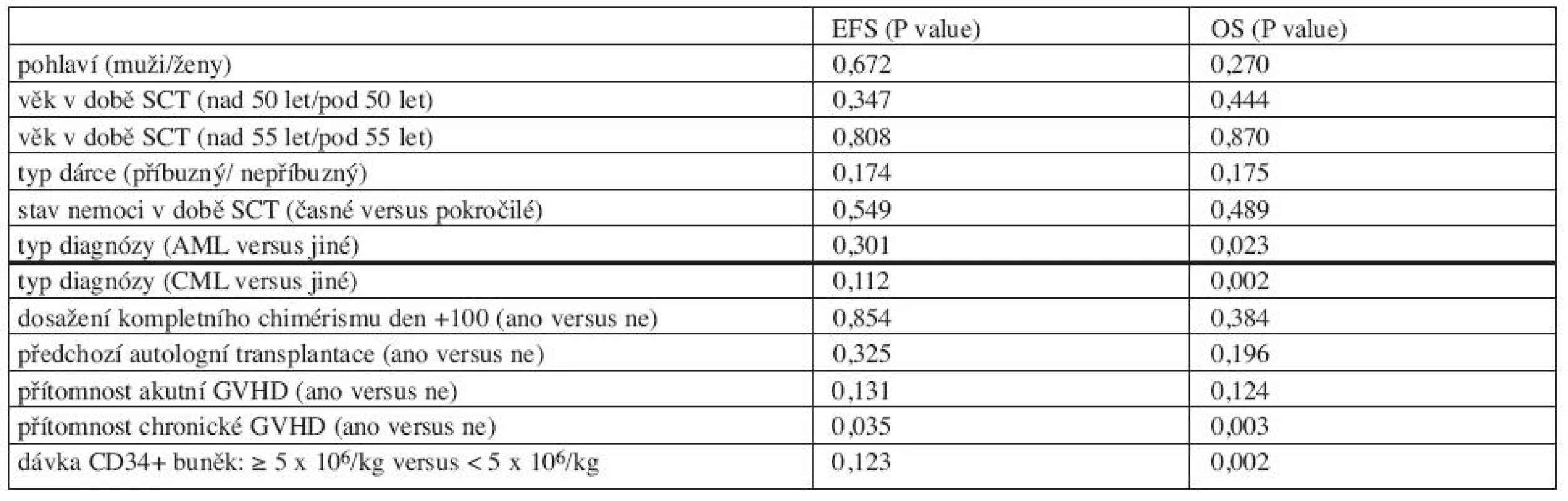
Srovnávali jsme EFS a OS po SCT pro AML pacienty a jiné diagnózy. Pacienti s AML měli signifikantně kratší OS než ostatní (medián OS 46,0 měsíců versus medián nebyl dosud dosažen, p = 0,023), nebyl zaznamenán statisticky významný rozdíl v EFS (medián EFS 21,4 měsíců versus 27,7 měsíců, p = 0,301). EFS a OS pro AML pacienty jsou znázorněny na grafu 2.
Graf 2. EFS a OS u 19 AML pacientů. 
Pacienti CML mají signifikantně delší OS než ostatní diagnózy (mediánu nebylo dosaženo versus medián 49,0 měsíců, p = 0,002). Medián EFS u CML pacientů byl 45,4 měsíců a medián EFS pro ostatní pacienty byl 20,9 měsíců. Byl trend delšího EFS u CML pacientů, ale rozdíl nebyl statisticky významný (p = 0,112). EFS a OS pro CML pacienty jsou uvedeny na grafu 3.
Graf 3. EFS a OS u 24 CML pacientů. 
Nebyl prokázán statisticky významný rozdíl EFS a OS mezi skupinou s aGVHD a skupinou bez aGVHD (p = 0,131; p = 0,124).
Přítomnost chronické GVHD prodlužovala statisticky signifikantně EFS a OS. Mediánu EFS pro pacienty s cGVHD nebylo dosud dosaženo, medián EFS pro pacienty bez cGVHD byl 23,2 měsíců (p = 0,035). Podobně medián OS pro pacienty s cGVHD nebyl dosud dosažen, medián OS pro pacienty bez cGVHD byl 49,3 měsíců (p = 0,003, graf 4).
Graf 4. Vliv chronické GvHD na celkové přežití po SCT. 
Dosažení kompletního chimérismu ve dnech +30, +60 a +100 nemělo statisticky významný vliv na EFS a OS.
Pacienti s aplikovaným množstvím CD34+ buněk 5 x 106/kg měli statisticky významně delší OS než pacienti s podanou dávkou CD34+ buněk < 5 x 106/kg (medián nebyl dosud dosažen oproti 33,3 měsícům, p = 0,002). Rozdíl mez oběma skupinami v EFS nebyl statisticky významný (p = 0,123).
Výsledky multivariantní analýzy jsou uvedeny v tabulce 5. Faktory spojené se statisticky významně kratším celkovým přežitím podle multivariantní analýzy byly: nepřítomnost chronické GVHD, diagnóza jiná než CML, dávka CD34 (+) buněk < 5 x 106/kg. Multivariantní analýza neidentifikovala žádný statisticky významný faktor ovlivňující EFS.
Tab. 5. Negativní prognostické faktory pro celkové přežití: multivariantní analýza. 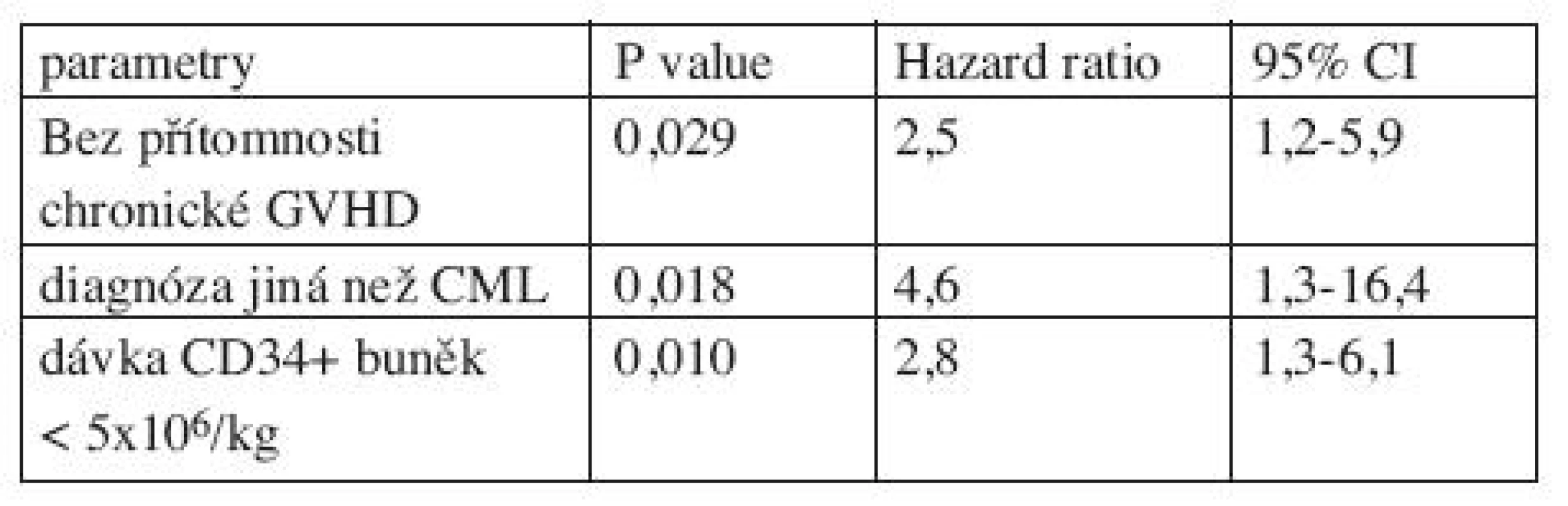
GVHD a infekce
Výskyt a klinické příznaky aGVHD byly hodnoceny u 69 pacientů. Incidence aGVHD byla 35 % (24 pacientů); stupeň I+II, a III+IV ve 20 (29 %) a 4 (6 %).
Chronická GVHD se projevila u 33 (52 %) z 64 pacientů, kteří žili po dni 100; limitovaná cGVHD v 25 případech (39 %) a extenzivní cGVHDv 8 případech (13 %).
Extenzivní chronická GVHD může ovlivnit kvalitu života, zvláště u pacientů s dlouhodobým přežitím po SCT. Z 8 pacientů s extenzivní cGVHD tři zemřeli (2 na GVHD, 1 na progresi hematologické malignity), 5 pacientů žije, tři v kompletní remisi a dva v parciální remisi s Karnofsky indexem nad 80.
Celkem 3 pacienti se steroid-refrakterní GVHD bylo rezistentní na terapii a zemřeli na GVHD. Ve všech ostatních případech byla léčba GVHD úspěšná.
Infekční komplikace mělo 50 pacientů (70 %) do dne +100, někteří z nich opakovaně. Febrilní neutropenii mělo 32 (45 %) pacientů s mediánem trvání 2 dny (rozmezí 1-15), ve všech případech po antimikrobiální terapii došlo k ústupu symptomů.
K reaktivaci CMV došlo u 17 (24 %) pacientů, všichni byli úspěšně léčeni ganciclovirem. Dalšími infekčními komplikacemi byla sepse (n = 10), bronchopneumonie (n = 7), makroskopická hematurie s pozitivitou na BK virus v moči (n = 2, rozvoj během imunosupresivní terapie GVHD). Do dne +100, pouze jeden pacient zemřel na sepsi s multiorgánovým selháním, ostatní infekční komplikace regredovaly při antimikrobiální terapii.
Po dni +100 po SCT, nemělo žádnou infekci 29 pacientů (45 %) z 64 hodnotitelných pacientů. Po dni + 100 mělo různé infekční komplikace 35 pacientů (55 %), někteří opakovaně. Konkrétně se jednalo o tyto infekce: pneumonie (n = 7), CNS toxoplazmóza (n = 1), infekce herpes zoster (n = 8), bronchitida (n = 15), meningitida (n = 1), sepse (n = 8). Čtyři pacienti zemřeli na sepsi s multiorgánovým selháním po dni +100 po SCT (ve 2 případech současně s relapsem maligního onemocnění a ve dvou případech současně s GvHD); ostatní infekce byly zvládnuty antimikrobiální terapií.
Diskuse
V naší práci popisujeme dlouhodobé výsledky souboru 71 pacientů s různými hematologickými malignitami, kteří podstoupili SCT po přípravném režimu Flu-Bu-ATG se snahou zhodnotit především efektivitu a toxicitu tohoto RIC režimu. Jak bylo publikováno v zahraniční literatuře, provedení alogenní SCT po režimu Flu-Bu-ATG dosahuje povzbudivých výsledků s akceptovatelnou toxicitou a přijatelnou NRM (8, 19), především ve skupině pacientů s CML (19).
V souladu s již dříve publikovanými pracemi jsme potvrdili tato fakta, celková léčebná odpověď dosáhla 87 %, toxicita režimu Flu-Bu-ATG byla ve skupině našich pacientů nízká, NRM ke dni +100 byla jen 4 %, nehematologická toxicita stupeň 3+4 byla pouze u 7 případů (10 %), a bylo zaznamenáno pouze jedno úmrtí z důvodu akutní orgánové toxicity. Dle našich výsledků dosahuje tento přípravný režim dosahuje vysoký počet kompletních remisí s přijatelnou toxicitou u starších pacientů, výrazně předléčených pacientů a pacientů s komorbiditami. Přípravný režim Flu-Bu-ATG se zdá být efektivní i v případě pokročilého onemocnění. V naší skupině jsme nezjistili signifikantní rozdíl v EFS a OS mezi skupinami s časným či pokročilým stadiem nemoci, přestože pokročilé onemocnění je považováno za negativní prognostický faktor dle některých prací (13). Léčebné možnosti u pacientů s pokročilým onemocněním jsou limitované a SCT může zlepšit jejich prognózu (18).
Infekční komplikace po RIC-SCT jsou častým a závažným problémem (24, 25). Někteří autoři publikovali, že RIC redukují riziko závažných infekcí po SCT (26, 27). V naší skupině pacientů byla incidence infekcí 70 % do dne +100 (50/71 pacientů) a 55 % po dni +100 (35/64), nastalo celkem 5 úmrtí na závažné infekční komplikace (7 %, 5/71). Podle našich výsledků jsou infekce poměrně častou komplikací po RIC-SCT, ale mortalita v souvislosti s infekcí je relativně nízká.
Vliv parametrů štěpu krvetvorných buněk na výsledek RIC-SCT zůstává nadále kontroverzní. Někteří autoři uvádějí signifikantní vliv množství CD34+ buněk na přežití (28), jiné práce tuto hypotézu nepotvrzují (29). V naší skupině pacientů byla dávka CD34+ buněk nad 5x106/kg byla spojená se signifikantně delším celkovým přežitím. Tato problematika vyžaduje další výzkum.
Přípravný režim Flu-Bu-ATG je sice celosvětově široce používán (30–32), ovšem dávka a typ ATG je variabilní (30), medián sledování po SCT je ve většině studií relativně krátký s rozmezím 21–37 měsíců) (30, 31) a často jsou různé typy RIC režimů analyzovány společně (13, 30, 31).
Typ ATG a jeho dávka může mít signifikantní vliv na konečný výsledek alogenní transplantace (33). V naší skupině pacientů jsme podávali ATG Fresenius v dávce 10 mg/kg/den, jak bylo publikováno dříve (8, 19). Ve studii 465 pacientů léčených RIC Flu+Bu s králičím ATG (Thymoglobuline), dávka ATG nad 10 mg/kg byla spojena s nižším EFS a OS (30). Byla publikována práce o snížení NRM a nižším výskytu infekcí v případě použití nižších dávek ATG u pacientů podstupujících RIC-SCT (32). Nicméně podle práce německých autorů (34), přidání ATG jako profylaxe GVHD vede k poklesu incidence akutní a chronické GVHD bez nárůstu počtu relapsů, NRM a celkové mortality.
Dosažení kompletního chimérismu (80 % pacientů) v naší skupině pacientů bylo vysoké a incidence selhání štěpu byla relativně nízká (3/71,4 %). Hodnocení chimérismu po SCT může pomoci v identifikaci pacientů s rizikem rejekce štěpu, GVHD a relapsu/progrese (35). Dle jiných autorů nebyla prokázána spojitost mezi chimérismem, GVHD a progresí nemoci po SCT (36). V naší skupině pacientů nebyla prokázána korelace mezi dosažením kompletního chimérismu, EFS a OS.
Vznik a rozvoj GVHD zůstává závažným problémem po alogenní SCT. GVHD je jedna z nejčastějších příčin morbidity a mortality v souvislosti s SCT (10, 19). Incidence aGVHD a cGVHD v naší skupině pacientů byla podobná jako v jiných publikovaných pracích (13, 19). Většina našich pacientů měla lehčí formy GVHD. Přítomnost chronické GVHD byla popsána jako hlavní faktor spojený s nízkou incidencí relapsu a vede ke zlepšení EFS a OS (37). V naší skupině pacientů byly potvrzeny tyto výsledky, pacienti s cGVHD měli statisticky signifikantně delší EFS a OS ve srovnání s pacienty bez cGVHD.
V naší skupině pacientů stejně jako ve většině dalších publikovaných prací o RIC SCT (37, 38) byl hlavní příčinou neúspěšnosti terapie relaps/progrese nemoci, celkem 46 % pacientů mělo relaps nebo progresi po SCT, především šlo o pacienty s AML (13 z 19). Reprezentativní klinické studie používající fludarabin a busulfan u stejné skupiny pacientů s myeloidní malignitou publikovaly 2leté EFS v rozmezí 43-49 % a 2leté OS 47-49 % (38). Především u starších pacientů s AML, je léčba obtížná a při konvenční chemoterapii je 3leté celkové přežití 18 % pro AML se standardním rizikem (38). Provedení SCT u AML pacientů může zlepšit výsledky jejich terapie a prodloužit celkové přežití (18. 38, 39).
Velkou skupinou v naší kohortě byli pacienti s CML (24/71, 34 %). Stejný přípravný režim byl použit u 24 CML pacientů s výbornými výsledky (19). Jediným rozdílem oproti našemu protokolu bylo použití nižší dávky ATG u části pacientů. V naší skupině CML pacientů byl medián EFS 45,4 měsíců a medián OS dosud nebyl dosažen. Devět našich CML pacientů z 24 (37 %) mělo po RIC-SCT relaps, ale 8 z nich dosáhlo další molekulární remise po DLI anebo po imatinibu.
Závěrem lze řící, že RIC Flu-Bu-ATG je efektivní režim, který dosahuje vysoké léčebné odpovědi s nízkou NRM a akceptovatelným profilem toxicity. Tento přípravný režim je vhodný i pro starší pacienty, předléčené pacienty a pacienty s komorbiditami. Hlavním problémem jsou relapsy nemoci po SCT, především u AML pacientů. V naší skupině pacientů prodloužení celkového přežití statisticky signifikantně koreluje s diagnózou CML, dávkou CD34+ buněk nad 5 x 106/kg a výskytem chronické GVHD.
Poděkování
Tato práce je podporována Českou leukemickou skupinou pro život (The CzEch Leukemia Study Group for Life, CELL) a výzkumným grantem IGA MZ CR NS 9683 - 4/2008.
MUDr. Yvona Brychtová
Interní hematoonkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: ybrychto@fnbrno.czDoručeno do redakce: 7. 1. 2011
Přijato po recenzi: 21. 1. 2011
Zdroje
1. Copelan EA. Hematopoietic stem-cell transplantation. N Engl J Med 2006; 354 : 1813-1826.
2. Clift RA, Buckner CD, Appelbaum FR, Bearman SI, Petersen FB, Fischer LD. Allogeneic marrow transplantation in patients with acute myeloid leukemia in first remission: a randomized trial of two irradiation regimens. Blood 1990; 76 : 1876-1871.
3. Burchenal JH, Oettgen HF, Holmberg EA, Hemphill SC, Reppert JA. Effect of total body irradiation on the transplantability of mouse leukemias. Cancer Res 1960; 20 : 425-430.
4. Barnes DW, Corp MJ, Loutit JF, Neal FE. Treatment of murine leukaemia with X rays and homologous bone marrow. Brit Med J 1956; 15 : 626-627.
5. Weiden PL, Flournoy N, Thomas ED, Prentice R, Fefer A, Buckner CD. Antileukemic effect of graft-versus-host disease in human recipients of allogeneic marrow grafts. N Engl J Med 1979; 30 : 1068-1073.
6. Kolb HJ, Mittermüller J, Clemm C, Holler E, Ledderose G, Brehm G. Donor leukocyte transfusions for treatment of recurrent chronic myelogenous leukemia in marrow transplant patients. Blood 1990; 76 : 2462-2465.
7. Giralt S, Estey E, Albitar M, van Besien K, Rondon G, Anderlini P. Engraftment of allogeneic hematopoietic progenitor cells with purine analog-containing chemotherapy: harnessing graft-versus-leukemia without myeloablative therapy. Blood 1997; 89 : 4531-4536.
8. Slavin S, Nagler A, Naparstek E, Kapelushnik Y, Aker M, Cividalli G. Nonmyeloablative stem cell transplantation and cell therapy as an alternative to conventional bone marrow transplantation with lethal cytoreduction for the treatment of malignant and nonmalignant diseases. Blood 1998; 91 : 756-763.
9. McSweeney P, Niederwieser D, Shizuru JA, Sandmaier BM, Molina AJ, Maloney DG. Hematopoietic cell transplantation in older patients with hematologic malignancies: replacing high-dose cytotoxic therapy with graft-versus-tumor effect. Blood 2001; 97 : 3390-3400.
10. Banna GL, Aversa S, Sileni VC, Favaretto A, Ghiotto C, Monfardini S. Nonmyeloablative allogeneic stem cell transplantation (NST) after truly nonmyeloablative and reduced intensity conditioning regimens. Crit Rev Oncol Hematol 2004; 51 : 171-189.
11. Barret A, Savani BN. Stem cell transplantation with reduced-intensity conditioning regimens: a review of ten years experience with new transplant concepts and new therapeutic agents. Leukemia 2006; 20 : 1661-1672.
12. Crawley C, Lalancette M, Szydlo R, Gilleece M, Peggs K, Mackinnon S. Outcome for reduced-intensity allogeneic transplantation for multiple myeloma: an analysis of prognostic factors from the Chronic Leukemia Working Party of the EBMT. Blood 2005; 105 : 4532-4539.
13. Crawley C, Szydlo R, Lalancette M, Bacigalupo A, Lange A, Brune A. Outcomes of reduced intensity transplantation for chronic myeloid leukemia: an analysis of prognostic factors from the Chronic Leukemia Working Party of the EBMT. Blood 2005; 106 : 2969-2976.
14. Shimoni A, Hardan I, Shem-Tov N, Rand A, Herscovici C, Yerushalmi R. Comparison between two fludarabine-based reduced-intensity conditioning regimens before allogeneic hematopoietic stem-cell transplantation: fludarabine/melphalan is associated with higher incidence of acute graft-versus-host disease and non-relapse mortality and lower incidence of relapse than fludarabine/busulfan. Leukemia 2007; 21 : 2109-2116.
15. Sorror ML, Sandmaier BM, Storer BE, Maris MB, Baron F, Maloney DG. Comorbidity and disease status-based risk stratification of outcomes among patients with acute myeloid leukemia or myelodysplasia receiving allogeneic hematopoietic cell transplantation. J Clin Oncol 2007; 25 : 4246-4254.
16. Schmidt C, Schleuning M, Schwerdtfeger R, Hertenstein B, Mischak-Weissinger E, Bunjes D. Long-term survival in refractory acute myeloid leukemia after sequential treatment with chemotherapy and reduced-intensity conditioning for allogeneic stem cell transplantation. Blood 2006; 108 : 1092-1099.
17. Tauro S, Craddock C, Peggs K, Begum G, Mahendra P, Cook G. Allogeneic stem cell transplantation using a reduced-intensity conditioning regimen has the capacity to produce durable remissions and long-term disease-free survival in patients with high-risk acute myeloid leukemia and myelodysplasia. J Clin Oncol 2005; 23 : 9383-9393.
18. Marks R, Potthoff K, Hahn J, Ihorst G, Bertz H, Spyridonidis A. Reduced-toxicity conditioning with fludarabine, BCNU, and melphalan in allogeneic hematopoietic cell transplantation: particular activity against advanced hematologic malignancies. Blood 2008; 112 : 415-425.
19. Or R, Shapira MY, Resnick I, Amar A, Ackerstein A, Samuel S. Nonmyeloablative allogeneic stem cell transplantation for the treatment of chronic myeloid leukemia in first chronic phase. Blood 2003; 101 : 441-445.
20. Lion T. Summary: reports on quantitative analysis of chimerim after allogeneic stem cell transplantation by PCR amplification of microsatellite markers and capillary electrophoresis with fluorescence detection. Leukemia 2003; 17 : 232-254.
21. Przepiorka D, Weisdorf D, Martin P, Klingemann HG, Beatty P, Hows J. Consensus Conference on Acute GVHD Grading. Bone Marrow Transplant 1995; 15 : 825-828.
22. Shulman HM, Sullivan KM, Weiden PL, Macdonald GB, Strike GE, Sale GE. Chronic graft-versus-host syndrome in man. A long-term clinicopatologic study of 20 Seattle patients. Am J Med 1980; 60 : 204-217.
23. Krejci M, Doubek M, Buchler T, Brychtova Y, Vorlicek J, Mayer J. Mycophenolate mofetil for the treatment of acute and chronic steroid-refractory graft-versus-host disease. Ann Hematol 2005; 84 : 681-685.
24. Junghanss C, Marr KA, Carter RA, Sandmaier BM, Maris MB, Maloeny DG. Incidence and outcome of bacterial and fungal infections following nonmyeloablative compared with myeloablative allogeneic hematopoeitic stem cell transplantation: a matched control study. Biol Blood Marrow Transplant 2002; 8 : 512-520.
25. Mohty M, Jacot W, Faucher C, Bay JO, Zandotti C, Collet L. Infectious complications following allogeneic HLA-identical sibling transplantation with antithymocyte globulin-based reduced intensity preparative regimen. Leukemia 2003; 17 : 2168-2177.
26. Martino R, Caballero MD, Canals C, San Miguel J, Sierra J, Rovira M. Reduced-intensity conditioning reduces the risk of severe infections after allogeneic peripheral blood stem cell transplantation. Bone Marrow Transplant 2001; 28 : 341-347.
27. Frere P, Baron F, Bonnet C, Hafraoui K, Pereira M, Willems E. Infections after allogeneic hematopoietic stem cell transplantation with a nonmyeloablative conditioning regimen. Bone Marrow Transplant 2006; 37 : 411-418.
28. Holtan SG, Hogan WJ, Elliott MA, Ansell SM, Inwards DJ, Porrata LF. CD34(+) cell dose and establishment of full donor chimerism at day +100 are important factors for survival with reduced-intensity conditioning with fludarabine and melphalan before allogeneic hematopoietic SCT for hematologic malignancies. Bone Marrow Transplant 2010; 45 : 1699-1703.
29. Tsirigotis P, Shapira MY, Or R, Bitan M, Samuel S, Gesundheit B. The number of infused CD34+ cells does not influence the incidence of GVHD or outcome of allogeneic PBSC transplantation, usinug reduced-intensity conditioning and athithymocyte globulin. Bone Marrow Transplant 2010; 45 : 1189-1196.
30. Michallet M, Le QH, Mohty M, Prebet T, Nicolini F, Boiron JM. Predictive factors for outcomes after reduced intensity conditioning hematopoietic stem cell transplantation for hematological malignancies: a 10-year retrospective analysis from the Societe Francaise de Greffe de Moelle et de Therapie Cellulaire. Exp Hematol 2008; 36 : 535-544.
31. Vigouroux S, Michallet M, Porcher R, Attal M, Ades L, Bernard M. Long-term outcomes after reduced-intensity conditioning allogeneic stem cell transplantation for low-grade lymphoma: a survey by the French Society of Bone Marrow Graft Transplantation and Cellular Therapy (SFGM-TC). Haematologica 2007; 92 : 627-634.
32. Hamadani M, Blum W, Philips G, Elder P, Andritsos L, Hofmeister C. Improved nonrelapse mortality and infection rate with lower dose of antithymocyte globulin in patients undergoing reduced-intensity conditioning allogeneic transplantation for hematologic malignancies. Biol Blood Marrow Transplant 2009; 15 : 1422-1430.
33. Bacigalupo A. Antilymhocyte/thymocyte globulin for graft versus host disease prophylaxis: efficacy and side effects. Bone Marrow Transplant 2005; 35 : 225-231.
34. Finke J, Bethge WA, Schmoor C, Ottinger HD, Stelljes M, Zabder AR. Standard graft-versus-host disease prophylaxis with or without anti-T-cell globulin in haematopoietic cell transplantation from matched unrelated donors: a randomized, open-label, multicentre phase 3 trial. Lancet Oncol 2009; 10 : 855-864.
35. Baron F, Sandmaier BM. Chimerism and outcomes after allogeneic hematopoietic cell transplantation following nonmyeloablative conditioning. Leukemia 2006; 20 : 1690-1700.
36. Valcarcel D, Martino R, Caballero D, Mateos MV, Perez-Simon JA, Canals C. Chimerism analysis following allogeneic peripheral blood stem cell transplantation with rediced-intensity conditioning. Bone Marrow Transplant 2003; 31 : 387-392.
37. Valcarcel D, Martino R, Caballero D, Martin J, Ferra C, Nieto JB. Sustained remissions of high-risk acute myeloid leukemia and myelodysplatic syndrome after reduced-intensity conditioning allogeneic hematopoetic transplantation: chronic graft-versus-host disease is the strongest factor improving survival. J Clin Oncol 2008; 26 : 577-584.
38. Shimoni A Hardan I, Shem-Tov N, Yeshurun M, Yerushalmi R, Avigdor A. Allogeneic hematopoietic stem-cell transplantation in AML and MDS using myeloablative versus reduced-intensity conditioning: the role of dose intensity. Leukemia 2006; 20 : 322-323.
39. Aoudjhane M, Labopin M, Gorin NC. Comparative outcome of reduced intensity and myeloablative conditioning regimen in HLA identical sibling allogeneic haematopoietic stem cell transplantation for patients older than 50 years of age with acute myeloblastic leukaemia: a retrospective survey from the Acute Leukemia Working Party (ALWP) of the European group for Blood and Marrow Transplantation (EBMT). Leukemia 2005; 19 : 2304-2312.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2011 Číslo 1- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Alogenní transplantace krvetvorných buněk po režimu s redukovanou intenzitou ve složení busulfan, fludarabin a antithymocytární globulin (ATG Fresenius): dlouhodobé výsledky
- A novel prognostic model in elderly patiens with acute myeloid leukemia: results of 909 patients entered into the prospective AML 96 trial
- Vyšetření pozitronovou emisní tomografií u nemocných s Hodgkinovým lymfomem
- Rebalanced hemostasis in patiens with liver disease: evidence and clinical consequences
- Je nutné vyšetření koagulace před adenoidektomií a tonzilektomií?
- Náhlá progrese mnohočetného myelomu charakterizovaná parciálním „light-chain escape“ fenoménem a sekundární translokací t(8;14)
- A review on allogeneic stem cell transplantation for newly diagnosed pediatric acute myeloid leukemia
- Comparable survival after HLA-well-matched unrelated or matched sibling donor transplantation for acute myeloid leukemia in first remission with unfavorable cytogenetics at diagnosis
- Zprávy odborných společností
- Molekulárně genetická vyšetření u trombofilních stavů spojených se žilním tromboembolismem a jeho komplikacemi – konsensus České společnosti pro trombózu a hemostázu ČLS JEP, Společnosti pro lékařskou genetiku ČLS JEP, České hematologické společnosti ČLS
- Doporučení České společnosti pro trombózu a hemostázu ČLS JEP Opatření ke snížení rizika žilního tromboembolismu u hospitalizovaných nemocných
- VYHODNOCENÍ RIZIKOVÝCH FAKTORŮ HLUBOKÉ ŽILNÍ TROMBÓZY (HŽT) U CHIRURGICKÝCH PACIENTŮ
- Základní imunohematologická laboratorní vyšetření červené řady – Obecné zásady a technické postupy
- Úvodník
- Předtransfuzní laboratorní vyšetření
- Současné možnosti využítí monoklonálních protilátek v protinádorové léčbě
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Současné možnosti využítí monoklonálních protilátek v protinádorové léčbě
- Je nutné vyšetření koagulace před adenoidektomií a tonzilektomií?
- Předtransfuzní laboratorní vyšetření
- Doporučení České společnosti pro trombózu a hemostázu ČLS JEP Opatření ke snížení rizika žilního tromboembolismu u hospitalizovaných nemocných
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy