-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
Pharmacokinetics as a tool for optimising the treatment of patients with haemophilia
Prophylaxis is the gold standard of care for persons with severe haemophilia. Prophylactic as well as „on-demand“ treatment is often guided only by the patient’s body weight. There is, however, significant inter-individual variability in factor concentrate clearance as well as in response to treatment between different persons with haemophilia (PWH) and thus the same treatment may lead to significantly different clinical outcomes. With the help of pharmacokinetics, such treatment can be optimized for every individual. PK also has the potential to increase the cost-effectivity of haemophilia treatment. The authors summarized their own experience as well as the literature available on PK-guided treatment in haemophilia and stress the benefits of PK guided therapy for patients, health-care providers and health-care payers.
Key words:
haemophilia, factor concentrate, pharmacokinetics
Autori: J. Blatný 1; O. Zapletal 1; S. Köhlerová 1; V. Fiamoli 1; M. Jelínková 1; P. Ovesná 2
Pôsobisko autorov: Oddělení dětské hematologie, FN Brno, LF MU Brno 1; Institut biostatistiky a analýz, LF MU, Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. 4, p. 103-106.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
Profylaxe je zlatým standardem léčby těžké formy hemofilie. Profylaktická, stejně jako „on-demand“ léčba je po výtce vedena a dávkována pouze na základě hmotnosti pacienta. Existuje však významná interindividuální variabilita mezi jednotlivými osobami s hemofilií a identická léčba tak může vést k významně odlišným výsledkům. S pomocí farmakokinetiky lze léčbu optimalizovat pro každého jednotlivce a zvýšit tak nejen její efektivitu, ale dosáhnout i optimalizace vynakládaných finančních prostředků. Autoři shrnují vlastní i literární zkušenosti s léčbou hemofilie na základě farmakokinetiky a vyzdvihují výhody takové léčby pro pacienty, zdravotníky i plátce zdravotní péče.
Klíčová slova:
hemofilie, koncentrát faktoru, farmakokinetikaÚvod
Profylaxe je zlatým standardem léčby osob s těžkou formou hemofilie (PWH – Persons with haemophilia), zejména v dětském věku. V posledních letech však i u nás roste počet dospělých s hemofilií, kteří využívají výhody profylaktické léčby. Ti, u nichž není profylaxe indikována či není možno ji z jakéhokoli důvodu poskytovat, jsou léčeni pouze při krvácení (léčba „on-demand“). Od konce 60. let, kdy byla profylaxe poprvé zavedena do klinické praxe (1), až do současnosti je nejčastěji používáno dávkování vycházející pouze z hmotnosti léčeného. I když za uplynulých více než 40 let tento přístup přinesl obrovské změny v léčbě hemofilie, zdá se, že strategie uniformního dávkování podle hmotnosti má své limity, na které v současnosti při snaze o další zkvalitnění péče začínáme narážet.
Standardní dávkování totiž nezohledňuje fakt, že efekt léčby (tedy doba, po kterou je v krvi nemocného hladina faktoru vyšší než kritická hodnota) je významně odlišný u jednotlivých PWH. Významná interindividuální variabilita daná rozdíly v poločasu podávaného koncentrátu faktoru resp. v jeho metabolismu („clearance“) je patrná jak u osob s hemofilií B (deficit FIX), tak především u osob s hemofilií A (deficit FVIII). Podle literárních údajů se může poločas koncentrátu podaného léčebně osobě s hemofilií A (tedy doba, za kterou klesne hladina FVIII v krvi pacienta na polovinu) pohybovat od 7 do 20 h (2), nebo dokonce od 6 do 28,8 h (3). Tyto rozdíly jsou dány především hladinou von Willebrandova faktoru (vWF), ale působí zde i jiné činitele, například věk (4).
Rozdíly jsou tedy větší než 200 % a je zcela zjevné, že dávkování pouze podle hmotnosti pacienta může vést k významně odlišným výsledkům u jednotlivých PWH. Když totiž přeneseme výše uvedené číselné údaje do praktické každodenní léčby, znamená to, že doba, po kterou se po podání identické dávky FVIII (např. 30 IU/kg) hladina faktoru udržuje nad 1 %, se může u jednotlivých PWH lišit až o 2,5 dne (5)! Pro hemofilii B jsou sice rozdíly vyjádřené procentuálně patrně méně signifikantní, ale s ohledem na významně delší přirozený poločas FIX je i zde interindividuální variabilita velmi významná. Z výše uvedeného jednoznačně plyne, že při užití dávkování zohledňujícího pouze hmotnost je část osob léčena nadměrně a část osob je léčena nedostatečně. V obou případech dochází k neefektivnímu využití léku (a tím i finančních zdrojů), neboť v prvním případě jsou zdroje vynakládány zbytečně a ve druhém případě neúčelně (nízké dávkování vede k vyššímu počtu krvácení, které následně nejen zhoršuje zdravotní stav a kvalitu života PWH, ale vynutí si i další prostředky na léčbu takových krvácení). I když se to týká především léčby profylaktické, má interindividuální variabilita význam i pro léčbu „on demand“. Jakým způsobem tedy zohlednit tyto signifikantní rozdíly mezi jednotlivci? Odpovědí je dle názoru autorů individualizovaná („na míru šitá“) léčba na základě farmakokinetiky.
Díky vyšetření farmakokinetiky lze u každého jednotlivce stanovit poločas léku/koncentrátu faktoru, kterým je léčen (T1/2), výši maximální hladiny, které dosáhneme podáním dané léčebné dávky („peak“), odpověď konkrétní osoby na léčbu (IVR – „in vivo recovery“) a z farmakokinetické křivky lze odečíst i dobu, za kterou klesne hladina faktoru v krvi pacienta pod určitou mez. Z praktického pohledu je vhodné se zaměřit kromě T1/2 a IVR i na dobu, kdy hladina klesne na 12 %, neboť v době, kdy je hladina FVIII nad 12 %, v podstatě nedochází k žádným klinicky významným kloubním krvácením (6), případně pod 1 %, kdy PWH již léčbou není chráněna vůbec. Všechny tyto parametry se liší nejen pro jednotlivé PWH, ale mohou se lišit i pro jednotlivé koncentráty koagulačních faktorů. Jak lze tedy výstup farmakokinetické analýzy (PK) využít v praxi:
- PK poskytne detailní a pro daného jedince specifické informace o efektu léčby.
- Na základě PK lze dle potřeby upravit léčbu (její interval, dávkování, případně i výběr koncentrátu).
- Léčená osoba může, se znalostí PK, přizpůsobit své aktivity poskytované léčbě a maximalizovat tak její efekt (např. prováděním rizikových aktivit pouze v době, kdy je ochrana podaným lékem maximální).
- Kombinací výše uvedeného (tedy sladěním ideálního dávkovacího režimu a aktivit léčené osoby) lze s pomocí PK dosáhnout optimalizace nákladů („cost-effectivity“) na léčbu každé PWH.
Vyšetření PK není nikterak náročné. Existují např. doporučení ISTH (International Society for Thrombosis and Haemostasis) jak pro PK u osob s hemofilií A, tak s hemofilií B. Pro příklad uveďme doporučení pro vyšetření PK u osob s hemofilií A, jimiž se řídí pracoviště autorů. Odběry hladiny FVIII jsou provedeny po minimálně 48 h (ideálně 72 h, je-li to možné) bez léčby FVIII. Tím eliminujeme přítomnost faktoru kolujícího v krvi pacienta po jeho předchozím podání. Pak je podána dávka FVIII (ideálně dávka identická s tou, která je podávána při profylaxi a/nebo léčbě krvácení – výsledky PK pak odpovídají reálné každodenní situaci a jsou optimálně použitelné pro danou osobu při dané léčebné strategii). Následně jsou odběry prováděny v těchto intervalech: 30 min., 1 hod., 3 hod., 6 hod., 12 hod., 24 hod., 48 hod. (případně i 72 hod.). U dětí mladších 6 let se počet odběrů většinou redukuje na pět. Z uvedeného jasně vyplývá, že i když lze PK vyšetření provést za hospitalizace (zejména menší děti a/nebo osoby žijící ve větší vzdálenosti od centra provádějícího vyšetření), lze vše stejně dobře zajistit i formou ambulantní a/nebo stacionární péče s minimem zameškaných hodin z práce/školy. Ty se v podstatě omezí pouze na jeden den (pouze první den je prováděn více než 1 odběr za 24 h). Parametry PK lze však zjistit i u osob, které nechtějí a/nebo nemohou kompletní PK vyšetření podstoupit. S použitím populačních farmakokinetických modelů založených na Bayesiánské statistické metodě, lze s pomocí 1 až 2 odběrů s velkou přesností určit základní PK parametry u každého jedince s hemofilií (4, 7).
Jak tedy užít PK v klinické praxi? Pro ilustraci níže uvádíme postupy a doporučení, která jsou standardně zavedena na oddělení dětské hematologie FN Brno:
- Vyšetření PK je nabídnuto všem dětem s těžkou formou hemofilie A/B, které absolvovaly již minimálně 50 ED („exposure days“). V případě souhlasu rodiny je možno jej opakovat každé 2 roky (PK se s věkem může měnit).
- V případě žádosti o vyšetření PK u dítěte s jinou než těžkou formou choroby je toto rovněž zváženo a podle možností se mu snažíme vyhovět.
- Vyšetření PK je vždy provedeno při přechodu na jiný derivát, ať už je příčina této změny jakákoli. Důvodem je snaha o prokázání „non-inferiority“ při přechodu na jinou léčbu, tedy snaha maximálně ochránit pacienta.
- PK spolu s vyšetřením inhibitoru provádíme i mimo výše uvedená doporučení v případě, že dochází ke zhoršení efektu stávající léčby. PK rovněž používáme na monitorování efektu imunotoleranční léčby (ITT – „immune tolerance treatment“)
Výstupem PK vyšetření pro klinika je křivka a tabulka uvedená na obrázku 2. Výstupem pro pacienta je pak text uvedený na obrázku 1, který obsahuje i výkladovou část, jenž umožní pacientu pochopit význam výstupů PK vyšetření a převést tuto informaci do denní praxe.
Obr. 1. Výstup vyšetření farmakokinetiky pro pacienta. 
Obr. 2. Výstup vyšetření farmakokinetiky pro lékaře. 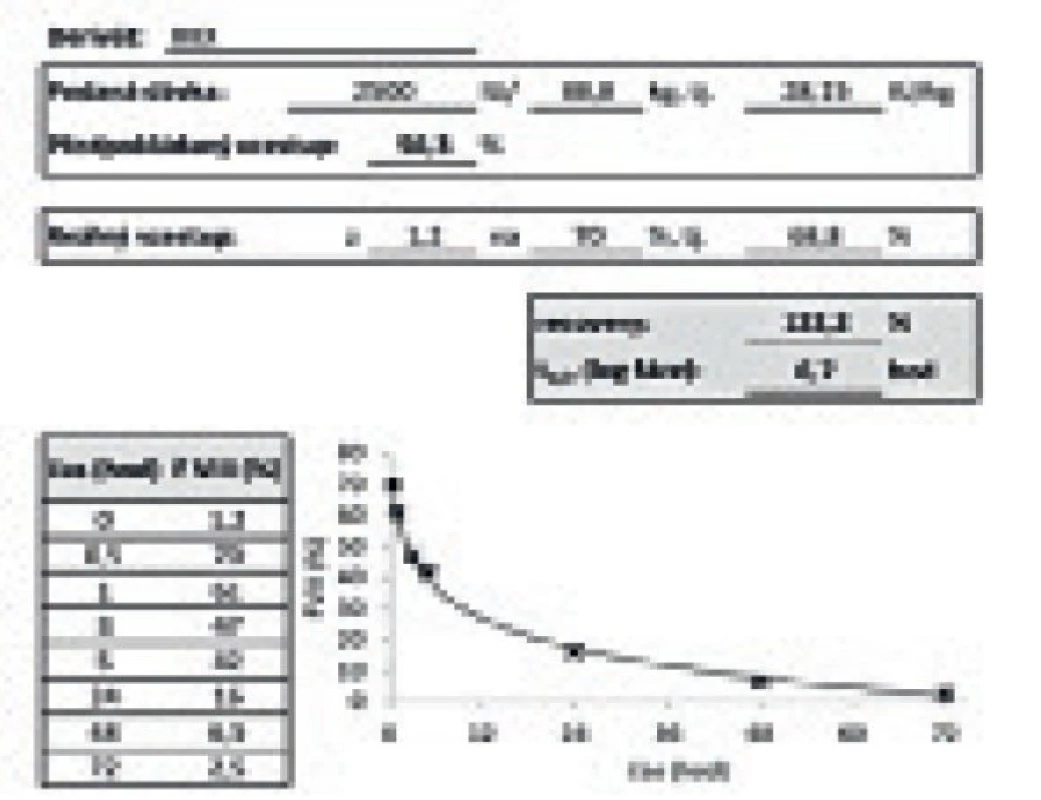
Závěrem lze tedy shrnout, že vyšetření farmakokinetiky má v léčbě hemofilie svůj jednoznačný význam a může z něj profitovat každý. Zdravotníkům poskytne informace nezbytné pro klinickou i ekonomickou optimalizaci nákladné léčby hemofilie a pacient se může cítit bezpečněji, neboť je schopen využít beze zbytku ochrany, kterou mu léčba poskytuje. Je navíc schopen, ve spolupráci se zdravotníky, přizpůsobit co nejlépe léčbu svým potřebám a/nebo své potřeby poskytované léčbě. Farmakokinetika tak jednoznačně přispívá k omezení počtu krvácení, má potenciál zlepšit kvalitu života osob s hemofilií a rovněž může být použita jako nástroj ke zvýšení nákladové efektivity („cost-effectivity“) léčby hemofilie.
Podíl autorů na tvorbě manuskriptu
JB napsal manuskript, MJ zodpovídala za veškerá laboratorní vyšetření. OZ, VF, SK, MJ a PO text připomínkovali a podíleli se na jeho závěrečné formě. Poděkování patří Jakubovi Gregorovi, který provedl grafické a formální úpravy a zpracoval text do podoby odpovídající standardům časopisu.
Doručeno do redakce: 27. 8. 2014
Přijato po recenzi: 30. 9. 2014
MUDr. Jan Blatný, Ph.D.
Oddělení dětské hematologie
Fakultní nemocnice Brno
jblatny@fnbrno.cz
Zdroje
1. Nilsson IM, Hedner U, Ahlberg A. Haemophilia prophylaxis in Sweden. Acta Paediatr Scand 1976; 65(2): 129-135.
2. van den Berg HM, De Groot PH, Fischer K. Phenotypic heterogenity in severe hemophilia. J Thromb Haemost 2007; 5(suppl.1): 151-156.
3. Fijnvandraat K, Peters M, Ten Cate JW. Interindividual variation in half-life of infused recombinant factor VIII is related to pre-infusion von Willebrand factor antigen levels. Br J Haematol 1995; 91(2): 474-476.
4. Björkman S, Oh M, Spotts G, et al. Population pharmacokinetics of recombinant factor VIII: the relationships of pharmacokinetics to age and body weight. Blood 2012; 119(2): 612-618.
5. Collins PW, Fischer K, Morfini M, et al. Implications of coagulation factor VIII and IX pharmacokinetics in prophylactic treatment of haemophilia. Heamophilia 2011; 17(1): 2-10.
6. Den Uijl IE, Mauser Bunschoten EP, Roosendaal G, et al. Clinical severity of haemophilia A: does the classification of the 1950s still stand? Haemophilia 2011; 17(6): 849-853.
7. Bjorkmann S. Pharmacokinetics of plasma-derived and recombinant factor IX – implications for prophylaxis and on-demand therapy. Haemophilia 2013; 19(6): 808-813.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2014 Číslo 4- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- 50 tisíc dárců českého národního registru dárců dřeně (ČNRDD) a obhájení akreditace WMDA: dobrá zpráva pro program transplantací krvetvorných buněk ČR
- Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
- Phase IV open-label study of the efficacy and safety of deferasirox after allogeneic stem cell transplantation
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) u mnohočetného myelomu
- Retransfuzní systém s dvojitou integrovanou filtrací – parametry kvality produktu
- Činnost transfuzní služby v České republice v období 1989–2013
- Indikátory kvality Českého národního registru dárců dřeně za rok 2013 a srovnání s předchozími roky
- The prognostic significance of early treatment response in pediatric relapsed acute myeloid leukemia: results of the international study Relapsed AML 2001/01
- Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials
- A novel integrated cytogenetic and genomic classification refines risk stratification in pediatric acute lymphoblastic leukemia
- Tacrolimus/sirolimus vs tacrolimus/methotrexate as GVHD prophylaxis after matched, related donor allogeneic HCT
- Factors that predict thrombosis in relatives of patients with venous thromboembolism
- Outcome of aplastic anemia in adolescence: a survey of the Severe Aplastic Anemia Working Party of the European Group for Blood and Marrow Transplantation
- Obsah ročníku 20/2014
- Vybrané odborné akce v roce 2015
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) u mnohočetného myelomu
- Činnost transfuzní služby v České republice v období 1989–2013
- Retransfuzní systém s dvojitou integrovanou filtrací – parametry kvality produktu
- Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



