-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) České skupiny pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP
Recommendations for the diagnosis and treatment of chronic lymphocytic leukaemia (CLL) Czech Group for Chronic Lymphocytic Leukaemia, section of the Czech Society of Haematology, CzMA
Chronic lymphocytic leukaemia (CLL) has a remarkably heterogeneous clinical course. The diagnostic procedures and therapeutic interventions need to be individually tailored according to patient age, comorbidities and therapeutic aims. There have been important developments in prognostication and therapy during recent years (e. g., significance of TP53 mutations, introduction of novel monoclonal antibodies and B-cell receptor signalling inhibitors). Therefore, the Czech CLL Study Group, the working group of the Czech Society of Haematology developed these updated guidelines to facilitate the decision-making process for diagnostic and therapeutic procedures in daily practice. The guidelines are based on a comprehensive analysis of current literature and follow the principles of evidence-based medicine.
Key words:
chronic lymphocytic leukaemia – diagnosis – treatment
Autori: L. Smolej 1; M. Špaček 2; P. Obrtlíková 2; Š. Pospíšilová 3; M. Jarošová 4; R. Urbanová 4; D. Lysák 5; M. Brejcha 6; J. Schwarz 7; M. Doubek 3
Pôsobisko autorov: V. interní hematologická klinika, Fakultní nemocnice Hradec Králové a Univerzity Karlovy v Praze, Lékařská fakulta v Hradci Králové 1; I. interní klinika – klinika hematologie, 1. lékařská fakulta Univerzity Karlovy a Všeobecné fakultní nemocnice Praha 2; Interní hematologická a onkologická klinika, Fakultní nemocnice a Lékařské fakulty Masarykovy univerzity Brno 3; Hemato-onkologická klinika, Fakultní nemocnice a Lékařské fakulty Univerzity Palackého Olomouc 4; Hematologicko-onkologické oddělení, Fakultní nemocnice Plzeň 5; Hematologické oddělení, Nemocnice Nový Jičín 6; Ústav hematologie a krevní transfuze, Praha 7
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 2, p. 115-126.
Kategória: Doporučené postupy
Verze z 8. 3. 2016, schválená výborem ČHS ČLS JEP
Súhrn
Chronická lymfocytární leukemie (CLL) je onemocnění s mimořádně různorodým klinickým průběhem. Diagnostiku a léčbu je nutno individualizovat s přihlédnutím k věku, celkovému stavu, přidruženým chorobám a cílům léčby. V posledních letech přibyly zásadní poznatky týkající se posouzení prognózy i léčby (význam mutací genu TP53, nové monoklonální protilátky, inhibitory drah B-buněčného receptoru a další). Česká skupina pro CLL, sekce České hematologické společnosti ČLS JEP, proto vytvořila tato aktualizovaná doporučení k usnadnění rozhodnování o diagnostických a léčebných postupech v klinické praxi. Doporučení se zakládají na důkladné analýze současné literatury a vycházejí z principů medicíny založené na důkazech.
KLÍČOVÁ SLOVA:
chronická lymfocytární leukemie – diagnostika – léčba1 STANOVENÍ DIAGNÓZY CLL
Diagnóza CLL je stanovena podle doporučení International Workshop on CLL (IWCLL) na základě vyšetření krevního obrazu s mikroskopickým rozpočtem a průtokové cytometrie periferní krve [1]. Diagnostika vyžaduje přítomnost minimálně 5 × 109/l B-lymfocytů v periferní krvi s průkazem charakteristického fenotypu a klonality průtokovou cytometrií. V krevním nátěru jsou nacházeny převážně malé, zralé lymfocyty s úzkým lemem cytoplazmy a kondenzovaným jádrem bez jadérka; může se vyskytovat příměs větších, atypických lymfocytů s naštípnutým jádrem nebo prolymfocytů, které mohou tvořit až 55 % všech leukemických buněk (tab. 1) [1]. Nález prolymfocytů nad 55 % vede společně s nálezem v průtokové cytometrii k diagnóze B-prolymfocytární leukemie (B-PLL) [1, 2]. Vzhledem k tomu, že maligní klon je možno jednoznačně identifikovat v periferní krvi, není pro stanovení diagnózy CLL nutné vyšetření kostní dřeně či mízní uzliny. Vyšetření kostní dřeně je zpravidla prováděno k objasnění etiologie anémie či trombocytopenie – odlišení infiltrace při CLL, autoimunitní příčiny apod. Exstirpace a histologické vyšetření mízní uzliny je indikováno v případě, kdy není diagnóza CLL jednoznačná (např. netypický imunofenotyp) či při podezření na transformaci do jiné lymfoproliferace (Richterův syndrom) [1].
Tab. 1. Diagnostická kritéria CLL podle International Workshop on CLL (IWCLL) [1] ![Diagnostická kritéria CLL podle International Workshop on CLL (IWCLL) [1]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4ffd73d27e8049028733d56b89e20a76.png)
Buňky CLL jeví charakteristický imufenotyp charakterizovaný koexpresí znaků CD5, CD19 a CD23. K cytometrické diagnóze CLL a diferenciální diagnostice je možno využít skórovací systém Royal Marsden založený na expresi pěti povrchových znaků nádorových lymfocytů (tab. 2) [3]. Většina případů CLL má vysoké skóre (4–5 bodů), ostatní B-lymfoproliferace mají skóre nízké (0–2 body). Diferenciálně diagnosticky je třeba od CLL odlišit zejména leukemizovaný lymfom z plášťových buněk a B-prolymfocytární leukemii.
Tab. 2. Skóre pro stanovení diagnózy CLL průtokovou cytometrií 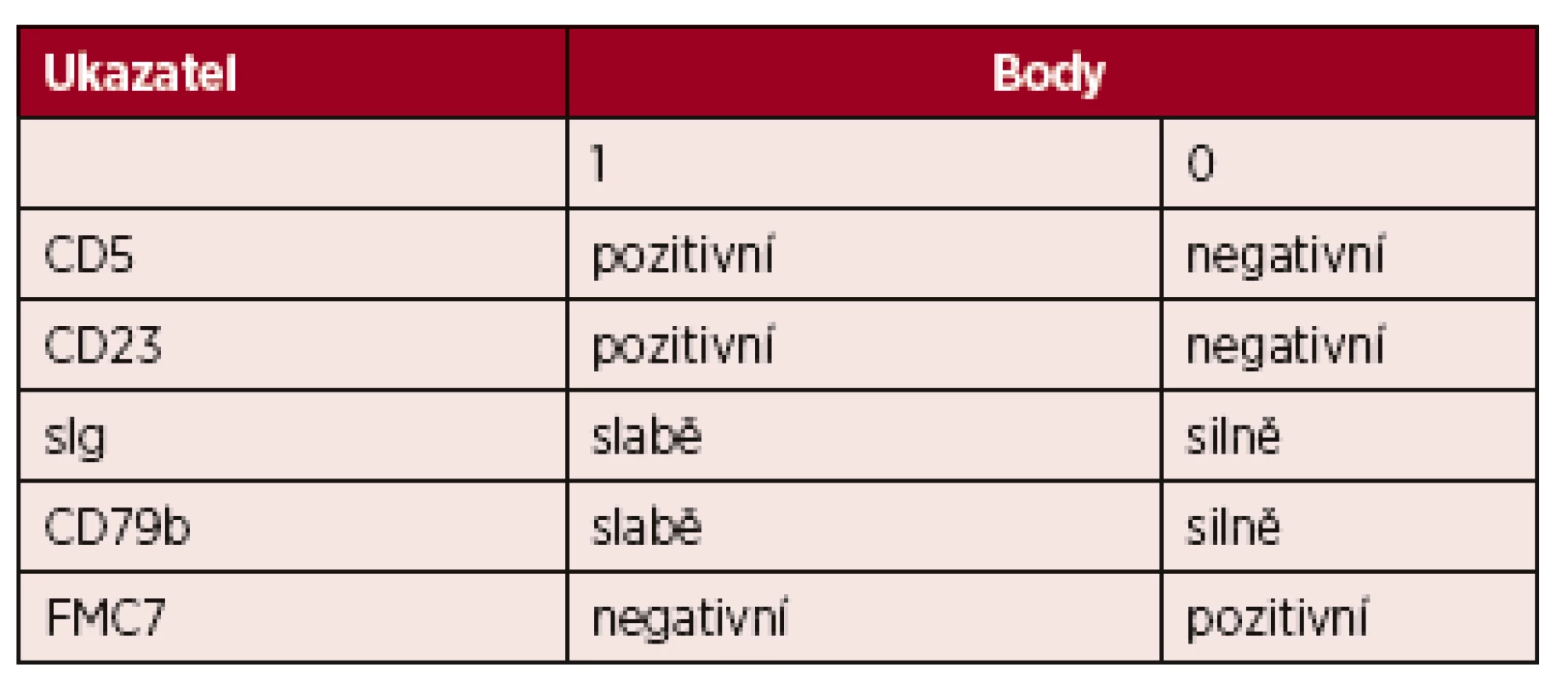
Většina případů CLL má vysoké skóre (4–5 bodů), ostatní B-lymfoproliferace mají typicky skóre nízké (0–2 body). Lymfom z malých lymfocytů (small lymphocytic lymphoma, SLL) má identický imunofenotyp jako CLL; nejzásadnějším rozdílem vůči CLL je nesplnění kritéria periferní lymfocytózy. Aktuální klasifikace Světové zdravotnické organizace uvádí CLL a SLL jako společnou jednotku CLL/SLL. Diagnóza SLL by měla být potvrzena histologickým vyšetřením mízní uzliny, pokud je to možné [1].
Nález klonální B-lymfocytózy < 5 × 109/l s imunofenotypem typickým pro CLL, ale bez současné lymfadenomegalie a organomegalie, cytopenie nebo B-příznaků definuje monoklonální B-lymfocytózu (MBL), která je prekancerózou CLL. V 1–2 % případů ročně může MBL progredovat do CLL [4].
2 DOPORUČENÁ VYŠETŘENÍ U NEMOCNÝCH S NOVĚ DIAGNOSTIKOVANOU CLL
Při diagnóze onemocnění se stanovuje na základě fyzikálního vyšetření a vyšetření krevního obrazu klinické stadium podle Raie nebo Bineta (tab. 3) [5, 6]. Další vyšetření doporučená v době diagnózy CLL shrnuje tabulka 4 [7].
Tab. 3. Klinická stadia podle Raie a Bineta 
1 – skupiny uzlin: krční, podpažní, tříselné, slezina a játra. Oboustranné postižení je počítáno za jednu oblast. Tab. 4. Minimální doporučený rozsah vyšetření u nemocných s nově zjištěnou CLL [7] ![Minimální doporučený rozsah vyšetření u nemocných s nově zjištěnou CLL [7]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b712800186d19882d89cefdfc10c5fb8.png)
LDH – laktátdehydrogenáza, B2M – beta 2-mikroglobulin 3 PROGNOSTICKÁ VYŠETŘENÍ U CLL
Vzhledem k mimořádné klinické variabilitě nemocných s CLL, a to i v rámci jednoho klinického stadia, je doporučeno u nemocných, kteří jsou kandidáty intenzivní/cílené léčby, zvážit vyšetření umožňující individuální prognózu zpřesnit. Mezi ně patří zejména: vyšetření genetických aberací fluorescenční in situ hybridizací (FISH – delece 13q, 11q, 17p, trizomie 12) [8], stanovení mutačního stavu genů pro variabilní část těžkého řetězce imunoglobulinu (IGHV) [9] a vyšetření mutace genu TP53 [10, 11]. Tyto prognostické faktory mají zásadní vliv na délku období bez léčby, období do progrese a celkové přežití. V současné době je u nemocných vhodných k léčbě ovlivňující přirozený průběh CLL (kombinované fludarabinové režimy, alemtuzumab, inhibitory signálních drah B-buněčného receptoru [BCR], alogenní transplantace) doporučováno provést vyšetření chromozomálních abnormalit pomocí FISH, zejména deleci 17p a analýzu mutací TP53 vždy před zahájením 1. linie léčby a také před každou novou linií léčby [7, 12]. Význam nově objevených mutací genů BIRC-3, NOTCH-1, MYD-88, SF3B1 a dalších, je v současné době intenzivně zkoumán; vyšetření těchto mutací není v současné době vyžadováno pro běžnou praxi [7].
Význam zobrazovacích vyšetření u CLL není dosud zcela jasný, avšak vzhledem k častému výskytu zejména nitrobřišní lymfadenopatie a jejímu nepříznivému prognostickému významu je vhodné v rámci stanovení rozsahu onemocnění před léčbou a při hodnocení léčebné odpovědi provést ultrasonografii břicha, u mladších nemocných eventuálně vyšetření hrudníku a břicha pomocí počítačové tomografie (CT) [7].
4 LÉČBA CLL
Léčba nemocných s CLL mimo klinické studie je individuální s přihlédnutím ke všem okolnostem aktuálního stavu nemocného, přidruženým onemocněním, přáním apod. Vzhledem k tomu, že pouze klinický výzkum vede ke zlepšování výsledků léčby, měla by být každému vhodnému nemocnému s CLL nabídnuta účast v některé z klinických studií probíhajících v České republice. Zásadní je dobrá komunikace mezi regionálními hematologickými pracovišti a centry vysoce specializované hematoonkologické péče pro dospělé. Velice důležité je do těchto center včas odeslat mladší nemocné s vysoce nepříznivým průběhem CLL ke zvážení alogenní transplantace krvetvorných kmenových buněk.
4. 1 Indikace k léčbě CLL
Řídíme se podle mezinárodně uznávaných kritérií International Workshop on Chronic Lymphocytic Leukemia (IWCLL). Nemocní s pokročilým onemocněním (stadium III a IV podle Raie nebo stadium C podle Bineta) jsou indikováni k zahájení léčby. Pouze u malé skupiny nemocných se stabilní mírnou anémií či trombocytopenií je možno léčbu nezahajovat a pečlivě monitorovat. U nemocných se středně pokročilým onemocněním (Rai I/II či Binet B) by měla být léčba zahájena pouze při průkazu aktivity CLL [1, 7].
K definici aktivního onemocnění a zahájení léčby je nutné splnit nejméně jedno z následujících kritérií:
- Průkaz progresivního selhání kostní dřeně, které se projevuje rozvojem nebo zhoršením anémie a/nebo trombocytopenie.
- Masivní (tj. > 6 cm pod levým žeberním obloukem) nebo progresivní nebo symptomatická splenomegalie.
- Masivní lymfadenopatie (tj. > 10 cm v nejdelším průměru) nebo progresivní nebo symptomatická lymfadenopatie.
- Progresivní lymfocytóza se vzestupem > 50 % během 2 měsíců nebo doba zdvojnásobení počtu lymfocytů (LDT) kratší než 6 měsíců. Zejména u nemocných s úvodní lymfocytózou pod 50 x 109/l je třeba vyloučit jiné faktory, které mohou přispívat k lymfocytóze nebo lymfadenopatii, např. infekce. Progrese lymfocytózy se může u některých nemocných zpomalit, proto je vhodné zejména při absenci ostatních známek aktivity CLL pečlivě sledovat klinický vývoj.
- Autoimunní anémie a/nebo trombocytopenie špatně odpovídající na kortikosteroidy nebo jinou standardní léčbu.
- Nejméně jeden z následujících systémových příznaků souvisejících s onemocněním:
- a) Nechtěný úbytek hmotnosti ≥ 10 % v průběhu předchozích 6 měsíců.
- b) Významná únava (tj. výkonnostní stav podle ECOG 2 nebo horší, nemožnost pracovat nebo provádět obvyklé činnosti).
- c) Horečky nad 38 °C po dobu 2 nebo více týdnů bez průkazu infekce.
- d) Noční pocení po dobu delší než 1 měsíc bez průkazu infekce.
Autoimunní hemolytická anémie a autoimunní trombocytopenie nejsou indikací k cytoredukční léčbě, nejsou-li současně splněna jiná kritéria aktivity CLL. Nemocní s autoimunitními cytopeniemi by měli být léčeni imunosupresivní léčbou, např. kortikoterapií. Hypogamaglobulinemie nebo monoklonální/oligoklonální paraproteinemie není sama o sobě důvodem zahájení léčby. U nemocných s CLL může být značně zvýšený počet leukocytů, avšak u CLL jsou příznaky z leukostázy velmi vzácné. Neměl by proto být absolutní počet leukocytů používán jako samostatný indikátor léčby u asymptomatických nemocných. Samotná přítomnost nepříznivých prognostických faktorů (nemutované IGHV geny, del 17p apod.) bez klinické aktivity CLL není indikací k zahájení léčby [1, 7].
4. 2 Vyšetření před léčbou
Před zahájením léčby je vhodné provést tato vyšetření:
- Stanovení rozsahu onemocnění: fyzikální vyšetření a dále vhodné provést ultrasonografii břicha, u mladších nemocných, eventuálně CT hrudníku a břicha. Vyšetření kostní dřeně je nutné zejména u nemocných s anémií či trombocytopenií k posouzení etiologie. Dále je doporučeno provést vyšetření FISH, zejména delece 17p a mutační analýzu TP53, jejichž přítomnost může ovlivnit volbu léčby [1, 7].
- Vyšetření nutná ke stanovení bezpečnosti léčby: kromě základních biochemických ukazatelů zejména přímý antiglobulinový (Coombsův) test + ukazatele hemolýzy (bilirubin, laktátdehydrogenáza, retikulocyty, haptoglobin) [7]. U nemocných s aktivní autoimunitní hemolýzou není zpravidla použití fludarabinu doporučováno. Samotná pozitivita přímého antiglobulinového testu bez aktivní hemolýzy však není důvodem fludarabin nepoužít. Dále vyšetřujeme sérologie virových hepatitid k vyloučení chronické hepatitidy B a C (HBsAg, anti-HBs, anti-HBc total a IgM, anti-HCV); u mladších nemocných je vhodné vyšetření sérologie HIV, před intenzivní léčbou vyšetření sérologie cytomegaloviru (CMV) [7]. Velmi důležité je stanovení funkce ledvin vzhledem k renálnímu vylučování řady cytostatik, např. fludarabinu a cyklofosfamidu. Lze použít např. vypočtenou clearance kreatininu podle Cockcroftovy a Gaultovy rovnice [13].
- Posouzení celkového stavu a přidružených onemocnění je velice důležité pro stanovení cílů léčby [14]. Významná část nemocných s CLL má již v době diagnózy významná přidružená onemocnění [15], jejichž počet či závažnost ovlivňují celkové přežití [15–17]. Důležitější než kalendářní je biologický věk. Stanovujeme výkonnostní stav podle ECOG, vhodné je však také posoudit počet a závažnost přidružených onemocnění. Je možno využít např. systém Cumulative Illness Rating Scale (CIRS) [17–19]. Základním způsobem lze rozdělit nemocné do tří skupin:
- a) nemocní v dobrém stavu bez závažných přidružených onemocnění („Go-Go“). V klinických studiích je používána hranice CIRS ≤ 6 bodů k definici této skupiny;
- b) nemocní s významnými přidruženými onemocněními, ale v uspokojivém stavu („Slow-Go“);
- c) nemocní ve špatném stavu s těžkými komorbiditami („No-Go“) [14].
Ke stanovení intenzity a typu léčby je v současné době nejdůležitější pečlivé individuální posouzení nemocného.
- Zásadní je také vzít v úvahu přání nemocného. Cíle a představy lékaře a nemocného se nemusí vždy shodovat, proto je důležité s nemocným prodiskutovat všechny vhodné možnosti léčby a podrobně vysvětlit výhody a nevýhody jednotlivých postupů.
4. 3 Hodnocení léčebné odpovědi
Řídí se doporučeními IWCLL [1]. Hodnocení léčebné odpovědi je vhodné provést po 2–3 měsících od ukončení léčby z důvodu umožnění regenerace v krevním obraze po myelotoxických režimech typu FCR. Hodnocení léčebné odpovědi se opírá o fyzikální vyšetření a vyšetření krevního obrazu s diferenciálním rozpočtem leukocytů. Tato vyšetření mohou být doplněna o vyšetření kostní dřeně a vyšetření zobrazovacími metodami. Ideálním cílem léčby je dosažení kompletní remise (CR). Jednotlivé kategorie léčebné odpovědi a jejich definice jsou shrnuty v tabulce 5. Vzhledem k tomu, že nové preparáty zasahující do signalizace B-buněčného receptoru (ibrutinib, idelalisib) způsobují redistribuci maligních lymfocytů z mízních uzlin do periferní krve s následnou lymfocytózou, která může být přechodná v úvodu léčby, ale také může trvat i řadu měsíců, byla navržena nová kategorie „částečná odpověď s lymfocytózou (PR-L)“[20]. Jde o případ, kdy nemocný nesplní kritérium PR z důvodu lymfocytózy vyvolané léčbou. Tato kategorie slouží zejména k tomu, aby nemocným v léčbě inhibitory BCR nebyla předčasně ukončena léčba; PR s lymfocytózou by neměla být považována za progresi CLL (20).
Tab. 5. Hodnocení léčebné odpovědi u CLL 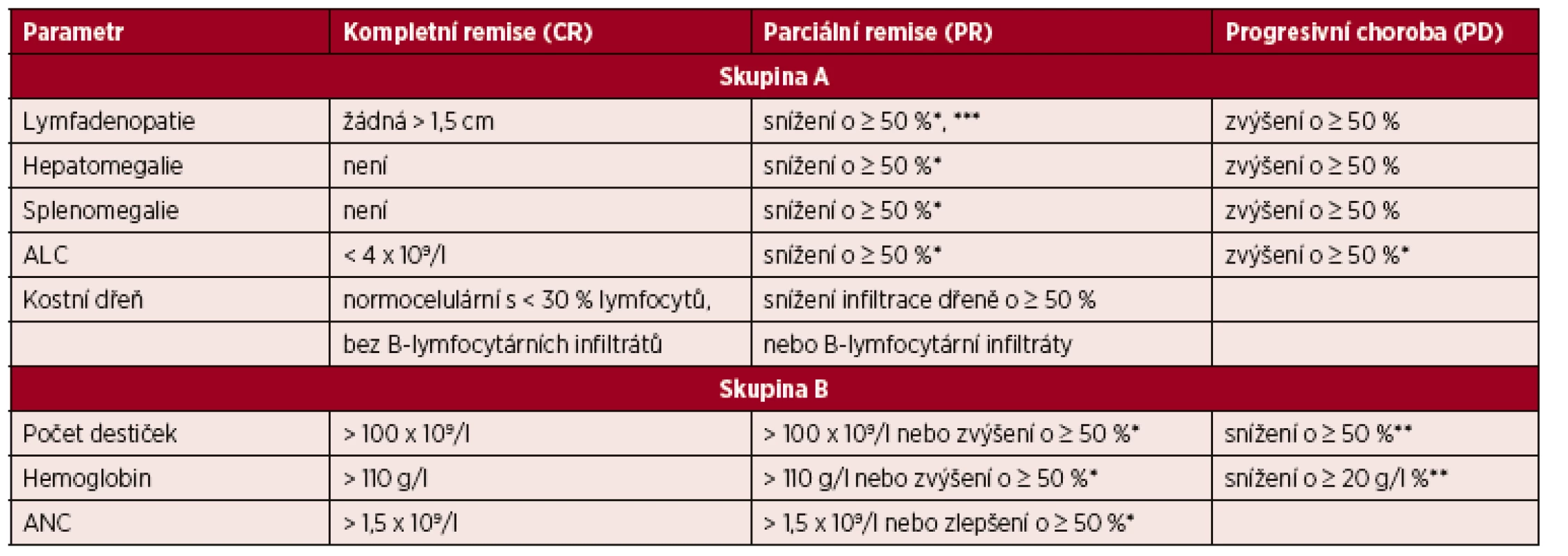
Upraveno podle [1]. Poznámky a vysvětlivky k tabulce: *oproti vstupnímu stavu před léčbou; **v důsledku CLL; ***aniž by se některá z uzlin zvětšila (povolenou výjimkou je zvětšení u malých uzlin do průměru 2 cm o maximálně 25 %); ALC – absolutní počet lymfocytů; ANC – absolutní počet neutrofilů. Definice CR: splněna veškerá kritéria skupiny A i B a nemocný nesmí mít systémové příznaky spojené s CLL. Vyšetření kostní dřeně není nezbytně nutné pro hodnocení kompletní remise mimo klinické studie.
Definice parciální remise (PR): splněna nejméně 2 kritéria ze skupiny A + nejméně jedno kritérium ze skupiny B.
Definice stabilní choroby (SD): nedosažení léčebné odpovědi (tedy CR či PR), zároveň nejsou splněna kritéria progresivní choroby.
Definice progresivní choroby (PD): splněno nejméně jedno z kritérií skupiny A či B.
Pro splnění definice CR a PR musí být hodnocené parametry stabilní nejméně 2 měsíce.
Kompletní remise s neúplnou restitucí krevního obrazu (CRi) je definována stejně jako CR, je však přítomna reziduální cytopenie po léčbě (snížený ANC a/nebo hemoglobin a/nebo trombocyty).
Pokud bylo dosaženo PR na základě hodnocení krevního obrazu a organomegalie, je vyšetření kostní dřeně irelevantní, neboť nezmění kategorii léčebné odpovědi.
Do kategorie „Progresivní choroba“ se řadí také transformace do lymfoproliferace vyšší malignity (Richterův syndrom).
Relaps je stav, kdy u nemocného, jenž dosáhl po léčbě CR nebo PR, dojde za ≥ 6 měsíců od skončení léčby k progresi nemoci (viz definice PD). Refrakterní onemocnění je definováno jako nedosažení CR nebo PR či relaps/progrese do 6 měsíců od ukončení léčby.
4. 4 Léčba 1. linie
4. 4. 1 Léčba 1. linie u nemocných bez významných přidružených onemocnění
Na základě výsledků randomizované studie CLL8 je režim FCR (fludarabin, cyklofosfamid, rituximab) považován za hlavní léčebnou možnost u nemocných v dobrém stavu bez závažných přidružených onemocnění a s normální funkcí ledvin [7, 21–23]. V případě delece 17p/mutace TP53 a nevhodnosti léčby chemoimunoterapií je vhodné použít ibrutinib [7, 24].
Vzhledem ke klinické variabilitě u nemocných s CLL je často nutno léčbu individualizovat.
Další léčebné možnosti (řazeno abecedně):
- alemtuzumab* [25];
- bendamustin + rituximab (BR) jako alternativa k režimu FCR u nemocných ≥ 65 let věku, zejména v případě vysokého rizika infekcí [21, 26];
- rituximab, cyklofosfamid, dexametazon (RCD) či obdobné režimy s vysoko dávkovanými kortikoidy [23, 27].
*Alemtuzumab není pro léčbu CLL registrován, je dostupný v rámci specifického léčebného programu.
4. 4. 2 Léčba 1. linie u nemocných s významnými přidruženými chorobami
U nemocných s významnými komorbiditami (např. skóre komorbidit CIRS > 6) či clearancí kreatininu < 70 ml/min., kteří tedy nejsou vhodní k léčbě plno dávkovaným protokolem FCR, jsou k dispozici tyto hlavní možnosti (v abecedním pořadí):
- obinutuzumab + chlorambucil [28, 29];
- ofatumumab + chlorambucil [30];
- rituximab + bendamustin (BR) [31];
- rituximab + chlorambucil [29, 32].
U nemocných s delecí 17p/mutací TP53 nevhodných k léčbě chemoimunoterapií je vhodné použít ibrutinib [7].
Další možnosti léčby (v abecedním pořadí):
- alemtuzumab* [25];
- bendamustin + ofatumumab (BO) [33];
- FCR se sníženými dávkami chemoterapie (“low-dose” FCR) [34];
- rituximab, cyklofosfamid, dexametazon (RCD) či obdobné režimy s vysoko dávkovanými kortikoidy [23, 27].
*Alemtuzumab není pro léčbu CLL registrován, je dostupný v rámci specifického léčebného programu.
U těžce komorbidních nemocných, u kterých lze očekávat krátké přežití z důvodu přidružených onemocnění, je cílem léčby ovlivnění symptomů CLL s minimem nežádoucích účinků (tab. 6). Lze využít např. chlorambucil v monoterapii, nízko dávkovaný cyklofosfamid v monoterapii či kortikoterapii.
Tab. 6. Přehled možností pro 1. linii léčby CLL 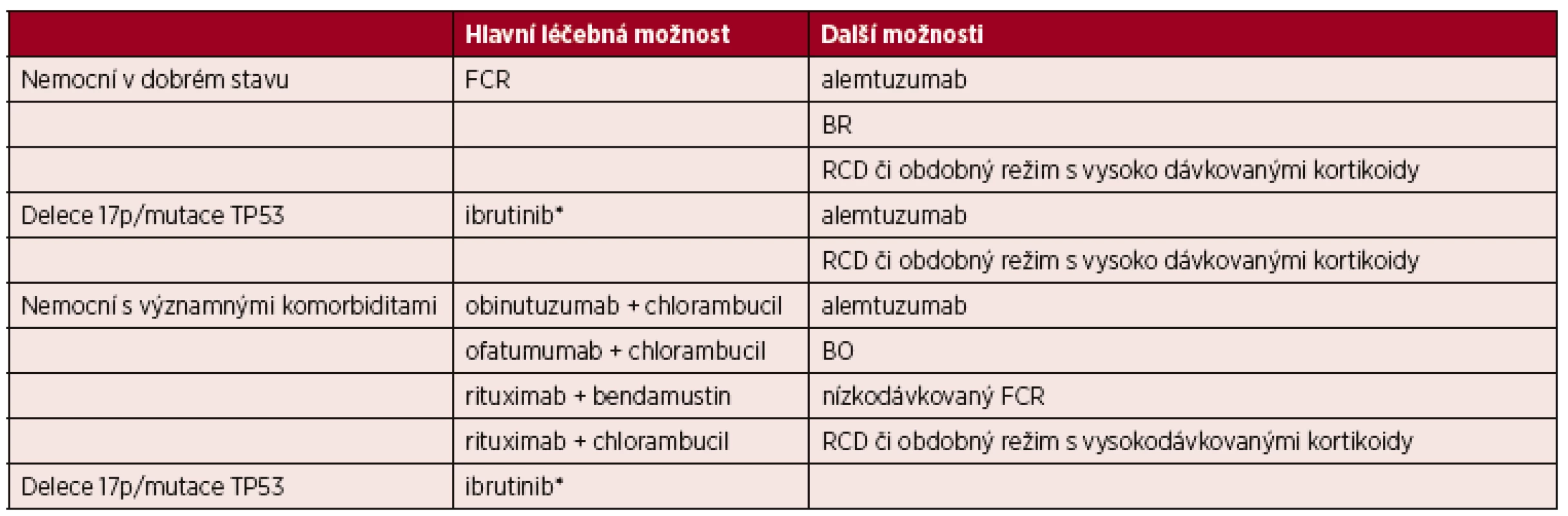
*V případech, kde nemocný není vhodný k léčbě chemoimunoterapií. FCR – fludarabin + cyklofosfamid + rituximab; BR – bendamustin + rituximab; BO – bendamustin + ofatumumab; RCD – rituximab + cyklofosfamid + dexametazon 4. 5 Léčba relapsu/refrakterní CLL
Volba vhodného léčebného režimu je dána celkovým stavem a věkem pacienta a také odpovědí na předchozí léčbu a délkou jejího trvání. Pacienti s pozdním relapsem po chemoimunoterapii, u nichž léčebná odpověď trvala déle než 2–3 roky, mohou profitovat z opakované aplikace chemoimunoterapie [7]. V případě časných relapsů (do 2–3 let) nebo refrakterní choroby je nutné změnit léčebný přístup a více zvažovat protokol bez chemoterapie [7].
4. 5. 1 Léčba relapsu/refrakterní CLL u nemocných bez významných přidružených onemocnění
Hlavní léčebné možnosti (řazené podle abecedy) představují nové molekuly ibrutinib a idelalisib zasahující do signalizace BCR [7, 23]. Tyto preparáty mají zpravidla mírnou hematologickou toxicitu, vyskytuje se však odlišný profil nežádoucích účinků, které je zapotřebí pečlivě sledovat (průjem/kolitida, zvýšení jaterních testů, pneumonitida, krvácení, kožní exantém apod.) [35, 36].
Další možnosti léčby (řazení podle abecedy):
- alemtuzumab [37, 38];
- BR (bendamustin + rituximab)** [39];
- FCR [40, 41];
- ofatumumab u nemocných refrakterních na fludarabin i alemtuzumab [42];
- RCD (rituximab, cyklofosfamid, dexametazon) či obdobné režimy s vysokodávkovanými kortikoidy, zejména u refrakterních nemocných [43, 44];
- kombinace rituximabu s intenzivními platinovými režimy (např. R-DHAP) u refrakterních nemocných mladšího věku ve velmi dobrém stavu bez závažných komorbidit [45].
**Bendamustin v léčbě relapsu/refrakterní CLL nemá indikaci podle souhrnu údajů o přípravku („off-label“ indikace), nutno žádat o úhradu revizního lékaře
4. 5. 2 Léčba relapsu/refrakterní CLL u nemocných s významnými přidruženými onemocněními
Hlavní možnosti (řazeno podle abecedy):
- ibrutinib [35, 46, 47];
- idelalisib + rituximab [36].
Další možnosti (řazeno podle abecedy):
- alemtuzumab [37, 38];
- BR (bendamustin + rituximab)** [39];
- FCR v redukovaných dávkách („low dose“ FCR) [34];
- ofatumumab u nemocných refrakterních na fludarabin i alemtuzumab [42];
- RCD (rituximab, cyklofosfamid, dexametazon) či obdobné režimy s vysokodávkovanými kortikoidy, zejména u refrakterních nemocných [43, 44];
**Bendamustin v léčbě relapsu/refrakterní CLL nemá indikaci podle souhrnu údajů o přípravku („off-label“ indikace), nutno žádat o úhradu revizního lékaře
U relabujících nemocných s nepříznivou genetikou (delece 17p/mutace TP53) by mělo být i v případě pozdního relapsu zvažováno podání ibrutinibu či idelalisibu, které nabízejí lepší kontrolu nemoci v porovnání s ostatní dosud dostupnou léčbou, s výjimkou alogenní transplantace krvetvorných kmenových buněk.
Nemocní s refrakterní CLL by měli být včas konzultováni v některém z center vysoce specializované hematoonkologické péče pro dospělé, které by mělo řídit další strategii léčby, indikovat případně léčbu moderními molekulami či monoklonálními protilátkami, ideálně v rámci klinických studií a také zvážit provedení alogenní transplantace krvetvorných buněk (tab. 7).
Tab. 7. Možnosti léčby relapsu/refrakterní CLL 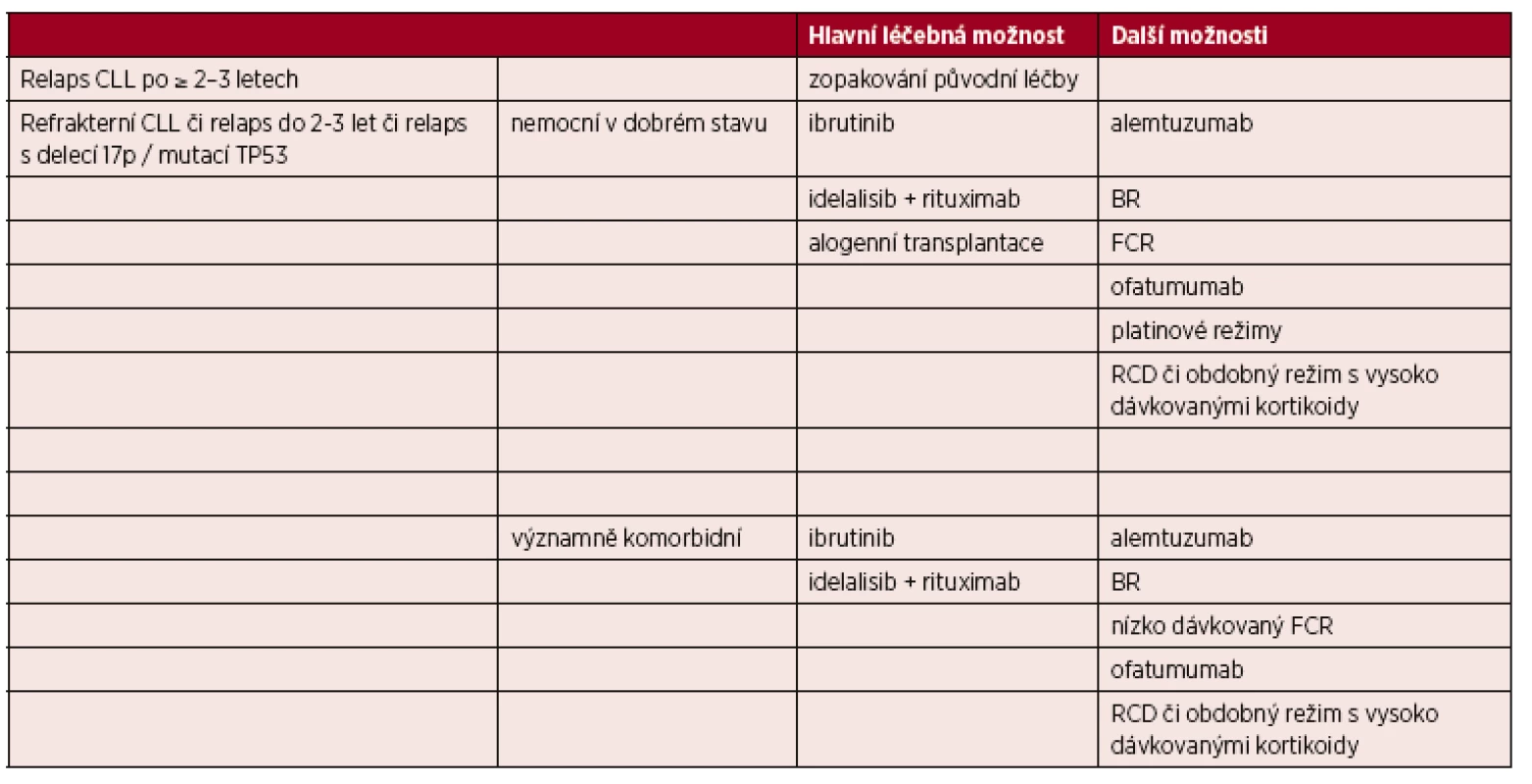
4. 6 Minimální reziduální nemoc
Moderní léčebné protokoly vedou u významné části nemocných ke snížení leukemického klonu pod úroveň detekce běžnými metodami; zbytkové leukemické elementy (minimální reziduální nemoc, MRN) mohou být zjistitelné pouze velmi citlivými metodami. V literatuře přibývá důkazů o prodloužení přežití bez progrese a celkového přežití u nemocných, u kterých bylo dosaženo negativity MRN [48]. Prognostický dopad MRN navíc není závislý na podané léčbě či na jiných rizikových faktorech (mutační stav IGHV, chromozomové aberace apod.). Vyšetření MRN v periferní krvi či kostní dřeni metodami s citlivostí minimálně 10-4 (pomocí průtokové cytometrie nebo PCR s individuálně připravenými primery) je vhodné zvážit u nemocných po intenzivní léčbě (např. kombinované fludarabinové režimy, alemtuzumab, režimy s novými monoklonálními protilátkami, alogenní transplantace) [49]. Dosud se nejedná o vyšetření povinné [7], ale význam MRN v budoucnu pravděpodobně významně vzroste. Vhodné je především u pacientů po alogenní transplantaci krvetvorných buněk.
4. 7 Transplantace krvetvorných buněk
Alogenní transplantace krvetvorných buněk by měla být včas zvažována u každého nemocného s vysoce rizikovou CLL (refrakterní na purinová analoga, relaps < 24–36 měsíců po chemoimunoterapii, delece 17p/mutace TP53), respektive obecně u nemocných s nepříznivým klinickým průběhem [50, 51]. Tito nemocní by měli být včas konzultováni v některém z center vysoce specializované hematoonkologické péče pro dospělé vzhledem k tomu, že transplantace by měla být provedena včas, dříve než je onemocnění kompletně refrakterní a pacient masivně předléčený.
Alogenní transplantace má u CLL kurativní potenciál a nabízí dlouhodobou kontrolu nemoci. Část nemocných dosahuje negativity na úrovni MRN a výsledek transplantace není nepříznivě ovlivněn negativními genetickými rizikovými faktory (delece 17p/mutace TP53). Transplantace je ovšem zatížena cca 15–30% nerelapsovou mortalitou v prvních dvou letech a až u 25 % pacientů omezuje jejich kvalitu života chronická reakce štěpu proti hostiteli (GVHD) [51].
Nové molekuly (inhibitory BCR/BCL2) pravděpodobně změní doporučení pro indikaci nebo minimálně pro načasování alogenní transplantace a transplantace se bude zvažovat ještě s větším důrazem na individuální situaci konkrétního pacienta. Transplantaci není v současné době nutné provádět u CLL s aberací TP53 v první remisi, s ohledem na to, že je velká šance na dosažení druhé remise novými molekulami nebo protilátkami. Indikace se více přesouvá do období relapsu onemocnění a kandidáty transplantace se stávají nemocní s relabující/refrakterní CLL a nedostatečnou odpovědí na tyto moderní léky [51].
Pacientům s vysoce rizikovou CLL by měla být v současné době nabídnuta některá z nových molekul (ibrutinib, idelalisib), nejlépe v rámci klinických studií [7]. Po dosažení odpovědi může být zvažována konsolidace alogenní transplantací nebo pokračující léčba novými molekulami do progrese onemocnění. Transplantační přístup bude upřednostňován u relabující/refrakterní CLL s delecí 17p/mutací TP53, a to především u mladších pacientů s dobře kompatibilním dárcem [51]. Netransplantační cesta je naopak vhodnější pro starší nemocné s komorbiditami, zejména při absenci nepříznivé genetiky a nedostupnosti vhodného dárce.
Pro alogenní transplantaci se v současné době volí nejčastěji použití nemyeloablativního přípravného režimu, který přináší nižší peritransplantační mortalitu a možnost provést transplantaci u nemocných do 65 (výjimečně 70) let. Tato metoda je v současné praxi upřednostňována před klasickým myeloablativním přístupem [51].
4. 8 Transformace CLL (Richterův syndrom, RS)
Transformace CLL do jiné lymfoproliferace, nejčastěji difuzního velkobuněčného lymfomu (DLBCL), vzácně Hodgkinova lymfomu, je prognosticky vysoce nepříznivý jev. K transformaci dochází u 2–10 % pacientů v průběhu jejich onemocnění, s pravděpodobností 0,5–1 % za rok [52–54]. Na transformaci CLL je nutno pomýšlet při následujících nálezech: významné zvýšení laktátdehydrogenázy, progrese lymfadenopatie, zejména asymetrické v jedné oblasti, rozvoj B-příznaků, progrese při terapii. Při podezření na Richterův syndrom je možné využít vyšetření pozitronovou emisní tomografií v kombinaci s CT (PET/CT). K potvrzení Richterovy transformace je rozhodující exstirpace mízní uzliny s histologickým vyšetřením [53]. U nemocných s Richterovým syndromem je indikována léčba pro agresivní lymfomy, tzn. chemoimunoterapie využívající rituximab (R-CHOP a další režimy), včetně léčby transplantační. Hlavním faktorem, který určuje prognózu pacienta s RS, je klonální příslušnost DLBCL k přítomné CLL. Na základě sekvenování IGHV genu lze odlišit, že kolem 20 % případů transformace představuje nově vzniklý DLBCL, bez klonálního vztahu k CLL [53]. Prognóza tohoto RS je stejná jako u de novo vzniklého DLBCL; léčí se proto stejným způsobem, nejčastěji protokolem R-CHOP. Při nedosažení kompletní remise je indikována záchranná léčba následovaná autologní transplantací. V 80 % případů Richterovy transformace do DLBCL jde o onemocnění vzniklé klonálně z původní CLL s výrazně nepříznivou prognózou (medián přežití 8–14 měsíců). Jako úvodní léčba je opět vhodný režim R-CHOP a po chemoimunoterapii se zvažuje transplantační léčba. Alogenní transplantace je preferována u mladších nemocných v dobrém celkovém stavu a dostupným vhodným dárcem. Autologní transplantace pro Richterův syndrom se volí u nemocných, kteří nejsou kandidáty alogenní transplantace z důvodu věku či komorbidit. V případě transformace do Hodgkinova lymfomu se použije chemoterapie určená k léčbě tohoto onemocnění (např. ABVD) [53].
4. 9 Podpůrná léčba
Nemocní s CLL mají vysoké riziko infekčních komplikací, které souvisí jak s defekty imunity v důsledku působení choroby samotné, tak i v důsledku imunosuprese navozené léčbou. Podpůrná léčba je tedy cílena zejména na prevenci a včasnou léčbu širokého spektra infekcí včetně oportunních nákaz. U každého nemocného léčeného protokoly obsahujícími fludarabin či kortikoidy by měla být zvážena protiinfekční profylaxe (sulfametoxazol/trimetoprim, antivirotika, eventuálně antimykotika). Prevence pneumocystové pneumonie pomocí kombinace sulfametoxazol + trimetoprim či vhodné alternativy je nutná u všech nemocných na léčbě idelalisibem [64]. Kombinace sulfametoxazol/trimetoprim + antivirotika je povinná u protokolů obsahujících alemtuzumab či vysokodávkované kortikoidy [55–57]. Při léčbě alemtuzumabem či idelalisibem je dále nutná pravidelná klinická a laboratorní monitorování CMV reaktivace a v případě klinicky významné reaktivace CMV pak přerušení terapie a zahájení antivirotické léčby (ganciclovir, valganciklovir) [55, 64]. U nemocných s opakovanými bakteriálními infekcemi a sníženou sérovou koncentrací IgG pod 5 g/l by měla být vedle intimikrobiální profylaxe dále individuálně zvážena i substituce parenterálními imunoglobuliny [7, 58, 59]. U pacientů s CLL je dále doporučováno i každoroční očkování proti chřipce a pravidelné očkování proti pneumokokům (každých 5 let) [60]. Je nutné mít na paměti, že pacienti s CLL mají nižší odpověď na očkování a v době chřipkové sezony se doporučuje zvýšená pozornost i u těch nemocných, kteří očkování podstoupili. Pacienti léčení rituximabem by měli být očkováni až poté, co dojde k regeneraci B-lymfocytů. Pacientům s CLL se nesmí podávat živé vakcíny. Imunosupresivní terapie může vést také k reaktivaci hepatitidy B nebo C, proto by pacienti před léčbou CLL měli být vyšetřeni na hepatitidy B a C (HBsAg, anti-HBs, anti-HBc total a IgM, anti-HCV) (7) a v případě průkazu proběhlé infekce je vhodné pacienta dále konzultovat s hepatologem či infektologem, v některých případech je nutná antivirotická profylaxe nebo terapie. U pacientů s CLL léčených chemoterapií, imunoterapií či imunochemoterapií, u kterých dojde k rozvoji anémie, je vhodná léčba erytropoézu-stimulujícími proteiny (erytropoetin, darbepoetin) v souladu s mezinárodními doporučeními [61]. U nemocných, kteří jsou těžce imunosuprimováni, zejména po léčbě fludarabinem či alemtuzumabem a po alogenní transplantaci, stejně jako u nemocných, u kterých se uvažuje o provedení alogenní transplantace v budoucnu, by měly být používány ozářené transfuzní přípravky vzhledem ke zvýšenému riziku rozvoje reakce štěpu proti hostiteli spojené s transfuzí [58]. Vzhledem k tomu, že intenzivní léčebné protokoly, zejména protokoly obsahující fludarabin či alemtuzumab, jsou spojeny s vysokým rizikem febrilní neutropenie, je vhodné na základě individuálního rizika zvážit primární profylaxi febrilní neutropenie pomocí granulocytového kolonie stimulujícího faktoru (G-CSF) v souladu s doporučeními mezinárodních společností [62]. V případě výskytu febrilní neutropenie při léčbě je vhodné podat G-CSF v dalších cyklech léčby jako sekundární profylaxi febrilní neutropenie.
Nemocní s CLL mají 2–5krát vyšší riziko vzniku sekundárních malignit. Časté jsou zejména kožní nádory, dále karcinom prostaty, plicní a kolorektální karcinom [63]. Je proto vhodné myslet u těchto nemocných ve spolupráci s praktickým lékařem na pravidelný onkologický screening: vyšetření stolice na okultní krvácení, kontroly PSA u mužů, gynekologické vyšetření a mamografie u žen a dermatologické vyšetření [60].
Upozornění: Tato doporučení jsou pouze návodem, jak je možno u nemocných s CLL postupovat. Autoři nenesou žádnou právní zodpovědnost za obsah těchto doporučení ani volbu konkrétního postupu u konkrétního nemocného – ta je plně zodpovědností ošetřujícího lékaře.
Seznam použitých zkratek
ABVD – doxorubicin, bleomycin, vinblastin, dakarbazin
ANC – absolutní počet neutrofilů
ALC – absolutní počet lymfocytů
B2M – beta 2-mikroglobulin
BCR – B-buněčný receptor
BO – bendamustin + ofatumumab
BR – bendamustin + rituximab
CIRS – Cumulative Illness Rating Scale
CLL – chronická lymfocytární leukemie
CR – kompletní remise
DLBCL – difuzní B-velkobuněčný lymfom
ECOG – Eastern Cooperative Oncology Group
FCR – fludarabin, cyklofosfamid, rituximab
FISH – fluorescenční in situ hybridizace
G-CSF – faktor stimulující granulocytové kolonie
GVHD – reakce štěpu proti hostiteli
IGHV – variabilní část těžkého řetězce imunoglobulinu
LDH – laktátdehydrogenáza
MBL – monoklonální B-buněčná lymfocytóza
MRN – minimální reziduální nemoc
IWCLL – International Workshop on Chronic Lymphocytic Leukemia
PD – progresivní choroba
PR – parciální remise
PR-L – parciální remise s lymfocytózou
R – rituximab
R-CHOP – rituximab, cyklofosfamid, doxorubicin, vinkristin, prednizon
R-DHAP – rituximab, dexametazon, cytosin-arabinosid, cisplatina
RCD – rituximab, cyklofosfamid, dexametazon
SD – stabilní onemocnění
SLL – lymfom z malých lymfocytů
Podíl autorů na přípravě rukopisu
Všichni autoři se podíleli na napsání rukopisu, připomínkování, kritické korektuře a schválení finální verze.
Poděkování
Tato práce byla podpořena granty IGA MZ ČR NT13412-4/2012, IGA MZ ČR NT 13576, IGA MZ ČR NT13493-4/2012, IGA-LF-2016-001, AZV MZ ČR č. 15-30015A-4/2015 a 15-31834A/2015, RVO MZ ČR (FNHK, 00179906) a programem PRVOUK P37/08 a PRVOUK P27/LF1/1.
Prohlášení o spolupráci s farmaceutickými společnostmi
L. Smolej: Gilead, Janssen-Cilag, GlaxoSmithKline, Roche, Abbvie (honoráře za přednáškovou činnost a konzultace, cestovní granty).
M. Špaček: Gilead, Janssen-Cilag, Mundipharma a Roche (honoráře za přednáškovou činnost, cestovní granty).
M. Brejcha: Janssen-Cilag, Roche, Baxter (honoráře za přednáškovou činnost, cestovní granty).
R. Urbanová: Roche (honoráře za přednáškovou činnost, cestovní granty).
P. Obrtlíková: Gilead, Janssen-Cilag, Roche (honoráře za přednáškovou činnost a konzultace, cestovní granty).
D. Lysák: Gilead, Janssen-Cilag, Roche (honoráře za přednáškovou činnost a konzultace, cestovní granty).
M. Doubek: AOP Orphan, ARIAD, Gilead, Janssen-Cilag, Novartis, Roche (honoráře za přednáškovou činnost a konzultace, cestovní granty)
Doručeno do redakce dne 21. března 2016.
Přijato po recenzi dne 9. května 2016.
doc. MUDr. Lukáš Smolej, Ph.D.
IV. interní hematologická klinika
Fakultní nemocnice Hradec Králové
a Univerzita Karlova v Praze
Lékařská fakulta v Hradci Králové
Sokolská 581
500 03 Hradec Králové
e-mail: SmolejL@lfhk.cz
Zdroje
1. Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 2008;111 : 5446–5456.
2. Dearden C. B - and T-cell prolymphocytic leukemia: antibody approaches. Hematology Am Soc Hematol Educ Program 2012;2012 : 645–651.
3. Moreau EJ, Matutes E, A’Hern RP, et al. Improvement of the chronic lymphocytic leukemia scoring system with the monoclonal antibody SN8 (CD79b). Am J Clin Pathol 1997;108 : 378–382.
4. Strati P, Shanafelt TD. Monoclonal B-cell lymphocytosis and early-stage chronic lymphocytic leukemia: diagnosis, natural history, and risk stratification. Blood 2015;126 : 454–462.
5. Rai KR, Sawitsky A, Cronkite EP, Chanana AD, Levy RN, Pasternack BS. Clinical staging of chronic lymphocytic leukemia. Blood 1975;46 : 219–234.
6. Binet JL, Auquier A, Dighiero G, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981;48 : 198–206.
7. Eichhorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-updagger. Ann Oncol 2015;26 Suppl 5: v78–v84.
8. Dohner H, Stilgenbauer S, Benner A, et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000;343 : 1910–1916.
9. Ghia P, Stamatopoulos K, Belessi C, et al. ERIC recommendations on IGHV gene mutational status analysis in chronic lymphocytic leukemia. Leukemia 2007;21 : 1–3.
10. Malcikova J, Pavlova S, Kozubik KS, Pospisilova S. TP53 mutation analysis in clinical practice: lessons from chronic lymphocytic leukemia. Hum Mutat 2014;35 : 663–671.
11. Cramer P, Hallek M. Prognostic factors in chronic lymphocytic leukemia-what do we need to know? Nat Rev Clin Oncol 2011;8 : 38–47.
12. Pospisilova S, Gonzalez D, Malcikova J, et al. ERIC recommendations on TP53 mutation analysis in chronic lymphocytic leukemia. Leukemia 2012;26 : 1458–1461.
13. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976;16 : 31–41.
14. Hallek M. Chronic lymphocytic leukemia: 2015 Update on diagnosis, risk stratification, and treatment. Am J Hematol 2015;90 : 446–460.
15. Thurmes P, Call T, Slager S, et al. Comorbid conditions and survival in unselected, newly diagnosed patients with chronic lymphocytic leukemia. Leuk Lymphoma 2008;49 : 49–56.
16. Extermann M, Overcash J, Lyman GH, Parr J, Balducci L. Comorbidity and functional status are independent in older cancer patients. J Clin Oncol 1998;16 : 1582–1587.
17. Goede V, Cramer P, Busch R, et al. Interactions between comorbidity and treatment of chronic lymphocytic leukemia: results of German Chronic Lymphocytic Leukemia Study Group trials. Haematologica 2014;99 : 1095–1100.
18. Parmelee PA, Thuras PD, Katz IR, Lawton MP. Validation of the Cumulative Illness Rating Scale in a geriatric residential population. J Am Geriatr Soc 1995;43 : 130–137.
19. Salvi F, Miller MD, Grilli A, et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly patients. J Am Geriatr Soc 2008;56 : 1926–1931.
20. Cheson BD, Byrd JC, Rai KR, et al. Novel targeted agents and the need to refine clinical end points in chronic lymphocytic leukemia. J Clin Oncol 2012;30 : 2820–2822.
21. Cramer P, Langerbeins P, Eichhorst B, Hallek M. Advances in first-line treatment of chronic lymphocytic leukemia: current recommendations on management and first-line treatment by the German CLL Study Group (GCLLSG). Eur J Haematol 2016;96 : 9–18.
22. Hallek M, Fischer K, Fingerle-Rowson G, et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet 2010;376 : 1164–1174.
23. Zelenetz AD, Gordon LI, Wierda WG, et al. Chronic lymphocytic leukemia/small lymphocytic lymphoma, version 1.2015. J Natl Compr Canc Netw 2015;13 : 326–362.
24. Farooqui MZ, Valdez J, Martyr S, et al. Ibrutinib for previously untreated and relapsed or refractory chronic lymphocytic leukaemia with TP53 aberrations: a phase 2, single-arm trial. Lancet Oncol 2015;16 : 169–176.
25. Hillmen P, Skotnicki AB, Robak T, et al. Alemtuzumab compared with chlorambucil as first-line therapy for chronic lymphocytic leukemia. J Clin Oncol 2007;25 : 5616–5623.
26. Eichhorst B, Fink AM, Busch R, et al. Frontline chemoimmunotherapy with fludarabine (F), cyclophosphamide (C), and rituximab (R) (FCR) shows superior efficacy in comparison to bendamustine (B) and rituximab (BR) in previously untreated and physically fit patients (pts) with advanced chronic lymphocytic leukemia (CLL): final analysis of an international, randomized study of the German CLL Study Group (GCLLSG) (CLL10 Study). Blood 2014; 124 : 19.
27. Michallet AS, Rossignol J, Cazin B, Ysebaert L. Rituximab-cyclophosphamide-dexamethasone combination in management of autoimmune cytopenias associated with chronic lymphocytic leukemia. Leuk Lymphoma 2011;52 : 1401–1403.
28. Goede V, Fischer K, Busch R, et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014;370 : 1101–1110.
29. Goede V, Fischer K, Engelke A, et al. Obinutuzumab as frontline treatment of chronic lymphocytic leukemia: updated results of the CLL11 study. Leukemia 2015;29 : 1602–1604.
30. Hillmen P, Robak T, Janssens A, et al. Chlorambucil plus ofatumumab versus chlorambucil alone in previously untreated patients with chronic lymphocytic leukaemia (COMPLEMENT 1): a randomised, multicentre, open-label phase 3 trial. Lancet 2015;385 : 1873–1883.
31. Michallet AS, Aktan M, Schuh A, et al. MABLE: Rituximab in combination with bendamustine or chlorambucil for the treatment of chronic lymphocytic leukemia: primary results from the randomized phase IIIb MABLE study. XVI. International Workshop on CLL 2015, abstract 88.
32. Hillmen P, Gribben JG, Follows GA, et al. Rituximab plus chlorambucil as first-line treatment for chronic lymphocytic leukemia: Final analysis of an open-label phase II study. J Clin Oncol 2014;32 : 1236–1241.
33. Offner F, Panagiotidis P, Afanasyev B, et al. Ofatumumab and bendamustine combination therapy in patients with untreated and relapsed chronic lymphocytic leukemia: initial results of the phase II study OMB115991. XV. International Workshop on CLL 2013, abstract 4.2.
34. Smolej L, Brychtova Y, Doubek M, et al. Low-dose FCR is a safe and effective treatment option for elderly/comorbid patients with chronic lymphocytic leukemia/small lymphocytic lymphoma. Updated results of project Q-Lite by Czech CLL Study Group. Blood 2014;124 : 4670.
35. Byrd JC, Brown JR, O’Brien S, et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014;371 : 213–223.
36. Furman RR, Sharman JP, Coutre SE, et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014;370 : 997–1007.
37. Keating MJ, Flinn I, Jain V, et al. Therapeutic role of alemtuzumab (Campath-1H) in patients who have failed fludarabine: results of a large international study. Blood 2002;99 : 3554–3561.
38. Stilgenbauer S, Zenz T, Winkler D, et al. Subcutaneous alemtuzumab in fludarabine-refractory chronic lymphocytic leukemia: clinical results and prognostic marker analyses from the CLL2H study of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2009;27 : 3994–4001.
39. Fischer K, Cramer P, Busch R, et al. Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2011;29 : 3559–3566.
40. Robak T, Dmoszynska A, Solal-Celigny P, et al. Rituximab plus fludarabine and cyclophosphamide prolongs progression-free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010;28 : 1756–1765.
41. Badoux XC, Keating MJ, Wang X, et al. Fludarabine, cyclophosphamide, and rituximab chemoimmunotherapy is highly effective treatment for relapsed patients with CLL. Blood 2011;117 : 3016–3024.
42. Wierda WG, Kipps TJ, Mayer J, et al. Ofatumumab as single-agent CD20 immunotherapy in fludarabine-refractory chronic lymphocytic leukemia. J Clin Oncol 2010;28 : 1749–1755.
43. Smolej L, Doubek M, Panovska A, et al. Rituximab in combination with high-dose dexamethasone for the treatment of relapsed/refractory chronic lymphocytic leukemia. Leuk Res 2012;36 : 1278–1282.
44. Doubek M, Brychtova Y, Panovska A, et al. Ofatumumab added to dexamethasone in patients with relapsed or refractory chronic lymphocytic leukemia. results from a phase II study. Am J Hematol 2015;90 : 417–421.
45. Durot E, Michallet AS, Lepretre S, Le QH, Leblond V, Delmer A. Platinum and high-dose cytarabine-based regimens are efficient in ultra high/high-risk chronic lymphocytic leukemia and Richter’s syndrome: results of a French retrospective multicenter study. Eur J Haematol 2015;95 : 160–167.
46. Byrd JC, Furman RR, Coutre SE, et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013;369 : 32–42.
47. Byrd JC, Furman RR, Coutre SE, et al. Three-year follow-up of treatment-naive and previously treated patients with CLL and SLL receiving single-agent ibrutinib. Blood 2015;125 : 2497–2506.
48. Bottcher S, Ritgen M, Fischer K, et al. Minimal residual disease quantification is an independent predictor of progression-free and overall survival in chronic lymphocytic leukemia: a multivariate analysis from the randomized GCLLSG CLL8 trial. J Clin Oncol 2012;30 : 980–988.
49. Logan AC, Zhang B, Narasimhan B, et al. Minimal residual disease quantification using consensus primers and high-throughput IGH sequencing predicts post-transplant relapse in chronic lymphocytic leukemia. Leukemia 2013;27 : 1659–1665.
50. Dreger P, Corradini P, Kimby E, et al. Indications for allogeneic stem cell transplantation in chronic lymphocytic leukemia: the EBMT transplant consensus. Leukemia 2007;21 : 12–17.
51. Dreger P, Schetelig J, Andersen N, et al. Managing high-risk CLL during transition to a new treatment era: stem cell transplantation or novel agents? Blood 2014;124 : 3841–3849.
52. Rossi D, Gaidano G. Richter syndrome: molecular insights and clinical perspectives. Hematol Oncol 2009;27 : 1–10.
53. Parikh SA, Kay NE, Shanafelt TD. How we treat Richter syndrome. Blood 2014;123 : 1647–1657.
54. Parikh SA, Shanafelt TD. Risk factors for Richter syndrome in chronic lymphocytic leukemia. Curr Hematol Malig Rep 2014;9 : 294–299.
55. Osterborg A, Foa R, Bezares RF, et al. Management guidelines for the use of alemtuzumab in chronic lymphocytic leukemia. Leukemia 2009;23 : 1980–1988.
56. Smolej L. Valganciclovir versus valaciclovir for prevention of alemtuzumab-induced cytomegalovirus reactivation: what are the implications for routine clinical practice? Blood 2008;112 : 2167.
57. Smolej L, Procházka V, Špaček M, et al. Doporučení pro léčbu alemtuzumabem u chronické lymfocytární leukémie (CLL). Vnitř Lék 2012;58(3): 232–236.
58. Oscier D, Dearden C, Eren E, et al. Guidelines on the diagnosis, investigation and management of chronic lymphocytic leukaemia. Br J Haematol 2012;159 : 541–564.
59. Dhalla F, Lucas M, Schuh A, et al. Antibody deficiency secondary to chronic lymphocytic leukemia: Should patients be treated with prophylactic replacement immunoglobulin? J Clin Immunol 2014;34 : 277–282.
60. Shanafelt T. Treatment of older patients with chronic lymphocytic leukemia: key questions and current answers. Hematology Am Soc Hematol Educ Program 2013;2013 : 158–167.
61. Bokemeyer C, Aapro MS, Courdi A, et al. EORTC guidelines for the use of erythropoietic proteins in anaemic patients with cancer: 2006 update. Eur J Cancer 2007;43 : 258–270.
62. Aapro MS, Bohlius J, Cameron DA, et al. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours. Eur J Cancer 2011;47 : 8–32.
63. Tsimberidou AM, Wen S, McLaughlin P, et al. Other malignancies in chronic lymphocytic leukemia/small lymphocytic lymphoma. J Clin Oncol 2009;27 : 904–910.
64. Idelalisib (Zydelig) – Souhrn údajů o přípravku (SPC). Dostupné na www: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ - _Product_Information/ human/003843/WC500175377.pdf. Stránka navštívena 3.5.2016.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo 2- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Liečba starších pacientov s myelodysplastickým syndrómom, nevhodných na intenzívnu terapiu a jej finančné dôsledky – skúsenosti jedného centra
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) České skupiny pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP
- Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP
- Cena České hematologické společnosti za nejlepší původní vědeckou práci v oboru hematologie v roce 2015
- Výběr z tisku a zprávy o knihách
- Analýza vztahu výsledků cytogenetického vyšetření k poměru volných lehkých řetězců κ/λ (FLC-r, FreeliteTM), páru těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM ) a vybraných prognostických faktorů vyšetřených při diagnóze mnohočetného myelomu
- Využití interfázní fluorescenční in situ hybridizace pro analýzu CD34+ buněk v periferní krvi u nemocných s myelodysplastickými syndromy
- Profylaxe versus léčba „on demand“ u dospělých pacientů s těžkou hemofilií A – zkušenosti z FN Brno
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP
- Liečba starších pacientov s myelodysplastickým syndrómom, nevhodných na intenzívnu terapiu a jej finančné dôsledky – skúsenosti jedného centra
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) České skupiny pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP
- Profylaxe versus léčba „on demand“ u dospělých pacientů s těžkou hemofilií A – zkušenosti z FN Brno
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



