-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Využití interfázní fluorescenční in situ hybridizace pro analýzu CD34+ buněk v periferní krvi u nemocných s myelodysplastickými syndromy
Application of interphase fluorescence in situ hybridisation for the analysis of CD34+ cells in peripheral blood of patients with myelodysplastic syndromes
Classical cytogenetic analysis of bone marrow cells is the standard for evaluating chromosomal aberrations in patients with myelodysplastic syndromes (MDS). However, there are several factors affecting the success of this method, such as the degree of cell proliferation, quality of preparations or size of pathological clone. In these cases, it is possible to use interphase fluorescence in situ hybridization (I-FISH), which allows detection of chromosomal aberrations in the nuclei of interphase cells. In this study, we used the I-FISH method to screen chromosomal aberrations in peripheral blood circulating CD34+ cells. Our objective was to evaluate the frequency of chromosomal aberrations in CD34+ cells isolated from peripheral blood, to compare this with the results of I-FISH analysis of bone marrow cells and to assess the significance of this method for monitoring the effect of therapy in patients with MDS.
We examined 22 samples of CD34+ cells separated from the peripheral blood of 16 patients with MDS (13 females, 3 males; 11 x 5q - syndromes, 4x MDS RCMD and 1x MDS/MPS). Four patients were investigated repeatedly.
I-FISH on the separated CD34+ cells confirmed the prior findings in bone marrow in all the patients examined – 14 patients had deletion of chromosome 5 in the 5q31 region, one patient had deletion of chromosome 20q11q12 and one patient had monosomy of chromosome 7. In our work, we demonstrated that isolation of CD34+ cells followed by I-FISH analysis is a practical, non-invasive method that can detect specific chromosomal abnormalities present in the pathological clone. This method has a predictive value and can be used for continuous disease control as well as for monitoring the pathological clone dynamics following treatment.Key words:
CD34+ cells – I-FISH – myelodysplastic syndromes
Autoři: Š. Ransdorfová 1; J. Březinová 1; I. Šárová 1,2; M. Beličková 1; A. Jonášová 3; R. Neuwirtová 3; Z. Zemanová 2; J. Čermák 1; K. Michalová 1,2
Působiště autorů: Ústav hematologie a krevní transfuze, Praha 1; Centrum nádorové cytogenetiky, Ústav lékařské biochemie a laboratorní diagnostiky VFN a 1. LF UK, Praha 2; 1. interní klinika VFN a 1. LF UK, Praha 3
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 2, p. 90-96.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Klasická cytogenetická analýza buněk kostní dřeně je základním standardem pro vyšetření pacientů s myelodysplastickými syndromy (MDS). Pro detekci chromozomových aberací v jádrech nedělících se buněk lze využít interfázní fluorescenční in situ hybridizaci (I-FISH). Jako alternativu k I-FISH analýze buněk kostní dřeně jsme v této práci využili metodu I-FISH pro analýzu chromozomových aberací v CD34+ buňkách cirkulujících v periferní krvi. Cílem bylo hodnotit metodou I-FISH frekvenci chromozomových aberací v CD34+ buňkách izolovaných z periferní krve, porovnat ji s výsledky I-FISH analýz buněk kostní dřeně a posoudit možnost využití této metody k monitorování úspěšnosti terapie u nemocných s MDS. Vyšetřili jsme celkem 22 vzorků CD34+ buněk separovaných z periferní krve šestnácti pacientů s MDS (13 žen; 3 muži; 11krát 5q - syndrom, 4krát MDS RCMD a 1krát MDS/MPS). Čtyři nemocní byli vyšetřeni opakovaně. Metoda I-FISH na separovaných CD34+ buňkách potvrdila předchozí nálezy v buňkách kostní dřeně u všech vyšetřených pacientů – 14 nemocných mělo deleci chromozomu 5 v oblasti 5q31, u jednoho nemocného byla nalezena delece chromozomu 20 v oblasti 20q11q12 a u jednoho nemocného monozomie chromozomu 7. V naší práci jsme prokázali, že izolace CD34+ buněk a následná I-FISH analýza je praktická neinvazivní metoda, která dokáže zachytit specifické chromozomové abnormality přítomné v kostní dřeni. Vyšetření lze tedy vhodně využít pro šetrnější kontrolu onemocnění a ke sledování dynamiky patologického klonu po léčbě.
KLÍČOVÁ SLOVA:
CD34+ buňky – I-FISH – myelodysplastické syndromyÚVOD
Myelodysplastické syndromy (MDS) zahrnují heterogenní skupinu hematologických malignit charakterizovaných onemocněním pluripotentní hematopoetické buňky. Změny vedou k neefektivní hematopoeze, morfologické dysplazii krvetvorných buněk a současné periferní cytopenii postihující jednu či více krvetvorných linií. Přítomna je rovněž abnormální imunitní odpověď organismu vedoucí k aktivaci cytotoxických T-lymfocytů a zvýšené produkci cytokinů indukujících apoptózu, zejména zralejších forem krvetvorby [1, 2]. Incidence MDS je udávána 2–3 případy na 100 000 obyvatel ročně. Výskyt MDS u dětí a mladých dospělých osob je nízký, ale stoupá s věkem nad 50 let, ve věkové skupině nad 60 let je incidence 15–50 nemocných na 100 000. U 10–20 % pacientů dochází k postupnému rozvoji onemocnění a k transformaci do akutní myeloidní leukemie (AML).
Klasická cytogenetická analýza buněk kostní dřeně (KD) detekuje klonální chromozomové aberace u 50–60 % dospělých nemocných s primárními MDS a až u 80 % nemocných se sekundárním typem onemocnění [3]. Nález abnormálního karyotypu je jedním ze základních parametrů při hodnocení patogeneze a prognózy onemocnění. Vzhledem k tomu, že MDS jsou z hlediska morfologické prezentace, klinického průběhu i cytogenetických nálezů velmi heterogenní, prošlo rozdělení do jednotlivých skupin značným vývojem. Nejnovější publikace rozdělují MDS podle cytogenetického nálezu do 5 prognostických podskupin [4, 5]. Do kategorie velmi dobrá prognóza patří samostatná delece dlouhých ramen chromozomu 11, del(11)(q) a ztráta gonozomu Y. Normální karyotyp, samostatná delece dlouhých ramen chromozomu 5 a 20, del(5)(q) a del(20)(q) a delece krátkých ramen chromozomu 12, del(12)(p) řadí nemocné do skupiny s dobrou prognózou. V kategorii střední prognóza jsou zařazeny delece dlouhých ramen chromozomu 7, del(7)(q), trizomie chromozomu 8 (+8), izochromozom dlouhých ramen chromozomu 17, i(17)(q) a trizomie chromozomů 19 a 21. Do skupiny s nepříznivou prognózou jsou řazeni nemocní se samostatnou monozomií chromozomu 7 (-7), derivovaným chromozomem 3, der(3)(q) a komplexními změnami karyotypu zahrnujícími 3 změny. Velmi špatnou prognózu představují komplexní přestavby karyotypu s více jak třemi změnami [6]. Mezi nejčastější chromozomové aberace u MDS patří intersticiální delece dlouhých ramen chromozomu 5 (5q) vyskytující se u 10–15 % nemocných [7]. WHO klasifikace (World Health Organization, 2008) řadí nemocné s přítomností samostatné delece 5q spolu s dalšími specifickými znaky (absence Auerových tyčí, < 5 % blastů v KD, < 1 % blastů v periferní krvi a další morfologické změny) do podtypu MDS, nazývaného 5q-syndrom [8]. Pacienti s 5q - syndromem mají relativně jednotný fenotyp a nízkou pravděpodobnost transformace do AML [9]. Tento syndrom byl popsán už Van den Berghem v roce 1974 a jeho klinický popis platí dodnes [10]. Společným deletovaným úsekem (CDR) pacientů s 5q-syndromem je oblast 5q32-q33.1 [11]. Onemocněním jsou postiženy převážně ženy (více než 80 % případů), příčina tohoto jevu není známa. V poslední době se v souvislosti s 5q-syndromem hovoří o pacientech, kteří mají spolu s del(5)(q) druhý nepříbuzný klon s trizomií chromozomu 8. Vzhledem ke klinickému průběhu onemocnění se zvažuje zařazení těchto případů biklonality do samostatné podskupiny 5q - syndromu [12].
V roce 2001 Vehmeyer et al. [13] dokázali, že u MDS pacientů se zvyšuje počet CD34+ progenitorových buněk cirkulujících v periferní krvi (PK). Obvyklé zastoupení CD34+ buněk je přibližně 0,5–3 % v kostní dřeni a 0,05 až 0,2 % v PK. U nemocných s MDS se zastoupení těchto buněk v PK zvyšuje na 0,2–1,5 % [14]. Studie CD34+ buněk v KD pacientů s AML a MDS prokázaly výskyt klonálních chromozomových aberací [15]. V současné době je proto snaha využít přítomnost CD34+ buněk v PK k méně invazivní detekci těchto změn.
Cílem této práce bylo zhodnotit výskyt a procentuální zastoupení chromozomových abnormalit v CD34+ buňkách izolovaných z PK u nemocných s MDS v průběhu onemocnění metodou I-FISH, porovnat ji s výsledky interfázní fluorescenční in situ hybridizace (I-FISH) v buňkách kostní dřeně (KD) a posoudit možnost využití této metody k monitorování úspěšnosti terapie.
SOUBOR NEMOCNÝCH
Metodou I-FISH jsme vyšetřili celkem 22 vzorků CD34+ buněk separovaných z PK od 16 nemocných. Čtyři pacienti byli vyšetřeni opakovaně, z toho u jedné pacientky jsme provedli vyšetření na 4 vzorcích CD34+ buněk v průběhu onemocnění. Skupinu nemocných tvořilo 13 žen a 3 muži ve věku od 20 do 82 let, medián 70 let. Nejčastěji zastoupenou diagnózou byl 5q-syndrom u 11 nemocných, čtyři pacienti měli refrakterní cytopenii s dysplazií ve více řadách (MDS RCMD) a jeden myelodysplastický/myeloproliferativní syndrom (MDS/MPS).
Metody
Konvenční cytogenetická analýza
U všech pacientů byla při stanovení diagnózy provedena konvenční cytogenetická analýza buněk KD. Nestimulované buňky KD byly kultivovány 24 hodin při 37 ˚C v médiu pro kultivaci kostní dřeně Marrow Grow (Cytogen, GmbH, Germany) s následným G-pruhováním podle klasických cytogenetických postupů. Při dostatečném počtu dělících se buněk jsme vyhodnotili u každého nemocného 20 metafází. Karyotypy jsme popsali podle mezinárodní nomenklatury ISCN 2013 (International system for human cytogenetic nomenclature) [16].
I-FISH, mFISH, mBAND
Sondy pro I-FISH byly zvoleny na základě výsledků klasické cytogenetické analýzy buněk KD. Preparáty jsme připravili ze stejné buněčné suspenze jako pro cytogenetické vyšetření KD a ze suspenze izolovaných CD34+ buněk PK. Pro detekci delece 5q jsme použili dvoubarevnou lokus-specifickou sondu Vysis LSI 5q31/5p15.2 (Abbott Molecular, USA) nebo ON MDS 5q - EGR1 5q31; CSF1R 5q33/hTERT 5p15 Triple-Color (Kreatech Biotechnology B.V., The Netherlands). U jednoho nemocného byla použita k průkazu delece dlouhých ramen chromozomu 20 dvoubarevná sonda ON PTPRT 20q11/20q12 (Kreatech Biotechnology B.V., The Netherlands) a u jednoho pacienta sonda pro ověření monozomie chromozomu 7 Vysis LSI 7q31/CEP 7 (Abbott Molecular, USA). Preparáty byly analyzovány ve fluorescenčním mikroskopu Axio Imager.Z1 (Carl Zeiss, Germany) a výsledný obraz byl zpracován softwarem pro I-FISH (ISIS, MetaSystems, Germany). Vždy jsme hodnotili 200 interfázních jader či CD34+ buněk, hodnota „cut-off value“ byla stanovena na 5 %. K ověření komplexních chromozomových aberací nalezených konvenčními technikami u jednoho nemocného byla použita metoda mnohobarevné FISH (mFISH) (MetaSystems, Germany) a mnohobarevného pruhování (mBAND, MetaSystems, Germany). Metody byly prováděny podle standardních postupů doporučených výrobci.
Izolace CD34+ buněk
V průběhu onemocnění byly analyzovány CD34+ buňky izolované z PK. Cirkulující CD34+ buňky z PK byly odděleny pomocí magneticky aktivované separace buněk Auto MACS separátorem (magnetic-activated cell sorting, Miltenyi Biotec, Bergisch Gladbach, Germany). Pro izolaci byly použity mononukleární buňky – PBMCs (monocyty, lymfocyty) získané z 20 až 30 ml PK denzitní gradientovou centrifugací za pomocí Ficoll-Pague. Cílové buňky jsou zachyceny v separační koloně umístěné v magnetickém poli separátoru. Neoznačené buňky protékají separační kolonou a po odstranění separační kolony z magnetického pole jsou cílové buňky separovány do pozitivní frakce.
Statistické metody
K průkazu korelací mezi výsledky vyšetření byl použit t-test.
VÝSLEDKY
U všech 16 pacientů jsme při diagnóze provedli vyšetření buněk KD klasickou cytogenetickou analýzou a metodou I-FISH (tab. 1). Čtrnáct nemocných mělo deleci dlouhých ramen chromozomu 5, u 10 z nich se jednalo o samostatnou aberaci a u čtyř se del(5)(q) vyskytovala společně s dalšími cytogenetickými změnami. Nemocný č. 4 měl reciprokou translokaci t(2;11)(p21;q23), nemocný č. 6 deleci krátkých ramen chromozomu 12 v oblasti 12p13.3 až 12p11.2 a u nemocného č. 16 jsme detekovali deletovaný chromozom 5 zahrnutý do dalších chromozomových přestaveb. U pacientky č. 13 jsme prokázali dva nepříbuzné patologické klony, jeden s delecí del(5)(q13q33.3) a druhý s trizomií chromozomu 8. U dvou pacientů jsme identifikovali pomocí klasické cytogenetiky chromozomové aberace, které nezahrnovaly chromozom 5 – nemocná č. 2 měla deleci dlouhých ramen chromozomu 20 v oblasti 20q11 až 20q12 jako samostatnou aberaci a nemocný č. 15 monozomii chromozomu 7. Nálezy klasické cytogenetiky v buňkách KD jsme u všech nemocných potvrdili metodou I-FISH za pomoci komerčně dodávaných sond.
Tab. 1. Souhrn cytogenetických dat nemocných 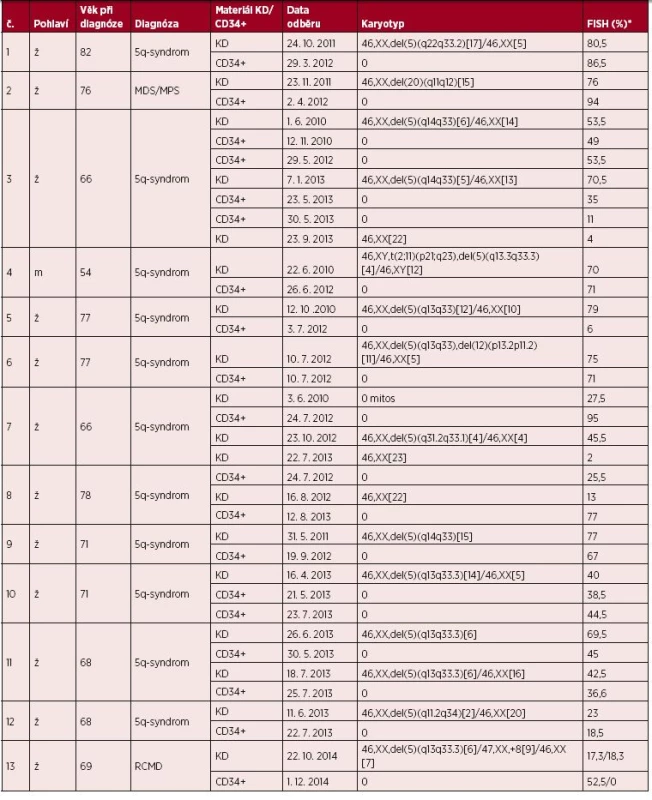

*FISH výsledky – procentuální zastoupení patologického klonu v buňkách KD a v CD34+ buňkách Legenda: KD – kostní dřeň, MDS – myelodysplastický syndrom, MPS – myeloproliferativní syndrom, FISH – fluorescenční in situ hybridizace, ž – žena, m – muž, RCMD – refrakterní cytopenie s dysplazií ve více řadách U všech 16 pacientů jsme rovněž provedli I-FISH vyšetření CD34+ buněk izolovaných z PK. Výsledky zobrazuje tabulka 1. Čtyři pacienti byli vyšetřeni opakovaně, z toho u jedné nemocné (č. 3) jsme v průběhu onemocnění provedli I-FISH vyšetření na čtyřech vzorcích CD34+ buněk z PK. Celkem 6 nemocných mělo odběry KD a PK provedeny ve stejný den nebo v rozmezí jednoho měsíce. U 10 nemocných byl časový odstup větší než 1 měsíc. Statistická analýza výsledků I-FISH KD a CD34+ buněk pomocí t-testu u všech 16 nemocných neprokázala významnou korelaci, ale ani odlišnost těchto hodnot (na zvolené hladině významnosti 0,05). U 11 nemocných rozdíl procentuálního zastoupení patologických klonů v buňkách KD a v CD34+ (graf 1) nepřesahoval 18 %. U těchto pacientů spolu hodnoty CD34+ a KD statisticky významně korelovaly, a to na hladině významnosti 0,001. Pouze u pěti pacientů se zastoupení klonů lišilo zásadněji, o více než 35 %. V případě nemocných č. 5, 7 a 13 se jednalo o velký časový odstup mezi odběry. Pacientka č. 5 měla v odběru KD při diagnóze v r. 2010 zachycenou deleci oblasti 5q31 v 79 % interfázních jader. Po dvou letech léčby lenalidomidem a dosažení celkové hematologické remise bylo v separovaných CD34+ buňkách detekováno pouze 6 % buněk s delecí 5q31 (obr. 1). Naopak pacientka č. 7 měla při vstupním vyšetření KD deleci oblasti 5q31 v 27,5 % buněk a 3,5 % blastů v PK. Po léčbě lenalidomidem (1/2011 až 8/2011) se krevní obraz znormalizoval a byla přerušena terapie (pojišťovna odmítla dál hradit léčbu). U pacientky od 4/2012 následovala progrese onemocnění, pokles hemoglobinu, zmnožení blastů na 13 % a závislost na transfuzích. Deleci 5q31 jsme detekovali 7/2012 již v 95 % CD34+ buněk. V následujících odběrech, po léčbě azacitidinem, se procento patologických buněk snížilo na 2 % (pod hranici cut-off) a pacientka je v současné době v celkové hematologické remisi. Pacientka č. 13 měla v odběru KD při vstupním vyšetření v r. 2013 nalezeny pomocí I-FISH dva izolované klony. Jeden s delecí del(5)(q13q33.3) v 57 % a druhý s trizomií chromozomu 8 v 8,5 % interfázních jader. Během léčby lenalidomidem (03/2014 až 11/2014) se snížil klon s delecí chromozomu 5 na 17,3 %. Po léčbě ale následovala progrese onemocnění, krvácivé stavy a deleci 5q31 jsme detekovali 12/2014 v 52,5 % CD34+ buněk. U dvou nemocných (č. 15, 16) bylo procentuální zastoupení patologického klonu v CD34+ buňkách vyšší oproti buňkám KD. Pacient č. 15 měl v odběru KD při diagnóze (02/2015) monozomii chromozomu 7 zachycenou v 18 % interfázních jader. V následujícím odběru KD 03/2015 se zvýšil patologický klon na 28,5 % interfázních jader, došlo k zmnožení blastů v PK na 7,2 % a současně cytologický nález svědčil o progresi onemocnění. V izolovaných CD34+ buňkách odběru PK téhož dne jsme detekovali vysoké procento patologického klonu (89 %). U nemocného č. 16 jsme v prvním odběru KD (10/2014) prokázali pomocí I-FISH aberovaný chromozom 5 v 28,5 % interfázních jader. V dalším odběru KD (04/2015) jsme zaznamenali již zvýšené procento patologického klonu (61 % interfázních jader), zvýšil se počet blastů v PK na 13,4 % a cytologický nález svědčil pro trvající onemocnění MDS RCMD. V odběru PK z téhož dne jsme detekovali patologický klon ve všech izolovaných CD34+ buňkách (100 %).
Graf 1. Srovnání procentuálního zastoupení I-FISH nálezů v buňkách KD a v CD34+ buňkách PK u 16 nemocných 
Obr. 1. Výsledek I-FISH na separovaných CD34+ buňkách u nemocné č. 1 Trojbarevná sonda ON MDS 5q- EGR1 5q31; CSF1R 5q33/hTERT 5p15; vlevo buňka s delecí oblasti 5q31 a 5q33 (zelený signál 1krát a červený signál 1krát), modrý kontrolní signál (2krát) pro oblast 5p15, vpravo buňka s normálním nálezem. 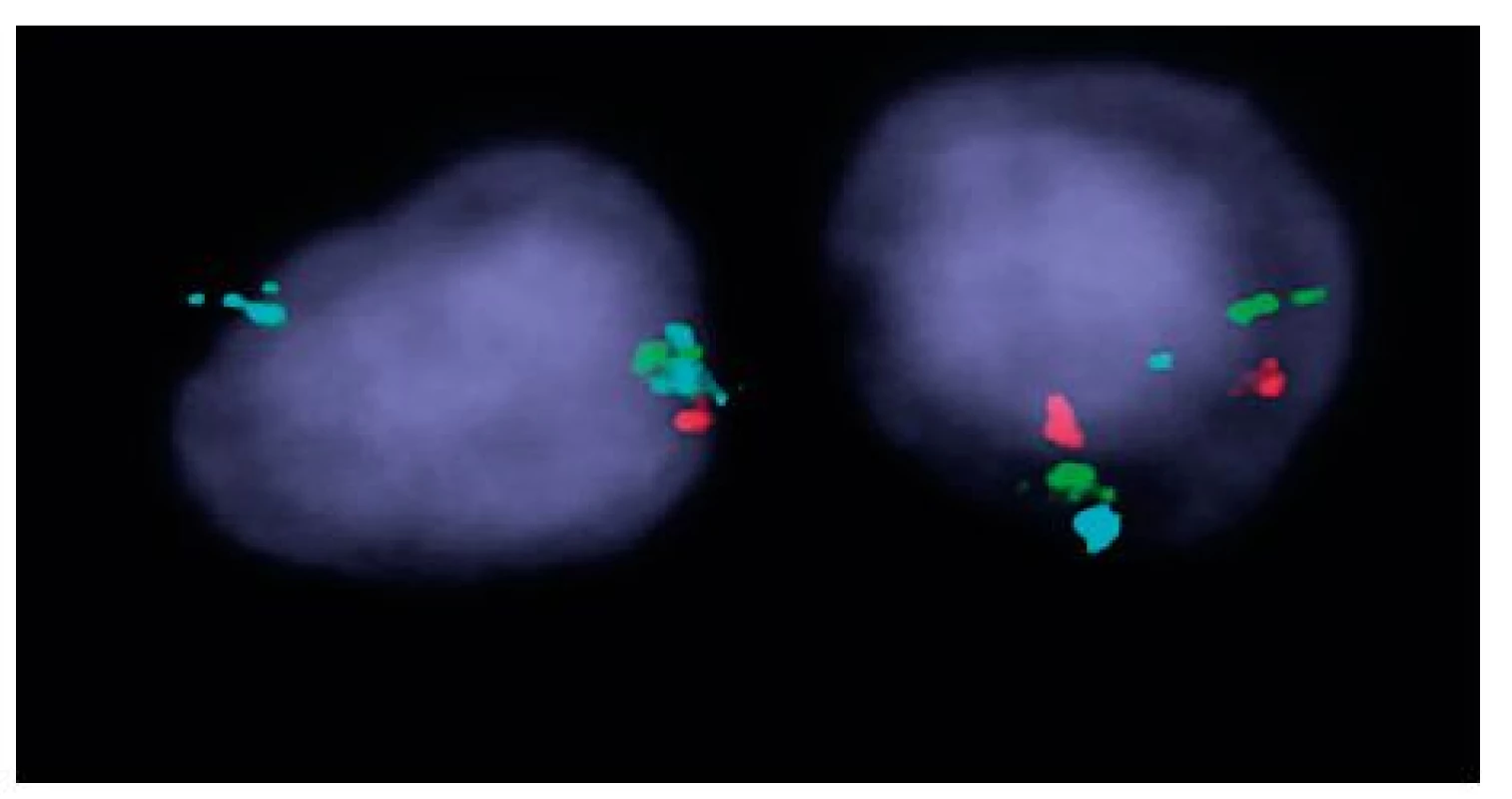
DISKUSE
Cytogenetická analýza a cytomorfologie jsou standardem pro vyšetření nemocných s MDS. V naší práci jsme se zaměřili na analýzu CD34+ buněk cirkulujících v PK, které představují obecně primární patologické hematopoetické buňky u MDS [15, 17]. K buněčné separaci lze využít techniku průtokové cytometrie nebo metodu magnetické separace buněk. Metoda MACS je založena na imunomagnetickém značení cílových buněk podle jejich povrchových antigenů monoklonální protilátkou, která je konjugována se superparamagnetickou partikulí [18].
Poprvé popisuje I-FISH analýzu CD34+ buněk izolovaných z PK jako novou metodu pro genetické sledování MDS pacientů Braulke et al. v roce 2010 [14]. Autoři separovali CD34+ buňky pomocí MACS separátoru celkem u 27 nemocných s MDS a označili ji jako citlivou a vhodnou k použití u všech pacientů. Rovněž naše výsledky ukazují, že I-FISH analýza cirkulujících CD34+ buněk v PK je schopna zachytit cytogenetické aberace přítomné v buňkách KD. Metoda I-FISH na buňkách KD potvrdila předchozí nálezy klasické cytogenetiky u všech 16 vyšetřených pacientů a následná I-FISH analýza separovaných CD34+ buněk z PK a KD ukázala statisticky významnou korelaci u 11 nemocných (69 %). Ve třech případech (č. 5, 7 a 13) se výsledky procentuálně rozcházely v důsledku časového odstupu mezi odběry KD a PK, odpovídaly ale aktuálnímu klinickému stavu nemocných. U dvou pacientů (č. 15 a 16) se potvrdila přítomnost patologického klonu, jehož procentuální zastoupení bylo v CD34+ buňkách PK vyšší oproti KD. V obou případech byly odběry provedeny v době léčebné terapie nemocných. Domníváme se, že důsledkem léčby je zastoupení patologického klonu v KD nižší a předchází nálezu v PK. Podobné výsledky uvádí i Lübbert et al. [19]. V další multicentrické studii z německých pracovišť sledovali autoři celkem 360 nemocných s MDS po dobu tří let [20]. K vyšetření CD34+ buněk pomocí I-FISH použili panel centromerických sond pro chromozomy 7, 8, X, Y a lokus-specifických sond pro deleci 5q, deleci 20q, gen TP53 a fúzní gen TEL/AML1. I-FISH analýzou potvrdili předchozí nález klasické cytogenetiky u 96 % nemocných a rovněž korelaci nálezů v buňkách KD a CD34+. V poslední práci z roku 2015 [21], autoři rozšířili panel použitých sond o lokus-specifické sondy pro deleci v oblasti 1p36 a 1q25, deleci genu RB1, deleci genu TET2 a fúzní gen IgH/BCL2 a opět potvrdili shodu výsledků.
V souladu s literaturou naše výsledky potvrzují, že analýza separovaných CD34+ buněk pomocí I-FISH je vhodná metoda pro sledování aberantního klonu v PK. Jedná se o cílené vyšetření, které umožňuje monitorovat pouze konkrétní vybrané aberace. Tato metoda tak nenahrazuje počáteční vyšetření KD, kdy je nutné určit chromozomové změny v karyotypu pomocí klasické cytogenetiky. Neodráží ani klonální vývoj neboť nedetekuje další změny karyotypu, a nemůže tedy nahradit klasickou cytogenetickou analýzu. Může ji ale vhodně doplnit v intervalech mezi odběry KD. Zvláště u pacientů s „low-grade“ FAB/WHO – podtypy s nízkým rizikem transformace do akutní myeloidní leukemie je žádoucí častější sledování v průběhu léčby (nejlépe s odstupem 1 měsíce). V těchto případech je analýza chromozomových aberací prováděná z PK méně invazivní než biopsie KD a může pomoci efektivněji vést léčbu založenou na molekulárně-cytogenetické odpovědi. Lze ji použít k šetrnému sledování průběhu nemoci, nebo pokud nelze odebrat KD pro suchou punkci, případně když pacient odběr KD odmítá.
ZÁVĚR
Prokázali jsme, že izolace CD34+ buněk s následnou I-FISH analýzou je praktická neinvazivní metoda, jejíž výsledky reprezentují patologické klony přítomné v buňkách kostní dřeně a mají vypovídající hodnotu. Tato metoda tak umožňuje častěji a snadněji monitorovat nemoc a individuální rizika v souladu s IPSS-R [5].
Podíl autorů na přípravě rukopisu
ŠR – provedení a vyhodnocení I-FISH analýz KD a CD34+ v PK, zpracování podkladů a literatury, napsání rukopisu
JB – provedení a vyhodnocení I-FISH analýz KD a CD34+ v PK, připomínkování rukopisu, schválení finální verze
IŠ – vyhodnocení I-FISH analýz KD a CD34+ v PK, úprava rukopisu
MB – spolupráce při separaci CD34+ buněk, připomínkování rukopisu
AJ – diagnostika a léčba nemocných, sběr klinických dat
RN – diagnostika a léčba nemocných, sběr klinických dat
JČ – diagnostika a léčba nemocných, sběr klinických dat
ZZ – analýza komplexních karyotypů, mFISH/mBAND, připomínkování rukopisu, schválení finální verze
KM – připomínkování rukopisu, schválení finální verze
Poděkování
Práce byla podpořena granty MZČR00023736,
RVO-VFN0064165, GAČR P302/12/G157Za provedené statistické analýzy děkujeme
Ing. Aleně Dohnalové.Čestné prohlášení autora
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doručeno do redakce dne 17. 9. 2015.
Přijato po recenzi dne 8. 2. 2016.
Mgr. Šárka Ransdorfová Ph.D.
ÚHKT, oddělení cytogenetiky
U Nemocnice 1
128 20 Praha 2
email: sarka.ransdorfova@uhkt.cz
Zdroje
1. Silverman LR, Demakos EP, Peterson BL, et al. Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome: a study of the cancer and leukemia group B. J Clin Oncol 2002; 20 : 2429–2440.
2. Parker JE, Mufti GJ. Ineffective haemopoiesis and apoptosis in myelodysplastic syndromes. Br J Haematol 1998; 101 : 220–230.
3. Germing U, Gattermann N, Strupp C, et al. Validation of WHO proposals for a new classification of primary myelodysplastic syndromes: a retrospective analysis of 1600 patients. Leukemia Res 2000; 24 : 983–992.
4. Schanz J, Tüchler H, Solé F, et al. A new comprehensive cytogenetic scoring system for primary myelodysplastic syndromes (MDS) and oligoblastic AML after MDS derived from an international diabase merge. J Clin Oncol 2012; 30 : 820–829.
5. Greenberg P, Tuechler H, Schanz J, et al. Revised international scoring system for myelodysplastic syndromes. Blood 2012; 120 : 2454–2465.
6. Schanz J, Steidl C, Fonatsch C, et al. Coalesced multicenter analysis of 2,351 patients with myelodysplastic syndromes indicates an underestimation of poor-risk cytogenetics of myelodysplastic syndromes in the international prognostic scoring system. J Clin Oncol 2011; 29 : 1963–1970.
7. Solé F, Espinet B, Sanz GF, et al. Incidence, characterization and prognostic significance of chromosomal abnormalities in 640 patients with primary myelodysplastic syndromes: Grupo Cooperativo Espanol de Citogenetica Hematologica. Br J Haematol 2000; 108 : 346–356.
8. Vardiman JW, Thiele J, Arber DA. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood 2009; 114 : 937–951.
9. Nimer SD. Clinical management of myelodysplastic syndromes with interstitial deletion of chromosome 5q. J Clin Oncol 2006; 24 : 2576–2582.
10. Van den Berghe H, Cassimann JJ, David G, et al. Distinct haematological disorder with deletion of long arm of no.5 chromosome. Nature 1974; 251 : 437–438.
11. Jerez A, Gondek LP, Jankowska AM, et al. Topography, clinical and genomic correlates of 5q myeloid malignancies revisited. J Clinic Oncol 2012; 30 : 1343–1349.
12. Neuwirtová R, Zemanová Z, Březinová J, et al. Jsme oprávněni řadit nemocné s dvěma samostatnými buněčnými klony a to s delecí 5q a s trizomií 8 jako podskupinu myelodysplatického syndromu typu 5q - syndromu? Transfuze Hematol Dnes 2014; 20 : 25–31.
13. Vehmeyer K, Haase D, Alves F. Increased peripheral stem cell pool in MDS: an indication of disease progression? Leukemia Res 2001; 25 : 955–959.
14. Braulke F, Schanz J, Jung K, et al. FISH analysis of circulating CD34+ cells as a new tool for genetic monitoring in MDS: Verification of the method and application to 27 MDS patients. Leukemia Res 2010; 34 : 1296–1301.
15. Haase D, Feuring-Buske M, Schäfer C, et al. Cytogenetic analysis of CD34+ subpopulations in AML and MDS characterized by the expression of CD38 and CD 117. Leukemia 1997; 11 : 674–679.
16. Shaffer LG, McGowan-Jordan J, Schmid M (eds). ISCN 2013: An international system for human cytogenetic nomenclature. S. Karger, Basel 2013.
17. Haase D, Fontasch C, Freund M, et al. Cytogenetic findings in 179 patients with myelodysplastic syndromes. Ann Hematol 1995; 70 : 171–187.
18. Miltenyi S, Műller W, Weichel W, et al. High gradient magnetic cell separation with MACS. Cytometry 1990; 11 : 231–238.
19. Lübbert M, Wijermans P, Kunzmann R, et al. Cytogenetic responses in high-risk myelodysplastic syndrome following low-dose treatment with the DNA methylation inhibitor 5-aza-2’-deoxycytidine. Br J Haematol 2001; 114 : 349–357.
20. Braulke F, Jung K, Schanz J, et al. Molecular cytogenetic monitoring from CD34+ peripheral blood cells in myelodysplastic syndromes: first results from a prospective multicenter German diagnostic study. Leukemia Res 2013; 37 : 900–906.
21. Braulke F, Platzbecker U, Müller-Thomas C, et al. Validation of cytogenetic risk groups according to International Prognostic Scoring Systems by peripheral blood CD34+FISH: results from a German diagnostic study in comparison with an international control group. Haematologica 2015; 100 : 205–213.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo 2- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Liečba starších pacientov s myelodysplastickým syndrómom, nevhodných na intenzívnu terapiu a jej finančné dôsledky – skúsenosti jedného centra
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) České skupiny pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP
- Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP
- Cena České hematologické společnosti za nejlepší původní vědeckou práci v oboru hematologie v roce 2015
- Výběr z tisku a zprávy o knihách
- Analýza vztahu výsledků cytogenetického vyšetření k poměru volných lehkých řetězců κ/λ (FLC-r, FreeliteTM), páru těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM ) a vybraných prognostických faktorů vyšetřených při diagnóze mnohočetného myelomu
- Využití interfázní fluorescenční in situ hybridizace pro analýzu CD34+ buněk v periferní krvi u nemocných s myelodysplastickými syndromy
- Profylaxe versus léčba „on demand“ u dospělých pacientů s těžkou hemofilií A – zkušenosti z FN Brno
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP
- Liečba starších pacientov s myelodysplastickým syndrómom, nevhodných na intenzívnu terapiu a jej finančné dôsledky – skúsenosti jedného centra
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) České skupiny pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP
- Profylaxe versus léčba „on demand“ u dospělých pacientů s těžkou hemofilií A – zkušenosti z FN Brno
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



