-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Analýza vztahu výsledků cytogenetického vyšetření k poměru volných lehkých řetězců κ/λ (FLC-r, FreeliteTM), páru těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM ) a vybraných prognostických faktorů vyšetřených při diagnóze mnohočetného myelomu
Analysis of the relationship of cytogenetic results with serum free light chain ratio κ/λ(FLC-r, FreeliteTM), heavy/light chain pairs of immunoglobulin ratio (HLC-r, HevyliteTM), and selected prognostic factors assessed at diagnosis of multiple myeloma
Introduction:
Assessment of serum levels of free light chains κ/λ(FLC-κ/λ) and recently of heavy/light chain immunoglobulin pairs (HLC) has extended the traditional algorithm of laboratory tests in multiple myeloma (MM). The aim of the study was to evaluate the relationship between standard prognostic MM factors, FLC-κ/λ ratio (sFLC-r), modified „involved/uninvolved“ FLC ratio (mFLC-r), the difference „involved – uninvolved“ FLC (FLC-dif), standard HLC-κ/λratio (sHLC-r), modified „involved/uninvolved” HLC ratio (mHLC-r), and the difference „involved-uninvolved“ HLC (HLC-dif) with the results of cytogenetic analysis at the time of MM diagnosis.Patients and methods:
In a group of 97 patients with MM, we assessed serum levels of FLC using the FreeliteTM method and calculated the following indices: sFLC-r, mFLC-r and FLC - dif. Using the HevyliteTM method, we assessed serum levels of HLC pairs and calculated the following indices: sHLC-r, mHLC-r and HLC-dif. For cytogenetic analysis of myeloma plasmocytes, we used fluorescent in situ hybridization with immunofluorescent staining of plasma cells (FICTION, “Fluorescence Immunophenotyping and Interphase Cytogenetics as a Tool for the Investigation of Neoplasms“).Results:
We confirmed a significant relationship between complex karyotype, del(13)(q14) and chromosome 1q21 gain with a decrease of Hb < 100 g/l; del(13)(q14) with thrombocytopenia < 150 x 109/l and increased creatinine levels; and in the case of t(14;16)(q32;q23) also a relationship with ß2-microglobulin (ß2-M) > 5.5 mg/l; deletion del(17)(p13) (TP53) with increased ß2-M and trisomy of chromosomes 15 and 17 with MIg > 25 g/L. sFLC-r index levels were significantly elevated only in the case of del(13q14). However, after focusing on the group with sFLC-r < 0.01 and > 100, we found a significant relationship with del(13)(q14), del(17)(p13) and complex karyotype. The presence of 1q21 gain, del (17)(p13), complex karyotype and trisomy 17 had significantly higher levels of mFLC-r and in patients with cut off ³ 79.6 we found del(13)(q14), chromosome 1q21 gain and complex karyotype. In the cohort with FLC-dif ³ 185 there was an association with del(13)(q14), del(17)(p13) and complex karyotype. The relationship between sHLC-r and other assessed cytogenetic markers was insignificant except for the relationship with t(4;14)(p16;q32). One original contribution is the discovery of significantly increased mHLC-r levels in the case of 1q21 gain, complex karyotype and trisomy of chromosome 17 as well as t(4;14)(p16;q32) translocation. This finding was confirmed by the corresponding results of HLC-dif analysis in the group with mHLC-r ³31.6. Significantly higher serum MIg concentration was found only in the case of chromosome 15 trisomy.Conclusion:
The study confirmed a statistically significant relationship between „high-risk“ structural changes, i.e. t(14;16)(q32;q23), del(13)(q14), del(17)(p13), 1q21 gain and complex karyotype with standard prognostic factors characterized by their relationship with the extent and biological features of MM. Our contribution towards a deeper understanding of MM pathobiology is the uncovered significant relationship between mFLC-r and del(13)(q14), 1q21 gain and del(17)(p13), as well as our original discovery of the significant relationship between mHLC-r and also partly HLC-dif. with prognostically unfavourable aberrations t(4;14)(p16;q32), chromosome 1q21 gain and complex karyotype.Key words:
multiple myeloma – prognostic factors – free light chains of immunoglobulin – heavy/light chain pairs of immunoglobulin – fluorescent in situ hybridization
Autoři: V. Ščudla 1,2; J. Balcárková 2; P. Lochman 3; M. Mlynárčiková 2; T. Pika 2; J. Minařík 2; J. Zapletalová 4; M. Jarošová 2
Působiště autorů: 3. interní klinika-nefrologická, revmatologická a endokrinologická, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice v Olomouci 1; Hemato-onkologická klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého v Olomouci 2; Oddělení klinické biochemie, Fakultní nemocnice v Olomouci 3; Ústav lékařské biofyziky, Lékařská fakulta Univerzity Palackého v Olomouci 4
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 2, p. 77-89.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod:
Vyšetření hladin volných lehkých řetězců κ/λ(FLC-κ/λ) a nověji i páru těžkých/lehkých řetězců imunoglobulinu (HLC) rozšířilo tradiční algoritmus laboratorních testů u mnohočetného myelomu (MM). Cílem studie bylo zhodnocení vztahu zavedených prognostických faktorů MM, standardního poměru FLC-κ/λ (sFLC-r), modifikovaného poměru, tj. „involved/uninvolved“ FLC (mFLC-r), rozdílu „involved – uninvolved“ FLC (FLC-dif), standardního poměru HLC-κ/λ(sHLC-r), modifikovaného poměru HLC, tj. poměru „involved/uninvolved” HLC (mHLC-r) a rozdílu „involved – uninvolved“ HLC (HLC -dif.) k výsledkům cytogenetického vyšetření při diagnóze MM.Soubor a metody:
V sestavě 97 nemocných s MM byly vyšetřeny metodou FreeliteTM hladiny FLC a vypočteny indexy sFLC-r, mFLC-r a FLC-dif metodou HevyliteTM byly stanoveny hladiny párů HLC a vypočteny indexy sHLC-r, mHLC-r a HLC-dif. Cytogenetické vyšetření myelomových plazmocytů bylo provedeno pomocí fluorescenční in situ hybridizace s imunofluorescenčním značením plazmatických buněk (metoda FICTION, “Fluorescence Immunophenotyping and Interphase Cytogenetics as a Tool for the Investigation of Neoplasms“).Výsledky:
Byl prokázán významný vztah komplexních změn, del(13)(q14) a zmnožení chromozomové oblasti 1q21 k tíži poklesu Hb < 100 g/l, del(13)(q14) k trombocytopenii <150 x 109/l a zvýšeným hodnotám kreatininu, v případě translokace t(14;16)(q32;q23) rovněž i k β2-mikroglobulinu (β2-M) > 5,5 mg/l, del(17)(p13) (TP53) k zvýšeným hodnotám β2-M a trizomie chromozomů 15 a 17 k výskytu monoklonálního imunoglobulinu (MIg) > 25 g/l. Hodnoty indexu sFLC-r byly signifikantně vyšší pouze v případě průkazu del(13)(q14), avšak při vyčlenění souboru s hodnotami indexu sFLC-r < 0,01 a > 100 se vynořil navíc signifikatní vztah k del(17)(p13) a k nálezu komplexních změn. Přítomnost zmnožení oblasti 1q21, del(17)(p13), komplexních změn a trizomie 17 se vyznačovala významně vyšší hodnotou mFLC-r a v případě vyčlenění souboru nemocných s cut-off ≥ 79,6 s průkazem del(13)(q14), zmnožením v oblasti 1q21 a s nálezem komplexních změn. V souboru s hodnotou FLC-dif s cut-off ≥ 185 byly významně častější del(13)(q14), del(17)(p13) a komplexní změny karyotypu. Vztah mezi sHLC-r a ostatními vyšetřenými cytogenetickými markery vyzněl až na statisticky významný vztah k t(4;14)(p16;q32) nesignifikantně. Originálním zjištěním je průkaz významně zvýšených hodnot indexu mHLC-r v případě zmnožení oblasti 1q21, komplexních změn karyotypu a trizomie chromozomu 17, ale i translokace t(4;14)(p16;q32) potvrzené souhlasným výsledkem analýzy HLC-dif. V souboru s hodnotou cut-off mHLC-r ≥ 31,6. Významně vyšší koncentrace MIg v séru byla zjištěna pouze v případě trizomie chromozomu 15.Závěr:
Studie prokázala statisticky významný vztah cytogenetických změn typu „high risk“, tj. t(14;16)(q32;q23), del(13)(q14), del(17)(p13), zmnožení oblasti 1q21 a komplexních změn k zavedeným standardním prognostickým faktorům vyznačujících se vztahem k rozsahu a biologickým vlastnostem MM. Příspěvkem k hlubšímu pochopení patobiologie MM je průkaz významného vztahu mFLC-r k del(13)(q14), zmnožení oblasti 1q21 a k del(17)(p13), zejména ale originální nález signifikantního vztahu mHLC-r, částečně i HLC-dif k prognosticky rizikovým aberacím t(4;14)(p16;q32), zmnožení oblasti 1q21 a komplexním změnám karyotypu.Klíčová slova:
mnohočetný myelom – prognostické faktory – volné lehké řetězce imunoglobulinu – pár těžkých/lehkých řetězců imunoglobulinu – fluorescenční in situ hybridizaceÚVOD
Mnohočetný myelom (MM) je značně heterogenní onemocnění podmíněné nekontrolovanou proliferací a akumulací neoplastických elementů plazmocelulární linie, vyznačující se značnou genetickou nestabilitou a přítomností komplexních genetických změn charakteru chromozomových translokací, delecí, duplikací a genetických mutací, uplatňujících se nejen v patogenezi, ale i v proměnlivosti klinického obrazu, léčebné odezvy a prognózy [1–6]. Genetická různorodost MM se projevuje chromozomovými změnami provázenými zmnožením genetického materiálu formou trizomií, vedoucí k hyperploidii (50–60 % změn) provázené obvykle příznivou prognózou a strukturními chromozomovými změnami označovanými jako “nonhyperploidní změny” (40–50 %), představující především přestavby genu pro těžký řetězec imunoglobulinu (IgH) s různými onkogeny umístěnými v zlomových oblastech chromozomů 4, 16 nebo 20 jako výsledek reciprokých translokací t(11;14)(q13;q32), t(4;14)(p16;q32), t(14;16)(q32;q23), t(14;20)(q32;q12) (7-9). Tyto translokace spolu s aberacemi typu delecí krátkých ramen chromozomu 17 del(17)(p13) zahrnující ztrátu genu TP53, zmnožení genetického materiálu dlouhých ramen chromozomu 1, ale i monozomií chromozomu 13 či intersticiální delecí 13q14 zahrnující Rb1 gen, jsou nejvýznamnějšími markery rizikové formy MM a zkráceného celkového přežívání (OS) [2, 3, 8, 10, 11]. MM není jednolitým onemocněním, ale skupinou cytogeneticky, genotypicky a klinicky odlišných podtypů nemoci [10]. Podstatné zlepšení prognózy s bezmála dvojnásobným prodloužením délky OS je výsledkem hlubšího poznání patogeneze myelomu a stále sofistikovanějších vyšetřovacích a především léčebných metod. Tradiční oporou diagnostiky, monitorování průběhu a hodnocení výsledků léčby je vyšetření izotypu a koncentrace monoklonálního imunoglobulinu (MIg) standardní (SPE) a imunofixační (IFE) elektroforézou séra, normálních imunoglobulinů pomocí nefelometrie a hladin volných lehkých řetězců imunoglobulinu (FLC) včetně jejich poměru κ/λ (FLC-r) pomocí FreeliteTM techniky [12, 13]. Nízkou senzitivitu a nespolehlivost SPE u oligosekreční a IgA formy MM, zkreslující vliv výkyvů hematokritu a objemu plazmy [14] i odlišný katabolismus jednotlivých tříd MIg [15] potlačila turbidimetrická technika HevyliteTM, umožňující přesné separátní stanovení hladin párů těžkých/lehkých řetězců Ig (HLC-κ a HLC - λ) v séru, tj. „involved“ -HLC (i-HLC, MIg vytvářený myelomovými buňkami) a „uninvolved“ -HLC (u-HLC, normální Ig stejného izotypu produkovaný normálními plazmocyty) s výpočtem jejich vzájemného poměru (HLC-r) a nově i jejich vzájemné diference (HLC-dif) [16–20]. Vyšetření HLC-r se osvědčilo při monitorování výsledku léčby zejména u hyposekreční formy MM, a to včetně hodnocení minimální reziduální nemoci [13, 21].
Vzhledem k tomu, že vztah mezi výsledky cytogenetické analýzy a ukazateli sekrece Ig normálních a myelomových plazmocytů, tj. indexů FLC-r a FLC-dif, zejména ale HLC-r a HLC-dif nebyl doposud analyzován a pouze v omezené míře hodnocen vztah k standardním prognostickým faktorům MM [22, 23], zaměřila se předložená analýza na tuto problematiku. Náplní studie bylo rovněž ověření pracovní hypotézy, že hodnoty indexu FLC-r, HLC-r a rozdílu jejich hodnot (FLC-dif a HLC-dif) by se měly v případě přítomnosti vs. nepřítomnosti chromozomových změn podstatně lišit. Případný pozitivní výsledek šetření by mohl vést k obohacení dosavadních znalostí molekulárně-cytogenetické patogeneze MM a vztahu cytogenetických markerů k standardním laboratorním ukazatelům s potenciální možností využití v klinické praxi.
SOUBOR NEMOCNÝCH A METODY
Studie vychází z analýzy 97členného souboru s IgG (73,2 %) a IgA typem MM (26,8 %) vyšetřeného při rozpoznání nemoci, splňující diagnostická kritéria International Myeloma Working Group (IMWG) – tabulka 1 [24, 25].
Tab. 1. Základní charakteristiky souboru mnohočetného myelomu vyšetřeného při diagnóze nemoci 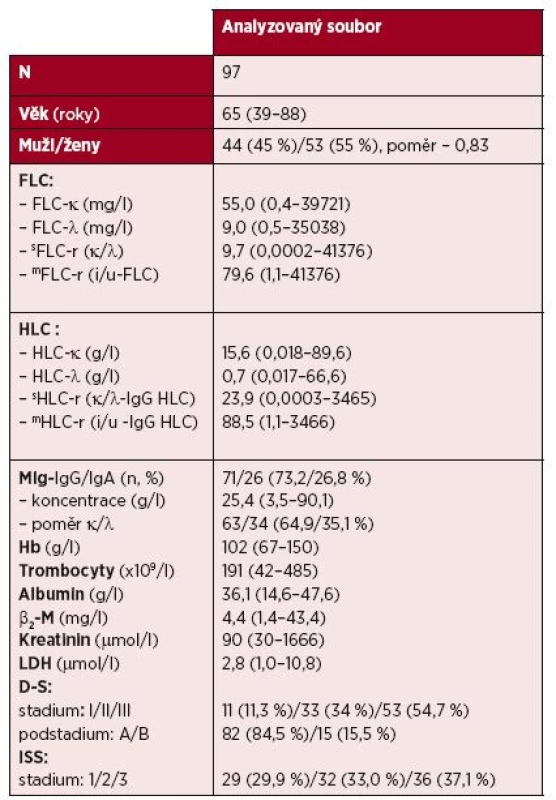
Vysvětlivky: FLC – volné lehké řetězce imunoglobulinu v séru („free light chain of immunoglobulin“), sFLC-r – „standardní“ poměr FLC-κ/λ, mFLC-r – „modifikovaný“ poměr i-FLC/u - FLC („involved/uninvolved FLC ratio“), HLC – pár těžkých/lehkých řetězců imunoglobulinu („immunoglobulin heavy/light chain pair“), sHLC-r – „standardní“ poměr HLC-κ/HLC-λ, mHLC-r – „modifikovaný“ poměr i-HLC/u-HLC „involved/uninvolved HLC ratio“), MIg – monoklonální imunoglobulin, Hb – hemoglobin, ß2-M – ß2-mikroglobulin, D-S – stážovací systém podle Durieho-Salmona, ISS – mezinárodní stážovací systém K cytogenetické analýze byla použita metoda fluorescenční in situ hybridizace (FISH) s imunofluorescenčním značením plazmatických buněk (metoda FICTION, tj. „Fluorescence Immunophenotyping and Interphase Cytogenetics as a Tool for the Investigation of Neoplasms“). Buněčná suspenze kostní dřeně zpracovaná pro klasické cytogenetické vyšetření z 24hodinové kultivace buněk bez stimulace a fixována v metanoloctové kyselině (3 : 1), byla převedena do fixace s 96% etanolem. Etanolem fixovaná suspenze byla nakapána na skla, obarvena pomocí protilátky proti lehkým řetězcům MIg (anti-human kappa nebo lambda chain) konjugované s 7-amino-4-metalkumarin-3-octovou kyselinou (AMCA) (Vector Laboratories Burlingame, CA). Fluorescenční signál byl zesílen protilátkou (anti-goat) konjugovanou s AMCA (Vector Laboratories Burlingame, CA) pro snadnější identifikaci populace klonálních plazmatických buněk [26]. Pro metodu FICTION byl použit panel komerčně dodávaných sond pro určení delece a zmnožení v oblasti 1p/1q, del(13)(q14), del(17)(p13), přestavby genu IgH a jeho nejčastější translokace (sondy XL 1p32/1q21, LSI RB1(13q14), LSI TP53/CEP17, LSI IGH/CCND1 Dual Color Dual fusion, IGH/FGFR3 Dual Color Dual Fusion, LSI IGH/MAF Dual Color Dual Fusion, XL t(6;14), XL t(14;16), XL IGH plus) (Abbott Molecular, Des Plaines, IL, USA; Dako, Glostrup, Denmark; Kreatech, Amsterdam, The Netherlands; MetaSystems, Altlusheim, Germany). K určení nejčastějších početních změn chromozomů byly použity centromerické sondy pro chromozomy 15 a 17 (Abbott Molecular). Hybridizace byla provedena podle návodu výrobce sondy. Výsledek hybridizace byl hodnocen pomocí fluorescenčního mikroskopu a programu ISIS (MetaSystems). Hodnoceno bylo 100 plazmatických buněk; hodnota cut-off pro genové sondy byla 10 %, pro centromerické sondy 20 %. Komplexní změny byly hodnoceny jako nález ≥ 3 změn v karyotypu nebo určené metodou FICTION.
Séra zmražená na -78 °C byla deponovaná v biobance Oddělení klinické biochemie a Hemato-onkologické kliniky FN v Olomouci, koncentrace MIg byla vyšetřena SPE přístrojem Sebia Hydrasy pomocí skeneru Epson 1680, IFE soupravou Hydragel 4 IF. Hladiny FLC byly vyšetřeny soupravami Freelite SPA Plus κ free (rozmezí 3,3–19,4 mg/l) a Freelite SPA Plus λ free (5,7–26,3 mg/l) s výpočtem indexu FLC-r, tj. poměru FLC-κ/ FLC-λ (0,26 až 1,65) [1, 3, 6]. Koncentrace HLC v séru byla vyšetřena turbidimetrem SPA Plus (The Binding Site) soupravami Hevylite Human: IgG-κ (3,84–12,07 g/l), IgG-λ (1,91–6,74 g/l), index IgG HLC-r z poměru IgG-κ/IgG-λ (1,12–3,21); hodnoty IgA-κ (0,57–2,08 g/l), IgA-λ (0,44–2,04 g/l), index IgA HLC-r z poměru IgA-κ/IgA-λ (0,78–1,94) [13, 16]. Na rozdíl od standardních kritérií, založených stabilně na výpočtu indexů FLC-r (sFLC-r) a HLC-r (sHLC-r) z poměru FLC-κ/FLC-λ, respektive HLC-κ /HLC-λ, vedoucí u nemocných s lehkým řetězcem λ k získání nízkých obtížně interpretovatelných hodnot, byl použit pro výpočet „modifikovaných“ indexů mFLC-r a mHLC-r (vždy poměr i-FLC/u-FLC nebo i-HLC/u-HLC) tj. hodnota „involved“ typu použitá v čitateli zlomku (např. v případě i-HLC-λ poměr i-HLC-λ/u-HLC-κ). Jde o analogii principu, použitého v případě FLC-r v některých předchozích studiích [22, 27, 28, 29] a zejména recentních IMWG (International Myeloma Working Group) revidovaných diagnostických kritériích MM (biomarker malignity FLC-r = i-FLC/u-FLC ≥ 100) [29, 30]. Výpočet rozdílu hodnot FLC (FLC-dif) a HLC (HLC-dif) byl proveden prostým odečtem hodnoty „uninvolved“ od hodnoty „involved“ FLC a HLC (20). Hodnoty β2-mikroglobulinu (β2-M) byly vyšetřeny metodou ELISA (< 2,3 mg/l), hodnoty hemoglobinu (Hb), trombocytů, albuminu, kreatininu a laktátdehydrogenázy (LDH) standardními postupy. Ke stratifikaci MM byl použit stážovací systém podle Durieho-Salmona (D-S), International Staging System (ISS) [24, 25, 31]. Zařazení do studie bylo vázáno na podpis informovaného souhlasu, design studie byl schválen etickou komisí FN v Olomouci.
Získaná data byla analyzována pomocí statistického software IBM SPSS Statistics 22, normalita dat byla posouzena pomocí Shapiro-Wilkova testu. Ke statistické analýze byly použity testy podle Pearsona, Kruskala-Wallise, U-test podle Manna-Whitneye a Fischerův přesný test s Bonferroniho korekcí signifikance. Všechny testy byly prováděny na hladině významnosti p < 0,05.
VÝSLEDKY
Vztah výsledků chromozomové analýzy k prognostickým faktorům
Výsledky vyšetření základních klinicko-laboratorních charakteristik v sestavě 97 nemocných při diagnóze MM jsou uvedeny v tabulce 1. Výskyt abnormálních cytogenetických ukazatelů, vyšetřených metodou FICTION je shrnut v tabulce 2. Cytogenetické změny byly zjištěny v 90,7 %, velmi častý byl nález komplexních změn (64,9 %), del(13)(q14) (50,5 %), trizomie chromozomu 15 (55,6 %) a zmnožení oblasti chromozomu 1q21 (46,4 %). Komplexní změny karyotypu se vyznačovaly významně nižšími hodnotami Hb, což potvrdil signifikantně vyšší výskyt komplexních změn v souboru s Hb < 100 g/l. V případě translokace t(14;16)(q32;q23) byla významně častější trombocytopenie (< 150 x 109/l) a zvýšený kreatinin (> 104 (μmol/l) i β2-M (> 5,5 mg/l) – tabulka 3. Trizomie chromozomů 15 a 17 se vyznačovala významně vyšším zastoupením nemocných s MIg > 25 g/l, zatímco přítomnost del(13)(q14) se vyskytovala významně častěji u nemocných s Hb < 100 g/l a trombocytopenií < 150 x 109/l. Del(17)(p13) zahrnující gen TP53 byla významně častěji provázena vysokou hodnotou β2-M, zatímco zmnožení oblasti chromozomu 1q21 se vyznačovalo vysoce významným vztahem k nízkým hodnotám Hb, včetně nemocných s Hb < 100 g/l. V případě hodnocení vztahu IgH přestavby typu translokace t(11;14)(q13;q32) a t(4;14)(p16;q32) k standardním PF MM, tj. Hb, albuminu, kreatininu, β2-M a LDH, nebyl zjištěn statisticky významný vzájemný vztah (viz tab. 3).
Tab. 2. Výsledky cytogenetické analýzy při diagnóze mnohočetného myelomu 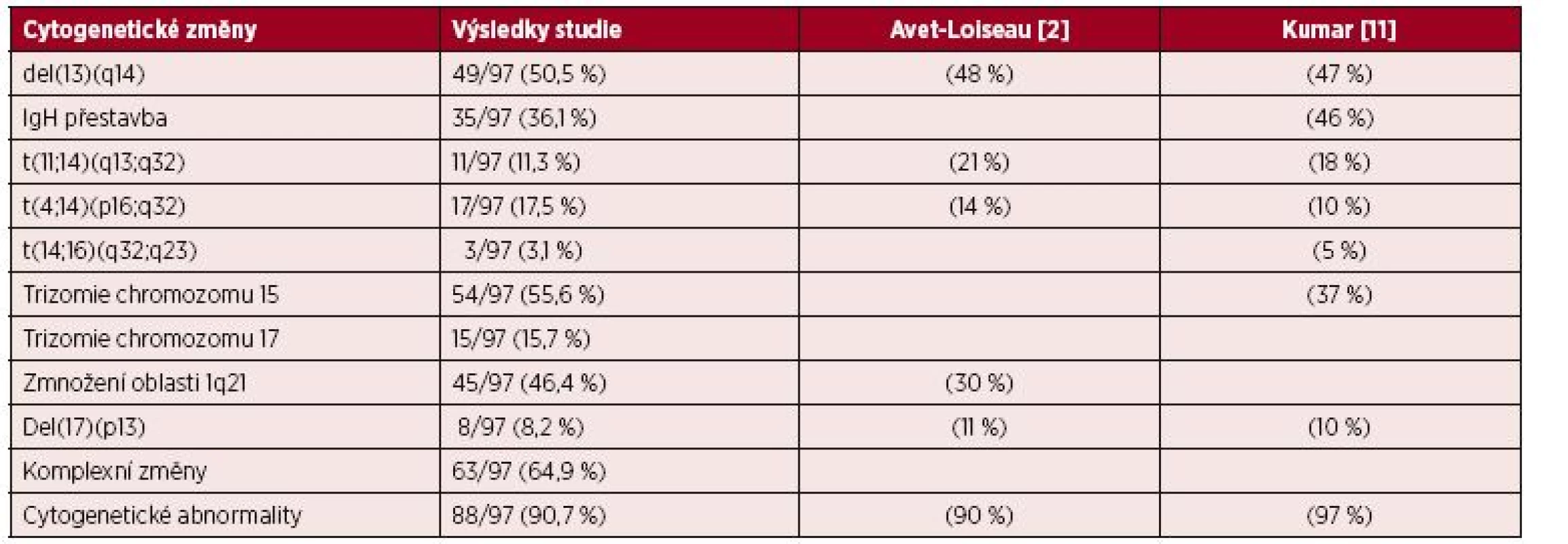
Vysvětlivky:IgH –gen pro těžký řetězec imunoglobulinu, Del – delece, t – translokace Tab. 3. Asociace cytogenetických změn s klinicko-laboratorními parametry 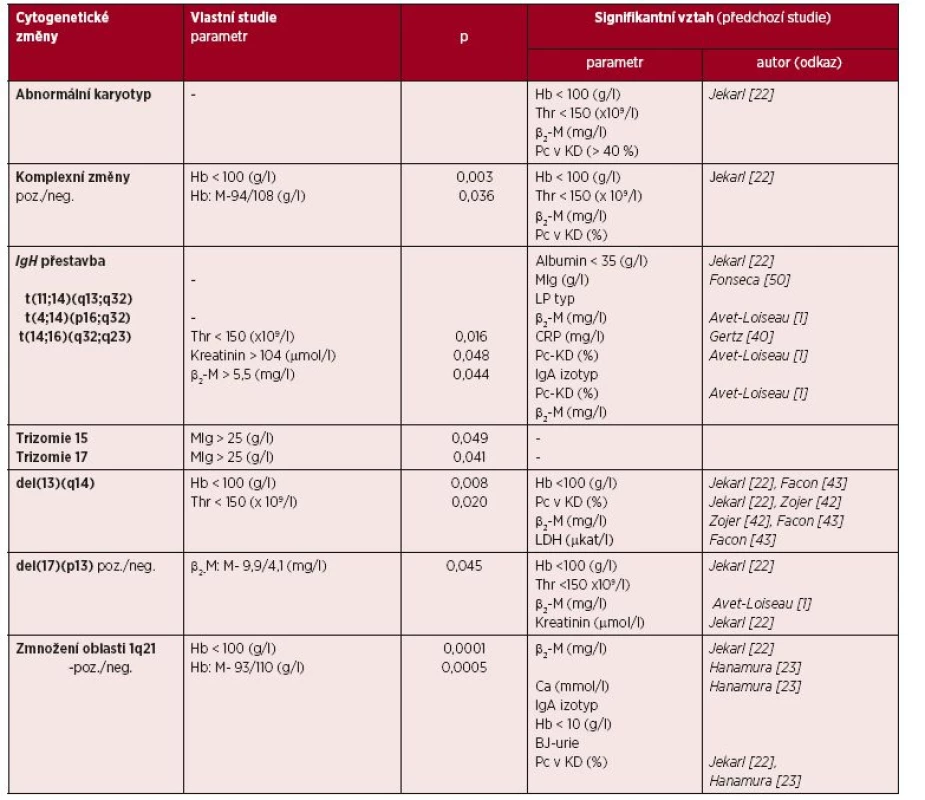
Vysvětlivky: Hb – hemoglobin, Thr – trombocyty, ß2-M – ß2-mikroglobulin, Pc-KD (%) – plazmocyty v kostní dřeni, MIg – monoklonální imunoglobulin, LP typ – lymfoplazmocytový typ myelomu, CRP – C-reaktivní protein, IgA – imunoglobulin-A, LDH – laktátdehydrogenáza, Ca – vápník, BJ-urie – Bence-Jonesova bílkovina v moči, p – index statistické významnosti Analýza vztahu cytogenetických změn a FLC-r
S výjimkou významně vyšších hodnot standardního indexu sFLC-r v případě del(13)(q14) nebyl zjištěn vztah k ostatním analyzovaným cytogenetickým změnám (tab. 4). Kromě statisticky významného vztahu del(13)(q14) (p = 0,025), del(17)(p13) (p = 0,025) a komplexních změn karyotypu (p = 0,008) k podsouboru s vysoce abnormálním indexem sFLC-r (cut-off < 0,01 a > 100) [29, 32] vyzněla analýza vztahu sFLC-r k přestavbě IgH, trizomii 15 a 17 i zmnožení oblasti chromozomu 1q21 nevýznamně. V případě modifikovaného indexu mFLC-r byly prokázány s výjimkou IgH přestavby a trizomie 15 významně vyšší hodnoty v rámci změn del(13)(q14), trizomie 17, zmnožení oblasti 1q21, del(17)(p13) a nálezu komplexních změn (viz tab. 4). Významně častější výskyt del(13)(q14) byl zjištěn i v podsouboru s hodnotou indexu mFLC-r >100 [podle 29] (p = 0,025).
Tab. 4. Souborná analýza vztahu vybraných prognostických laboratorních ukazatelů k výsledkům cytogenetické analýzy v sestavě 97 nemocných s mnohočetným myelomem vyšetřeným při diagnóze nemoci 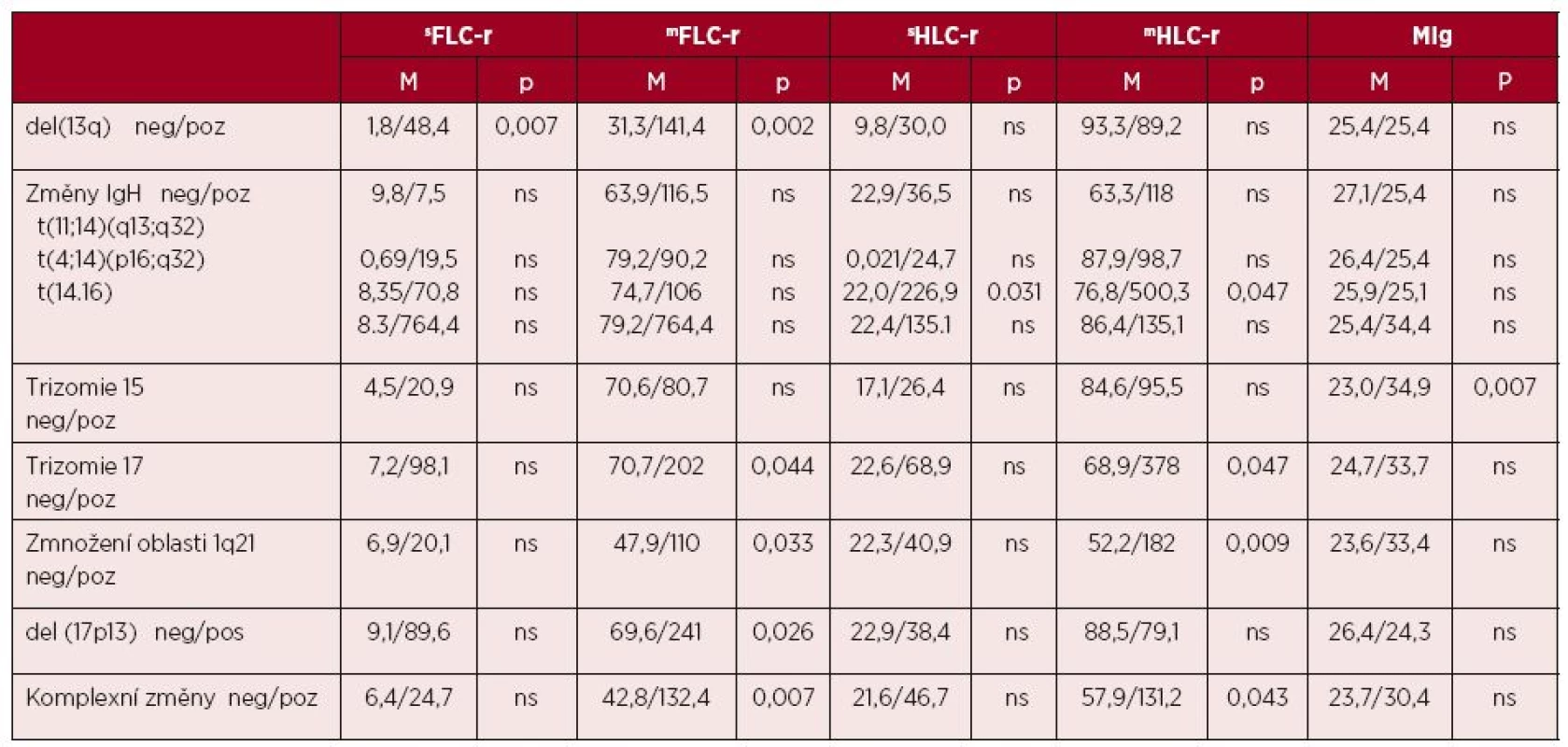
Vysvětlivky:sFLC-r – „standardní“ poměr volných lehkých řetězců imunoglobulinu – κ/λ, mFLC-r – „modifikovaný“ poměr i-FLC/u-FLC („involved/uninvolved FLC ratio“), HLC – pár těžkých/ lehkých řetězců imunoglobulinu („immunoglobulin heavy/light chain pair“), sHLC-r – „standardní“ poměr páru těžkých/lehkých řetězců imunoglobulinu κ/λ (HLC-κ/HLC-λ), mHLC-r – „modifikovaný“ poměr i-HLC/u-HLC („involved/uninvolved HLC ratio“), MIg – monoklonální imunoglobulin, M – medián naměřených hodnot, p – index statistické významnosti, ns – nesignifikantní vztah Analýza vztahu cytogenetických změn a HLC-r
S výjimkou t(4;14)(p16;q32) (p = 0,031), provázené signifikantně a bezmála 10krát vyššími hodnotami standardního indexu sHLC-r, nebyl prokázán významný vztah k ostatním analyzovaným chromozomovým změnám, a to ani v případě hlubší analýzy podsouborů s nízce (0,022 a < 45) vs. vysoce abnormálními hodnotami (< 0,022 a > 45) rozčleněnými podle Ludwiga [33]. V případě modifikovaného indexu mHLC-r byly zjištěny významně vyšší hodnoty pouze v případě přítomnosti trizomie 17, zmnožení oblasti 1q21 a nálezu komplexních změn. Cílená analýza zaměřená na aberace chromozomu 14 prokázala významně vyšší hodnoty mHLC-r u nemocných s přítomností translokace t(4;14)(p16;q32)(p = 0,047), nikoliv ale t(11;14)(q13;q32) a t(14;16)(q32;q23). S výjimkou trizomie 15, vyznačující se signifikantně vyššími hodnotami koncentrace MIg nebyla zjištěna v případě ostatních analyzovaných cytogenetických změn statisticky významná souvislost (viz tab. 4).
Výsledky hlubší analýzy zaměřené na analýzu podsouborů s vysokými vs. nízkými hodnotami mFLC-r nebo mHLC-r jsou shrnuty v tabulce 5. V podsouboru mFLC-r s hodnotami ≥ 79,6 (medián souboru) byl zjištěn významně vyšší výskyt del(13)(q14), zmnožení oblasti 1q21 a nález komplexních změn. Tento nález byl potvrzen i analýzou souborů s použitím cut-off ≥ 277, použitý s úspěchem v předchozí studii [22] (viz tab. 5). V případě FLC-dif byl při použití cut-off ≥ 185 zaznamenán významný vztah k del(13)(q14), komplexním změnám karyotypu a del(17)(p13). Analýza věnovaná modifikovanému indexu mHLC-r prokázala v podsouboru s hodnotou ≥ 89,2 (medián souboru) signifikantně častější výskyt pouze zmnožení oblasti 1q21 a nález komplexních změn, v případě cut-off ≥ 94,5, zvoleného na podkladě doporučení naší předchozí studie [28] byl zjištěn významný vztah k zmnožení oblasti 1q21 (p = 0,002) a navíc i k přítomnosti komplexních změn karyotypu (p = 0,031). Samostatná analýza vyčleněného podsouboru třídy IgG zachytila v případě hodnot ≥ 94,5 vedle významně častějšího zmnožení oblasti 1q21 (p = 0,013) i častější nález trizomie chromozomu 17 (p = 0,029), analýza nemocných s izotypem IgA vyzněla nepříznačně. V případě analýzy podsouborů rozdělených podle hodnoty mediánu HLC-dif v našem souboru (cut-off ≥ 31,6) byl zjištěn významný vztah pouze k výskytu translokace t(4;14)(p16;q32) a zmnožení oblasti 1q21 (viz tab. 5).
Tab. 5. Souborná analýza vztahu skupin s vysokou vs. nízkou hodnotou modifikovaného poměru (mFLC-r) a rozdílu (FLC-dif) hladin volných lehkých řetězců imunoglobulinu a modifikovaného poměru (mHLC-r) a rozdílu (HLC-dif) hodnot párů těžkých/lehkých řetězců k výsledkům cytogenetické analýzy v souboru 97 nemocných s mnohočetným myelomem vyšetřených při diagnóze nemoci 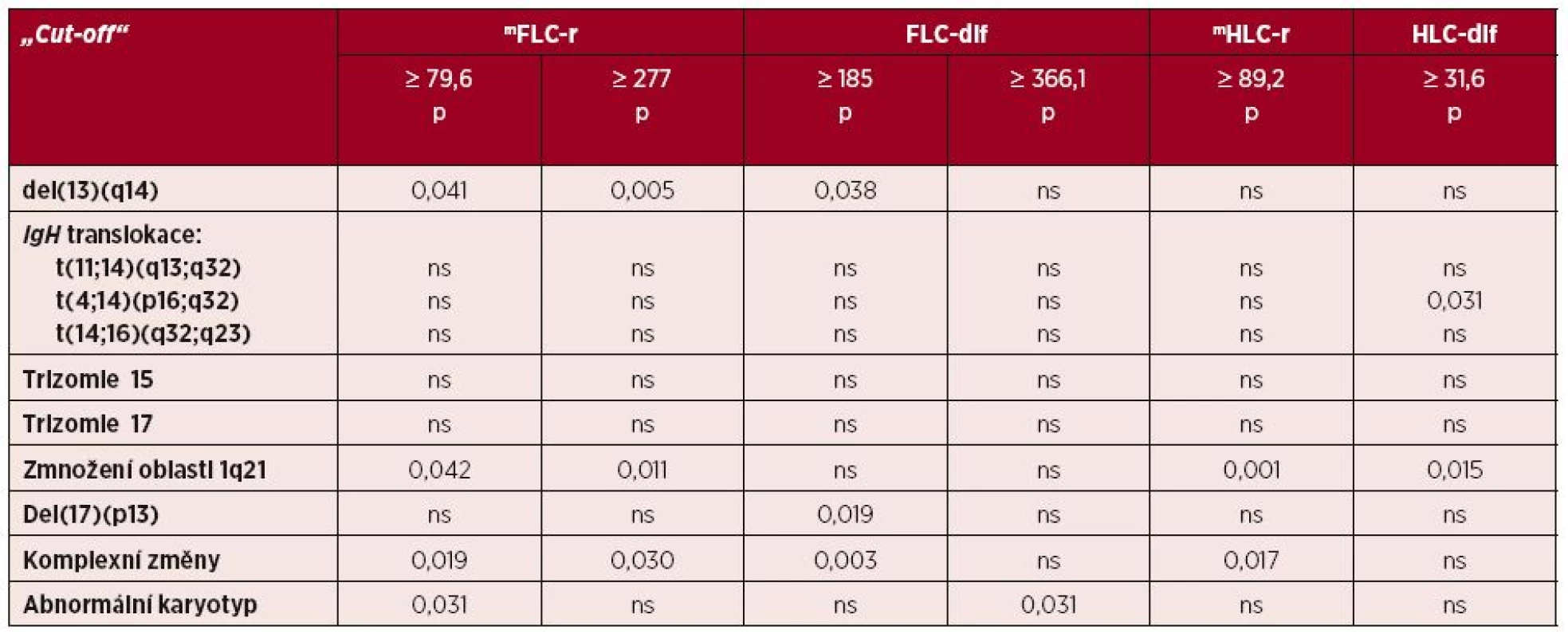
Vysvětlivky:mFLC-r – „modifikovaný“ poměr volných lehkých řetězců imunoglobulinu i-FLC/u-FLC („involved/uninvolved FLC ratio“), FLC dif – rozdíl hladin volných lehkých řetězců (rozdíl mezi iFLC-uFLC), mHLC-r – „modifikovaný“ poměr i-HLC/u-HLC („involved/uninvolved HLC ratio“), HLC-dif – rozdíl sérových hladin iHLC-uHLC, ns – nesignifikantní vztah, p – index statistické významnosti, IgH – gen pro těžký řetězec imunoglobulinu, t – translokace, Del – delece DISKUSE
MM je plazmocelulární neoplazie s komplexní, neúplně vyřešenou molekulární patogenezí a se složitou subklonální strukturou. V důsledku klinicko-laboratorní, genetické, molekulárně-biologické a intraklonální různorodosti MM se většina recentních studií zaměřila s použitím vysoce sofistikovaných molekulárně-genetických metod na odhalení biologické podstaty nemoci [34, 35]. Hlubší poznání vnitřních biologických vlastností myelomových buněk a jejich vztahu k mikroprostředí kostní dřeně, ale i ke standardním klinicko-laboratorním ukazatelům vedlo k sestavení nových stratifikačních systémů založených na metodě iFISH, tj. mSMART (Mayo Stratification of Myeloma and Risk-Adapted Therapy) [36] a R-ISS (Revised International Staging System) [37] jako východiska specificky orientované terapie [7, 11, 36, 37]. V 97členném souboru MM vyšetřeném při diagnóze metodou FICTION byl zaznamenán obdobný výskyt chromozomových aberací jako v předchozích studiích, tj. v analýze Aveta-Loiseaua [38] a Kumara [7, 11], v našem souboru bylo ale nižší zastoupení t(11;14)(q13;q32) a poněkud vyšší výskyt t(4;14)(p16;q32) – viz tab. 2.
Vztah výsledků chromozomové analýzy k prognostickým faktorům
V souladu s dosavadními prameny byly v naší studii zjištěny cytogenetické změny u naprosté většiny (90,7 %) nemocných [11, 38]. V předchozích studiích byl zjištěn vztah abnormálního karyotypu k standardním prognostickým faktorům se vztahem k náloži myelomové tkáně (viz tab. 3). U nemocných s přítomností komplexních změn jsme v souladu s předchozí analýzou zaznamenali pouze signifikantní vztah k tíži anémie, nikoliv k albuminu, β2-M, kreatininu Ca a LDH, zatímco předchozí studie popsala vedle vztahu k poklesu Hb rovněž významný vztah k trombocytopenii, zvýšeným hodnotám β2-M a počtu plazmocytů v kostní dřeni [22]. Přes poměrně širokou škálu parametrů, u nichž byl v předchozích studiích popsán vztah k přítomnosti prognosticky „inertní“ translokace t(11;14)(q13;q32) – viz tab. 3, včetně výskytu lymfoplazmocytové morfologie myelomových buněk u 20 % nemocných, přítomnosti hyposekrečního a/nebo B-J typu MM, vyzněla naše studie, a to pravděpodobně i v důsledku pouze 11,3% zastoupení nepříznačně [1, 4, 11, 22, 38, 50]. Rovněž u primární, pro MM specifické a prognosticky poměrně nepříznivé translokace t(4;14)(p16;q32) jsme na rozdíl od předchozích autorů nezaznamenali žádný vztah k analyzovaným standardním prognostickým faktorům (viz tab. 3) [2, 39]. V předchozích studiích byl zaznamenán významný vztah t(4;14)(p16;q32) k tak prognosticky významným parametrům, jakými jsou β2-M, množství plazmocytů v kostní dřeni a IgA izotyp MM [1, 2, 40]. U poměrně vzácné t(14;16)(q32;q23), spojované s výskytem plazmocelulární leukemie a nepříznivou prognózou jsme zaznamenali významný vztah k trombocytopenii, k vzestupu kreatininu a v souladu s Avetem - Loiseauem i k vyšším hodnotám β2-M (viz tab. 3)
[1, 41]. Trizomie chromozomu 15 a 17 byla v naší studii provázena význačně zvýšenou koncentrací MIg > 25 g/l, což nebylo doposud popsáno a pro což nemáme doposud věrohodné vysvětlení. Del(13)(q14) měla v našem souboru vztah k anémii a trombocytopenii, zatímco v předchozích studiích navíc k množství plazmocytů v kostní dřeni a zvýšeným hodnotám β2-M i LDH (viz tab. 3) [22, 42, 43]. Je známo, že zejména kompletní, ale i parciální delece chromozomu 13, případně translokace 13q zjištěná pomocí konvenční chromozomové analýzy se vyznačuje nepříznivou prognózou, zatímco v případě identifikace pomocí iFISH jsou nižší léčebná odezva a kratší OS vázány na současný výskyt t(4;14)(p16;q32) a del(17)(p13) [2, 42]. U nemocných s přítomností del(17)(p13) s delecí TP53, tj. aberace s narůstajícím výskytem v průběhu MM a spojené v důsledku ztráty řady genů a mutace TP53 s chemorezistencí a nepříznivou prognózou, jsme zaznamenali na rozdíl od jiných autorů pouze vztah k vyšším hodnotám β2-M (viz tab. 3) [1, 2, 22, 44]. Bylo zjištěno, že v případě t(4;14)(p16;q32), t(14;16)(q32;q23), t(14;20)(q32;q12) a del(17)(p13) dochází zčásti ke snížení negativního prognostického náboje v případě současné trizomie [11, 45]. Dosti frekventní aberace typu zmnožení oblasti 1q21 byla na rozdíl od jiných autorů, prokazujících vztah k mnoha negativním prognostickým faktorům (β2-M, hyperkalcemie, vysoká BJ-urie, infiltrace kostní dřeně myelomovými plazmocyty, IgA izotyp) v naší i v dalších analýzách vysoce významně sdružena s výskytem anémie (viz tab. 3) [22, 23]. Popsaný vztah mezi Hb a zmnožením oblasti 1q21 odpovídá zjištění, že alterace transkripční regulace genů lokalizovaných na chromozomu 1q přispívá k progresi nemoci a krátké délce života, tedy často k průběhu MM s již prvotně nízkou hodnotou Hb [8]. Bylo odhaleno, že další oblast chromozomu 1, tj. oblast 1p36 je často deletovaná, a tato deletovaná oblast nese nádorový supresor, gen p73 s úzkým vztahem k p53 [46]. Výskyt amplifikace chromozomu 1q narůstá s pokročilostí MM a zejména ve spojení s del(13)(q14), jde o nezávislý nepříznivý prognostický faktor s krátkým PFS a OS [47, 48, 49]. Z předložených výsledků vyplývá, že chromozomové aberace měly převážně vztah k významným prognostickým faktorům MM se vztahem k rozsahu a biologickým vlastnostem nádorové tkáně, tj. k hodnotám Hb, trombocytů, β2-M a k zastoupení plazmocytů v kostní dřeni, zatímco asociace s jinými laboratorními ukazateli byla dosti proměnlivá. Za přínos pro klinickou praxi lze považovat mj. spojení trombocytopenie s abnormálním karyotypem [22], nižší hodnoty albuminu i MIg a vysoký výskyt lymfoplazmocytového typu MM u t(11;14)(q13;q32) (22, 50, 51), častější zastoupení IgA izotypu MM v případě t(4;14)(p16;q32) [1, 52], zvýšené hodnoty LDH v případě del(13)(q14) (43) aj. (viz tab. 3).
Analýza vztahu cytogenetických změn k FLC-r
Z analýzy vyplynulo, že hodnoty standardního indexu monoklonality, tj.sFLC-r byly statisticky významně zvýšeny pouze u nemocných s aberací del(13)(q14). Hlubší analýza věnovaná podsouborům s vysokým vs. nízkým indexem sFLC-r (cut-off < 0,01 a > 100) [29, 32] potvrdila vedle relace k del(13)(q14) taktéž signifikantní vztah k del(17)(p13) (TP53) a komplexním změnám karyotypu. Zjištěné vztahy dokládají závislost výše indexu sFLC-r k těmto karyotypovým aspektům patobiologie MM. Analýza modifikovaného indexu mFLC-r odhalila s výjimkou přestavby IgH a trizomie chromozomu 15 významně vyšší hodnoty v případě del(13)(q14), trizomie 17, zmnožení oblasti 1q21, del(17)(p13) a komplexních změn karyotypu. Delece 13q14 se významně častěji vyskytovala u nemocných s indexem mFLC-r > 100. Popsané vztahy neodkrývají pouze vztah mezi sekrečním nábojem myelomového klonu v produkci monoklonálního/„involved“ FLC vs. snížení výskytu a suprese funkce normálních plazmocytů projevující se snížením tvorby normálních/„uninvolved“ FLC k široké škále primárních a sekundárních karyotypových změn, ale i předností modifikovaného indexu mFLC-r před formou standardní (sFLC-r). Naše pozorování, že hodnoty indexu sFLC-r a mFLC-r se v případě přestavby IgH lišily pouze nevýznamně, neodpovídá předchozím zkušenostem, kdy nemocní s „high-risk“ IgH translokacemi, zejména t(14;16)(q32;q23), měli významně vyšší medián hodnot FLC a FLC-r [10, 45]. Současný výskyt t(14;16)(q32;q23) a renální insuficience vedly na rozdíl od samotné translokace bez renální insuficience ke zkrácení OS, takže negativní vztah t(14;16)(q32;q23) k prognóze je zřejmě podmíněn vyšší prevalencí renální insuficience nežli biologickou agresivitou choroby [10]. Klinický přínos iFISH analýzy umocňuje zjištění, že nebyla nalezena významná rozdílnost mezi hodnotami FLC a FLC-r při diagnóze a v relapsu MM v případě „high-risk“ IgH translokací charakteru t(4;14)(p16;q32), t(14;16)(q32;q23) a t(14;20)(q32;q12) oproti nemocným bez jejich průkazu [35]. Naše, obdobně jako některé předchozí studie osvědčila dobrou zkušenost s výpočtem modifikovaného indexu mFLC-r z poměru „involved/uninvolved“ FLC [22, 27, 29, 30]. V poměrně přínosném světle se rovněž jevilo použití výpočtu indexu FLC-dif, neboť při analýze vztahu cytogenetických změn k podskupinám s nízkou vs. vysokou hodnotou FLC-dif byl ve skupině s cut-off ≥ 185 vyjádřen statisticky významný vztah k přítomnosti del(13)(q14), del(17)(p13) a komplexním změnám karyotypu. S výjimkou zmnožení 1q21 byly při použití FLC-dif zjištěny obdobné vztahy, jako v případě mFLC-r, což signalizuje určitou informační ekvivalenci obou indexů.
Analýza vztahu cytogenetických změn k HLC-r
Korelační analýza neshledala významný vztah mezi zvýšením hodnot sHLC-r a přítomností některé z analyzovaných cytogenetických změn, a to ani v případě hlubší analýzy s vyčleněním podsouborů s nízkou vs. vysokou hodnotou sHLC-r (cut-off < 0,022 a > 45 podle doporučení Ludwiga) [19, 33]. Jedinou výjimkou byla významná, desetinásobně zvýšená hodnota mediánu sHLC-r nemocných s t(4;14)(p16;q32), podchycená i v případě modifikovaného indexu mHLC-r a indexu HLC-dif. Přítomnost t(4;14)(p16;q32) při diagnóze MM se tedy vyznačovala statisticky významným vztahem nejen k standardnímu poměru HLC-κ/HLC-λ (sHLC-r), k modifikovanému poměru „involved/uninvolved“ HLC (mHLC-r), ale i k rozdílu hodnot obou izotypů HLC („involved – uninvolved“ HLC) (HLC-dif), tedy parametrů vyjadřujících současný stav produkce monoklonálního Ig (MIg) myelomovými plazmocyty a suprimované syntézy normálního/polyklonálního Ig (PIg) téhož izotypu reziduálními normálními, tj. polyklonálními plazmocyty. Této problematice se doposud pouze okrajově věnovala studie Ludwiga, jež popsala významnou korelaci mezi supresí páru HLC a cytogenetickým „high risk“ obrazem, nikoliv stupněm infiltrace kostní dřeně myelomovými plazmocyty [33].
Z nálezu významného vztahu mezi zvýšenými hodnotami mHLC-r a trizomie 17, zmnožení oblasti 1q21 a nálezu komplexních změn karyotypu vyplývá, že jde o účelně pojatý ukazatel se statisticky širším a významnějším korelačním potenciálem nežli standardní index sHLC-r [16, 18], zatížený význačným rozptylem neobyčejně rozdílných hodnot ztěžujících klinickou interpretaci [28]. Analýza výskytu cytogenetických změn v souborech nemocných s nízkou vs. vysokou hodnotou mHLC-r odhalila v případě cut-off ≥ 89,2 (medián souboru) významně častější přítomnost zmnožení oblasti 1q21 a komplexních změn. Separátní analýza nemocných s IgG izotypem MM rozpoznala na rozdíl od IgA třídy vztah mHLC-r nejen k zmnožení oblasti 1q21, ale i k trizomii 17. Ve skupině nemocných s cut-off indexu HLC-dif ≥ 31,6 byla vedle opět významně častějšího zmnožení oblasti 1q21 a navíc i translokace t(4;14)(p16;q32). Originálně odhalený významný vztah vysokých hodnot indexu mHLC-r k řadě různých chromozomových změn nasvědčuje určité provázanosti cytogenetických aberací s náloží a funkcí myelomového klonu a zprostředkovaně i s velikostí kompartmentu normálních plazmocytů, zejména s prognosticky rizikovými typy karyotypu. Výše indexu mHLC-r, případně i HLC-dif nemá tedy vztah pouze k objemu nádorové masy a redukci normálních plazmocytů, ale i k doposud nedostatečně poznaným vnitřním biologickým vlastnostem myelomových plazmocytů a druhotným změnám „niche“ mikroprostředí kostní dřeně. Složitost vzájemného vztahu cytogenetických změn, hodnot indexu HLC-r a prognostických faktorů MM demonstrují i výsledky multivariační analýzy Bradwella [53] prokazující, že hodnoty HLC-r a β2-M měly k přežití bez progrese významnější vztah, nežli albumin, FLC-r a překvapivě i cytogenetické změny typu parciální delece nebo monozomie chromozomu 13 (51), translokace t(4;14)(p16;q32) (54) a přítomnosti monoalelické del(17)(p13) (40, 53). Stadium 3, vyčleněné s pomocí stratifikačního modelu založeného na hodnotách HLC-r a β2-M se vyznačovalo významně kratším přežitím do progrese nežli při stanovení s pomocí ISS [53].
Analýza vztahu cytogenetických změn k MIg
Za překvapivý nutno považovat nález, že na rozdíl od standardních i modifikovaných indexů FLC-r a HLC-r, případně i FLC-dif a HLC-dif byla zjištěna významně vyšší koncentrace MIg v séru pouze v případě trizomie chromozomu 15. Příčinou mnohem přínosnějších výsledků v případě FLC-r a zejména HLC-r ve srovnání s koncentrací MIg je nepochybně komplexnější podstata indexů FLC-r a HLC-r. Stanovení poměru „involved vs. uninvolved“ sekrečních produktů plazmocytů, tj. FLC a HLC se vyznačuje mnohem komplexnějším vztahem ke změnám v kostní dřeni provázejících rozvoj MM, tj. nejen k proliferačním a dalším vnitřním změnám nádorového klonu, ale i k hloubce útlumu populace normálních plazmocytů. Bylo zjištěno, že k HLC izotypově-specifické supresi polyklonálních Ig dochází v důsledku selektivní změny „niche“ mikroprostředí kostní dřeně vyvolané proliferujícími neoplastickými plazmocyty IgG případně i IgA typu [53]. Podle zjištění Katzmanna suprimují v případě IgG typu monoklonální gamapatie nejistého významu monoklonální IgG plazmocyty IgG populaci s opačným typem lehkého řetězce, takže stupeň suprese těchto neklonálních plazmocytů je předpovědním ukazatelem vysokého rizika maligní transformace monoklonální gamapatie nejistého významu v MM [55].
ZÁVĚR
Studie potvrdila, že cytogenetické vyšetření MM metodou FICTION je přirozenou součástí „dobré klinické praxe“, neboť významně prohlubuje možnosti individuálního poznání biologických vlastností této geneticky velmi heterogenní nemoci. Zejména v případě strukturálních aberací vyčleňujících skupinu se „středním“, tj. t(4;14)(p16;q32) a „vysokým“ prognostickým rizikem, tj. del(13)(q14), del(17)(p13), zmnožením oblasti 1q21 a přítomností komplexních změn byl prokázán významný, i když proměnlivý vztah k ukazatelům rozsahu (Hb, trombocyty) i biologickým vlastnostem myelomové tkáně (β2-M), zatímco v případě trizomie chromozomu 15 a 17 ke zvýšené koncentraci M-proteinu v séru. Byl rovněž ověřen praktický přínos výpočtu modifikovaných indexů mFLC-r a mHLC-r, případně stanovení indexů FLC-dif a HLC-dif s originálním odhalením statisticky významného vztahu zejména modifikovaného indexu mHLC-r, výběrově i indexu HLC-dif ke stěžejním, prognosticky významným strukturálním aberacím, především k t(4;14)(p16;q32), zmnožení oblasti 1q21 a nálezu komplexních změn. Je zřejmé, že k získání širších a všeobecně platných poznatků prohlubujících poznání patobiologie MM je nezbytná, zejména v případě chromozových změn s nízkou incidencí, analýza podstatně rozsáhlejších souborů.
Seznam použitých zkratek
BJ – Bence-Jones
β2-M – β2-mikroglobulin
Ca – vápník
Del – delece
D-S – stážovací systém podle Durieho-Salmona
FISH – fluorescenční in situ hybridizace
iFISH – interfázní fluorescenční in situ hybridizace
FLC – volné lehké řetězce imunoglobulinu („free light chains of immunoglobulin“)
FLC-dif – rozdíl volných lehkých řetězců imunoglobulinu („involved – uninvolved“ FLC)
FLC-r – poměr lehkých řetězců imunoglobulinu séra κ/λ („immunoglobulin free light chain ratio“)
mFLC-r – modifikovaný poměr „involved/uninvolved“ FLC
sFLC-r – standardní poměr „involved/uninvolved“ FLC
IFE – imunofixační elektroforéza
Ig – imunoglobulin
IgA – imunoglobulin-A
IgG – imunoglobulin-G
IgH – přestavba genu pro těžký řetězec imunoglobulinu
IMWG – International Myeloma Working Group
ISS – mezinárodní stážovací systém
Hb – hemoglobin
HLC – pár těžkých/lehkých řetězců imunoglobulinu („immunoglobulin heavy/light chain pairs“)
HLC - dif – rozdíl „involved – uninvolved“ HLC
HLC-r – poměr párů těžkých/lehkých řetězců imunoglobulinu („imunoglobulin heavy/light chain ratio“)
mHLC-r – modifikovaný poměr „involved/uninvolved“ HLC
sHLC-r – standardní poměr „involved/uninvolved“ HLC
i-HLC – „involved-heavy/light chain immunoglobulin“
IMWG – International Myeloma Working Group
LDH – laktátdehydrogenáza
LP typ – lymfoplazmocytový typ
M – medián
MGUS – monoklonální gamapatie nejistého původu („monoclonal gammopathy of undetermined significance“)
MIg – monoklonální imunoglobulin
MM – mnohočetný myelom
mSMART – „Mayo Stratification of Myeloma and Risk--Adapted Therapy“
ns – nesignifikantní
OS – celkové přežívání („overal survival“)
PIg – polyklonální imunoglobulin
Pc – plazmocyt
PFS – doba od diagnózy do progrese nebo úmrtí, („progression free survival“)
R-ISS – revidovaný mezinárodní stážovací systém
SPE – elekroforéza proteinů séra
T – translokace
Thr – trombocyty
u-HLC – „uninvolved heavy/light chain immunoglobulin“
Podíl autorů na přípravě rukopisu
ŠV – hlavní autor, zpracování dat a sepsání rukopisu
BJ – cytogenetická analýza a příprava dat
LP – analýza VLŘ a párů HLC
MM – cytogenetická analýza
PT – spolupráce při výběru a analýze klinických dat
MJ – spolupráce při analýze KD a klinických dat
ZJ – statistická analýza
JM – analýza cytogenetických dat, hlavní korekce rukopisu
Poděkování
Podpora grantové studie IGA MZ ČR NT /12451-5 a NT/1440-3.
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku neshledávají žádný střet zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 28. 12. 2015.
Přijato po recenzi dne 19. 1. 2016.
prof. MUDr. Vlastimil Ščudla, CSc.
3. interní klinika NRE a Hemato-onkologická klinika LF UP a FN v Olomouci
I. P. Pavlova 6
772 00 Olomouc
e-mail: vlastimil.scudla@fnol.cz
Zdroje
1. Avet-Loiseau H, Facon T, Grosbois B, et al. Oncogenesis of multiple myeloma: 14q32 and 13q chromosomal abnormalities are not randomly distributed, but correlate with natural history, immunological features, and clinical presentation. Blood 2002; 99 : 2185–2191.
2. Avet-Loiseau H, Attal M, Moreau M, et al. Genetic abnormalities and survival in multiple myeloma: the experience of the Intergroupe Francophone du Myélome. Blood 2007; 109 : 3489–3495.
3. Kalff A, Spencer A. The t(4;14)(p16;q32) translocation and FGFR3 over expression in multiple myeloma: prognostic implications and current clinical strategies. Blood Cancer 2012; 2 : 1–8.
4. Liebisch P, Döhner H. Cytogenetics and molecular cytogenetics in multiple myeloma. Eur J Cancer 2006; 42 : 1520–1529.
5. Keats J, Reiman T, Maxwell Ch A, et al. In multiple myeloma, t(4;14(p16;q32) is an adverse prognostic factor irrespective of FGFR3 expression. Blood 2003; 101 : 1520–1529.
6. Köningsberg R, Zojer N, Ackermann J, et al. Predictive role of interphase cytogenetics for survival of patients with multiple myeloma. J Clin Oncol 2000; 18 : 804–812.
7. Kumar SK, Mikhael JR, Buadi F, et al. Management of newly diagnosed symptomatic multiple myeloma: updated Mayo stratification of myeloma and risk-adapted therapy (mSMART) consensus guidelines. Mayo Clin Proc 2009; 84 : 1095–1110.
8. An G, Xu Y, Shi L, et al. Chromosome 1q21 gains confer inferior outcomes in multiple myeloma treated with bortezomib but copy number variation and percentage of plasma cells involved have no additional prognostic value. Haematologica 2014; 99 : 353–359.
9. Fonseca R. International Myeloma Working Group molecular classification of multiple myeloma: spotlight review. Leukemia 2009; 23 : 2210–2221.
10. Greenberg AJ, Rajkumar SV, Therneau TM, Singh PP, Dispenzieri A, Kumar SK. Relationship between initial clinical presentation and the molecular cytogenetic classification of myeloma. Leukemia 2014; 28 : 398–403.
11. Kumar S, Fonseca R, Ketterling RP, et al. Trisomies in multiple myeloma: impact on survival in patients with high-risk cytogenetics. Blood 2012; 119 : 2100–2105.
12. Dispenzieri A, Kyle RA, Merlini G, et al. International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. Leukemia 2009; 23 : 215–224.
13. The Binding Site Group Ltd, editor. Serum free light chain analysis plus Hevylite. 7 th ed. Birmingham: The Binding Site Ltd, 2015.
14. Alexanian R. Blood volume in monoclonal gammopathy. Blood 1997; 49 : 301–307.
15. Akilesh S, Christianson GJ, Roopenian DC, Shaw AS. Neonatal FcR expression in bone marrow-derived cell functions to protect serum IgG from catabolism. J Immunol 2007; 179 : 4580–4588.
16. Bradwell AR, Harding SJ, Fourrier NJ, et al. Assessment of monoclonal gammopathies by nephelometric measurement of individual immunoglobulin k/l ratios. Clin Chemistry 2009; 55 : 1646–1655.
17. Keren DF. Heavy/light-chain analysis of monoclonal gammopathies. Clin Chemistry 2009; 55 : 1606–1608.
18. Katzmann JA, Kyle RA, Benson J, et al. Screening panels for detection of monoclonal gammopathies. Clin Chemistry 2009; 55 : 1517–1522.
19. Ludwig H, Milosavljevic D, Zojer N, et al. Immunoglobulin heavy/light chain ratios improve paraprotein detection and monitoring, identify residual disease and correlate with survival in multiple myeloma patients. Leukemia 2013; 27 : 213–219.
20. Bhutani M, Landgren O, Korde N. Serum heavy-light chains (HLC) and free-light chains (FLC) as predictors for early CR in newly diagnosed myeloma patients treated with carfilzomib, lenalidomide, and dexamethasone. 55TH ASH Annual Meeting, 2013;Abstr. No. 762.
21. Batinic J, Perič Z, Šegulja D, et al. Immunoglobulin heavy/light chain analysis enhances the detection of residual disease and monitoring of multiple myeloma patients. Croat Med J 2015; 56 : 263–271.
22. Jekarl DW, Min ChK, Kwon A, et al. Impact of genetic abnormalities on the prognosis and clinical parameters of patients with multiple myeloma. Ann Lab Med 2013; 33 : 248–254.
23. Hanamura I, Stewart JP, Huang Y, et al. Frequent gain of chromosome band 1q21 in plasma-cell dyscrasias detected by fluorescence in situ hybridization: incidence increases from MGUS to relapsed myeloma and is related to prognosis and disease progression following tandem stem-cell transplantation. Blood 2006; 108 : 1724–1732.
24. Hájek R, Adam Z, Ščudla V, et al. Diagnostika a léčba mnohočetného myelomu. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí ČHS a Slovenskou myelómovou Společností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze Hematol dnes 2012; 18(Supplementum): 1–92.
25. International Myeloma Working Group criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121 : 749–757.
26. Balcárková J, Procházková K, Ščudla V, et al. Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem. Transfuze Hematol dnes 2007; 13 : 176–182.
27. Kyrtsonis MCH, Theodoros P, Vassilakopoulos TP, et al. Prognostic value of serum free light chain ratio at diagnosis in multiple myeloma. Br J Haematol 2007; 137 : 240–243.
28. Ščudla V, Lochman P, Pika T, et al. Relationship of differences in immunoglobulin heavy/light chain pairs (HevyliteTM), selected laboratory parameters and stratification systems in different immunochemical types of multiple myeloma. Biomed Pap Med Fac Univ Palacky Olomouc 2016;159:(in press). Doi:10.5507/bp.2015.032 (Epub ahead of print).
29. Larsen JT, Kumar SK, Dispenzieri A, Kyle RA, Katzmann JA, Rajkumar SV. Serum free light chain ratio as a biomarker for high-risk smoldering multiple myeloma. Leukemia 2013; 27 : 941–946.
30. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15 : 538–548.
31. Ščudla V, Zemanová M, Minařík J, et al. International prognostic index (IPI) – a critical comparison with five multiple myeloma staging systems in the group of 270 patients treated by conventional chemotherapy. Neoplasma 2006; 53 : 277–284.
32. Ghobrial I.M, Langren O. How I treat smoldering multiple myeloma. Blood 2014; 124 : 3380–3388.
33. Ludwig H, Milosavljevic D, Zojer N, et al. Supression of the non-involved HLC pair correlates with survival in newly diagnosed and relapsed/refractory patients with myeloma. Congress of European Haematology Association, Milano 2014; P-980.
34. Keats JJ, Chessi M, Egan JB, et al. Clonal competition with alternating dominance in multiple myeloma. Blood 2012; 120 : 1067–1076.
35. Brioli A, Giles H, Pawlyn Ch, et al. Serum free immunoglobulin light chain evaluation as a marker of impact from intraclonal heterogeneity on myeloma outcome. Blood 2014; 123 : 3414–3419.
36. Mikhael JR, Dingli D, Vivek R, et al. Management of newly diagnosed symptomatic multiple myeloma: updated Mayo stratification of myeloma and risk-adapted therapy (mSMART) consensus guidelines 2013. May Clin Proc 2013; 88 : 360–374.
37. Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised International Staging System for multiple myeloma: A report from International Myeloma Working Group. J Clin Oncol 2015; 33 : 2863–2869.
38. Avet-Loiseau H. Role of genetics in prognostication in myeloma. Best Pract Res Clin Haematol 2007; 20 : 625–635.
39. Shah JJ, Narang M, Abonour R, et al. Clinical outcomes in patients with newly diagnosed multiple myeloma and t(4;14)(p16;q32) in the connect MM registry. Clin Lymphoma Myeloma 2015; 15, Suppl 3: e137.
40. Gertz MA, Lacy MQ, Dispenzieri A, et al. Clinical implications of t(11;14)(q13;q32)(q13;q32), t(4;14)(p16;q32)(p16,3;q32), and -17p13 in myeloma patients treated with high-dose therapy. Blood 2005; 106 : 2837–2840.
41. Avet-Loiseau H, Malard F, Campion L, et al. Translocation t(14;16)(q32;q23) and multiple myeloma: is it really an independent prognostic factor? Blood 2011; 117 : 2009–2011.
42. Zojer N, Königsberg R, Ackermann J, et al. Deletion of 13q14 remains an independent adverse prognostic variable in multiple myeloma despite its frequent detection by interphase fluorescence. Blood 2000; 95 : 1925–1930.
43. Facon T, Avet-Loiseau H, Guillerm G, et al. Chromosome 13 abnormalities identified by FISH analysis and serum beta2-microglobulin produce a powerful myeloma staging system for patients recveiving high-dose therapy. Blood 2001; 97 : 1566–1571.
44. Lodé L, Eveillard M, Trichet V, et al. Mutation in TP53 are exclusively associated with del(17p) in multiple myeloma. Haematologica 2010; 95 : 1973–1976.
45. Kumar S, Zhang L, Dispenzieri A, et al. Relationship between elevated immunoglobulin free light chain and the presence of IgH translocations in multiple myeloma. Leukemia 2010; 24 : 1498–1505.
46. Zhan F, Huang Y, Colla S, et al. The molecular classification of multiple myeloma. Blood 2006; 108 : 2020–2028.
47. Shaughnessy JD Jr, Zhan F, Burington BE, et al. A validated gene expression model of high-risk multiple myeloma is defined by deregulated expression of genes mapping to chromosome 1. Blood 2007; 109 : 2276-2284.
48. Wu KL, Beverloo B, Lokhorst HM, et al. Abnormalities of chromosome 1p/q are highly associated with chromosome 13/13q deletions and are an adverse prognostic factor for the outcome of high-dose chemotherapy in patients with multiple myeloma. Br J Haematol 2007; 136 : 615–623.
49. Hebraud B, Leleu X, Lauwers-Cances V, et al. Deletion of the 1p32 region is a major independent prognostic factor in young patients with myeloma: the IFM experience on 1195 patients. Leukemia 2014; 28 : 675–679.
50. Fonseca R, Van Wier SA, Chang WJ, et al. Prognostic value of chromosome +q21 gain by fluorescent in situ hybridization and increase CKS1B expression in myeloma. Leukemia 2006; 20 : 2034–2040.
51. Fonseca R, Blood ER, Oken MM, et al. Myeloma and the t(11;14)(q13;q32)(q13;q32); evidence for a biologically defined unique subset of patients. Blood 2002; 99 : 3735–3741.
52. Karlin L, Soulier J, Chandesris O, et al. Clinical and biological features of t(4;14)(p16;q32) multiple myeloma: a prospective study. Leu Lymphoma 2011; 52 : 238–246.
53. Bradwell AR, Harding S, Fourrier N, et al. Prognostic utility of intact immunoglobulin Ig´kappa/Ig´lambda ratios in multiple myeloma patients. Leukemia 2013; 27 : 202–207.
54. Moreau P, Facon T, Leleu X, et al. Recurrent 14q32 translocations determine the prognosis of multiple myeloma, especially in patients receiving intensive chemotherapy. Blood 2002; 100 : 1579–1583.
55. Katzmann JA, Clark R, Kyle RA, et al. Supression of uninvolved immunoglobulins defined by heavy/light chain pair suppression is a risk factor for progression of MGUS. Leukemia 2013; 27 : 208–212.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo 2- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Liečba starších pacientov s myelodysplastickým syndrómom, nevhodných na intenzívnu terapiu a jej finančné dôsledky – skúsenosti jedného centra
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) České skupiny pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP
- Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP
- Cena České hematologické společnosti za nejlepší původní vědeckou práci v oboru hematologie v roce 2015
- Výběr z tisku a zprávy o knihách
- Analýza vztahu výsledků cytogenetického vyšetření k poměru volných lehkých řetězců κ/λ (FLC-r, FreeliteTM), páru těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM ) a vybraných prognostických faktorů vyšetřených při diagnóze mnohočetného myelomu
- Využití interfázní fluorescenční in situ hybridizace pro analýzu CD34+ buněk v periferní krvi u nemocných s myelodysplastickými syndromy
- Profylaxe versus léčba „on demand“ u dospělých pacientů s těžkou hemofilií A – zkušenosti z FN Brno
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP
- Liečba starších pacientov s myelodysplastickým syndrómom, nevhodných na intenzívnu terapiu a jej finančné dôsledky – skúsenosti jedného centra
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) České skupiny pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP
- Profylaxe versus léčba „on demand“ u dospělých pacientů s těžkou hemofilií A – zkušenosti z FN Brno
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



