-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunogenetické faktory ovlivňující aloimunizaci proti antigenům krevních skupinových systémů
Immunogenetic factors influencing red blood cell alloimmunization
The development of red blood cell alloantibodies is induced by the transfusion of antigen incompatible blood products. Similarly, incompatibility between maternal and foetal erythrocyte antigens may be the cause of alloantibody occurrence in pregnant women. The presence of antibodies may have clinical consequences such as haemolytic transfusion reactions or haemolytic disease of the foetus and new-born. In transfusion medicine, antibodies present certain complications in the selection of suitable blood products, especially in patients who require long-term RBC transfusion therapy. Individuals exposed to RBC alloantigens can be divided into responders (producing alloantibodies) and non-responders (without alloantibody production). The aim of this work was to summarize current knowledge concerning alloimmunization based on immunogenetic predisposing risk factors, focusing on the occurrence of specific alloantibodies in association with particular MHC HLA Class II molecules.
KEY WORDS:
transfusion – alloimmunization – RBC antibodies – HLA system
Autoři: A. Malušková 1; P. Kovářová 1; M. Kořístka 1; F. Mrázek 2; Z. Čermáková 1,3
Působiště autorů: Krevní centrum, Fakultní nemocnice Ostrava 1; Ústav imunologie, Fakultní nemocnice Olomouc, Lékařská fakulta UP v Olomouci 2; Lékařská fakulta OU v Ostravě 3
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 3, p. 157-167.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Tvorba aloimunních protilátek proti červeným krvinkám je důsledkem transfuze antigenně neshodných transfuzních přípravků (TP). Podobně inkompatibilita mezi erytrocytovými antigeny plodu a matky může být příčinou výskytu aloprotilátek u gravidních žen. Přítomnost protilátek může mít klinické důsledky v podobě hemolytické potransfuzní reakce či hemolytického onemocnění plodu a novorozence. V transfuzním lékařství představuje přítomnost aloimunních protilátek komplikaci při zajišťování odpovídajících TP především u pacientů vyžadujících dlouhodobější transfuzní terapii. Jedince, kteří byli vystaveni aloantigenům červených krvinek, lze rozdělit na respondery (tvořící aloprotilátky) a non-respondery (bez tvorby aloprotilátek). V této práci jsme shrnuli dosavadní poznatky o aloimunizaci z hlediska imunogenetických predispozičních rizikových faktorů, se zaměřením na výskyt specifických aloprotilátek ve vztahu s určitými HLA molekulami II. třídy.
KLÍČOVÁ SLOVA:
transfuze – aloimunizace – protilátky proti červeným krvinkám – HLA systémÚVOD
Aloimunizace je proces, při kterém imunitní systém rozpoznává neznámé antigeny (aloantigeny) jiného jedince téhož druhu a reaguje na ně např. produkcí protilátek (aloprotilátky). Aloimunizace vykazuje určité podobnosti s protiinfekční imunizací, je také ovlivněna imunogenicitou antigenu a aktuálním „zánětlivým“ prostředím, vyskytuje se však v daleko nižší míře než heterologní imunizace [1]. Existují tři základní možnosti aloimunizace spojené s tvorbou protilátek: aplikace transfuzního přípravku (TP), těhotenství a transplantace. Přehled cílových antigenů a stupeň aloimunizace je uveden v tabulce 1.
Tab. 1. Podíl hlavních aloantigenů na imunizaci 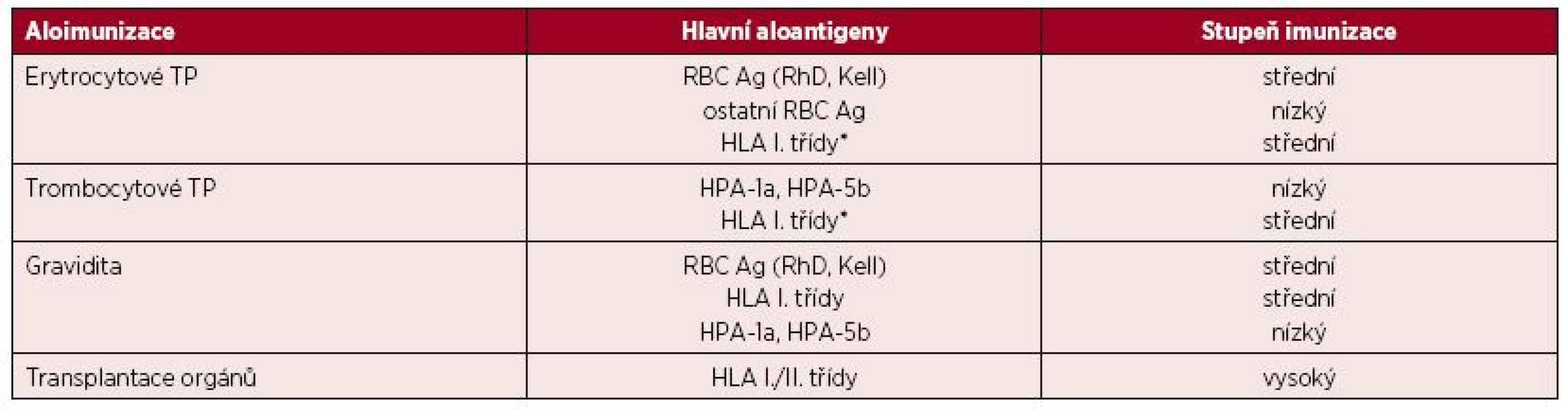
(Upraveno podle [1]) *hlavně zbytkové leukocyty u nedeleukotizovaných TP a trombocyty Léčba pomocí TP se začala používat až v první polovině 20. století, kdy byl plně pochopen z hlediska transfuzního lékařství nejdůležitější krevní skupinový systém AB0, který je charakterizován jak přítomností antigenů na červených krvinkách, tak současně výskytem „přirozených“ protilátek v plazmě. V současné době je známo 306 antigenů řazených do 36 krevních skupinových systémů potvrzených ISBT (International Society of Blood Transfusion) [2].
Vedle AB0 systému jsou u dárců plné krve v ČR vyšetřovány standardně také další systémy, především Rh systém (C/c, D, E/e) a Kell. Ostatní antigenní systémy se zpravidla určují až v případě potřeby, tj. při výběru TP pro pacienty s identifikovanými aloprotilátkami proti červeným krvinkám. Pacientovi s klinicky signifikantní specifickou protilátkou je potřeba zajistit kompatibilní TP, obsahující erytrocyty bez této antigenní specificity. Příčinou aloimunizace vůči antigenům červených krvinek jsou tedy nejčastěji transfuze erytrocytových přípravků kompatibilní většinou pouze v systému AB0 a antigenu RhD.
IMUNOGENICITA, RESPONDEŘI A NON-RESPONDEŘI
Krevní transfuze lze považovat v podstatě za nejrozšířenější typ transplantace. Ročně je na celém světě podáno podle Světové zdravotnické organizace (WHO) okolo 100 milionů TP. Důvod, proč u některých jedinců dojde k tvorbě aloprotilátek, zatímco u jiných jsou cizorodé antigeny tolerovány, je stále předmětem intenzivního výzkumu. Jednu z příčin představuje tzv. imunogenicita, což je schopnost antigenu indukovat imunitní odpověď charakterizovanou tvorbou aloimunních protilátek. Jednotlivé skupinové systémy erytrocytů vykazují různou imunogenicitu, např. v případě vysoce imunogenního erytrocytového antigenu RhD dochází k aloimunizaci RhD negativních pacientů po expozici RhD pozitivními erytrocyty, ve 20–30 % případů [3, 4]. K aloimunizaci v ostatních erytrocytových antigenních systémech dochází, v případě aplikace AB0 a RhD kompatibilních erytrocytových TP, u 8–10 % pacientů [5, 6]. Z toho vyplývá, že u většiny příjemců TP nedochází navzdory inkompatibilitě v některém z krevních skupinových systémů k tvorbě aloprotilátek a tito jedinci jsou pak označováni jako non-respondeři. Skupinu aloimunizovaných pacientů, neboli responderů, lze následně rozdělit na ty, kteří i po opakované expozici TP tvoří pouze monospecifickou protilátku (tzv. respondeři) a pacienty tvořící protilátky proti dvěma a více antigenním specificitám (tzv. multirespondeři). Z dosud publikovaných studií vyplývá, že 22–30 % aloimunizovaných pacientů patří do skupiny multiresponderů [7, 8]. U zdravých RhD negativních dobrovolníků však byla zaznamenána signifikantně vyšší míra imunizace než u pacientů indikovaných k podání TP, která po druhé expozici RhD pozitivními erytrocyty dosahuje až 93 % [9]. U pacientů s hemoglobinopatiemi (se srpkovitou anémií či talasemií) činí podíl responderů 18–47 % a je až čtyřnásobně vyšší než stupeň aloimunizace u pacientů bez těchto dědičných chorob [10–12] a transfundovaných z jiných příčin. Vysoká míra imunizace těchto pacientů je stále předmětem zkoumání, protože vedle dlouhodobého a pravidelného vystavování se imunizačním stimulům během transfuzní léčby by další z možných vysvětlení mohly nabídnout polymorfismy genů s imunoregulační funkcí.
ÚLOHA HLA MOLEKUL V ALOIMUNIZACI
Tvorba aloimunních protilátek je podmíněna prezentací peptidů derivovaných z antigenů krevních skupinových systémů prostřednictvím HLA molekul II. třídy. Tato skutečnost vedla k myšlence, zda má polymorfismus HLA molekul II. třídy, jež zásadně ovlivňuje schopnost vazby zpracovaných peptidových fragmentů, spojitost s tvorbou konkrétní specifické aloprotilátky. Genová oblast hlavního histokompatibilního systému na krátkém raménku 6. chromozomu stále patří mezi jednu z nejvíce zkoumaných oblastí lidského genomu. V této oblasti se totiž nacházejí geny kódující HLA antigeny, které hrají klíčovou roli při regulaci imunitní odpovědi. HLA antigeny II. třídy jsou heterodimery skládající se z α a ß řetězců kódovaných geny A, respektive B ležícími v lokusech HLA-DR, DQ a DP. Vazebný žlábek tvoří α1 a ß1 domény obou řetězců.
Obr. 1. HLA-molekula II. třídy 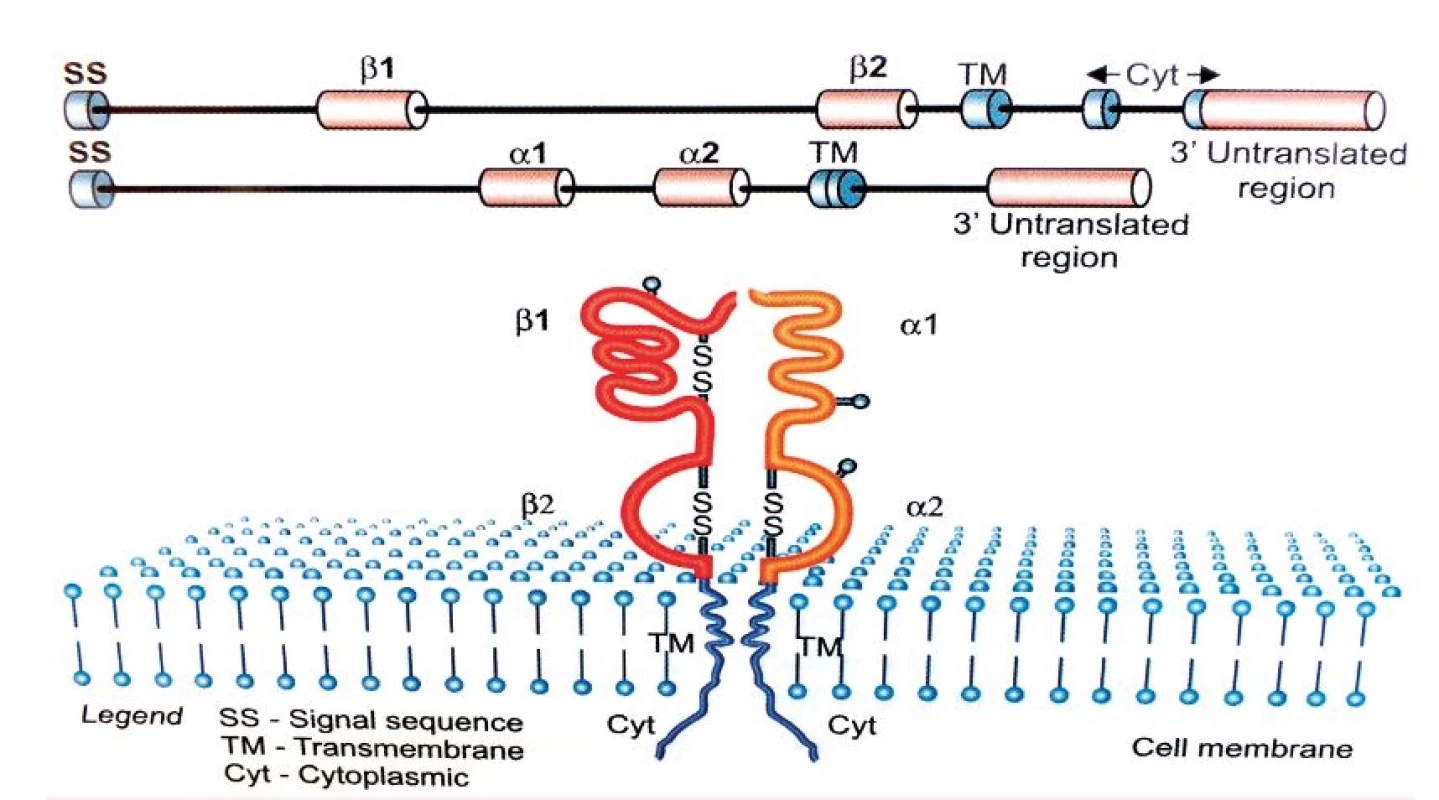
(podle [13, kap. 4]) Geny kódující glykoproteiny HLA II. třídy jsou vysoce polymorfní, přičemž nejvyšší polymorfismus vykazuje právě oblast vazebného žlábku, která slouží k prezentaci peptidového fragmentu. U HLA-DR molekul je polymorfní pouze řetězec ß kódovaný geny HLA-DRB1, 3, 4 a 5, zatímco u HLA-DQ a DP antigenů, kódovaných geny DQA1, DQB1, DPA1, DPB1, jsou polymorfní oba řetězce, tedy α i ß [13, kap. 4]. Exogenní antigeny jsou fagocytovány APC buňkami a štěpeny v lysozomech či jiných organelách obsahujících proteolytické enzymy. Odtud jsou pak dopravovány endozomy do specializovaných endozomálních váčků označovaných jako MCII, kam jsou transportovány rovněž nově vytvořené molekuly HLA II. třídy. Zde dochází k vazbě zpracovaného antigenního peptidu na vazebný žlábek HLA molekuly. Peptidy prezentované molekulami HLA II. třídy obsahují minimálně 13 aminokyselin, ale mohou dosahovat délky 30 reziduí a více [14, 15]. Kromě peptidů zpracovaných z exogenních antigenů mohou tyto molekuly vázat i peptidové fragmenty z toxinů, neinfekčních virionů, fagocytovaného materiálu a prezentovat je CD4 pozitivním Th lymfocytům. Komplex HLA antigenu II. třídy s peptidem je rozeznáván antigenně specifickým TCR receptorem T-lymfocytů, který je strukturně podobný imunoglobulinům. TCR receptor je tvořen dvěma řetězci (nejčastěji α a ß), jejichž variabilita je důsledkem, podobně jako u imunoglobulinů, náhodných genových přestaveb, ke kterým dochází během zárodečného vývoje T-lymfocytů v kostní dřeni a následně při vyzrávání v thymu. T-lymfocyty pomocí svého TCR receptoru zkoumají konformační změny na „vlastních“ HLA molekulách, které jsou způsobeny vazbou antigenního peptidu do vazebného žlábku. Pokud T-lymfocyt zaznamená změnu, inkorporuje se do hlubších struktur HLA za vzniku tzv. imunologické synapse. T-lymfocyty ovšem rozpoznávají i cizí (alogenní) HLA molekuly, a to buď přímo (vazbou na alogenní antigeny HLA II. třídy s peptidem), nebo nepřímo, tj. po jejich zpracování APC buňkami a prezentaci z nich odvozených peptidů vlastními HLA molekulami II. třídy. HLA molekuly se podílejí na regulaci imunitní odpovědi tím, že vážou antigenní peptidy ve svém žlábku a prezentují je T-lymfocytům (tzv. HLA restrikce), specifickou vazbou peptidového fragmentu však současně určují, které T-lymfocyty budou schopné se na komplex HLA-peptid vázat svým TCR receptorem a konečně vymezují B-lymfocyty vázající na svém BCR receptoru (= povrchový IgM) stejný typ antigenu, které budou aktivovanými T-lymfocyty stimulovány k tvorbě protilátek [13]. Aloimunní protilátky jsou T-dependentní, to znamená, že k aktivaci příslušných B-lymfocytů je zapotřebí signálu z buněk Th CD4+. Při tomto ději je důležité, aby B-lymfocyt svým BCR rozpoznal antigen, tento antigen pohltil, rozštěpil na peptidové fragmenty a navázaný na MHC II antigen jej prezentoval na svém povrchu T-lymfocytům. Stejné komplexy HLA – peptidový fragment prezentují i jiné APC buňky (dendritické), které pohltily identický aloantigen. Nejprve tedy musí APC buňka iniciovat vznik klonu aktivovaných Th lymfocytů schopných vázat svým TCR receptorem peptidový fragment prezentovaný konkrétní HLA molekulou, protože pouze takto aktivovaný Th lymfocyt může poskytnout B-lymfocytu potřebný signál k proliferaci a diferenciaci v plazmatické buňky produkující specifické protilátky [14]. HLA systém člověka charakterizuje vysoký počet genů (více než 200) a současně vysoký počet alel, tj. variant jednotlivých genů. HLA systém je tedy vysoce polymorfní, což znamená, že každý jedinec, s výjimkou monozygotních dvojčat a eventuálně HLA identických sourozenců, nese unikátní sestavu molekul HLA I. a II. třídy, což podmiňuje jeho individuální imunologickou reaktivitu [15]. Aktuální počet HLA alel [16] je uveden v tabulce 2.
Tab. 2. Počet variant HLA genů 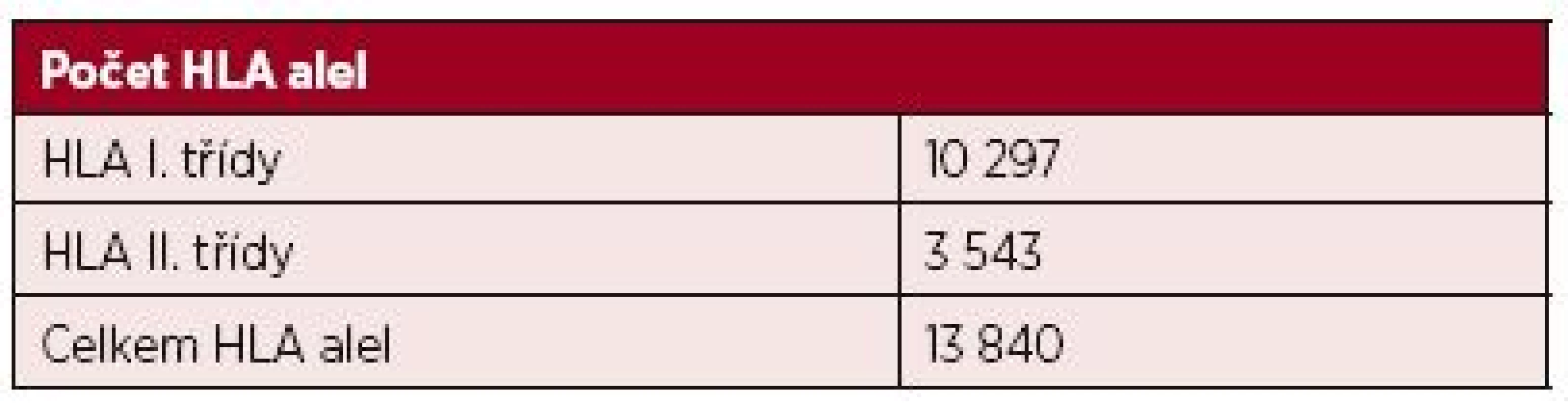
(Upraveno podle [16]) Na fenomén HLA restrikce v souvislosti s indukcí tvorby protilátek bylo poprvé poukázáno u aloimunizace proti specifickému antigenu HPA-1a krevních destiček. Aloprotilátka anti-HPA-1a je nejčastější příčinou rozvoje fetomaternální aloimunitní trombocytopenie (FMAITP). První sérologické analýzy [17, 18] i pozdější genetická analýza potvrdila přítomnost alely HLA-DRB3*01 : 01 u 91 % responderů (pc < 0,001, OR = 27,9) a alely HLA-DQB1*02 : 01 dokonce u 94 % responderů (pc < 0,001, OR = 25,4) [19]. Experimentální potvrzení vzniku různě dlouhých peptidů se shodnou centrální částí odvozených z HPA-1a antigenu a prezentované molekulou HLA-DRB3*01 : 01 [20] potvrdil mechanismus, popisovaný v dřívějších studiích [21, 22]. K tomuto jevu dochází tak, že molekula HLA II. třídy váže a chrání hlavní epitop extracelulárního antigenu před proteolytickým štěpením již v časné fázi jeho zpracování. Následné štěpení peptidových fragmentů je náhodné a zcela variabilní, čímž vzniká délkový polymorfismus fragmentů obsahujících shodný hlavní epitop [23, 24]. Další signifikantní asociace mezi HLA molekulami a aloimunizací k dalším HPA antigenům se vzhledem k malým testovaným souborům nepodařilo prokázat [25, 26, 27].
HLA – DRB1 ASOCIACE S TVORBOU PROTILÁTEK PROTI ANTIGENŮM ČERVENÝCH KRVINEK
Transfuze erytrocytových transfuzních přípravků je nejčastější příčinou aloimunizace. Pouze menšina, v průměru méně než 10 % příjemců (inkompatibilní) transfuze, začne vytvářet aloprotilátky [28, 29]. V doposud publikovaných výsledcích nebyla zatím identifikována konkrétní HLA alela II. třídy, která by představovala jednoznačnou genetickou predispozici k tvorbě aloprotilátek. Zjištěné frekvence variant HLA-DRB1 genu u pacientů s klinicky významnými aloprotilátkami proti antigenním systémům erytrocytů nedosáhly v žádné z publikovaných studií tak vysokou hodnotu OR jako v případě aloimunizace proti HPA-1a antigenu.
Rh systém
Rh systém je nejpolymorfnějším z antigenních systémů erytrocytů a pomocí polyklonálních sér lze rozlišit 56 antigenů (podle ISBT nomenklatury označovány RH1 až RH61) a je také vedle AB0 klinicky nejvýznamnějším systémem v transfuzním lékařství. Základními antigeny jsou D, C, c, E, e a Cw. Imunitní odpověď na antigeny proteinového typu, což je případ Rh systému, je typickým příkladem protilátkové odpovědi závislé na T-lymfocytech. Tento typ odpovědi je závislý na kooperaci mezi B - a TH-lymfocyty. Z protilátek jsou klinicky nejvýznamnější anti-D a anti-c způsobující těžké HON a mírné až těžké HTR pozdního typu [30]. Proteiny RhD a RhCcEe (a jejich varianty) jsou kódovány dvěma geny lokalizovanými na chromozomu 1, RHD a RHCcEe. Zatímco RhD pozitivní jedinci mají alespoň jednu kopii RHD genu, negativní jedinci (z kavkazské populace) mají obě kopie RHD genu deletované. Téměř 70 % RhD negativní černošské populace nese kompletní, ale neaktivní RHD – pseudogen (RHDΨ) [31]. RhD protein je považován za antigen s nejvyšším stupněm imunogenicity (hned po AB0 systému). To je způsobeno hlavně tím, že rozdíl mezi proteinem RhD a RhCcEe u RhD negativních jedinců činí přibližně 35 aminokyselin, takže pravděpodobnost tvorby imunogenních epitopů prezentovaných v kontextu s molekulami HLA II. třídy specifickým TCR receptorům lymfocytů je mnohem větší než v případě rozdílu jen v jedné aminokyselině u polymorfismu RhE/e, nebo polymorfismu RhC/c daného substitucí 4 aminokyselin, z nichž pouze záměna Ser(C)103Pro(c) je umístěna v extracelulární části [32].
V prvotní práci byla studována role HLA antigenů v aloimunizaci na souboru 76 anti-D pozitivních matek a 54 anti-D negativních, tj. neimunizovaných matek [33]. Sérologickým vyšetřením HLA-A, B, C, DR a DQ antigenů bylo zjištěno zvýšené riziko (OR > 2) u HLA-A3, B17, Cw2 a DR4 antigenů. Tento nález ovšem nebyl potvrzen novější studií, ve které u 171 pacientů s monospecifickou protilátkou anti-D byla nalezena statisticky signifikantní asociace pouze s HLA-DRB1*01 skupinou alel (OR = 1,8) a současně u kombinované přítomnosti alelických skupin HLA-DRB1*01, *03, *11 (OR = 2,1) [41]. Výsledné nízké OR svědčí o malém podílu HLA restrikce v prezentaci z antigenu RhD odvozených peptidů a je i možným vysvětlením vysokého stupně imunogenicity antigenu RhD. Tento předpoklad byl potvrzen také ve studii, jejímž cílem bylo pomocí synteticky připravených 68 překrývajících se peptidů o délce 15 aminokyselin, jež představují kompletní sekvenci RhD proteinu, identifikovat dominantní epitopy vyvolávající T-lymfocytovou odpověď. Autoři zjistili, že k signifikantní proliferaci mononukleárů, izolovaných od aloimunizovaných dárců, vedly všechny synteticky připravené peptidy a ve většině případů bylo stimulačních několik peptidů současně. Detekce těchto epitopů by mohla být potencionálním začátkem pro vývoj peptidové imunoterapie jako prevence HON a rovněž navržení syntetického imunogenu by mohlo nahradit imunizaci dobrovolníků pomocí RhD pozitivních krvinek při přípravě humánního séra anti-D [34]. Druhou nejčastěji detekovanou aloprotilátkou v systému Rh je anti-E. V práci Schoenewilla et al. byla ve skupině 136 pacientů nalezena signifikantně zvýšená frekvence HLA-DRB1*09 (8,8 % vs. 2,5 %, OR = 3,7) a v případě kombinované přítomnosti signifikantně zvýšená frekvence alelických skupin DRB1*07 a *09 (36 % vs. 22 %, OR = 2,2). V případě anti-C/c protilátek, jejichž výskyt je v kavkazské populaci vzácnější, nebyly zvýšené frekvence HLA-DRB1 variant statisticky významné. Příčinou byl malý soubor pacientů tvořený 11 pacienty s anti-C a 30 s anti-c protilátkou [41].
Kell (K) systém
Kell systém je charakterizovaný základním antigenním/alelickým párem: antigenem K (Kell, KEL1) a k (Cellano, KEL2) a dalšími páry, např. Kpa (Penny, KEL3) a Kpb (Rautenberg, KEL4). Celkem bylo dosud identifikováno 35 antigenů. Antigen K je třetím nejimunogennějším antigenem erytrocytů (po AB0 a RhD). K/k polymorfismus je dán jednonukleotidovou substitucí c. 698C > T vedoucí k záměně methioninu za threonin na 33. pozici peptidového řetězce. Tato mutace vede k narušení N glykosylačního místa antigenu K, a tím k chybění glykosylace, což vysvětluje jeho vysokou antigenicitu. Antigen K je méně frekventní než k, protilátka anti-K může způsobit těžký HON s útlumem erytropoézy plodu a těžší formy HTR [30, 31]. Chiaroni et al. nalezli zvýšenou frekvenci HLA-DRB1*11 v souboru 54 pacientů (57 %) oproti kontrolní skupině (27 %), OR = 3,5. Kombinovaná frekvence skupin alel HLA-DRB1*11 a DRB1*13 byla signifikantně vyšší u pacientů s anti-K protilátkou (83 %) než u kontrolní skupiny (52 %), OR = 4,5. Autoři podrobně analyzovali HLA-DRB1*11 a *13 alely, jež sdílejí společnou sekvenci v HLA-DRB1 genu, kódující P4 kapsu vazebného žlábku a obsahující 3 specifické aminokyselinové zbytky v pozicích 13, 70 a 74. Tato sekvence aminokyselin byla častější u imunizovaných pacientů než v kontrolní skupině. Toto zjištění vedlo autory k závěru, že zmíněná sekvence S13D70A74 je odpovědná za prezentaci peptidu, odvozeného z antigenu K, T-lymfocytům. Praktické využití svého nálezu vidí autoři především u gravidních žen Kell negativních HLA-DRB1*11 a/nebo HLA-DRB1*13 pozitivních, u kterých by se prováděl častější odběr vzorků z důvodu vyššího rizika imunizace antigenem Kell [35]. Noizat-Pirenne se spolupracovníky nalezli signifikantní asociaci mezi anti-K aloimunizací a HLA--DRB1 geny jen v případě alelické skupiny DRB1*13 (28,33 % vs. 13,54 %, OR = 2,5) [37]. Důvodem mohl být soubor 30 aloimunizovaných pacientů zařazených do analýzy oproti 54 pacientům s protilátkou anti-K ve studii od Chiaroniho et al. [35]. Skutečnost, že ve skupině pacientů s protilátkou anti-K byla evidována značná různorodost HLA molekul a distribuce získaných fenotypů korespondovala s distribucí fenotypů v kontrolní skupině, vedla autory k závěru, že vazba, respektive prezentace peptidů odvozených z antigenu K není omezena specifickou HLA-DRB1 molekulou [37]. Tento poznatek koreluje i se zjištěním Schoenewilla et al., který v souboru 156 pacientů s anti-K nenalezl signifikantní asociaci s žádnou HLA-DRB1 alelou a potvrdil tak předpoklad, že peptidový fragment zpracovaný z antigenu K mohou v podstatě prezentovat všechny HLA-DRB1 varianty vyskytující se v kavkazské populaci. Omezení HLA restrikce je pravděpodobně jedním z faktorů ovlivňujícím imunogenicitu jednotlivých antigenů červených krvinek. Schoenewille et al. v souvislosti s imunizací anti-K prokázali pouze signifikantně vyšší kombinovanou frekvenci alel DRB1*01, *11, *13 nebo *15 u pacientů (80,1 %) než u kontrol (58,3 %), s OR = 2,9 [41].
Kidd (Jk ) systém
Kidd systém tvoří alelický pár JK*A a JK*B lišící se substitucí c. 838G >A, ta vede k záměně Asp280Asn ve čtvrté extracelulární doméně Kidd antigenu. Obě alely se dědí kodominantně. Genotypové frekvence v kavkazské populaci tvoří zhruba čtvrtina homozygotů Jka Jka, druhá čtvrtina Jkb Jkb a asi polovina heterozygotů (Jka Jkb). Kidd glykoprotein je přenašečem močoviny [30]. Protilátky anti-Jk mohou být velmi nebezpečné, jelikož jsou obtížně detekovatelné, mají tendenci rychle mizet z plazmy a mohou způsobit těžké HTR především pozdního typu [31]. Reviron v analyzovaném souboru 20 pacientů a gravidních žen s protilátkou anti-Jka nalezli statisticky významně vyšší frekvenci alelické skupiny HLA-DRB1*01 než v kontrolní skupině (55 % vs. 17 %, OR 5,9). HLA-DRB1*10 byla také více zastoupena u pacientů než u kontrol (10 % vs. 3 %, OR 4,3), rozdíl však nebyl významný [36]. Silná asociace HLA-DRB1*01 s imunizací anti-Jka byla potvrzena i na větším souboru 68 pacientů Schoenewilla et al., s OR = 3,1 [41]. Méně častá protilátka anti-Jkb byla studována na souboru pouze 11 pacientů, kdy byla zaznamenána zvýšená frekvence HLA-DRB1*11 (OR = 2,8), která však nebyla statisticky významná [41].
Duffy (Fy) systém
Duffy systém je tvořen dvěma hlavními variantami FY*A a FY*B lišícími se substitucí 125G > A v exonu 2 FY genu, která vede k záměně Gly42Asp v peptidovém řetězci glykoproteinu Fya a Fyb. Další alela FYx kóduje slabý antigen Fyb. Extracelulární část antigenu obsahuje tři místa N-glykosylace. Téměř 70 % černošské populace má fenotyp Fy(a-b-) způsobený mutací v místě vazby transkripčního faktoru na kódující oblast genu FY. Tato mutace, projevující se pouze v erytroidní linii buněk, zabraňuje expresi antigenu Fy na erytrocytech. Nositelé fenotypu Fy(a-b-) jsou rezistentní k infekci malárií, jelikož glykoprotein Fy je receptorem jednak pro prozánětlivé chemokiny, ale také pro některé druhy plazmodií [31]. Aloprotilátky mohou způsobit jak HTR, tak HON [32]. Výskyt protilátky anti-Fya je 20krát frekventnější než anti-Fyb. Anti-Fya je pravděpodobně i jednou z protilátek, které se mohou podílet na rejekci renálního štěpu [40]. Podání anti-RhD (IgG) imunoglobulinu překvapivě suprimuje tvorbu anti-Fya protilátky a je prevencí HON [41]. Noizat-Pirenne et al. analyzovali soubor 29 jedinců s anti-Fya protilátkou a zjistili, že 100 % jedinců s anti-Fya jsou nositelé HLA-DRB1*04 fenotypu, zatímco v kontrolní skupině byla tato varianta zastoupena v 19 %. Alelická frekvence DRB1*04 (56,62 %) byla statisticky významně vyšší v anti-Fya pozitivní skupině ve srovnání s kontrolní skupinou (9,9 %), OR = 12,9 [37]. Asociací HLA-DRB1* s aloimunizací anti-Fya se u jihoevropské populace zabýval rovněž Picard et al. Na skupině 67 pacientů potvrdil asociaci s DRB1*04 a nalezl signifikantní asociaci i s DRB1*15. Jak DRB1*04, tak DRB1*15 byly signifikantně častěji přítomny u pacientů (35 %, respektive 30 %) než u kontrol (12 %, respektive 9 %), OR = 4,2 respektive 4,3. Dokonce 96 % pacientů s protilátkou anti-Fya neslo nejméně jednu DRB1*04 nebo DRB1*15 alelu ve srovnání s 34 % v kontrolní skupině (OR = 41,4). Varianty HLA-DRB1*03 a*07 byly přítomny pouze u 10 % pacientů s anti-Fya ve srovnání s 51 % v kontrolní skupině (pc < 0,001), což svědčí o možném protektivním účinku těchto alel z důvodu neschopnosti prezentovat peptidy odvozené z antigenu Duffy TH-lymfocytům [38]. Tato zjištění byla potvrzena i ve studii Schoenewilla et al., kteří pro skupinu 52 pacientů s protilátkou anti-Fya uvádí asociaci s HLA-DRB1*04 (OR = 7,9) a s DRB1*15 (OR = 3,2), při současné přítomnosti obou alel pak OR = 16 [41].
MNS systém
MNS systém je druhým nejpolymorfnějším antigenním systémem červených krvinek (dosud zdokumentováno 46 antigenů). Největší význam mají antigeny M a N (glykoforiny A, GPA) a antigeny S a U (glykoforiny B, GPB). Glykoforiny jsou sialoglykoproteiny. Antigenní epitopy M a N jsou lokalizovány na N-konci GPA molekul a liší se ve dvou aminokyselinách v pozici 1 (Ser1Leu) a 5 (Gly5Glu). Antigen M je v kavkazské populaci přítomen u 78 % jedinců a N u 72 % populace. Polymorfismus S/s určuje záměna jediné aminokyseliny v GPB molekule (Met29Thr). Antigen S je v kavkazské populaci přítomen u 55 % jedinců a s u 99 %. GPB sdílí s GPAN (s epitopem N) na N terminálním konci prvních 26 aminokyselin. Geny GYPA a GYPB jsou vysoce homologní a jsou v těsné vazbě. Zatímco protilátky anti-M (častější, mnohdy spíše poinfekční než aloimunní) a anti-N (vzácnější) reagují za nižších teplot a jsou většinou klinicky nezávažné, tak anti-S, -s a -U jsou většinou třídy IgG, reagující při 37 °C a mohou způsobit klinicky závažné HTR a HON [30, 31]. Asociace HLA-DRB1 s protilátkou anti-S byla analyzována Schoenewillem et al. na souboru 19 aloimunizovaných pacientů. Bylo zjištěno, že alela DRB1*07 byla přítomna u 68,4% pacientů s OR = 8,7 (oproti kontrolní skupině), kombinovaná přítomnost DRB1*07 nebo *08 byla rovněž signifikantně asociována s OR = 8,4. Ovšem zvýšená frekvence výskytu DRB1*08 (OR = 4,1) nebyla po korekci již statisticky významná [41]. Asociace mezi antigeny HLA II. třídy a výskytem protilátek proti dalším antigenům MNS systému nebyly dosud publikovány. Výsledky všech zmíněných asociací jsou shrnuty v tabulce 3.
Tab. 3. Asociace mezi HLA-DRB1 a výskytem monospecifických aloprotilátek (OR1) 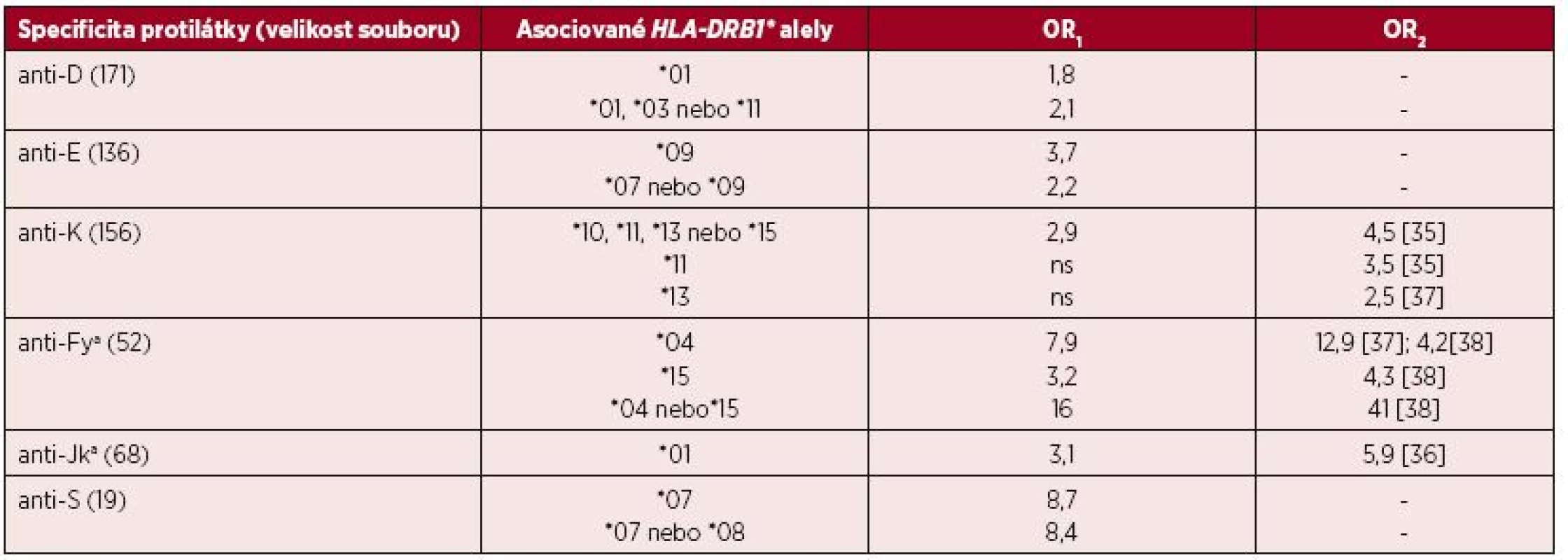
OR1 – odds ratio převzato z práce Schoenewilla et al. [41] OR2– odds ratio z dalších souvisejících článků, citovaný článek uveden v závorce Je zřejmé, že prezentace výsledků dosažených analýzou souborů s méně než 30 jedinci a omezených úzkým populačním spektrem může zkreslovat výsledná data a je pravděpodobně příčinou rozdílných výsledků OR či nepotvrzení nalezených asociací v pozdějších studiích provedených s odlišnou kohortou pacientů. Nejvýznamnější asociace byla nalezena mezi alelickou skupinou HLA-DRB1*04 a tvorbou aloprotilátky anti-Fya a HLA-DRB1*07 s anti-S. Výsledky mohou být rovněž ovlivněny specificitou zkoumaných protilátek, nástupem jejich tvorby po imunizačním podnětu, délkou přetrvávání v oběhu a jejich detekovatelností.
MULTIRESPONDEŘI
Kohortu 379 pacientů s výskytem dvou a více protilátek (tzv. multiresponderů) analyzoval opět Schoenewille et al. Tito pacienti byli rozděleni do dvou skupin, první skupinu tvořilo 275 multiresponderů s vícečetnou specificitou již při prvním vyšetření aloprotilátek, druhá skupina 114 pacientů měla původně detekovánu pouze monospecifickou protilátku, ke které později přibyly další specificity. Po korekci zůstala statisticky významná vazba v případě první skupiny pouze pro HLA-DRB1*12 (8 % vs. 3,8 %, OR = 2,2) a DRB1*15 (40 % vs. 25,2 %, OR = 2). Při analýze obou skupin (379 pacientů) byla signifikance zachována pouze pro HLA-DRB1*15 (OR = 1,8) vůči kontrolnímu souboru. Předpoklad, že se u multiresponderů vyskytuje zvýšená frekvence součtu všech asociovaných HLA-DRB1* variant ve srovnání s kontrolní populací, byl ověřován analýzou kombinací protilátkových dvojic (např. C+D, D+E, c+E, atd). Z 625 vzniklých kombinací byla pouze u 80 (12,8 %) nalezena suma DRB1 alel asociovaných s výskytem monospecifické aloprotilátky. Ve skupině 2 a více protilátek byly nalezeny u 5 kombinací protilátek signifikantně asociované DRB1* alely, ve skupině právě dvou protilátek byla nalezena signifikance pouze pro kombinaci anti-c+E s DRB1*07 a DRB1*13 fenotypem [41]. Výsledky u multiresponderů jsou shrnuty v tabulce 4.
Tab. 4. Statisticky významné asociace mezi HLA-DRB1 a výskytem vícečetných protilátek [41] ![Statisticky významné asociace mezi HLA-DRB1 a výskytem vícečetných protilátek [41]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c4d031b74c6b903acde0c6db57cb746b.jpg)
NON HLA FAKTORY A ALOIMUNIZACE
Vedle vyšetření HLA genů byla u aloimunizovaných pacientů v několika studiích věnována pozornost i jiným genům. Byly to například TAP-1, 2 a HSP70 non-HLA geny ležící v HLA oblasti, které byly vyšetřovány v souvislosti s HPA aloimunizací. Pozitivní signifikantní asociace byla prokázána u TAP2 homozygotní kombinace aminokyselin Ile-Ile v pozici 379 (pc < 0,02, OR = 4,7), tento nález však nevedl k žádnému obecnému závěru [26]. Tatari-Calderone et al. se zabývali pacienty se srpkovitou anémií, onemocněním typickým pro populaci afrického původu, pro které jsou opakované transfuze erytrocytovými transfuzními přípravky jedinou možností léčby. Podíl responderů činí 18–47 % a je až čtyřikrát vyšší než stupeň aloimunizace u pacientů bez této dědičné choroby a transfundovaných z jiných příčin. Autoři se zaměřili na geny s imunomodulačními vlastnostmi ležícími v blízkosti genu pro HbßS. Jedním z vybraných kandidátních genů byl gen Ro52 se SNP polymorfismem rs660, který je asociován s lupus erythematodes u Afroameričanů. Produkt genu, protein Ro52, slouží jako intracelulární receptor pro imunokomplexy. Touto vazbou se aktivují imunitní procesy v buňce vedoucí k produkci prozánětlivých cytokinů. Současně má stejná molekula i zcela opačnou funkci, jelikož inhibuje produkci interferonu typu I, má i protizánětlivé účinky. Polymorfismus rs660C/T se nachází v oblasti 1. intronu genu a zdá se, že ovlivňuje vazbu transkripčních faktorů na sekvenci obsahující zmíněný SNP. Na skupině 83 pacientů (Afroameričanů) homozygotních pro hemoglobin S, transfundovaných nejméně dvěma AB0, RhD kompatibilními deleukotizovanými erytrocytovými TP, však zjistili, že žádný z genotypů polymorfismu rs660 není asociovaný s vyšším stupněm aloimunizace, ani s vážností onemocnění. Podání první transfuze před pátým rokem věku u pacientů s rs660T/T genotypem však vedl k toleranci aloimunizace při následném aloimunizačním podnětu. Po 5. roce věku je schopnost aloimunizace u nositelů C/T nebo T/T genotypů stejná. Zůstává otázkou, je-li příčinou imunotolerance skutečně genotyp T/T nebo obecně suboptimální stav imunity u novorozenců a malých dětí [42]. Africká populace je obecně schopna vyvinout silnější zánětlivou a imunitní odpověď než jiní transfundovaní pacienti, což je pravděpodobně příčinou vysokého podílu responderů. U Afroameričanů je vyšší výskyt zánětlivých onemocnění (astma, systémový lupus erythematodes, artritida atd.) a vyšší výskyt akutních rejekcí po transplantaci ve srovnání s kavkazskou populací [43]. Je známo, že tvorba protilátek u příjemců TP závisí na množství podaných TP a imunogenicitě aloantigenu. Svou roli hrají pravděpodobně i další vrozené a získané faktory, např. zvýšené riziko aloimunizace u žen v souvislosti s graviditou, u pacientů s diabetem a solidními nádory, snížené riziko u pacientů s myeloproliferativními chorobami (dysfunkce lymfocytů, imunosuprese). Zalpuri zveřejnil plán kohortové studie, jejímž cílem bude zkoumat možný vztah mezi klinickým stavem, životním prostředím a genetickou charakteristikou příjemců transfuze erytrocytů a rizikem aloimunizace během transfuzní periody. Autoři předpokládají dva výstupy ze studie:
- identifikovat skupinu příjemců transfuze, u nichž bude nutné zajistit co nejshodnější TP a
- pochopit mechanismy související s tvorbou aloprotilátek.
U vybraných pacientů (celkem asi 500 případů) i v kontrolní skupině (celkem 1000) budou zmapovány všechny faktory modulující imunitní odpověď – očkování, onemocnění v dětském věku, návštěva předškolních zařízení, životní styl (vesnický, městský), sociálně-ekonomický status, chov domácích zvířat. Z genetických markerů budou vyšetřeny HLA geny, z biomarkerů cytokiny a titr protilátek proti antigenům vakcín [44].
Na základě dostupných informací lze schematicky znázornit faktory ovlivňující pravděpodobnost aloimunizace (schéma 1) [45].
Schéma 1. Faktory ovlivňující aloimunizaci 
MDS – myelodysplastický syndrom (zdroj [45]) ZÁVĚR A SHRNUTÍ
Indukce tvorby aloimunních erytrocytových protilátek závisí, mimo jiné, na reakci TH - lymfocytů, a tedy úzce souvisí s fenoménem HLA restrikce. Otázkou však stále zůstává, proč se humorální imunitní odpověď vyvine přibližně jen u 10 % jedinců, kteří se setkali s aloantigeny erytrocytů. Tato skutečnost nasměrovala výzkum k nalezení vztahu mezi výskytem specifických aloprotilátek proti erytrocytům a přítomností určitých molekul HLA-DRB1 lokusu. V závislosti na produkci specifické aloprotilátky byly identifikovány konkrétní HLA antigeny s OR 1,4–8,7. Výsledky studií shrnuté v tomto článku však nepředložily jednoznačný průkaz, snad s výjimkou velmi pravděpodobné asociace aloimunizace vůči Duffy systému a skupinou alel HLA-DRB1*04. Důvodem, proč výše uvedená hypotéza zůstala nepotvrzena, může být absence projektu, který by obsahoval homogenní skupinu pacientů se známým RBC fenotypem, transfundovanou TP podobného stáří, (nejlépe) deleukotizovanými a od dárců se známou skladbou erytrocytových antigenů. Ve všech citovaných publikacích autoři použili retrospektivně zpracovaná data poměrně různorodých kohort aloimunizovaných pacientů. Nižší hodnoty odds ratio (OR) v referovaných pracích mohl ovlivnit také neoptimálně navržený kontrolní soubor použitý pro srovnání. Lze předpokládat, že kontrolní skupinu představoval většinou vzorek populace zahrnující jak respondery, tak non-respondery, a to mohlo vést ke zkreslení publikovaných výsledků. Objasnění vztahu mezi aloimunizací a přítomností HLA alel II. třídy považujeme stále za atraktivní téma. V rámci řešení našeho projektu jsme se zaměřili na pacienty – respondery s vytvořenými monospecifickými aloprotilátkami proti vybraným aloantigenům a na multirespondery, tj. pacienty s minimálně dvěma erytrocytovými aloprotilátkami. Vedle HLA-DRB1 jsou u pacientů vyšetřovány i geny kódující DQ molekuly, u nichž nebyl možný vztah k aloimunizaci dosud publikován. Jako kontrolní skupina nám poslouží dárci kostní dřeně z našeho regionu se známým HLA-DR, DQ fenotypem. Pravděpodobně jako vhodnější kontrolní skupina se jeví využít polytransfundované pacienty – non-respondery. Cílem projektu je nalezení predispozičních HLA alel/skupin alel, respektive haplotypu HLA-II. třídy, asociovaných s vyšším rizikem tvorby aloprotilátek proti antigenům erytrocytů. Podle míry zjištěného rizika zvážit zavedení screeningové metody na průkaz predispozičních HLA variant k selekci pacientů, u nichž by se provádělo předtransfuzní vyšetření rozšířené o dotypování RBC antigenů za účelem zajištění co nejkompatibilnějších erytrocytových TP. Druhou možností by bylo provádět stanovení predispozičních HLA variant pouze u responderů a multiresponderů, u kterých existuje vysoká pravděpodobnost tvorby dalších aloprotilátek proti inkompatibilním antigenům erytrocytů. Průkaz predispozičních HLA variant by tak mohl být indikací k dotypování antigenů a k zamezení rozvoje další aloimunizace.
Použité zkratky
HLA – hlavní histokompatibilní systém člověka (human leukocyte antigens)
HPA – specifické antigeny trombocytů (human platelet antigens)
APC – antigen prezentující buňka
RBC – červené krvinky (red blood cells)
TP – transfuzní přípravek
SNP – jednonukleotidový polymorfismus
HON – hemolytické onemocnění plodu a novorozence
HTR – hemolytická potransfuzní reakce
TAP – peptidový transportér (Transporter associated with Antigen Processing)
Poděkování
Tato práce byla podpořena grantem v rámci Institucionální podpory č. 2 - RVO-FNOs/2014.
Prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 6. 1. 2016.
Přijato po recenzi dne 21. 4. 2016.
Mgr. Alena Malušková
Krevní centrum FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: alena.maluskova@fno.cz
Zdroje
1. Prigent A, Maillard N, Absi L, et al. From Donor to Recipient: Current Questions Relating to Humoral Alloimunization. Antibodies 2014; 3 : 130–152.
2. http://www.isbtweb.org/fileadmin/user_upload/Working_parties/WP_on_Red_Cell_Immunogenetics_and/Updates/Table_of_blood_group_antigens_within_systems_v5_151222.pdf
3. Yazer MH, Triulzi DJ. Detection of anti-D in D-recipients transfused with D+ red blood cells. Transfusion 2007; 47 : 2197–2201.
4. Frohn C, Dumbgen L, Brand JM, Gorg S, Luhn J, Kirchner H. Probability of anti-D development in D - patients receiving D+ RBCs. Transfusion 2003; 43 : 893–898.
5. Redman M, Regan F, Contreras M,. A prospective study of the incidence of red cell allo-immunization following transfusion. Vox Sang 1996; 71 : 216–220.
6. Alves VM, Martins PR, Soares S, et al. Alloimmunization screening after transfusion of red blood cells in a prospective study. Rev Bras Hematol Hemoter 2012; 34 : 206–211.
7. Torney CA, Stack G. The Characterization and classification of concur-rent blood group antibodies. Transfusion 2009; 49 : 2709–2718.
8. Schoenwille H, Brand A. Does an alloimmune response to strong immunogenic red blood cell antigens enhance a response to weaker antigens? Transfusion 2008; 48 : 958–963.
9. Urbaniak SJ, Robertson AE. A successful program of immunizing Rh-negative male volunteers for anti-D production using frozen/thawed blood. Transfusion 1981; 21 : 64–69.
10. Natukunda B, Schoenwille H, Ndugwa C, Brand A. Red blood cell alloimmunization in sickle cell disease patients in Uganda. Transfusion 2010; 50 : 20–25.
11. Aly R, EJ-Sharnoby MR, Hapag AA. Frequency of red cell alloimmunization in patients with sickle cell anemia in an Egyptian referral hospital. Transfus Apher Sci 2012; 47 : 253–257.
12. Ben Amor I, Louati N, Khemekhem H, et al. Red blood cell immunization in haemoglobinopathies about 84 cases (in French). Transfus Clin Biol 2012; 19 : 345–352.
13. Mehra NK. The HLA Complex in Biology and Medicine: A Resource Book. 2010, ISBN 978-81-8448-870-8.
14. Hořejší V, Bartůňková J, Brdička T, Špíšek R. Základy imunologie. 2013, ISBN 978-80-7387-713-2.
15. Krejsek J, Kopecký O. Klinická imunologie. 2004, ISBM 80-86255-50-X.
16. Robinson J, Halliwell JA, Hayhurst JH, Flicek P, Parham P, Marsh SGE. The IPD and IMGT/HLA database: allele variant databases. Nucleic Acids Research 2015; 43: D423–431.
17. Décary F, L’Abbé D, Tremblay L, Chartrand P. The immune response to the HPA-1a antigen: assosiation with HLA-DRw52a. Transf Med 1991; 1 : 55.
18. Kuijpers RWAM, von dem Borne AEGK, Kiefel V, et al. Leucine33-Proline33 substitution human platelet glycoprotein IIIa determines HLA-DRw52a (Dw24) association of the immune response against HPA-1a (Zwa/PIA1) and HPA-1b (Zwb/PIA2). Hum Immunol 1992; 34 : 253–356.
19. L’Abbé D, Tremblay L, Filion M, et al. Alloimmunization to platelet antigen HPA-1a (PIA1) is strongly associated with both HLA-DRB3*0101 and HLA-DQB1*0201. Hum Immunol 1992; 34(2): 107–114.
20. Sarab GA, Michael Moss, Barker RN, Urbaniak SJ. Naturally proces-sed peptides spanning the HPA-1a polymorphism are efficiently generated and displayed from platelet glycoprotein by HLA--DRB3*0101-positive antigen-presenting cells. Blood 2009; 114(9): 1954–1957.
21. Phelps RG, Turner AN, Rees AJ. Direct identification of naturally processed autoantigen-derived peptides bound to HLA-DR15. J Biol Chem. 1996; 271(31): 18549–18553.
22. Peakman M, Stevens EJ, Lohmann T, et al. Naturally processed and presented epitopes of the islet cell autoantigen IA-2 eluted from HLA-DR4. J Clin Invest. 1990; 104(10): 1449–1457.
23. Hunt D, Michel H, Dickinson T, et al. Peptides presented to the immune system by the murine class II major histocompatibility complex molecule I-Ad. Science 1992; 256(5065): 1817–1820.
24. Rudensky AY, Preston-Hurburt P, al-Ramadi BK, Rotbard J, Janeway CA Jr. Truncation variants of peptides isolated from MHC class II molecules suggest sequence motifs. Nature 1992; 359(6394): 429–431.
25. Mueller-Eckhardt C, Kiefel V, Kroll H, Mueller-Eckhardt G. HLA--DRw6, a new immune response marker for immunization against the platelet alloantigen Bra. Vox Sang 1989; 57(1): 90–91.
26. Semana G, Zazoun T, Alizadeh M, Morel-Kopp MCh, Genetet B, Kaplan C. Genetic Susceptibility and anti-human Platelet Antigen 5b alloimmunization Role of HLA class II and TAP genes. Hum Immunol 1996; 46 : 114–119.
27. Westman P, Hashemi-Tavoularis S, Blanchette V, Kekomäki S, Laes M,Porcelijn L, Kekomäki R. Maternal DRB1*1501, DQA1*0102, DQB1*0602 haplotype in fetomaternal alloimmunization against human platelet alloantigen HPA-6b (GPIIIa-Gln489). Tissue Antigens 1997; 50 : 113–118.
28. Redman M, Regan F, Contreras M. A prospective study of the incidence of red cell alloimmunization following transfusion. Vox Sang. 1996; 71 : 216–220.
29. Schoenwille H, Haak HL, van Zijl AM. Alloimmunization after blood transfusion in patients with hematologic and oncologic diseases. Transfusion 1999; 39 : 763–771.
30. Daniels G. Human Blood Groups 2002. ISBN 0-632-056460.
31. Řeháček V, Masopust J a kol. Transfuzní lékařství. 2013; 166–170. ISBN 978-80-247-4534-3.
32. Urbaniak SJ. Alloimmunity to RhD in humans. Transfus Clin Biol. 2006; 13(1–2): 19–22.
33. Shankar Kumar U, Ghosh K, Gupte SS, Gupte SC, Mohanty D. Role of HLA antigens in Rh (D) alloimmunized pregnant women from Mumbai, Maharashtra, India. J. Biosciences 2002; 27(2): 135–141.
34. Stott LM, Barker RN, Urbaniak SJ. Identification of alloreactive T-cell epitopes on the Rhesus D protein. Blood 2000; 96(13): 4011–4019.
35. Chiaroni J, Dettori I, Ferrera V, et al. HLA-DRB1 polymorphism is associated with Kell immunisation. Br J Haematol 2006; 132(3): 374–378.
36. Reviron D, Dettori I, Ferrera V, Legrand D, Touinssi M, Mercier P, de Micco P, Chiaroni J. HLA-DRB1 alleles and Jk(a) immunization. Transfusion 2005; 45(6): 956–959.
37. Noizat-Pirenne F, Tournamille Ch, Bierling P, et al. Relative immunogenicity of Fya and K antigens in a Caucasian population, based on HLA class II restriction analysis. Transfusion 2006; 46 : 1328–1333.
38. Picard C, Frassati C, Basire A, et al. Positive association of DRB1*04 and DRB1*15 alleles with Fya immunization in a Southern European population. Transfusion 2009; 49(11): 2412–2417.
39. Lerut E, van Damme B, Mizat–Pirenne F, et al. Duffy and Kidd blood group antigens: minor histocompatibility antigens involved in renal allograft rejection? Transfusion 2007; 47 : 28–40.
40. Branch DR, Scofield TL, Moulds JJ, Swanson JL. Unexpected suppression of anti-Fya and prevention of hemolytic disease of the fetus and newborn after administration of Rh immune globulin. Transfusion 2011; 51 : 816–819.
41. Schonewille H, Doxiadis IIN, Levering WHBM, Roelen DL, Claas FHJ, Brand A. HLA-DRB1 association in individuals with single and multiple clinically relevant red blood cell antibodies. Transfusion 2014; 54 : 1971–1978.
42. Tatari-Calderone Z, Luban NLC, Vukmanovic S. Genetics of Transfusion Recipient Alloimmunization: Can Clues from Susceptibility to Autoimmunity Pave the Way? Transfusion Medicine and Hemotherapy 2014; 41 : 436–445.
43. Padyiar A, Augustine JJ, Bodziak KA, Aeder M, Schulak JA, Hricik DF. Influence of African-American ethnicity on acute rejection after early steroid withdrawal in primary kidney transplant recipients. Transplant Proc 2010; 42 : 1643–1647.
44. Zalpuri S, Zwaginga JJ, van der Born JG. Risk Factors for Alloimmunisation after red blood Cell Transfusions (R-FACT): a case cohort study. BMJ Open 2012; 2e001150.
45. Gehrie EA, Tormey ChA. The Influence of Clinical and Biological Factors on Transfusion-Associated Non-ABO Antigen Alloimmunization: Responders, Hyper-Responders and Non--Responders. Transfus Med Hemother 2014; 41 : 420–429.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo 3- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Imunogenetické faktory ovlivňující aloimunizaci proti antigenům krevních skupinových systémů
- Rutinné používanie tromboelastometrie (ROTEM) k hodnoteniu koagulácie (adopcia ,,novej“ paradigmy hodnotenia koagulácie) na jednotke intenzívnej starostlivosti vedie k značnému zníženiu podávania krvnej plazmy
- Analýza zhody vyšetrenia inhibítorov FVIII Bethesda metódou a modifikovanou Nijmegen metódou a vplyv hraničných titrov inhibítorov na farmakodynamiku a farmakokinetiku FVIII u pacientov s hemofíliou A
- Analýza variantních nálezů počtu signálů při určení translokace t(4;14)(p16.3;q32.3) metodou FICTION u nemocných s mnohočetným myelomem
- Diagnostika a prognostické faktory lymfomu z buněk pláště
- Alfa-talasemie u 45 českých rodin a 37 rodin cizinců žijících v České republice: přehled literatury a molekulárně-genetická diagnostika
- Současnost a budoucnost alternativních zdrojů hematopoetických buněk včetně pupečníkové krve. Perspektivy bank pupečníkové krve. Závěry Panelu expertů
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Alfa-talasemie u 45 českých rodin a 37 rodin cizinců žijících v České republice: přehled literatury a molekulárně-genetická diagnostika
- Diagnostika a prognostické faktory lymfomu z buněk pláště
- Imunogenetické faktory ovlivňující aloimunizaci proti antigenům krevních skupinových systémů
- Analýza zhody vyšetrenia inhibítorov FVIII Bethesda metódou a modifikovanou Nijmegen metódou a vplyv hraničných titrov inhibítorov na farmakodynamiku a farmakokinetiku FVIII u pacientov s hemofíliou A
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



