-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
KLINICKÁ TRANSFUZIOLOGIE
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. Supplementum, p. 35-40.
Kategorie: Přednášky
39 Trombocyty z buffy-coatu nebo trombocyty z aferézy?
Řeháček V., Jiroušová H., Černohorská J., Kočová Tužilová P.
Transfuzní oddělení, Fakultní nemocnice a Lékařská fakulta UK Hradec Králové
Úvod. Porovnávání trombocytů z buffy-coatu (TB) a trombocytů z aferézy (TA) je častým námětem diskusí mezi klinickými lékaři všech odborností, hematology/transfuziology nevyjímaje.
Metodika, výsledky. Odborná literatura nabízí řadu prací, které porovnávají TB a TA z pohledu kvality přípravků, klinické účinnosti, rizik spojených s jejich podáním atd. Při hledání podpory pro/proti TB či TA je třeba v publikacích pečlivě hodnotit a) typ podávaných přípravků (např. „TB“ v některých pracích z USA jsou zcela odlišné trombocyty vyráběné z plazmy bohaté na destičky – PRP, některé práce porovnávají nedeleukotizované TB s deleukotiovanými TA atd.), b) dávku trombocytů (od 2 x 1011/T.D. až po 0,7 x 1011/10 kg váhy pacienta), c) krevní skupinu trombocytů (AB0 shodné vs. kompatibilní), d) dobu skladování před podáním, e) způsoby hodnocení a kvantifikace krvácení/zástavy krvácení a další faktory. Studie porovnávající klinický efekt trombocytových přípravků vyráběných v posledních letech standardně v Evropě (resuspendované, příp. patogen-inaktivované) jsou nedostatečné. Poměr výroby/spotřeby TA a TB je v jednotlivých zemích EU zcela rozdílný, kolísá od 85% spotřeby TA v zemích Velké Británie až po více než 90% zastoupení TB (Nizozemsko, Finsko, Dánsko). ČR patří mezi země s převahou spotřeby TA (76 % v roce 2013).
Na TO FNHK se TB vyrábějí ze 4 buffy-coatů na přístroji OrbiSac (TerumoBCT), všechny přípravky jsou od r. 2011 deleukotizovány a resuspendovány v SSP+ (TBSDR). TA se odebírají na separátorech Trima Accel (TerumoBCT) a Haemonetics MCS+, všechny jsou deleu-kotizovány a resuspendovány v SSP+ (TADR). Obsah trombocytů v TBSDR je 259,4 (221–301) x 109/T.D., v TADR 230,3 (193–282) x 109/T.D. Počet leukocytů je pod 1 x 106/T.D. v obou typech přípravků. Na konci doby skladování (5 dnů) je pH v TBSDR 7,1 (7,0–7,3), v TADR 6,9 (6,5–7,1). Roční spotřeba trombocytů ve FNHK činí 2500–3000 T.D. trombocytů, poměr spotřeby TBSDR:TADR ve FNHK stoupl ze 17,7 % v roce 2009 na 62,1 % v roce 2015. Hlavním žadatelem o TA ve FNHK je 4. interní hematologická klinika.
Závěr. Pokud jsou trombocytové přípravky deleukotizovány v okamžiku jejich výroby, jsou TB a TA považovány za srovnatelné ve své funkci a účinnosti pro neimunizované pacienty. Pro pacienta s antileukocytovou nebo antitrombocytovou protilátkou jsou indikovány TA od kompatibilního dárce. Deleukotizace trombocytů snižuje riziko potranfuzních reakcí (febrilní reakce, imunizace), náhrada části plazmy resuspenzním roztokem snižuje riziko alergické reakce a TRALI. Trombocytové přípravky vyráběné v TO FNHK splňují kritéria kvality, obsah trombocytů v TB je o 10 % vyšší než v TA. Změnu poměru TB:TA ve prospěch TB považujeme za správný směr z mnoha důvodů, včetně efektivnějšího využití darované plné krve a nižších nákladů na výrobu trombocytových přípravků.
40 AB0 inkompatibilita trombocytů a praxe v Nemocnici České Budějovice a.s.
Biedermann P., Staňková H., Jandová J., Sulková J.
Transfuzní oddělení, Nemocnice České Budějovice a.s.
Úvod. Při nepředvídatelných stavech velkého krvácení zvláště traumatického původu, vzrůstá spotřeba trombocytů, která se nestačí vykrýt stejnoskupinovými AB0 přípravky. Autoři shrnují obecné poznatky k tomuto problému a popisují praxi ve vlastní nemocnici.
Metodika. Rozlišuje se velká – Major inkompatibilita trombocytů – kdy příjemce má v séru protilátky – isoaglutininy anti-A, anti-B proti antigenům A, B dárce, které jsou přítomny na povrchu membrány trombocytů. Tato neshoda je spojena se zkráceným přežíváním transfundovaných trombocytů. Při malé – Minor inkompatibilitě trombocytů – je příjemci převáděna plazma dárce s isoaglutininy anti-A, anti-B ,které jsou neslučitelné s antigeny A, B příjemce. V literatuře byly popsány v omezeném počtu případů hemolytické reakce způsobené zvláště trombocyty získanými z aferéz s vysokými titry isoaglutininů v převáděné plazmě. Nikdy však nebyla jednoznačně stanovena bezpečná hranice titru isoaglutininů a objem převáděné inkompatibilní plazmy. V evropských doporučeních odborných společností je v současné době preferováno podávání deleukotizovaných trombocytů, které jsou resuspendovány v náhradním roztoku s redukovaným objemem plazmy. Riziko z možné hemolýzy je pak zvláště malé u trombocytů směsných z buffy-coatu resuspendovaných v náhradním roztoku.
Výsledky. Nemocnice České Budějovice a.s. je velká nemocnice s centrovou péčí vyjma transplantačního programu. V roce 2015 bylo vydáno oddělením 975 terapeutických dávek (T.D.) trombocytů z toho 867 směsných deleukotizovaných z BC (TBSD). Od března 2016 jsou vyráběny směsné delukotizované trombocyty v náhradním roztoku (TBSDR). Asi 10 % v současné době vydávaných T.D. trombocytů je nestejnoskupinových v AB0 systému. Tyto koncentráty jsou podávány hlavně v době pohotovostních služeb, vyjma dětských pacientů.
U TBSDR skupiny 0, byly vyšetřovány titry isoaglutininů gelovou aglutinací. Titry nepřesáhly výši 1 : 32+ u anti-A i anti-B, což je akceptovaná bezpečná hodnota.
Závěr. Na základě klinické praxe a ve shodě s dostupnými literárními údaji považují autoři podávání směsných deleukotizovaných trombocytů z BC ressupendovaných v náhradním roztoku (TBSDR) i při inkompatibilitě plazmy mezi dárcem a příjemcem za málo rizikové, vyjma dětských pacientů.
41 Kryokonzervované trombocyty v klinickém použití – komparativní klinická studie
Bohoněk M., Landová L., Kutáč D.
Oddělení hematologie a krevní transfuze, Ústřední vojenské nemocnice – Vojenská fakultní nemocnice, Praha
Úvod. Běžné trombocytární přípravky skladované při teplotě 20–24 °C jsou zatíženy nevýhodou krátké doby použitelnosti, která vylučuje tvorbu větších zásob a ztěžuje logistiku spojenou s jejich přípravou, distribucí a použitím. Jedním z míst, kde je toto omezení zvláště limitující, jsou traumacentra, urgentní příjmy a oddělení intenzivní péče, která řeší problematiku masivního krvácení. Dostupnost trombocytů k včasné aplikaci moderního masivního transfuzního protokolu během první „zlaté hodiny“ po vzniku krvácení je často problematická a většina nemocnic si je nemůže dovolit mít kvůli krátké exspiraci a vysoké ceně trvale na skladě, v případě urgentní potřeby většího množství přípravků, mají problémy s dostupností trombocytů i pracoviště fakultního typu. Vhodnou alternativou jsou kryokonzervované trombocyty, které se s úspěchem používají ve vojenském zdravotnictví a v ÚVN Praha byly do běžné klinické praxe zavedeny v září 2014. Cílem sdělení je prezentace výsledků komparativní klinické studie, srovnávající použití čerstvých a kryokonzervovaných trombocytů u stavů spojených s masivní ztrátou krve.
Metodika. V období září 2014 až červen 2016 bylo v ÚVN Praha podáno celkem 243 TU trombocytů 82 pacientům s masivním krvácením, z toho 161 TU TADK (57 pacientům). Do studie bylo zařazeno 26 pacientů transfundovaných celkem 88 TU TADK a kontrolní skupina 20 pacientů transfundovaných celkem 70 TU TAD. Seznam pacientů a diagnóz je uveden v tabulce 1. Jako čerstvé i pro zmražení byly použity trombocyty z aferézy, deleukotizované, o obsahu trombocytů > 280 x 109/TU. Mražení trombocytů se provádí při -80 °C po přidání 6% DMSO a odstranění supernatantu, doba použitelnosti při stejné teplotě skladování je 2–4 roky. Před použitím se rozmražené trombocyty skupiny 0 rekonstituují v rozmražené plazmě skupiny AB. Pro účely studie jsme hodnotili tato kritéria: 1) laboratorní hodnoty (před a po transfuzi) – KO, APTT, PT, Fbg, ROTEM, 2) vitální funkce (před a po transfuzi) – T, P, TK, GCS, 3) koagulační aktivitu přípravků – TEG, 4) množství podaných trombocytů, erytrocytů, plazmy, fibrinogenu a TXA 5) klinická data – ISS (international severity score) a přežití.
Výsledky. Kryokonzervované trombocyty jsou ve srovnání s čerstvými částečně aktivované, z měření TEG je patrná zkrácena doba iniciace koagulace (vyšší prokoagulační aktivita) při redukované, nicméně dostatečné, maximální pevnosti koagula. Laboratorní data obou skupin pacientů nevykazují signifikantní rozdíly u kryokonzervovaných a čerstvých trombocytů použitých při léčbě masivního krvácení, vyjma počtu trombocytů, které jsou vyšší po transfuzi čerstvých trombocytů, viz Tab 2. Výsledky klinických pozorování, spotřeba transfuzních přípravků, fibrinogenu a TXA jsou u obou skupin srovnatelná.
Závěr. Krykonzervované trombocyty jsou vhodným přípravkem nikoli pouze pro vojenské, ale též pro civilní použití, zejména pro řešení akutních stavů spojených s masivním krvácením, kdy není k dispozici trvalá a dostatečná zásoba čerstvých trombocytů. Rozmražení a rekonstituce je jednoduchý proces, který trvá max. 30 min. Kryokonzervace trombocytů může nalézt uplatnění i u dalších aplikací, jako např. při přípravě autologních trombocytů pro transfuzní, ale i netransfuzní použití nebo při přípravě vzácných, či HLA kompatibilních trombocytů. Vzhledem k nízkým nákladům spojeným s jejich přípravou, jejich použití nepředstavuje významné zvýšení nákladů.
Tab. 1. Seznam diagnóz transfundovaných pacientů 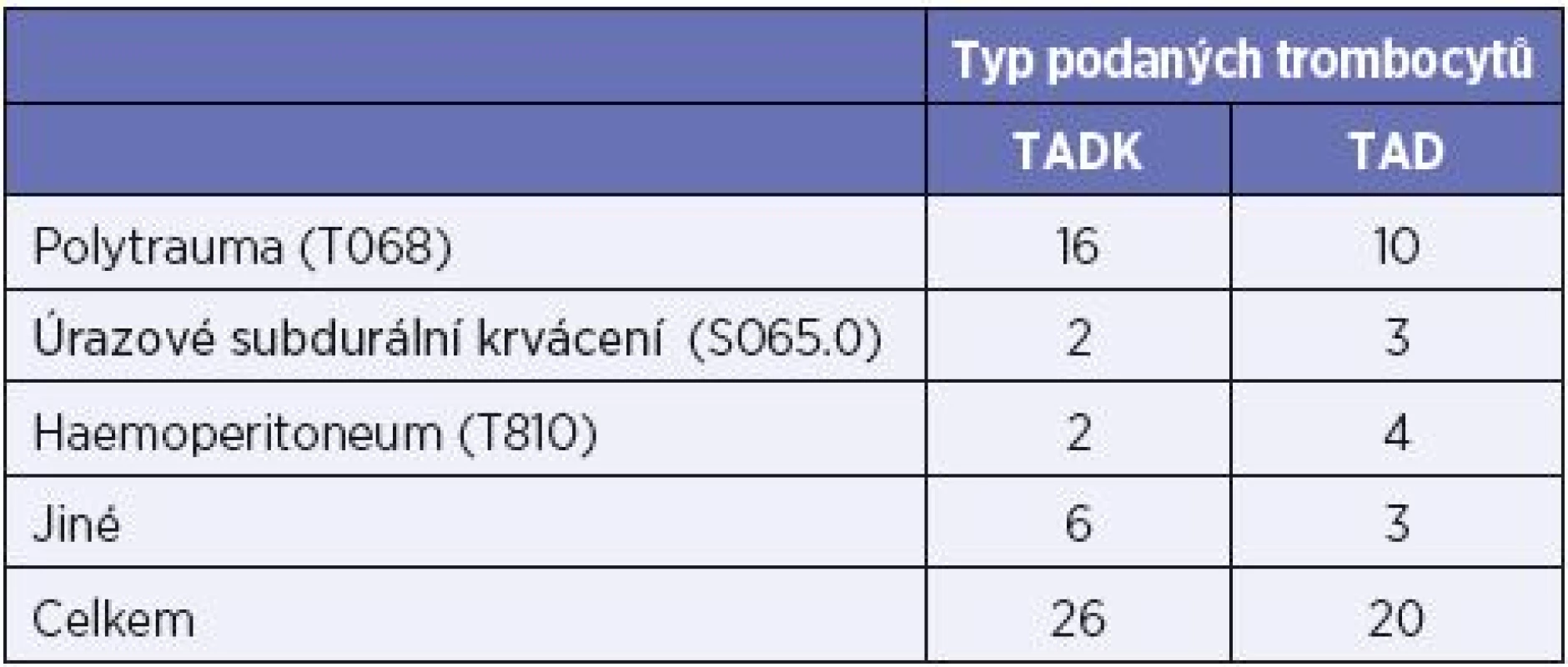
Tab. 2. Hodnoty laboratorních vyšetření před a po podání trombocytů (medián) 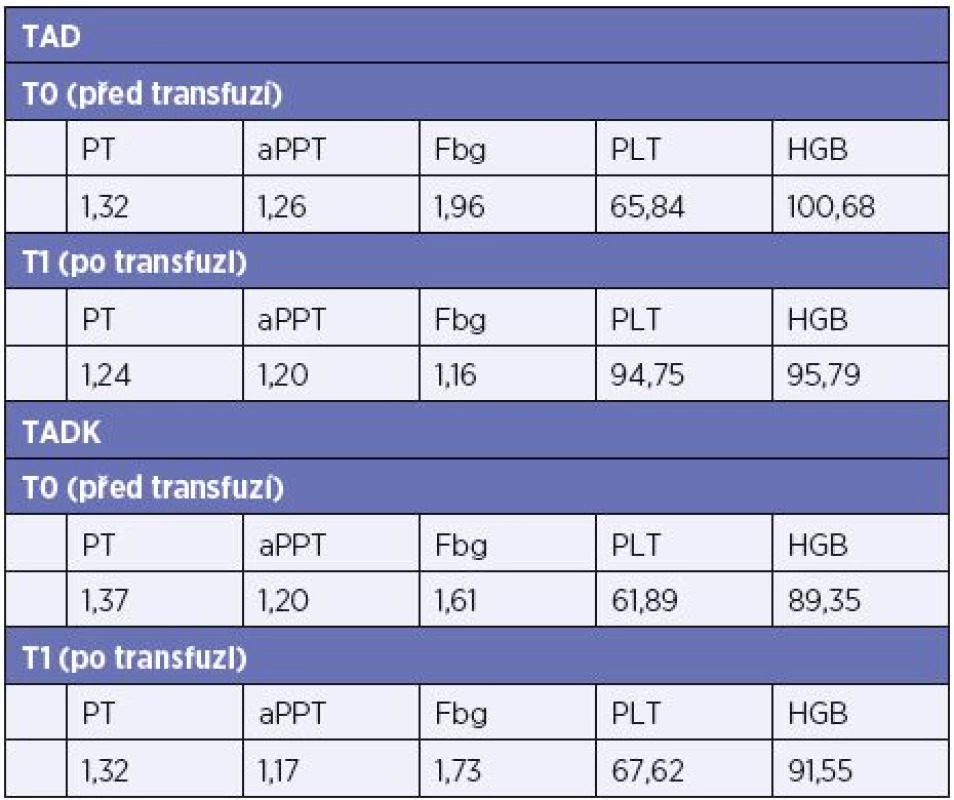
42 Interakce trombocytů s nano - a mikrovlákennými materiály pro tkáňové inženýrství
Procházková R.1, 3, Horáková J.2, Jakůbková Š.1, Jiroušová J.1, Pilařová K.2, Pavlíková T.2, Jenčová V.2
1 Transfuzní oddělení, Krajská nemocnice Liberec, a.s.
2 Katedra netkaných textilií, Textilní fakulta, Technická univerzita v Liberci
3 Fakulta zdravotnických studií Technická univerzita v LiberciÚvod. Tkáňové inženýrství (TE) je interdisciplinární obor, který využívá znalostí přírodních věd a inženýrství pro vývoj biologických náhrad, které slouží k obnově, zachování či zlepšení funkcí tkání nebo orgánů. Nano - a mikrovlákenné tkáňové nosiče (scaffoldy) jsou základními komponenty pro celou řadu aplikací v oblasti tkáňového inženýrství a regenerativní medicíně, protože svojí strukturou napodobují nativní extracelulární matrix. Vlákenné scaffoldy z biokompatibilních, biologicky rozložitelných a netoxických polymerů poskytují strukturální podporu tkáně, 3D strukturu s dobrou pórovitostí, poskytují prostor pro buněčnou adhezi a regulaci funkce buněk (tvar, proliferace, migrace, diferenciace). Buňky na povrch nanovlákenných struktur snadno adherují a v ideálním případě prorůstají do vnitřních vrstev jejich struktury. Proliferaci buněk do vnitřní struktury scaffoldů je však potřebné stimulovat, např. destičkovými růstovými faktory, získanými z plazmy bohaté na trombocyty (PRP). PRP obsahuje více než 300 bioaktivních molekul, mezi nejdůležitější patří růstové faktory (např. PDGF, TGFB1, PDGFs, IGF1, FGF1, EGF, VEGFs), mediátory makrofágů a monocytů, interleukiny, fibrinogen, imunoglobuliny a další. PRP má potenciál přinést kombinace růstových faktorů a cytokinů, které jsou schopné stimulovat buněčnou aktivitu, proliferaci a produkci ECM. Začlenění trombocytů do polymerních skeletů přispívá k podpoře integrace nativních tkání do scaffoldů a zvyšuje celkovou průchodnost polymerní nano - a/nebo mikrovlákennou strukturou.
Metodika. Ke studiu interakce mezi nativními trombocyty a vlákennými materiály s různou morfologií (poréznost, průměr vlákna - mikro, nano) jsme použili plazmu bohatou na trombocyty. Materiály byly připraveny z polykaprolaktonu (PCL), Mn 45000, různými způsoby: elektrické zvlákňování (E), forcespinning (FS), meltblown (MB) a kombinace technologií meltblown a elektrického zvlákňování (MBE). Průměrné rozpětí průměru vlákna testovaných materiálů bylo 732 ± 292 nm pro elektrostatická vlákna (E), 6,5 ± 4,4 mm pro vlákna připravená metodou meltblown (MB). Připravené a sterilizované scaffoldy byly inkubovány po dobu 2 hodin s nativními trombocyty (koncentrace PLT 7x106/ml, PRP byla získána z buffy-coatů). Materiály s adherovanými trombocyty byly dále inkubovány v Composol roztoku při teplotě 37 °C. Po inkubační době 2 hodiny, 1, 4 a 8 dní byla vyhodnocena adheze trombocytů (MTT test), morfologie adherovaných a aktivovaných trombocytů, jejich agregace a uvolnění růstových faktorů (GF). Interakce PLT s materiály byla hodnocena fluorescenční mikroskopií (FITC-anti CD41) a elektronovou mikroskopií (SEM). Uvolnění GF bylo monitorováno pomocí SDS PAGE.
Výsledky. Trombocyty adherovaly na oba – nano-i mikrovlákenné materiály. Míra adheze PLT byla významně vyšší u materiálů obsahujících nanovlákna získaná elektrostatickým zvlákňováním (E) nebo v kombinaci s meltblown (MBE). SEM snímky pořízené po 2 hodinách inkubace prokázaly kompletní pokrytí a aktivaci trombocytů na nanovlákenných materiálech v porovnání s tvarem PLT na mikrovláknech. Pozorovali jsme také rozdíly v agregaci trombocytů na materiálech s různým průměrem vláken - PLT formovaly agregáty spíše na mikrovláknech nežli na nanovláknech.
SEM obrazy ukázaly, že PLT na nanovláknech jsou rozprostřeny na jejich povrchu, přes více vláken, zatímco na mikrovlákenném materiálu jsou adherovány na jednotlivých vláknech. Uvolňování GF z PLT je výrazně rychlejší u materiálů obsahujících nanovlákna.
Naši hypotézu o ztrátě aktivace na mikrovlákenných materiálech také podporuje analýza uvolňování proteinů. Většina proteinů byla uvolněna do 1 dne po adhezi trombocytů. Nicméně u mikrovlákenných materiálů (MB, MBE) bylo uvolnění GF zjištěno až 8. den. Závěr: První výsledky ukazují, že přítomnost mikrovláken ve struktuře scaffoldu má vliv na aktivaci trombocytů a dochází k pozvolnějšímu uvolňování růstových faktorů.
Podpora projektu: Grant MZdr.No 15-29241A.
43 Výroba kryoproteinu na transfuzním oddělení Thomayerovy nemocnice
Turek P.1, Matloch Z.2, Lerlová A. 1, Senohrábková J. 1
1Thomayerova nemocnice, Praha; 2IKEM, Praha
Po rozmražení plazmy na teplotu +4 až + 10 °C zůstává nerozpuštěna frakce obsahující zejména fibrinogen, komplex F VIII / von Willebrandův faktor, fibronektin, fibrin stabilizující faktor (F XIII) a některé další adhesivní proteiny. Nerozpuštěnou frakci plazmy, nazývanou kryoprotein, je možné oddělit centrifugací (zkoncentrovat). V minulosti byl kryoprotein užíván při léčbě hemofilie A, v současnosti se využívá zejm. jako alternativní zdroj fibrinogenu.
Výroba kryoproteinu byla na TO Thomayerovy nemocnice znovu zavedena v září r. 2013 na základě požadavku IKEM.
Postup výroby: kryoprotein je vyráběn z plazmy mužů (snížení rizika TRALI), která prošla 6měsíční karanténou (snížení rizika HIV, HBV, HCV). Vaky se zmraženou plazmou (260-270 ml) skladované při teplotě – 25 °C a se nechají pozvolna tát 16-18 hod. při teplotě +2 až + 8 °C. Poté se k vakům sterilně připojí prázdný vak a jednotlivé vaky se centrifugují v centrifuze předchlazené na +4 °C při 3300 g po dobu 10 min. Supernatantní „K-plazma“ (Plazma bez kryoproteinu) se pomocí manuálního lisu přetlačí do prázdného vak tak, aby se kryoprotein zkoncentroval cca 10x. Šest jednotek kryoproteinu se sterilně napojí na směšovací vak, kryoprotein v jednotlivých vacích se pečlivě homogenizuje (mírným tlakem proti pevné podložce) a jednotlivé jednotky se zpoolují do směšovacího vaku. Zkontroluje se značení (množství vzniklé sloučením 6 TU výchozího kryoproteinu považujeme za „terapeutickou dávku“, TD), odebere se vzorek a kryoprotein se bezodkladně zmrazí (stejným způsobem, jako plazma). Exspirace přípravku ve zmraženém stavu je stejná, jako u výchozí plazmy.
Kontrola kvality: standardně sledujeme objem, obsah fibrinogenu a F VIII. Obsah F XIII a titr anti-A, anti-B izohemaglutininů byly ověřeny v rámci validační studie.
Výsledky: v období 9/2013-3/2016 bylo vyrobeno 104 terapeutických dávek Kryoproteinu směsného (6 TU). Standardní objem je 200 ml, průměrný obsah fibrinogenu je 2 g/TD, F VIII cca 750 I.U./TD, což je zhruba dvojnásobek oproti minimu požadovanému Doporučením Rady Evropy (0,14 g fibrinogenu respektive 70 I.U. FVIII na 1 jednotku výchozí plazmy). Obsah F XIII je 200 IU/TD kryoproteinu. Titr anti-A, anti-B v konečném přípravku nepřesahoval titr ve výchozí plazmě (přípravek doporučujeme podávat jako „skupinový“ s tím, že přípravek krevní skupiny AB je univerzální). Validační studie prokázala vyhovující kvalitu přípravku.
Použití: „Kryoprotein směsný (6 TU)“ je podáván zejm. jako zdroj fibrinogenu při kardiochirurgických výkonech prováděných na IKEM. Přípravek je indikován buď na základě výsledků rotační tromboelastometrie (ROTEM) provedené u lůžka nemocného nebo při poklesu hladiny fibrinogenu na 2 g/l. Typickým příjemcem kryoproteinu je polytransfundovaný pacient podstupující implantaci mechanické srdeční podpory. Tito pacienti totiž zkonzumují až 40 % ze všech transfuzí.
Ve sledovaném období bylo podáno 80 TD kryoproteinu. Účinnost léčby je srovnatelná s účinností lyofilizovaného komerčně dostupného fibrinogenu (Haemocomplettan® P, CSL Behring), což bylo ověřeno srovnávací studií. Kryoprotein se stal důležitou součástí konceptu racionální hemoterapie na ARO v IKEM a je preferován v situacích, kdy pacient dostává i jiné transfuzní přípravky. Vzhledem k obsahu F XIII a F VIII je superiorní oproti Heamocomplettanu při chirurgických koagulopatiích. Haemocomplettan se spíše podává u imunosuprimovaných či objemově přetížených pacientů a při urgentní potřebě podat fibrinogenu, kdy je výhodou rychlá rekonstituce Haemocomplettanu.
44 Potransfuzní reakce v České republice za rok 2015
Galuszková D.
Transfuzní oddělení, Fakultní nemocnice Olomouc
Úvod. Cílem sdělení je poskytnout informace o potransfuzních reakcích v České republice za rok 2015. Potransfuzní reakcí se rozumí nezamýšlená zdravotní odezva organizmu pacienta, související s transfuzí transfuzního přípravku.
Metodika. Za rok 2015 hlášení poslalo 63 pracovišť. Bylo aplikováno 451 910 transfuzních přípravků a nahlášeno 479 potransfuzních reakcí (0,11%), z toho bylo 47 hodnoceno jako reakce těžké.
Na základě zpracování přehledu je patrné, že relativně nejvyšší počet hlášených reakcí je po podání trombocytových TP, poté po podání plazmy a relativně nejnižší po podání erytrocytových TP.
Nejčastějšími potransfuzními reakcemi jsou reakce alergické (234), následované febrilními nehemolytickými (150) a oběhovým přetížením (15). Mezi nejzávažnější reakce uplynulého roku patří 3krát přenos hepatitidy C, 5 případů TRALI, 2krát imunní časná hemolýza a 3krát anafylaktická reakce.
Závěr. Hlášení potransfuzních reakcí je důležitou součástí hemovigilance. Jde o retrospektivní data, která jsou významná k nastavení správných procesů při zvýšení bezpečnosti hemoterapie.
Tab. 1 Roční výkaz potransfuzních reakcí 
Legenda ke způsobu zápisu: lehká reakce před lomítkem/těžká reakce za lomítkem, červeně reakce po podání plazmy i erytrocytů Tab. 2. Potransfuzní reakce v závislosti na typu transfuzního přípravku 
45 Krevní transfuze – včera, dnes … zítra?
Kořístka M., Čermáková Z.
Krevní centrum, Fakultní nemocnice Ostrava
Po předlouhém “ne-transfuzním” úsvitu několik klíčových objevů (Harwey - krevní oběh (1628), Landsteiner - krevní skupiny AB0 (1901), Lewisohn - 0,2% citrát sodný (1915) otevřelo dveře krevní transfuzi VČERA: první krevní banka (Robertson, Belgie, 1917), první “blood donor” služba (Percy, Londýn, 1921) a první národní transfuzní služba (Velká Británie, 1938-46).
Na těchto neměnných pilířích je založena a budována krevní transfuze DNES, která v nebývalém komfortu moderních technologií a poznatků prožívá “zlaté období”. Krevní transfuze je medicínsky maximálně účinná a bezpečná, přičemž je jasné, že v principech tohoto směru půjde dál i krevní transfuze ZÍTRA.
Lze očekávat ještě nějaká zásadní překvapení? Benefit může přinést “umělá” krev. Její výzkum probíhá již desetiletí a je stále více stimulován pragmatickými důvody (nedostatečné lidské zdroje, infekční rizika, potřeba univerzální krve). I když neznáme všechny detaily tohoto výzkumu, což není důležité, můžeme na základě záblesků dílčích fakt z posledních let vydedukovat závěry a předpovědi, co asi lze reálně očekávat.
Počáteční cíl výzkumu byl jednoduchý – vyrobit “umělou krev”, která funkčně nahradí pravou. Složitost krevních buněk a jejich funkcí redukuje cíl na jediný “reálný” - konkurovat erytrocytům a zajistit transfer kyslíku. Jaké jsou možnosti? Asi dvě – buď Plán 1) Zkopírovat funkčně lidský hemoglobin: a) vyrobit vlastní nosič kyslíku, b) nalézt již existující vhodný nosič v živé/neživé přírodě, nebo Plán 2) Vyrobit “umělé” erytrocyty ve zkumavce.
Plán 1) ukázal, že není schůdnou cestou k řešení, třebaže zaznamenal dílčí úspěchy – nosiče, které i bohatě neinteligentně přenášejí kyslík do tkání, ovšem s různými komplikacemi, které je diskvalifikují, snad někdy budou použity ke krátkodobé saturaci kyslíkem v kritických klinických situacích. Naopak Plán 2) se stal velkou výzvou, jakmile se podařilo in vitro “vypěstovat” erytrocyty z kmenových buněk.
V roce 2014, po 4 letech výzkumu v rámci projektu Blood Pharma, oznámilo sdružení Wellcome Trust vyrobení “umělých” erytrocytů v použitelné kvalitě a standardech vhodných pro transfuze u lidí. Klinické testování “umělých” erytrocytů má být zahájeno na konci roku 2016. Pokud bude úspěšné, bude třeba ve velkém převést produkci ze zkumavky do výroby a pak k pacientovi.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek 9. NÁRODNÍ AFERETICKÝ DENČlánek IMUNOHEMATOLOGIE IIČlánek ŽIVOT OHROŽUJÍCÍ KRVÁCENÍČlánek PosteryČlánek REJSTŘÍKČlánek IMUNOHEMATOLOGIE IČlánek SEKCE NLP IČlánek SEKCE NLP II
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo Supplementum- Nejasný stín na plicích – kazuistika
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
Najčítanejšie v tomto čísle- IMUNOHEMATOLOGIE II
- ORGANIZACE TRANSFUZNÍ SLUŽBY, DÁRCOVSTVÍ, VÝROBA TRANSFUZNÍCH PŘÍPRAVKŮ
- KLINICKÁ TRANSFUZIOLOGIE
- INFEKCE – RIZIKA, VYŠETŘOVÁNÍ; VARIA
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



