-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Postery
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. Supplementum, p. 48-60.
Kategorie: Postery
P01 Erytrocytární aloimunizace u těhotných žen
Holusková I.1, Ľubušký M.2,Galuszková D.1
1Transfuzní oddělení, Fakultní nemocnice Olomouc
2Porodnicko-gynekologická klinika, Fakultní nemocnice OlomoucÚvod. Cílem studie bylo určení incidence specifických, klinicky významných antierytrocytárních aloprotilátek, které mohou způsobit závažné hemolytické onemocnění plodu a novorozence, u těhotných žen v I. trimestru těhotenství v olomouckém regionu.
Metodika. V letech 2000–2015 bylo na našem Transfuzním oddělení vyšetřeno celkem 54657 těhotných žen. V prvním trimestru těhotenství byl u všech žen proveden screening nepravidelných tepelných antierytrocytárních protilátek, a dále pak i identifikace protilátkových nálezů.
Výsledky. Klinicky významné antierytrocytární aloprotilátky byly detekovány u 1,7 % těhotných žen (899/54657). Nejčastěji byla detekována aloprotilátka anti-E s incidencí 6,3 ‰ (342/54657), následována aloprotilátkou anti-D s incidencí 4,1 ‰ (222/54657), dále následovaly aloprotilátky anti-M s incidencí 1,8 ‰ (97/54657), anti-K s incidencí 1,3 ‰ (71/54657), anti-C s incidencí 1,2 ‰ (67/54657), anti-c s incidencí 0,9 ‰ (47/54657), anti-S s incidencí 0,4 ‰ (23/54657), anti-Jka s incidencí 0,2 ‰ (11/54657) a anti-Fya s incidencí 0,1 ‰ (6/54657).
Závěr. Nejčastěji detekovanou aloprotilátkou v našem souboru byla aloprotilátka anti-E, o které ovšem víme, že může vznikat i přirozeně, bez erytrocytárního antigenního podnětu. Druhou nejčastěji detekovanou, avšak klinicky asi nejvýznamnější aloprotilátkou, byla aloprotilátka anti-D, a to i přes provádění anti-D imunoprofylaxe u RhD negativních žen. Klinický problém mohou představovat i jiné aloprotilátky, zejména pak anti-c a anti-K. Je-li tedy u těhotné ženy na začátku těhotenství diagnostikována klinicky významná aloprotilátka, je nutné zajistit adekvátní konzultaci pacientky se stanovením dalšího postupu na pracovišti s odborností gynekologie a porodnictví. Nezbytná je mezioborová spolupráce gynekologa, imunohematologa a neonatologa.
P02 A new missense mutation in exon 7, c.662G>A, causing the Bw phenotype – a family study in Northern Moravia
Pisacka M.1, Kralova M. 1, Kralova J. 1, Koristka M. 2, Cermakova Z.2, Hellberg Å.3, Hult A.3, Storry J.R.3, Olsson M.L.3
1UHKT Prague, 2Blood Centre, 2University Hospital Ostrava, 3Lund
Background. Weak variants of the B blood group are detected much more rarely than weak A subgroups in Europe. B subgroups are difficult to classify, and an analogy with A variants is used. The Bw phenotype has been associated with 38 different alleles to date (dbRBC). Here we report a family study showing that a novel single nucleotide mutation in an otherwise normal ABO*B.01 allele results in weakened B antigen expression and is associated with the phenomenon of allelic enhancement.
Aim. The investigation was prompted by discrepant blood grouping results in a 55-year-old male patient whose red blood cells (RBCs) initially typed as group O but whose plasma gave only a weak reaction with B test RBCs. Initial genotyping results revealed an ABO*B.01/O.01 genotype consistent with group B. Samples from family members were drawn under informed consent for testing.
Materials and Methods. Blood grouping was performed on gel cards (BioRad; Grifols) by manual tube agglutination tests (Exbio; MTC) and by automatic analyzer in microtitre plates (Galileo, Immucor). Genotyping was done by PCR-SSP (Innotrain; BAG) and on a microarray (BloodChip Reference, Grifols). ABO exons 1 to 7 were sequenced using Big Dye Terminator reagents on the ABI 3500DX (v3.1, Applied Biosystems), and analysed using CodonCode Aligner software. RBCs were tested with monoclonal anti-A, anti-B and anti-H by flow cytometry.
Results. See the table for a summary of ABO phenotype and genotype results. B antigen was detected weakly in gel cards on the niece‘s RBCs only. Sequence analysis showed a novel mutation in ABO exon 7, c.662G > A in the B allele from the proband, his sister and niece, predicting an amino acid change p.Gly221Asp. This residue is completely conserved among the members of the GT6 family of glycosyltransferases and centrally located in the enzyme, 7 amino acids from the DVD motif that coordinates the UDP-galactose donor substrate. Analysis of ABO exons 1-6 on the proband sample did not show any other change.
Flow cytometric analysis showed very weak B antigen expression on RBCs from the proband and his sister and notably stronger expression on RBCs from the niece. While the same mutation was present in all three individuals, the niece had also inherited a normal ABO*A1.01 allele and the increased B antigen expression is consistent with allelic enhancement.
Subsequent to the family study, an unrelated person, also of Czech origin with the same mutation (genotype B.01/O.01) and identical phenotype was identified in our laboratories.
Summary/Conclusions. This family study revealed a new inherited mutation in the B gene predicting an amino acid change near the catalytic site with weakening effect of the B transferase activity. The interesting difference of more emphasized weakening effect when this allele is inherited with O.01 in trans compared with being paired with A1.01 demonstrates the phenomenon of allelic enhancement.
This mutation together with observed presence of anti-B in plasma could cause discrepant or in some cases even wrong ABO determination and might be underdetected by routine serological methods, as indicated by the coincidental finding in an unrelated individual.
Supported by Ministry of Health, Czech Republic - conceptual development of research organization Institute of Haematology and Blood Transfusion IHBT CZ00023736.
P03 Kazuistiky AIHA: Paroxysmální chladová hemoglobinurie
Linhartová E.1, Suková M.2
1Oddělení krevní banky, Fakultní nemocnice v Motole, Praha, 2Klinika dětské hematologie a onkologie, 2. LF a FN v Motole, Praha
Autoimunní hemolytické anémie (AIHA) jsou heterogenní skupinou patologických stavů, kde zjišťujeme protilátky proti erytrocytárním antigenům a jimi způsobený zrychlený zánik červených krvinek. Rozeznáváme AIHA s tepelnými, chladovými protilátkami, paroxysmální chladovou hemoglobinurii a léky indukovanou hemolytickou anémii. Paroxysmální chladová hemoglobinurie je raritní příčinou akutní autoimunní hemolytické anémie zjištěnou především u malých dětí po virovém onemocnění. Je charakterizována intravaskulární hemolýzou a následnou hemoglobinurií po aktivací komplementu bifázickou protilátkou (Donathův-Landsteinerův hemolyzin). Tato protilátka se váže na erytrocyty po vystavení organismu chladu v akrálních částech a po přesunu do teplejších centrálních částí organismu dochází k intravaskulární hemolýze a hemoglobinurii.
Prezentujeme paroxysmální chladovou hemoglobinurii (PCH) u 3 pacientů z roku 2015 ve věku 2–3 let, u kterých se po virovém infektu projevila klinicky závažná hemoglobinurie s variabilním klinickým průběhem.
Hodnoty Hb při přijetí pacienta 1 a 2 byly 104 g/l, resp. 102 g/l (odpovídající podané transfuzi před přijetím), u pacienta 3 Hb 84 g/l (norma 115–135 g/l). Nízké hodnoty hematokritu byly u všech pacientů 0,277; 0,286; 0,244 (norma 0,34–0,40 l/l), vyšší leukocyty 18,4; 18,0; 22,0 x109/l (norma 5,5–17,0 x109/l), retikulocyty nebyly příliš vysoké 1,93; 1,00; 1,15 % (norma 0,82-1,45 %). Z biochemických výsledků vysoké hodnoty volného Hb v séru 1138,0; 3954,0; 516,36 mg/l (norma 124–310 mg/l), vysoká hodnota LDH 34,12; 42,40; 21,9 μkat/l (norma 1,93-4,91 μkat/l), nízká hodnota haptoglobinu u pacienta 2 a 3 (u pacienta 1 vyšetření neprovedeno) potvrzovaly probíhající hemolýzu.
Imunohematologická vyšetření
Zjištěna senzibilizace erytrocytů (PAT 3-4+) složkami aktivovaného komplementu C3d (3-4+), negativní screening protilátek při 37 °C u všech pacientů, při 4 °C pozitivní pouze u pacienta 3. Zjištěny autoprotilátky v NAT při 37 °C i při 4 °C pozitivní (3-4+) u všech pacientů, v enzymovém testu (1+) jen pacient 1. Prováděné laboratorní testy ve spolupráci s ÚHKT potvrzují, že Donath-Landsteinerův test je pomocným vyšetřením, potvrdil diagnózu pouze u pacienta 3.
Klinický průběh onemocnění
Pacient 1: akutní AIHA, rychlá stabilizace hemolýzy, kortikoidy 14 dní, za měsíc po vysazení kortikoidů hemoragická diatéza s trombocytopenií 7x109/l, červený KO v normě, promptní odpověď na kortikoidy – uzavřeno jako Evansův syndrom (AIHA+ITP), v plánu vyšetření CVID, dispenzarizace na hematologii.
Pacient 2: perakutní průběh AIHA s renálním selháním, pro renální selhání a respirační selhání nutná eliminační léčba (CVVH), plazmaferéza 2x, regrese hemolýzy, reparace funkce ledvin během 14 dnů, kortikoidy celkem 21 dnů, další průběh příznivý – AIHA nerecidivovala, plná úprava funkce ledvin, imunologické vyšetření vylučuje imunodeficit, další dispenzarizace na nefrologii.
Pacient 3: ataka AIHA následující po respiračním infektu, rozvoj intravaskulární hemolýzy během hodin, bez alterace renálních parametrů. Anémie se upravila po 1 transfuzi, hemolýza se spontánně upravila bez léčby kortikoidy, další průběh příznivý, AIHA nerecidivovala, dispenzarizace u PLDD.
P04 Přímý antiglobulinový test jako prediktor možného lymfoproliferativního onemocnění u asymptomatické dárkyně krve
Motáň V.1, Biedermann P.1, Staňková H.1, Sýkora M.2
1Transfuzní odd., Nemocnice České Budějovice a.s.
2Oddělení klinické hematologie, Nemocnice České Budějovice a.s.Úvod. Přímý antiglobulinový test (PAT) prokazuje in vivo navázané protilátky nebo složky komplementu na erytrocytech, je základním testem v diagnostice autoimunitní hemolytické anemie (AIHA). PAT se doplňuje u dárců krve v případě podezřelých laboratorních nálezů (pozitivní screening protilátek, pozitivní autokontrola, pozitivní Rh kontrola) a v případě reaktivity erytrocytárního transfúzního přípravku či krevního vzorku příjemce.
Metodika. Sdělení se zabývá případem 50leté dlouholeté dárkyně krve, u které byl nově zjištěn pozitivní PAT. Při hematologickém došetřování v séru zjištěna monoklonální gamapatie IgG lambda (6 g/l). Histologicky z trepanobiopsie nebyla splněna kritéria mnohočetného myelomu (přítomno pouze 5 % plazmatických buněk), uzavřeno jako monoklonální gamapatie nejasného významu (MGUS).
Závěr. Pozitivita PAT u jinak asymptomatických dárců krve není raritní. V následném hematologickém došetřování je důležité klást důraz na anamnézu a doplnění laboratorních vyšetření (autoimunitní panel, markery hemolýzy, imunoelektroforéza sérových bílkovin). Pozitivita PAT totiž může signalizovat dosud nepoznaná lymfoproliferativní onemocnění jako je např. monoklonální gamapatie neurčeného významu (MGUS), mnohočetný myelom, lymfomy. V zahraniční literatuře je popsána řada takových případů.
P05 Externí hodnocení kvality – čerstvé porovnání poskytovatelů SEKK a EQAS
Böhmová T., Masopust J.
Transfuzní oddělení, Krajská zdravotní, a.s. – Masarykova nemocnice v Ústí nad Labem, o. z.
Účast v externím hodnocení kvality (EHK) je základní součástí sledování kvality laboratorních výsledků a plnění akreditačních požadavků na klinické laboratoře. Hlavním poskytovatelem EHK v České republice (ČR) je společnost SEKK spol. s.r.o. – pro obor transfuzní služby jsou relevantní dva nabízené programy: Imunohematologie (IH) a Přímý antiglobulinový test (PAT).
Pro imunohematologické testování je nově k dispozici také program „Blood typing Program“ v rámci EHK poskytovaného firmou Bio-Rad s.r.o. (z anglického jazyka označováno jako EQAS). Tento program je akreditován pro zkoušení způsobilosti, ale zatím pouze u Americké asociace pro laboratorní akreditaci, je tedy otázkou uznávání při externích auditech kvality. Testuje se na několika imunohematologických pracovištích v ČR.
Na rozdíl od známého IH, které je rozděleno do čtyř samostatných cyklů po dvou vzorcích, je v EQAS objednáván v ročním cyklu, který tvoří celkem devět vzorků rozesílaných odděleně ve třech kolech, součástí každého kola je také jeden vzorek suspenze erytrocytů zastupující transfuzní přípravek a používaný pro test kompatibility (dodávána zkumavka, ne segment). Do cyklu je dle informací na webu možné se přihlásit i během roku a vzorky, které již byly rozesílány, vyšetřit dodatečně (hodnocení je doplněno v následujícím kole). Vzorky jsou dodávány nerozdělené na erytrocyty a plazmu na rozdíl od vzorků v cyklech IH, což je určitou výhodou pro vyšetření na analyzátoru. V nabídce jsou zatím jen některá imunohematologická vyšetření (krevní skupina v systému AB0; stanovení hlavních antigenů Rh systému – D, C, c, E, e; screening nepravidelných protilátek a jejich identifikace; PAT a test kompatibility). Výsledky jsou zadávány stejně jako v cyklech IH elektronicky, a to prostřednictvím internetových stránek, na kterých se účastník přihlásí pod vlastními přihlašovacími údaji. Tyto stránky jsou v českém jazyce, nicméně převedení z angličtiny není dokonalé (problémy s diakritikou, jazyk vyhodnocení a při zadávání). Pokud účastník provádí některé vyšetření různými metodami, lze předem vytvořit „účty“. Prakticky je při zadávání nejprve zvolen daný účet, následně vyšetřený vzorek, u kterého se zobrazí pro vyplnění jen prováděné metody. Tímto způsobem jsou postupně pro všechny aktuální vzorky a účty vyplněny získané výsledky. To je určitou výhodou oproti IH, kde se při zadávání výsledků (aplikace Cibule) zobrazují všechna vyšetření daného cyklu. Výsledky se v EQAS zadávají po vzorcích, v IH po metodách. Pro vyšetření antigenu D je nepřesně uvedena možnost „weak“ (většina laboratoří rozlišení mezi slabým antigenem a variantou neprovádí), rovněž se neuvádí použitá diagnostika (klony protilátek), které jsou v tomto ohledu důležité. Možnosti u dalších vyšetření odpovídají, v případě identifikace protilátek by byla užitečná možnost „neprovedeno“ (odpovídá běžnému postupu při negativním výsledku screeningu nepravidelných protilátek), test kompatibility je zadáván formou hodnocení kompatibilní-nekompatibilní, což je jiné než vlastní výsledek reakce (pozitivní/negativní). Jednotlivá kola jsou rychle vyhodnocena – dostupnost již několik dní po konečném termínu opět na webových stránkách. Hodnocení je formou rozsáhlého reportu vystaveného pro každý vzorek (a u něj prováděné metody v daném účtu) – přínosem by byl přehledný dokument pro dané kolo a účet (použitelný např. v případě auditů). Po skončení celého cyklu je vystaven certifikát o účasti a úspěšnosti daného účastníka.
Při souhrnném porovnání je dle našich dosavadních zkušeností EQAS možnou alternativou pro externí hodnocení kvality, nicméně pro plnou konkurenceschopnost tradičnímu poskytovateli jsou potřeba ještě další změny.
P06 Dárcovská politika – naše cesty vstříc k dárcům
Furková J., Kořístka M., Čermáková Z.
Krevní centrum, Fakultní nemocnice Ostrava
Úvod. Dárcovská základna je životně nezbytným prvkem každého efektivně fungujícího zařízení transfuzní služby. Dostatečný počet aktivních dárců je vždy dynamicky proměnný a jeho vývoj reguluje zejména transfuzní a výrobní záměr daného zařízení. Jeho profil, stabilitu a celkový směr vývoje z dlouhodobého hlediska ovlivňují a formují i různé společenské a socioekonomické faktory. V rozlehlé ostravské aglomeraci lze pozorovat v 90. letech silný “příliv” dárců z velkých průmyslových a těžebních podniků a to bez zvláštní aktivní propagace. Po téměř čtvrt století, kdy již tento fenomén pominul a dochází ke generační výměně, je dárcovská politika směrem k veřejnosti velmi aktivní, zaměřená na systematické budování perspektivní dárcovské základny.
Metodika. V roce 2014 stanoven základní cíl vybudovat extramurální odběrové místo v obchodní zóně a tímto se pokusit rozšířit dárcovskou základnu zejména z řad mladých.
Výsledky. V listopadu 2015 bylo otevřeno nové odběrové místo “OMKC” (Odběrové místo Krevního centra FN Ostrava) v největší ostravské obchodní zóně Avion Shopping park, které je vyhrazeno pouze pro odběry plazmy. Během šesti měsíců fungování odběrového místa se odběrová aktivita zvýšila o 10 % a zvýšily se rovněž možnosti efektivního využití dárcovské základny.
Závěr. Zavedení OMKC je ”atraktivní” pro dárce z hlediska lokalizace v rušné obchodní zóně a nabídkou odběrů aferetické plazmy až do pozdních odpoledních hodin (od 9 do 19 hodin v pracovní dny). Z hlediska dárcovské politiky OMKC postupně přináší očekávaný benefit – přitahuje pozornost i nových mladých dárců.
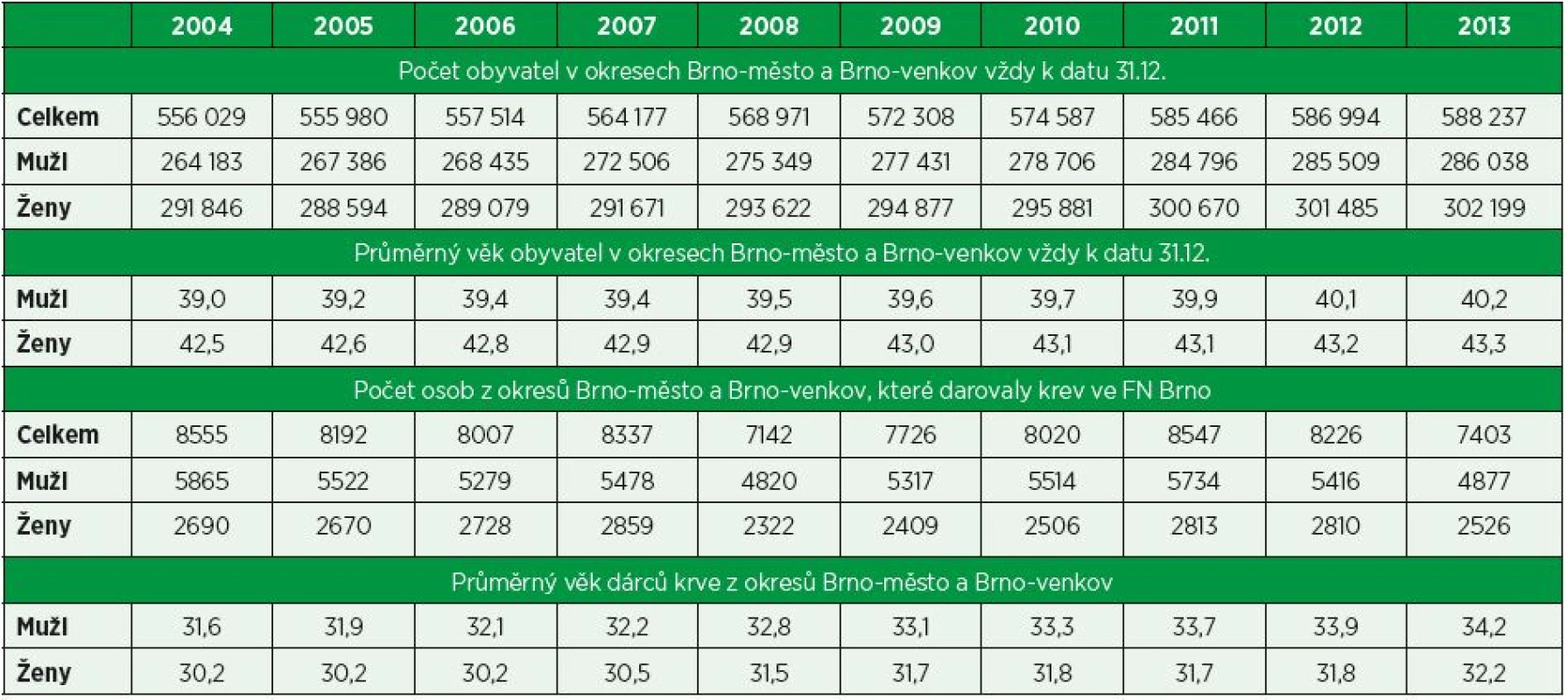
P07 Demografická data z registru dárců krve Fakultní nemocnice Brno
Tesařová E.1, Mlčochová G.2, Ševčíková L.2, Kroupová D.3, Lejdarová H.2
1Oddělení zdravotních pojišťoven Ekonomický odbor, Fakultní nemocnice Brno
2Transfuzní a tkáňové oddělení, Fakultní nemocnice Brno
3Centrum informatiky, Fakultní nemocnice BrnoÚvod. Ve sdělení autoři prezentují data registru dárců krve Fakultní nemocnice Brno (FN Brno) z okresů Brno-město a Brno-venkov ve vztahu k věku a pohlaví v období od 2004 do 2013 a posuzují reflexi registru dárců krve k demografickým údajům okresů Brno-město a Brno-venkov.
Metodika. Demografické údaje okresů Brno-město a Brno-venkov byly získány z webových stránek Českého statistického úřadu. Data registru dárců krve Fakultní nemocnice Brno byla získána z informačního systému IS AMIS*H, transfuzní služba, který Fakultní nemocnice Brno do června 2016 využívala, a to jak ke správě registru dárců krve, tak i k výrobě transfuzních přípravků a podpoře činností laboratoří Transfuzního a tkáňového oddělení FN Brno (TTO FN Brno). Soubor dat byl analyzován ve vztahu k pohlaví a věku dárců krve z okresů Brno-město a Brno-venkov, kteří v definovaném roce minimálně jednou darovali krev nebo krevní složku.
Závěr. V průběhu desetiletého období od roku 2004 do roku 2013 se kontinuálně zvyšoval počet obyvatel okresů Brno-město a Brno-venkov, a to jak mužů, tak i žen. Počet osob se zvýšil celkově o 32 208 osob, počet mužů se zvýšil o 21 855 osob, počet žen o 10 353 osob. Zvýšení počtu obyvatel bylo způsobeno vyšším počtem živě narozených dětí a přistěhovalectvím. V průběhu sledovaného období kolísal meziročně počet osob z okresů Brno-město a Brno-venkov, které ve FN Brno darovaly krev nebo krevní složku. Porovnáním let 2004 a 2013 je nutné konstatovat, že počet dárců krve, u nichž byl v definovaném roce realizován minimálně jeden odběr krve nebo krevní složky, klesl o 1 152 osob; počet mužů klesl o 988 osob, počet žen o 164 osoby. V průběhu sledovaného období se kontinuálně zvyšoval průměrný věk obyvatel regionu; mužů o 1,2 roku; žen o 0,8 roku. Demografický vývoj regionu kopíroval registr dárců krve FN Brno. Průměrný věk dárců krve se ve sledovaném období kontinuálně zvyšoval; u mužů vzrostl o 2,6 roku, u žen o 2,0 roky. Ženy představovaly v jednotlivých letech i v celkovém součtu přibližně jednu třetinu registru dárců krve FN Brno zároveň s konstatováním, že průměrný věk žen – dárkyň krve byl přibližně o dva roky nižší než průměrný věk mužů – dárců krve.
P08 Hemoglobinometr CompoLabTS – ověření použití pro vyšetření dárců krve
Böhmová T., Pyšná S.
Transfuzní oddělení, Krajská zdravotní, a.s. – Masarykova nemocnice v Ústí nad Labem, o. z.
Úvod. Koncentrace hemoglobinu (Hb) je jeden z hlavních faktorů rozhodujících o propuštění dárce k odběru plné krve. Standardní metodou měření Hb je fotometrické měření barevných produktů vzniklých přeměnou Hb ve vzorku – ať už venózní nebo kapilární krve. Oba typy vzorků mohou být měřeny na samostatných hemoglobinometrech, prostřednictvím speciálních kyvet obsahujících potřebné reagencie. Na jiném principu je založeno měření Hb přístrojem CompoLabTS (Fresenius Kabi). V kyvetě se vzorkem nedochází k žádné reakci, ale fotometrické měření probíhá při různých délkách zahrnujících různé hemoglobinové frakce, obsažené ve vzorku, a jejich součtem je získána výsledná koncentrace, zobrazovaná na displeji. Výhodou je, že kyvety neobsahují žádné reagencie, a nedochází tedy k ovlivnění jejich kvality během používání (jako to je u kyvet pro běžně používané hemoglobinometry).
Metodika. U celkem 62 dárců (z toho 24 žen a 38 mužů) bylo provedeno měření kapilární a venózní krve na používaném přístroji HemoCue 201 DM (Cheiron a.s.) a hemoglobinometru CompoLabTS, vzorky venózní krve byly měřené také na hematologickém analyzátoru (referenční hodnota). Byla porovnána shoda naměřených hodnot (jako limitní stanovena odchylka ± 2,5 %). Kromě toho bylo ze získaných dat určeno riziko falešného přijetí/odmítnutí dárce (při měření kapilární krve, vztaženo k referenčnímu měření na hematologickém analyzátoru a limitním hodnotám pro přijetí dárce k odběru).
Výsledky. Hodnoty koncentrace Hb jsou na přístroji CompoLabTS vyšší jak v porovnání s hematologickým analyzátorem (% vyšších hodnot u žen/mužů: 70/55, u přístroje HemoCue pouze 33/36) tak i hemoglobinometrem HemoCue 201 DM (% vyšších hodnot u žen/mužů: venózní krev – 63/42, kapilární krev – 71/42).
Diskuse a závěr. V souvislosti s tím je u testovaného hemoglobinometru výraznější riziko falešného přijetí k odběru u dárkyň (29 %). Kromě již uvedené výhody kyvet bez reagencií je měření velmi rychlé, nevýhodou pro běžný provoz v odběrových centrech je nemožnost přenosu výsledků do PC/informačního systému. Hemoglobinometr CompoLabTS s jiným principem, rychlostí a přesností měření je zajímavou možností pro odběrová pracoviště, případně terénní odběry dárců (vzhledem k přenosu dat), získaná data ale ukazují, že koncentrace hemoglobinu jsou na tomto přístroji vyšší, což je z hlediska přijetí dárce nevyhovující.
P09 Dárci krve s infekcí HIV, HCV, HBV a syfilis ve FN Brno
Tesařová E.1, Křížová E.2, Lejdarová H.2
1Oddělení zdravotních pojišťoven Ekonomický odbor, Fakultní nemocnice Brno
2Transfuzní a tkáňové oddělení, Fakultní nemocnice BrnoÚvod. Postupy vyšetřování známek krví přenosných infekcí u dárců krve a propouštění transfuzních přípravků pro klinické použití v ČR definuje vyhláška č. 143/2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidské krve a jejích složek, ve znění pozdějších předpisů, která vychází z požadavků směrnic Evropského parlamentu a Rady Evropy a je prováděcí vyhláškou zákona č. 378/2007 Sb., o léčivech, ve znění pozdějších předpisů. Vyhláška ukládá při každém odběru provést vyšetření diagnostických vzorků získaných od dárce zahrnující vyšetření k průkazu známek infekce virem lidského imunodeficitu typů 1 a 2 (HIV 1 a 2), a to metodou stanovení protilátky a antigenu p24, virem hepatitidy typu B (HBV), a to metodou stanovení povrchového antigenu, virem hepatitidy typu C (HCV), a to metodou stanovení protilátky, a syfilis, a to metodou stanovení specifické protilátky proti Treponema pallidum (TP).
Metodika. Autoři prezentují detekované infekce u dárců krve, a to jak infekce prodělané v minulosti, tak i infekce aktivní v době jejich detekce z období let 2001–2015. Od 10. 10. 2010 jsou vzorky krve, získané od dárců při každém odběru v Transfuzním a tkáňovém oddělení Fakultní nemocnice Brno (TTO FN Brno), vyšetřovány navíc pomocí systému cobas s201 (Roche Diagnostics), který je určen pro screening vzorků lidské plazmy od jednotlivých dárců nebo směsí lidské plazmy, složené ze stejných alikvotních podílů vzorků od jednotlivých dárců (v poolech), na obsah infekčních agens pomocí technologie amplifikace polymerázovou řetězovou reakcí a 5´nukleázové detekční technologie v reálném čase (RT PCR). Systém cobas s201 s použitím in vitro diagnostika Cobas TaqScreen MPX Test, verze 2, umožňuje simultánní detekci a rozlišení RNA HIV, RNA HCV a DNA HBV. Plazma dárců krve je v TTO FN Brno testována v poolech ze 6 vzorků. Detekované infekce pomocí sérologických testů a/nebo pomocí testu RT PCR byly konfirmovány v Národních referenčních laboratořích SZÚ CEM v Praze.
Výsledky. Ve sledovaném období byly detekovány prodělané či aktivní infekce (HIV, HCV, HBV, syfilis) u 72 osob – dárců krve, z toho u 55 mužů a 17 žen. 33 osob darovalo krev poprvé, 39 osob bylo opakovanými dárci krve. Nejvíce bylo zachyceno osob s infekcí HCV, a to 36, 17 osob s infekcí HBV, 12 osob s prodělanou a/nebo aktivní syfilis. Celkem 7 osob bylo zachyceno s HIV pozitivitou – všechny osoby byly mužského pohlaví; z nich 6 v následném rozhovoru přiznalo MSM (men who have sex with men) přesto, že všechny HIV pozitivní osoby v dotazníku dárce krve odpověděly, že se cítí být bezpečnými osobami z pohledu možného rizika přenosu infekce svojí krví na pacienta - příjemce transfuzního přípravku. U 70 osob byla zjištěna infekce pomocí sérologických screeningových testů. U dvou osob byla detekována přítomnost HBV DNA při současné negativitě sérologického testu HBsAg.
Závěr. Jak vyplývá z prezentovaných výsledků, záchyt testovaných infekcí u dárců krve není raritní a je povinností všech zúčastněných v rámci hemoterapie s rizikem přenosu infekcí počítat. Dle názorů autorů by bylo možné zvýšit bezpečnost hemoterapie rozšířením algoritmu vyšetřování krve dárců o povinnou detekci nukleových kyselin minimálně tří původců krví přenosných infekcí (HBV, HCV a HIV), aniž by při rozumném organizačním modelu transfuzní služby v ČR, rozšíření testování představovalo neúměrné zvýšení nákladů.
P10 Zkušenosti s použitím metod LIAISON XL MUREX HIV Ab/Ag HT a LIAISON XL MUREX HIV Ab/Ag při testování dárců krve na analyzátoru LIAISON XL
Janoušková M., Mecelová K., Nováková E.
Transfuzní oddělení, KKN a.s., Nemocnice v Karlových Varech
Úvod. Vyšetření známek infekce u dárců krve a jejích složek se provádí při každém odběru a tvoří součást kritérií pro propuštění transfuzních přípravků pro léčebné použití i jako suroviny pro další zpracování. Na platformě chemiluminiscenčního analyzátoru LIAISON XL jsou nyní k dispozici dva typy vysoce citlivých a specifických testů 4. generace určených ke kombinovanému kvalitativnímu stanovení antigenu p-24 HIV-1 a specifických protilátek proti viru humánní imunodeficience typu 1 (HIV-1 skupiny M a skupiny O) a/nebo viru humánní imunodeficience typu 2 (HIV-2) ve vzorcích lidského séra a plazmy. Test LIAISON XL Murex HIV Ab/Ag je schopen s použitím dvou reagenčních integrálů detekovat HIV antigen p-24 a HIV protilátky odděleně, zatímco nová metoda LIAISON XL Murex HIV Ab/Ag HT používá pouze jeden reagenční integrál a detekuje antigen a/nebo protilátku proti HIV paralelně bez původního rozlišení.
Oba testy, test LIAISON® XL HIV Ab/Ag a test LIAISON® XL MUREX HIV Ab/Ag HT, byly porovnány a vyhodnoceny při testování vzorků dárců krve a plazmy na analyzátoru LIAISON XL.
Metodika. 150 vzorků séra náhodně vybraných dárců krve, 5 vzorků z cyklu externího hodnocení kvality (SEKK) a 2 vzorky komerčně dodávané pozitivní kontroly (Accurun) byly testovány na analyzátoru LIAISON XL v současné době používaným testem LIAISON XL Murex HIV Ab/Ag a nově zavedeným testem LIAISON XL Murex HIV Ab/Ag HT. Měření oběma testy bylo provedeno v tentýž den. Byly porovnány výsledky, vyhodnocena jejich shoda či neshoda a porovnána doba analýzy vzorků. Pro porovnání propustnosti obou kombinovaných testů HIV Ab/Ag v rutinním provozu transfuzního oddělení byly u vzorků dárců krve současně s těmito testy vyšetřovány rovněž další povinné infekční markery HBsAg, HCV Ab a Treponema Ab pomocí testů LIAISON XL Murex HBsAg Quant, LIAISON XL Murex HCV Ab a LIAISON Treponema Screen,
Výsledky. Byla prokázána 100% shoda mezi výsledky získanými metodou LIAISON XL Murex HIV Ab/Ag HT a metodou LIAISON XL Murex HIV Ab/Ag (150 vzorků dárců krve negativní, vzorky z externího hodnocení kvality 2 pozitivní a 3 negativní, 2 Accurrun vzorky pozitivní). Doba potřebná k dosažení výsledku HIVAb/Ag u jednoho vzorku je při použití metody LIAISON XL Murex HIV Ab/Ag HT kratší o 23 minut (42 %) ve srovnání s testem LIAISON XL Murex HIV Ab/Ag. Doba potřebná ke screeningu 50 vzorků dárců krve na čtyři povinné infekční markery (HIV Ab/Ag, HBsAg, HCV Ab, Treponema Ab) na analyzátoru LIAISON XL je o 40 minut (21 %) kratší při použití testu LIAISON XL Murex HIV Ab/Ag HT v porovnání s testem LIAISON XL Murex HIV Ab/Ag.
Závěr. Zavedení nového testu LIAISON XL Murex HIV Ab/Ag HT do rutinního vyšetřování infekčních markerů u dárců krve významně zkrátilo dobu analýzy a zvýšilo propustnost vzorků, což je zvláště patrné při testování velkých sérií vzorků.
P11 Statistika hlášení klinického Look-backu za období 2006–2016 na Transfuzním oddělení FNOL
Svobodová N., Galuszková D., Vymětalová R.
Transfuzní oddělení, Fakultní nemocnice Olomouc
Úvod. Pojem klinický look-back (KLB) byl u nás v TO FNOL zaveden v roce 1998 a podléhá stejným postupům jako look-back pro infekční markery tj.: hlášení a dohledání transfuzních přípravků (TP) v návaznosti na vyrobené transfuzní přípravky. KLB se týká dodatečných onemocnění dárce (např. onkologické onemocnění, chřipka, borelióza atd.), rizikového chování (např. promiskuita, návykové látky, hygienické návyky atd.), hlášení z hygienické stanice (HS) o potransfuzní hepatitidě a kontaktu dárce s infekčním onemocnění přenášené krví. KLB podléhá také hlášení ze strany zpracovatele plazmy, pokud zjistí a nahlásí záchyt pozitivního výsledku na infekční markery, které si zpracovatelé vyšetřují pomocí metody PCR ze vzorků plazmy zaslané dodavatelem.
Dárce krve má transfuznímu oddělení oznámit dodatečně zjištěné onemocnění, které by mohlo mít vliv na kvalitu odebrané krve. Účelem tohoto hlášení je, aby transfuzní oddělení dodatečně vyřadilo z použití vyrobené transfuzní přípravky, které by mohly vykazovat sníženou bezpečnost a kvalitu.
Tato dodatečná onemocnění nám hlásí nejenom samotní dárci krve, ale i obvodní lékaři a odběrová střediska (OS), která k nám zasílají plné krve (PK) ke zpracování.
Metodika. Příspěvek předkládá statistiku KLB za posledních deset let.
V případě hlášení KLB je osoba odpovědná za look-back (OOLB) povinna ihned zpracovat hlášení, vyhledat všechny TP od dárce a pozdržet je nebo zničit podle typu hlášení. OOLB postupuje dle legislativních požadavků a požadavků zpracovatelských firem.
Výsledky za období roku 2006–2016. Počet hlášení o dodatečném onemocnění je znázorněno v přehledu o KLB v grafu (viz níže). Graf zahrnuje počty hlášení za jednotlivé období od roku 2006 – polovina 2016. Celkový počet hlášení za jednotlivé období jsou rozděleny mezi hlášení získaných z TO FNOL a hlášení z odběrových středisek (Přerov, Vsetín, Hranice, Jeseník). Každý rok se na KLB průměrně zničilo 154 transfuzních přípravků.
Závěr. Dárcovská populace, skládající se z dobrovolných bezpříspěvkových dárců, je považována za stabilní a relativně bezpečnou skupinu lidí. Počty hlášení o dodatečných onemocněních za jednotlivé roky ukazují, že poučení dárců o nutnosti hlášení dodatečného onemocnění je nezbytné a zvyšuje bezpečnost hemoterapie.
P12 Systém sledování komplikací u dárců v ČR
Koukalová A., Galuszková D.
Transfuzní oddělení, Fakultní nemocnice Olomouc
Abstrakt nebyl dodán.
P13 Autologní odběry provedené na Transfuzním oddělení Fakultní nemocnice Olomouc v roce 2015
Hlávková E., Koukalová A., Galuszková D.
Transfuzní oddělení, Fakultní nemocnice Olomouc
Úvod. Autotransfuze je považována za jednu z nedílných součásti hemoterapie. U řady operačních výkonů jako náhrada krevních ztrát při operaci. Nejčastější indikací k autologním odběrům jsou pacienti před ortopedickými a urologickými operacemi, ale i před řadou dalších operačních výkonů.
Cíl. Cílem je zmapovat počet indikovaných odběrů, odebraných a vydaných autologních krví k plánovaným operačním výkonům. Zjistit počet nevydaných proexspirovaných autologních odběrů. Na závěr zjistit i počet homologních transfuzních přípravků vydaných pacientům s indikovanými autologními odběry před plánovaným operačním výkonem.
Metodika. Data v této prezentaci jsou zpracována za rok 2015 u autologních odběrů provedených na TO FNOL, aplikovaných ve FN Olomouc a ve Vojenské nemocnici Olomouc. Jedná se o autologní odběry vyrobené na našem oddělení. Sledovány byly i odběry nedokončené či zničené na úseku výroby. Data jsou zpracována z informačního systému TO a dokumentace pacientů. Dle indikace lékaře jsou pacientům odebírány 1-3 T.U. plné krve v týdenních intervalech. Standardně je při odběru odebíráno 405 ml plné krve. Odběr plné krve provádíme manuálně pomocí odběrových vah do odběrových vaků s následným zpracováním, nebo pomocí separátorů krevních buněk, kdy jsou odebrány jednotlivé složky krve.
Výsledky. Ve sledovaném období jsme odebrali autologní odběry u 244 pacientů v zastoupení 121 mužů a 123 žen. Indikace praktickým lékařem k autolognímu odběru u daných pacientů byla v zastoupení: 1–2 odběry 31x, 2 odběry 70x, 2–3 odběry 131x, 3 odběry 2x a 3–4 odběry 10x. Celkem 641 indikací odběrům autologní krve. Vyrobeno a přijato do expedice k výdeji bylo celkem 444 T.U. AEBR, 446 T.U. AP a 5 T.U. AERD. Pacientům bylo vydáno a aplikováno 303 T.U. AEBR (68,2 %), 4.T.U. AERD (80 %), 306 T.U. AP (68,6 %). Neaplikováno autologních odběrů bylo 141 T.U. AEBR (31,8 %), 1T.U. AERD (20 %), 140 T.U. AP (31,4 %). Pro soubor 244 pacientů s připravenými autologními odběry k operačnímu výkonu bylo vydáno 47 T.U. EBR, 1T.U. ERD, 6 T.U. PA homologních transfuzních přípravků.
Závěr. Autotransfuze je léčebná metoda, která snižuje u příjemce riziko potransfuzních reakcí. Nejčastěji byly autologní odběry indikovány v počtu 2–3. Vydáno a aplikováno bylo 68,2 % AEBR, 80 % AERD a 68,6 % AP. Neaplikováno bylo 31,8 % AEBR, 20 % AERD a 31,4 % AP. Počet vydaných homologních transfuzních přípravků pro pacienty s autologními odběry byl minimální.
P14 Spectra Optia – pilotní separace na TO FNOL
Entrová A., Zemanová M., Svobodová N., Stratilová I., Galuszková D.
Transfuzní oddělení, Fakultní nemocnice Olomouc
Úvod. Aferetická jednotka TO FNOL byla v listopadu 2015 rozšířena o systém pro aferézu Spectra Optia. Spectra Optia je mobilní automatický separátor krevních složek, který pomocí centrifugace a optické detekce systémem automatického řízení rozhraní AIM (Automated Interface Management), provádí terapeutické aferézní procedury a procedury sběru buněk.
Metody. V průběhu 12/2015 až 6/2016 byly provedeny pilotní odběry vybraných procedur – odběry dárcovských trombocytů, procedura výměny erytrocytů, kontinuální sběr mononukleárních buněk (CMNC) a sběr granulocytů (PMN). Mimo separace trombocytů vyžadují všechny ostatní procedury dvoužilní přístup.
Výsledky. Odběrů dárcovských trombocytů procedura Sběr trombocytů – TROMBO bylo provedeno 59 (7x1TU, 31x2TU, 21x3TU), odběry byly provedeny do odběrové soupravy REF 10400, v případě odběrů 3 TU byl ještě použit akcesorní vak na skladování trombocytů REF 70030. Jakostní parametry produktů byly vyhovující, přístroj však neumožňuje odběry trombocytů do náhradního roztoku.
Procedura výměny erytrocytů (Red blood cell exchange – RBCX) byla provedena u 3 pacientů (u 1 pacienta se sekundární polycytémií a u 2 pacientů s familiární erytrocytózou). K depleci erytrocytů byla použita odběrová souprava REF 10220. Pacientům bylo odebráno 413–616 g erymasy s kompletní objemovou náhradou FR, délka procedur byla 35–40 minut. U tohoto typu odběru se nejvíce projevila limitace dvoužilního přístupu.
Procedura sběr granulocytů (PMN) byla provedena 12x u dárce po stimulaci kortikoidy, do odběrové soupravy REF 10300 jako HES byl použit roztok Voluven 10%. Parametry procedur: zpracovaná PK 6000ml, délka procedur 96 – 114 minut, vstupní průtok 65ml/min, průtok sběru 3,9–4,8 ml/min, úroveň sběru 28–36. Jakostní parametry granulocytů z aferézy: leu 15,4-46 x109/l, neutro 11,2–42 x109/l, Hb 52–63 g/l, Hct 0,13–0,19, výtěžnost granulocytů 0,43–1,44 x1010/TU, objem 402–483 ml.
Procedura kontinuální sběr mononukleárních buněk (CMNC) byla použita u dvou dárců k odběru Koncentrátu mononukleárních buněk pro externího odběratele (biotechnologickou společnost) pro využití ke studijním a výzkumným účelům. Pro odběry byla použita odběrová souprava REF 10300. Byly odebrány dva leukaferetické produkty (Koncentráty mononukleárních buněk) o objemu 112 ml a 113 ml, celkem bylo zpracováno 9000 ml plné krve u obou odběrů, délka procedur byla 157 minut a 165 minut, průtok sběru 0,8 ml/min, vstupní průtok 65 ml/min. Poměr vstup/antikoagulant byl vstupně nastaven na 12 : 1, pro výskyt shluků ve sběrné lince přechodně sníženo na 8 : 1 následně návrat k hodnotám 11 : 1. Oba produkty splnily požadavek na obsah mononukleárních buněk > 4x109/TU.
Závěr. Spectra Optia vhodně doplnila portfolio aferetický přístrojů našeho pracoviště. Uvítali jsme možnost provádění dárcovských odběrů trombocytů, která zvyšuje efektivnost využití přístroje, i přes možnost separace trombocytů pouze do plazmy. Nutnost dvoužilního přístupu byla limitující u deplečních výkonů erytrocytů u pacientů. Ostatní odběry byly provedeny u dárců, kde žilní přístup nebyl problém. Separace cestou centrálního žilního katétru nebyla provedena.
P15 Aurora – kvalita v novém hávu
Holaň J., Čermáková Z.
Krevní centrum, Fakultní nemocnice Ostrava
Úvod. Na odběrových sálech Krevního centra FN Ostrava došlo v průběhu roku 2015 a 2016 ke generační výměně plazmaferetických separátorů Autopheresis-C (Fresenius Kabi AG, Bad Homburg, Německo) za nový model „AURORA“ (Fresenius Kabi AG, Bad Homburg, Německo). Na první pohled je větší část přístroje nezměněná. Oproti původním separátorům Autopheresis-C nabízí Aurora několik novinek, např.: dárcovská obrazovka, dotykový displej obsluhy a komfortní zpracování procesních dat.
Separátor je uživatelsky přátelský, datově komunikativní a k dárci vstřícnější.
Metodika
1. Přednosti pro dárce
Informace, v jaké části odběrného cyklu se dárce aktuálně nachází, umožňuje obrazovka, která je umístěna na obou bocích separátoru. Dárce získává informace o aktuálním a posléze i konečném odebraném objemu plazmy v ml. AURORA formou piktogramů dárce rovněž informuje o tlaku při odběrovém cyklu, a zda je nutné cvičením tlak zvýšit.
Ve srovnání s modelem Autopheresis-C je dárci pozitivně vnímán.
2. Přednosti pro obslužný personál
Dotyková obrazovka dovoluje obsluze jednoduše komunikovat s přístrojem. Umožňuje obsluze prohlížet, řídit a upravovat parametry používané během postupu. Obrazovka poskytuje obecné informace a provozní stav postupu, výzvy k zadání informací nebo k určitým úkonům a otevírá jednotlivé obrazovky s informacemi k příslušným krokům postupu.
Testování, kalibrace, nastavování parametrů, veškeré požadované kroky jsou doprovázeny podpůrným textem a grafickým znázorněním.
3. Přenos dat ze separátoru do informačního systému
Přístroj AURORA umožňuje datovou komunikaci s informačním systémem transfuzního oddělení a předává parametry jednotlivých procedur. Napojení je možné formou bezdrátového přenosu nebo přes datový kabel. Podle konfigurace získáme veškeré relevantní informace, týkající se jednorázové soupravy, soupravy jehly, vaku na odebranou plazmu a roztoků včetně kódů, čísel šarže a dat exspirace, které byly v postupu zadány. Dále identifikační kód dárce, kód obsluhy, čas zahájení odběru, čas ukončení odběru, odebraný a požadovaný objem plazmy, množství použitého antikoagulantu, poměr objemu antikoagulantu k objemu plné krve, počet cyklů, objem plné krve dárce odebrané a separované během odběru a celkový objem fyziologického roztoku podaný do oběhu dárce během proplachování fyziologickým roztokem a infuze.
Závěr. První zkušenosti se separátorem krevní plazmy Aurora v Krevním centru FNO jsou pozitivní.
P16 Produkce kryoproteinu ošetřeného metodou redukce patogenů ve FN Brno
Tesařová E.1, Adamcová M.2, Pacasová R.2, Poloková N.2, Lejdarová H.2 Zavřelová J. 3
1Oddělení zdravotních pojišťoven Ekonomický odbor, Fakultní nemocnice Brno, 2Transfuzní a tkáňové oddělení, Fakultní nemocnice Brno, 3Oddělení klinické hematologie, Fakultní nemocnice Brno
Úvod. Kryoprotein je transfuzní přípravek, který je připravován z čerstvé zmražené plazmy během řízeného tavení a následné resuspenze. Obecné příručky odkazují zejména na fibrinogen a koagulační faktory VIII a XIII v něm obsažené. Hlavní indikací kryoproteinu je substituce fibrinogenu při konzumpci v rámci diseminované intravaskulární koagulace. Pro léčbu hemofilie a von Willebrandovy choroby představuje kryoprotein pouze záložní možnost při nedostupnosti koncentrátů koagulačních faktorů. V současné době se v ČR již prakticky nepoužívá, pravděpodobně také z důvodu, že jeho složitá role v procesu hemostázy nebyla dosud dostatečně objasněna.
Metodika. Autoři prezentují kryoprotein, patogen inaktivovaný, vyráběný v Transfuzním a tkáňovém oddělení Fakultní nemocnice Brno. Jedná se o transfuzní přípravek získávaný z plazmy dárců krve, výhradně mužů, bez transfuze v anamnéze, v množství 650 ml, resp. 3 TU. Plazma je získávána od jednoho dárce technikou aferézy, po odběru je ošetřena metodou redukce patogenů pomocí technologie INTERCEPT® a šokově zmrazená do 60 minut v jádře na teplotu -30°C. Z plazmy je následně precipitací bílkovin při tání ze zmrazeného stavu vytěžen kryoprecipitát, který je resuspendován v původní plazmě do objemu 90 – 105 ml.
Výsledky. V průběhu procesu výroby byl analyzován obsah, resp. ztráty jednotlivých koagulačních faktorů (tabulka 1).
Tabulka 1. Průměrné hodnoty obsahu koagulačních faktorů ve 30 testovaných produktech 
V průběhu roku 2015 bylo ke klinickému použití vydáno ve FN Brno 71 vaků á 3 TU; v průběhu I. pololetí 2016 bylo vydáno 53 vaků á 3 TU. Žádné podání kryoproteinu, patogen inaktivovaného, nebylo provázeno výskytem potransfuzní reakce.
Závěr. Indikací pro podání kryoproteinu, patogen inaktivovaného, je vrozená hypofibrinogenemie a afibrinogenemie, získaná hypofibrinogenemie v souvislosti se získanou koagulopatií a/nebo diseminovanou intravaskulární koagulací s hypefibrinolýzou, vrozený nebo získaný nedostatek koagulačního faktoru XIII. Množství aplikovaného kryoproteinu musí být určeno podle stupně a rozsahu krvácení a klinického stavu pacienta. Obvyklá počáteční dávka substituovaného fibrinogenu u koagulopatie navozené peripartálním krvácením a/nebo u traumatické koagulopatie představuje 4 gramy, tzn. 15 TU kryoproteinu v pěti vacích pro 3 TU. K prevenci předávkování je nezbytné monitorovat aktivitu fibrinogenu dostupnými laboratorními metodami (dle Clause) nebo metodami POCT.
P17 Výroba trombocytů k přežívání na TO FN Olomouc
Háblová M.1, Procházková O.1, Vymětalová R.1, Galuszková D.1, Drymlová J.2
1 Transfuzní oddělení, Fakultní nemocnice Olomouc, 2 Klinika nukleární medicíny, Fakultní nemocnice Olomouc
Úvod. Výroba a použití trombocytů k přežívání představuje cílené využití trombocytárního koncentrátu. Transfuzní přípravek (TP) je vyráběn na základě písemného požadavku ošetřujícího lékaře. Slouží ke klinickému vyšetření přežívání trombocytů v oběhu pacienta. Ročně vyrobíme průměrně 6 T.U. Od roku 2010 do 2015 jsme jich vyrobili 42.
Metodika. Trombocyty k přežívání vyrábíme podle krevní skupiny pacienta od dvou dárců plné krve (PK). Podmínkou je, aby dárce měl v krevním obraze hodnotu trombocytů 220 - 270 9/l. Před výrobou TP musí být potvrzena negativita infekčních markerů a screeningu antierytrocytárních protilátek.
Vlastní výroba probíhá ve dvou fázích:
1. fáze – výroba plazmy bohaté na trombocyty (TPK) + erytrocytů resuspendovaných (ER), probíhá v den odběru PK. TPK je skladováno do pondělí na třepačce při teplotě 20–24 °C.
2. fáze – výroba trombocytů k přežívání (T-přežív.) a plazmy nativní (PN) k promývání trombocytů, probíhá vždy v den aplikace.
Transfuzní přípravky T-přežív. a PN jsou po propuštění kvalifikovanou osobou co nejdříve odeslány na kliniku nukleární medicíny (KNM), kde proběhne další zpracování. Jde o ozáření a poté aplikaci TP pacientovi.
Závěr. Výroba trombocytů k přežívání tvoří jen malou část naší produkce, nicméně pro pacienty je tento produkt velmi důležitý a potřebný pro jejich další léčbu. K výrobě kvalitního transfuzního přípravku je nezbytná spolupráce mezi transfuzním oddělením a KNM.
P18 Stabilita erytrocytového koncentrátu skladovaného mimo doporučené rozmezí teplot
Lerlová A., Turek P.
Transfuzní oddělení, Thomayerova nemocnice, Praha
Podmínky pro skladování transfuzních přípravků červené řady jsou poměrně striktně stanoveny. O postupech doporučených při odchylkách od standardního skladování je k dispozici podstatně méně informací. Na podzim r. 2015 vydala Společnost pro transfuzní lékařství Dop_STL2015_11 Skladování a přeprava transfuzních přípravků. Cílem práce bylo ověřit vliv krátkodobého vzestupu teploty na hemolýzu erytrocytů během skladování.
Metodika. Standardně vyrobené Erytrocyty bez buffy-coatu resuspendované (EBR) a Erytrocyty resuspendované deleukotizované (ERD) byly podrobeny zátěžovému testu simulujícímu poruchu skladovacích prostor – přípravky byly vyjmuty z prostor s řízenou teplotou a uloženy na 24 hod. v „laboratorní teplotě“ (20–24 °C), a to ve dvou různých režimech, na konci expirační doby, anebo ve třetím týdnu jejich skladování. Použity byly přípravky, které nebyly vhodné ke klinickému použití, ale jinak splňovaly všechny parametry kvality. Míra hemolýzy byla ověřována stanovením volného hemoglobinu v resuspenzním roztoku před a po zátěžovém testu. U transfuzních přípravků podrobených zátěžovému testu uprostřed jejich doby použitelnosti byla hemolýza stanovena i na konci doby použitelnosti poté, co byly po zátěžovém testu přípravky až do exspirace skladovány za předepsaných podmínek.
Výsledky: Zátěžovému testu bylo podrobeno celkem 29 TU erytrocytových koncentrátů, z toho 16 EBR a 13 ERD. U 7 přípravků byl zátěžový test proveden během 3. týdne skladování, u 22 přípravků těsně po uplynutí doby použitelnosti. U 22 přípravků došlo k vzestupu koncentrace volného hemoglobinu po zátěžovém testu (u sedmi došlo paradoxně k poklesu, což může souviset s chybou při odběru vzorku či při stanovení). Průměrný vzestup volného hemoglobinu na konci skladování byl 32 mg/TU u EBR a 22 mg/TU u ERD. Mezi zátěží uprostřed a na konci doby skladování jsme neprokázali rozdíl. U jednoho přípravku (EBR), který měl hraniční hodnotu volného hemoglobinu již před zátěží, došlo po zátěži k překročení hranice 500 mg/TU.
Diskuse. Vyhláška č. 143/2008 Sb., o krvi, uvádí jako přípustný limit hemolýzy na konci skladování 0,8 % erytrocytů, což odpovídá 500 mg volného hemoglobinu/přípravek. Množství volného hemoglobinu na konci doby použitelnosti u přípravků vyráběných Transfuzním oddělením Thomayerovy nemocnice kolísá v širokém rozmezí, dlouhodobý průměr r. 2015 je 275 mg/TU u EBR a 162 mg/TU u ERD. Vystavení erytrocytů během skladování teplotě 20–+24 °C na dobu 24 hod. vedlo k vzestupu volného hemoglobinu cca o 10 % obvyklé hodnoty. Vzestup u ERD je nižší, což odpovídá literárně uváděné i vlastní praxí ověřeně lepší stabilitě ERD během skladování. Teplotní zátěž použitá během studie byla výrazně náročnější, než jakou předpokládá v mimořádných situacích doporučení STL a lze předpokládat, že při menší zátěži bude i nárůst hemolýzy během skladování menší. K přesnějšímu posouzení dopadu mírnějších odchylek od předepsaného skladování by ale bylo třeba zásadním způsobem rozšířit studii. Pravidla pro posuzování mimořádných odchylek při skladování stanovená v Dop_STL2015_11 lze podle našeho názoru bez většího rizika aplikovat v praxi.
P19 Transfuzní podpora při transplantaci jater – srovnání let 2010 a 2015
Turek P.1, Pagáčová L.2, Danč R.3, Trunečka P.4
1Transfuzní oddělení, Thomayerova nemocnice, Praha, 2Pracoviště speciálních laboratoří, IKEM, Praha, 3Klinika anestezie, resuscitace a intenzivní péče, IKEM, Praha, 4Transplantcentrum, IKEM, Praha
Zajištění transplantace jater vyžaduje mimo jiné masivní podporu transfuzními přípravky a dobrou spolupráci mezi hepatology, transplantačními chirurgy, anesteziology a transfuziology. Transplantaci jater indikuje a provádí Transplantcentrum IKEM (spolupráce Kliniky hepatogastroenterologie a Kliniky transplantační chirurgie), anestezii a pooperační péči zajišťuje Klinika anestezie, resuscitace a intenzivní péče IKEM. Transfuzní přípravky červené řady (a výjimečně i trombocyty a plazmu) zajišťuje Transfuzní oddělení Thomayerovy nemocnice, trombocytové transfuzní přípravky a plazmu zajišťuje Pracoviště spec. laboratoří – Aferetická jednotka IKEM. Cílem práce bylo srovnat spotřebu transfuzních přípravků při transplantaci jater v peroperačním a pooperačním průběhu před 5 lety a v současnosti.
Metodika. Spotřeba transfuzních přípravků byla sledována u skupiny 20 konsekutivních transplantací jater provedených v roce 2010 a v roce 2015, ze souboru byly ale vyřazeni pacienti s diagnózou hepatocelulárního karcinomu (peroperační péče se liší, neprovádí se peroperační sběr krve – cell saving) a děti ve věku do 18 let (jiná tělesná hmotnost = jiné dávkování). Evidovány byly všechny transfuzní přípravky podané pacientovi v den transplantace a během 30 následujících dní.
Výsledky. Spotřeba transfuzních přípravků při transplantaci jater kolísá ve velmi širokém rozmezí (od dvou do několika desítek TU), spotřeba přípravků v potransplantačním období je závislá na rozvoji případných komplikací. Přesto došlo v průběhu 5 let k poklesu průměrné spotřeby přípravků červené řady při samotném výkonu o cca 25% a o dalších 10% v pooperačním průběhu. Podobný pokles je možno zaznamenat i u ostatních transfuzních přípravků.
Diskuse. Transplantace jater představuje i nadále náročný výkon s relativně velkou spotřebou transfuzních přípravků. Celkový pokles spotřeby ale umožnil upravit standard pro zajištění operačního výkonu. V červené řadě bylo v r. 2010 ke každé transplantaci automaticky kříženo 20 TU erytrocytových koncentrátů s tím, že 10 TU bylo automaticky vydáno k výkonu. V r. 2015 bylo již automaticky kříženo jen 10 TU erytrocytů s tím, že o množství vydaných přípravků se rozhoduje podle odhadu technické náročnosti výkonu (obvykle 5 TU). V pooperačním průběhu jsou transfuzní přípravky indikovány jednotlivě podle potřeby pacienta. K poklesu spotřeby při zajištění transplantace jater během posledních pěti let došlo i u plazmy a trombocytů. Příčin, které se na poklesu podílely, je zřejmě několik: od lepší přípravy pacienta na výkon, stabilizaci operační techniky, rutinní zapojení peroperačního sběru ztrácené krve, uvážlivější indikace až po stabilizaci spolupráce klinických pracovišť s transfuzním oddělením. Pokles spotřeby snižuje nároky na transfuzní oddělení a aferetickou jednotku zejména u pacientů s komplikovaným imunohematologickým nálezem, snižuje riziko potransfuzních komplikací a samozřejmě snižuje i ekonomickou náročnost výkonu.
P20 Transfuzní služba v ČR v roce 2015
Turek P.1, Milštainová J.2
1Transfuzní oddělení, Thomayerova nemocnice, Praha; 2MZ ČR
V práci jsou shrnuty základní údaje o činnosti transfuzní služby v ČR r. 2015. Údaje pocházejí zčásti z výročních zpráv odesílaných jednotlivými zařízeními transfuzní služby (ZTS) Ministerstvu zdravotnictví, zčásti s výročních výkazů ÚZIS, jejichž kopii jednotlivá ZTS poskytla autorům.
V roce 2015 zajišťovalo výrobu transfuzních přípravků a plazmy pro průmyslové zpracování 52 výrobců transfuzních přípravků a 15 odběrových středisek. Tato zařízení a dalších 59 krevních bank zajišťovala také zásobování nemocnic transfuzními přípravky. Plazmu pro průmyslové zpracování odebíralo 6 dalších subjektů v 16 odběrových centrech. Počet dárců krve a jejích složek v zařízeních nemocniční TS mírně klesá (v r. 2015 bylo evidováno 225 tis. osob), po delší době poklesl i počet dárců v plazmaferetických centrech (72 tis. osob). Dárcovský kádr ZTS je poměrně stálý (11 % prvodárců), v plazmaferetických centrech je obměna dárců větší (26 % prvodárců). Záchyt sledovaných infekcí (tj. HIV/HBV/HCV/syfilis) je stabilní, a u hepatitid má spíše klesající tendenci. Zachyceno bylo celkem 212 dárců pozitivních v některém z infekčních markerů (z toho 9x HIV). Mezi dárci nemocniční TS a dárci komerční plazmaferézy je zřetelný rozdíl v záchytu zejm. HCV (ZTS 15, plazmaferetická centra 135).
Nemocniční transfuzní službou bylo provedeno 405 tis. odběrů plné krve (100 % bezpříspěvkově), 203 tis. plazmaferéz (99 % bezpříspěvkově) a 21 tis. jiných aferéz (2/3 dárců žádají kompenzační příspěvek). Komerční plazmaferetická centra provedla 466 tis. odběrů plazmy (dárci dostávají kompenzační příspěvek).
Krevním bankám bylo vydáno 397 tis. TU erytrocytů (z toho 27 % deleukotizovaných při výrobě; další 4 % přípravků byla deleukotizována dodatečně) a 43 tis. léčebných dávek trombocytů (z toho 2/3 přípravků jsou z aferézy, 97 % deleukotizovaných). Dále bylo vydáno 48 tis. litrů karantenizované plazmy pro klinické účely. Kromě toho dodala nemocniční ZTS 213 tis. l plazmy pro frakcionaci (z toho 72 tis. z odběrů plné krve a 141 tis. l z plazmaferézy). Dalších 371 tis. litrů plazmy pro frakcionaci připravila plazmaferetická střediska. Spotřeba transfuzních přípravků je stabilizovaná, ČR je v produkci transfuzních přípravků soběstačná. Transfuzní politika v jednotlivých nemocnicích se zřejmě podstatně liší, rozdíly v zastoupení jednotlivých přípravků jsou velké (např. poměr podané erytrocyty/plazma). Závažné nežádoucí účinky transfuze jsou relativně vzácné, hlášeno bylo 15 závažných reakcí s příčinnou vazbou k transfuzi (žádná smrtelná). Zaznamenány byly 3 případy přenosu HCV transfuzí, zdrojem infekce byly 4 aferetické přípravky ze dvou různých odběrů od téhož dárce odebraného v inkubační době onemocnění.
P21 Systém sledování a vyhodnocování kvality vzorků biologického materiálu dodaných do zdravotnických laboratoří Fakultní nemocnice Olomouc
Juráňová J.1, Koukalová A.2, Galuszková D.2, Holusková I.2, Slavík L.1, Papajík T.1
1Hemato-onkologická klinika (HOK), Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc, 2Transfuzní oddělení (TO), Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc
Úvod. Průběh sledování a hodnocení kvality vzorků biologického materiálu dodaných do zdravotnických laboratoří mapuje tzv. preanalytická fáze, která spolu s analytickou a postanalytickou fází tvoří laboratorní diagnostický proces. Cílem sdělení je seznámit odbornou veřejnost se systémem sledování a vyhodnocování kvality vzorků biologického materiálu dodaných do hematologických a transfuzních laboratoří. Monitorovací systém byl zaveden managementem FNOL v procesu přípravy na akreditaci. Záměrem bylo identifikovat nejčastější příčiny neshod a zajistit postupné snižování jejich výskytu.
Metodika. Provedli jsme statistické vyhodnocení sledovaných let (pro hematologické laboratoře za období 2008–2015, pro transfuzní laboratoře za období 2012–2015). Monitorované neshody byly definovány a rozděleny do deseti kategorií, z nichž největší pozornost byla věnována počtu zaměněných vzorků.
Vlastní výsledky. Během sledovaných let nepřesáhl počet neshod v hematologických laboratořích (z celkového počtu vzorků dodaných do laboratoří) jedno procento a vykazuje klesající trend. Počet zaměněných vzorků k celkovému počtu neshod klesá. Kromě dvou záměn způsobených na straně laboratoře, byly všechny ostatní způsobené žadatelem o vyšetření a to převážně v ambulantním provozu pracovišť našeho zdravotnického zařízení. Neshody mapované v transfuzních laboratořích mají rovněž každoročně klesající tendenci, která je dána opakovaným proškolováním personálu na jednotlivých klinických pracovištích. Počet záměn ve sledovaných letech má kolísavý charakter, nepřesáhl však 1 % z dodaných vzorků. Všechny zaměněné vzorky byly z klinických pracovišť, nejednalo se o externě dodané vzorky.
Závěry. Data ukazují, že přestože se vzrůstajícím počtem hematologických či imunohematologických vyšetření klesá počet neshod, nelze se jim vyhnout úplně. Je potřeba mít na paměti zejména lidský faktor či manipulaci s biologickým materiálem, použitý spotřební materiál nebo nedokonalý software nemocničního informačního systému, popř. další faktory, které kvalitu vyšetření mohou ovlivnit. Z tohoto důvodu se domníváme, že sledování kvality vzorků dodaných do laboratoří je pro validitu výsledku vyšetření zásadní a neodmyslitelné.
Tab. 1. Přehled počtu vyšetřených vzorků, neshod a záměn vzorků v období let 2008–2015 v laboratořích HOK 
Legenda: počet vzorků (celkový počet vyšetřených vzorků), počet neshod (z celkového počtu vyšetřených vzorků), počet záměn vzorků (z počtu neshod). Tab. 2. Přehled počtu vyšetřených vzorků, neshod a záměn vzorků v období let 2012–2015 v laboratořích TO 
Legenda: počet vzorků (celkový počet vyšetřených vzorků), počet neshod (z celkového počtu vyšetřených vzorků), počet záměn vzorků (z počtu neshod).
Štítky
Hematológia Interné lekárstvo Onkológia
Článek 9. NÁRODNÍ AFERETICKÝ DENČlánek IMUNOHEMATOLOGIE IIČlánek ŽIVOT OHROŽUJÍCÍ KRVÁCENÍČlánek KLINICKÁ TRANSFUZIOLOGIEČlánek SEKCE NLP IČlánek SEKCE NLP IIČlánek REJSTŘÍKČlánek IMUNOHEMATOLOGIE I
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo Supplementum- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
Najčítanejšie v tomto čísle- IMUNOHEMATOLOGIE II
- ORGANIZACE TRANSFUZNÍ SLUŽBY, DÁRCOVSTVÍ, VÝROBA TRANSFUZNÍCH PŘÍPRAVKŮ
- KLINICKÁ TRANSFUZIOLOGIE
- INFEKCE – RIZIKA, VYŠETŘOVÁNÍ; VARIA
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy