Molekulárně genetická vyšetření prováděná v Ústavu hematologie a krevní transfuze u pacientů s myelodysplastickým syndromem
Molecular genetic tests in patients with myelodysplastic syndrome performed at the Institute of Haematology and Blood Transfusion
Myelodysplastic syndrome (MDS) is one of the most common haematological diseases occurring after the age of 60 years. Its pathogenesis has not yet been fully elucidated, but with the development of new molecular genetic methods, the molecular background of the disease is being gradually revealed. Determination of cell mono- or poly-clonality may be considered as the first genetic test performed in MDS patients. Subsequent important methods include monitoring of the methylation level of promoter regions in tumour suppressor genes and determination of telomeric-telomerase complex changes. Microarray platforms were brought to the forefront of molecular technologies at the beginning of the 21st century and enabled detection of the expression of thousands of genes simultaneously. At the same time, the role of non-coding RNAs such as miRNA and lncRNA became the focus of great interest. In recent years, revolutionary technology represented by massive parallel sequencing enabling sequencing of the whole human genome in a short time has been introduced. The results of this research, focusing on the study of mutations in various genes, are already being gradually incorporated in the routine molecular screening of MDS patients.
Key words:
myelodysplastic syndrome – molecular genetic methods
Autori:
M. Beličková 1; H. Votavová 1; Čermák J. Za Pracovní Skupinu Pro Mds V Úhkt 1
Pôsobisko autorov:
Ústav hematologie a krevní transfuze, Praha
1
Vyšlo v časopise:
Transfuze Hematol. dnes,23, 2017, No. Supplementum1, p. 20-24.
Kategória:
ZVLÁŠTNÍ VYDÁNÍ SUPLEMENTU K 65. VÝROČÍ ÚHKT
Pozn: *za pracovní skupinu pro MDS v ÚHKT
Súhrn
Myelodysplastický syndrom (MDS) představuje jedno z nejčastějších hematologických onemocnění ve věku nad 60 let. Jeho patogeneze není doposud dostatečně objasněna, ale s rozvojem nových molekulárně genetických metod dochází k postupnému odhalování molekulárního pozadí choroby. Za první genetické vyšetření prováděné u MDS pacientů můžeme pokládat určení buněčné mono- či polyklonality. Další významné vyšetření bylo sledování hladiny metylace promotorových oblastí tumor-supresorových genů a změny telomero-telomerázového komplexu. Na začátku 21. století se do popředí molekulárních technologií dostaly mikročipové platformy, které umožnily sledovat expresi tisíce genů současně. Zároveň se intenzivně zkoumají role nekódujících RNA, jako jsou miRNA a lncRNA. V posledních letech se za revoluční technologii považuje masivní paralelní sekvenování, které umožnuje sekvenování celého lidského genomu za krátkou dobu. Výsledky z tohoto výzkumu, zaměřeného na studium mutací v různých genech, jsou již postupně zařazovány do rutinního molekulárního screeningu u MDS pacientů.
Klíčová slova:
myelodysplastický syndrom – molekulárně genetická vyšetření
Myelodysplastický syndrom (MDS) je heterogenní skupina klonálních onemocnění hematopoetické kmenové buňky s neefektivní hematopoézou. Je charakterizován morfologickou dysplazií a periferní cytopenií, postihující jednu či více vývojových linií, a zvýšeným rizikem transformace do akutní myeloidní leukemie (AML) [1]. Incidence MDS se přibližně pohybuje kolem 3–5 případů na 100 000 obyvatel, s přibývajícím věkem však jeho výskyt prudce stoupá.
Patogeneze MDS je intenzivně zkoumána, ale přesto není zcela objasněna. Předpokládá se, že stejně jako u ostatních nádorových onemocnění, se jedná o vícestupňový proces, kdy dochází k postupnému hromadění genetických změn, které vedou k maligní transformaci buňky. Klonálním množením transformované buňky, která má růstovou výhodu, dochází ke vzniku nádorové populace buněk, která postupně obsadí celou kostní dřeň. Vedle genetických faktorů se při patogenezi onemocnění uplatňují i faktory epigenetické a imunopatologické, mikroprostředí HSC (hematopoetické kmenové buňky) a reparační mechanismy.
Pro klasifikaci MDS syndromů bylo vytvořeno několik klasifikačních systémů, které jsou založeny hlavně na hodnocení počtu a typu cytopenií a procentu myeloblastů v kostní dřeni. Prvním systémem klasifikace byla francouzsko-americko-britská (FAB) klasifikace z roku 1982, která rozdělila MDS do pěti subtypů [2]. Nejnovější klasifikací, z roku 2016, je klasifikace Světové zdravotnické organizace (WHO), která MDS dělí na jedenáct podtypů [3]. Stejně tak existuje několik prognostických systémů pro zhodnocení prognózy a přežití pacientů. V roce 1997 byl sestaven IPSS (International Prognostic Scoring System), který byl v roce 2012 revidován na IPSS-R (Revised International Prognostic Scoring System), kdy byly přidány další prognostické hodnoty jako hladina hemoglobinu, počet krevních destiček, neutrofilů a detailnější analýza cytogenetických abnormalit a jejich prognostický význam [4]. IPSS-R zařazuje pacienty do pěti kategorií rizika (velmi nízké až po velmi vysoké) na základě prognózy vývoje onemocnění s rozdílnou dobou přežití pacientů a dobou progrese onemocnění do AML.
MDS lze také zjednodušeně rozdělit na dvě stadia – časné a pokročilé. Časné stadium lze zařadit mezi prekancerózy, kdy nalézáme v krvetvorných buňkách zvýšenou apoptózu, která nenasvědčuje o nádorové povaze buněk. Ale zároveň detekujeme již některé vlastnosti nádorových buněk, jako je poškozená diferenciace, chromozomové aberace a mutace genů. Raná stadia považujeme tedy za indolentní formy MDS oproti agresivním, proliferačním, pozdním formám MDS, které již mají plnou charakteristiku nádorových buněk, jako je zvýšená proliferace, snížená apoptóza, poškozená diferenciace, další chromozomální abnormality (často komplexní karyotyp), následné mutace, zejména v tumor supresorových genech a protoonkogenech. Přibližně 1/3 všech diagnostikovaných pacientů přechází neoplastickou transformací v AML.
Léčba pacientů je individualizovaná a založena na rizikovosti onemocnění. Léčebná strategie pro pacienty s nižším a středním rizikem spočívá v podpůrné, stimulační (podávání růstových faktorů krvetvorby), chelatační, imunosupresivní nebo imunomodulační terapii. Cílem je zlepšení kvality a prodloužení délky života. U pacientů s vysokým rizikem je terapie zaměřena na vymýcení patologického klonu a na prevenci transformace do AML, nejčastěji jsou indikovány tyto typy léčby: hypometylační léčba, intenzivní chemoterapie s následnou transplantací krvetvorných buněk nebo bez ní. Jeden z perspektivních nových objevů v oblasti léčebných postupů je zapojení přirozeného imunitního systému do potlačení vývoje MDS. Bylo zjištěno, že myelodysplastické buňky vytvářejí zánět a v tomto prostředí se jim daří. Na tento konkrétní typ zánětu by bylo možné se zacílit pomocí léků, a tím by se MDS buňky staly zranitelnější. Tento přístup musí být důkladně testován klinicky, ale výzkum v této oblasti by mohl poskytnout široký soubor terapeutických cílů. Dále jsou například zkoumány apoptotické cesty či mutované sestřihové faktory, které také patří mezi slibné terapeutické cíle.
Pracoviště ÚHKT patří mezi Centra excelence ustanovené mezinárodní nadací MDS Foundation, která jsou specializovaná na péči o pacienty s diagnózou MDS. Probíhá zde těsná spolupráce mezi lékaři a vědeckými pracovníky s cílem dosáhnout nejlepší možné péče.
V oblasti molekulárně genetických vyšetření u MDS došlo v posledních letech k velkému pokroku a probíhá řada studií, které validují význam nálezů pro zpřesnění klasifikačních a prognostických systémů, a hlavně pro zavádění nových léčebných postupů. V ÚHKT se více než 20 let vědečtí pracovníci věnují intenzivnímu výzkumu molekulárních faktorů podílejících se na patogenezi MDS a jejich aplikací do klinické praxe. Detekce buněčné mono- či polyklonality hraje významnou roli při odlišení některých maligních neoplazií, které jsou v drtivé většině monoklonální, od polyklonálních reaktivních lézí. Vzhledem ke klonálnímu charakteru MDS, prvotním molekulárním testem v 90. letech bylo proto stanovení klonality pomocí metody HUMARA. Tato metoda byla založena na stanovení metylačního statutu chromozomů X v lokusu HUMARA u MDS pacientů ženského pohlaví. Klonalita byla určována u separovaných CD3 pozitivních buněk, T lymfocytů, CD14 pozitivních monocytů a granulocytů periferní krve či kostní dřeně [5]. Stupeň klonality sloužil klinickým pracovníkům pro určení a zpřesnění diagnózy a stanovení prognózy. Další vědecké poznatky poukázaly na význam epigenetických modifikací genů v patogenezi MDS. V tomto kontextu bylo na našem pracovišti zavedeno sledování hladiny metylace promotorové oblasti genu CDKN2B (p15Ink4B). Metylace byla detekována metylově specifickou PCR po modifikaci DNA bisulfidem sodným a aberantní metylace genu p15Ink4B byla asociována s progresí onemocnění MDS. Původní metoda byla nahrazena vyšetřením pomocí metylačně specifické MLPA (Multiplex Ligation Dependent Probe Amplification), která umožňuje detekovat jak počet genových kopií, tak i metylační změny současně [6]. Od roku 2004 byly dále u pacientů s MDS sledovány změny telomero-telomerázového komplexu a genů, které ho ovlivňují, včetně expresních profilů POT1, TEP1, TRF1, TNKS, jež nebyly u pacientů s MDS z celosvětového hlediska zatím vůbec sledovány. Dynamika telomer byla studována pomocí metod TRF (Metoda Terminálního Repetičního Fragmentu pro délku telomer) a TRAP (pro stanovení aktivity telomerázy) a zvýšená telomerázová aktivita signifikantně souvisela se zkrácenými telomerami a byla detekována u poloviny pacientů s MDS [7]. V roce 2008 byl zaveden metodický postup pro sledování nejčastěji se objevujících bodových mutací v protoonkogenu N-Ras ve 12. a 13. kodonu prvního exonu a v 61. kodonu druhého exonu u MDS pomocí sekvenační analýzy. Frekvence výskytu zmíněných mutací významně narůstala s progresí MDS.
Na začátku 21. století se do popředí molekulárních technologií dostaly mikročipové platformy, které umožnily sledovat aktivitu (expresi) tisíce genů v rámci jednoho vzorku, a tak se vědcům otevřel nový pohled na globální regulační síť a interakce genů. Naše pracoviště bylo jedním z prvních v Česku, která začala tuto novou technologii používat pro molekulární charakterizaci hematologických malignit. V laboratoři byly optimalizovány protokoly pro mnoho různých mikročipových platforem od firem Clontech, Ambion, Combimatrix, Luminex, Illumina. Poslední jmenovaná platforma Illumina již umožňovala celogenomové analýzy a pomocí ní byl získán velmi cenný a komplexní soubor dat o transkriptomu MDS. Jednak byly stanoveny expresní profily specifické pro jednotlivé subtypy MDS [8] a geny vykazující signifikantní změny u pacientů byly dále validovány pomocí metody RT-PCR. V další fázi výzkumu jsme se zaměřili i na expresní změny asociované se specifickou léčbou. Konkrétně jsme studovali efekt lenalidomu na transkripční aktivitu MDS buněk a odhalili jsme deregulaci TNF signální dráhy u MDS pacientů léčených touto imunomodulační látkou [9]. Na validačních kohortách pacientů byl ověřen prognostický význam vybraných kandidátních genů, které se jeví jako klinicky relevantní pro hodnocení individuálního rizika MDS pacienta a pro rozhodnutí o optimální léčbě. Kromě protein-kódujících genů, na které byly zaměřeny počáteční projekty expresního profilování, jsme se v roce 2006 začali věnovat i studiu protein-nekódujících malých (miRNA) a dlouhých RNA (lncRNA). Tyto regulační RNA hrají významnou roli v regulaci genové exprese a díky specifickým vlastnostem se jeví jako spolehlivé a stabilní molekulární markery u MDS. Obdobně jako expresní profily mRNA také specifické profily miRNA byly asociovány se subtypy MDS [10] a při léčbě lenalidomem byla signifikantně ovlivněna exprese miRNA klastrovaných v oblasti 14q32 [11]. Od roku 2000 naše pracoviště publikovalo přes 20 článků v impaktovaných zahraničních časopisech, které byly věnovány využití mikročipových technik u hematologických malignit, a to především u MDS. V roce 2005 jsme získali „Cenu Časopisu lékařů českých za nejlepší publikaci roku“. V neposlední řadě se naše laboratoř stala školicím pracovištěm v oblasti mikročipových technologií. Získané praktické zkušenosti a odborné znalosti byly předávány studentům v rámci „Praktického kurzu biočipových technologií“ pořádaného na ÚHKT od roku 2002 po dobu 13 let.
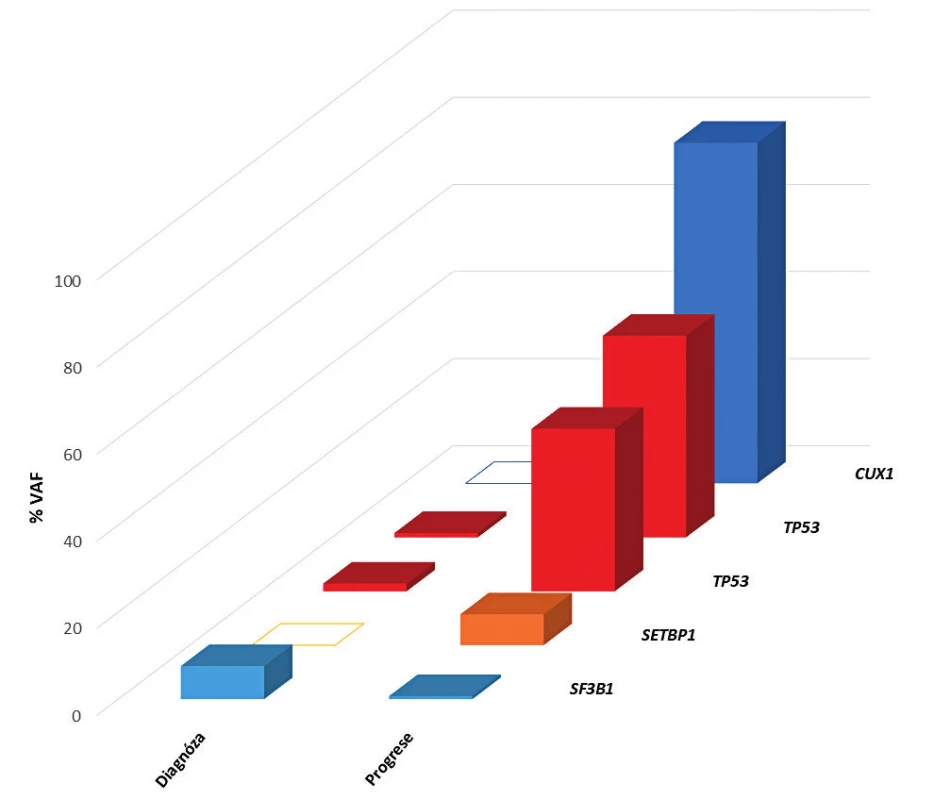
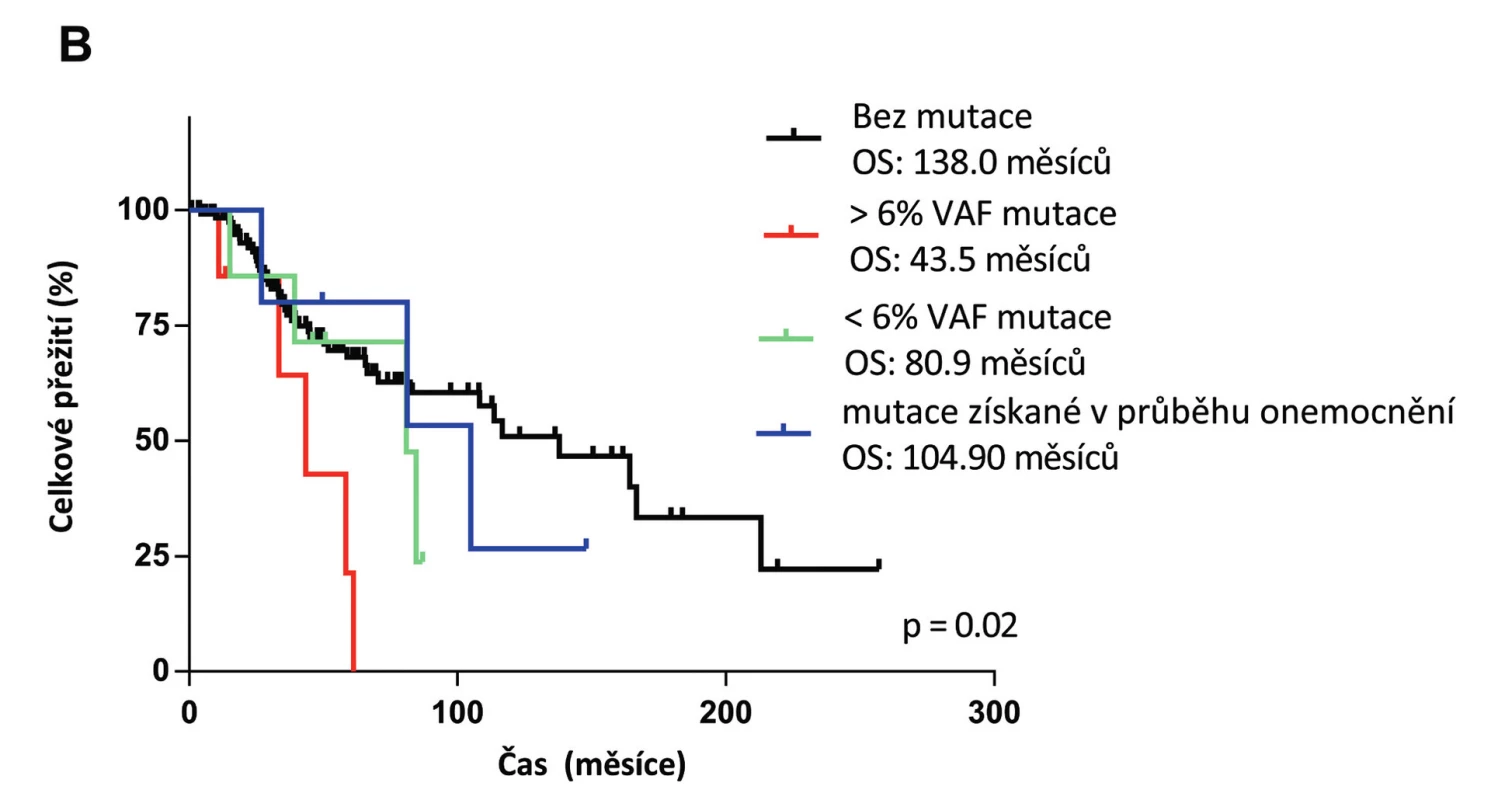
V roce 2011 byl na našem pracovišti spuštěn provoz první platformy pro sekvenování nové generace (NGS). Tato revoluční technologie umožňuje masivní paralelní sekvenování celého lidského genomu za krátkou dobu. Za použití NGS provádíme u MDS pacientů mutační screening v době diagnózy a při progresi onemocnění (obr. 1). Prokázali jsme, že mutace v genu TP53 jsou signifikantní rizikový faktor pro celkové přežití pacientů (obr. 2) [12]. Stejné výsledky byly již publikovány i v jiných studií, a proto se uvažuje o zařazení mutačního stavu genu TP53 do prognostického systému a o jeho rutinním vyšetřování u MDS. V nejbližší době lze očekávat zařazení vyšetření mutačního statusu dalších genů jako např. NRAS či RUNX1. Od roku 2016 jsou již mutace genu SF3B1 používány jako pomocný diagnostický faktor v WHO klasifikaci.
Nové terapeutické přístupy u MDS zahrnují epigenetickou léčbu azacitidinem a imunomodulační terapii lenalidomidem (LEN). Tím vyvstala potřeba rozpoznat pacienty pozitivně reagující na tyto terapie. Zjistili jsme, že vysoké hladiny mRNA genu pro cereblon (CRBN) jsou důležité pro účinnost LEN a mohou predikovat léčebnou odpověď. Práce na toto téma, prezentována na konferenci Americké hematologické společnosti (ASH) v roce 2013, byla vybrána mezi nejvýznamnější příspěvky konference do tzv. „Highlights of ASH 2013“ [13].
V rámci výzkumné činnosti jsme řešili více jak 20 grantových projektů s tématem MDS a získali např. Čestné uznání ministra zdravotnictví MUDr. T. Julínka za mimořádně úspěšné řešení výzkumného projektu NR/7989-3. Ve spolupráci s Univerzitou Karlovou jsou do výzkumných projektů na našem pracovišti zapojovány pre- i postgraduální studenti.
Podíl autorů na přípravě rukopisu
MB – napsání a revize rukopisu
HV – napsání a revize rukopisu
JČ – připomínkování a schválení rukopisu
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Mgr. Monika Beličková, Ph.D.
Oddělení genomiky
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-mail: monika.belickova@uhkt.cz
Zdroje
1. Nimer SD. Myelodysplastic syndromes. Blood 2008;111(10):4841–4851.
2. Bennett JM, Catovsky D, Daniel MT, et al. Proposals for the classification of the acute leukaemias. French–American–British (FAB) Co-operative Group. Br J Haematol 1976;33:451–458.
3. Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classi fication of myeloid neoplasms and acute leukemia. Blood 2016;127(20):2391–2406.
4. Greenberg PL, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood 2012;120(12):2454–2465.
5. Krejcová H, Neuwirtová R, Cermák J, Belicková M, Brdicka R. Cell clonality inmyelodysplastic syndrome. Sb Lek 2002;103(3):339–348.
6. Cechova H, Lassuthova P, Novakova L, et al. Monitoring of methylationchanges in 9p21 region in patients with myelodysplastic syndromes and acutemyeloid leukemia. Neoplasma 2012;59(2):168–174.
7. Sieglová Z, Zilovcová S, Cermák J, et al. Dynamics oftelomere erosion and its association with genome instability in myelodysplasticsyndromes (MDS) and acute myelogenous leukemia arising from MDS: a marker ofdisease prognosis? Leuk Res 2004;28(10):1013–1021.
8. Vasikova A, Belickova M, Budinska E, Cermak J. A distinct expression ofvarious gene subsets in CD34+ cells from patients with early and advancedmyelodysplastic syndrome. Leuk Res 2010;34(12):1566–1572.
9. Belickova M, Cermak J, Dostalova Merkerova M, et al. Changes associated with lenalidomide treatment in the gene expression profiles of patients with del(5q). Clin Lymphoma Myeloma Leuk 2012;12(5):375–383.
10. Dostalova Merkerova M, Krejcik Z, Votavova H, Belickova M, Vasikova A, Cermak J. Distinctive microRNA expression profiles in CD34+ bone marrow cells frompatients with myelodysplastic syndrome. Eur J Hum Genet 2011;19(3):313–319.
11. Krejčík Z, Beličková M, Hruštincová A, et al. Aberrant expression of the microRNA cluster in 14q32 is associated with del(5q) myelodysplastic syndrome andlenalidomide treatment. Cancer Genet 2015;208(4):156–161.
12. Belickova M, Vesela J, Jonasova A, et al. TP53 mutation variant allele frequency is a potentialpredictor for clinical outcome of patients with lower-risk myelodysplasticsyndromes. Oncotarget 2016;7(24):36266–36279.
13. Jonasova A, Bokorova R, Polak J, et al. High level of full-length cereblon mRNA in lower risk myelodysplastic syndrome with isolated 5q deletion is implicated in the efficacy of lenalidomide. Eur J Haematol 2015;95(1):27–34.
Štítky
Hematológia Interné lekárstvo OnkológiaČlánok vyšiel v časopise
Transfuze a hematologie dnes

2017 Číslo Supplementum1
- Nejasný stín na plicích – kazuistika
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
Najčítanejšie v tomto čísle
- Dysfibrinogenemie a afibrinogenemie v České republice
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Transfuze a imunohematologie v ÚHKT
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
