-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné trendy v léčbě a diagnostice chronické myeloidní leukemie
Current trends in the treatment and diagnostics of chronic myeloid leukaemia
Current CML therapy based on tyrosine kinase inhibitors (TKI) provides excellent outcomes: more than 80% of patients diagnosed in chronic phase of CML survive at least 10 years and a quite high number of patients have a long-term deep molecular response. Nevertheless, modern trends in clinical practice include discontinuation of TKI therapy in patients with sustained deep molecular response. Patient concerns and health care cost considerations have prompted research into the possibility of TKI treatment-free remission for selected patients or into the setting up individual treatment approaches based on the identification of disease progression markers. To apply this strategy, monitoring of minimal residual disease and early detection of relapse is absolutely critical. Digital PCR (dPCR) represents a very precise and sensitive technology for detecting BCR-ABL1 at mRNA or DNA level – with a capability of detecting CML cells lacking expression of BCR-ABL1. Exact measurement of minimal residual disease is key for CML therapy management and eventual TKI discontinuation.
KEY WORDS:
chronic myeloid leukaemia – tyrosine kinase inhibitors – BCR-ABL1 mutations – leukemic stem cell
Autoři: H. Klamová; H. Žižková; P. Burda; N. Čuřík; D. Srbová; K. Machová Poláková
Působiště autorů: Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. Supplementum1, p. 34-46.
Kategorie: ZVLÁŠTNÍ VYDÁNÍ SUPLEMENTU K 65. VÝROČÍ ÚHKT
Souhrn
Současné výsledky léčby chronické myeloidní leukemie, dosahované pomocí tyrozinkinázových inhibitorů (TKI) jsou zcela excelentní, více jak 80 % nemocných diagnostikovaných v chronické fázi onemocnění přežívá deset let a více, vysoké je také procento dlouhodobých hlubokých molekulárních odpovědí. Aktuálními trendy usilujícími o další zlepšení výsledků léčby jsou možnost ukončit léčbu TKI při trvající molekulární odpovědi a volba individualizovaného přístupu k pacientovi. Zcela zásadní je také monitorování minimální zbytkové nemoci, jejíž přesnější kvantifikace pomocí digitální PCR na úrovni BCR-ABL1 transkriptu nebo na úrovni DNA, s cílem detekovat i transkripčně neaktivní leukemické buňky, může v blízké budoucnosti poskytovat lékaři při rozhodování o ukončení léčby spolehlivé vodítko.
Klíčová slova:
chronická myeloidní leukemie – inhibitory tyrozinové kinázy – BCR-ABL1 – mutace – leukemická kmenová buňkaÚVOD
Chronická myeloidní leukemie (CML) je klonální myeloproliferativní onemocnění hematopoetické kmenové buňky spojené s translokací chromozomů 9 a 22 - t(9;22)(q34;11), která vede ke vzniku Filadelfského chromozomu (Ph chromozom) [1]. Důsledkem chromozomové aberace je vznik fúzního genu BCR-ABL1, který kóduje chimerický onkoprotein Bcr-Abl. Tato tyrozinová kináza, která je v cytoplazmě buněk nekontrolovaně aktivována, ovlivňuje řadu signálních drah (např. STAT, RAS, JUN, MYC) a je klíčovou molekulou vedoucí k navození neoplastické transformace a ke vzniku onemocnění [2, 3].
CML představuje 15–20 % všech leukemií dospělého věku s incidencí 1–1,5 nových případů onemocnění na 100 000 obyvatel za rok [4]. Počet nových onemocnění narůstá s přibývajícím věkem, maximum výskytu spadá do věkových kategorií s mediánem kolem 53 let [5]. Prevalence se díky současným možnostem léčby zvyšuje. Podle údajů z Národního onkologického registru bylo v České republice v roce 2014 celkem 775 nemocných s CML [6]. V Evropě je v roce 2050 očekáván počet 400 tisíc nemocných s CML.
ZAVEDENÍ INHIBITORŮ TYROZINOVÝCH KINÁZ (TKI) A MOLEKULÁRNĚ GENETICKÉHO MONITOROVÁNÍ V LÉČBĚ CML
První informace o léčbě CML pochází sice z roku 1885, kdy byl poprvé podán v této indikaci arzenik, avšak prvními cytoredukčními látkami používanými od poloviny minulého století byly busulfan a hydroxyurea. Jednalo se však pouze o paliativní léčbu, která sice dokázala na určitou dobu příznaky nemoci potlačit a navodit hematologickou odpověď, ale její trvání bylo limitované. V 80. letech 20. století vstoupil do klinické praxe interferon alfa (IFN) s inhibičním účinkem na leukemickou buňku, schopností diferenciačního efektu a imunomodulace. Až do roku 2001 byl, eventuálně v kombinaci s cytosinarabinosidem, standardní léčbou pro pacienty s mediánem přežití 5–7 let, kteří nebyli léčeni alogenní transplantací krvetvorných buněk. Projevy nežádoucích účinků léčby však vedly k časté redukci dávky, přerušování léčby a z toho plynoucí ztrátě účinnosti [7]. Alogenní transplantace krvetvorných buněk byla v letech 1990–1999 prováděna jako léčba první volby pouze u mladých pacientů, kde byl k dispozici HLA zcela shodný sourozenec.
Zavedení imatinibu a dalších TKI do klinické praxe odsunuly tuto léčbu až v dalších liniích terapie. Nové poznatky v molekulární biologii koncem 90. let umožnily jak molekulární poznání podstaty nemoci, tak také objev zcela nového principu léčby v podobě inhibice tyrozinové kinázy Bcr-Abl. Zavedení TKI do klinické praxe znamenalo zcela zásadní změnu léčebného přístupu k pacientům s CML a vedlo k doslova revolučnímu zlepšení prognózy většiny nemocných s významným prodloužením předpokládaného celkového přežití (OS – Overall Survival) a přežití bez progrese nemoci (PFS – Progression Free Survival). Prvním TKI, který vstoupil do klinické praxe již po prvních velmi nadějných výsledcích klinické studie IRIS (International Randomized Study of Interferon versus STI-571), byl v roce 2001 imatinib. Hodnocení po 18 měsících potvrdilo předpokládanou účinnost. Bylo dosaženo 87 % velkých cytogenetických odpovědí a pravděpodobnost přežití bez progrese 97 % [8].
CML v ÚHKT léčíme a studujeme již téměř 30 let. Jak výrazně se zlepšilo za tu dobu celkové přežití našich pacientů, znázorňuje obrázek 1. Čtyři roky od zahájení terapie hydroxyureou přežívalo 38 %, na léčbě IFN 57 % a na terapii imatinibem 92 % nemocných.
Obr. 1. Celkové přežití pacientů ÚHKT s CML v závislosti na typu léčby 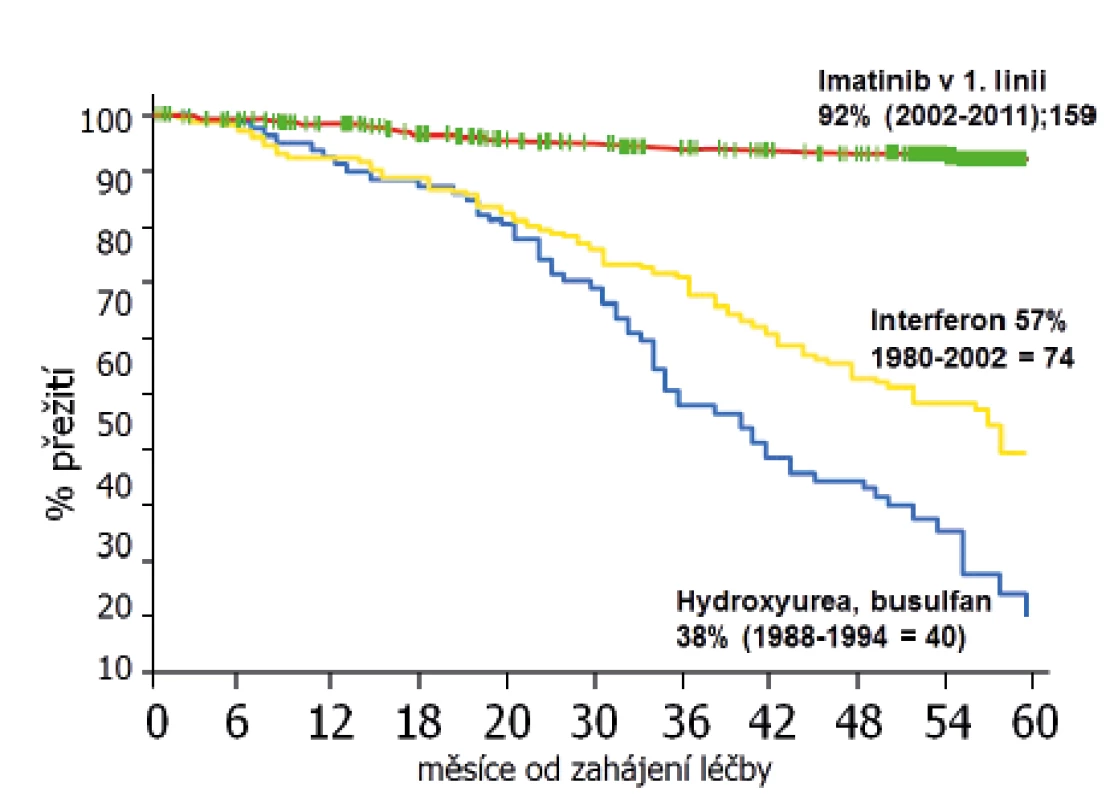
V následujících letech (2006 a 2007) pak byly na základě výsledků multicentrických klinických studií START (Src/Abl Tyrosine Kinase Inhibitor Activity: Research Trials of Dasatinib) a ENACT (Expanding Nilotinnib Access in Clinical Trials) schváleny pro klinickou praxi další TKI dasatinib a nilotinib. V současně době existují ještě další dva účinné TKI bosutinib a ponatinib, které lze podat v případě neúčinnosti předchozích TKI. Ponatinib, multipotentní TKI třetí generace, je jediným TKI účinným vůči pan-rezistentní mutaci T315I v kinázové doméně Bcr-Abl, vůči které selhává léčba ostatních dostupných TKI. Bosutinib a ponatinib však nemají v současné době v ČR schválenou úhradu a lze je zatím podat pouze po schválení žádosti o mimořádnou úhradu revizním lékařem nebo v rámci klinické studie.
Zkušenosti s léčbou dasatinibem po selhání nebo netoleranci imatinibu u pacientů ze šesti hematologických center ČR jsme publikovali v roce 2010. Naše výsledky potvrdily vysokou účinnost dasatinibu zvláště v chronické fázi (CP) onemocnění s dosaženou kompletní cytogenetickou odpovědí (CCyR; Ph+ 0 %) v 67 % a velkou molekulární odpovědí u 61 % nemocných v mediánu 10 měsíců. U většiny z 15 pacientů se zjištěnou mutací v kinázové doméně BCR-ABL1 došlo na terapii dasatinibem k překonání rezistence a navození odpovědi [9].
Znalosti molekulární podstaty CML, fúzního onkogenu BCR-ABL1 se začalo využívat v diagnostice a monitorování odpovědi na léčbu TKI. Diagnóza CML je potvrzována kromě přítomnosti Ph chromozomu cytogenetickými analýzami také přítomností BCR-ABL1 na úrovni ribonukleové kyseliny (RNA). U 99 % pacientů s CML je přítomen transkript (mRNA) BCR-ABL1 s přestavbou Major (b2a2/e13a2, b3a2/e14a2), u zbývajících pacientů jsou detekovány raritní typy přestaveb. Na základě doporučení Evropské leukemické sítě (European LeukemiaNet, ELN) je po potvrzení diagnózy CML a zahájení léčby TKI u pacienta pravidelně každé 3 měsíce vyšetřována hladina BCR-ABL1 transkriptů [10]. V současné době je zlatým standardem pro kvantifikaci BCR-ABL1 metoda reverzně transkriptázové real-time kvantitativní PCR (RT-qPCR) s doporučeným metodickým postupem, primery a próbami podle EAC (Europe Against Cancer, [11]).
Velká molekulární odpověď (MMR) je významným molekulárně genetickým parametrem odrážejícím úspěšnost léčby CML prostřednictvím TKI a predikce OS a PFS. Pro přesné hodnocení MMR bylo nezbytné, aby laboratoře poskytující vyšetření kvantifikace BCR-ABL1 transkriptu metodou RT-qPCR harmonizovaly své metodiky a jednotně vydávaly výsledky v mezinárodním měřítku (IS). Pod záštitou ELN byl v roce 2007 zahájen projekt EUTOS for CML (The EUropean Treatment Outcome Study for CML), který mezi své hlavní úkoly zařadil vytvoření standardizované metodiky [12]. První publikované výsledky potvrdily, že pomocí tzv. konverzních faktorů (CF) lze výsledky rozdílných analytických postupů sjednotit a vydávat v IS [13]. V roce 2006 začalo Oddělení molekulární genetiky, Národní referenční laboratoř pro DNA diagnostiku (NRL) ÚHKT, ověřovat svoji odbornou způsobilost pomocí mezilaboratorních porovnávacích zkoušek (MPZ) na mezinárodní úrovni. Na zasedání ELN v Heidelbergu (r. 2007) byla NRL ÚHKT navržena jako koordinátor MPZ a standardizace molekulárního monitorování pacientů s CML pro Českou republiku (ČR). V tomto roce byla myšlenka vytvoření sítě BCR-ABL1 laboratoří v ČR diskutována na workshopu České leukemické skupiny pro život (CELL). V roce 2008 získala NRL ÚHKT od ELN referenční laboratoře (Scientific Laboratory, III. Medizinische Klinik; Medizinische Fakultät Mannheim der Universität Heidelberg, Mannheim, Německo) revalidovaný CF k vyjadřování výsledků v IS. Současně NRL ÚHKT požádala Český institut pro akreditaci, o. p. s., (www.cia.cz) o statut pilotního pracoviště provádějícího MPZ v oblasti kvantifikace transkriptů BCR-ABL1. Již v roce 2008 proběhlo první mezilaboratorní porovnávání. MPZ je nabízeno všem laboratořím v ČR poskytujícím monitorování hladiny BCR-ABL1. Tohoto procesu se již několik let pravidelně účastní 4 laboratoře, které jsou součástí velkých hematologických center v ČR [14].
Výsledky léčby imatinibem u nově diagnostikované CML v chronické fázi, léčené v běžné klinické praxi v letech 2003–2009 v 11 hematoonkologických centrech ČR a Slovenska, jsme analyzovali u celkem 458 pacientů zařazených v klinických registrech INFINITY a CAMELIA [15]. Kromě kumulativní incidence hematologické, cytogenetické a molekulární odpovědi, OS, přežití bez příhody (EFS) a PFS jsme hodnotili také prognostický význam hladin transkriptů BCR-ABL1. Zpracovali jsme molekulární data pacientů léčených v 1. linii v reálné praxi tří českých center, která v té době již měla standardizovanou metodiku pro kvantifikaci BCR-ABL1 transkriptů a měřila porovnatelně. Zjistili jsme, že kumulativní incidence dosažení CCyR a MMR ve 12. a 18. měsíci od zahájení léčby imatinibem je významně spjata s ≤ 10% hladinou BCR-ABL1 dosaženou po 3 měsících léčby, což bylo v souladu s dalšími publikovanými daty [16, 17].
V praxi se 10% hranice BCR-ABL1 IS zatím neuplatnila jako kritérium pro změnu léčby. K tomuto přispívá i fakt, že kvantifikace BCR-ABL1 v analyzovaném vzorku je ovlivněna variabilitou samotného měření, která odpovídá mnohastupňovému procesu od zpracování primárního vzorku až po konečný výpočet výsledku. Proto i doporučení ELN pro hodnocení odpovědi na léčbu TKI jsou opatrnější a hladina vyšší než 10 % BCR-ABL1 zjištěná ve 3. měsíci od zahájení léčby je klasifikována jako varující parametr, ale neindikuje změnu léčby [10].
Rezistence vůči léčbě TKI
Přes vysokou účinnost léčby CML pomocí TKI existuje skupina pacientů (20–30 %), kteří neodpoví primárně, anebo rozvinou rezistenci v průběhu léčby. Nejvíce poznatků je shromážděno v souvislosti s rezistencí vůči léčbě imatinibem. Extenzivně studovaným mechanismem rezistence vůči TKI jsou jednobodové mutace v kinázové doméně (KD) proteinu Bcr-Abl, kterým se intenzivně věnujeme i v ÚHKT. Dosud bylo v souvislosti s rezistencí k imatinibu popsáno okolo 100 typů mutací v KD Bcr-Abl. Díky vývoji TKI 2. a 3. generace je možné rezistenci spjatou s mutacemi v KD Bcr-Abl překonávat. Z publikovaných dat z klinických studií či reálné praxe je známé, vůči kterým typům mutací rezistentních k imatinibu jsou účinné preparáty 2. generace dasatinib, nilotinib a bosutinib. Ponatinib je lék 3. generace a jediný účinný TKI vůči mutaci T315I. Odborná konsorcia ELN [18] a National Comprehensive Cancer Network (NCCN; Clinical Practice Guidelines in Oncology 2013) vydala doporučení o volbě léčby v případě zjištění konkrétního typu mutace.
V lékařské praxi je doporučováno mutace vyšetřovat při podezření na rozvoj rezistence. Jedná se o případy, kdy pacient na léčbu TKI neodpovídá v definovaných časových intervalech optimálně, což je charakterizováno varovnými ukazateli a ztrátou odpovědi v průběhu léčby TKI podle definic ELN [10, 18]. Otázkou zůstává časnost a citlivost vyšetření. Z biologického hlediska pracujeme s hypotézou, že časný záchyt mutací, a tedy rozvoje mutovaného klonu, vede k časné změně léčby, účinnému potlačení mutovaného klonu a odvrácení progrese onemocnění. Časným záchytem mutací jsme se zabývali v naší práci studiem raných ukazatelů rozvoje rezistence, které by mohly indikovat vyšetření mutací [19]. Zjistili jsme, že pacienti, kteří vykazovali fluktuaci hladin BCR-ABL1 kolem 0,1 % (definovali jsme jako BCR-ABL1 plató), nedosáhli stabilní MMR a byli ve vysokém riziku ztráty odpovědi spjaté s pomalu se rozvíjejícími mutovanými klony. S příchodem molekulárně genetické technologie sekvenování nové generace (NGS) se otevřela možnost vysoce citlivé analýzy celé kinázové domény BCR-ABL1 pro identifikaci mutací na hladinách nižších než 15 % mutovaného BCR-ABL1 transkriptu z celkového množství BCR-ABL1 [20], která je hraniční pro klasické Sangerovo sekvenování, které v současné době představuje zlatý standard vyšetřování. Zjistili jsme, že v případě pacientů, u nichž selhala léčba imatinibem, byly mutace přítomny již v době MMR. U pacientů vykazujících BCR-ABL1 plató kolem 0,1 % jsme díky NGS odhalili výrazně komplexnější spektrum pozvolně expandujících mutací [21], než nám umožnila technologie Sangerova sekvenování [19]. Domníváme se, že k časnému záchytu mutací a rozvíjející se rezistence patří vyšetření i těch pacientů, kteří při užívání TKI ve standardních dávkách vykazují nestabilní MMR, tedy BCR-ABL1 plató.
Dalším dosti studovaným mechanismem rezistence vůči léčbě TKI jsou změny aktivity a exprese lékových transportérů, které přenášejí různé typy rozpustných látek včetně léků přes plazmatickou membránu buněk. Přepokládá se, a řada prací ukazuje, že aktivita a exprese lékových transportérů má dopad na intracelulární koncentrace preparátů, a tedy na účinnost léčby. Proteiny SLC (solute carriers) zprostředkovávají vstup látek do buněk, zatímco ABC proteiny (ATP binding cassette) umožňují jejich exkreci. Lidský genom obsahuje 49 ABC genů, přičemž 10 z nich je spjato s multilékovou rezistencí rakovinových buněk [22]. Nejvíce studovaným transportérem u CML je ABCB1, který je zvýšeně exprimován v buňkách blastického zvratu CML a přispívá ke snížené efektivitě léčby v pokročilých stadiích CML [23, 24]. Velká skupina čítající 55 rodin SLC genů kóduje 362 transportérů. Sedm genových rodin SLC kóduje proteiny s anotovanou funkcí lékových přenašečů [25]. MMR byla častěji dosažena u pacientů se zvýšenou aktivitou SLC22A1 (OCT1) [26, 27]. Různé úrovně aktivity či exprese těchto lékových přenašečů mohou mít souvislost s polymorfismy v genech těchto proteinů. Jednobodové nukleotidové polymorfismy (SNP) v kódujících oblastech genů byly studovány v souvislosti s odpovědí na léčbu imatinibem. Byly popsány některé kandidátní SNP v SLC genech, které by mohly mít souvislost s odpovědí na léčbu imatinibem [28, 29]. Naproti tomu SNP nalezené v ABCB1 přinášejí mezi publikovanými pracemi docela protichůdné výsledky v souvislosti s dosahováním odpovědí na léčbu imatinibem [30–32].
V naší práci jsme se zaměřili na studium SNP v regulačních oblastech genové exprese, promotorech, které by mohly mít dopad na expresi transportéru, a tedy na účinnost léčby imatinibem. Ve 107 promotorech genů ABC a SLC bylo u zdravých jedinců různých etnik identifikováno více jak 500 polymorfismů [33]. Pomocí NGS jsme vyšetřili promotory 19 genů a identifikovali jsme SNP související s odpovědí na léčbu imatinibem. Tyto SNP byly analyzovány u 129 pacientů s CML v souvislosti s kumulativním dosažením MMR a pravděpodobnosti EFS. U pacientů nesoucích genotyp SNP rs2631365-TC jsme pozorovali významný rozdíl ve frekvencích zastoupení rs460089-GC (SLC22A4) a rs460089-GG (SLC22A4) genotypů, což bylo spojeno v prvním případě s jejich optimální a v druhém případě neoptimální (varující odpověď a selhání léčby) odpovědí na imatinib po 12 měsících léčby. Odhalili jsme, že lokusy SNP rs460089 a rs2631365 jsou ve významné vazebné nerovnováze s 12 regulačními SNP nacházejícími se v intronech obou genů. Zjistili jsme, že pacienti s rs460089-GC mají významně vyšší pravděpodobnost dosažení MMR, naopak genotyp rs460089-GG představuje rizikový faktor pro selhání léčby, který je ještě vyšší pro kombinaci genotypů rs460089-GG_rs2631365-TC. Domníváme se, že SNP rs460089 a rs2631365 představují farmakogenetické markery, které mohou predikovat odpověď na léčbu imatinibem u pacientů s CML v době diagnózy [34]. Tyto velmi slibné genetické markery a jejich možné uplatnění v lékařské praxi pro předpověď pravděpodobnosti odpovědi na léčbu imatinibem v 1. linii jsou nyní ověřovány v rámci mezinárodní spolupráce s pracovišti ve Skandinávii, Velké Británii, Německu a Francii.
Léčba a monitorování CML v roce 2017
Současná léčba CML inhibitory tyrozinových kináz, která je v České republice soustředěna v hematologických centrech, vychází z doporučení ELN, NCCN (Clinical Practice Guidelines in Oncology) (http://www.nccn.org), ESMO (Evropská společnost klinické onkologie), České hematologické společnosti (ČHS) a CELL [10, 35]. Úspěšnost léčby definuje typ léčebné odpovědi, kterou hodnotíme jako hematologickou, cytogenetickou a molekulární. Kvalita odpovědi monitorovaná ve stanovených časových bodech je podle ELN doporučení hodnocená jako optimální, varování a selhání léčby. Správné hodnocení kvality dosažené odpovědi je nezbytné při rozhodování o dalším léčebném postupu [10]. Při dosažení optimální odpovědi podle ELN kritérií pokračujeme v zavedené léčbě. Při selhání léčby je doporučením změna TKI. Důležité je také hodnocení nežádoucích účinků léčby, která může být také důvodem ke změně typu TKI. Hodnotíme podle kritérií National Cancer Institute Common Toxicity Criteria (CTCAE v3.0). (http://ctep.cancer.gov). Pozornost je třeba věnovat také možnosti lékových interakcí, které mohou efekt léčby významně ovlivnit
(http://medicine.jupui.edu/flockhart/table.htm).
Při současných možnostech léčby TKI, pokud vycházíme ze zpracování hodnocení výsledků léčby devíti největších světových studií nově diagnostikovaných CML v chronické fázi (IRIS, DASISION, German IV study, ENEStTnd a dalších) [36–39], do kterých bylo zařazeno celkem více než 5 tisíc pacientů s mediánem sledování přes 5 let, přežívá 90 %, 6 let 89 %, 8 let 86 % a 10 let 83–84 % nemocných. Pouze polovina z pacientů, kteří zemřeli, umírá na progresi nemoci, ostatní v době remise onemocnění v souvislosti s důsledky toxicity léčby nebo z jiných příčin s CML nesouvisejícími [40]. Obrázek 2 souhrnně zobrazuje celkové přežití a přežití bez progrese 260 nemocných s CML v chronické fázi léčených na ÚHKT inhibitory tyrozin kináz v letech 2005–2016 s pravděpodobností přežití bez progrese u 87 % a celkovém přežití 83 % pacientů v době sledování 10 let, což jsou výsledky srovnatelné s výsledky klinických studií. Kumulativní incidence dosažených CCyR a MMR po 12 měsících byla 66 % a 58 %, po 24 měsících 77 % a 73 %.
Obr. 2. Léčba pacientů s CML pomocí TKI v ÚHKT 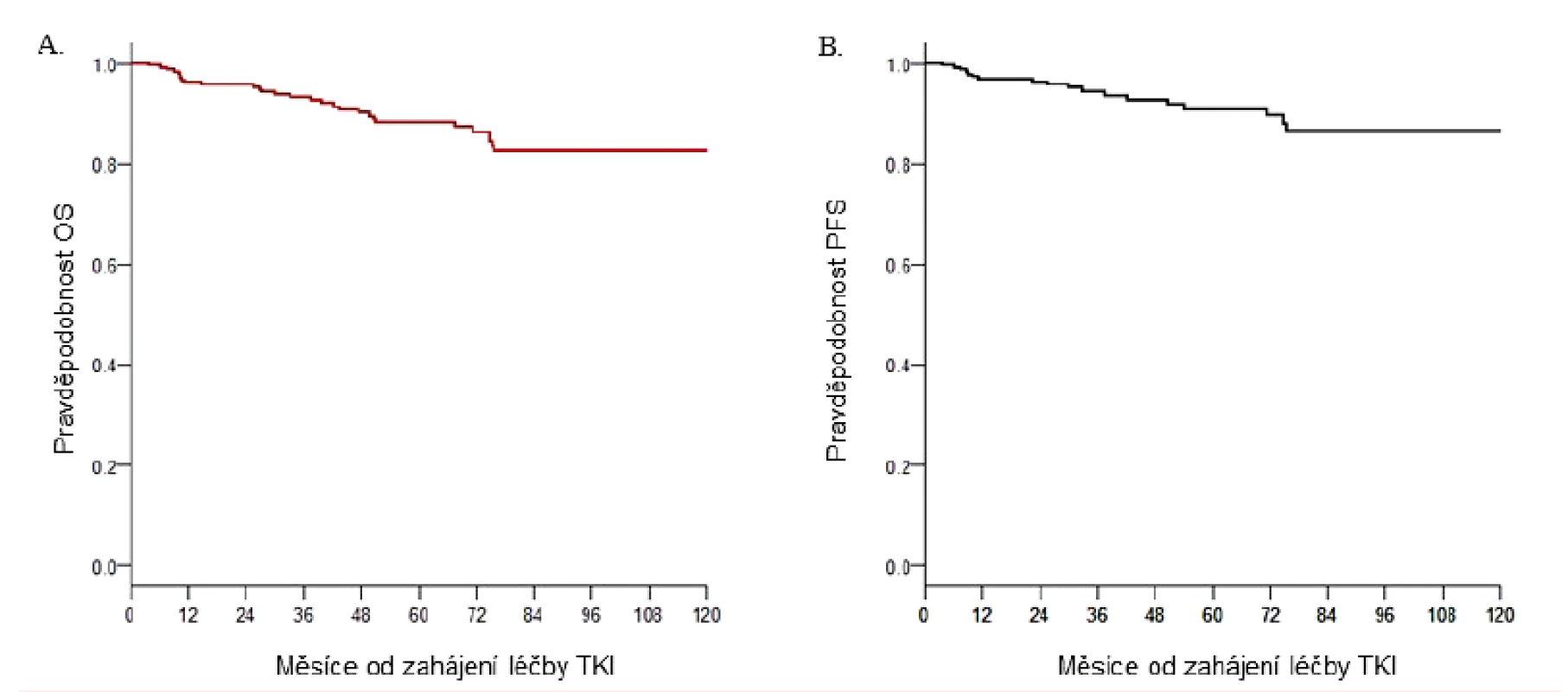
A. Pravděpodobnost celkového přežití. B. Pravděpodobnost přežití bez progrese. OS – celkové přežití; pacienti nebyli cenzorováni v době změny léčby; PFS – přežití bez progrese; pacienti byli cenzorováni v době změny TKI – inhibitory tyrozinkinázy Pokud je pacient diagnostikován v chronické fázi a odpovídá na léčbu TKI, jeho očekávaná pravděpodobnost přežití se prakticky neliší od délky života zdravého člověka dané věkové kategorie. Tyto opravdu excelentní výsledky evokují otázku, zdali ještě existuje prostor, jak zlepšit léčbu a kvalitu života u těchto 80–90 % nemocných, kteří dosáhli optimální odpovědi a předpokladu délky života zdravé populace.
K takto úspěšné léčbě CML v současnosti přispěla i standardizace BCR-ABL1 monitorování mezi laboratořemi. Ke zlepšení a zjednodušení procesu kalibrace postupů pro vydávání výsledků v IS přispěla i rozsáhlá práce vybraných EUTOS referenčních laboratoří, včetně ÚHKT, s cílem vyvinout a validovat mezinárodní certifikovaný referenční plazmidový standard pro výraznou pomoc a usnadnění procesu standardizace. Výstupem práce, na které spolupracovala NRL ÚHKT, je existence referenčního materiálu ERM-AD623a-f, který je v současné době komerčně dostupný [41]. Je nutné zdůraznit, že samotné používání standardu nevede k vydávání výsledků v IS, avšak napomáhá zvýšit přesnost samotného měření RT-qPCR ve smyslu určení počtů kopií měřeného BCR-ABL1 a kontrolního genu. Pro zajištění toho, aby laboratoře mohly vydávat výsledky v IS bez nutnosti výměny vzorků pacientů s referenční laboratoří pro obdržení přepočtového koeficientu, byla silná potřeba vyvinout sekundární referenční materiál postihující celou metodiku. V rámci mezinárodní studie zahrnující vybrané EUTOS referenční laboratoře včetně NRL ÚHKT byl vyvinut a validován první buněčný BCR-ABL1 sekundární referenční panel [42]. Použití tohoto sekundárního referenčního panelu pro BCR-ABL1 kvantifikaci a kalibraci testů na IS v současné době testujeme společně s dalšími evropskými laboratořemi v rámci mezinárodního projektu EUTOS 2016, přičemž doporučený postup pro aplikování v praxi by měl být publikován v roce 2018.
Aktuálními tématy současné doby v léčbě CML jsou možnosti ukončit léčbu TKI a individualizovaný přístup k pacientovi zohledňující projevy nežádoucích účinků léčby ovlivňující kvalitu jeho života. Individualizovaným přístupem rozumíme nejen volbu léčby podle klasických vstupních rizikových skóre, stadia nemoci, přítomnosti komorbidit, ale také podle slibných molekulárně genetických ukazatelů, jako je míra poklesu hladin BCR-ABL1 v prvních měsících od zahájení léčby, včasné odhalení rozvoje mutací v KD BCR-ABL1 díky citlivému vyšetřování NGS, přirozená kombinace genotypů SNP v promotorech genů SLC22A4 a SLC22A5 předpovídající účinnost léčby imatinibem, které v komplexním hodnocení mohou pomoci k efektivní a časné úpravě léčby.
Ukončení léčby TKI
Léčba TKI je zatím podle všeobecně uznávaných doporučení pro léčbu a diagnostiku považována za dlouhodobou, při trvání optimální odpovědi, prakticky doživotní. Avšak dosažení a dlouhodobé trvání tzv. hluboké molekulární odpovědi (MR), výskyt nežádoucích účinků a také finanční nákladnost léčby vedly k odvážné úvaze o terapii TKI u určité skupiny pacientů za jasně definovaných podmínek vysadit a trvání molekulární odpovědi pečlivě sledovat. Zcela zásadní význam měly výsledky první multicentrické prospektivní studie STIM (STop IMatinib trial), kdy bylo hodnoceno 100 pacientů s CML v CP léčených imatinibem v první linii déle než 3 roky, kteří byli alespoň dva roky v MR, a poté jim byla léčba vysazena. Po 24 měsících ukončené léčby zůstalo bez molekulárního relapsu 38 % nemocných, kumulativní incidence molekulárního relapsu po 65 měsících byla 61 % [43]. Zatím největší studií, řešící problematiku možnosti ukončení léčby TKI, je studie EURO-SKI (EUROpe Stop TKI), projekt ELN, kterého se účastní celkem 68 center z 11 zemí Evropy. Mezi lety 2012–2014 bylo zařazeno 800 pacientů, 62 z nich také z 6 center ČR. Kritéria zařazení zahrnovala CML v chronické fázi, trvání léčby TKI před zařazením do studie déle než tři roky a hladinu transkriptu BCR-ABL1 ≤ 0,01 % v IS (MR4) alespoň jeden rok trvající. Hlavním cílem studie je zhodnotit trvání MMR po vysazení TKI a definovat možné prognostické faktory předpovídající udržení MR po vysazení léčby [44]. Monitorování hladin BCR-ABL1 probíhalo ve standardizovaných EUTOS laboratořích s certifikací validního vyšetřování hluboké molekulární odpovědi MR4,5. V rámci studie zajišťovala NRL ÚHKT monitorování BCR-ABL1 v ČR. Podle předběžné analýzy prvních 200 pacientů, představené na sjezdu Americké hematologické společnosti v prosinci 2014, zůstalo 61 % nemocných po 6 měsících od vysazení léčby v MMR, tedy bez nutnosti zahájení léčby TKI [45]. Aktuální výsledky studie byly prezentovány na Evropském hematologickém sjezdu v roce 2017. Ze 750 hodnocených pacientů s ověřenými molekulárními daty zůstalo bez molekulárního relapsu po 6 měsících 62 %, po 12 měsících 56 % a po 24 měsících 52 % nemocných. Univariantní analýza potvrdila významnou korelaci (p < 0,001) mezi trváním léčby TKI a trváním MR4 před vysazením se stavem MMR po 6 měsících od vysazení. Delší doba trvání léčby, optimálně ≥ 5,8 let, je spojena s vyšší pravděpodobností setrvání v MR bez potřeby léčby, a to 65,5 % oproti 42,6 % při terapii trvající kratší dobu [46]. ÚHKT zařadilo do EURO-SKI studie 14 pacientů. K 7/2017 zůstává 57 % nemocných (8/14) v mediánu 40 měsíců (34–50) v MMR a jsou stále bez léčby. U 6 nemocných došlo ke ztrátě MMR v mediánu 4 měsíců, když 5/6 pacientů (83 %) ztratilo odpověď do 6 měsíců od vysazení TKI. Po zpětném navrácení původní léčby dosáhli opět MMR v mediánu 7 měsíců (2–13 měsíců).
Zcela klíčovou součástí takových léčebných protokolů aplikujících u jasně definované skupiny CML pacientů vysazení léčby TKI, je standardizované monitorování hluboké molekulární odpovědi. Bylo proto zapotřebí seriózně se zabývat otázkou definice a standardizace MR na základě měření množství BCR-ABL1 transkriptu s přestavbou major (varianty e13a2, e14a2; 97% CML pacientů), pro které existuje externí plazmidový kalibrátor pro určení počtu kopií. Společně s dalšími EUTOS laboratořemi jsme se zabývali technickými detaily a způsobem interpretace, které laboratořím umožní kategorizovat pacienty ve standardizované formě. Vyvinuli jsme laboratorní postup definující MR reprodukovatelným způsobem [47]. BCR-ABL1 laboratoře podle těchto doporučení vyhodnocují MR následovně:
- MR4: pokles o ≥ 4 řády od IRIS standardizované hranice, tj. buď detekovatelná choroba na hladině ≤ 0,01 % IS BCR-ABL1 nebo nedetekovatelná choroba (0 kopií BCR-ABL1) při detekci ≥ 10 000 kopií ABL1, respektive ≥ 24 000 kopií GUSB v každé z testovaných paralel;
- MR4,5: pokles o ≥ 4,5 řádů od IRIS standardizované hranice, tj. buď detekovatelná choroba na hladině ≤ 0,0032 % IS BCR-ABL1, nebo nedetekovatelná choroba (0 kopií BCR-ABL1) při detekci součtu ≥ 32 000 kopií ABL1, respektive ≥ 77 000 kopií GUSB;
- MR5: pokles o ≥ 5,0 řádů od IRIS standardizované hranice, tj. buď detekovatelná choroba na hladině ≤ 0,001 % IS BCR-ABL1, nebo nedetekovatelná choroba (0 kopií BCR-ABL1) při detekci součtu ≥ 100 000 kopií ABL1, respektive ≥ 240 000 kopií GUSB.
Ukončit léčbu TKI bez rizika návratu choroby je tedy reálné, u kterých pacientů však bude možno léčbu vysadit, je zatím ne zcela jednoznačně zodpovězenou otázkou. Zcela nezbytnou podmínkou vysazování léčby jsou pravidelné kontroly nemocných a častější monitorování molekulární odpovědi ve validované a akreditované laboratoři s certifikátem o schopnosti vyšetřovat hlubokou molekulární odpověď MR4,5.
PERSONALIZOVANÝ PŘÍSTUP V LÉČBĚ CML
Většina pacientů je léčena, jak již bylo uvedeno, podle obecně platných doporučení (ELN, NCCN a ČHS). Existují však situace, kdy je potřeba volit individuální přístup k léčbě pacienta, hovoříme o léčbě „šité na míru“. Takovou situací jsou kromě vstupních rizikových skóre, přítomnosti komorbidit a molekulárních markerů, také projevy nežádoucích účinků léčby hodnocené podle intenzity stupněm 2–4. Jsou časné (brzy po zahájení léčby) nebo pozdní přechodnou dobu trvající, avšak zvládnutelné symptomatickou léčbou. Nebo se jedná o dlouhodobé nežádoucí účinky, tedy chronické, které jsou sice do určité míry tolerovatelné, ale kvalitu života zhoršují. Je také potvrzena souvislost s adherencí pacienta k léčbě. Způsob léčby je pak nutno volit s ohledem na dosažení optimální odpovědi a současně minimalizaci, nejlépe vymizení, nežádoucích účinků. Výskyt přítomnosti dlouhodobých projevů nežádoucích účinků léčby řešíme na našem pracovišti u 30 nemocných. Jedná se o pacienty s dlouhodobými projevy nežádoucích účinků typu křeče ve svalech, bolesti kostí, retence tekutin včetně otoků víček, dyspepsie a dalších potíží, nereagující dostatečně na symptomatickou léčbu. Pokud byli současně alespoň tři roky léčeni TKI a minimálně dva roky setrvávali v hluboké molekulární odpovědi (BCR-ABL1 ≤ 0,01 %), přistoupili jsme k intermitentnímu režimu léčby, tj. jeden měsíc užívat TKI a druhý měsíc TKI nepodávat. U pacientů bylo pozorováno výrazné snížení až vymizení projevů nežádoucích účinků a v intermitentním režimu léčby zůstává do současné doby 60 % nemocných (17/30) v mediánu sledování 30 měsíců. Pokud u pacienta došlo ke ztrátě MMR, pokračovala každodenní léčba TKI. Zajímavé je, že procentuální zastoupení pacientů bez ztráty MMR je srovnatelné s EURO-SKI studií.
Dalším příkladem individualizované terapie je management léčby CML u těhotných žen, jak od okamžiku zjištění těhotenství, tak v souvislosti s plánovaným těhotenstvím v době probíhající léčby. Vzhledem k jednoznačnému doporučení po dobu těhotenství TKI nepodávat, je léčbou volby IFN nebo leukodeplece. Zcela jinou situací je plánované těhotenství, které lze umožnit optimálně poté, kdy žena dosáhne na terapii TKI dlouhodobé hluboké molekulární odpovědi trvající alespoň 2 roky. Před vlastní koncepcí musí být TKI vysazen a po dobu těhotenství nepodáván. Také při otěhotnění léčené ženy např. při selhání antikoncepce, je nutno TKI neprodleně vysadit. Těhotenství ženy s CML je vždy považováno za rizikové, a jelikož dosud neexistují na důkazech založená zcela jednoznačná doporučení, léčba vždy vyžaduje zcela individualizovaný a multidisciplinární přístup [48–50]. O zkušenostech s prvními pěti těhotnými pacientkami s CML léčenými na našem pracovišti jsme referovali již v roce 2009 [51]. Do současné doby čítá náš soubor celkem 28 těhotenství při léčbě CML, z toho 18 těhotenství žen a 10 těhotenství partnerek mužů s CML. Nejčastěji byly řešeny situace nově diagnostikované CML a současně potvrzené časné gravidity ženy, nebo plánované těhotenství ženy již určitou dobu léčené TKI. Z 18 těhotenství bylo 14 ukončeno fyziologickým porodem 14 zdravých dětí. Dvě ženy byly v době trvání CML dvakrát těhotné, čtyři ženy požádaly o ukončení těhotenství ze zdravotních důvodů. U šesti žen byla diagnóza CML stanovena již v době několik týdnů trvajícího těhotenství. V prvním trimestru byly léčeny leukodeplecemi, ve druhém a třetím trimestru IFN. Teprve po porodu byla zahájena terapie TKI. Všechny ženy dosáhly, i když po delší době, cytogenetické a molekulární odpovědi. Sedm dalších těhotenství bylo plánovaných po několika letech probíhající léčby TKI, kdy pacientky docílily hluboké molekulární odpovědi, která trvala alespoň 24 měsíců. TKI, většinou imatinib, byl před vlastní koncepcí vysazen a období prvního trimestru proběhlo bez terapie. Také po dobu druhého a třetího trimestru nebylo, s výjimkou jedné pacientky, potřeba léčby. Ženy sice ztratily molekulární odpověď, po opětném nasazení TKI ji však znovu dosáhly. Jedno těhotenství vzniklo po selhání užívané antikoncepce. Narozené děti, nyní již ve věku 3 měsíců až 13 let, jsou zdravé, jejich vývoj probíhá zcela fyziologicky.
Příklad individualizované terapie s aplikováním nanotechnologie NGS pro vyšetření mutací v KD BCR-ABL1 v reálné praxi představuje práce na souboru 6 pacientů léčených v ÚHKT, FN Královské Vinohrady a FN Olomouc [52]. Jednalo se o pacienty, u nichž selhala léčba na aplikovaných TKI v první a druhé linii kvůli vysoce rezistentní mutaci T315I a dalším vícečetným rezistentním mutacím. V takových případech je doporučováno pacienty transplantovat, nebo je indikována léčba ponatinibem. Těchto 6 pacientů nebylo možné transplantovat z různých důvodů (např. pro multilékově rezistentní tuberkulózu) a v daném období nebyl ponatinib k dispozici. U těchto pacientů se přistoupilo k alternativní individualizované strategii léčby s aplikováním IFN, který byl podán po selhání léčby TKI sólo, sekvenčně nebo současně s TKI. Vycházeli jsme z předpokladu, že IFN terapeuticky působí zcela odlišně než TKI a může vést k potlačení mutovaného klonu. NGS pro detekci mutací byla aplikována v průběhu této individualizované terapie, aby odrážela mutační status a umožnila podle aktuálního stavu měnit léčbu. Zjistili jsme, že tento léčebný přístup vedl k potlačení mutovaného klonu T315I a vícečetných mutací, které byly identifikovány NGS jako kompozitní na nedetekovatelné hladiny, což bylo doprovázeno dosažením MMR a MR u 4 z 6 pacientů. Svou úlohu sehrála vlastní imunitní odpověď pacientů vyvolaná léčbou dasatinibem, která byla následně ještě umocněna IFN, což jsme vypozorovali na základě imunitního profilování.
VÝHLEDY NA NOVÉ TECHNOLOGIE A POSTUPY MONITOROVÁNÍ PACIENTŮ S CML
Digitální PCR (dPCR) představuje technologii, která by mohla přispět ke zvýšení citlivosti a přesnosti měření zbytkové nemoci u pacientů v MR. Jejím principem je rozdělení reakční směsi na sta až miliony dílčích PCR reakcí a v každé této reakci je zjišťována přítomnost cílového genu. Metoda slouží především pro detekci vzácně se vyskytujících molekul a poskytuje absolutní kvantifikaci bez nutnosti použití standardů a tvorby kalibračních křivek. Naše první výsledky ukazují, že citlivější měření minimální zbytkové nemoci (MRN) u pacientů s CML pomocí digitální PCR s přesnější kvantifikací může přinést zásadní informaci při rozhodování o přerušení léčby TKI.
Dalším důležitým přístupem, který by mohl pomoci zpřesnit monitorování MRN, je sledování hladiny BCR-ABL1 na úrovni DNA. Jedná se o komplikovanější postup, protože ke zlomům dochází v rozsáhlých intronových oblastech genů BCR a ABL1 u každého pacienta v jiném místě. Je tedy třeba u každého pacienta stanovit sekvenci zlomu [53] a navrhnout specifické laboratorní vyšetření pro jednotlivého pacienta, které nám pak ale poskytne informaci o všech BCR-ABL1 pozitivních buňkách a nejen o těch transkripčně aktivních, tj. pozitivních na úrovni mRNA. V rámci výzkumného projektu podporovaného zdravotnickou agenturou AZV (č. 15-31540A) řešíme společně s pracovišti FN Brno a 2. LF UK i otázku monitorování CML pacientů na úrovni DNA. V rámci projektu provádíme vyšetření prospektivně u nově diagnostikovaných pacientů, u pacientů, kteří se v průběhu léčby TKI nacházejí v hlubokých molekulárních odpovědích a také u pacientů, u kterých je vysazena léčba TKI v rámci EURO-SKI. Porovnáváme mezi sebou úrovně hladin mRNA a DNA BCR-ABL1, ale také data zjištěná pomocí RT-qPCR a dP-CR. Kvantifikovatelná množství mRNA a DNA měřená v celkových leukocytech periferní krve spolu signifikantně korelují, což poukazuje na to, že míra exprese BCR-ABL1 rovněž reálně odráží počet leukemických buněk v periferní krvi. To není překvapivé zjištění, když si uvědomíme fakt, že monitorování hladiny BCR-ABL1 transkriptů je uplatněno v lékařské praxi více než 10 let a prokazatelně odráží míru účinku TKI na redukci leukemických buněk. Odlišnosti nacházíme u vzorků, u kterých nebyl transkript BCR-ABL1 detekován. K tomu, abychom jednoznačně mohli mluvit o vyšší citlivosti měření zbytkové nemoci na úrovni DNA, si musíme počkat, až v rámci projektu budeme mít analyzován kompletní soubor, čítající přes 100 pacientů.
NOVÉ LÉČEBNÉ CÍLE – CESTA K VYLÉČENÍ CML
Dnes víme, že léčba TKI sice způsobuje inhibici proliferace i nezralejších progenitorů, ale jen nevýrazně u nich zvyšuje sklon k apoptóze. Přítomnost těchto HSPC (Haematopoietic Stem and Progenitor Cells) tedy představuje riziko selhání léčby TKI a návrat nemoci a je třeba hledat doplňkovou léčbu, kterou nepokrývá účinek TKI. Cramer et al. ve své studii ukazují schopnost přežití HSPC nezávisle na aktivitě BCR-ABL1 [54]. Podstatou zachování HSPC nabízí patrně i tzv. mikroprostředí těchto buněk, které svými interakcemi vytváří dostatek signálu k přežití. Cramer et al. rozvíjí teorii tzv. klidových leukemických kmenových buněk [54]. U klidových kmenových buněk náležejících k CML je kombinace abnormální tyrozin kinázové aktivity (nejen BCR-ABL1) a aberantní lokalizace proteinů kontrolujících buněčný cyklus klíčová k deregulaci buněčného cyklu v Ph+ buňkách, což je patrně spojené rezistencí k TKI.
První studie popisující existenci HSPC se objevili ještě před zavedení léčby TKI. Léčbu CML pomocí TKI nelze považovat za kurativní. I při snížení množství Ph+ buněk na hranici detekce lze mluvit o přetrvávající minimální reziduální nemoci právě kvůli přítomnosti nevyzpytatelných TKI rezistentních HSPC. Řada studií se shoduje na výskytu těchto HSPC zhruba u dvou třetin pacientů při pětiletém užívání TKI.
Existují důkazy o zásahu BCR-ABL1 do signální kaskády PI3K/AKT/FOXO, též do Hedgehog, Wnt i JAK/STAT signalizací a mnohých dalších (shrnuto v [55]). Proteiny signální kaskády Wnt jsou důležité zejména v embryonálním vývoji a kontrole sebeobnovy buněk prakticky všech tkání, včetně HSPC. Některé studie popisují zvýšenou aktivitu této dráhy při progresi CML do blastické krize [56–58]. Hedgehog signalizace koordinuje správný průběh primitivní i adultní hematopoézy [59]. Jiné práce dokonce ukazují aberantní „crosstalk“ Hedgehog/Wnt/Notch signálních drah při progresi CML [60, 61].
Klíčem k léčbě CML může být též cílená terapie dalších jednotlivých molekul diferenciálně exprimovaných v CML. V jiné práci je uveden seznam 97 genů diferenciálně exprimovaných v normálních a leukemických HSPC [62]. Autoři též ukazují odlišnosti v dalších buněčných procesech u CML HSPC: snížení aktivity prodiferenciační dráhy TGF-beta/BMP, zvýšený oxidativní metabolismus a zvýšení aktivity drah opravující poškození DNA a aktivace zánětlivých cytokinů.
Vývoj CML lze též připisovat chybnému tzv. „primingu“, neboli přirazení správné diferenciační linii při vývoji z HSPC. Transgenní modely myší např. demonstrují, že nedostatek transkripčního faktoru JUN B vedl k vývoji onemocnění velice podobnému CML. Transplantace HSPC s dostatkem JUN B nicméně vedla k úspěšné léčbě [63, 64].
Epigenetické změny (DNA metylace, histonové modifikace) permanentně ovlivňují genovou expresi a jejich aberace mají potenciál navodit leukemický fenotyp. Zvýšená aktivita histonové deacetylázy SIRT1 byla identifikována jako kritická pro přežívání CML HSPC [65, 66] a navozuje patrně prozatím nepopsaným mechanismem rezistenci k TKI. Inhibice SIRT1 in vitro i in vivo zvyšuje apoptózu leukemických progenitorů v chronické i blastické fázi CML. Je prokázané, že inhibice SIRT1 má několikanásobně slabší efekt na proliferaci a apoptózu normálních zdravých HSPC, tím se stává potenciálně cílovou molekulou pro eliminaci HSPC příslušející CML.
Dalším klíčem k pochopení přežívání HSPC CML může být analýza malých nekódujících molekul RNA tzv. mikroRNA, jejich role přesahuje od regulace proliferace, diferenciace až k apoptóze. Recentní práce [67] identifikuje několik miRNAs aberantně exprimovaných v HSPC u CML nezávisle na aktivitě BCR-ABL1.
Oddělení molekulární genetiky ÚHKT se věnuje studiu regulace miR-150 a miR-155 u CML v závislosti na léčbě TKI. Již dříve jsme zjistili souvislost významně snížené hladiny miR-150 a zvýšené hladiny miR-155 v CML [68]. V připravované publikaci (Šrůtová et al. 2017) jsme identifikovali BCR-ABL1 dependentní dráhu vedoucí k regulaci produkce těchto miRNA, zahrnující i několik dalších molekul, suspektních cílů terapie CML (např. MYC, PU.1, MYB).
Pro zlepšení léčby či potlačení následků onemocnění CML je dnes celá řada studií. Limity pro kurativní léčbu představuje účinná eliminace leukemických buněk již na úrovni HSPC. Kombinovaná léčba TKI se specifickými inhibitory dalších potenciálních leukemogeních proteinů je velmi pravděpodobně cesta k navození kompletní dlouhodobé remise pacientů s CML. Potenciální onkogenní molekuly (např. beta1-integrin, CXCR4, INF-alfa, MHC-II/CIITA) jsou dnes blokovány specifickými inhibitory v rámci klinických studií pro léčbu CML, další jiné na podobné studie čekají (CD26, CD44, HIF1-alfa, MYC).
ZÁVĚR
Vstup inhibitorů tyrozinových kináz do klinické praxe před 15 lety znamenal zcela zásadní převrat v léčbě CML. Díky existenci již pěti typů TKI, kterými lze v současné době léčit, se významně prodloužilo přežití nemocných bez progrese nemoci i celkové přežití a díky individualizovanému léčebnému přístupu k pacientovi se výrazně zlepšila také kvalita jejich života. Předpokládaný medián přežití pacientů diagnostikovaných v chronické fázi, kteří dobře odpovídají na léčbu, je v současné době odhadován na 25 let a více. TKI již více samy o sobě život pacienta prodloužit nemohou, nicméně stále ještě existují možnosti, jak celkové výsledky léčby zlepšovat. Za velmi nadějné lze považovat současné trendy, kterými jsou z pohledu klinika možnost ukončit léčbu TKI u určité skupiny pacientů v trvalé hluboké molekulární odpovědi a možnost individualizovat léčbu, jejímž cílem je ovlivnit také projevy nežádoucích účinků léčby a kvalitu života. V ÚHKT jsme připraveni na možnost rutinního vysazování TKI u jednotlivých pacientů, které však můžeme provádět díky kvalitnímu a certifikovanému monitorování hluboké molekulární odpovědi v EUTOS laboratoři ÚHKT. Individualizovaný přístup k pacientovi v praxi již realizujeme. Mnohé nás ještě čeká na poli výzkumu, kde je potřeba zaměřit pozornost na CML kmenovou buňku.
Odkazy kurzivou jsou nejvýznamnější publikace ÚHKT prvoautorské a spoluautorské v oblasti léčby, molekulárního monitorování a výzkumu CML.
Podíl autorů na přípravě rukopisu
HK a KMP – koncept a psaní rukopisu, kritická revize a souhlas s finální verzí
HŽ – podíl na psaní rukopisu, souhlas s finální verzí
PB a NČ – podíl na psaní rukopisu, revize rukopisu a souhlas s finální verzí
DS – revize rukopisu a souhlas s finální verzí
Poděkování
Poděkování patří Tereze Nečasové (Institut biostatistiky a analýz, LF Masarykovy univerzity) a Jiřině Procházkové (Interní hematologická a onkologická klinika FN Brno) za tvorbu grafu na obrázku 2. Poděkování patří též pracovním skupinám CELL a CAMELIA.
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
MUDr. Hana Klamová, CSc.
Mgr. Kateřina Machová Poláková, Ph.D.
Klinický úsek
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-maily: hana.klamova@uhkt.cz;
katerina.machova@uhkt.cz
Zdroje
1. Rowley JD. Letter: A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature 1973;243(5405):290–293.
2. Faderl S, Talpaz M, Estrov Z, et al. The biology of chronic myeloid leukemia. New Engl J Med 1999;341(3):164–172.
3. Sawyers CL. Chronic myeloid leukemia. New Engl J Med 1999;340(17):1330–13340.
4. Faber E, Indrák K, et al. Chronická myeloidní leukémie. Praha: Galén, 2010. ISBN 978-80-7262-680-9.
5. Indrák K. Hematologie a transfuzní lékařství. Praha: TRITON. 2014. ISBN 978-80-7387-722-4.
6. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita, 2005. (http://www.svod.cz)
7. Kantarjian HM, O’Brien S, Cortes JE, et al. Complete cytogenetic and molecular responses to interferon-alpha-based therapy for chronic myelogenous leukemia are associated with excellent long-term prognosis. Cancer 2003;97(4):1033–1041.
8. O’Brien SG, Guilhot F, Larson RA, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. New Engl J Med 2003;348(11):994–1004.
9. Klamova H, Faber E, Zackova D, et al. Dasatinib in imatinib-resistant or -intolerant CML patients: data from the clinical practice of 6 hematological centers in the Czech Republic. Neoplasma 2010;57(4):355–359.
10. Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood 2013;122(6):872–884.
11. Beillard E, Pallisgaard N, van der Velden VH, et al. Evaluation of candidate control genes for diagnosis and residual disease detection in leukemic patients using ‘real-time’ quantitative reverse-transcriptase polymerase chain reaction (RQ-PCR) - a Europe against cancer program. Leukemia 2003;17(12):2474–2486.
12. Branford S, Cross NC, Hochhaus A, et al. Rationale for the recommendations for harmonizing current methodology for detecting BCR-ABL transcripts in patients with chronic myeloid leukaemia. Leukemia 2006;20(11):1925–1930.
13. Branford S, Fletcher L, Cross NC, et al. Desirable performance charac-teristics for BCR-ABL measurement on an international reporting scale to allow consistent interpretation of individual patient response and comparison of response rates between clinical trials. Blood 2008;112(8):3330–3338.
14. Zemanová K, Žižková H, Jurček T, et al. Chronická myeloidní leukemie-standardizace molekulárního monitorování hladiny transkriptů BCR--ABL1 v České republice. Transfuze Hematol dnes 2016;22(1):56–64.
15. Klamova H, Polakova KM, Muzik J, et al. Evaluation of 5-year imatinib treatment of 458 patients with CP-CML in routine clinical practice and prognostic impact of different BCR-ABL cutoff levels. Cancer Med 2013;2(2):216–225.
16. Hanfstein B, Muller MC, Hehlmann R, et al. Early molecular and cytogenetic response is predictive for long-term progression-free and overall survival in chronic myeloid leukemia (CML). Leukemia 2012;26(9):2096–2102.
17. Marin D, Ibrahim AR, Lucas C, et al. Assessment of BCR-ABL1 transcript levels at 3 months is the only requirement for predicting outcome for patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors. J Clin Oncol 2012;30(3):232–238.
18. Soverini S, Hochhaus A, Nicolini FE, et al. BCR-ABL kinase domain mutation analysis in chronic myeloid leukemia patients treated with tyrosine kinase inhibitors: recommendations from an expert panel on behalf of European LeukemiaNet. Blood 2011;118(5):1208–1215.
19. Polakova KM, Polivkova V, Rulcova J, et al. Constant BCR-ABL transcript level >or=0.1% (IS) in patients with CML responding to imatinib with complete cytogenetic remission may indicate mutation analysis. Exp Hematol 2010;38(1):20–26.
20. Soverini S, De Benedittis C, Machova Polakova K, et al. Unraveling the complexity of tyrosine kinase inhibitor-resistant populations by ultra-deep sequencing of the BCR-ABL kinase domain. Blood 2013;122(9):1634–1648.
21. Machova Polakova K, Kulvait V, Benesova A, et al. Next-generation deep sequencing improves detection of BCR-ABL1 kinase domain mutations emerging under tyrosine kinase inhibitor treatment of chronic myeloid leukemia patients in chronic phase. J Cancer Res Clin Oncol 2015;141(5):887–899.
22. Vasiliou V, Vasiliou K, Nebert DW. Human ATP-binding cassette (ABC) transporter family. Human Genomics 2009;3(3):281–290.
23. Kuwazuru Y, Yoshimura A, Hanada S, et al. Expression of the multidrug transporter, P-glycoprotein, in chronic myelogenous leukaemia cells in blast crisis. Br J Haematol 1990;74(1):24–29.
24. Singh O, Chan JY, Lin K, Heng, Chowbay. SLC22A1-ABCB1 haplotype profiles predict imatinib pharmacokinetics in Asian patients with chronic myeloid leukemia. PloS ONE 2012;7(12):e51771.
25. He L, Vasiliou K, Nebert DW. Analysis and update of the human solute carrier (SLC) gene superfamily. Human Genomics 2009;3(2):195–206.
26. White DL, Saunders VA, Dang P, et al. Most CML patients who have a suboptimal response to imatinib have low OCT-1 activity: higher doses of imatinib may overcome the negative impact of low OCT-1 activity. Blood 2007;110(12):4064–4072.
27. Gromicho M, Magalhaes M, Torres F, et al. Instability of mRNA expression signatures of drug transporters in chronic myeloid leukemia patients resistant to imatinib. Oncol Rep 2013;29(2):741–750.
28. Kim DH, Sriharsha L, Xu W, et al. Clinical relevance of a pharmacogenetic approach using multiple candidate genes to predict response and resistance to imatinib therapy in chronic myeloid leukemia. Clin Cancer Res 2009;15(14):4750–4758.
29. Angelini S, Soverini S, Ravegnini G, et al. Association between imatinib transporters and metabolizing enzymes genotype and response in newly diagnosed chronic myeloid leukemia patients receiving imatinib therapy. Haematologica 2013;98(2):193–200.
30. Dulucq S, Bouchet S, Turcq B, et al. Multidrug resistance gene (MDR1) polymorphisms are associated with major molecular responses to standard-dose imatinib in chronic myeloid leukemia. Blood 2008;112(5):2024–2027.
31. Ni LN, Li JY, Miao KR, et al. Multidrug resistance gene (MDR1) polymorphisms correlate with imatinib response in chronic myeloid leukemia. Med Oncol 2011;28(1):265–269.
32. Maffioli M, Camos M, Gaya A, et al. Correlation between genetic polymorphisms of the hOCT1 and MDR1 genes and the response to imatinib in patients newly diagnosed with chronic-phase chronic myeloid leukemia. Leuk Res 2011;35(8):1014–1019.
33. Hesselson SE, Matsson P, Shima JE, et al. Genetic variation in the proximal promoter of ABC and SLC superfamilies: liver and kidney specific expression and promoter activity predict variation. PloS ONE 2009;4(9):e6942.
34. Jaruskova M, Curik N, Hercog R, et al. Genotypes of SLC22A4 and SLC22A5 regulatory loci are predictive of the response of chronic myeloid leukemia patients to imatinib treatment. J Exp Clin Cancer Res 2017;36(1):55.
35. Hochhaus A, Dreyling M, Group EGW. Chronic myelogenous leukemia: ESMO clinical recommendations for the diagnosis, treatment and follow-up. Ann Oncol 2008;19(Suppl 2):ii63–64.
36. Hochhaus A, Larson RA, Guilhot F, et al. Long-term outcomes of imatinib treatment for chronic myeloid leukemia. New Engl J Med 2017;376(10):917–927.
37. Cortes JE, Saglio G, Kantarjian HM, et al. Final 5-year study results of DASISION: The dasatinib versus imatinib study in treatment-naive chronic myeloid leukemia patients trial. J Clin Oncol 2016;34(20):2333–2340.
38. Kalmanti L, Saussele S, Lauseker M, et al. Safety and efficacy of imatinib in CML over a period of 10 years: data from the randomized CML-study IV. Leukemia 2015;29(5):1123-1132.
39. Hochhaus A, Saglio G, Hughes TP, et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial. Leukemia 2016;30(5):1044–1054.
40. Baccarani M, Pane F, Rosti G, et al. Chronic myeloid leukemia: room for improvement? Haematologica 2017;102(7):1131–1133.
41. White H, Deprez L, Corbisier P, et al. A certified plasmid reference material for the standardisation of BCR-ABL1 mRNA quantification by real-time quantitative PCR. Leukemia 2015;29(2):369–376.
42. Cross NC, White HE, Ernst T, et al. Development and evaluation of a secondary reference panel for BCR-ABL1 quantification on the International Scale. Leukemia 2016;30(9):1844–1852.
43. Etienne G, Guilhot J, Rea D, et al. Long-term follow-up of the French Stop Imatinib (STIM1) Study in patients with chronic myeloid leukemia. J Clin Oncol 2017;35(3):298–305.
44. Mahon XF, Richter J, Guilhot J, et al. Iterim analysis of a pan European Stop Tyrosine Kinase Inhibitor Trial in CML: The EURO-SKI study. Blood 2014;124:Abs.151
45. Saussele S, Richter J, Guilhot J, et al. First iterim analysis of a Pan-European Stop Trial using standardized moolecular criteria: results of the EURO-SKI trial. Haematologica 2014;99 : 792.
46. Saussele S, Richter J, Hochhaus A, Mahon FX. The concept of treatment-free remission in chronic myeloid leukemia. Leukemia 2016;30(8):1638–1647.
47. Cross NC, White HE, Colomer D, et al. Laboratory recommendations for scoring deep molecular responses following treatment for chronic myeloid leukemia. Leukemia 2015;29(5):999–1003.
48. Palani R, Milojkovic D, Apperley JF. Managing pregnancy in chronic myeloid leukaemia. Ann Hematol 2015;94(Suppl 2):S167–176.
49. Milojkovic D, Apperley JF. How I treat leukemia during pregnancy. Blood 2014;123(7):974–984.
50. Abruzzese E, Trawinska MM, de Fabritiis P, Baccarani M. Management of pregnant chronic myeloid leukemia patients. Exp Rev Hematol 2016;9(8):781–791.
51. Klamova H, Markova M, Moravcova J, et al. Response to treatment in women with chronic myeloid leukemia during pregnancy and after delivery. Leuk Res 2009;33(11):1567–1569.
52. Polivkova V, Rohon P, Klamova H, et al. Interferon-alpha revisited: individualized treatment management eased the selective pressure of tyrosine kinase inhibitors on BCR-ABL1 mutations resulting in a molecular response in high-risk CML patients. PloS ONE 2016;11(5):e0155959.
53. Linhartova J, Hovorkova L, Soverini S, et al. Characterization of 46 patient-specific BCR-ABL1 fusions and detection of SNPs upstream and downstream the breakpoints in chronic myeloid leukemia using next generation sequencing. Mol Cancer 2015;14 : 89.
54.Cramer K, Nieborowska-Skorska M, Koptyra M, et al. BCR/ABL and other kinases from chronic myeloproliferative disorders stimulate single-strand annealing, an unfaithful DNA double-strand break repair. Cancer Res 2008;68(17):6884–6888.
55. Holyoake TL, Vetrie D. The chronic myeloid leukemia stem cell: stemming the tide of persistence. Blood 2017;129(12):1595–1606.
56. Chen XS, Sheller JR, Johnson EN, Funk CD. Role of leukotrienes revealed by targeted disruption of the 5-lipoxygenase gene. Nature 1994;372(6502):179–182.
57. Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature 2001;414(6859):105–111.
58. Saudy NS, Fawzy IM, Azmy E, Goda EF, Eneen A, Abdul Salam EM. BMI1 gene expression in myeloid leukemias and its impact on prognosis. Blood Cell Molec Dis 2014;53(4):194–198.
59. Morrison SJ, Uchida N, Weissman IL. The biology of hematopoietic stem cells. Annual review of cell and developmental biology. 1995;11 : 35–71.
60. Williams DA, Zheng Y, Cancelas JA. Rho GTPases and regulation of hematopoietic stem cell localization. Meth Enzymol 2008;439 : 365–393.
61. Hu Y, Chen Y, Douglas L, Li S. beta-Catenin is essential for survival of leukemic stem cells insensitive to kinase inhibition in mice with BCR--ABL-induced chronic myeloid leukemia. Leukemia 2009;23(1):109–116.
62. Gerber JM, Gucwa JL, Esopi D, et al. Genome-wide comparison of the transcriptomes of highly enriched normal and chronic myeloid leukemia stem and progenitor cell populations. Oncotarget 2013;4(5):715–728.
63. Passegue E, Jochum W, Schorpp-Kistner M, Mohle-Steinlein U, Wagner EF. Chronic myeloid leukemia with increased granulocyte progenitors in mice lacking junB expression in the myeloid lineage. Cell 2001;104(1):21–32.
64. Chu S, Xu H, Shah NP, et al. Detection of BCR-ABL kinase mutations in CD34+ cells from chronic myelogenous leukemia patients in complete cytogenetic remission on imatinib mesylate treatment. Blood 2005;105(5):2093–2098.
65. Wang Z, Yuan H, Roth M, Stark JM, Bhatia R, Chen WY. SIRT1 deace-tylase promotes acquisition of genetic mutations for drug resistance in CML cells. Oncogene 2013;32(5):589–598.
66. Li L, Wang L, Li L, et al. Activation of p53 by SIRT1 inhibition enhances elimination of CML leukemia stem cells in combination with imatinib. Cancer Cell 2012;21(2):266–281.
67. Salati S, Salvestrini V, Carretta C, et al. Deregulated expression of miR-29a-3p, miR-494-3p and miR-660-5p affects sensitivity to tyrosine kinase inhibitors in CML leukemic stem cells. Oncotarget 2017;8(30):49451–49469.
68. Machova Polakova K, Lopotova T, Klamova H, et al. Expression patterns of microRNAs associated with CML phases and their disease related targets. Mol Cancer 2011;10 : 41.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2017 Číslo Supplementum1- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Molekulárně genetická vyšetření prováděná v Ústavu hematologie a krevní transfuze u pacientů s myelodysplastickým syndromem
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
- Současné trendy v léčbě a diagnostice chronické myeloidní leukemie
- Každý obor potřebuje svůj ústav excelence
- Využití molekulárně cytogenetických technik při analýze chromozomových aberací u hematologických malignit
- Transplantace krvetvorných buněk v Ústavu hematologie a krevní transfuze (1986–2016)
- Genetické testy pro výběr dárce hematopoetických kmenových buněk a potransplantační monitorování
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Dysfibrinogenemie a afibrinogenemie v České republice
- Transfuze a imunohematologie v ÚHKT
- Standardní a velkoobjemové separace krvetvorných buněk z periferní krve za použití nového protokolu pro kontinuální sběr mononukleárních buněk Spectra Optia
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Dysfibrinogenemie a afibrinogenemie v České republice
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Transfuze a imunohematologie v ÚHKT
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



