-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
S imunoglobulinem IgG4 asociované onemocnění
IgG4 releated disease
Ig-G4 related disease is a heterogeneous disorder with multi-organ involvement recognised as a separate entity at the start of this century only. Almost all organs can be involved by this disease, but mostly is manifested in gastrointestinal trakt and pankreas. In some patients it can cause retroperitoneal fibrosis and in some patients may be present as lymfadenopathy. Diagnosis involves establishing high circulating levels of IgG4 > 135 mg/dL, increased serum IgG4 to IgG ratio of > 8%, immunohistochemistry showing dense lymphoplasmacellular inflammatory infiltrate consisting of IgG4-positive plasma cells with storiform fibrosis and obliterative phlebitis, and increased IgG4 positive plasma cell. Glucocorticoids are the primary form of therapy. Rituximab is the second line of therapy in case of no responce to kortikosteroids or intolerance of corticosteroids.
Key words:
IgG4 releated disease – IgG4 subclass of immuniglobuline – corticosteroids – rituximab
Autoři: Z. Adam 1; M. Krejčí 1; Z. Chovancová 2; Z. Řehák 4,5; R. Koukalová 3; M. Štork 1; A. Čermák 6; L. Říhová 3; L. Pour 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Ústav klinické imunologie a alergologie LF MU a FN u svaté Anny Brno 2; Laboratoř průtokové cytometrie Oddělení klinické hematologie LF MU a FN Brno 3; Oddělení nukleární medicíny Masarykův onkologický ústav (MOU) 4; Regionální centrum molekulární onkologie (RECAMO) Masarykův onkologický ústav 5; Urologická klinika LF MU a FN Brno 6
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 2, p. 78-86.
Kategorie: Souhrnné a edukační práce
Souhrn
S imunoglobulinem IgG4 asociované onemocnění je heterogenní porucha s multiorgánovým poškozením. Jako samostatná jednotka bylo toto onemocnění definováno teprve počátkem tohoto století. Nemoc může postihovat téměř všechny orgány, ale nejčastěji se manifestuje v trávicí trubici a v pankreatu. Někdy tato nemoc může způsobovat retroperitoneální fibrózu. U některých pacientů se může manifestovat lymfadenopatií. Pro stanovení diagnózy je zásadní průkaz vysoké koncentrace podtypu imunoglobubulinu IgG4 vyšší než 1,35 g/l a vysoký poměr sérových koncentrací podtypu imunoglobulinu IgG4 ke koncentraci IgG, větší než 8 %. Pro stanovení diagnózy je zásadní imunohistochemický průkaz denzní lymfoplazmocelulární proliferace s průkazem zvýšené koncentrace IgG4 v plazmatických buňkách, se znaky fibrózy a obliterativní flebitidy. Pro iniciální léčbu se používají glukokortikoidy a v případě neúspěchu glukokortikoidní léčby či její netolerance lze s úspěchem použít rituximab.
Klíčová slova:
IgG4 asociované onemocnění – podtřída IgG4 imunoglobulinu – kortikosteroidy – rituximab
ÚVOD
Termín IgG4-asociované onemocnění (IgG4-releated disease podle anglické terminologie) představuje novou klinickou jednotku, která byla ustanovena až v roce 2012. IgG4-asociované onemocnění je z hlediska etiologie zatím neobjasněné. Je definováno morfologicky (zánětlivé a fibrotické změny). Při histopatologickém vyšetření je pro toto onemocnění charakteristická lymfocytární, lymfoplazmocytární a plazmocytární infiltrace, přičemž imunohistochemicky je v plazmatických buňkách prokazatelná vysoká exprese podtřídy imunoglobulinu IgG4 a v séru těchto pacientů jsou pak zvýšené koncentrace podtřídy IgG4 imunoglobulinů. Nemoc asi nejvíce postihuje slinivku břišní, pan-kreatické a biliární cesty, proto nejvíce publikací je v literatuře gastroenterologické a patologické [1–12]. Ale postižen může být kterýkoliv orgán v těle, a tak není překvapující, že i v české a slovenské odborné literatuře zmiňují IgG4-asociovanou chorobu lékaři všech odborností [13–29]. Přehlédnutí těchto citovaných prací, či alespoň jejich názvů [1–30] ilustruje pestrost možných manifestací této nemoci. A mimo jiné se může projevit také lymfadenopatií a diagnóza může být stanovena při exstirpaci a histologickém vyšetření odebraných uzlin.
V nejasných případech [1–30] je třeba:
- Provést vyšetření podtřídy imunoglobulinu IgG4 v séru.
- V odebrané tkáni prokázat plazmatické buňky tvořící podtřídu imunoglobulinů IgG4.
- Poslat krev na vyšetření průtokovou cytometrií k detekci cirkulujících plazmablastů.
VÝVOJ POZNÁNÍ
První popis pacienta, který měl zřejmě IgG4--asociované onemocnění, zveřejnil již před dávnými lety chirurg Johann Freiherr von Mikulicz-Radecki. Popsal pacienta se systémovým zduřením slinných žláz, které byly infiltrovány mononukleárními buňkami, aniž by ovšem tušil další souvislost [30]. Od jeho popisu se odvíjela popisná diagnóza „Mikuliczova choroba“.
Jevem podobným Mikuliczově syndromu je izolovaná submandibulární sklerozující sialoadenitida (Klittnerův tumor) a Riedlova tyreoiditida.
Nejčastěji postiženým orgánem je pankreas v rámci autoimunitní pankreatitidy, takže nejčastěji se s tímto onemocněním setkávají gastroenterologové [1–12, 31]. Autoimunní pankreatitida byla poprvé předpokládána již v roce 1961 Sirem Henry Sarlesem [32], ale potvrzena byla až podstatně později.
Klinická jednotka “IgG4-related disease” – IgG4--asociované onemocnění byla poprvé definována až v roce 2010 na konferenci v Japonsku a o něco později se objevila definice této klinické jednotky v odborné literatuře [33]. Potvrzena byla na mezinárodní konferenci a závěry byly zveřejněné v roce 2012 [34] a následně vznikala mezinárodní doporučení pro léčbu této klinické jednotky [35].
Histologickými znaky tohoto onemocnění jsou: lymfoplazmocytární infiltrát, dále obliterující flebitida a fibróza. Fibrotické změny určují míru pokročilosti nemoci a způsobují poškození orgánů [36].
O genetické predispozici k této nemoci je málo známo, nejvíce informací plyne ze souboru japonských pacientů s autoimunitní pankreatitidou. Byla prokázána souvislost s určitými HLA-typy, ale také s polymorfismy genů nesouvisejících s HLA systémem, jako například „cytotoxic T lymphocyte-associated antigen-4“ (CTLA-4), Tumor necrosis factor-α (TNFα), „Fc receptor-like 3 molecule“ (FcRL3) [37, 38].
KLINICKÉ PROJEVY NEMOCI
Příznaky IgG4-asociovaného onemocnění odpovídají vždy místu lokalizace nemoci. Infiltrace může vést ke zvětšení orgánů (pseudotumor) [39]. Pestrost možných projevů této nemoci ilustruje tabulka 1.
Tab. 1. Přehled možných projevů IgG4-asociovaného onemocnění 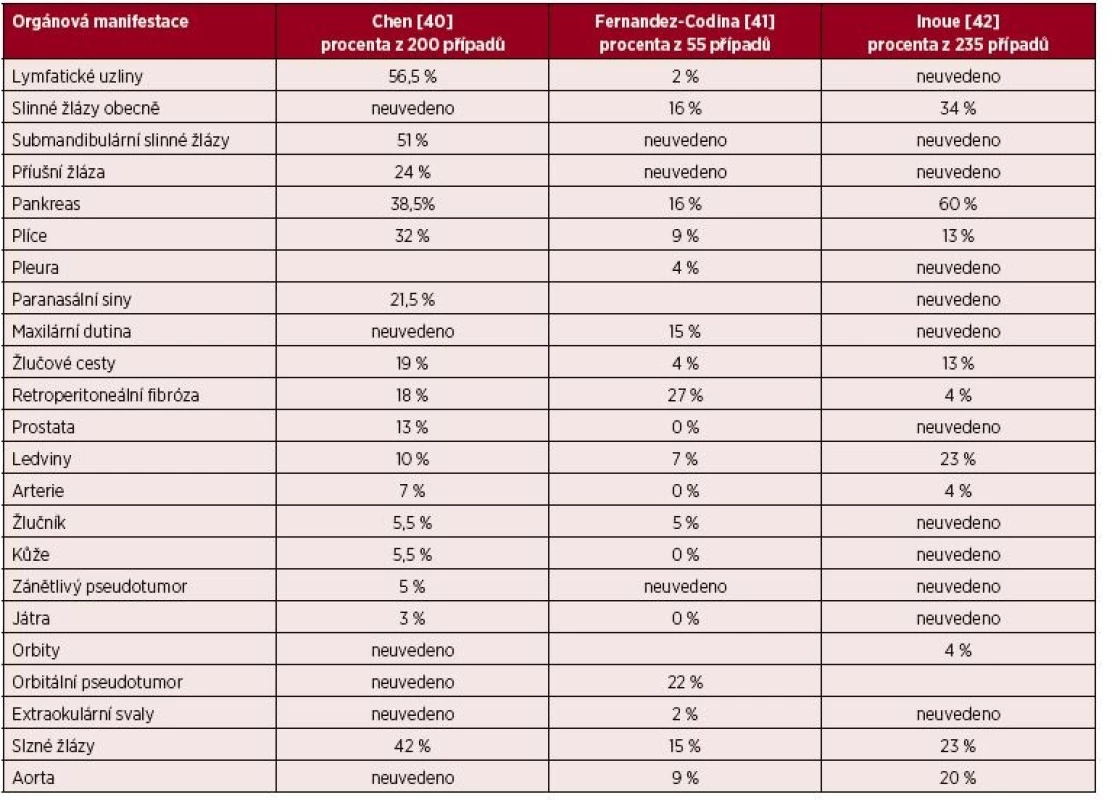
EPIDEMIOLOGIE
Zprávy o epidemiologii se koncentrují na akutní autoimunitní pankreatitidu a pocházejí hlavně z Japonska a Koreje. Prevalence nemoci odhadují na 4,6 a roční incidenci na 1,4 případů na 100 000 obyvatel [43]. Retrospektivní analýza resekovaných pankreatů z Mayo Clinic prokázala autoimunitní pankreatitidu u 11 % z nich [44]. Další velká analýza je ale opět z Japonska, v 8 velkých nemocnicích analyzovali v letech 2005–2013 celkem 235 pacientů. Poměr žen a mužů byl 4 : 1, medián věku při stanovení diagnózy byl 67 let a 90 % pacientů bylo ve věkovém intervalu 50–70 let. Při stanovení diagnózy byly příznaky přítomny u 70 %, ale 18 % udávalo jen nespecifické bolesti břicha. Celkem 39 % pacientů mělo diabetes mellitus a 30 % mělo buď alergickou rýmu či astma, nebo medikamentózní alergii. U mužů byla slinivka břišní nejčastěji postiženým orgánem (63 %), následována slinnými žlázami, zatímco u žen byly v 57 % postiženy slinné žlázy a na druhém místě byla slinivka břišní [42].
PATOFYZIOLOGIE
Podtřída IgG4 je frakce nejméně zastoupená v imunoglobulinech třídy IgG. IgG4 tvoří jen 5 % celkového množství IgG [37, 38]. Na rozdíl od jiných imunoglobulinů je schopnost IgG4 aktivovat komplement omezená. Redukovaná vazba na antigeny, a tím redukovaná schopnosti aktivace komplementu vede k domněnce, že samotná molekula IgG4 není tou vlastní hnací silou nemoci, ale pouze jejím markerem [45]. Tvorba podtřídy imunoglobulinu typu IgG4 je následkem dlouhodobé expozice antigenům z potravy a antigenům zevního prostředí vůbec. Alergie dětského věku po zhojení ve věku dospělém vykazují přeměnu z tvorby IgE na tvorbu IgG4 [37, 46]. Podobný fenomén byl popsán po desenzibilizační léčbě ve dospělém věku. Tento dílčí fakt ale nepomáhá k porozumění patofyziologie IgG4 asociovaného onemocnění.
Jedna z vysvětlujících hypotéz předpokládá, že neznámý podnět stimuluje iniciální TH1-immunitní odpověď, což způsobuje sekreci proinflamatorních cytokinů a aktivaci B-buněk a plazmocytů a také eozinofilních granulocytů. To vysvětluje častou eozinofilii, stejně jako vyšší hladinu IgA protilátek u postižených pacientů. Současně tento neznámý podnět stimuluje TH2 imunitní odpověď, což vede k expanzi a tvorbě IgG4 tvořících plazmatických buněk. Zřejmě dochází také k poruše funkce regulačních T-buněk, která má za následek perzistující TH1 a TH2 imunitní odpověď.
Poškození orgánů však rezultuje z pokračující orgánové fibrózy. Ta se dává do souvislosti s nadprodukcí TH2 typických cytokinů IL-4 a IL-13 a uvolnění IL-10 z autoregulačních T-buněk. Výsledkem je aktivace makrofágů a produkce profibrotických cytokinů, jako jsou „transforming growth factor β1“ (TGF-β1) a „platelet-derived growth factor“ (PDGF).
V centru etiopatogenetického dění je klonální expanze CD4+ cytotoxických T-lymfocytů, vyznačující se zvýšením jejich počtu jak v periferní krvi, tak i ve fibrotických ložiscích v postižených orgánech. Byl prokázán zvýšený počet T-regulačních elementů (Tregs) v periferní krvi, provázený zvýšenou hladinou jimi produkovaných cytokinů, včetně IL-1 a TGF-beta v postižené tkáni.
STANOVENÍ DIAGNÓZY
Stanovení diagnózy se opírá o:
- anamnézu a klinické vyšetření,
- stanovení sérové koncentrace IgG4 imunoglobulinu,
- průkaz zvětšení orgánu či otoku orgánu odpovídající zobrazovací metodou,
- histologické vyšetření se speciálním barvením na IgG4 obsahující plazmocyty a plazmoblasty,
- průkaz zvýšeného počtu cirkulujících plazmoblastů v periferní krvi vícebarevnou průtokovou cytometrií [47, 48, 49].
Histologické potvrzení diagnózy je stále zlatým standardem. Pro některé lokalizace této nemoci jsou vytvořena speciální diagnostická kritéria: pro autoimunitní pankreatitidu [50], autoimunitní cholangitidu [51], pro zvětšení slinných žláz [52], pro postižení ledvin [53]. V případě postižení lymfatických uzlin v rámci diferenciální diagnostiky nutno myslet i na možnosti Castlemanovy nemoci – její plazmocelulární varianty.
Zajímavé je, že IgG4-asociovaná choroba je v Japonsku obligátně spjata se zvýšenou hladinou podtřídy IgG4, ale u evropské populace s prokázanou IG4-asociovanou chorobou nedochází vždy ke zvýšené sérové hladiny podtřídy IgG4. V Evropě proto není měření podtřídy IgG4 vhodné pro screening ani pro vyloučení nemoci. V západní Evropě má asi jen 50–59 % osob s IgG4-asociovanou chorobou zvýšené hladiny IgG4, zatímco v Asii a USA je to téměř 100 % [54]. Specificita zvýšení podtřídy IgG4 se udává při hodnotě nad hranicí 27 g/1 vyšší než 90 %, ale senzitivita jen 35 % [48]. Problém je, že u některých chorob může být vyšší koncentrace imunoglobulinů podtřídy IgG4, aniž by to byla IgG4-asociovaná choroba [48].
Zvýšené hodnoty IgG4 v séru jsou nespecifické a tento laboratorní nález se vyskytuje taktéž u multicentrické Castlemanovy choroby, alergických onemocnění včetně eozinofilní granulomatózy s polyangiitidou (syndrom Churg-Straussové), sarkoidózy, respektive širokého spektra dalších onemocnění. V laboratorním obraze se lze setkat i s pozitivitou ANF a s pozitivitou revmatoidních faktorů, s typicky sníženou hodnou C3 a C4 složky komplementu, se vzestupem IgE imunoglobulinu a s přítomností tkáňové depozice imunokomplexů.
Aktivitu nemoci lze hodnotit i pomocí vyšetření průtokovou cytometrií.
Někteří autoři dávají přednost před vyšetřením hladiny IgG4 imunoglobulinu v séru podchycení obvykle dramaticky zvýšeného počtu IgG4+ plazmoblastů v periferní krvi. Vyšetření průtokovou cytometrií slouží nejen pro diagnostiku aktivní formy „IgG4-related“ onemocnění, ale i pro monitorování vývoje nemoci. Vysoký počet plazmoblastů v periferní krvi lze identifikovat pomocí vícebarevné průtokové cytometrie (CD1910w, CD38+, CD20-, CD27+). Plazmoblasty bývají zvýšeny i v případě normálních hladin IgG4 v séru. Vyšetření zvýšeného počtu cirkulujících plazmoblastů je doporučováno jako potenciální diagnostický biomarker nemoci využitelný i v hodnocení hloubky léčebné odezvy a odhalení progrese s potřebou zahájení opětovné léčby [55]. Toto speciální vyšetření průtokovou cytometrií provádí RNDr. Lucie Říhová na pracovišti Oddělení klinické hematologie v Brně-Bohunicích.
Pro histopatologický obraz nemoci je typická tato triáda:
- hustý lymfoplazmocytární infiltrát, který obsahuje IgG4 pozitivní plazmatické buňky. Častý je zvýšený počet eozinofilů v postižené tkáni a eozinofilie v obvodové krvi;
- výrazná fibróza;
- podél cév asociované zánětlivé procesy včetně flebitidy s obliterací lumen [55, 56, 57].
Při prvním pohledu na hodnoty podtříd IgG imunoglobulinů je překvapivé, že hodnota celkového imunoglobulinu IgG je nižší než součet koncentrací podtypů imunoglobulinu Ig1 až IgG4. Připojujeme proto stručnou exkurzi do měření kvantity imunoglobulinů, aby bylo jasné, proč součet naměřených koncentrací podtříd imunoglobulinů nemusí souhlasit s naměřeným celkovým množstvím imunoglobulinu IgG.
Měření celkové koncentrace imunoglobulinu typu IgG se dnes rutinně provádí ve většině biochemickým laboratoří. Měření podtříd imunoglobulinů IgG nebo IgA se provádí jen ve speciálních imunologických laboratořích.
Koncentrace celkového imunoglobulinu třídy IgG a jeho podtříd se stanovují nefelometricky. Logicky zní, že naměřená koncentrace celkového IgG imunoglobulinu by se měla rovnat součtu naměřených koncentrací imunoglobulinů IgG1 + IgG2 +IgG3+IgG4. To však při nefelometrickém stanovení celkového IgG a při stanovení koncentrace jednotlivých podtříd imunoglobulinů neplatí.
Princip nefelometrického měření koncentrace celkových IgG imunoglobulinů je reakce firemního činidla (směsi protilátek proti IgG1, IgG2, IgG3, IgG4 v určitém poměru a koncentraci) se sérem nemocného. Po inkubaci séra pacienta s tímto činidlem se vytvoří vazby mezi IgG1 imunoglobuliny v séru pacienta a anti-IgG1 protilátkami obsaženými ve firemním činidlu, IgG2 imunoglobuliny a anti-IgG2 protilátkami (atd.), a tím vzniknou imunokomplexy, které vytvoří zákal. Nefelometr pak měří rozptyl světla, procházejícího zákalem a přepočítá to na koncentraci imunoglobulinů.
Ale pokud sérum vyšetřovaného pacienta obsahuje výrazně vyšší koncentraci některé IgG podtřídy (např. našeho IgG4), která přesahuji koncentraci protilátek proti IgG4, tak po navázání všech protilátek proti IgG4 na imunoglobulin IgG4 zůstane v roztoku ještě mnoho molekul imunoglobulinu IgG4, na které již nezbyly žádné protilátky proti IgG4, které by se na ně navázaly. A molekuly imunoglobulinu IgG4, na které již nezbyla žádná molekula protilátky proti IgG4, nemohou vytvořit zákal, a tak uniknou měření.
Výsledná koncentrace celkových IgG imunoglobulinů je potom proto nižší než součet koncentrací IgG1 až IgG4. V tomto případě je nutné brát tuto koncentraci celkových IgG imunoglobulinů pouze jako orientační a nelze na ni brát zřetel.
Terapie
Léčba se doporučuje u všech pacientů, kteří mají příznaky, a dále pak u pacientů, kteří vykazující následující postižení na zobrazovacích vyšetřeních:
- vaskulitida aorty,
- retroperitoneální fibróza,
- cholangitida,
- tubulointersticiální nefritida,
- pachymeningitida,
- autoimunitní pankreatitida,
- perikarditida.
Cílem léčby je zabránit dlouhodobé ztrátě funkce orgánů vlivem excesivní fibrózy. Medikamentózní léčbu je možno doplnit i mechanickou intervencí, např. stentováním [35].
V první linii se používají glukokortikoidy. Prednison se podává zpočátku v dávce 30–40 mg denně po dobu 2–4 týdnů, a pak následuje postupné snižování. Celková doba glukokortikoidní léčby se pohybuje mezi 3–6 měsíci.
Po ukončení této 3–6měsíční léčby se uvádí možnost přijít na udržovací dávku 2,5–5 mg denně. Počet recidiv se pohybuje mezi 23–34 %. Agresivnější léčba se doporučuje v případě vysokých hladin IgG4, při multiorgánovém postižení při léčbě recidiv a při postižení proximálních žlučových cest [56].
Glukokortikosteroidy jsou především účinnou léčbou zejména v iniciální, „prefibrotické“ fázi nemoci, přičemž u části nemocných je úspěšná i léčba udržovací.
Z dalších léků se testovaly imunomodulátory, které by pomohly zmenšit dávky glukokortikosteroidů: azathioprin, mykofenolát, 6-mercaptopurin, metotrexát, ale také tacrolimus a cyklofosfamid. Ale tyto léky se ukázaly v monoterapii jako minimální účinné, takže v současnosti se jejich používání v této indikaci nedoporučuje a za jedinou účinnou léčbu se považuje rituximab [56]. Glukokortikoidy nepůsobí cíleně na B-buňky, mají mnohem širší spektrum účinku a nemají potenciál totálně přerušit patologickou imunitní rekci. Léčba protilátkou rituximab však způsobuje v této situaci žádoucí B-buněčnou depleci. Povrchový antigen CD20 se nachází pouze na B-lymfocytech, proto rituximab výrazně sníží jejich počet. Tím se sníží množství buněk, z něhož se mohou rekrutovat IgG4 secernující plazmocyty. Poklesem počtu B-buněk se také sníží jejich možné interakce s regulatorními T-buňkami, a tím se zastaví profibrotická a proinflamatorní imunitní odpověď [57–60].
Léčba rituximabem je indikována u nemocných s kortikorezistencí nebo s intolerancí léčby glukokortikosteroidy. Přínosem léčby rituximabem je okolnost, že vedle deplece B-lymfocytů vede i k depleci cirkulujících IgG4-plazmocytů a cirkulujících plazmoblastů.
Klinické zkušenosti s léčbou rituximabem jsou vysoce pozitivní a celková kumulativní dávka může být menší, než je tomu v indikaci u maligních lymfomů, kde se obvykle používá 8 aplikací v dávce 375/m2. V indikaci IgG4 asociované nemoci je dostačující nižší kumulativní dávka, i když názory na optimální dávku nejsou zatím jednotné.
Na Mayo Clinic podávali 3krát po sobě 375 mg/m2 a dosáhli 83 % léčebných odpovědí. A další klinická studie, v níž byla léčba omezena na dvě aplikace vyšší dávky rituximabu (1000 mg v jedné dávce), dosáhla 97 % remisí [61].
Použití rituximabu pro léčbu IgG4-asociované nemoci je věnováno hodně publikací a z popsaných zkušeností vyplývá, že tato léčba je celosvětově považována za léčbu volby při jakékoliv orgánové lokalizaci s velmi dobrou účinností již od roku 2012. Jsou popsány lokální aplikace při postižení orbity či mening [62–74]. Recidivy této nemoci se uvádějí až 40%.
Sledování efektu léčby
IgG4-asociované onemocnění (IgG4-related disease), je zpravidla FDG-avidní (akumulující FDG) při PET/CT vyšetření, a naopak ve fázi remise lze dokumentovat pokles akumulace FDG. Pro hodnocení rozsahu a aktivity této nemoci je PET/CT vyšetření přínosné, ale pochopitelně je nelze použít pro diferenciální diagnózu mezi nádorovou infiltrací a zánětlivými změnami při IgG4-asociovaném onemocnění. FDG-PET/CT vyšetření umožní přesnější hodnocení vývoje aktivity nemoci než klasické CT nebo MR zobrazení [75–81].
Pokud je zvýšená vstupně koncentrace podtřídy imunoglobulinu IgG4, lze tuto hodnotu použít pro sledování vývoje nemoci v průběhu a po ukončení léčby. Monitorování počtu plazmoblastů v periferní krvi průtokovou cytometrií je taktéž velmi přínosná metoda sledování aktivity nemoci, vyžaduje však speciální vícebarevnou průtokovou cytometrii a zavedené hodnocení počtu plazmocytů a plazmablastů v periferní krvi i v kostní dřeni [55, 82, 83, 84].
ZÁVĚRY PRO PRAXI
- Termín IgG4-associované onemocnění popisuje velmi vzácné onemocnění, které může postihnout prakticky kterýkoliv orgán a způsobí v něm makroskopicky induraci a fibrózu.
- Nemoc může způsobit mimo jiné lymfadenopatii podobnou jako u multicentrické Castlemanově nemoci a diferenciální diagnostika těchto dvou podobných nemocí není jednoduchá.
- Nemoc se vyskytuje obvykle v druhé polovině života, nejčastější postihuje slinivku břišní či slinné žlázy, ale může postihnout člověka od hlavy (pachymeningitida, postižení orbit) až po močový trakt (poškození ledvin a retroperitoneální fibróza) či kůži.
- Při difuzním zvětšení kteréhokoliv orgánu je nutno myslet i na toto onemocnění.
- Histologické vyšetření je základem za předpokladu, že vyšetřující patolog má k dispozici speciální barvení na IgG4 v plazmatických buňkách.
- Zvýšení hladiny podtřídy imunoglobulinu typu IgG4 je důležité, ale není specifické, nelze jej použít ke screeningu, ani k vyloučení diagnózy.
- Onemocní je léčitelné glukokortikosteroidy a antiCD20 protilátkou – rituximabem. Rituximab sice není pro léčbu této nemoc registrován, lze jej ale získat pro léčbu po žádosti na revizní lékaře zdravotních pojišťoven na paragraf 16.
- Podrobné informace o této nemoci lze nalézt na adrese https://www.uptodate.com/contents/overview-off-igg4related-disease/print
Podíl autorů na přípravě rukopisu
AZ – shromáždění jednotlivých částí rukopisu, jeho revize a finalizace
KM, ŠM, ČA, PL – shromažďování odborné literatury, finalizace definitivních formulací
KR, ŘZ – příprava částí rukopisu týkajících se zobrazovacích metod
ChZ – příprava textu o měření subtypů imunoglobulinů
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Publikace vznikla za podpory těchto grantů: MZ ČR – RVO (FNBr, 65269705) MOÚ: MZ ČR – RVO (MOÚ, 00209805) RECAMO: projekt LO 1413.
Do redakce doručeno dne 8. 12. 2017.
Přijato po recenzi dne 2. 2. 2018.
doc. MUDr. Luděk Pour, Ph.D.
Interní hematologická a onkologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno Bohunice
e-mail: pour.ludek@fnbrno.cz
Zdroje
1. Blaho M, Dítě P, Bojková M, et al. Příspěvek k diferenciální diagnostic sklerosující cholangitidy. Vnitř Lék 2017;63(1):50–55.
2. Hrnčíř Z, Laco J. Klinický význam IgG-4 asociované nemoci (IgG4 related disease). Čas Lék Česk 2011;150(8):438–441.
3. Laco J. IgG4-asociovaná systemová skleróza – přehled. Česk Patol 2010;46(4):82–85.
4. Honsová E, Lodererová A, Kostolná E, et al. Autoimunitní pancreatidass postižením biliárních cest a jater jako součást IgG4-asociované autoimunitní sklerozující choroby (IgG4 related autoimmune sclerosing disease). Česk Patol 2010;46(3):65 – 67.
5. Matěj R. Monitor aneb nemělo by vám uniknout, že Wegenerova granulomatóza, co již není Wegenerova granulomatóza, může mít vztah k systémovému onemocnění asociovanému s IgG4. Česko-slov Patol Soudní Lék 2014;50–59(2):60.
6. Matěj R. Monitor aneb nemělo by vám uniknout, že plicní hyalinizující granulom je možná formou systémového sklerotizujícího onemocnění asociovaného s IgG4 Česko-slov Patol Soudní Lék 2012;57–48(4):176.
7. Bojková M, Dítě P, Dvořáčková J. Immunoglobulin G4, autoimmune pancreatitis and pancreatic cancer. Digestive Diseases 2015;33(1):86–90.
8. Danningerová-Molnárová A. Autoimunitná pankreatitída. Interná medicína 2012;12(4):172–176.
9. Dítě P, Husová L, Lukás Z, et al. Immunoglobulin IG4-asociovaná cholangitida. Vnitř Lék 2010;56(8):824 – 826.
10. Dítě P, Novotný I, Kianička P. Imunologlobulin IgG4 associovaná onemocnění. Gastroenterol pre prax 2011;10(3):151–152.
11. Dítě P, Novotný I, Kinkor Z. Autoimunní forma chronické pankreatitidy a IgG4 pozitivní mastitida. Gastroenterol Hepatol 2011;65(1):22–25.
12. Dítě P, Novotný I, Lata J, et al. Autoimunitní pankreatitida a IgG4 pozitivní sklerotizující cholangitida. Vnitřní Lék 2011;57(3):254–257.
13. Drahoš J, Vyhnálek P. Imunoglobulin G4 asociovaná sklerozující cholangitida u pacienta s Crohnovou nemocí. Gastroenterol Hepatol 2017;71(1):49–52.
14. Hrnčíř Z, Laco J, Slezák R. Mikuliczova choroba s jednostranným exoftalmem – onemocnění se vztahem k IgG4. Česká Revmatol 2011;19(3):125–130.
15. Hybášková J, Zeleník K, Urban O. Manifestace IgG4 asociované nemoci v oblasti hlavy a krku. Otorinolaryngol Foniatrie 2015;64(3):163–167.
16. Laco J, Podhola M, Kamarádová K. Idiopathic vs. secondary retroperitoneal fibrosis: a clinicopathological study of 12 cases, with emphasis to possible relationship to IgG4-related disease. Virchows Archiv 2013;463(5):721–225
17. Laco J, Örhalmi J, Bártová J. Enterocolic lymphocytic phlebitis as a newly recognized manifestation of IgG4-related disease. Intern J Surg Pathol 2015;23(2):165–169.
18. Laco J. Monitor aneb nemělo by vám uniknout, že IgG4 choroba se může v oblasti hlavy a krku manifestovat jako tumoriformní slizniční léze. Česko-slov Patol Soudní Lék 2013;49–58(4):111.
19. Laco J. Systémová sklerozující choroba spojená s imunoglobuliny IgG4 – současné poznatky. Česko-slov Patol Soudní Lék 2010;46-55(4):82–85.
20. Losse S, Žurková M. Plicní projevy nemoci asociované s IgG4. Postgrad Med 2017;19(Příl. 2):120–128.
21. Merta M. Klinický obraz onemocnění ledvin asociovaných s IgG4. Postgrad Nefrol 2013;11(2):26–27.
22. Mikulová Š, Jílek D, Richter J. Nemoc asociovaná s IgG4. Úvod, patogeneze, diagnostika. Alergie 2015;17(1):16–24.
23. Mikulová Š, Jílek D, Richter J. Nemoc asociovaná s IgG4. Klinický obraz, orgánová postižení a terapie. 2. část. Alergie 2015;17(2):91–99.
24. Novotný I, Dítě P, Trna J. Immunoglobulin G4-related cholangitis: a variant of IgG4-releated systemic disease. Digestive Dis 2012;30(2):216–219.
25. Průcha M, Sedláčková L. Onemocnění asociovaná s IgG4 – pacient s mnohočetným orgánovým postižením. Med Promoci 2016;17(1):70–71.
26. Dítě P, Novotný I, Kala Z, et al. Pozitivita imunoglobulinu IgG4 v krevním séru u osob s karcinomem slinivky břišní. Gastroenterol Hepatol 2012;66(3):187–190.
27. Průcha M, Czinner R. IgG4-related diseases – a rare polycystic form of Ormond‘s disease. Prague Med Rep 2016;117(2-3):124–128.
28. Šteiner I, Laco J. IgG4-related disease of the aortic valve. Cardiovasc Pathol 2015;24(4):264.
29. Vaňásek J, Hoffmann P, Laco J, et al. IgG4 asociovaná pankreatitida a cholangoitida Česká Radiol 2014;68(4):294–297.
30. Mikulicz J. Über eine eigenartige symmetrishe erkrankung der Tranen und Mundspeicheldrüsen. Beitr Chir Festschr Theodor Billroth 1892 : 610–630.
31. Hamano H, Kawa S, Horiuchi A, et al. High serum IgG4 concentrations in patients with sclerosing pancreatitis. N Engl J Med 2001;44 : 732–788.
32. Sarles H, Sarles JC, Muratore R et al. Chronic inflammatory sclerosis of the pancreas – an autonomous pancreatic disease? Am J Dig Dis 1961;6 : 688–698.
33. Umehara H, Okazaki K, Masaki Y, et al. A novel clinical entity, IgG4-related disease (IgG4RD): general concept and details. Mod Rheumatol 2012;22 : 1–14.
34. Stone JH, Khosroshahi A, Deshpande V, et al. Recommendations for the nomenclature of IgG4-related disease and its individual organ system manifestations. Arthritis Rheum 2012;64 : 3061–3067.
35. Khosroshahi A, Wallace ZS, Crowe JL, et al. International consensus guidance statement on the management and treatment of IgG4-related disease. Arthritis Rheumatol 2015;67 : 1688–1699.
36. Stone JH, Zen Y, Deshpande V. IgG4-related disease. N Engl J Med 2012;366 : 539–551.
37. Kleger A, Seufferlein T, Wagner M, et al. IgG4-related autoimmune diseases: polymorphous presentation complicates diagnosis and treatment. Dtsch Arztebl Int 2015;112 : 128–135.
38. Nirula A, Glaser SM, Kalled SL, et al. What is IgG4? A review of the biology of a unique immunoglobulin subtype. Curr Opin Rheumatol 2011;23 : 119–124.
39. Okazaki K, Umehara H. Are classification criteria for IgG4-RD now possible? The concept of IgG4-related disease and proposal of comprehensive diagnostic criteria in Japan. Int J Rheumatol 2012 : 3570–3571.
40. Chen Y, Zhao J, Feng R, et al. Types of organ involvement in patients with immunoglobulin G4-related disease. Chin Med J (Engl) 2016;129(13):1525–1532.
41. Fernández-Codina A, Martínez-Valle F, Pinilla B, et al. IgG4-related disease: results from a multicenter Spanish registry. Medicine (Baltimore) 2015;94(32):e1275.
42. Inoue D, Yoshida K, Yoneda N, et al. IgG4-related disease: dataset of 235 consecutive patients. Medicine (Baltimore) 2015;94:e680.
43. Kanno A, Masamune A, Okazaki K, et al. Nationwide epidemiological survey of autoimmune pancreatitis in Japan in 2011. Pancreas 2015;44 : 535–539.
44. Yadav D, Notahara K, Smyrk TC, et al. Idiopathic tumefactive chronic pancreatitis: clinical profile, histology, and natural history after resection. Clin Gastroenterol Hepatol 2003;1 : 129–135.
45. Kamisawa T, Zen Y, Pillai S, et al. IgG4-related disease. Lancet 2015;385 : 1460–1471.
46. Stone JH, Zen Y, Deshpande V. IgG4-related disease. N Engl J Med 2012;366 : 539–551.
47. Carruthers MN, Khosroshahi A, Augustin T, et al. The diagnostic utility of serum IgG4 concentrations in IgG4-related disease. Ann Rheum Dis 2015;74 : 14–18.
48. al Zahrani H, Kyoung KT, Khalili K, et al (2014) IgG4-related disease in the abdomen: a great mimicker. Semin Ultrasound CT MR 2014;35 : 240–254.
49. Shimosegawa T, Chari ST, Frulloni L, et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the international association of pancreatology. Pancreas 2011;40 : 352–358.
50. Ohara H, Okazaki K, Tsubouchi H, et al. Clinical diagnostic criteria of IgG4-related sclerosing cholangitis 2012. J Hepatobiliary Pancreat Sci 2012;19 : 536–542.
51. Masaki Y, Sugai S, Umehara H. IgG4-related diseases including Mikulicz’s disease and sclerosing pancreatitis: diagnostic insights. J Rheumatol 2010;37 : 1380–1385.
52. Kawano M, Saeki T, Nakashima H, et al. Proposal for diagnostic criteria for IgG4-related kidney disease. Clin Exp Nephrol 2011;15 : 615–626.
53. Kamisawa T, Chari ST, Giday SA, et al. Clinical profile of autoimmune pancreatitis and its histological subtypes: an international multicenter survey. Pancreas 2011;40 : 809–814.
54. Maillette De Buy Wenniger LJ, Doorenspleet ME, et al. Immunoglobulin G4+ clones identified by next-generation sequencing dominate the B cell receptor repertoire in immunoglobulin G4 associated cholangitis. Hepatology 2013;57 : 2390–2398.
55. Wallace ZS, Mattoo H, Carruthers M, et al. Plasmablasts as a biomarker for IgG4-related disease, independent of serum IgG4 concentrations. Ann Rheum Dis 2015;74 : 190–195.
56. Hart PA, Topazian MD, Witzig TE, et al. Treatment of relapsing autoimmune pancreatitis with immunomodulators and rituximab: the Mayo Clinic experience. Gut 2013;62 : 1607–1615.
57. Gu WJ, Zhang Q, Zhu J, et al. Rituximab was used to treat recurrent IgG4-related hypophysitis with ophthalmopathy as the initial presentation: A case report and literature review. Medicine (Baltimore) 2017;96(24):e6934.
58. Mochizuki H, Kato M, Higuchi T, et al. Overlap of IgG4-related disease and multicentric Castleman’s disease in a patient with skin lesions. Intern Med 2017;56(9): 1095–1099.
59. Aouidad I, Schneider P, Zmuda M, et al. IgG4-related disease with orbital pseudotumors treated with rituximab combined with palpebral surgery. JAMA Dermatol 2017;153(3):355–356.
60. Wallace ZS, Mattoo H, Mahajan VS, et al. Predictors of disease relapse in IgG4-related disease following rituximab. Rheumat (Oxford) 2016;55(6):1000–1008.
61. Carruthers MN, Topazian MD, Khosroshahi A, et al. Rituximab for IgG4-related disease: a prospective, open-label trial. Ann Rheum Dis 2015;74(6):1171–1177.
62. Berta AI, Agaimy A, Braun JM, et al. Bilateral orbital IgG4-related disease with systemic and corneal involvement showing an excellent response to steroid and rituximab therapy: report of a case with 11 years follow-up. Orbit 2015;34(5):299–301.
63. McMahon BA, Novick T, Scheel PJ, et al. Rituximab for the treatment of IgG4-related tubulointerstitial nephritis: case report and review of the literature. Medicine (Baltimore) 2015;94(32):e1366.
64. Gillispie MC, Thomas RD, Hennon TR. Successful treatment of IgG-4 related sclerosing disease with rituximab: a novel case report. Clin Exp Rheumatol 2015;33(4):549–550.
65. Yamamoto M, Awakawa T, Takahashi H. Is rituximab effective for IgG4-related disease in the long term? Experience of cases treated with rituximab for 4 years. Ann Rheum Dis 2015;74(8):e46.
66. Wu A, Andrew NH, Tsirbas A, et al. Rituximab for the treatment of IgG4-related orbital disease: experience from five cases. Eye (Lond) 2015;29(1):122–128.
67. Savino G, Battendieri R, Siniscalco A, et al. Intraorbital injection of rituximab in idiopathic orbital inflammatory syndrome: case reports. Rheumatol Int 2015;35(1):183–188.
68. Chen TS, Figueira E, Lau OC, et al. Successful “medical” orbital decompression with adjunctive rituximab for severe visual loss in IgG4-related orbital inflammatory disease with orbital myositis. Ophthal Plast Reconstr Surg 2014;30(5):e122–125.
69. Jalilian C, Prince HM, McCormack C, et al. IgG4-related disease with cutaneous manifestations treated with rituximab: case report and literature review. Australas J Dermatol 2014;55(2):132–136.
70. Caso F, Fiocco U, Costa L, et al. Successful use of rituximab in a young patient with immunoglobulin G4-related disease and refractory scleritis. Joint Bone Spine 2014;81(2):190–192.
71. Ebbo M, Grados A, Guedj E, et al. Usefulness of 2-[18F]-fluoro-2-deoxy-D-glucose-positron emission tomography/computed tomography for staging and evaluation of treatment response in IgG4-related disease: a retrospective multicenter study. Arthritis Care Res (Hoboken). 2014;66(1):86–96.
72. Murakami J, Matsui S, Ishizawa S, et al. Recurrence of IgG4-related disease following treatment with rituximab. Mod Rheumatol 2013;23(6):1226–1230.
73. Khosroshahi A, Carruthers MN, Deshpande V, et al. Rituximab for the treatment of IgG4-related disease: lessons from 10 consecutive patients. Medicine (Baltimore) 2012;91(1):57–66.
74. Khosroshahi A, Bloch DB, Deshpande V, et al. Rituximab therapy leads to rapid decline of serum IgG4 levels and prompt clinical improvement in IgG4-related systemic disease. Arthritis Rheum 2010;62(6):1755–1762.
75. Kashiwagi N, Enoki E, Hosokawa C, et al. 18F-FDG PET/CT features of chronic sclerosing sialadenitis presenting as localized IgG4-related disease. Clin Nucl Med 2017;42(2):131–132.
76. Fu Z, Liu M, Zhang J, et al. IgG4-related renal lesions detected by delayed 18F-FDG PET/CT scan. Clin Nucl Med 2017;42(1):66–67.
77. Ichiki A, Hashimoto N, Ueda T, et al. IgG4-related disease with bone marrow involvement. Intern Med 2016;55(16):2295–2299.
78. Lee J, Hyun SH, Kim S, et al. Utility of FDG PET/CT for differential diagnosis of patients clinically suspected of IgG4-related disease. Clin Nucl Med 2016;41(5):e237–243.
79. Zhao Z, Wang Y, Guan Z, et al. Utility of FDG-PET/CT in the diagnosis of IgG4-related diseases. Clin Exp Rheumatol 2016;34(1):119–125.
80. Lauwyck J, Piette Y, Van Walleghem L, et al. IgG4-related disease: The utility of (18)F-FDG PET/CT in diagnosis and treatment. Hell J Nucl Med 2015;18(Suppl 1):155–159.
81. Zhang J, Chen H, Ma Y, et al. Characterizing IgG4-related disease with ¹⁸F-DG PET/CT: a prospective cohort study. Eur J Nucl Med Mol Imaging 2014;41(8):1624–1634.
82. Kase S, Ishijima K, Uraki T, et al. Usefulness of flow cytometry in diagnosis of IgG4-related ophthalmic disease and extranodal marginal zone B-cell lymphoma of the ocular adnexa. Anticancer Res 2017;37(9):5001–5004.
83. Lin W, Zhang P, Chen H, et al. Circulating plasmablasts/plasma cells: a potential biomarker for IgG4-related disease. Arthritis Res Ther 2017;19(1):25–26.
84. Wallace ZS, Deshpande V, Mattoo H, et al. IgG4-related disease: clinical and laboratory features in one hundred twenty-five patients. Arthritis Rheumatol 2015;67(9):2466–2475.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2018 Číslo 2- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Predikce vzniku inhibitoru faktoru VIII v kohortě SIPPET pomocí analýzy mutací a měření antigenu faktoru VIII
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Automatizované promývání transplantátů krvetvorných buněk pro autologní použití
- Život ohrožující orgánové infiltrace u akutní myeloidní leukemie – kazuistiky
- Léčba vitaminem C obnovuje nedostatek enzymové aktivity TET2 a přispívá k senzitivitě buněk vůči inhibitorům PARP
- Obinutuzumab dosáhl v kombinaci s chlorambucilem ve srovnání s rituximabem zlepšení celkového přežití komorbidních pacientů s chronickou lymfocytární leukemií: finální analýza přežití ve studii CLL11
- 100. výročí založení Československé republiky – vzpomínky hematologa
- Prof. MUDr. Milan Bláha, CSc., osmdesátníkem
- Doc. MUDr. Adela Bártová, CSc. (1927–2018)
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
- Srovnatelná účinnost přímých antikoagulancií a warfarinu u pacientů s rakovinou a fibrilací předsíní
- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



