-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Automatizované promývání transplantátů krvetvorných buněk pro autologní použití
Automated washing of autologous haematopoietic stem cell grafts
Introduction: High-dose chemotherapy with autologous transplantation of haematopoietic stem cells represents a standard treatment of various haematological malignancies. Prerequisites for successful transplantation include collection of a sufficient number of haematopoietic stem cells, their processing, cryopreservation, and storage guaranteeing their complete viability until transplant. To maintain viability of haematopoietic stem cells, it is necessary to use a cryoprotective agent for cryopreservation. Dimethyl sulfoxide is the most commonly used cryoprotective agent, typically at a concentration of 10% in the grafts. Reinfusion of hematopoietic stem cells containing dimethyl sulfoxide is frequently associated with toxicity. Complications could be prevented by removing dimethyl sulfoxide from the grafts by washing these before infusion to the patient. Nowadays, automatic washing devices are available offering standardized washing of grafts in closed systems. Compared to manual techniques, the main advantages of these devices are: better efficacy, higher viability of haematopoietic cells, significant reduction of labour, negligible probability of microbial contamination. In 2014, one of these devices, Sepax 2, was purchased by our department.
Patients and methods: Grafts from 5 patients (males, 42–67 years) treated for multiple myeloma (n = 4) and Hodgkin’s lymphoma (n = 1) were thawed and washed before reinfusion using the Sepax 2 (Biosafe S.A. Eysins, Switzerland) automated washing device. Quality controls were performed before cryopreservation and after washing: blood count, cell vitality, number of CD34+ cells and number of CFU-GM (colony-forming units – granulocyte/macrophage).
Results: Concentration of dimethyl sulfoxide before washing of the grafts was 10%, and 0.65% after (0.35–0.69%); recovery of CD34+ cells after washing was 94% (34.57–105.30%); recovery of CFU-GM was 56% (45.14–99.90%); vitality was 85% (78–89%) – the results are listed as median and range. The graft volumes were decreased after washing by 31% (28–42%) compared to the original volumes. Administration of washed grafts was very simple. Patients reported only insignificant inconvenience associated with the transplantations and no significant adverse events were observed. No delay in engraftment was observed: leukocytes > 1 x 109/l day +11, granulocytes > 0,5 x 109/l day +11, PLT > 20 x 109/l day +13 (medians).
Conclusions: The washing of thawed cryopreserved autologous grafts provided required graft volume reduction. The decrease of CD34+ and CFU-GM cells during washing was not significant, cell vitality was satisfactory and the reinfusion of washed grafts was not associated with significant subjective or objective complaints. We conclude that the washing-out of DMSO from grafts using an automated device is feasible and beneficial for both the patients and the staff. The automated washing of dimethyl sulfoxide-containing grafts could be recommended, especially in patients who require lower volumes of reinfused cells.
key words
autologous transplant – haematopoietic stem cell – HSC – Sepax 2 – dimethylsulfoxide – DMSO
Autoři: L. Adamusová 1,2; Z. Kořístek 1,3; J. Smejkalová 1; M. Navrátil 1,3; L. Grebeníček 1; I. Tvrdá 1; M. Michaliková 1; R. Hájek 1,3
Působiště autorů: Klinika hematoonkologie, Fakultní nemocnice Ostrava 1; Katedra biologie a ekologie, Přírodovědecká fakulta, Ostravská univerzita 2; Lékařská fakulta, Ostravská univerzita 3
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 2, p. 115-122.
Kategorie: Původní práce
Souhrn
Úvod:
Vysokodávkovaná chemoterapie s autologní transplantací krvetvorných buněk je standardní součástí léčby u řady hematologických malignit. Základní podmínkou pro úspěšnou transplantaci je získání dostatečného počtu krvetvorných buněk a takové zpracování, zamrazení a uskladnění transplantátu, které zaručí zachování plné viability krvetvorných buněk až do okamžiku jejich převodu příjemci. Pro zachování životnosti hematopoetických buněk během kryoprezervace je nezbytné používat kryoprotektivní činidlo. V současné době se jako hlavní nebo výhradní kryoprotektivní činidlo používá dimethylsulfoxid, jehož výsledná koncentrace v transplantátech je nejčastěji 10%. Převod transplantátu hematopoetických buněk obsahujícího dimethylsulfoxid je u příjemců často spojeno s projevy toxicity. Nežádoucí účinky dimethylsulfoxidu lze eliminovat pomocí promytí transplantátu před jeho podáním pacientovi. V současnosti jsou dostupné automatizované promývací systémy, které umožňují standardizované promývání transplantátů v uzavřeném systému. Oproti manuálním technikám se tyto systémy vyznačují: nižšími ztrátami a vyšší viabilitou hematopoetických buněk, výrazným snížením pracnosti a také menší pravděpodobností mikrobiální kontaminace štěpů. V roce 2014 byl jeden z těchto přístrojů, Sepax 2, pořízen na naše pracoviště.
Pacienti a metody:
Transplantáty od 5 pacientů (muži, 42–67 let), kteří byli léčeni pro mnohočetný myelom (n = 4) a Hodgkinův lymfom (n = 1), byly těsně před převodem po rozmrazení promyty pomocí automatizovaného systému Sepax 2 (Biosafe S. A. Eysins, Švýcarsko). V rámci kontroly kvality bylo před zamrazením a po promytí provedeno: stanovení krevního obrazu, viability buněk, obsahu CD34+ buněk a CFU-GM (colony-forming units – granulocyte/macrophage).
Výsledky:
Koncentrace dimethylsulfoxidu před promytím štěpů byla 10%, po promytí 0,65 % (0,35–0,69 %), zůstatek CD34+ buněk po promytí byl 94% (34,57–105,3 %), zůstatek CFU-GM byl 56 % (45,14–99,9 %), viabilita po promytí byla 85 % (78–89 %) – výsledky jsou uvedeny jako medián a rozsah od-do. Objem transplantátů po promytí byl 31 % (28–42 %) původního objemu. Převody štěpů proběhly zcela hladce, pacienti uváděli jen zanedbatelné subjektivní obtíže spojené s podáním transplantátů a rovněž nebyly zaznamenány žádné vážné nežádoucí reakce. K restituci krevního obrazu, a tedy krvetvorby, došlo v obvyklém časovém intervalu od podání štěpu: leukocyty >1 x 109/l den +11, granulocyty > 0,5 x 109/l den + 11, PLT > 20 x 109/l den +13 (mediány).
Závěr:
Promytí rozmražených kryokonzervovaných autologních transplantátů zajistilo požadovanou redukci jejich objemu, během promytí nedošlo k významnému poklesu počtů CD34+ buněk a CFU-GM, viabilita buněk byla uspokojivá a převod promytých štěpů nebyl u pacientů spojen se subjektivními a objektivními potížemi. Závěrem tedy konstatujeme, že vymývání dimethylsulfoxidu z transplantátů automatizovaným zařízením je snadno proveditelné a přínosné jak pro pacienty, tak pro personál. Automatické promývání transplantátů obsahujících dimethylsulfoxid bylo doporučeno zejména u těch pacientů, kteří vyžadují redukci štěpů.
Klíčová slova:
autologní transplantace – krvetvorné buňky – HSC – Sepax 2 – dimethylsulfoxid – DMSO
ÚVOD
Vysokodávkovaná chemoterapie následovaná autologní transplantací krvetvorných buněk je standardně používaným léčebným postupem pro některé typy hematoonkologických malignit. Hematopoetické buňky (HC) jsou získávány leukaferézou z periferní krve po mobilizaci růstovými faktory pro granulocyty (G-CSF) nebo granulocyty a makrofágy (GM-CSF) [1]. Výsledný produkt sběru je poté zpracován v laboratoři, dochází k úpravě jeho objemu, přidání kryoprotektivní směsi, zamrazení a uskladnění až do doby podání.
Klíčovým krokem při zpracování transplantátů HC je zamrazení na teplotu -150 °C a nižší, což umožňuje jejich kryoprezervaci neboli časově téměř neomezené skladování vitálních štěpů HC v kapalné či plynné fázi tekutého dusíku při teplotě -196 až -150 °C. Během pomalého zamrazování však dochází k tvorbě ledových krystalů v extracelulárním prostoru, což vede ke zvýšení extracelulární osmolarity, výraznému nárůstu gradientu osmolarity mezi intra - a extracelulárním prostorem, úniku vody z buněk a k následnému poškození buněk jejich dehydratací. Tento nežádoucí jev lze minimalizovat použitím kryoprotektivních činidel. V současnosti se až na výjimky jako kryoprotektivní činidlo používá dimethylsulfoxid (DMSO), hygroskopická polární látka, která velice snadno proniká buněčnou membránou do intracelulárního prostoru. DMSO v používaných výsledných koncentracích (5–10 %) vyrovnává osmolaritu mezi intra - a extracelulárním prostorem a chrání buňky před poškozením dehydratací [2–4].
Po kryogenním zamrazení jsou transplantáty s HC skladovány při teplotě nižší než -150 °C až do použití pro transplantaci pacientovi. Na většině pracovišť jsou transplantáty rozmraženy ve vodní lázni při 37 °C bezprostředně těsně před podáním příjemci a aplikovány nitrožilně pomocí katétru zavedeného do centrální žíly. Vlastní převod rozmražených transplantátů HC bývá často spojen s nežádoucími reakcemi. Většina z nich je připisována právě DMSO, jehož toxicita je dobře známá [2]. Mezi nežádoucí účinky DMSO patří zejména nepříjemná pachuť v ústech, bolest v krku, dráždění ke kašli, nevolnost, bolest hlavy a návaly horka. Mezi závažnější projevy toxicity DMSO řadíme především zvracení, křečovité bolesti v břiše, hypotenzi, hypertenzi, bradykardii, tachykardii [5–7]. Byly popsány i velmi závažné nežádoucí reakce: těžká srdeční arytmie vedoucí k srdeční zástavě [8], závažná hypoventilace vedoucí k zástavě dechu [9], přechodná globální amnézie, cévní mozková příhoda [10] a epileptický záchvat [11]. Nežádoucí účinky související s aplikací rozmražených transplantátů HC nejsou pouze důsledkem toxicity DMSO. Nežádoucí efekty vyvolává rovněž přítomnost rozpadlých a mrtvých buněk, především granulocytů, které jsou výrazně náchylnější k osmotickému stresu než lymfocyty a HC. Granulocyty se při manipulaci s transplantátem snadno a rychle poškozují a rozpadají, větší množství DNA z rozpadlých buněk může zvyšovat viskozitu transplantátu a vést k agregaci buněk [4, 12, 13].
Výše uvedené problémy vedly k hledání řešení, jak se vypořádat s toxicitou DMSO a snížit frekvenci nežádoucích reakcí. Jednou z možností je používat při zamrazování transplantátů HC nižší koncentraci DMSO. Z výsledků vyplývá, že při použití 5% a 7,5% koncentrace DMSO dochází ke snížení nežádoucích reakcí [3]. Další z možností je transplantát před podáním pacientovi promýt. Dodnes stále používanou metodou je manuál-ní promytí štěpu po rozmražení s použitím běžné centrifugace [14]. Při procesu ale může dojít ke shlukování buněk a jejich významným ztrátám, podstatně se rovněž zvyšuje riziko mikrobiální kontaminace štěpu.
Nejmodernějším přístupem je promývání transplantátů po rozmražení pomocí automatizovaných přístrojů, mezi které patří zařízení CytoMate, Sepax a Cobe 2991 [1, 15, 16]. Ze srovnání manuální metody a automatizovaného promytí pomocí zařízení Sepax vyplynulo, že přístrojová metoda přináší signifikantně lepší výsledky, především pokud se týká zachování počtu leukocytů, CD34+ buněk a CFU-GM [1]. Navíc v případě přístrojové techniky odpadá riziko kontaminace štěpu, protože se jedná o uzavřený systém.
S cílem zlepšit péči o nemocné a snížit rizika spojená s převodem autologních transplantátů HC zejména u starších a polymorbidních pacientů byl v roce 2014 ve Fakultní nemocnici Ostrava pořízen přístroj Sepax 2 pro automatizované promývání transplantátů po rozmražení. Přístroj Sepax 2 pracuje na centrifugačním principu, kdy dochází k separaci jednotlivých komponent v centrifugační komoře a následnému rozdělení jednotlivých vrstev do různých vaků pomocí přesměrovávání ventilů a posunu pístu, který je součástí centrifugační komory. Proces je automatizovaný a pro řízení využívá vyhodnocování opticky detekovaného obsahu hadiček v klíčových místech setu. Výsledný objem promytého produktu lze nastavit v rozmezí 50–200 ml (protokol od výrobce doporučuje 100 ml). Validace přístroje a metody potvrdila, že promytí transplantátů nevede k významnému snížení počtu a viability leukocytů, CD34+ buněk a CFU-GM. Výsledky validace metody byly prezentovány formou posteru na EBMT 2016 (European Society for Blood and Marrow Transplantation) [17]. Předkládaná publikace shrnuje zkušenosti, které jsme získali jako první pracoviště v České republice při promytí a následném převodu autologních transplantátů HC u pěti pacientů.
SOUBOR NEMOCNÝCH A METODY
Promytí transplantátů bylo indikováno a provedeno u pěti pacientů léčených pro mnohočetný myelom a Hodgkinův lymfom ve věku od 42 do 67 let, podrobnější demografická data jsou uvedena v tabulce 1. Kritéria pro indikaci k promytí byla zvolena na základě zkušeností s nežádoucími reakcemi při převodu transplantátů: indikované podání 3 a více kryovaků (odpovídá objemu 360 ml suspenze a 36 ml DMSO), nebo koncentrace sérového kreatininu před transplantací větší než 130 µmol/l. U jednoho pacienta jsme indikovali promytí transplantátu pro zvýšené riziko závažnosti případných nežádoucích reakcí při standardním převodu transplantátu (progrese základního onemocnění, chronická ischemická choroba srdeční s nemocí dvou tepen, vyšší arytmogenní pohotovost, lehká renální insuficience atd.) přesto, že nesplnil přijatá kritéria pro indikaci promytí. U tří pacientů se jednalo o druhou autologní transplantaci, u dvou o první transplantaci. Všichni pacienti byli podrobně seznámeni s účelem promytí, metodou a očekávaným přínosem a podepsali informovaný souhlas s převodem transplantátů.
Tab. 1. Přehled kohorty pacientů 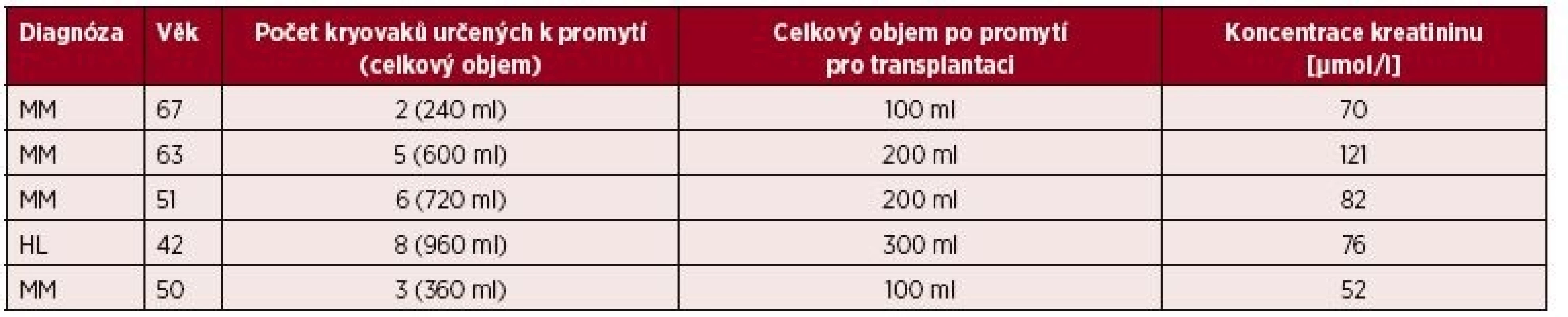
MM – mnohočetný myelom, HD – Hodgkinova choroba Zpracování a kryogenní zamražení transplantátu
Transplantáty, produkty leukaferézy, byly kryogenně zamrazeny do 24 hodin od ukončení aferézy. Výsledná koncentrace DMSO v zamrazených štěpech byla 10 % a objem transplantátu v jednom kryovaku byl 120 ml. Kryovaky byly vloženy do sekundárního obalu (OriGen Biomedical GmbH, Burladingen, Německo), který byl uzavřen svarem a umístěn do terciárního obalu (kovová kazeta). Kontrolované zamrazení bylo realizováno naprogramovaným tempem v zamrazovači Ice Cube 14S (SY-LAB Geräte GmbH, Neupurkersdorf, Rakousko) na teplotu -156 °C. Kryovaky s transplantáty byly uskladněny v terciárních obalech v kryogenních kontejnerech v plynné fázi tekutého dusíku.
Rozmrazení a promytí transplantátů
Pro promývání transplantátů pomocí přístroje Sepax 2 byl použit set CS-600.1. (Biosafe S.A. Eysins, Switzerland), který byl v laminárním boxu napojen na vak obsahující promývací roztok a vak určený pro promytý produkt. Kryovaky s transplantáty určenými k promytí byly přeneseny při teplotě nižší než -150 °C do laboratoře a rychle rozmraženy ve vodní lázni při 37 °C standardizovaným způsobem, přičemž teplota rozmražených transplantátů nepřekročila 4 °C. Po rozmražení byly kryovaky sterilně napojeny na promývací set a byl spuštěn program Smart Wash, který je specificky navržen pro promývání transplantátů HSC. Složení promývacího roztoku (objemové poměry): 5% lidský albumin = 50 % (Grifols, Barcelona, Španělsko), fyziologický roztok = 42 % (B. Braun Melsungen AG, Hessen, Německo), citrátový roztok ACD-A = 8 % (Fresenius Kabi, Bad Homburg, Německo). Pokud bylo potřebné promýt další transplantát, postupovalo se obdobně. Po ukončení promývání byl vak s promytým produktem odpojen od zbytku promývacího setu a po odběru vzorků na vyšetření kvality byl transportován při teplotě 4–8 °C k podání příjemci, které probíhalo na monitorovaném lůžku.
Vyšetření kvality
Krevní obrazy byly stanoveny pomocí analyzátoru Sysmex XN-9000 DI-60 (Sysmex Corporation, Japonsko). Zastoupení CD34+ buněk bylo stanoveno pomocí přístroje Navios firmy Beckman Coulter (Beckman Coulter Life Sciences, Indianapolis, USA), použité monoklonální protilátky (anti-CD34 a anti-CD45) byly od BD Biosciences (San Jose, CA, USA). Koncentrace CFU-GM byla stanovena pomocí standardní kultivační techniky s využitím kompletního polotuhého média (Methocult GF84434, Stem Cell Technologies, Vancouver, British Columbia, Kanada). Viabilita byla stanovena jako procentuální podíl mrtvých a živých buněk, hodnoceno mikroskopicky pomocí Bürkerovy komůrky, jako barvivo použita trypanová modř (Stem Cell Technologies, Vancouver, British Columbia, Kanada).
VÝSLEDKY
Promývání bylo prováděno podle standardní a validované procedury (na validaci bylo vázáno povolení činnosti ze strany SÚKLu). Doba promytí jednoho vaku, včetně rozmrazení a manipulace v laminárním boxu, byla 50 minut. Parametry kvality transplantátů před zamrazením a po promytí jsou uvedeny v tabulce 2. Efektivita promývání byla vysoká a současně nedošlo k zásadním ztrátám cílových buněk. Promyté transplantáty obsahovaly 94,4 % CD34+ buněk (medián) přítomných v transplantátech před zamražením a 56,2 % CFU-GM (medián).
Tab. 2. Výsledky vyšetření kvality transplantátů před zamrazením a po promytí 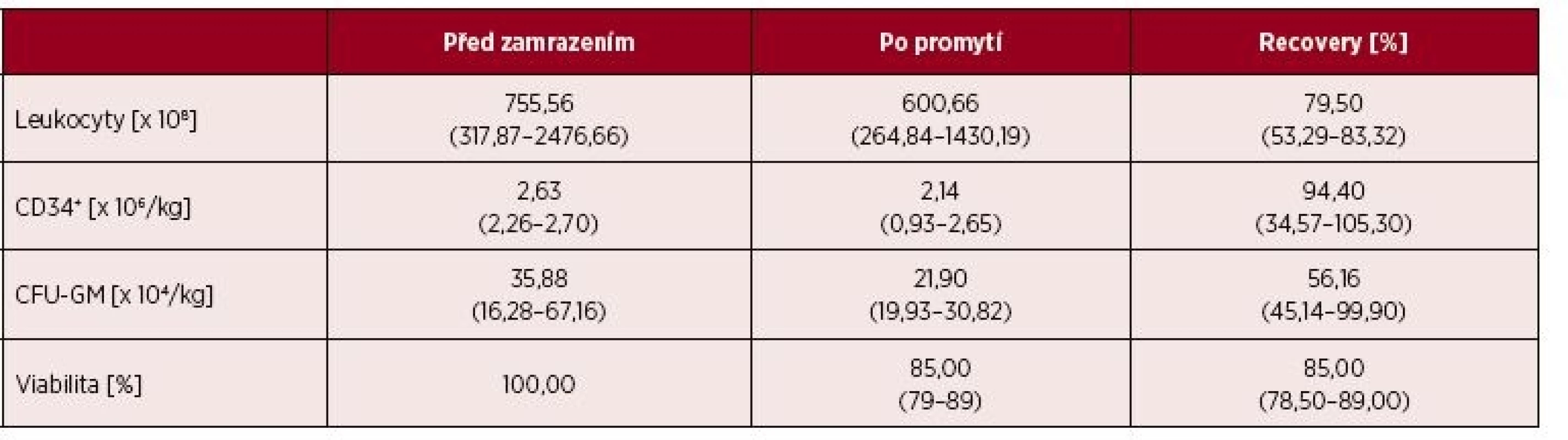
*Hodnoty jsou uvedeny jako medián (od – do) Stanovení počtu CD34+ buněk po rozmrazení není na našem pracovišti prováděno. U čerstvě rozmražených buněk se můžeme často setkávat s nedostatečnou nebo nespecifickou vazbou protilátek na antigeny na jejich povrchu a to může vést ke zkreslení výsledků. Z toho důvodu zde jsou porovnávány výsledky metody před zamrazením a po promytí. Uvedená variabilita měřených CD34+ po promytí v tabulce 2, je způsobena nepřesností měření z důvodu velmi nízké relativní koncentrace CD34+ buněk u daného dárce, který byl případem špatně mobilizovatelného dárce (tzv. „poor mobilizer“), kdy i minimální subjektivní změna odečtení CD34+ znamenala významnou změnu v jejich celkovém počtu.
Počty CFU-GM sice byly v porovnání s výsledky kultivací před zamražením nižší, ale to je obvyklý výsledek kultivačního vyšetření z rozmražených vzorků HC. Na tomto místě je potřebné zdůraznit, že standardní kultivační vyšetření počtů CFU-GM ze vzorků transplantátů uchovávaných v kryotubách (s manuálním vymytím DMSO) dosahovalo přibližně poloviční hodnoty ve srovnání s promytými transplantáty: počet CFU-GM zjištěných ve vzorcích z kryotub oproti hodnotě před zamražením byl 28,2–63,9 %, počet CFU-GM zjištěných z promytých transplantátů byl 45,1–99,9 % hodnoty před zamražením.
Použití promytých trans-plantátů nemělo za následek oddálení obnovy krvetvorby. Absolutní doba neutropenie, tedy počet dnů s granulocyty pod 500/µl, se pohybovala od šesti do devíti dnů. Počty dnů potřebných k dosažení jednotlivých sledovaných parametrů krevního obrazu jsou pro všechny pacienty uvedeny v grafu 1.
Graf 1. Parametry obnovy krevního obrazu
WBC – leukocyty [x 109/l]; GRN – granulocyty [x 109/l] a PLT – trombocyty [x 109/l] U pacienta č. 1 k poklesu koncentrace trombocytů pod 20 x 109/l nedošlo.![Parametry obnovy krevního obrazu <br>WBC – leukocyty [x 109/l]; GRN – granulocyty [x 10<sup>9</sup>/l] a PLT – trombocyty [x 10<sup>9</sup>/l] U pacienta č. 1 k poklesu koncentrace trombocytů pod 20 x 10<sup>9</sup>/l nedošlo.](https://pl-master.mdcdn.cz/media/image_pdf/a90f19f882ad4dffc3216a3a8e5fa108.jpeg?version=1534169027)
Výskyt a intenzita nežádoucích účinků provázejících převod transplantátů a vyskytujících se v průběhu dne po podání transplantátů byly pečlivě sledovány a zaznamenávány odborným pracovníkem asistujícím u transplantace, subjektivní obtíže byly monitorovány s použitím dotazníků. K závažným nežádoucím reakcím nedošlo ani v jednom případě, významné objektivně vyhodnotitelné nežádoucí účinky nebyly pozorovány. Z výsledků dotazníkového šetření vyplynulo, že rovněž subjektivní nežádoucí účinky při převodu promytých štěpů byly ojedinělé a velmi mírné. Podobně se významnější nežádoucí účinky nevyskytly ani ve zbytku dne po transplantaci. Přehled zachycených nežádoucích účinků, jejich četnosti a závažnosti ukazuje graf 2 a 3. Celkově lze uzavřít, že převody promytých transplantátů byly snášeny velice dobře. Pro odborný personál (zdravotní sestry a lékaře) pak převod promytého transplantátu znamenal výrazné zjednodušení celé procedury a časovou úsporu.
Graf 2. Nežádoucí účinky v průběhu převodu promytého štěpu 
Graf 3. Nežádoucí účinky v průběhu dne po převodu promytého štěpu 
DISKUSE
Převod rozmrazeného transplantátu obsahujícího DMSO může vést ke vzniku nežádoucích reakcí, které jsou sice obvykle mírné, ale mohou být i závažné až fatální [6, 8, 9, 10]. Subjektivní potíže související s převodem rozmraženého transplantátu jsou relativně časté a pacienty velmi negativně vnímané. Na četnost a závažnost nežádoucích účinků DMSO se zaměřil průzkum EBMT. Celkem se průzkumu zúčastnilo 95 transplantačních center a referovaná četnost významných nežádoucích účinků DMSO byla v průměru 2,1% [3]. Z uvedené práce rovněž vyplývá, že největší vliv na snížení nežádoucích reakcí je promytí štěpů těsně před transplantací. Některá pracoviště stále ještě využívají manuální metodu poprvé popsanou Rubinsteinem et al. v roce 1995, založenou na dvojitém promytí a centrifugaci. Tato metoda ale vede k významným ztrátám hematopoetických buněk, je značně zatížená rizikem mikrobiální kontaminace a je časově náročná [14]. V současnosti je proto pokládána za překonanou a nevyhovující. Lepších výsledků může být dosaženo použitím automatizovaných systémů, jako je např. Sepax [1].
Při validaci techniky promývání transplantátů jsme prokázali, že přístroj Sepax 2 je pro promývání buněčných koncentrátů vhodný a že promytí zamražených transplantátů HC nemá za následek výrazný pokles počtu jednotlivých sledovaných typů buněk oproti jejich počtu před zamražením: zůstatek leukocytů 79,5 %, CD34+ buněk 94,4 % a CFU-GM 56,2 %. Viabilita všech buněk po promytí byla 85 % a bylo dosaženo odstranění více než 99 % DMSO [17], což je více, než uvádí například Calmels et al. (98,5 %) a Lemaire et al. (97,3 %) při použití přístroje Cytomate [18].
Pro promytí jsme použili promývací roztok, který se standardně nepoužívá a který je obohacen o citrát. Objemové složení promývacího roztoku bylo následující: 5% lidský albumin = 50 %, fyziologický roztok = 42 %, citrátový roztok ACD-A = 8 %. Nejčastěji používané promývací roztoky obsahují v různém objemovém složení Dextran nebo Voluven [1, 19, 20]. Abonnenc et al. vyzkoušeli při nastavování metody promytí na přístroji Sepax 2 promývací roztok obsahující Ringerův roztok v kombinaci s lidským albuminem i s Voluvenem. Kombinace Ringerova roztoku a lidského albuminu vedly k vyšším hodnotám viability než při použití samotného Voluvenu, ale docházelo k tvorbě sraženin [20]. Sánchez-Salinas et al. využili při promývání pouze fyziologický roztok s 2,5% lidským albuminem a problémy s tvorbou sraženin neuvádí [21]. Pro promytí transplantátu jsme nejprve zvolili pouze roztok lidského albuminu a fyziologického roztoku. Vzhledem k tomu, že jsme zaznamenali tvorby agregátů, doplnili jsme promývací roztok o antikoagulační roztok ACD-A (8 % objemu promývacího roztoku), poté již ke tvorbě sraženin či agregátů nedocházelo.
Při procesu zpracování a zamrazení transplantátů periferních kmenových buněk dochází k početním ztrátám buněk a ke snížení viability. Abonnenc et al. dosáhli při sekvenčním promývání koncentrátů zachování počtu buněk (recovery) 74,3 ± 14,3 % pro leukocyty a 79,9 ± 9,4 % pro CD34+ buňky [20]. Při našem způsobu zpracování byl u dvou pacientů promyt jenom jeden kryovak a u třech pacientů dva až tři kryovaky. Při promytí byly kryovaky rozmraženy a napojeny na přístroj společně a promyty najednou, nebylo tedy použito sekvenčního promytí, které popisuje Abonnenc et al. Recovery po proceduře promytí dosáhla v našem případě 79,5 % pro leukocyty a 94,4 % pro CD34+ buňky, což je plně srovnatelné s výsledky jiných autorů [20]. Z uvedeného můžeme uzavřít, že není nutné kryovaky promývat sekvenčně, ale je možné provést promytí současně, v jednom cyklu, a zkrátit tak výrazně čas procedury.
Promytí přístrojem Sepax 2 je na našem pracovišti určeno zejména pro pacienty, u kterých je indikován převod transplantátu uchovávaného ve 3 a více kryovacích, nebo kteří mají významnou renální insuficienci. Prvních pět pacientů, u kterých bylo využito promytí štěpu pro transplantaci, snášelo převod promytého štěpu velice dobře a neobjevily se u nich vážné nežádoucí reakce (kardiovaskulární, neurologické, renální a další obtíže). Na snížení frekvence a závažnosti nežádoucích reakcí při transplantaci promytými štěpy poukazují i další práce [3, 16, 19]. Transplantace pomocí promytých štěpů neměla vliv na rychlost obnovy krevního obrazu ve srovnání s historickou kontrolou. Podobné výsledky přinesla rovněž multicentrická studie publikovaná Saccardim et al., která uvádí 12 dnů jako medián doby do dosažení koncentrace granulocytů nad 500/µl [19].
ZÁVĚR
Automatizované promytí kryogenně zamražených transplantátů HC pro autologní použití pomocí přístroje Sepax 2 je přínosem jak pro pacienty, tak pro ošetřovatelský a lékařský personál. Promytí transplantátů nevedlo k významnému snížení kvality transplantátů ve smyslu snížení počtu progenitorů krvetvorby či jejich viability, což nepřímo potvrdily i parametry obnovy krevního obrazu po transplantaci, které se nelišily od historických kontrol. Procedura promytí je standardizovaná a probíhá v podmínkách zavedené laboratoře pro zpracování buněčných transplantátů zaškoleným týmem, což výrazně snižuje rizika suboptimálního rozmražení transplantátů, mikrobiální kontaminace apod. Aplikace promytých transplantátů je velmi jednoduchá, usnadňuje práci sester i lékařů a šetří jejich čas. Pacienti podání promytých transplantátů tolerovali výborně a téměř bez nežádoucích účinků. Vlastní aplikaci promytých štěpů pacienti vnímali velmi pozitivně a s menší emocionální zátěží, než jinak obvyklý postup využívající rozmrazování transplantátu u lůžka. Automatizované promývání kryogenně skladovaných transplantátů HC pomocí přístroje Sepax 2 můžeme na základě našich zkušeností plně doporučit, zejména v případech, kdy má příjemce snížené renální funkce nebo pokud má být objem DMSO převedeného spolu s transplantátem větší, než přibližně 0,4 ml/kg hmotnosti příjemce, což platí především pro pacienty s nízkou hmotností a děti.
Podíl autorů na přípravě rukopisu
LA – hlavní autor práce a korespondující autor
ZK, RH – léčba nemocných, spoluautoři, revize rukopisu
MN – léčba nemocných
IT, MM – péče o nemocné a monitorování pacientů
LG, JS – laboratorní zpracování
Čestné prohlášení autorů
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů, a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Tohle prohlášení se vztahuje i na spoluautora.
Poděkování
Práce vznikla za podpory Institucionálního rozvojového plánu OU v Ostravě, finanční prostředky přiděluje MŠMT (projekt č. IRP201550).
Do redakce doručeno dne 8. 12. 2017.
Přijato po recenzi dne 2. 2. 2018
Mgr. Lucie Adamusová
Laboratoř krvetvorných buněk
Tkáňové zařízení
Klinika hematoonkologie FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: lucie.adamusova@fno.cz
Zdroje
1. Scerpa MC, Daniele N, Landi F, et al. Automated washing of human progenitor cells: evaluation of apoptosis and cell necrosis. Transfusion Medicine 2011;21 : 402–407.
2. Shu Z, Heimfeld S, Gao D. Hematopoietic SCT with cryopreserved grafts: adverse reactions after transplantation and cryoprotectant removal before infusion. Bone Marrow Transplantation 2014;49 : 469–476.
3. Windrum P, Morris TCM, Drake MB, et al. Variation in dimethyl sulfoxide use in stem cell transplantation: a survey of EBMT centres. Bone Marrow Transplantation 2005;36 : 601–603.
4. Rowley SD. Hematopoietic stem cell cryopreservation: a review of current techniques. Journal of Hematotherapy 1992;1 : 233–250.
5. Akkok CA, Holte MR, Tangen JM, et al. Hematopoietic engraftment of dimethyl sulfoxide-depleted autologous peripheral blood progenitor cells. Transfusion 2009;49 : 354–361.
6. Alessandrino E, Bernasconi P, Caldera D, et al. Adverse events occurring during bone marrow or peripheral blood progenitor cell infusion: analysis of 126 cases. Bone Marrow Transplantation 1999;23 : 533–537.
7. Davis JM, Rowley SD, Braine HG, et al. Clinical toxicity of cryopreserved bone-marrow graft infusion. Blood 1990;75 : 781–786.
8. Zenhausern R, Tobler A, Leoncini L, et al. Fatal cardiac arrhythmia after infusion of dimethyl sulfoxide-cryopreserved hematopoietic stem cells in a patient with severe primary cardiac amyloidosis and end-stage renal failure. Annals of Hematology 2000;79 : 523–526.
9. Benekli M, Anderson B, Wentling D, et al. Severe respiratory depression after dimethylsulphoxide-containing autologous stem cell infusion in a patient with AL amyloidosis. Bone Marrow Transplantation 2000;25 : 1299–1301.
10. Hoyt R, Szer J, Grigg A. Neurological events associated with the infusion of cryopreserved bone marrow and/or peripheral blood progenitor cells. Bone Marrow Transplantation 2000;25 : 1285–1287.
11. Hequet O, Dumontet C, El Jaafari-Corbin A, et al. Epileptic seizures after autologous peripheral blood progenitor infusion in a patient treated with high-dose chemotherapy for myeloma. Bone Marrow Transplantation 2002;29 : 544.
12. Bojanic I, Cepulic BG, Mazic S, et al. Toxicity related to autologous peripheral blood haematopoietic progenitor cell infusion is associated with number of granulocytes in graft, gender and diagnosis of multiple myeloma. Vox Sanguinis 2008;95 : 70–75.
13. Calmels B, Lemarie C, Esterni B, et al. Occurrence and severity of adverse events after autologous hematopoletic progenitor cell infusion are related to the amount of granulocytes in the apheresis product. Transfusion 2007;47 : 1268–1275.
14. Rubinstein P, Dobrila L, Rosenfield RE, et al. Processing and cryopreservation of placental/umbilical cord blood for unrelated bone marrow reconstitution. Proc Natl Acad Sci U S A 1995;92 : 10119–10122.
15. Rodriguez L, Velasco B, Garcia J, Martin-Henao GA. Evaluation of an automated cell processing device to reduce the dimethyl sulfoxide from hematopoietic grafts after thawing. Transfusion 2005;45 : 1391–1397.
16. Fois E, Desmartin M, Benhamida S, et al. Recovery, viability and clinical toxicity of thawed and washed haematopoietic progenitor cells: analysis of 952 autologous peripheral blood stem cell transplantations. Bone Marrow Transplantation 2007;40 : 831–835.
17. Adamusova L, Koristek Z, Smejkalova J, et al. Results of Sepax 2 validation for washing of PBSC transplants after thawing and process optimization. Bone Marrow Transplantation 2016;51:S325–S326.
18. Lemarie C, Calmels B, Malenfant C, et al. Clinical experience with the delivery of thawed and washed autologous blood cells, with an automated closed fluid management device: CytoMate. Transfusion 2005;45 : 737–742.
19. Saccardi R, Blanquer M, Boieri M, et al. Washing of thawed PBSC graft by a fully automated, clinical-grade method: results of a prospective, multicentre trial. Bone Marrow Transplantation 2013;48:S184.
20. Abonnenc M, Pesse B, Tissot JD, et al. Automatic washing of thawed haematopoietic progenitor cell grafts: a preclinical evaluation. Vox Sanguinis 2017;112 : 367–378.
21. Sanchez-Salinas A, Cabanas-Perianes V, Blanquer M, et al. An automatic wash method for dimethyl sulfoxide removal in autologous hematopoietic stem cell transplantation decreases the adverse effects related to infusion. Transfusion 2012;52 : 2382–2386.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2018 Číslo 2- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Predikce vzniku inhibitoru faktoru VIII v kohortě SIPPET pomocí analýzy mutací a měření antigenu faktoru VIII
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Automatizované promývání transplantátů krvetvorných buněk pro autologní použití
- Život ohrožující orgánové infiltrace u akutní myeloidní leukemie – kazuistiky
- Léčba vitaminem C obnovuje nedostatek enzymové aktivity TET2 a přispívá k senzitivitě buněk vůči inhibitorům PARP
- Obinutuzumab dosáhl v kombinaci s chlorambucilem ve srovnání s rituximabem zlepšení celkového přežití komorbidních pacientů s chronickou lymfocytární leukemií: finální analýza přežití ve studii CLL11
- 100. výročí založení Československé republiky – vzpomínky hematologa
- Prof. MUDr. Milan Bláha, CSc., osmdesátníkem
- Doc. MUDr. Adela Bártová, CSc. (1927–2018)
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
- Srovnatelná účinnost přímých antikoagulancií a warfarinu u pacientů s rakovinou a fibrilací předsíní
- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



