-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
Long-term results of allogeneic stem cell transplantation in 533 patients: a single centre experience
Allogeneic stem cell transplantation (SCT) is considered to be the treatment of choice for many haematological disorders, especially haematological malignancies. We present here our long-term experience with allogeneic SCT in cohort of 533 pts.
We analysed 533 pts who underwent allogeneic SCT at our centre from November 1996 to June 2017. The diagnoses were as follows: AML (187 pts; 35%), ALL (73 pts, 14%), lymphomas (66 pts, 12%), MDS + MPN (52 pts, 10%), CML (74 pts, 14%), CLL (47 pts, 9%), other diagnoses (34 pts, 6%). The median age was 45 years (range 18–64). The types of donors and grafts used were as follows: HLA identical sibling, n = 257 (48%); unrelated donor, n = 276 (52%); PBSCs, n = 492 (92%); BM, n = 41 (8%). Median follow-up from SCT was 26.6 months, median follow-up from SCT for surviving pts was 83.2 months. Myeloablative conditioning (MAC) was used in 253 pts (47%), reduced intensity conditioning (RIC) was used in 280 pts (53%). Disease status at SCT was remission in 351 pts (66%) and active disease in 182 pts (34%). Median time from diagnosis to SCT was 7.4 months.
The overall response rate after allogeneic SCT was 82%, including CR in 78% of pts and PR in 4% of pts. The incidence of acute and chronic GvHD was 42% and 40% resp. Non-relapse mortality (NRM) was 18%, 19% and 20% at 1 year, 2 years and 4 years from SCT resp. Relapse incidence was 22%, 27% and 31% at 1 year, 2 years and 4 years from SCT resp. Median PFS was 31.5 months, median OS was 85.6 months. Gender, type of donor, type of graft, time from diagnosis to SCT and type of conditioning did not significantly influence PFS and OS in our cohort of pts. Patients with AML had significantly shorter PFS compared to pts with other diagnoses (median PFS 18.9 months versus 43.2 months, p = 0.031, HR 1.32). Patients with active disease at SCT had significantly shorter PFS compared to pts in remission at SCT (median PFS 9.6 months versus 73.7 months, p < 0.001, HR 1.79). On multivariate analysis, diagnosis of AML versus other diagnoses (median OS 29.7 months versus 197.2 months, p < 0.001, HR 1.63) and active disease at SCT versus remission at SCT (median OS 25.0 months versus 186.5 months, p < 0.001, HR 1.93) were significant predictors of poor OS.
Allogeneic transplantation remains the standard treatment option predominantly for various haematological malignancies. According to our results, the type of diagnosis and disease status at allogeneic SCT are important prognostic factors for PFS and OS. Patients in remission of their disease at the time of allogeneic SCT have significantly longer PFS and OS.
Key words:
allogeneic stem cell transplantation – haematological malignancies – acute leukaemi
Autori: M. Krejčí; M. Doubek; M. Tomíška; Z. Ráčil; A. Janíková; Y. Brychtová; B. Robešová; J. Procházková; A. Žmijáková; K. Kšeňáková; P. Kouřilová; Z. Král; J. Mayer
Pôsobisko autorov: Interní hematologická a onkologická klinika LF MU a FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 4, p. 284-296.
Kategória: Původní práce
Súhrn
Alogenní transplantace krvetvorných buněk (alo-HCT) je považována za léčebnou metodu volby především u hematologických malignit. V článku prezentujeme naše dlouhodobé výsledky léčby alo-HCT ve skupině 533 pacientů (dále jen pac.).
Bylo retrospektivně analyzováno 533 nemocných, kteří podstoupili alo-HCT v období 11/1996 až 6/2017. Diagnózy byly následující: AML (187 pac., 35 %), ALL (73 pac., 14 %), lymfomy (66 pac., 12 %), MDS + MPN (52 pac., 10 %), CML (74 pac., 14 %), CLL (47 pac., 9 %), ostatní (34 pac., 6 %). Medián věku byl 45 let. Typy dárců a štěpů: HLA identický sourozenec, n = 257 (48 %); nepříbuzný dárce, n = 276 (52 %); periferní krvetvorné buňky, n= 492 (92 %); kostní dřeň, n = 41 (8 %). Mediány sledování po alo-HCT byly 26,6 a pro žijící pac. 83,2 měsíců. Myeloablativní režim byl podán u 253 pac. (47 %), režim s redukovanou intenzitou u 280 pac. (53 %). Stav onemocnění před alo-HCT: remise u 351 pac. (66 %), aktivní onemocnění u 182 pac. (34 %).
Celková léčebná odpověď po alo-HCT byla 82 %, z toho 78 % CR a 4 % PR. Incidence akutní a chronické GvHD byla 42 % a 40 %. Mortalita bez souvislosti s relapsem a incidence relapsů v 1, 2 a 4 letech po alo-HCT byly 18 %, 19 % a 20 % a 22 %, 27 % a 31 %. Mediány PFS a OS byly 31,5 a 85,6 měsíců. Pohlaví, typy dárce, štěpu a přípravného režimu neovlivnily signifikantně PFS a OS. Pacienti s AML měli kratší PFS než ostatní (medián PFS 18,9 vs. 43,2 měsíců, p = 0,031, HR 1,32), pac. s aktivním onemocněním před alo-HCT měli kratší PFS než pac. v remisi (medián PFS 9,6 vs. 73,7 měsíců, p < 0,001, HR 1,79). Signifikantní parametry pro kratší OS podle multivariační analýzy byly: diagnóza AML vs. ostatní (medián OS 29,7 vs. 197,2 měsíce, p < 0,001, HR 1,63) aktivní nemoc v době alo-HCT vs. remise (medián OS 25,0 vs. 186,5 měsíce, p < 0,001, HR 1,93).
Alogenní HCT zůstává standardní léčebnou možností pro různé hematologické malignity (zejména AML+ALL+MDS+MPN). Typ diagnózy a stav onemocnění v době transplantace jsou důležité prognostické faktory pro PFS a OS, nejlepších výsledků dosahují nemocní v remisi.
KLÍČOVÁ SLOVA:
alogenní transplantace krvetvorných buněk – hematologické malignity – akutní leukemie
ÚVOD
Transplantace krvetvorných buněk (hematopoietic cell transplantation, HCT) je efektivní léčebná procedura pro mnoho získaných i vrozených onemocnění krvetvorby [1–4]. Provedení HCT se rozumí jakýkoliv léčebný postup, umožňující podání krvetvorných buněk z jakéhokoliv zdroje a od jakéhokoliv dárce příjemci s cílem obnovit nebo nahradit plně nebo částečně jeho krvetvorný systém [5]. Krvetvorné buňky jsou nejčastěji získávány z periferní krve nebo z kostní dřeně. Vlastní HCT je tedy intravenózní podání štěpu krvetvorných buněk, kterému předchází podání přípravného předtransplantačního režimu, nejčastěji jde o kombinaci cytostatik, případně i celotělového ozáření. Rozlišujeme dva základní typy transplantací (HCT): autologní HCT, kdy pro transplantaci jsou použity vlastní krvetvorné buňky nemocného, odebrané zpravidla ve stadiu remise nebo minimální aktivity základní nemoci a alogenní HCT, kdy pro transplantaci jsou použity krvetvorné buňky jiného člověka, nejčastěji je to vhodný nepříbuzný dárce nebo vhodný sourozenec.
Terapeutické využití HCT je dlouhodobé a trvalé, léčba HCT je standardně v České republice (ČR) prováděna již od devadesátých let 20. století. I v současné době (rok 2018) zůstává provedení HCT u celé řady onemocnění, především některých hematologických malignit (90 % všech HCT indikací), nadále nenahraditelnou a nezastupitelnou léčebnou modalitou, která může vést k vyléčení jinak smrtelného onemocnění. Tento terapeutický výkon je značně složitý, nese s sebou řadu možných závažných zdravotních komplikací, které mohou vést v některých případech i k úmrtí pacienta [6].
Provedení alogenní HCT v ČR jednoznačně spadá do kompetence center vysoce specializované hematoonkologické péče (HOC), respektive transplantačních hematoonkologických center. Interní hematologická a onkologická klinika (IHOK) Fakultní nemocnice Brno je jedním z těchto center, program transplantací krvetvorných buněk zde byl zahájen v roce 1995 a od roku 1996 jsou zde prováděny jak autologní, tak alogenní HCT u dospělých pacientů (nemocných starších 18 let). V současné době (rok 2018) je na IHOK prováděno ročně kolem 110 prvních transplantací krvetvorných buněk, z toho je 70–75 autologních HCT a 35–40 alogenních HCT od příbuzných i nepříbuzných dárců.
V tomto sdělení předkládáme retrospektivní analýzu souboru 533 nemocných po první alogenní HCT léčených na IHOK v období 1996–2017 s důrazem na transplantační indikace a jejich vývoj v čase, dále na údaje o přípravných režimech, o dárcích a zdrojích krvetvorných buněk, dále o celkových léčebných výsledcích, ale také na souhrnná data o potransplantačních komplikacích a celkovém přežití po provedení alogenní HCT.
PACIENTI A METODY
Pacienti
V letech 1996–2017 bylo léčeno celkem 533 pacientů provedením první alogenní HCT na Interní hematologické a onkologické klinice Fakultní nemocnice Brno (IHOK FN Brno). Základní klinická data od těchto pacientů byla vložena po jejich předchozím souhlasu do transplantačního registru a následně byla provedena jejich retrospektivní analýza.
Indikace k provedení těchto alo-HCT byly vždy v souladu s aktuálně platnými národními a mezinárodními doporučeními a vyvíjely se v čase na základě výsledků klinických studií zabývajících se problematikou transplantací krvetvorných buněk [3, 5–8]. Vývoj indikací k alogenním HCT u jednotlivých diagnóz v čase na IHOK ukazuje graf 1.
Graf 1. Vývoj indikací k alo-HCT v čase na IHOK 
Přípravné režimy, reakce štěpu proti hostiteli (graft-versus-host disease, GvHD) – profylaxe a terapie
Transplantační přípravné režimy tvoří většinou různé kombinace cytostatik, někdy spolu s celotělovým ozářením (TBI). Těchto režimů je celá řada. Liší se svou intenzitou, podle které mohou být klasifikovány do dvou základních kategorií: myeloablativní režim (myeloablative conditioning, MAC), režim s redukovanou intenzitou (reduced intensity conditioning, RIC) [5, 6]. V případě myeloablativních režimů se jednalo především o kombinaci busulfan + cyklofosfamid (BuCy) nebo cyklofosfamid + celotělové ozáření (Cy + TBI). U pacientů s nepříbuznými dárci byl jako součást přípravného režimu podáván anti-thymocytární globulin (ATG) jako profylaxe reakce štěpu proti hostiteli (GvHD), což je v souladu s doporučením Evropské skupiny pro transplantace kostní dřeně a periferních krvetvorných buněk [9]. Pokud jde o režimy s redukovanou intenzitou, převládaly režimy ve složení fludarabin + busulfan + ATG [10–12] a dále kombinace fludarabin + amsakrin + cyklofosfamid + TBI (režim FLAMSA/RIC), případně jeho modifikace [13–15].
Pro profylaxi reakce štěpu proti hostiteli (GvHD) byl standardně používán cyklosporin A (CsA) a metotrexát, případně CsA a mykofenolát mofetil [9].
Podpůrná léčba, antimikrobiální profylaxe a terapie byly prováděny v souladu s aktuálně platnými mezinárodními doporučeními. Akutní a chronická GvHD a jejich stupně byly hodnoceny podle platných mezinárodních kritérií [16–19]. Akutní GvHD byla zprvu v rámci léčby 1. linie léčena kortikosteroidy (2 mg/kg/den) v případě nedostatečné odpovědi byl podáván mykofenolát mofetil, pulzní cyklofosfamid nebo jiná imunosupresivní terapie druhé linie [9, 20, 21]. Chronická GvHD byla léčena lokální terapií nebo kortikosteroidy, pokročilejší formy potom obvykle kombinovanou imunosupresivní terapií (cyklosporin A ± steroidy ± mykofenolát mofetil [20]. Analýza dárcovského chimerismu a jeho kvantifikace byla prováděna z periferní krve před transplantací a pravidelně po alo-HCT z periferní krve či kostní dřeně [22]. Jako kompletní chimerismus byl definován stav, kdy bylo dosaženo více než 99 % dárcovské krvetvorby v období po alo-HCT.
Statistická analýza
Data byla analyzována k 31. 10. 2017. Analýza přežití byla vypočítána pomocí metodiky Kaplana-Meiera, všechny bodové odhady byly doplněny 95% intervalem spolehlivosti (IS). V některých případech nebyl medián přežití dosažen (NA), nebo nebylo možno spočítat 95 % IS pro odhad mediánu přežití z důvodu nízkého počtu sledovaných událostí.
Celkové přežití (overall survival, OS) bylo definováno jako doba od data alogenní HCT do úmrtí z jakéhokoliv důvodu. Doba do progrese (progression-free survival, PFS) byla počítána od data provedení alogenní HCT do progrese onemocnění nebo úmrtí pacienta. V případě, že u pacienta nenastala sledovaná událost, byl pacient cenzorován k datu poslední aktualizace záznamu. Srovnání přežití pacientů v rámci podskupin bylo provedeno pomocí log-rank testu. Veškeré testy statistických hypotéz byly provedeny na 5% hladině významnosti (hodnota p pod 0,05). Multivariační analýza byla provedena využitím Coxova modelu proporcionálního hazardu.
Pro zpracování výsledků byl použit statistický software „IBM SPSS Statistics Version 24; výrobce IBM Corp., Armonk NY, USA“.
Úmrtí z jiných příčin než relaps/progrese nemoci (non-relapse mortality, NRM) bylo definováno jako doba od data provedení alogenní HCT do data úmrtí pacienta bez progrese/relapsu. Relaps nemoci byl definován jako doba od data provedení alogenní HCT do data prvního relapsu, byl hodnocen u pacientů, kteří byli v době alo-HCT v remisi.
VÝSLEDKY
Základní charakteristiky souboru
Celkem bylo hodnoceno 533 pacientů po první alogenní HCT léčených na IHOK v období 1996–2017, medián věku byl 45 let (rozpětí 18–65 roků). Diagnózy pacientů byly následující: akutní myeloidní leukemie (AML, n = 187, 35 %), akutní lymfoblastická leukemie (ALL, n = 73, 14 %), non-Hodgkinské lymfomy (NHL, n = 55, 10 %), Hodgkinův lymfom (HL, n = 7; 1 %), mnohočetný myelom (MM, n = 5; 1 %), myelodysplastický syndrom, primární idiopatická myelofibróza a jiná chronická myeloproliferativní onemocnění kromě CML (n = 52, 10 %), chronická myeloidní leukemie (CML, n = 74, 14 %), chronická lymfatická leukemie (CLL; n= 47, 9 %), těžká aplastická anémie (SAA, n= 11; 2 %) a ostatní diagnózy (n = 22, 4 %).
Stav nemoci před provedením alogenní HCT byl následující: parciální/kompletní remise nemoci (PR/CR) nebo chronická fáze CML: 351 pac. (66 %); aktivní nemoc, nedosažení remise onemocnění či jiné než chronické fáze u CML: 182 pac. (34 %).
Medián intervalu od stanovení diagnózy do provedení alogenní HCT byl 7,4 měsíce. V našem souboru 533 pacientů byly použity v 47 % případů (253/533) přípravné režimy myeloablativní a v 53 % případů (280/533) přípravné režimy s redukovanou intenzitou.
Pacienti dostali nemanipulovaný štěp periferních krvetvorných buněk (peripheral blood stem cells, PBSC) (n = 492, 92 %) nebo kostní dřeň (n = 41, 8 %) od HLA identických příbuzných dárců (n = 256, 48 %) nebo vhodných nepříbuzných dárců (n = 275, 52 %). Pokud jde o nepříbuzné dárce, většinou šlo o dobře shodné dárce se shodou 10/10 (92 % všech nepříbuzných dárců), jen 8 % nepříbuzných dárců mělo 1 či 2 neshody s příjemcem v požadovaných HLA antigenech I. a II. třídy.
Nejdůležitější charakteristiky souboru pacientů jsou shrnuty v tabulce 1. Medián doby sledování od provedení alo-HCT byl 26,6 měsíce (rozpětí 0,0–254,3 měsíce), medián doby žijících pacientů byl 83,2 měsíce (rozpětí 5,1–254,3 měsíce).
Tab. 1. Základní charakteristiky souboru 533 pacientů po alogenní HCT 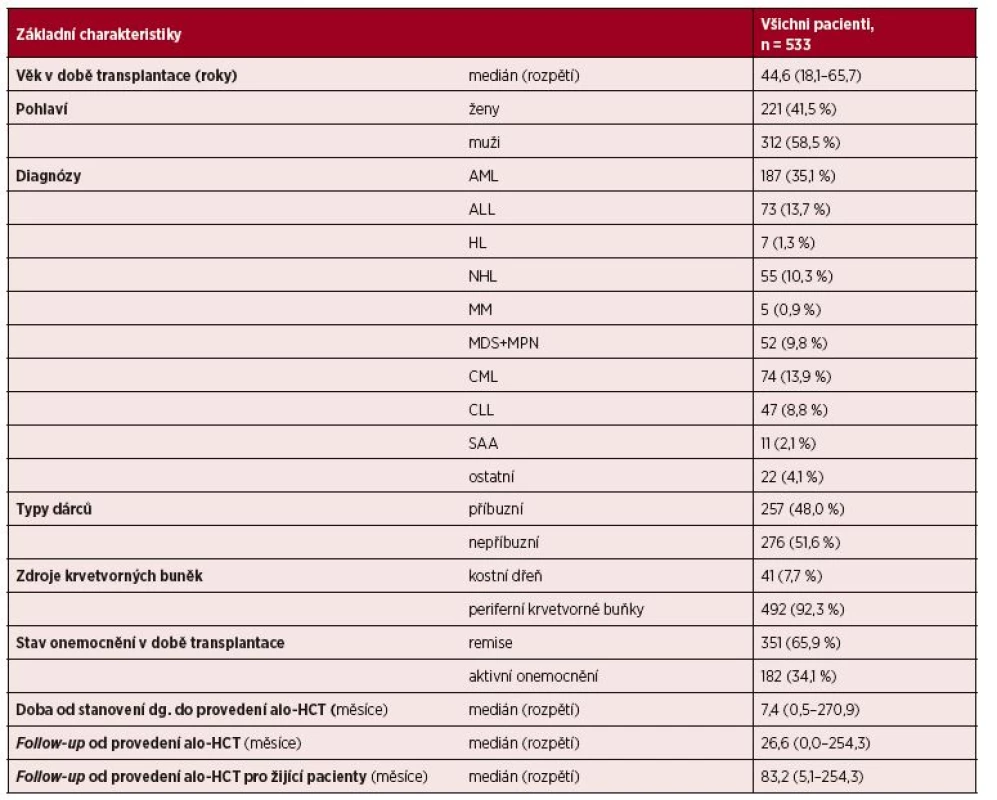
Vysvětlivky zkratek: AML – akutní myeloidní leukemie, ALL – akutní lymfoblastická leukemie, HL – Hodgkinův lymfom, NHL – ne-Hodgkinské lymfomy, MM – mnohočetný myelom, MDS+MPN – myelodysplastický syndrom + chronická myeloproliferativní onemocnění, CML – chronická myeloidní leukemie, CLL – chronická lymfatická leukemie, SAA – těžká aplastická anemie Přihojení štěpu, peritransplatační mortalita, chimerismus a incidence GvHD
Přihojení štěpu krvetvorných buněk bylo dosaženo u naprosté většiny pacientů (457/533, 86 %), 75 nemocných (75/533, 14 %) zemřelo v období dřeňového útlumu (aplazie) ještě před přihojením štěpu.
Medián dávky podaných hematopoetických buněk nesoucích povrchový znak CD34+ byl 6,2 x 106/kg (rozpětí 1,7 až 20,8 x 106/kg). Medián doby do přihojení neutrofilů (neutrofily nad 0,5 x 109/l) byl 17 dní (rozpětí 10–41 dní), medián doby do přihojení trombocytů (trombocyty nad 20 x 109/l byl 18 dní (rozpětí 11–59 dní).
Kumulativní incidence mortality bez souvislosti s relapsem (NRM) do dne +100, po 1 roce, po 2 letech a po 4 letech od provedení alo-HCT byly následující: 14 % (75/533), 18 % (96/533), 19 % (101/533) a 20 % (107/533). Data týkající se vyhodnocení chimerismu byla k dispozici u 430 pacientů, kompletní dárcovský chimerismus byl dosažen u 71 % pacientů (305/430) v mediánu 30 dní od provedení alo-HCT (rozpětí 15–100 dní).
Přítomnost či nepřítomnost akutní GvHD byla hodnocena u 484 pacientů, z tohoto počtu 59 % pacientů (283/484) nemělo známky akutní GvHD. Akutní GvHD stupně I a II byla přítomna u 157 nemocných (32 %), pouze 9 % pacientů mělo závažnější formy akutní GvHD stupně III a IV (44/484).
Přítomnost či nepřítomnost chronické GvHD byla hodnocena u 437 pacientů, z toho 60 % pacientů (261/437) nemělo známky chronické GvHD. Chronická GvHD mírného či středního stupně byla u 30 % pacientů (133/437), závažnější formy chronické GvHD byly přítomny u 10 % nemocných (43/437).
Léčebné odpovědi, PFS a OS v celém souboru 533 nemocných
Ve skupině 457 pacientů s přihojeným štěpem po alo-HCT dosáhlo kompletní remise (CR) nemoci celkem 357 pacientů (78 %), dalších 18 pacientů (4 %) mělo parciální remisi (PR), celková léčebná odpověď byla 82 % (375/457).
Medián sledování celého souboru 533 pacientů od provedení alo-HCT byl 26,6 měsíců (rozpětí 0,1–254,3 měsíce), medián sledování skupiny žijících pacientů 83,2 měsíce (rozpětí 5,1–254,3 měsíce). Medián doby do progrese (PFS) od provedení alo-HCT byl v celém souboru nemocných 31,5 měsíce (95% interval spolehlivosti (IS): 7,5–55,5 měsíce), medián celkového přežití od provedení alo-HCT 85,6 měsíce (95% IS: 22,6–148,7 měsíce). Graf 2 ukazuje křivky PFS a OS v celém souboru 533 pacientů.
Graf 2. Doba do progrese a celkové přežití v souboru 533 pacientů po alogenní transplantaci 
Celá skupina 533 alogenně transplantovaných pacientů měla 2leté a 4leté celkové přežití 60 % (95% IS: 56–65 %) a 54 % (95% IS: 45–58 %) a dobu do progrese ve 2 letech a ve 4 letech po alo-HCT 52 % (95% IS: 47–56 %) a 46 % (95% IS: 42–51 %)
I přes provedení alo-HCT dochází u části nemocných k relapsům původního onemocnění, v našem souboru nemocných byla frekvence relapsů 1. rok, 2. rok a 4. rok po alo-HCT následující: 21,6 %, 27,5 % a 31,5 %. K největšímu počtu relapsů tedy docházelo v průběhu prvního roku od provedení alo-HCT, v pozdějším období byl již relaps méně pravděpodobný.
Doba do progrese a celkové přežití u vybraných diagnóz
V této části jsou prezentovány PFS a OS u nejčastějších diagnóz, pro které byla provedena alo-HCT. Uváděné mediány PFS a OS jsou většinou doplněny 95% intervalem spolehlivosti (IS), pokud nebyl medián dosažen, je uvedena pravděpodobnost 5letého přežití.
Akutní myeloidní leukemie: tito nemocní tvořili největší skupinu ze všech alogenně transplantovaných pacientů (187/533, 35 %). Medián PFS u všech našich pacientů s AML byl 18,9 měsíců (95% IS: 4,0–33,9 měsíce), medián OS byl 29,7 měsíce (95% IS: 8,9–50,6 měsíce). Jako velmi významný faktor u pacientů s AML se ukázal být stav onemocnění v době transplantace, 47 pacientů s aktivním onemocněním, respektive bez dosažení remise před provedením alo-HCT, měli medián PFS pouze 3,2 měsíce (95% IS: 2,4–4,1 měsíce) a medián OS 4,9 měsíce (95% IS: 3,7-6,0 měsíce). Oproti tomu 140 pacientů s AML v remisi nemoci před provedením alo-HCT mělo medián PFS 42, 2 měsíce (95% IS: 0,0–93,8 měsíce) a medián OS byl 76,7 měsíce (95% IS: 25,4–128,0 měsíce).
Akutní lymfoblastická leukemie: celkem bylo alogenně transplantováno 73 pacientů s ALL, medián PFS byl 63,9 měsíce a mediánu OS nebylo dosaženo, pravděpodobnost 5letého přežití byla 54 %.
Lymfomy: celkem bylo alogenně transplantováno 62 pacientů s lymfomy, většinu tvořily non-Hodgkinské lymfomy (89 %, 55/62). Medián PFS u pacientů s lymfomy byl 100,9 měsíce (95% IS: 0,0 až 220,4 měsíce), medián OS nebyl dosažen, pravděpodobnost 5letého přežití byla 65 %.
Chronická myeloidní leukemie: bylo transplantováno celkem 74 pacientů s CML, medián PFS byl 46,1 měsíce, medián OS nebyl dosažen, pravděpodobnost 5letého přežití byla 68,7 %.
Myelodysplastický syndrom a chronická myeloproliferativní onemocnění vyjma CML: celkem bylo transplantováno 52 nemocných, medián PFS byl 93,2 měsíce, medián OS byl 197,2 měsíce.
Chronická lymfatická leukemie: celkem bylo transplantováno 47 pacientů s CLL, medián PFS byl 26,1 měsíce (95% IS: 9,6–42,6 měsíce), medián OS byl 50,5 měsíce (95% IS: 30,5–70,4 měsíce).
Těžká aplastická anémie (SAA): celkem bylo transplantováno 11 pacientů, mediány PFS a OS nebyly dosaženy, pravděpodobnost 5leté doby bez progrese byla 64 %, pravděpodobnost 5letého OS byla 73 %.
Graf 3 zachycuje křivky PFS pro jednotlivé diagnózy a ukazuje jejich vzájemné srovnání. Graf 4 zachycuje křivky celkového přežití (OS) u jednotlivých diagnóz po provedení alo-HCT.
Graf 3. Doba do progrese u jednotlivých diagnóz 
Graf 4. Celkové přežití u jednotlivých diagnóz 
Faktory ovlivňující PFS a OS po alo-HCT: univariační a multivariační analýza
V souboru 533 pacientů po alogenní HCT byla hodnocena řada jednoduchých, ale klinicky významných parametrů, které byly v době provedení analýzy k dispozici. Jednalo se o typ přípravného režimu, typ dárce, různý věk pacienta v době transplantace, doba od stanovení diagnózy do provedení transplantace, typ diagnózy, časové období provedení alo-HCT, pohlaví. Výsledky univariační analýzy jsou shrnuty v tabulce 2 pro dobu do progrese a v tabulce 3 pro celkové přežití. Pohlaví, doba od stanovení diagnózy do provedení alo-HCT, typ přípravného režimu a typ dárce neměly statisticky významný vliv na PFS a OS v naší skupině pacientů.
Tab. 2. Vliv vybraných klinických parametrů na PFS: univariační analýza 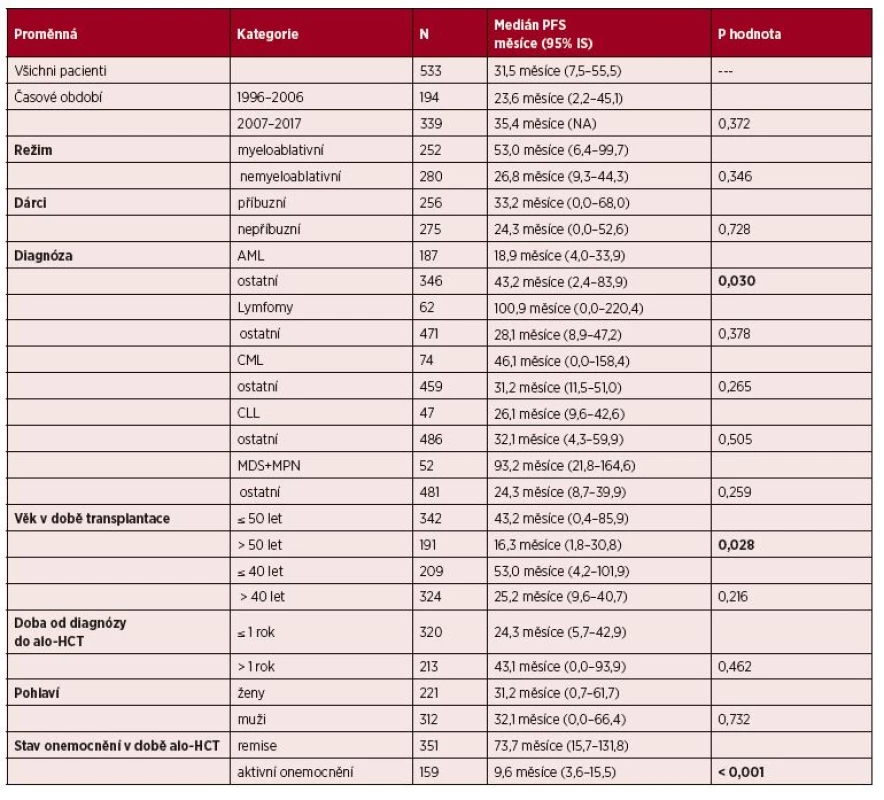
Jako naprosto zásadní a významný faktor jak pro PFS, tak pro OS, se ukázal být stav onemocnění před alo-HCT. Pacienti, kteří měli remisi nemoci, dosáhli statisticky významně delšího PFS i OS než nemocní s aktivním onemocněním v době alo-HCT (medián PFS 73,7 měsíců vs. medián PFS 9,6 měsíce, p < 0,001; medián OS 186,5 měsíců vs. medián OS 25,0 měsíce, p < 0,001). Vliv stavu nemoci před alo-HCT na PFS i OS v naší skupině nemocných ukazuje graf 5.
Graf 5. Vliv stavu onemocnění před alo-HCT na dobu do progrese a celkové přežití (remise versus aktivní onemocnění) 
Dalším klinickým ukazatelem, který byl hodnocen ve vztahu k PFS a OS, byl typ diagnózy. U pacientů s ALL, lymfomy, CLL, MDS + MPN nebyl zjištěn statisticky významný rozdíl jak pro PFS, tak pro OS (viz tabulky 2 a 3). U pacientů s CML nebyl významný rozdíl pro PFS ve srovnání s ostatními diagnózami, ale pacienti s CML měli signifikantně delší OS než ostatní (p = 0,002).
Tab. 3. Vliv vybraných klinických parametrů na OS: univariační analýza 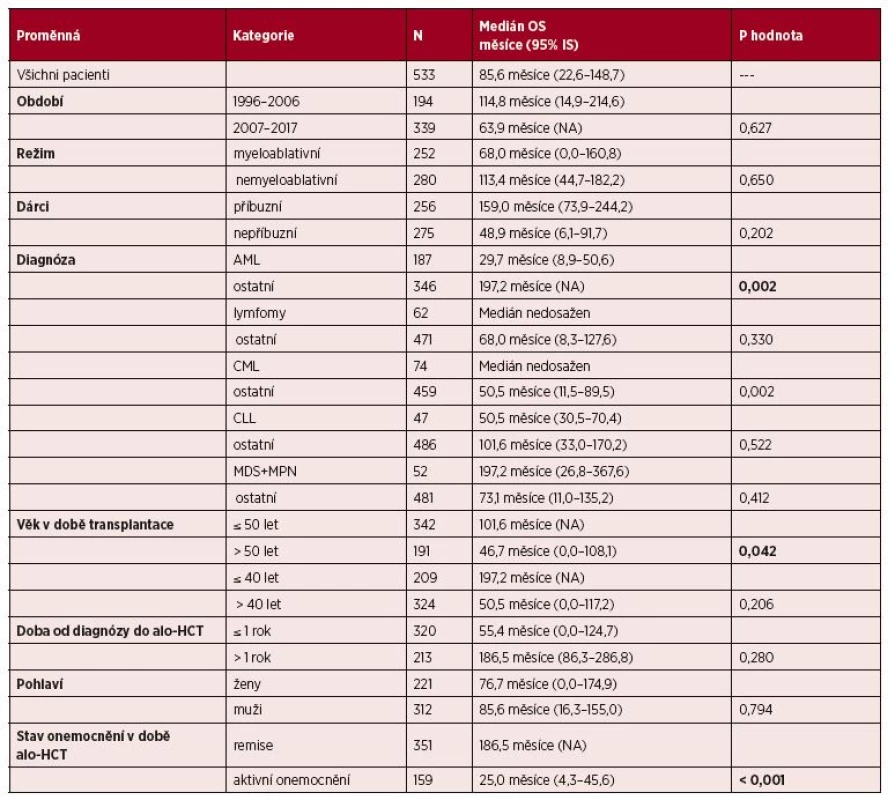
Pacienti s diagnózou AML měli signifikantně kratší OS než ostatní (medián OS 46,0 měsíců vs. medián OS 197,2 měsíce, p = 0,002), dále pacienti s AML měli signifikantně kratší PFS než pacienti s ostatními diagnózami (medián PFS 18,9 měsíce vs. 43,2 měsíce, p = 0,030). Vliv diagnózy na dobu do progrese a celkové přežití po alo-HCT pro pacienty s AML vs. ostatní diagnózy zachycuje graf 6. I u nemocných s AML měl stav nemoci zásadní vliv na PFS a OS, pacienti s AML v kompletní remisi nemoci měli medián PFS 42,2 měsíce, pacienti s AML transplantovaní bez dosažení remise měli medián PFS 3,2 měsíce (p < 0,001), pacienti s AML v remisi nemoci měli medián OS 76,7 měsíce, pacienti s AML bez dosažení remise měli medián OS 4,9 měsíce (p < 0,001).
Graf 6. Vliv diagnózy na dobu do progrese a celkové přežití po alo-HCT (AML versus ostatní) 
Dalším hodnoceným parametrem byl věk pacientů v době alo-HCT, podle univariační analýzy se v celém souboru nemocných ukázal jako faktor statisticky významný pro delší PFS i OS věk < 50 let ve srovnání s pacienty staršími 50 let (medián PFS 43,2 měsíce vs. 16,3 měsíce, p = 0,028; medián OS 101,6 měsíce vs. 46,7 měsíce, p = 0,042). Při hodnocení věkových skupin do 40 let (209 pacientů) a nad 40 let (324 pacientů) nebyl sice prokázán statisticky významný rozdíl podle univariační analýzy, nicméně pacienti do 40 let věku měli delší mediány PFS i OS než pacienti nad 40 let věku (medián PFS 53,2 vs. 25,2 měsíce, medián OS 197,2 měsíce vs. 50,5 měsíce).
Dále byly analyzovány zvlášť myeloablativní (252 pacientů) a nemyeloablativní režimy (280 pacientů). Pokud jde o nemyeloablativní režimy či režimy s redukovanou intenzitou, nebyl prokázán vliv období transplantace, typu dárce, věku v době alo-HCT, doby od diagnózy do provedení alo-HCT a pohlaví na PFS a OS. Jediným statisticky významným faktorem byl stav nemoci v době alo-HCT, pacienti v remisi nemoci měli signifikantně delší PFS a OS (medián PFS 44,2 měsíce vs. 10,1 měsíce, p = 0,018; medián OS 159,0 měsíce vs. 39,2 měsíce, p = 0,012).
Pokud jde o myeloablativní režimy, nebyl pozorován vliv období transplantace, typu dárce, doby od diagnózy do provedení alo-HCT a pohlaví na PFS a OS. Statisticky signifikantním faktorem v této skupině pacientů byl věk < 40 let ve srovnání s pacienty staršími 40 let (medián PFS 94,7 měsíce vs. 11,2 měsíce, p = 0,005; medián OS 197,2 měsíce vs. 16,1 měsíce, p = 0,003). Rovněž stav nemoci před alo-HCT byl zásadním faktorem pro PFS i OS, pacienti v remisi nemoci měli signifikantně delší PFS a OS (medián PFS 86,5 měsíce vs. 7,0 měsíce, p < 0,001; medián OS 186,5 měsíce vs. 12,7 měsíce, p < 0,001).
Výsledky multivariační analýzy pro PFS jsou uvedeny v tabulce 4. Faktory spojené se statisticky významně kratším celkovým přežitím byly následující: aktivní onemocnění vs. remise nemoci v době alo-HCT (HR 1,79; p < 0,001) a diagnóza AML vs. ostatní diagnózy (HR 1,32; p = 0,031).
Tab. 4. Vliv vybraných klinických parametrů na PFS: multivariční analýza 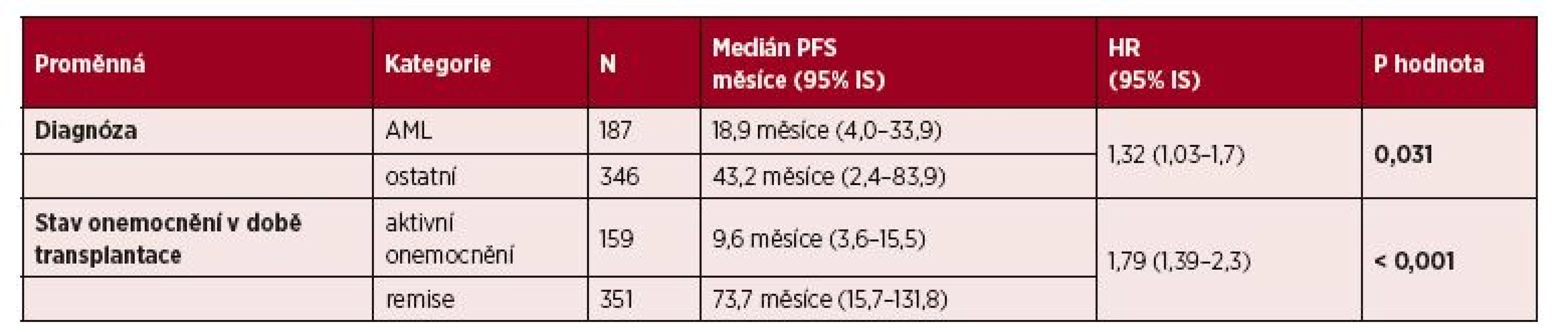
Výsledky multivariační analýzy pro OS jsou uvedeny v tabulce 5. Faktory spojené se statisticky významně kratším celkovým přežitím byly následující: aktivní onemocnění vs. remise nemoci v době alo-HCT (HR 1,93; p < 0,001) a diagnóza AML vs. ostatní diagnózy (HR 1,63; p < 0,001).
Tab. 5. Vliv vybraných klinických parametrů na OS: multivariční analýza 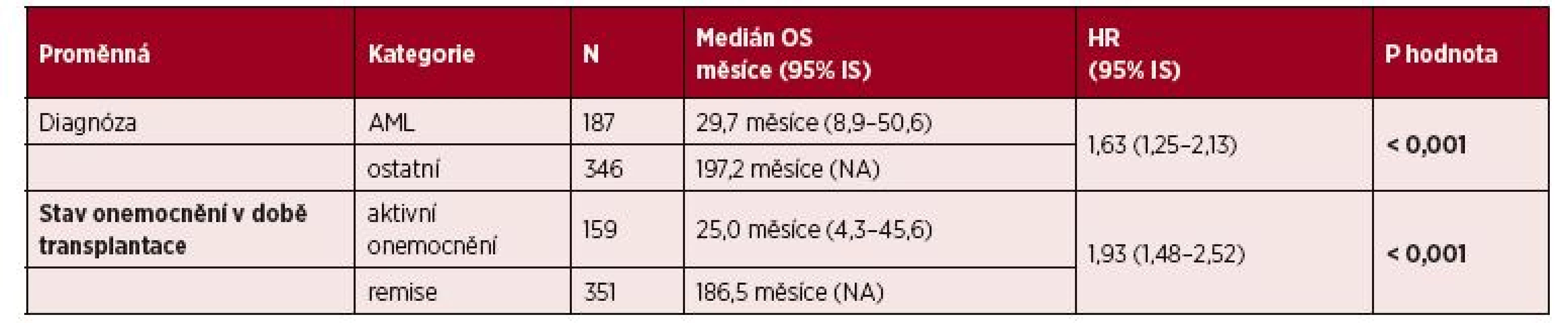
DISKUSE
Indikační doporučení k alogenním HCT byla opakovaně publikována a aktualizována v ČR i v zahraničí a vycházejí ze závěrů a doporučení řady klinických studií, které se této problematice věnují [3, 5–8].
U každého nemocného vstupuje do hry celá řada faktorů (celkový klinický stav, přítomnost přidružených onemocnění, věk, dostupnost dárce, stav základní nemoci, různé prognostické faktory a další skutečnosti), které ovlivňují závěrečné indikační rozhodnutí k provedení alo-HCT.
Transplantace krvetvorných buněk jsou prováděny v Evropě i v ČR se stále narůstající frekvencí, počet transplantací v Evropě za rok přesahuje 40 000 procedur [23], z toho alo-HCT tvoří přes 40 %. Přes 90 % všech transplantačních indikací tvoří hematologické malignity. Problémem zůstává peritransplantační mortalita (NRM), která i přes veškeré dosažené léčebné pokroky i v současné době obvykle dosahuje u alogenních transplantací 15–20 % [23] a podílí se na ní více faktorů. Většina úmrtí spojených s provedením alo-HCT a zároveň nesouvisejícím s relapsem původní nemoci obvykle nastává v prvním roce po provedení alo-HCT, mezi nejčastější příčiny úmrtí patří toxicita přípravného režimu, dále závažné infekční komplikace, rozvoj GvHD rezistentní na steroidy a další příčiny (např. závažné krvácení, potransplantační lymfoproliferativní onemocnění a jiné). Transplantační léčba není tedy pro nemocné jednoduchá a představuje určitou zátěž. V současné době je v oblasti hematoonkologie k dispozici celá řada nových cílených léků (targeted therapy), které mají ve srovnání s léčbou transplantační výrazně nižší toxicitu a jsou vysoce účinné. Je tedy diskutováno a zkoumáno v rámci klinických studií, zda tyto nové léky mohou v některých případech zcela nahradit transplantační léčbu, případně zda by mohly být určitým léčebným překlenutím (bridge to transplant) k provedení transplantace [23]. Problémem je obvykle ekonomická náročnost této cílené terapie.
U akutních leukemií (AML, ALL) prozatím nemáme k dispozici takové cílené léky, které by byly jednoznačně účinnější než transplantační léčba, a proto alo-HCT zůstávají i nadále standardní terapií u středně a vysoce rizikových forem akutních leukemií. Akutní leukemie v současné době představují 51 % všech indikací pro alogenní transplantace v Evropě i v ČR (AML 35 %, ALL 16 %) [24] a jsou jednoznačně nejčastějšími indikacemi pro provedení alo-HCT.
Na druhé straně tyrozinkinázové inhibitory (TKI, imatinib, nilotinib, dasatinib) jsou aktuálně široce používány v léčbě pacientů s chronickou myeloidní leukemií v chronické fázi nemoci a provedení alogenní transplantace u CML je zvažováno pouze u malé skupiny nemocných, kteří nereagují na léčbu TKI, případně mají akcelerovanou fázi či blastický zvrat CML [6]. Alogenní transplantace u CML tvoří nyní pouze 3 % všech indikací pro alogenní HCT [24].
Pokud jde o myelodysplastický syndrom, hypometylační látky neprokázaly vyšší účinnost ve srovnání s provedením alogenní HCT, a tak zůstává alogenní HCT i nadále metodou volby u vhodných pacientů s vysoce rizikovými formami MDS. Rovněž inhibitory Janusovy kinázy u některých typů chronických myeloproliferativních onemocnění mají pouze dočasný terapeutický efekt a mohou sloužit jako překlenovací terapie před provedení alogenní HCT u vhodných nemocných [23]. Alogenní transplantace pro MDS a chronické myeloproliferativní onemocnění tvoří 15 % všech indikací pro alogenní HCT [24].
Také u chronické lymfatické leukemie jsou nyní k dispozici nové cílené léky, které lze individuálně využít u vysoce rizikových forem CLL (ibrutinib, idelalisib a další). Diskutuje se, zda pro vhodné pacienty s vysoce rizikovou CLL je lepší provedení alo-HCT nebo podávání těchto nových léků [23]. Opět je nutno individuálně zvážit možný benefit transplantační léčby oproti riziku potransplantančních komplikací. Vysoce riziková CLL představuje aktuálně 3 % všech indikací pro alogenní HCT [24].
V naší práci shrnujeme výsledky 533 pacientů po alogenní transplantaci krvetvorných buněk, kteří byli léčeni na našem pracovišti v období 1996–2017. Spektrum diagnóz a indikace k provedení alogenních transplantací byly v souladu s mezinárodními doporučeními [5, 24]. Časné přihojení štěpu a kompletní dárcovský chimerismus byly dosaženy u většiny našich nemocných.
Reakce štěpu proti hostiteli (GvHD) je významným problémem po alogenní transplantaci a zůstává jednou z hlavních příčin potransplantační morbidity a mortality [25]. U našich pacientů byl relativně nízký výskyt závažnějších forem GvHD (akutní u 9 %, chronická u 10 %), což je pravděpodobně vlivem profylaktického podání ATG jako součásti předtransplantační přípravy, především u nemocných s nepříbuznými dárci. Bylo prokázáno randomizovanou klinickou studií, že profylaktické podání ATG snižuje významně incidenci GvHD bez ovlivnění relapsů či celkové mortality [26].
Celková léčebná odpověď po provedení alogenní HCT byla u našich pacientů vysoká, 82 %. Medián doby do progrese v celém souboru byl 31,5 měsíce, medián celkového přežití byl 85,6 měsíce, soubor je však heterogenní a výsledky byly individuální pro jednotlivé diagnózy. Pravděpodobnost 5letého celkového přežití po alo-HCT se v našem souboru nemocných pohybovala v rozmezí 50–70 % v závislosti na typu diagnózy. Naše léčebné výsledky jsou plně srovnatelné s jinými pracemi, publikovanými na toto téma [8, 27].
I přes provedení alo-HCT dochází u části pacientů k relapsu původního onemocnění, což je velký terapeutický problém. V našem souboru pacientů došlo k největšímu počtu relapsů (21 %) již v prvním roce po provedení alo-HCT, ale k relapsu nemoci může dojít i v pozdějším období. Relapsu nemoci po alo-HCT u rizikových nemocných můžeme předejít rychlejším
vysazováním imunosuprese a také profylaktickým podáváním dárcovských T lymfocytů [13, 14], důležité je také pokusit se o navození remise nemoci ještě před vlastním provedením alo-HCT.
V našem souboru nemocných nebyl prokázán statisticky signifikantní vliv časových období 1996–2006 (celkem 194 pacientů) a 2007–2017 (celkem 339 pacientů) na PFS a OS, důvodem je pravděpodobně značná heterogenita souboru a také to, že v prvním časovém období bylo transplantováno více nemocných s diagnózou CML (33 %, 64/194) než v druhém časovém období (3 %, 10/339). Pacienti s CML, především v první chronické fázi, mají obecně velmi dobrou prognózu a delší přežití po alo-HCT ve srovnání s ostatními diagnózami [27], nicméně v současné době jsou tito pacienti již léčeni tyrozinkinázovými inhibitory a alogenně transplantováno je jen malé procento indikovaných nemocných s CML v pokročilejších fázích.
V našem souboru 533 pacientů byla dále hodnocena řada jednoduchých, ale klinicky významných parametrů a jejich možný vztah pro PFS a OS, detailně jsou rozebrány v předchozím textu. Jako nejvýznamnější faktor pro signifikantně delší PFS i OS je dosažení remise nemoci ještě před provedením alo-HCT, což je v souladu s jinými publikovanými pracemi [14, 27].
Dále byl pozorován vliv diagnózy na výsledek alo-HCT, pacienti s AML měli signifikantně kratší PFS a OS ve srovnání s ostatními diagnózami, na druhé straně 1/4 všech našich AML pacientů (25 %, 47/187) mělo v době transplantace aktivní onemocnění a tito nemocní měli medián PFS a OS jen několik měsíců. Zdá se tedy, že provedení alo-HCT u nemocných s aktivní AML nemá dlouhodobější terapeutický efekt, nemocní sice dosáhnou dočasně léčebné odpovědi, ale brzo po provedení alo-HCT dochází k relapsu AML a mediány PFS a OS jsou velmi krátké. Oproti tomu nemocní s AML v remisi nemoci (140 pacientů) měli velmi dlouhé mediány PFS a OS po alo-HCT (42 a 76 měsíců) a výrazně profitovali z provedení alo-HCT. V současné době již pacienty s aktivním onemocněním neindikujeme k provedení alo-HCT.
I podle jiných publikovaných prací [27] je patrné, že přežití pacientů s AML po alo-HCT je ovlivněno stavem nemoci v době transplantace, nejlepších výsledků dosahují nemocní transplantovaní v první CR, např. nemocní s AML transplantovaní v první či druhé CR měli pravděpodobnost 3letého přežití 50–60 %, naopak nemocní s AML transplantovaní mimo remisi pouze 20 %.
ZÁVĚR
První alogenní HCT byla na našem pracovišti provedena v roce 1996 a v průběhu dalších let se stala alogenní HCT rutinní léčebnou metodou v terapii některých hematologických malignit (94 % všech indikací), především akutních leukemií (49 % všech indikací), ale i řady dalších onemocnění. I přes značné pokroky, učiněné v terapii hematologických malignit a zavedení celé řady nových cílených léků zůstává provedení alogenní HCT stále i v současné době (rok 2018) metodou volby u indikovaných nemocných. Do konce roku 2017 bylo na IHOK FN Brno provedeno přes 500 alogenních HCT, v posledních letech se roční počty alogenních HCT na IHOK FN Brno pohybují kolem 35–40 procedur. Výsledky alogenní transplantační léčby jsou velmi individuální a záleží na celé řadě faktorů, podle našich dat záleží především na typu diagnózy a stavu základního onemocnění před HCT. U dospělých pacientů (starších 18 let) se celkové 5leté přežití po alogenní HCT obvykle pohybuje kolem 50–70 %, nejvíce z provedení alo-HCT profitují nemocní v remisi nemoci.
Podíl autorů na přípravě rukopisu
KM – příprava rukopisu, podíl na léčbě pacientů
Ostatní autoři – korekce a revize rukopisu, podíl na léčbě pacientů
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve středu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 28. 6. 2018.
Přijato po recenzi dne 1. 8. 2018.
prof. MUDr. Marta Krejčí, Ph.D.
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
62500 Brno
e-mail: krejci.marta@fnbrno.cz
Zdroje
1. Copelan EA. Hematopoietic stem-cell transplantation. N Engl J Med 2006;354 : 1813–1826.
2. Appelbaum FR. Hematopoietic-cell transplantation at 50. N Engl J Med 2007;357 : 1472–1475.
3. Ljungman P, Bregni M, Brune M, et al. European Group for Blood and Marrow. Allogeneic and autologous transplantation for haematological diseases, solid tumours and immune disorders: current practice in Europe 2009. Bone Marrow Transplant 2010;45 : 219–234.
4. Gratwohl A, Baldomero H, Aljurf M, et al. Hematopoietic stem cell transplantation: a global perspective. JAMA 2010;303 : 1617–1624.
5. Sureda A, Bader P, Cesaro S, et al. Indications for allo - and auto-SCT for haematological diseases, solid tumours and immune disorders: current practice in Europe, 2015. Bone Marrow Transplant 2015;50 : 1037–1056.
6. Krejčí M, Sedláček P, Jindra P, et al. Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP. Transfuze Hematol dnes 2016;22 : 127–150.
7. Koza V, Cetkovský P, Faber E, et al. Indikace k alogenním a autologním transplantacím krvetvorných buněk. Doporučení České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP. Transfuze Hematol dnes 2006;12 : 223–231.
8. Majhail NS, Farnia SH, Carpenter PA, et al. Indications for autologous and allogeneic hematopoietic cell transplantation: guidelines from the American Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant 2015;21 : 1863–1869.
9. Ruutu T, Grathwohl A, T de Witte, et al. Prophylaxis and treatment of GVHD: EBMT-ELN working group recommendations for a standartized practice. Bone Marrow Transplant 2014;49 : 168–173.
10. Slavin S, Nagler A, Naparstek E, et al. Nonmyeloablative stem cell transplantation and cell therapy as an alternative to conventional bone marrow transplantation with lethal cytoreduction for the treatment of malignant and nonmalignant diseases. Blood 1998;91 : 756–763.
11. Or R, Shapira MY, Resnick I, et al. Nonmyeloablative allogeneic stem cell transplantation for the treatment of chronic myeloid leukemia in first chronic phase. Blood 2003;101 : 441–445.
12. Krejci M, Brychtova Y, Doubek M, et al. Long-term results of allogeneic hematopoietic stem cell transplantation after reduced-intensity conditioning with busulfan, fludarabine, and antithymocyte globulin. Neoplasma 2011;58 : 406–414.
13. Schmid C, Schleuning M, Ledderose G, et al. Sequential regimen of chemotherapy, reduced-intensity conditioning for allogeneic stem-cell transplantation, and prophylactic donor lymphocyte transfusion in high-risk acute myeloid leukemia and myelodysplastic syndrome. J Clin Oncol 2005;23 : 5675–5687.
14. Krejci M, Doubek M, Dusek J, et al. Combination of fludarabine, amsacrine, and cytarabine followed by reduced-intensity conditioning and allogeneic hematopoietic stem cell transplantation in patients with high-risk acute myeloid leukemia. Ann Hematol 2013;92 : 1397–1403.
15. Krejci M, Doubek M, Brychtova Y, et al. Fludarabine with cytarabine followed by reduced-intensity conditioning and allogeneic hematopoietic stem cell transplantation in patients with poor-risk chronic lymphocytic leukemia. Ann Hematol 2013;92 : 249–254.
16. Przepiorka D, Weisdorf D, Martin P, et al. Consensus conference on acute GVHD grading. Bone Marrow Transplant 1995;15 : 825–828.
17. Rowlings PA, Przepiorka D, Klein JP, et al. IBMTR severity index for grading acute graft-versus-host disease: retrospective comparison with Glucksberg grade. Br J Haematol 1997;97 : 855–864.
18. Shulman HM, Sullivan KM, Weiden PL, et al. Chronic graft-versus-host syndrome in man. A long-term clinicopatologic study of 20 Seattle patients. Am J Med 1980;60 : 204–217.
19. Filipovich AH, Weisdorf D, Pavletic S, et al. National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant 2005;11 : 945–956.
20. Krejci M, Doubek M, Buchler T, et al. Mycophenolate mofetil for the treatment of acute and chronic steroid-refractory graft-versus-host disease. Ann Hematol 2005;84 : 681–685.
21. Mayer J, Krejci M, Doubek M, et al. Pulse cyclophosphamide for corticosteroid-refractory graft-versus-host disease. Bone Marrow Transplant 2005;35 : 699–705.
22. Lion T. Summary: reports on quantitative analysis of chimerim after allogeneic stem cell transplantation by PCR amplification of microsatellite markers and capillary electrophoresis with fluorescence detection. Leukemia 2003;17 : 232–254.
23. Passweg JR, Baldomero H, Bader P, et al. Impact of drug development on the use of stem cell transplantation: a report by the European society for blood and marrow transplantation (EBMT). Bone Marrow Transplant 2017;52 : 191–196.
24. Passweg JR, Baldomero H, Bader P, et al. Hematopoietic SCT in Europe 2013: recent trends in the use of alternative donors showing more haploidentical donors but fewer cord blood transplants. Bone Marrow Transplant 2015;50 : 476–482.
25. Barret A, Savani BN. Stem cell transplantation with reduced-intensity conditioning regimens: a review of ten years´ experience with new transplant concepts and new therapeutic agents. Leukemia 2006;20 : 1661–1672.
26. Finke J, Bethge WA, Schmoor C, et al. Standard graft-versus-host disease prophylaxis with or without anti-T-cell globulin in haematopoietic cell transplantation from matched unrelated donors: a randomized, open-label, multicenter phase 3 trial. Lancet Oncol 2009;10 : 855–864.
27. Vítek A, Vydra J, Marková-Šťastná M, et al. Transplantace krvetvorných buněk v Ústavu hematologie a krevní transfúze (1986–2016). Transfuze Hematol dnes 2017;23 : 54–66.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2018 Číslo 4- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Vplyv nádorového metabolizmu na terapiu detských leukémií
- Registr dárců plné krve – srovnání dat 12 zařízení transfuzní služby v letech 2008 a 2016
- Bezpečnost a efektivita léčby rituximabem u dětí s autoimunitním onemocněním
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
- Dlouhodobě skladované kryokonzervované transplantáty a jejich likvidace
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- Nové poznatky o mechanismech opravy DNA po poškození alkoholem
- EMA schválila první imunoterapii pomocí CAR T-lymfocytů
- Životní jubileum prof. MUDr. Radima Brdičky, DrSc.
- Prim. MUDr. Josef Nedvěd
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- EMA schválila první imunoterapii pomocí CAR T-lymfocytů
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



