-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
Hypercalcemia may be the first sign of multiple myeloma, but not only that
Hypercalcemia associated with malignancy is relatively common, occurring in up to 20–30% of cancer patients. It can occur in patients with both solid tumours and haematological malignancies, the most common being multiple myeloma, breast cancer, lung cancer and renal cell carcinoma. However, hyperparathyroidism, sarcoidosis and hereditary or acquired endocrine disorders should be considered in the differential diagnosis. The signs and symptoms of hypercalcemia are often nonspecific and include fatigue, nausea, vomiting, constipation and confusion, making the diagnosis challenging. These clinical features often mimic general symptoms of the underlying cancer itself or the adverse effects of treatment such as chemotherapy. The development of hypercalcemia of malignancy indicates a poor prognosis for patients with multiple myeloma or other cancer. This text describes the differential diagnosis and therapy.
Keywords:
hypercalcemia – bisphosphonates – denosumab – multiple myeloma – hyperparathyroidism – sarcoidosis – hereditary hypercalcemia
Autoři: Z. Adam 1; K. Starý 2; K. Zajíčková 3; Z. Řehák 4; R. Koukalová 4; A. Šprláková-Puková 5; M. Tomíška 1; M. Doubková 6; Z. Čermáková 7; M. Krejčí 1; V. Sandecká 1; M. Štork 1; L. Ostřížková 1
; A. Čermák 8; L. Pour 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Interní gastroenterologická klinika LF MU a FN Brno 2; Endokrinologický ústav, Praha 3; Oddělení nukleární medicíny, centrum PET, RECAMO. Masarykův onkologický ústav, Brno 4; Klinika radiologie a nukleární medicíny FN Brno a LF MU v Brně 5; Klinika nemocí plicních a tuberkulózy LF MU a FN Brno 6; Oddělení klinické biochemie FN Brno a Katedra laboratorních metod LF MU Brno 7; Urologická klinika LF MU a FN Brno 8
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 4, p. 238-252.
Kategorie: Souhrnné/edukační práce
Souhrn
Hyperkalcemie asociovaná s maligním onemocněním je relativně častým problémem, který v průběhu onemocnění postihne 20–30 % pacientů s nádorovým onemocněním. Nejčastější maligní choroby, u nichž v počátku či v průběhu nemoci se manifestuje hyperkalcemie, je mnohočetný myelom, karcinom prsu, karcinom plic a karcinom ledviny. V diferenciálně diagnostické úvaze je však třeba zmínit hyperparatyreoidózu, granulomatózní procesy, hlavně sarkoidózu a hereditární či získané endokrinní choroby. Příznaky hyperkalcemie jsou často nespecifické, jako je patologická únava, nevolnost, zvracení, zácpa a také spavost a zmatenost, což ztěžuje stanovení diagnózy. Tyto příznaky totiž lze vysvětlit také obecnými příznaky nádorové nemoci nebo nežádoucími účinky farmakoterapie, třeba podaných cytostatik. Hyperkalcemie je stále nepříznivým prognostickým znamením. V textu je popsána diferenciální diagnostika a léčba hyperkalcemie.
Klíčová slova:
hyperkalcemie – bisfosfonáty – denosumab – mnohočetný myelom – hyperparatyreoidóza – sarkoidóza – vrozená hyperkalcemie
ÚVOD
Klinické projevy hyperkalcemie jsou velmi pestré a pro samotné symptomy lze najít vždy více vysvětlení. Nevolnost, zvracení oblenění pasáže a zácpu lze u nemocného vysvětlit vlivem opioidů či dalších léků (chemoterapie) nebo onemocněním zažívacího traktu. Zmatenost lze považovat za nástup psychiatrické nemoci či medikamenty indukované zmatenosti. Selhání ledvin lze vysvětlit četnými léky či samostatným onemocněním ledvin. A špatná interpretace příznaků zavedla třeba jednoho našeho pacienta nejprve na psychiatrické oddělení. A psychiatři po vyšetření hladiny vápníku diagnostikovali zmatenost při hyperkalcemii. Nejznámější krevní chorobou, která způsobuje hyperkalcemii, je mnohočetný myelom. A proto právě nemocní s hyperkalcemií jsou odesíláni do ambulancí specializovaných pro mnohočetný myelom s otázkou, má-li či nemá-li pacient právě tuto krevní chorobu. V souboru téměř 5 tisíc pacientů mělo 13 % nemocných hyperkalcemii při stanovení diagnózy jako jeden z prvních projevů nemoci [1]. To, že jedním z prvních příznaků jsou projevy hyperkalcemie, signalizuje signifikantně horší prognózu ve srovnání s pacienty s mnohočetným myelomem, u nichž při stanovení diagnózy byla hladina kalcia v normě [2].
Mnohočetný myelom je častou příčinou hyperkalcemie, ne však jedinou nemocí, která hyperkalcemii způsobuje. Pokud nalezneme hyperkalcemii a monoklonální imunoglobulin, neznamená to vždy, že je to hyperkalcemie u mnohočetného myelomu. Monoklonální gamapatie se vyskytuje relativně často až u 3 % osob starších 50 let, a může být provázena hyperkalcemii neplazmocytární etiologie. Hyperparatyreózu lze snadno zjistit vyšetřením hladiny parathormonu, ale jako příčina byla například popsána i sarkoidóza u pacienta s MGUS. Část textu je proto věnována diferenciální diagnostice hyperkalcemie z úhlu pohledu hematologů, endokrinologů, specialistů na sarkoidózu a také zobrazovacích lékařů a biochemiků. V závěru je uveden přehled léčby.
Cílem článku je také připomenout, že je vhodné stanovit vápník při vyšetřování každého nejasného onemocnění a je vhodné vápník vyšetřit i v rámci preventivních prohlídek.
FYZIOLOGICKÁ HOMEOSTÁZA KALCIA
Ionizované a celkové kalcium
Z celkového kalcia v těle je 99 % deponováno v hydroxyapatitu, který je základním kamenem pro tvorbu kostí a rezervoárem kalcia pro další tkáňové kompartmenty. Pouze malá část celkového kalcia je lokalizována v intracelulární a extracelulární tekutině. Udržování stabilní fyziologické koncentrace kalcia v těchto tekutinách je zásadní pro normální průběh akčních potenciálů ve svalových a nervových buňkách, pro svalovou kontrakci, pro exocytózu neurotransmiterů a hormonů, pro regulaci buněčného růstu, pro aktivaci koagulace. Také aktivita četných enzymů je regulována koncentrací kalcia [3].
Kalcium se v krvi vyskytuje ve třech formách. Přibližně 50 % kalcia je vázáno na bílkoviny, dominantně na albumin. Malá část kalcia je vázána v komplexech citrátů a fosfátů. Zbylé množství, 45–50 % se v séru vyskytuje jako ionty Ca2+. A pouze toto ionizované kalcium je biologicky aktivní [3].
Dříve byly pro pacienty se zásadní odchylkou koncentrace celkové bílkoviny a albuminu používány vzorce pro přepočet hladiny vápníku na normální hladiny albuminu a celkové bílkoviny. Dnes je jednodušší vyšetřit ionizované kalcium u všech pacientů s abnormálními hodnotami albuminu anebo celkové bílkoviny.
Jedno z pravidel pro přepočet hladiny vápníku zní: „na každých 10 g albuminu/l, chybějících do průměrné normální hladiny 40 g/l, je třeba přičíst 0,2 mmol/l Ca“ [4].
Poměr vázaného a ionizovaného kalcia souvisí s pH, při poklesu pH na nižší hodnoty (při acidóze) se zvyšuje koncentrace ionizovaného kalcia.
Regulační mechanismy
Za fyziologických okolností je hladina ionizovaného kalcia udržována ve velmi úzkém rozmezí. Na regulaci se podílí parathormon (PTH), metabolity vitaminu D a kalcitonin. Tyto tři zásadní fyziologické regulační faktory ovlivňují rychlost přestupu kalcia mezi kostí a extracelulární tekutinou, prostupy kalcia tubuly ledvin a mukózou trávicího traktu.
Množství kalcia vstřebaného trávicím traktem se pohybuje mezi 15–60 % množství přijatého potravou. Aktivní vstřebávání střevní mukózou je stimulováno 1,25-dihydroxyvitaminem D a nepřímo PTH díky jeho vlivu na metabolismus vitaminu D [3].
Kalcium je v ledvině volně filtrováno v glomerulu, denně 8–10 g, ale většina vápníku (98 %) je zpět vstřebána, takže močí je vyloučeno 100–300 mg/24 hodin, což odpovídá 2,5–7,5 mmol/24 hod.
Většina vápníku je vstřebána v proximálním tubulu v procesu spjatém se vstřebáváním sodíku, nezávisle na parathormonu. Parathormon stimuluje vstřebávání vápníku v distálním tubulu a současně inhibuje vstřebávání fosfátů.
Kosti neustále podléhají postupné přestavbě, asi 500 mg kalcia je denně z kosti uvolněno a na jiném místě uloženo. Jak PTH, tak 1,25-dihydroxyvitamin D stimulují resorpční pochody z kosti, zatímco kalcitonin inhibuje resorpci [3].
Parathormon
Je polypeptid obsahující 84 aminokyselin, je produkován buňkami příštítných tělísek a secernován v závislosti na koncentraci ionizovaného kalcia v prostředí. Informace o koncentraci kalcia v okolním prostředí je přenášena do buňky receptorem pro kalcium (calcium sensing receptor). Při vzestupu kalcia v okolním prostředí se calcium sensing receptor aktivuje a potlačí tvorbu parathormonu.
Ten samý receptor je přítomný v parafolikulárních buňkách ve štítné žláze, tvořících kalcitonin. Aktivace receptoru v buňkách tvořících kalcitonin zvýší tvorbu kalcitoninu.
Dále aktivace calcium sensing receptoru v tubulárních buňkách v ledvině sníží reabsorbci vápníku.
Mutace, které vedou k inaktivaci calcium sensing receptoru, způsobují hyperkalcemii s hypokalciurií. Tato nemoc je autosomálně dominantně dědičná [5]. Naopak, mutace, které vedou ke zvýšené aktivitě calcium sensing receptoru vedou k autosomálně dominantní hypokalcemii [5].
Laboratorní vyšetřování hyperkalcemie
Stanovení kalcia je dnes standardizovanou metodou a fyziologické hodnoty se udávají 2,15–2,55 mmol/l. Pro stanovení vápenatého kationtu je při odběru nutné zabránit nadměrnému zatažení paže manžetou, což může způsobit zvýšení hladiny vápníku o 0,12–0,25 mmol/l v důsledku vytlačení vody z cévního kompartmentu. Odebírá se srážlivá nebo nesrážlivá krev s přídavkem heparinátu litného. Je nutno zabránit kontaminaci vzorku cheláty, jako je EDTA nebo citrát, které jsou používány pro vyšetření krevního obrazu. EDTA či jiné cheláty na sebe pevně váží kalcium, což sníží hodnotu kalcia ve vyšetřovaném vzorku.
V rámci diferenciální diagnostiky hyperparatyreózy se často zdůrazňuje důležitost vyšetření odpadu kalcia močí za 24 hod. Pro stanovení kalcia ve sbírané moči je nutno brát vzorek z celého promíchaného množství a v laboratoři je nutno provést acidifikaci pro uvolnění vápníku z vazby. Je vhodné též stanovit kreatinin pro posouzení správnosti sběru moče. Problémem stanovení kalcia v moči sbírané po 24 hodin spočívá v obvykle nízké kvalitě (přesnosti) sběru. V praxi se nyní nepoužívá pro stanovení kalciurie standardní dieta. Referenční hodnoty kalciurie nejsou většinou udávány současně s údajem o dietě. Rozmezí kalciurie pro muže je 2,4–7,5 mmol/24 hod, pro ženy je horní referenční mez 6,2 mmol/24 hod. Za hyperkalciurii lze považovat zvýšený odpad vápníku za 24 hodin nad referenční mez a současně je poměr Ca/kreatinin v moči nad 0,6. Při dietě s dostatečným množstvím kalcia by kalciurie neměla být nižší než 2,0 mmol/24 hod [3].
K dalším parametrům, které se vyšetřují při diferenciální diagnostice hyperkalcemie, zmíníme koncentraci fosfátů v séru, aktivitu alkalické fosfatázy, 25-hydroxyvitamin D, případně 1,25-dihydroxyvitamin D a dále sbíranou moč za 24 hodin a v ní nejen kalciurii, ale také poměr kalcia a kreatininu v moči.
Příznaky hyperkalcemie
Příznaky hyperkalcemie se odvíjejí od výše ionizovaného kalcia. Nádorové hyperkalcemie obvykle mají rychlý vzestup kalcemie v čase a s tím související rychlý nástup symptomů. Chronická hyperkalcemie, provázející hyperparatyreózu, má podstatně méně intenzivní příznaky. Pacienti s hyperparatyreózou a hyperkalcemií mají často i vyšší krevní tlak, který se normalizuje po odstranění nadprodukce parathormonu. A tak vyšetření kalcia patří ke standardním vyšetřením u všech osob s hypertenzí.
Ale nejenom dehydratace, zvracení a selhání ledvin jsou příznaky hyperkalcemie. Zvýšené hladina kalcia způsobuje také různé poruchy funkce CNS, z nichž nejčastější je zmatenost. Vyšetření hladiny kalcia by proto mělo patřit ke standardu i při všech nově vzniklých psychiatrických odchylkách. Klinické příznaky podle jednotlivých orgánů shrnuje tabulka 1.
Tab. 1. Příznaky hyperkalcemie 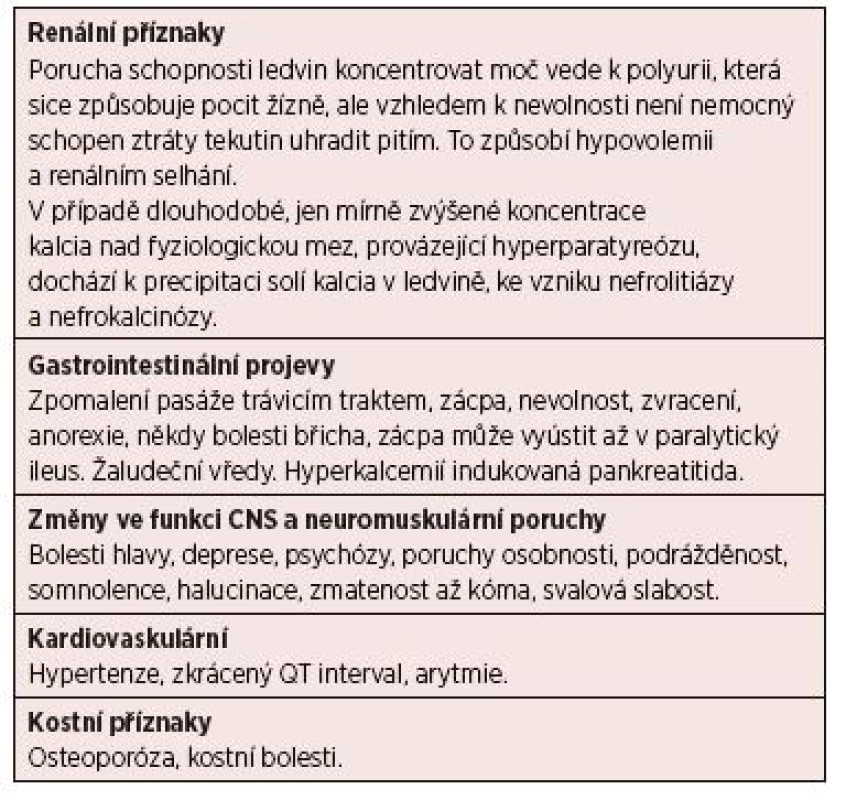
Přehled příčin hyperkalcemie
Hyperkalcemie je nejčastěji způsobena buď hyperparatyreoidózou, nebo maligní chorobou, která nějakým způsobem zvyšuje hladinu kalcia. Ostatní příčiny, zmíněné v textu, jsou méně časté. Pro diferenciální diagnostiku je vhodné rozdělit hyperkalcemie na:
- hyperkalcemii se zvýšenou hodnotou parathormonu (PTH dependentní),
- hyperkalcemie s nezvýšenou hodnotou parathormonu (PTH independentní) [3].
Jednotlivé příčiny pak uvádí tabulka 2.
Tab. 2. Přehled etiologie hyperkalcemie 
Primární hyperparatyreoidóza
Dříve bývala hyperparatyreoidóza diagnostikována až při závažném poškození organismu, při nefrolithiáze či nefrokalcinóze, a tak panovala představa, že jde o nemoc velmi vzácnou. V posledních letech, kdy je hladina kalcia vyšetřována rutinně v rámci laboratorního vyšetření, indikovaného z jiných důvodů, či z důvodů preventivních, tak většina případů hyperparatyreoidózy bývá diagnostikována zcela náhodně v době, kdy zvýšení kalcia a parathormonu je bezpříznakové. Mnozí pacienti nemají žádné příznaky či jejich příznaky jsou jen mírné a hladina kalcia zůstává stabilní po více let. K nespecifickým příznakům nezávažné hyperkalcemie patří deprese, bolesti svalů, svalová slabost, ale také zácpa, projevy nefrolitiázy, nefrokalcinózy a urolitiázy, nebo i kostní projevy. Příznaky jsou podobné, ale méně intenzivní než při nádorem indukované hyperkalcemii. Pacienti s hyperparatyreoidózou mají často vyšší krevní tlak, který se po úspěšné operaci sníží [6].
Broulík uvádí, že v sedmdesátých letech minulého století byla incidence hyperparatyreoidózy 8 nových případů/100 000 obyvatel, zatímco v současnosti se incidence zvýšila na 24 případů/100 000 obyvatel a je 4krát častější u žen než u mužů [6]. Příčina tohoto prudkého vzestupu není jasná, podílet se na ní bude možná častější vyšetřování kalcia v rámci preventivních vyšetření.
Z uvedených důvodů by rozhodnutí o léčbě mělo být opřeno o přítomnost komplikací, způsobených primární hyperparatyreoidózou [6].
Rozlišují se následující stavy:
- Primární hyperparatyreoidóza – primární odchylka s nadměrnou tvorbou PTH.
- Sekundární hyperparatyreoidóza – nadměrná tvorba parathormonu je odpovědí na nízkou koncentraci vápníku v těle, většinou u pacientů s nemocemi ledvin, příčinou mohou být i malabsorbční poruchy a další.
- Terciální hyperparatyreoidóza – chronická stimulace příštítných tělísek hypokalcemií u renální insuficience vede nakonec k autonomní hyperfunkci [6].
Existuje i normokalcemická nebo epizodická hyperparatyreóza. Léčba je identická, jen diagnostika je složitější. Přestože laboratorně se jedná o méně nápadné formy primární hyperparatyreózy, lze i u nich očekávat typické komplikace.
Morfologickým podkladem zvýšené tvorby PTH je v 80–90 % benigní adenom příštítného tělíska.
V 10–15 % jde o onemocnění více tělísek nebo o difuzní parathyreoidální hyperplazii.
V méně než 1 % jde o karcinom příštítných tělísek [6]. Zcela raritně je PTH produkován ektopicky, například funkčními neuroendokrinními nádory pankreatu.
Obtížnou diferenciálně diagnostickou otázku pak představují hereditární formy hyperparathyreoidózy [7].
Projevy primární hyperparatyreoidózy
Biochemicky prokazujeme hyperkalcemii a normo - nebo hypofosfatemii (v důsledku inhibice reabsorpce fosfátu v proximálním tubulu). Hodnota PTH je zvýšená, někdy jen mírně, někdy značně. Normální PTH při hyperkalcemie také může znamenat PTH podmíněnou hyperkalcemie. Neboli je-li při hyperkalcemii hodnota PTH jiná než přiměřeně nízká, může jít o PTH podmíněnou hyperkalcemii.
Kalcium je ve zvýšené míře vylučováno močí – hypekalciurie obvykle > 400 mg/den, což odpovídá 10 mmol/24 hod., která diferencuje primární hyperparatyreózu od familiární hypokalciurické hyperkalcemie. S délkou trvání hyperfunkce příštítných tělísek se progresivně snižuje hodnota kostní hmoty měřené pomocí dvoufotonové denzitometrie (DEXA) a vzniká rentgenový obraz subperiostální resorpce s tvorbou hnědých tumorů nebo osteitis fibrosa, což svědčí pro delší trvání onemocnění. Časté jsou fraktury obratlů či v oblasti kyčlí po neadekvátním traumatu nebo i zcela bez úrazového děje. Hyperkalcemie spolu s nadprodukcí 1,25 (OH)2D vytvářejí podmínky pro ukládání kalcia v ledvině, k tubulointersticiálnímu postižení nebo nefrolitiáze či urolitiáze. Hyperkalcemie u některých nemocných s primární hyperparatyreoidózou poškozuje tubulární funkce ledvin a způsobuje nefrogenní diabetes insipidus, a tedy polyurii [6]. Přibližně 5 % pacientů s ledvinnými kameny má diagnostikován hyperparatyreoidózu. Takže urologové jsou jednou z odborností, která tuto endokrinologickou abnormalitu diagnostikuje. Hyperkalcemie však může také indukovat žaludeční vředy a pankreatitidu [6] a v neposlední řadě zvyšuje krevní tlak v důsledku kalciem-indukované vazokonstrikce [6].
Zobrazovací možnosti adenomu příštítného tělíska
Sonografické a scintigrafické vyšetření jsou základem pro zobrazení parathyreoideální tkáně nadměrně produkující parathormon.
Sonograficky lze zobrazit většinu hyperfunkčních příštítných tělísek. Správnost diagnózy můžeme v případě potřeby ověřit biochemickým vyšetřením punktátu.
Je nutné uvést, že „normální“ příštítné tělísko přiměřené velikosti a funkce nelze zobrazit zpravidla žádnou zobrazovací metodou. Zobrazovací metody se proto využívají prakticky jenom k lokalizaci patologicky zvětšených a/nebo hyperfunkčních příštítných tělísek, nejedná se o diagnostické vyšetření příštítných tělísek v pravém slova smyslu. Zobrazení a lokalizace hyperprodukující parathyreoidální tkáně má hlavní význam pro chirurgický výkon. Přesná lokalizace (zejména ektopických adenomů příštítných tělísek) ovlivňuje zásadně úspěšnost operace a umožňuje v řadě případů provést jenom miniinvazivní výkon. Zobrazovací techniky jsou efektivní zejména na pracovištích, kde se provádí větší počet vyšetření a je zpětná vazba z operačních nálezů.
Standardem scintigrafického vyšetření je dnes zobrazení pomocí isonitrilů (scintigrafie 99mTc-methoxyizobutylizonitril = MIBI). Je to lipofilní kationt, který byl do klinické praxe zaveden koncem 80. let minulého století k vyšetření perfuze myokardu. Brzy byla zjištěna jeho akumulace v nejrůznějších maligních nádorech. Začal být proto využíván i v nespecifické onkologické diagnostice. Přesný mechanismus akumulace v nádorech nebyl u radiofarmak značených 99mTc zatím zcela objasněn. MIBI je převážně akumulován v mitochondriích viabilních buněk a v cytoplasmě. Hlavním mechanismem akumulace je pravděpodobně elektrostatická přitažlivost mezi kladným nábojem lipofilní molekuly MIBI a negativním nábojem v mitochondriích. 99mTc-MIBI je po nitrožilní aplikaci akumulován ve štítné žláze a v adenomech příštitných tělísek [8]. Ze štítné žlázy je poměrně rychle vyplavován, na rozdíl od příštitných tělísek a tím se mění poměr aktivity. Vyšetření se provádí obvykle jako dvoufázová scintigrafie (snímáme za 10 a 120 minut po nitrožilní aplikaci cca 700–800 MBq 99mTc MIBI) s možností odečtu časných a pozdních snímků.
Senzitivita metody na pracovištích, která se touto problematikou zabývají, je udávána okolo 90 %, specificita okolo 95 %. Podmínkou je dostatečná zkušenost a kvalitní přístrojové vybavení. Vysoké diagnostické přesnosti se nejčastěji dosahuje pomocí tomografické techniky SPECT (single photon emission computed tomography) ve spojení s CT zobrazením. To dovolí přesnou anatomickou identifikaci ložisek se zvýšenou kumulací aktivity. Tyto informace jsou cenné před chirurgickým výkonem, při kterém je možné použít scintilační sondu a provést navigovaný chirurgický výkon.
Nejnověji se k zobrazování využívá PET (positron emission tomography) ve spojení s CT nebo MR po aplikaci radiofarmaka 18F-fluorocholinu (FCH) [9]. PET má lepší rozlišení než SPECT a 18F-fluorocholin se akumuluje v příštítných tělískách jiným způsobem než MIBI. PET/CT s fluorocholinem může být rozhodujícím vyšetřením v případech, kdy nebylo úspěšné ultrazvukové a MIBI vyšetření [9].
V ČR je tato metoda již dostupná. Díky vysoké efektivitě PET/CT s fluorocholinem téměř vymizí situace, kdy jsme nechali chirurga exstirpovat příštítné tělísko „naslepo“. Jedná se o inovativní diagnostický postup, a proto není možno odhadnout četnost indikací. Již nyní lze ale říci, že má metoda své místo v diagnostickém algoritmu PHP. Obrázky 1–4 ukazují, jak vypadá zobrazení adenomu příštítného tělíska pomocí PET/MR vyšetření s aplikací radiofarmaka fluorocholinu, provedené na PET/MR přístroji ve FN Brno.
Obr. 1. Sagitální rovina PET (pozitronové emisní tomografie) po aplikaci 18fluorcholinu (18-FCH) Šipka označuje místo zvýšené akumulace radiofarmaka, tedy na oblast hyperfunkčního příštítného tělíska 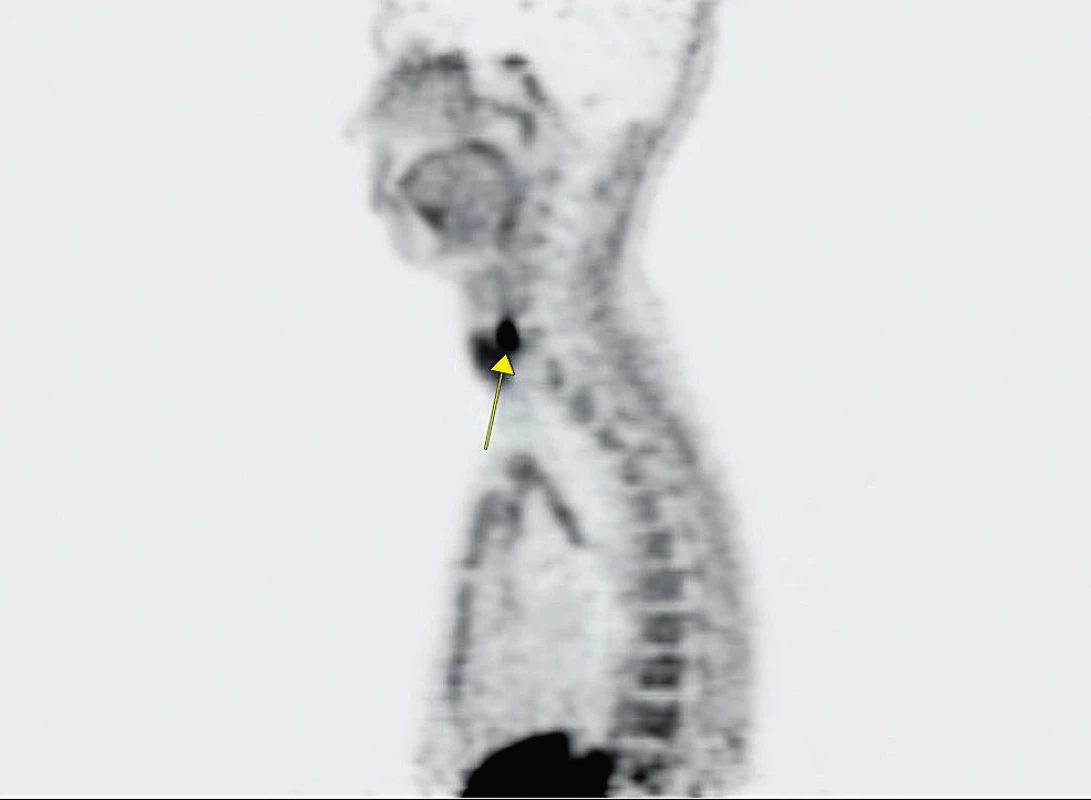
Obr. 2. PET zobrazení v rovině transverzální Šipka směřuje k místu hypermetabolismu, k hyperfunkčnímu příštítnému tělísku 
Obr. 3. Fúze obrazů PET a MR v transverzální rovině přesně dokumentuje místo zvýšené akumulace radiofarmaka (18-FCH) K ložisku směřuje šipka. Náběr dat pro PET i MR část je provázen simultánně, nejedná se o fúzi prováděnou až po jednotlivých vyšetřeních. Vyšetření probíhá na přístroji PETMR GE Signa 3.0T. 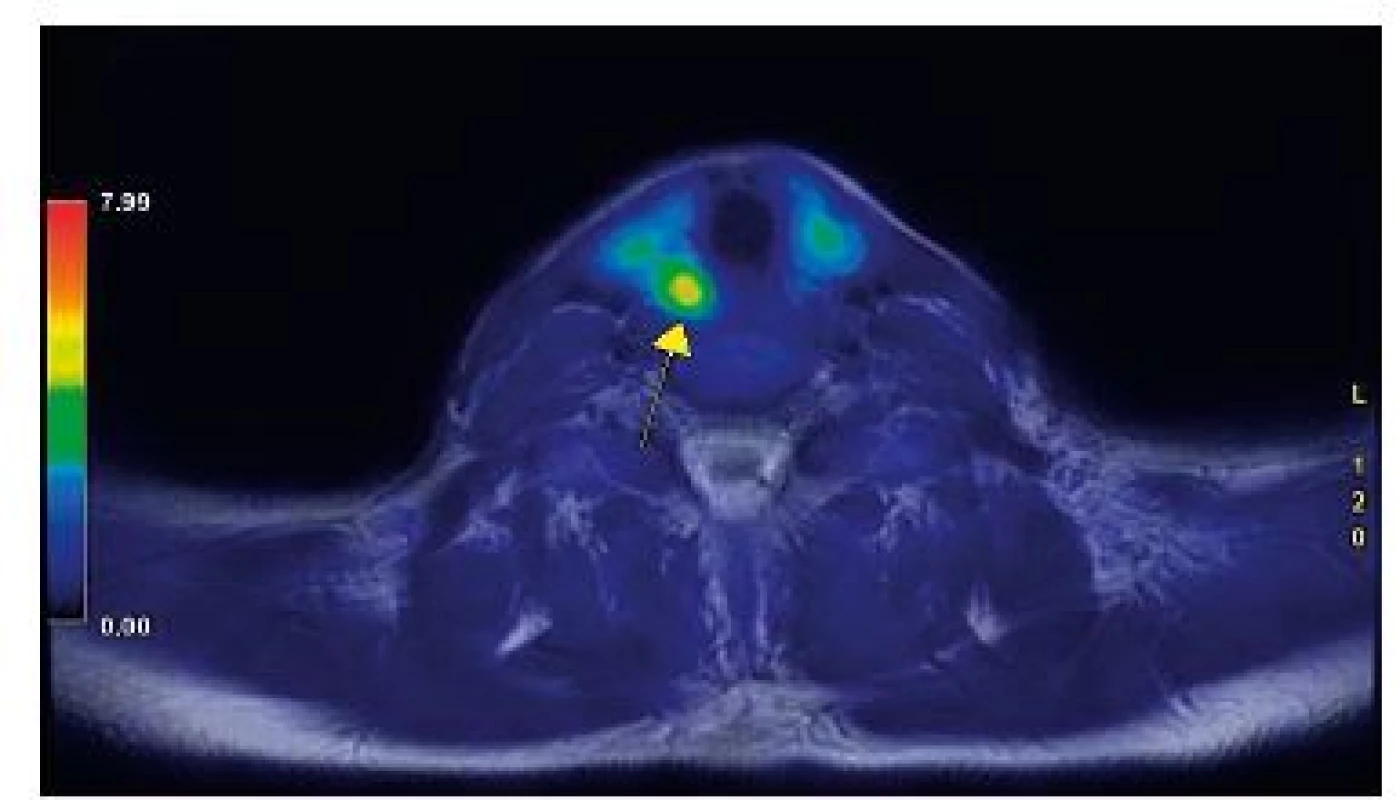
Obr. 4. MR obrázek v transverzální rovině, T2 sekvence Šipka směřuje k dorzokraniálnímu okraji pravostranného laloku štítné žlázy, kde je patrná drobná nodularita v T2 sekvenci vykazující na fúzovaných (PET a MR) obrázcích hypermetabolismus odpovídající hyperfunkčnímu příštítnému tělísku. 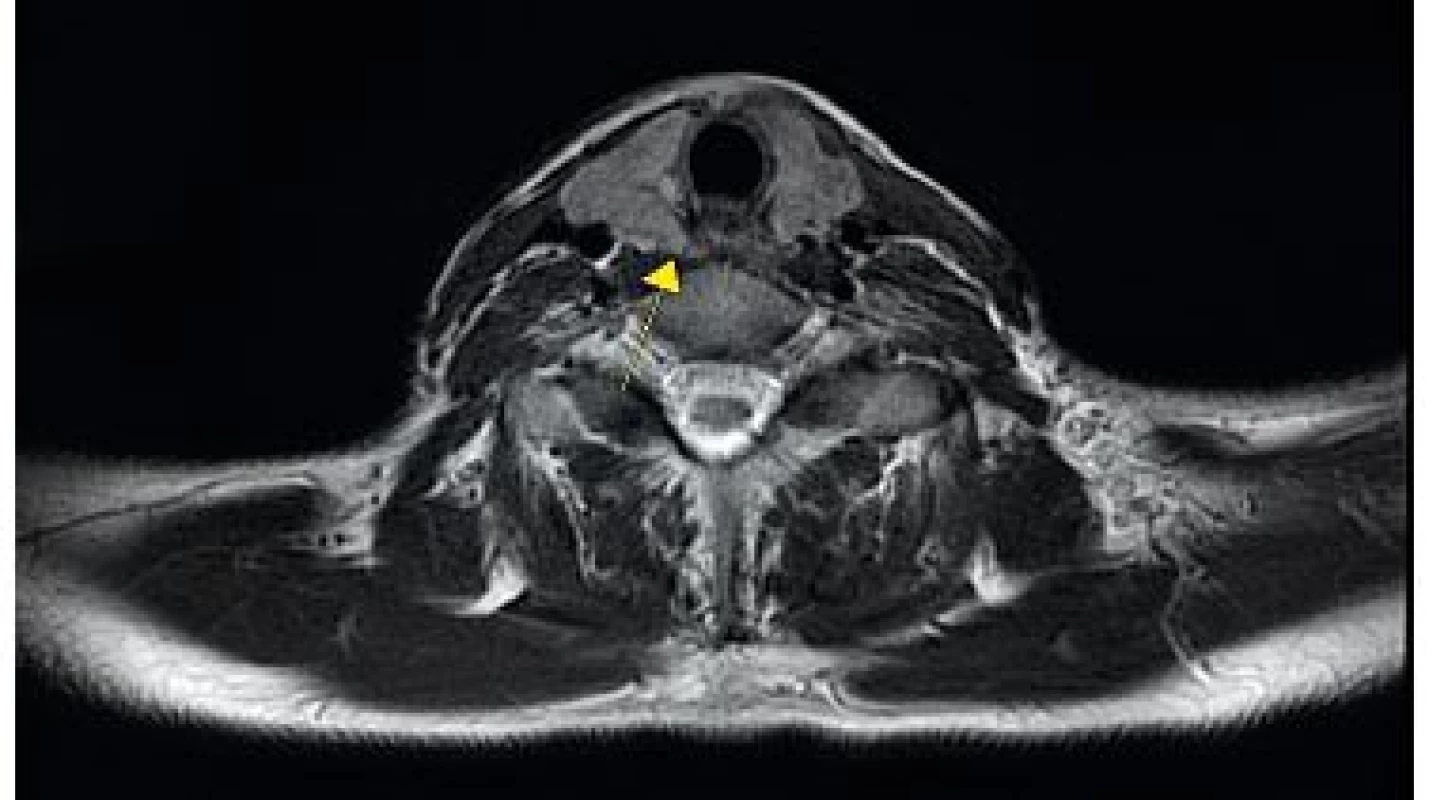
Užití radioizotopových zobrazovacích technik pro lokalizaci hyperprodukující parathyroideální tkáně má smysl jen v případech, pokud je signifikantně zvýšena hladina parathormonu. Nejlepších výsledků dosahuje scintigrafie právě při vysoké hladině parathormonu i kalcia. Při hraničních hodnotách scintigrafie zpravidla selhává (nedostatečně zvětšené tělísko s malou metabolickou aktivitou). Klasické CT a MR vyšetření má také své místo v diagnostice, ale nejpřínosnější je kombinace CT anebo případně i MR s radioizotopovým zobrazením [9].
Léčba hyperparatyreoidózy
Pokud se podaří zobrazit a detekovat suspektní příštítné tělísko, je léčba operační [10]. Vhodné je provádět resekce adenomů příštítných tělísek na specializovaných pracovištích. Při operačním řešení se používá peroperační sonografie či detekce pomocí označení příštítného tělíska radiofarmakem MIBI s následnou detekcí ložiska zářením (gammanavigovaná explorace).
Pokud se nepodaří najít příštítné tělísko, zbývá jedině léčba farmakologická, pokud se nesáhne k exploraci krku zkušeným chirurgem. Kličková diuretika mohou mírně snížit kalcemii, naopak nezbytné je vysazení thiazidových diuretik, která mají opačný efekt. Klasické antiresorptivní léky, jako jsou bisfosfonáty nebo raloxifen, sice nemají signifikantní vliv na hladinu kalcia a parathormonu, ale snižují resorpci kosti a zvyšují kostní denzitu osob léčených s hyperparatyreózou.
Jako kalcimimetické léky se označují takové látky, která aktivují calcium sensing receptor. Výsledkem je pokles koncentrace parathormonu a kalcia. V současnosti je k dispozici tabletová forma kalcimimetického agens zvaná cinacalcet (Mimpara). Používá se u pacientů, u kterých není možná operační léčba [11]. Nízkokalciová dieta zvýší efekt farmakologické léčby. Pro pacienta je často velmi neoblíbená. Pozitivní motivací je příslib vysokokalciové diety po úspěšné resekci příštítného adenomu.
Hyperkalcemie související s maligní chorobou
K hyperkalcemii může dojít až po dlouhodobějším normokalcemickém průběhu maligní choroby, a pak hyperkalcemie signalizuje transformaci do agresivnější formy nemoci a tedy obvykle špatnou prognózu. Někdy však mohou být symptomy hyperkalcemie, například zmatenost, prvními příznaky dosud nerozpoznaného mnohočetného myelomu. Jeden z našich pacientů s mnohočetným myelomem byl po první návštěvě svého lékaře poslán na psychiatrii pro závažnou zmatenost. Až tam vyšetřili kalcium a přesměrovali jej na interní oddělení, kde byla stanovena diagnóza dříve nepoznaného mnohočetného myelomu.
Z maligních chorob, které svými buňkami infiltrují (invadují) skelet a indukují osteolýzu, je třeba zmínit mnohočetný myelom a karcinom prsu, plic nebo ledvin s metastázami do skeletu.
Hyperkalcemie při maligní chorobě může vzniknout i bez invaze maligních buněk do kosti. Nejčastěji se to popisuje u dlaždicobuněčných tumorů plic, jícnu, nádorů hlavy a krku, gynekologických malignit, karcinomu prsu a karcinomu ledvin. Ale prakticky i každá jiná neoplazie může být příčinou hyperkalcemie.
Molekulární příčiny hyperkalcemie u maligních chorob jsou velmi pestré. V případě mnohočetného myelomu jde o sekreci četných cytokinů, které ve svém důsledku aktivují osteoklasty (tumor necrosis factor beta, interleukin-1, interleukin-6). V případně lymfomů se v některých případech prokázala zvýšená tvorba 1,25-dihydroxyvitaminu D, nebo peptidu zvaného parathormon releated peptide (PTHrP). Případy, kdy by tumor produkoval přímo parathormon, jsou vzácné, spíše šlo o koincidenci hyperparatyreózy a maligní nemoci.
Hyperkalcemie u solidních nádorů je většinou způsobena látkami, které jsou kategorizovány jako PTHrP, což je bílkovina, která má s parathormonem četné společné biologické vlastnosti a sekvenci prvních 13 aminokyselin, které zodpovídají za jeho aktivitu. Parathormon se skládá pouze z 84 aminokyselin, zatímco PTHrP má více izoforem, které obsahují od 139 do 173 aminokyslin. Biologická aktivita PTH a PTHrP je téměř identická, ale ne zcela, PTHrP neaktivuje 1-alfa hydroxylázu 25-hydroxyvitaminu D. Pacienti, kteří mají hyperkalcemii způsobenou PTHrP, mají obvykle nízké koncentrace jak PTH, tak i 1,25-dihydroxyvitaminu D, protože PTHrP není detekovatelný klasickým testem používaným k průkazu PTH. PTHrP není nádorově specifický, je to fyziologicky tvořený peptid různými buňkami s fyziologickými funkcemi. V případně nádorových buněk je však produkován v nadbytku a to vede k vzestupu hladiny kalcia [12, 13, 14].
V aktivaci osteolýzy má zásadní význam aktivace signalizace dráhy RANK-RANKL. Kostní tkáň podléhá neustálé přestavbě, starší struktury hydroxyapatitu jsou odstraňovány a nahrazovány novými. Klíčové role v tomto procesu mají osteoblasty, které kost budují a osteoklasty, které ji odbourávají. Prekurzory osteoblastů mají na svém povrchu receptor zvaný RANK (receptor activator of NF-κB , nuclear factor-kappa B). RANK je aktivizován pomocí RANKL (RANK-Ligand), které se mimo jiné nachází na povrchu osteoblastů. Aktivace RANK pomocí RANKL stimuluje vyzrávání pre-osteoclastů do aktivních osteoklastů a tím osteolýzu [14]. Cílem léčby hyperkalcemie je zastavit patologicky zvýšenou aktivitu osteoklastů. Toho lze dosáhnout aplikací bisfosfonátů, jimž bylo v české literatuře věnováno hodně publikací a nejnověji pomocí denosumabu. Denosumab inhibuje maturaci osteoklastů tím, že váže a inaktivuje RANKL. To odpovídá přirozené aktivitě osteoprotegerinu, endogenního inhibitoru RANKL. Aktivita osteoprotegerinu za některých okolností nestačí regulovat nádorem zvýšenou osteolýzu a v případech pacientů s osteoporózou není zcela jasná příčina snížené aktivity osteoprotegerinu.
SARKOIDÓZA A DALŠÍ ZÍSKANÉ PŘÍČINY HYPERKALCEMIE
Sarkoidóza
Granulomatózní choroby jsou další známou příčinou hyperkalcemie. Sarkoidóza je systémové granulomatózní nekaseifikující onemocnění nejasné etiologie, které může postihnout jakýkoliv orgán v lidském těle. V 90 % případů postihuje respirační systém, proto je sarkoidóza doménou plicních lékařů. Vyskytuje se zejména u jedinců mladšího a středního věku. Prognóza je většinou příznivá a závisí na typu a rozsahu postižení. Sarkoidóza může mít akutní či pozvolný chronický průběh. Z mimoplicních lokalizací sarkoidózy je nutno zmínit kůži, na které tvoří uzlovité infiltráty a plaky, a také erythema nodosum může být signálem přítomnosti sarkoidózy.
Sarkoidóza se může projevit zvětšením periferních uzlin a imitovat tak lymfom. Sarkoidóza může způsobit uveitidu a iridocyklitidu, ale také postižení srdce, nervového systému a kostí. Starší literatura označovala kostní změny jako ostitis multiplex cystoides Jüngling [15]. Typickou kostní lokalizací, kde bývají často detekovány kostní změny způsobené sarkoidózou, jsou kosti ruky a nohy. Tvoří je drobná, ostře ohraničená cystoidní projasnění v prořídlé „síťovité“ spongióze. Ale jak dokumentují v poslední době FDG-PET/CT studie, postižení skeletu je prokazatelné i v dlouhých kostech a axiálním skeletu [15].
Se zvyšující se dostupností PET/CT vyšetření se zvyšuje i počet pacientů se sarkoidózou, kteří prošli tímto vyšetřením. A to poněkud mění pohled na tuto nemoc. Ukazuje se, že mimo plicní a uzlinová postižení jsou často pomocí PET/CT detekována také postižení sleziny, kostí i dalších orgánů a kombinovaná systémová postižení až s obrazem připomínajícím lymfomy [16, 17].
V souboru 158 pacientů vyšetřených metodou FDG-PET/CT byla PET pozitivita prokázána u 75 % z nich. V této skupině PET pozitivních pacientů bylo mimoplicní postižení prokázáno u 75 % [18].
Optimální pro zjištění rozsahu sarkoidózy se však zdá být kombinace FDG-PET/CT vyšetření s magnetickou rezonancí (MR). MR může prokázat kardiální, svalová a CNS ložiska sarkoidózy, zatímco PET/CT lépe informuje o postižení lymfatických uzlin a kostí [18].
Plicní formy jsou diagnostikovány pomocí laboratorních vyšetření (skiagram hrudníku, výpočetní tomografie s vysokou rozlišovací schopností - HRCT), bronchoskopie s bronchoalveolární laváží. Sarkoidózu v jiných lokalizacích většinou prokazujeme odběrem vzorku postižené tkáně.
Z laboratorních parametrů bývá vyšší sedimentace erytrocytů, a popsáno bylo i polyklonální zmnožení imunoglobulinů [19]. Diferenciálně diagnosticky je nutno odlišit sarkoidózu od multicentrické formy Castlemanovy choroby, která způsobuje zvýšení zánětlivých markerů a zvýšení koncentrace polyklonálních imunoglobulinů, ale někdy i zvýšení koncentrace monoklonálního imunoglobulinu.
V 70–80 % případů sarkoidózy bývá zvýšená aktivita ACE (angiotensin converting enzyme) v séru. Hyperkalcemie je popisována u 2–10 % pacientů se sarkoidózou [20]. Hyperkalciurie je častější a nachází se až v 40 % případů [20]. Více se projeví v letních měsících, kdy se vápník zvýšeně resorbuje střevem při zevní aktivaci vitaminu D. V případě, kdy byla podána vyšší dávka vitaminu D pacientovi s nerozpoznanou sarkoidózou, došlo k jeho rychlé hydroxylaci na kalcitriol a ke vzniku hyperkalcemie, a tak i k odhalení sarkoidózy [20].
Příčinou hyperkalcemie a hyperkalciurie u sarkoidózy jsou makrofágy granulomů transformované na epiteloidní buňky. Makrofágy mají vysokou aktivitu 1-alfahydroxylázy vitaminu D, což vede ke zvýšené hydroxylaci 25-hydroxyvitaminu D a jeho přeměně na 1,25-dihydroxyvitamin D. Za fyziologických podmínek dochází k této hydroxylaci jen vlivem PTH, ale v případně sarkoidózy je tato hydroxylace nezávislá na PTH [21].
Nic však neplatí absolutně, v literatuře lze nalézt případy hyperkalcemie u sarkoidózy, kdy příčinou byl PTHrP [22].
Další získané příčiny hyperkalcemie
Granulomatózní ložiska však mohou mít i jinou příčinu než je sarkoidóza. Literatura například popisuje případ jihoamerické ženy, které si z kosmetických důvodů nechala aplikovat do gluteální krajiny metylmetakrylátové injekce. Depozita metylmetakrylátu způsobila chronický zánět, detekovaný zvýšenou akumulací fluorodeoxyglukózy při PET/CT vyšetření. Autoři sdělení předpokládají jako příčinu hyperkalcemie zvýšenou tvorbu kalcitriolu granulomatózní tkání kolem depozit metakrylátu [23]. A podobné granulomatózní reakce s hyperkalcemií byla popsány kolem implantovaného silikonu, který se uvolní mimo implantát [24]. Na tuto možnost je vhodné upozornit osoby se silikonovými implantáty. Granulomatózní tkáň vzniká také kolem případné nekrózy tuku a i v tomto případě může způsobit hyperkalcemii [25, 26].
Hypertyreóza způsobuje taktéž zvýšenou resorpci vápníku, ale obvykle se projeví pouze zvýšenou kalciurií bez signifikantní hyperkalcemie.
Imobilizace také způsobuje zvýšenou resorpci kalcia, ale obvykle jen do té míry, že se projeví samotnou hyperkalciurií, ale již ne hyperkalcemií.
Z léků nutno zmínit thiazidová diuretika, která snižují kalciurii, ale obvykle již nezpůsobují signifikantní hyperkalcemii.
Z dalších léků, zvyšujících kalcemii, je nutno zmínit lithium. To však již není tak často podáváno jako dříve. Také teriparid, léčebně používaný derivát parathormonu, může někdy zvýšit hladinu kalcia. Zvýšení hladiny kalcia může být způsobeno také intoxikací vitaminem D nebo vitaminem A.
Sami jsme pozorovali případ chybné diagnózy u pacienta s předávkováním vitaminem D v podobě veterinárního preparátu, který si pacient sám aplikoval intramuskulárně s cílem vybudovat svalovou hmotu. Pacient přišel pro nejasné zvracení, naneštěstí však hladina vápníku nebyla vyšetřena, pouze byla zjištěna vyšší hladina amylázy a v důsledku toho byla diagnostikována akutní pankreatitida. Po přechodném zlepšení stavu a propuštění do domácího léčení se potíže opakovaly, při návratu do nemocnice však znovu nebyl vápník vyšetřen a stav byl hodnocen jako recidiva akutní pankreatitidy. Teprve při třetí hospitalizaci byla již na interním pracovišti laboratorně zjištěna vysoká hyperkalcemie a neměřitelně vysoká hladina vitaminu D, která pak přetrvávala ještě několik týdnů.
U mladíků vášnivě oddaných body building aktivitám se lze setkat nejen vzestupem hodnot CK a myoglobinu, ale i další publikované zkušenosti popisují hyperkalcemie u těchto jedinců, zapálených pro budování svalů, osob, kteří polykají různé potravinové doplňky prodávané v posilovnách [27].
Je důležité si uvědomit, že i u pacientů s nádorem se může současně vyskytnout nenádorová příčina hyperkalcemie. Přehled možných příčin hypekalcemie shrnuje tabulka 2.
Hereditární hyperkalcemie
Endokrinolog se ve své praxi setká nejčastěji s hyperkalcemií na podkladě primární hyperparatyreoidózy, která může být vzácně součástí familiárního syndromu buď jako izolovaná porucha, nebo asociovaná s jinými endokrinními i neendokrinními nádory, ale také hereditárními poruchami [28, 29]. Podle některých autorů na hereditární formu připadá každá desátá primární hyperparatyreóza, nejčastěji jako iniciální projev mnohočetné endokrinní neoplazie 1. typu (MEN1) [30]. K abnormální sekreci parathormonu (PTH) a následné hyperkalcemii dochází na podkladě zárodečných mutací vedoucích k aktivaci protoonkogenů (např. tyrozinkinázy RET u MEN2A) nebo k inaktivaci nádorových supresorů (např. meninu u MEN1) [30].
Hereditární forma primární hyperparatyreózy se v rodině dědí nejčastěji autosomálně dominantně a vedle MEN1 může být součástí dalších syndromů jako jsou MEN2A, MEN4, syndrom hyperparatyreoidózy asociované s nádory čelisti, familiární hypokalciurická hyperkalcemie (FHH) nebo jako familiární izolovaná hyperparatyreoidóza. Vedle běžného biochemického vyšetření a zobrazovacích metod používaných u sporadické formy primární hyperparatyreoidózy jsou u některých syndromů k dispozici také mutační analýzy příslušných genů.
V klinické praxi na hereditární formu onemocnění pomýšlíme zejména, pokud je primární hyperparatyreoidóza diagnostikována u pacientů mladších 40 let, pokud je adenomem nebo hyperplazií postiženo současně více příštítných tělísek nebo pokud má primární hyperparatyreóza rekurentní průběh. Mezi další faktory, které by mohly svědčit pro genetické pozadí onemocnění, patří pozitivní rodinná anamnéza primární hyperparatyreózy a/nebo jiných endokrinopatií, které by mohly být součástí familiárních syndromů. Nebo pokud jsou tyto endokrinopatie nalezeny u jednoho pacienta současně s primární hyperparatyreoidózou [28, 29]. Pokud primární hyperparatyreoidóza vzniká na podkladě karcinomu příštítných tělísek je doporučována analýza genu pro parafibromin [31]. Tento jinak vzácný karcinom se může až v 15 % vyskytovat u syndromu hyperparatyreoidózy asociované s nádory čelisti. Každý ze zmíněných syndromů má svá specifika, nicméně od ostatních se svým průběhem odlišuje familiární hypokalciurická hyperkalcemie. U této poruchy je hyperkalcemie přítomna již od narození, je asymptomatická, proto bývá zjištěna často náhodně a na rozdíl od jiných syndromů není vhodná paratyroidektomie. U homozygotní formy onemocnění (neonatální závažná primární hyperparatyreoidóza) je naopak totální paratyroidekotmie nutná co nejdříve po narození. Přesný popis uvedených syndromů, jejich diagnostická kritéria a indikace ke genetickému vyšetření přesahují rámec tohoto odstavce [30, 31].
Vedle zmíněného genu pro menin u MEN1, RET u MEN2A a parafibrominu u syndromu hyperparatyreoidózy asociované s nádory čelisti je možné geneticky vyšetřit ještě gen CDKN1B u syndromu MEN4 a gen pro calcium-sensing receptor (CASR) u familiární hypokalciurické hyperkalcemie [31]. Některá z těchto vyšetření jsou dostupná i v České republice, proto při podezření je vhodné se obrátit na Endokrinologický ústav v Praze. Genetické vyšetření neodhalí mutaci v příslušném genu u všech pacientů. U MEN1 se např. uvádí, že mutaci se podaří identifikovat asi v 75 %. Nález mutace umožní včas odhalit další rodinné příslušníky ještě před klinickými projevy onemocnění.
Pro doplnění přehledu se k hereditárním hyperkalcemiím řadí i tzv. PTH-nondependentní hyperkalcemie s nízkou nebo normální hodnotou PTH. K takovému biochemickému obrazu dochází např. u autosomálně recesivní mutace v genu pro 24-hydroxylázu vitaminu D3 (CYP24A1). Klinický obraz těchto pacientů doplňuje častý nález nefrokalcinózy. Vzhledem k nízké aktivitě enzymů metabolizujících vitamin D3 může suplementace vitaminem D při neznalosti této poruchy zhoršit hyperkalcemii, hyperkalciurii , a tak vést k postižení ledvin [32].
DIFERENCIÁLNÍ DIAGNOSTIKA HYPERKALCEMIE
Zásadní pro nasměrování dalšího postupu je ověření hyperkalcemie vyšetřením ionizovaného kalcia, pokud jsou odchylky v koncentraci albuminu a celkové bílkoviny. Následuje vyšetření parathormonu a případně 1,25-hydroxyvitaminu D, je-li dostupné a také vyšetření odpadu kalcia za 24 hodin (kalciurie). Snížený odpad kalcia při hyperkalcemii by mohl svědčit pro familiární hyperkalcemii s hypokalciurií.
V případně zvýšeného parathormonu je etiologie jasná a endokrinologové dále upřesňují, zda jde o izolovanou hyperparatyreoidózu, či o projev mnohočetné endokrinní neoplazie.
V případě hyperkalcemie a hyperkalciurie s nezvýšenou hodnotou parathormonu, či přesněji s adekvátně sníženou hodnotou parathormonu, je třeba pátrat po nádorech, případně po granulomatózních chorobách.
Vzhledem k tomu, že řada malignit metastazuje do kostí a může být provázena hyperkalcemií, je možné v rámci pátrání po okultní malignitě doporučit i FDG-PET/CT vyšetření. Některé malignity s osteoplastickými kostními metastázemi (například karcinom prostaty) bývají provázeny variabilní a často i nízkou akumulací FDG a kostní postižení takového typu může být lépe zobrazitelné pomocí konvenční scintigrafie skeletu. Nádory s osteolytickým typem kostního postižení jsou naopak FDG-PET/CT vyšetřením zobrazitelné zpravidla dobře, a to v místech primárního nádoru i kostních metastáz. Míra akumulace fluorodeoxyglukózy s nádorovým ložiskem jak známo přímo souvisí s mírnou aktivity metabolismu nádorové tkáně. U rychle progredujících nádorů, ale aktivních zánětů je proto aktivita vysoká, zatímco u pomalu rostoucích nádorů a jejich metastáz je aktivita metabolismu maligních buněk a tedy i akumulace FDG nižší. Výhodou FDG-PET/CT v diferenciální diagnostice hyperkalcemie s nezvýšenou hodnotou parathormonu je to, že pozitivní obraz mohou mít také ložiska zánětu (zejména granulomatózního), nevýhodou je však to, že nemusíme diferenciálně diagnosticky rozlišit ložiska granulomatózního zánětu od nádorových (obr. 5). FDG-PET/CT může mít místo u všech nejasných případů hyperkalcemie s nezvýšenou hodnotou PTH.
Obr. 5. FDG-PET/ CT vyšetření pacienta s histologicky prokázanou sarkoidózou A) FDG-PET/CT vyšetření detekující mnohočetná metabolicky aktivní ložiska v plicích, slezině, lymfatických uzlinách a kostech – MIP PET trup. B) Axiální řez CT a PET/CT nezvětšené sleziny prostoupené hypodenzními splývajícími, metabolicky aktivními ložisky velikosti do 17 mm, SUVmax do 8,5. C) Axiální řez CT a PET/CT v místě metabolicky aktivního osteolytického ložiska v levé sedací kosti 11 mm v průměru, SUVmax 5,6. D) Axiální řez CT a PET/CT v místě ovoidní uzliny ventrálně od společného ilického cévního svazku vlevo velikosti 12 x 8 mm v příčném průměru, SUVmax 5,6. 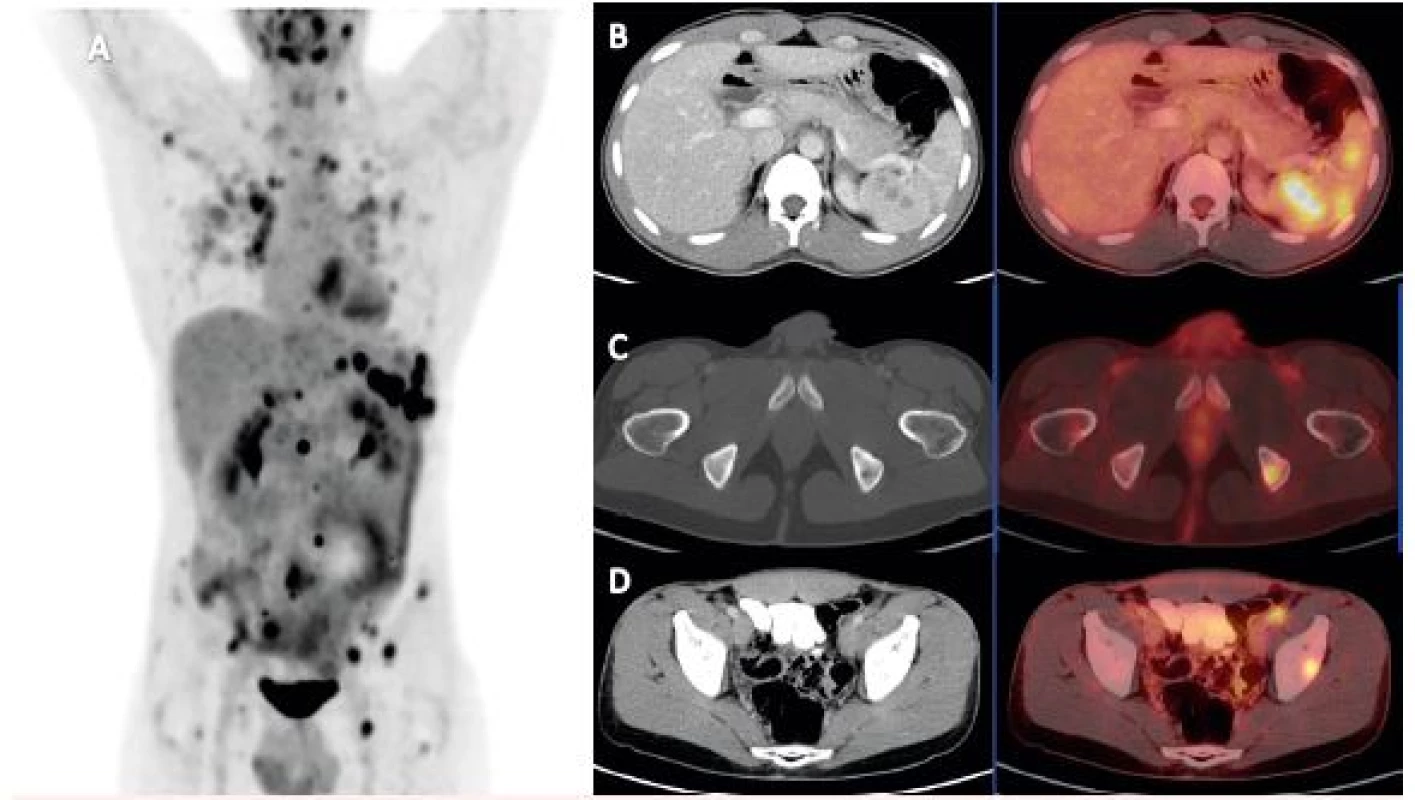
V případě hyperkalcemie u dětí je nutno pátrat i po hereditárních příčinách. Ale i u pacienta s nádorem je třeba myslet na možnost nenádorové příčiny hyperkalcemie a pro jistotu vyšetřit i parathormon a při zvýšení parathormonu se často podaří zobrazit adenom pomocí MIBI vyšetření (viz obr. 2).
V případě hyperkalcemie u dětí či spíše obecně, když se nepodaří prokázat ani maligní onemocnění, ani granulomatózní onemocnění a ani primární hyperparatyreoidózu, je třeba pátrat také po hereditárních příčinách, což je doménou specializovaných endokrinologů, jak uvádí Žofková a další [29].
LÉČBA HYPERKALCEMIE
Intenzita léčby se odvíjí od výše kalcemie. Pacienti s kalciem do 3 mmol/l jsou často bez přítomnosti klinicky závažných příznaků. Se vzestupem kalcemie nad 3,0 mmol/l se prohlubuje intenzita příznaků, deplece intravaskulární a extracelulární tekutiny, dramatický pokles glomerulární filtrace se vzestupem koncentrace kreatininu a urey, hypotenzí a celkovým obluzením, zpomalení fyziologické motility trávicího traktu, takže člověk není schopen uhradit deficit tekutin pitím, protože zvrací.
Na EKG křivce se zkracuje QT interval. V případě, že pacient užívá digitalis, zvyšuje se jeho toxicita.
Léčba se proto zahajuje podáváním iontových roztoků, které mají upravit hypovolemii [33].
Hydratace iontovými roztoky bez kalcia
Hyperkalcemie způsobuje poruchu koncentrace moče a tedy polyurii. Většina pacientů s klinicky významnou hyperkalcemií má proto snížený objem intravaskulární tekutiny. Léčbu je vždy nutno zahájit nitrožilním podáním iontových roztoků bez obsahu vápníku. Lze použít Plasmalyte nebo fyziologický roztok, ale nikoliv Ringerův roztok nebo roztok EL 1/1, v nichž je vápník obsažen. Zásadní je přívod sodíku ve velkém objemu, první den často 3–6 litrů s ohledem na klinický stav nemocného, optimálně za monitorování centrálního žilního tlaku.
A co furosemid?
Podání furosemidu je sice při zvládání hyperkalcemie také zmiňováno, ale furosemid neovlivní nijak zásadně hladinu kalcemie, a tak by jeho místo mělo být u těch pacientů, u nichž hydratace způsobila již nežádoucí převodnění, jak uvádí v podrobném přehledu Maier [34].
Furosemid tím, že poruší vstřebávání sodíku, může prohloubit zmenšení intravaskulárního objemu. Furosemid také zvyšuje vylučování kalia, může vést k hypokalemii a mít za následek metabolickou alkalózu [35]. Podávání forusemidu s cílem snížit kalcemii tedy nedoporučujeme, jeho místo vidíme v případě převodnění pacienta při rychlé hydrataci.
Kalcitonin
Kalcitonin byl standardním preparátem pro akutní snížení hyperkalcemie. Jeho účinek trval však jen několik hodin, a proto jej bylo nutno podávat opakovaně. V době, kdy byl standardně dostupný, jsme jej podávali podkožně po 6 hodinách až do poklesu kalcemie na normální hodnoty. Pokles kalcia po bisfosfonátech se objeví až po 48 hodinách od podání, a tak pro akutní snížení hyperkalcemie měl kalcitonin svůj nezastupitelný význam. Jeho aplikace umožňovala výrazně snížit kalcemii již v prvních 24 hodinách, tedy v době, kdy ještě nenastoupil efekt nitrožilně podaných bisfosfonátů [33]. Nyní však kalcitonin není dostupný.
Bisfosfonáty
Bisfosfonáty jsou standardním lékem již po několik desetiletí. Pro léčbu hyperkalcemie lze použít kterýkoliv z nitrožilně aplikovaných preparátů. Otázkou pouze je v jaké dávce.
Pokud se podaří aktivitu maligní nemoci zvládnout chemoterapií, tak je dostačující pouze jedna aplikace bisfosfonátů. Pokud ovšem je onemocnění na chemoterapii či jinou léčbu rezistentní a způsobuje hyperkalcemii, je nutno intervaly mezi nitrožilní aplikací bisfosfonátů stanovit podle vývoje kalcemie. V těchto případech je někdy nutné podávat bisfosfonáty nitrožilně i vícekrát do měsíce, tedy častěji, než jsou jejich standardní intervaly při dlouhodobé profylaktické léčbě pacientů s kostními metastázami či kostními infiltráty mnohočetného myelomu či lymfomu).
Klodronat
Pro léčbu hyperkalcemie lze použít klodronat v dávce 1500 mg v 4hodinové infuzi fyziologického roztoku či roztoku 5% glukózy. Roztok je po naředění chemicky stabilní nejméně po 24 hodin. V případě renální insuficience je doporučena redukce. O redukci uvažujeme pří dlouhodobé chronické aplikaci, ne však při léčbě hyperkalcemie.
Námi často používanou alternativou je podání 900 mg i. v. ve 4–6hodinové infuzi 2 dny po sobě, nebo podání 1500 mg v kontinuální 24hodinové infuzi. Hyperkalcemie způsobuje velmi často reverzibilní renální selhání, dominantně z dehydratace. V těchto případech proto neprovádíme redukci dávky klodronatu podle firemního doporučení, ale zásadně prodloužíme délku aplikace.
Toto naše praxí ověřené doporučení vychází ze známého velmi krátkého plazmatického poločasu, který souvisí mimo jiné s tím, že z krve, která proteče kostními kapilárami, je prakticky vychytán veškerý klodronat hydroyapatitovými strukturami.
Při podání 1500 mg klodronatu formou 24hodinové infuze pacientovi s hyperkalcemií provázenou renálním selháním jsme nepozorovali nikdy nežádoucí účinky klodronatu a uvedenou neredukovanou dávkou jsme dosáhli rychlé normalizace hyperkalcemie. Díky 24hodinové kontinuální infuzi se plazmatické hladiny klodronatu nijak zásadně nezvyšují [33].
Pamidronat
Pamidronat se doporučuje podávat po naředění do fyziologického roztoku nebo 5% glukózy, roztok nesmí obsahovat kalcium. Infuzní rychlost podle posledního doporučení nemá překročit 60 mg/hodinu. Pro celkové množství 90 mg pamidronatu je dostačující zředění ve 250 ml infuzního roztoku a podání během dvou hodin. U pacientů s hyperkalcemií se doporučuje podávat 90 mg v 500 ml roztoku v průběhu nejméně 4 hodin. Při dlouhodobém podávání je vhodné sledovat vývoj hodnot urey a kreatininu. V případě renální insuficience jakéhokoliv stupně není doporučena redukce dávek.
Při nedostatečném poklesu do 3–7 dnů je možné opakovat podání pamidronatu a léčba se vždy opakuje při opětovném vzestupu koncentrace kalcia.
Původní firemní materiály doporučovaly obezřetnost při podávání pamidronatu pacientům s renální insuficiencí, blíže však toto doporučení nespecifikovaly. V současnosti je přijat názor, že pamidronat není nutno při renální insuficienci redukovat, je však nutno infuzi s pamidronatem nechat kapat déle než u pacientů s normální funkcí ledvin. Stejná dávka u pacienta s renální insuficiencí má větší hypokalcemizující efekt, jinak ale žádné negativní dopady. Obrovské plochy hydroxyapatitu lze přirovnat k rozsáhlým bažinám, kterým je celkem jedno, zda pohltí větší či menší množství pamidronatu. V informacích k preparátu pamidronatu proto není uvedena nutnost redukce dávky ani při závažném selhání ledvin. U pacientů se selháním funkce ledvin se doporučuje podstatně pomalejší infuzní podání, 20 mg/hodinu [33].
Ibandronat
Pro léčbu hyperkalcemie se doporučuje 6 mg ibandronatu v nitrožilní infuzi. U ibandronatu se v dokumentaci objevuje doporučení redukovat dávku při chronické renální insuficienci. Pokud je kreatininová clearance nad 30 ml/minutu (0,5 ml/sec), podává se plná dávka, při clearance pod 30 ml/min (0,5 ml/s) se doporučuje podávat 2 mg v intervalu 3–4 týdnů a infuze by měla trvat nejméně 1 hodinu.
Nicméně v literatuře lze najít více publikací malých sérií pacientů s hyperkalcemií, léčených neredukovanou dávkou ibandronatu i při renální insuficienci, u nichž nebylo popsáno žádné poškození ledvin. Autoři těchto sdělení na základě vlastních zkušeností doporučí neredukovat dávku ibandronatu u pacientů s akutní hyperkalcemií a zhoršenou funkcí ledvin [36, 37, 38]. Tyto práce tedy podstatně rozšiřují podání oproti informacím z SPC.
Zoledronat
V případně zoledronatu byla popsána renální toxicita podstatně častěji, než je tomu u ostatních bisfosfonátů, a proto zde je vhodné i při léčbě hyperkalcemie zoledronatem respektovat doporučení pro úpravu dávky v závislosti na funkci ledvin [34].
Další léky
Glukokortikoidy
Glukokortikoidy snižují vstřebávání vápníku tím, že sníží tvorbu 1,25-dihydroxyvitaminu D. Používají se proto pro léčbu hyperkalcemie provázející granulomatózní choroby a případně pro léčbu hyperkalcemie způsobené mnohočetným myelomem nebo lymfomy [34]. U sarkoidózy, jako zástupce granulomatózních procesů, se prednison podává v ranní dávce 20–40 mg.
Denosumab
Denosumab je protilátka vázající se na RANKL, centrální stimulátor osteoklasické aktivity. Denosumab má u metastatického postižení skeletu podobnou protektivní roli jako bisfosfonáty. Denosumab se proto podává jako dlouhodobá léčba, jejímž cílem je brzdit progresi postižení skeletu maligním procesem. Dále jej lze úspěšně použít pro léčbu hyperkalcemie u solidních tumorů. U mnohočetného myelomu zatím není v této indikaci registrován, byť z mechanismu účinku je zřejmé, že bude také účinný. Výhodou denosumabu je, že jeho dávkování není závislé na funkci ledvin, protože denosumab je metabolizován intracelulárně. Vzhledem k tomu, že hyperkalcemie způsobuje poruchu funkce ledvin a vzestup kreatininu, je nezávislost dávkování denosumabu na hodnotě kreatininu jeho velkou předností. Denosumab se podává v dávce 120 mg podkožně [39, 40].
V březnu 2017 byla poprvé přednesena na 16. myelomovém workshopu a v březnu 2018 zveřejněna in extenso první velká klinické studie srovnávající denosumab a zoledronat u nově diagnostikovaných pacientů s mnohočetným myelomem [41]. Pacienti byli randomizováni do skupin dostávající podkožní injekce denosumabu 120 mg 1krát měsíčně anebo do skupiny dostávající 4 mg zoledronatu 1krát měsíčně. Celkem bylo randomizováno 1718 pacientů, takže v každé skupině bylo 859 osob. Renální toxicita byla hlášena u 85 (10 %) pacientů s denosumabem a u 146 (17 %) se zoledronatem. Hypokalcemie jako nežádoucí účinek byla hlášena u 144 (17 %) pacientů s denosumabem a u 106 (12 %) se zoledronatem. Incidence osteonekrózy čelisti byla 35 (4 %) u pacientů s denosumabem oproti 24 (3 %) se zoledronatem (p = 0,147). Při mediánu sledování 17,4 měsíce mělo 43,8 % dostávajících denosumab a 44,6 % pacientů dostávajících zoledronat první kostní komplikaci (skeletal related event). Medián intervalu do první kostní komplikace byl 22,83 měsíců při léčbě denosumabem a 23,98 měsíce při léčbě zoledronatem. Ze statistického hodnocení vyplývá, že denosumab neměl horší účinnost než zoledronat z hlediska délky intervalu do první kostní komplikace. Celkové přežití (OS) nebylo signifikantně odlišné v obou skupinách, ale medián PFS vycházel lepší při denosumabu. Takže co je lepší, denosumab či zoledronat? Pokud odhlédneme od rozdílnosti cen obou léků, tak denosumab má přednost oproti zoledronatu v podkožní aplikaci, zoledronat vyžaduje aplikaci infuzí. U denosumabu je výhoda nezávislost dávkování na funkci ledvin a absence nefrotoxicity. To, že v klinické studii byl hlášen vzestup kreatininu neboli nefrotoxicita ve skupině léčené denosumabem, neznamená, že zde byla příčinná souvislost, protože pacienti konzumují hodně léků a myelom samotný má potenciál zhoršovat funkci ledvin [41].
Jaké jsou zkušenosti s použitím denosumabu v případě nádorové hyperkalcemie? Publikací na téma hyperkalcemie s renálním selháním a její řešení denosumabem je zatím málo.
Při podávání poloviční dávky 60 mg denosumabu pacientům s hyperkalcemií, nereagující na léčbu bisfosfonáty a se střední či závažnou renální dysfunkcí, docházelo k signifikantní a prolongované hypokalcemii. A tak jako alternativu autoři zvolili dávku 0,3 mg/kg jako přijatelnou alternativu pro pacienty s hyperkalcemií a renálním selháním, protože tato dávka minimalizovala riziko hyperkalcemie. Tato dávka je sice spojena s možným poddávkováním, a tak doporučují po týdnu zkontrolovat hladinu kalcia a případně podat další dávku denosumabu [42, 43].
A podobné zkušenosti – zvýšené riziko následující hypokalcemie popisují i další autoři s podáním denosumabu v případě renální insuficience a hyperkalcemie. Vysvětlení je pouze spekulativní. I když farmakokinetika denosumabu není funkcí ledvin zásadně ovlivněna, již jednou proběhlé poškození ledvin snížilo jejich kompenzační mechanismus a zvyšuje riziko iontových dysbalancí a tedy i hypokalcemie po denosumabu [44–48].
S aplikací denosumabu pacientům s renálním selháním a hyperkalcemií nemáme vlastní zkušenosti, takže pouze upozorňujeme na možnou symptomatickou hypokalcemii, popisovanou zahraničními autory, což je však problém lehce řešitelný infuzí s kalciem. Citovaná literatura popisuje i efektivitu v případě selhání bisfosfonátů. Faktem je, že u velmi agresivního onemocnění mnohočetným myelomem jsme byli nuceni podávat bisfosfonáty v 14denním intervalu, abychom udrželi normokalcemii a někdy i častěji. Šlo o terminální stavy onemocnění se značnou agresivitou. V těchto případech bychom rádi vyzkoušeli denosumab.
Kalcimimetikum cinacalcet (MIMPARA)
Snižuje kalcémii v případě zvýšené hladiny parathormonu. Jeho předepisování spadá do kompetence endokrinologů [5]. Podání cinacalcetu sníží kalcemii, kalciurii a má tak protektivní účinek na denzitu skeletu. Endokrinolog ale při jeho indikaci musí zvážit nejen efekt, ale i náklady a svůj rozpočet.
Specifika léčení hyperkalcemie u sarkoidózy
V případě sarkoidózy lze použít jak výše uvedené léky inhibující osteolýzu, tak při méně intenzivních příznacích použít léky, které potlačí chorobu a tím také tvorbu 1,25-dihydroxyvitaminu D. S tímto cílem se podávají jak glukokortikoidy, tak i další léky, hydroxychlorochin a i infliximab byl použit k normalizaci kalcemie u pacienta se sarkoidózou [49].
Hemodialýza
Hemodialýza je metoda vedoucí k velmi rychlé úpravě kalcemie, vhodná pro kritické stavy, kde nelze čekat na nástup účinku bisfosfonátů.
ZÁVĚRY PRO PRAXI
- Vyšetření kalcia by mělo být běžnou součástí laboratorních vyšetření v případně nejasných potíží, ale i v rámci preventivního vyšetření, protože může odhalit zatím asymptomatickou hyperkalcemii.
- V případě abnormalit v koncentraci celkové bílkoviny a albuminu je vhodné doplnit i vyšetření koncentrace ionizovaného kalcia.
- Vyšší hladina kalcia vyžaduje akutní diferenciální diagnostiku, základem je vyšetření hladiny parathormonu.
- V případě vyšší hladiny parathormonu se zaměří vyšetření na příštítná tělíska.
- V případě nezvýšeného parathormonu je nejpravděpodobnější příčinou maligní onemocnění anebo granulomatózní onemocnění, např. sarkoidóza.
- Pokud akutní rentgenový snímek plic a sonografie břišní neodhalí solidní tumor, vyšetření monoklonálního imunoglobulinu je negativní, vyšetření kostní dřeně neodhalí mnohočetný myelom či maligní infiltraci kostní dřeně, tak je vhodné provést FDG-PET/CT vyšetření, které může odhalit jak maligní, tak i zánětlivý granulomatózní proces.
- V případě potřeby lokalizace adenomu příštítného tělíska je v roce 2018 již dostupné i PET/CT nebo PET/MR vyšetření s radioizotopem fluorocholinem.
- Pokud se neprokáže jakékoliv vyvolávající onemocnění, může jít o hereditární odchylku, například o familiární hyperkalcemickou hypokalciurii a tyto pacienty je třeba odeslat na specializovaná endokrinologická pracoviště.
Podíl autorů na přípravě rukopisu
KS, KZ – sestavili a zodpovídají za pohled z úhlu endokrinologa.
ZŘ, RK, AŠP – odpovídají za pohled z úhlu zobrazovacích metod.
MT – odpovídá za text z pohledu lékaře specializovaného na metabolismus a výživu.
MD – odpovídá za text z pohledu lékaře specializovaného na plicní chorobu a sarkoidózu.
ZČ – zodpovídá za text z pohledu biochemika.
AČ – zodpovídá za text z pohledu urologa, který je zkušený v řešení nefro - a ureterolitiázy a diagnostiky jejich příčin.
ZA, LP, MK, VS, MŠ – zodpovídají za text z úhlu pohledu lékařů myelomové ambulance, kam jsou posíláni s otázkou: „Není hyperkalcemie projevem myelomu?“
LO – zodpovídá za text z úhlu pohledu lékařů solidní onkologie
Poděkování
Vytvoření textu bylo podpořeno grantem MUNI/A/0968/2017.
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 15. 2. 2018.
Přijato po recenzi dne 23. 3. 2018.
doc. MUDr. Luděk Pour, Ph.D.
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno-Bohunice
e-mail: adam.zdenek@fnbrn
Zdroje
1. Blimark CH, Turesson I, Genell A, et al. Swedish Myeloma Registry. Outcome and survival of myeloma patients diagnosed 2008–2015. Real world data on 4904 patients from the Swedish Myeloma Registry (SMR). Haematologica 2018;103(3):506–513.
2. Zagouri F, Kastritis E, Zomas A, et al. Greek Myeloma Study Group. Hypercalcemia remains an adverse prognostic factor for newly diagnosed multiple myeloma patients in the era of novel antimyeloma therapies. Eur J Haematol 2017;99(5):409–414.
3. Felsenfeld A, Rodriguez M, Levine B. New insights in regulation of calcium homeostasis. Curr Opin Nephrol Hypertens 2013;22(4):371–376.
4. Payne RB, Little AJ, Villiams RB, et al. Interpretation of serum calcium in patients with abnormal serum proteins. Brit Med J 1973;4(5893):643–646.
5. Egbuna OI, Brown EM. Hypercalcaemic and hypocalcaemic conditions due to calcium-sensing receptor mutations. Best Pract Res Clin Rheumatol 2008;22(1):129–148.
6. Broulík P. Diferenciální diagnóza hyperkalcémie. Vnitř Lék 2007;53(7–8):826–830.
7. Giusti F, Cavalli L, Cavalli T, et al. Hereditary hyperparathyroidism syndromes. J Clin Densitom 2013;16(1):69–74.
8. Hindié E, Zanotti-Fregonara P, Tabarin A. The role of radionuclide imaging in the surgical management of primary hyperparathyroidism. J Nucl Med 2015;56(5):737–744.
9. Kluijfhout WP, Vriens MR, Valk GD, et al. (18)F-Fluorocholine PET-CT enables minimal invasive parathyroidectomy in patients with negative sestamibi SPECT-CT and ultrasound: A case report. Int J Surg Case Rep 2015;13 : 73–75.
10. Adámek S, Libánský P, Lischke R, et al. Surgical therapy of primary hyperparathyrodism in the context of orthopaedic diagnosis and treatment: our experiences in 441 patients. Acta Chir Orthop Traumatol Czech 2011;78(4):355–360.
11. Yousaf F, Charytan C. Review of cinacalcet hydrochloride in the management of secondary hyperparathyroidism. Ren Fail 2014;36(1):131–138.
12. Turan S. Current nomenclature of pseudohypoparathyroidism: inactivating parathyroid hormone/parathyroid hormone-related protein signaling disorder. J Clin Res Pediatr Endocrinol 2017;9(Suppl 2):58–68.
13. Jin J, Chung JO, Chung MY, et al. Causes and survival in 115 cancer patients with parathyroid hormone related protein-mediated hypercalcemia. J Bone Metab 2017;24(4):249–255.
14. Krug S, Michl P. Metabolic disorders as paraneoplastic syndromes. Internist (Berl) 2018;59(2):114–124.
15. Baltzer G, Behrend H, Behrend T. Incidence of cystic bone alterations (ostitis cystoides multiplex Jüngling) in sarcoidosis. Dtsch Med Wochenschr 1970;95(38):1926–1929.
16. Talmi D, Smith S, Mulligan ME. Central skeletal sarcoidosis mimicking metastatic disease. Skel Radiol 2008;37(8):757–761.
17. Sobic-Saranovic D, Grozdic I, Videnovic-Ivanov J, et al. The utility of 18F-FDG PET/CT for diagnosis and adjustment of therapy in patients with active chronic sarcoidosis. J Nucl Med 2012;53(10):1543–1549.
18. Cremers JP, Van Kroonenburgh MJ, Mostart RL, et al. Extent of disease aktivity assessed by 18-FDG-PET-CT in Dutch sarcoidosis population. Sarcoidosis BASF Difuse Lung Dis 2014;31(1):37–45.
19. Nageshwaran S, Majumdar K, Russell S. Hypergammaglobulinemia, normal serum albumin and hypercalcaemia: a case of systemic sarcoidosis with initial diagnostic confusion. BMJ Case Rep 2012; publikováno elektronicky 21. června, DOI: 10.1136/bcr.01.2012.5478.
20. Baughman RP, Teirstein AS, Judein MA, et al. Clinical characteristics of patient in a case control study of sarcoidosis. Am J Resp Crit Care Med 2001;164(10):1885–1889.
21. Baughman RP, Lower EE. Goldilocks, vitamin D and sarcoidosis. Arthritis Res Ther 2014;16(3):111.
22. van Realte DH, Goorden SM, Kemper EA, et al. Sarcoidosis releated hypercalcaemia due to production of parathyreoid hormone releated peptide. Brit Med J Case Rep 2015; publikováno elektronicky 9. července, DOI: 10.1136/bcr-2015-210189.
23. Rados DV, Furlanetto TW. An unexpected cause of severe and refractory PTH-independent hypercalcemia: case report and literature review. Arch Endocrinol Metab 2015;59(3):277–280.
24. Amiraian DE, Accurso JM, Jain MK. Severe hypercalcemia related to silicone granulomas, as discovered by FDG-PET. Indian J Nucl Med 2017;32(4):343–344.
25. Samedi VM, Yusuf K, Yee W, et al. Neonatal hypercalcemia secondary to subcutaneous fat necrosis successfully treated with pamidronate: a case series and literature review. AJP Rep 2014;4(2):e93–96.
26. Zhang JT, Chan C, Kwun SY, et al. A case of severe 1,25-dihydroxyvitamin D-mediated hypercalcemia due to a granulomatous disorder. J Clin Endocrinol Metab 2012;97(8):2579–2583.
27. Schäfer CN, Guldager H, Jørgensen HL. Multi-organ dysfunction in bodybuilding possibly caused by prolonged hypercalcemia due to multi-substance abuse: case report and review of literature. Int J Sports Med 2011;32(1):60–65.
28. Hrdličková E, Kutílek S. Idiopatická infantilní hypercalcémie. Čas Lék Čes 1990;129(44):1397–1400.
29. Žofková I. Osteologie a kalcium – fosfátový metabolismus. Praha, Grada 2012, s. 214.
30. Thakker RV, Newey PJ, Walls GV, et al. Clinical practice guidelines for multiple endocrine neoplasia type 1(MEN1). J Clin Endocrinol Metab 2012;97 : 2990–3011.
31. Hendy GN, Cole D. Genetic defects associated with familial and sporadic hyperparathyroidism. Front Horm Res 2013;41 : 149–165.
32. Molin A, Baudoin R, Kaufmann M, et al. CYP24A1 mutations in a cohort of hypercalcemic patients: evidence for a recessive trait. J Clin Endocrinol Metab 2015;100:E1343–1352.
33. Wagner J, Arora S. Oncologic metabolic emergencies. Emerg Med Clin North Amer 2014;32(3):509–525.
34. Maier JD, Levine SN. Hypercalcemia in the intensive care unit: a review of pathophysiology, diagnosis, and modern therapy. J Intens Care Med 2015;30(5):235–252.
35. Reiser IW, Ali S, Gotlieb V, et al. Hypercalcemia-induced hypokalemic metabolic alkalosis in a multiple myeloma patient: the risk of furosemide use. Case Rep Oncol 2015;8(3):389–393.
36. Henrich DM, Hoffmann M, Uppenkamp M, et al. Tolerability of dose escalation of ibandronate in patients with multiple myeloma and end-stage renal disease: a case series. Onkologie 2009;32(8–9):482–486.
37. Bergner R, Henrich DM, Hoffmann M, et al. Renal safety and pharmacokinetics of ibandronate in multiple myeloma patients with or without impaired renal function. J Clin Pharmacol 2007;47(8):942–950.
38. Bergner R, Henrich DM, Hoffmann M, et al. Therapy of hypercalcemia with ibandronate in case of acute renal failure. Internist (Berl) 2006;47(3):293–296.
39. Freeman A, El-Amm J, Aragon-Ching JB. Use of denosumab for renal cell carcinoma-associated malignant hypercalcemia: a case report and review of the literature. Clin Genitourin Cancer 2013;11(4):e24–26.
40. Dietzek A, Connelly K, Cotugno M, et al. Denosumab in hypercalcemia of malignancy: a case series. J Oncol Pharm Pract 2015;21(2):143–147.
41. Raje N, Terpos E, Willenbacher W, et al. Denosumab versus zoledronic acid in bone disease treatment of newly diagnosed multiple myeloma: an international, double-blind, double-dummy, randomised,controlled, phase 3 study. Lancet Oncol 2018; publikováno elektronicky 8. února. DOI: 10.1016/S1470-2045(18)30072-X.
42. Cicci JD, Buie L, Bates J, et al. Denosumab for the management of hypercalcemia of malignancy in patients with multiple myeloma and renal dysfunction. Clin Lymphoma Myeloma Leuk 2014;14(6):e207–211.
43. Thosani S, Hu MI. Denosumab: a new agent in the management of hypercalcemia of malignancy. Future Oncol 2015;11(21):2865–2871.
44. Hu MI, Glezerman IG, Leboulleux S, et al. Denosumab for treatment of hypercalcemia of malignancy. J Clin Endocrinol Metab 2014;99(9):3144–3152.
45. Uehara A, Yazawa M, Kawata A, et al. Denosumab for treatment of immobilization-related hypercalcemia in a patient with end-stage renal disease. CEN Case Rep 2017;6(1):111–114.
46. Dahmani O, Sophoclis C, Kebir M, et al. Denosumab for the treatment of bisphosphonate resistant hypercalcemia in a hemodialysis patient. Saudi J Kidney Dis Transpl 2017;28(1):154–157.
47. Ashihara N, Nakajima K, Nakamura Y, et al. Denosumab is effective for controlling serum calcium levels in patients with humoral hypercalcemia of malignancy syndrome: a case report on parathyroid hormone-related protein-producing cholangiocarcinoma. Intern Med 2016;55(23):3453–3457.
48. Sparks JA, McSparron JI, Shah N, et al. Osseous sarcoidosis: clinical characteristics, treatment, and outcomes--experience from a large, academic hospital. Semin Arthritis Rheum 2014;44(3):371–379.
49. Huffstutter JG, Huffstutter JE. Hypercalcemia from sarcoidosis successfully treated with infliximab. Sarcoidosis Vasc Diffuse Lung Dis 2012;29(1):51–52.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Prim. MUDr. Josef Nedvěd
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2018 Číslo 4- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Vplyv nádorového metabolizmu na terapiu detských leukémií
- Registr dárců plné krve – srovnání dat 12 zařízení transfuzní služby v letech 2008 a 2016
- Bezpečnost a efektivita léčby rituximabem u dětí s autoimunitním onemocněním
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
- Dlouhodobě skladované kryokonzervované transplantáty a jejich likvidace
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- Nové poznatky o mechanismech opravy DNA po poškození alkoholem
- EMA schválila první imunoterapii pomocí CAR T-lymfocytů
- Životní jubileum prof. MUDr. Radima Brdičky, DrSc.
- Prim. MUDr. Josef Nedvěd
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- EMA schválila první imunoterapii pomocí CAR T-lymfocytů
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



