Vývoj diagnostiky a léčby mnohočetného myelomu v průběhu posledních 25 let
Developments in the diagnosis and treatment of multiple myeloma over the past 25 years
Multiple myeloma is the second most frequent blood malignancy. This review examines developments in diagnostics, prognosis and treatment strategies over the past 25 years. The past decade alone has seen multiple myeloma rank among cancers with the greatest dynamics in treatment strategies. Based on clear progress and long-term results, we may now consider patients with multiple myeloma to be potentially curable. The proportion of curable patients will increase with the availability of the treatment options of proven efficacy in randomized trials.
Keywords:
progress – cure
Autori:
R. Hájek 1,2,3,4
Pôsobisko autorov:
Klinika hematoonkologie, Fakultní nemocnice Ostrava
1; Lékařská fakulta, Ostravská univerzita, Ostrava
2; Myelomová sekce České hematologické společnosti, Praha
3; Česká myelomová skupina, Brno
4
Vyšlo v časopise:
Transfuze Hematol. dnes,25, 2019, No. 1, p. 96-106.
Kategória:
Souhrnné/edukační práce
Súhrn
Mnohočetný myelom je druhým nejčastějším krevním nádorem. V přehledném článku je posouzen vývoj v oblasti diagnostiky, prognostiky a strategie léčby během posledních 25 let. Zvláště v poslední dekádě patří mnohočetný myelom mezi nádorové onemocnění s největší dynamikou rozvoje léčebných strategií. Na základě průkazného pokroku a dlouhodobých výsledků již dnes hovoříme o vyléčitelnosti nemocných s mnohočetným myelomem. Podíl vyléčitelných nemocných bude stoupat s dostupností léčebných možností s prokázanou účinností v randomizovaných studiích.
Klíčová slova:
pokrok – vyléčení
ÚVOD
V úvodu mně dovolte poblahopřát časopisu Transfuze a hematologie dnes k 25. výročí od jeho založení. Blahopřání je v zastoupení členů České myelomové skupiny a také jejího nadačního fondu. Děkujeme za možnost publikovat, zvláště děkujeme za možnost publikování národních doporučení pro diagnostiku a léčbu mnohočetného myelomu ve formě zvláštních vydání. Třetí z nich bylo vydáno nedávno, a to v roce 2018 [1, 2]. Spolupráce s časopisem, respektive jeho redakčními týmy, byla vždy na výborné úrovni a těšíme se, že bude pokračovat i v dalším období [3].
Je zpravidla snadné časopis založit, těžší jej udržet při životě a nejtěžší je trvale zvyšovat kvalitu časopisu. Asi se mnou čtenáři budou obecně souhlasit, že ty první dva kroky se přes řadu obtíží povedly. Určitě bychom uvítali, kdyby časopisu byl přiznán „impact factor“ vypovídající o mezinárodní úrovni časopisu. Třeba by to mohl být cíl do dalších 25 let. Každopádně je dobré mít své národní odborné periodikum pro transfuziologii a hematologii, a tuto roli časopis dobře naplňuje.
Mnohočetný myelom (MM) patří mezi nejčastější krevní nádorová onemocnění. S ohledem na zaměření článku budou uvedena jen vybraná základní fakta a autor se bude snažit spíše popsat dynamiku vývoje za posledních 25 let (1993–2018) u tohoto nádoru z různých úhlů pohledu tak, jak ji vnímá.
ZÁKLADNÍ ÚDAJE O ONEMOCNĚNÍ
Mnohočetný myelom (MM) je onemocnění vyznačující se klonální nekontrolovatelnou proliferací abnormních neoplastických elementů B-lymfocytární linie (patologických plazmocytů), které se nazývají myelomové buňky. Onemocnění je provázeno produkcí monoklonálního imunoglobulinu, prokazatelného v moči nebo v séru, s projevy orgánového poškození (anémie případně trombocytopenie, osteolytické změny skeletu, renální insuficience). Mnohočetný myelom tvoří asi 10 % všech krevních nádorových onemocnění. Jeho incidence v ČR pozvolna stoupá od 2,3 na 4,8 nových případů na 100 000 tisíc obyvatel v období 1980–2014. Ještě významnější trend lze pozorovat v prevalenci onemocnění se vzestupem z 6,3 na 18,8 žijících nemocných s MM na 100 000 tisíc obyvatel v období 1990–2014 [4]. Medián věku při stanovení diagnózy je kolem 68 let a pouze 1 % osob je v době stanovení diagnózy mladších 40 let. Etiologické souvislosti vzniku této nemoci nebyly známy ani před 25 lety a nejsou známy ani dnes. Vyšší incidence MM je v afro-karibské skupině obyvatel. Menší část případů MM vzniká transformací z monoklonální gamapatie nejasného významu (MGUS – monoclonal gammopathy of unknown significance). Ale i u většiny nově diagnostikovaných MM víme, že každému z nich musela předcházet různě dlouhá doba, ve které byl nemocný ve fázi MGUS [5].
SROVNÁNÍ RŮZNÝCH ASPEKTŮ V DYNAMICE POSLEDNÍCH 25 LET
1 Diagnostické nástroje u MM
Mnohočetný myelom je komplexní onemocnění. Základní charakteristikou mnohočetného myelomu nadále zůstává přítomnost monoklonálního imunoglobulinu (M-Ig; dříve paraprotein, M-protein) v séru. S tím souvisí i základní diagnostická sada nástrojů, která se v průběhu 25 let v podstatě nezměnila. Cílem je prokázat monoklonální imunoglobulin (standardní imunoelektroforéza séra a moče s následným provedením imunofixace pro stanovení klonality, morfologické vyšetření plazmocytů a jejich stanovení v procentech, nalezení osteolytických ložisek pomocí standardního celotělového RTG vyšetření). Tento standardní diagnostický set byl celosvětově rozšířen již před rokem 1993 a toto platí i v roce 2018 [1]. Jsou tu další významné diagnostické nástroje, které mají uplatnění nejméně v polovině světa.
1. 1 Stanovení volných lehkých řetězců
U 15 % nemocných s typem MM z volných lehkých řetězců (historicky Bence Jones typ) bylo zásadním zlepšením diagnostiky zavedení metody stanovení volných lehkých řetězců (FLC – free light chains) v séru a moči [6]. Podobný diagnostický monitorovací význam mělo zavedení této metody pro nesekreční myelom a amyloidózu. O významnosti svědčí fakt, že tato metoda se stala součástí nových diagnostických nástrojů u MM a MGUS doporučených IMWG (International Myeloma Working Group) včetně možnosti využití této metody při monitorování dynamiky monoklonálních gamapatií [7, 8]. Oproti tomu představení nadstavbové metody pro stanovení těžkého i lehkého řetězce imunoglobulinu doposud nenašlo zásadní klinické uplatnění [9, 10]. Přestože proteomika je zajímavou oblastí ve výzkumu i u monoklonálních gamapatií a uplatnění hmotnostní spektrometrie se v poslední dekádě nepochybně rozvíjí také v klinické praxi, u mnohočetného myelomu zatím nenašla zásadní význam.
1. 2 Zobrazovací metody skeletu
V zobrazovacích metodách zůstala myelomová komunita v doporučení změn během posledních 25 let velmi konzervativní, místy až nevysvětlitelně. Neustále se vracelo a diskutovalo dokola téma, zda zjištění osteolytických ložisek metodou citlivější, než je prostá RTG metoda (MRI, CT, low density CT, PET-CT,...), má stejný význam a je tedy indikací k léčbě. Až v roce 2014 se poprvé objevilo v doporučeních IMWG, aby malá osteolytická ložiska (≥ 5 mm), dříve běžnou RTG metodou neviditelná, byla považována za „skutečně osteolytická“, a tudíž byla indikací k léčbě [11]. Skutečností je, že rentgenové vyšetření skeletu je v řadě zemí jediným dostupným vyšetřením z doporučených. Přestože low density CT je citlivější, rychlejší a pro nemocného pohodlnější metodou, stále je prosté RTG skeletu nejrozšířenější metodou na světě. Nejnověji využití PET-CT nabízí kombinaci zobrazení patologického ložiska se současným popisem metabolické aktivity. Přestože u MM stále schází velká validační klinická studie, metoda již našla své místo v doporučení i pro vyhodnocení MRD [12, 13].
V České republice jsou všechny metody dostupné a jen kapacitní možnosti různých metod v různých nemocnicích jsou rozhodující pro preferenci některé ze zobrazovacích metod lékaři jednotlivých center [14]. V České republice byl také velký počet nemocných vyšetřen pomocí PET-CT časně po zavedení metody, avšak pro zviditelnění výsledků s mezinárodním ohlasem jsme správný čas už propásli.
1. 3 Vyšetření průtokovou cytometrií
Průtoková cytometrie byla v roce 1993 i v univerzitním prostředí vyspělých zemí velmi omezeně dostupnou technologií. Dynamika v technologickém pokroku byla mimořádná. Dnes patří průtoková cytometrie k důležitým diagnostickým nástrojům u monoklonálních gamapatií. Její největší předností je možnost stanovení podílu klonálních a normálních buněk a přesnější určení různých fenotypů včetně vyhodnocení ostatních imunokompetentních buněk ve vzorku kostní dřeně nemocného. Nově IMWG doporučila využití průtokové cytometrie k vyhodnocování zbytkového nádorového onemocnění (MRD – minimal residual disease) [15]. Nemocní dosahující MRD negativity mají významně lepší prognózu nezávislou na použité léčbě [16].
Na mezinárodní i národní úrovni dlouhodobě probíhají víceméně úspěšné pokusy o standardizaci vyšetření průtokovou cytometrií, a to především v rámci Euroflow konsorcia. Přes mimořádný pokrok v této oblasti je paradoxně jeho vnitřní nevýhodou neustálý technologický pokrok, umožňující neustálé zdokonalování metody. V praxi to znamená, že ochota a flexibilita center přebírajících protokoly musí být velká. U mnohočetného myelomu dnes pracujeme například s již 4. verzí, nyní tzv. NFC (NextFlowCytometry).
V České republice je ve všech univerzitních a v řadě regionálních hematologických centrech nejméně čtyřbarevná průtoková cytometrie dostupná a dlouhodobě zavedená. V roce 2018 jsou v České republice dvě centra (Brno a Ostrava), která pracují podle Euroflow protokolů u mnohočetného myelomu, přitom brněnské centrum slouží jako referenční pro akademické klinické studie. Obě centra jsou schopna vyhodnotit MRD až se senzitivitou 10E(-6). Všechna další univerzitní centra jsou schopna zhodnotit MRD nejméně se senzitivitou 10E(-4).
1. 4 Cytogenetika a genomika
V oblasti cytogenetiky a genomiky je mimořádně vidět jaké tempo má výzkum a technologický pokrok. Bohužel je také vidět střídání velkých ambicí s představením každé nové metody (FISH, jednotlivé arrays, genové expresní profily, sekvenování nové generace,...) a následným vystřízlivěním. Obrovským očekáváním bylo například provázeno zavedení metody stanovení genového expresního profilu arkansaskou výzkumnou skupinou v roce 2005–2007 [17]. Nic zásadního se však nestalo, pomineme-li, že máme k dispozici další nedokonalý prognostický nástroj, bohužel zjevně celosvětově neaplikovatelný.
V reálné praxi stanovujeme vybrané chromozomální abnormality ze vzorku kostní dřeně pomocí metody FISH (fluoresence in situ hybridization) již nejméně 15 let. Až po analýze přínosu novějších léčebných postupů, tedy asi po deseti letech, však nakonec IMWG v roce 2014 navrhlo definovat „high-risk“ skupinu nemocných na základě přítomnosti cytogenetických aberací (t(4;14), t(14;16) a del(17/17p) [18, 19]. Skutečností je, že až s dostupností řady nových léků (asi od roku 2016) nabývá toto vyhodnocení na významu, neboť je jedním z rozhodujících laboratorních vyhodnocení pro výběr určitého typu léčby u nemocných typu „high-risk“.
V České republice je na rozdíl od většiny světa toto vyšetření dobře dostupné. Podíl nemocných s provedeným FISH vyšetřením je ve srovnání se světem relativně vysoký, třebaže dosahuje jen asi 35 %. V průběhu posledních 15 let proběhla standardizace tohoto vyšetření, na kterém se významně podílela i Česká myelomová skupina, respektive cytogenetičtí experti z České republiky na danou problematiku s námi spolupracující [20]. Lze říct, že celoplošně je v České republice tato metoda používána na vysoké úrovni s velkou výpovědní hodnotou. A v roce 2018 konečně s možností reálného praktického využití, neboť použití imunomodulačních látek není u „high-risk“ podskupiny nemocných s MM optimální a přednost mají proteasomové inhibitory a kombinované léčebné režimy složené ze tří léků [1].
2 Změny kritérií v průběhu 25 let
2. 1 Diagnostická kritéria
Během posledních 25 let aktualizovala mezinárodní myelomová pracovní skupina (IMWG) několikrát kritéria pro stanovení diagnózy mnohočetného myelomu, naposledy v roce 2014 [21]. Ty jediné zaslouží zvláštní komentář, neboť předcházející aktualizace byly spíše formální. Do té doby platná kritéria od roku 2003 si vyžádala úpravy na základě průkazu přínosu nových zobrazovacích technik u MM (odstavec 1.2) a také úpravu se snahou zabránit poškození organismu v rámci asymptomatické fáze onemocnění při identifikaci nových rizikových faktorů. Nová kritéria jsou přehledně uvedena v tabulce 1 [1].

1Klonalita by měla být stanovena pomocí průkazu k/l restrikce lehkých řetězců při vyšetření pomocí průtokové cytometrie, imunohistochemie nebo imunofluorescence, počet plazmatických
buněk by měl být přednostně stanoven z biopie kostní dřeně; v případě rozdílu v procentuálním zastoupení plazmatických buněk zjištěném v aspirátu a bioptickém vzorku by měla být použita
vyšší hodnota.
2Pokud je počet klonálních plazmatických buněk v kostní dřeni < 10 %, pak je nutná přítomnost více než jednoho ložiska k odlišení od solitárního plazmocytomu s minimálním postižením
kostní dřeně.
3Při použití stanovení pomocí metody Freelite© (The Binding Site, Birmingham, UK).
4Velikost ložiska musí být minimálně 5 mm.
V rámci dosud platných CRAB kritérií bylo doplněno k dosavadnímu posouzení renální insuficience pomocí koncentrace sérového kreatininu ještě stanovení kreatininové clearance. V rámci sledování nemocných se „smoldering“ (asymptomatickým) MM byly nově identifikovány 3 rizikové faktory, tzv. biomarkery malignity, jejichž identifikace znamená pro nemocné riziko časné progrese do symptomatické formy onemocnění, a jejich přítomnost tak dnes opravňuje k zahájení léčby. Za nemocné s mnohočetným myelomem, indikované k léčbě, jsou proto nově považováni jedinci s infiltrací ≥ 60 % klonálními plazmatickými buňkami v kostní dřeni, s poměrem postižených/nepostižených volných řetězců v séru ≥ 100 a více než jedním ložiskem skeletu větším než 5 mm při vyšetření pomocí MRI i přes absenci kritérií CRAB [1]. Jde o minimální počet nemocných, kterých se nová kritéria časného myelomu týkají. Je pravdou, že v posledním období je tato změna kritérií vedoucí k možnosti časného zahájení léčby často kritizovaná i na mezinárodních fórech. Nicméně je tu možnost léčbu zahájit dříve, kterou lékař s nemocným může zvážit.
2. 2 Léčebná kritéria
Před právě 20 lety vznikla EBMT kritéria, která si rychle našla název „Blade criteria“ podle profesora Bladé z Barcelony, který se stal v následných 20 letech jednou z nejcitovanějších osob v myelomové komunitě [22]. Přestože tato kritéria myelomovou komunitu nesjednotila ve 100 %, byl to zásadní počin v celosvětovém sjednocení kritérií léčebné účinnosti u MM včetně definice klíčových intervalů a kritérií progrese onemocnění. Při následné dynamice došlo k několika modifikacím již pod hlavičkou IMWG, a to nejprve v roce 2006 [23]. Tato modifikace měla své silné stránky (uplatnila se již celosvětově, pod francouzským vlivem zavedla kategorii velmi dobré parciální remise, kvantifikovala kategorie v případě použití volných lehkých řetězců a také upřesnila definici relapsu z kompletní remise). Měla také slabší stránky. S odstupem času ji nazýváme jako modifikaci ukvapenou a dílem tendenční. Jednak zmizela kategorie minimální léčebné účinnosti, která se naopak dále stále používá, neboť je klinicky důležitá. Naopak přibyla kategorie „stringent CR“ (complete remission) vyžadující stanovení volných lehkých řetězců, respektive jejich normalizaci. Ta byla zavedena bez důkladné validace a následně se ukázalo, že tato kategorie je prognosticky nepodstatná a přestala se reálně klinicky používat. I přidání kategorie molekulární CR s definicí PCR negativity při vyšetření kostní dřeně lze považovat za krok sice dobrý, ale v roce 2006 bezvýznamný. Následné úpravy v letech 2011 a 2016 lze potom nazvat optimalizací. Zpět byla zavedena kategorie „minimální léčebná odpověď“, nově byla zahrnuta kategorie imunofenotypová kompletní remise s jistou limitací významu, ale zjevným směřováním k vyhodnocení MRD. Finálně v roce 2016 byla upřesněna definice molekulární remise, respektive MRD negativity s možností vyhodnocení jak průtokovou cytometrií, tak s použitím sekvenování nové generace [24, 25]. V tabulce 2 jsou uvedena platná kritéria pro MRD od roku 2016. Přes velkou kritiku některých členů je IMWG vydala s vědomím, že jejich platnost bude mít doslova jepičí život. Jak je poučeným čtenářům jasné, téměř hned po vydání byla kritéria již stará a jejich úprava bude provedena v roce 2019.

Z celosvětového pohledu lze považovat za důležité, že se základní rámec hodnocení léčebné odpovědi za posledních 25 let nezměnil. Je ohraničen na jedné straně definicí biochemické kompletní remise a na druhé straně definicí progrese. To umožňuje dobře porovnávat výsledky léčby v různých obdobích. Tato definice je celosvětově uznávaná a především aplikovatelná v 75 % zemí světa. Až zavedení nových léčebných metod dosahujících významný počet kompletních remisí si následně vynutil, podobně jako u jiných krevních nádorů, podrobnější definici kompletní remise za meze imunobiochemických metod. A to naštěstí technologický pokrok v druhé dekádě tohoto století již umožnil. Od dvoubarevné průtokové cytometrie jsme se za 25 let přesunuli ke klinicky využívanému osmibarevnému vyhodnocení průtokovou cytometrií a výzkumně jsme ještě dále.
V České republice je celoplošně kvalita stanovení léčebné odpovědi na mimořádně vysoké úrovni. O dostupnosti vyhodnocení MRD pomocí průtokové cytometrie jsou informace uvedeny v odstavci 2.3 a Česká myelomová skupina má pro potřeby interních vyhodnocení zajištěnu možnost vyhodnocení MRD i pomocí sekvenování nové generace. Víme však, že dynamika v této oblasti bude velká, zvláště věříme ve zjednodušení a zlevnění metod. Zcela zásadní pokrok, na který čekáme, bude možnost vyhodnocení MRD jen ze vzorku periferní krve oproti stávající nutnosti vyhodnocení ze vzorku kostní dřeně. To je velkou limitací pro kvalitní a časté monitorování MRD u mnohočetného myelomu.
2. 3 Prognostická kritéria
Za pozoruhodné lze označit skutečnost, že systém stanovení klinického stadia podle Durieho a Salmona, který byl docela starý již před 25 lety (vznikl v roce 1975, tabulka 3) má v roce 2018 stále své uplatnění [26]. Více než ¾ světa jej stále používá při vstupním popisu onemocnění. Pana doktora Salmona jsem osobně nepoznal. Pana doktora Durieho ano. Sám si nikdy nemyslel, že něco takto empiricky vytvořeného může být používáno tak dlouho. Skutečností je, že svět se v té době ani příliš nesnažil, neboť výstupy jakékoliv léčby byly podobné. K řadě nastavených tzv. „cut-off“ hodnot v různých systémech se přistupovalo často více s klinickým citem a pocitem experta, než že by došlo k analýze robustních dat s využitím statistických nástrojů. Přinejmenším ve srovnání s dnešní dobou. Klasickým příkladem je například nastavení hranice 20 % cirkulujících plazmocytů v periferní krvi pro diagnózu plazmocelulární leukemie. Tuto hranici používáme dodnes, přestože jsme si jistí, že nikdy v minulosti neproběhla žádná věrohodná validace takového nastavení. Víme, že na začátku šlo o „pocit experta“, kde hranice má být (osobní komunikace s R. Kyle). V průběhu 25 let lze pozorovat jistý vývoj, třebaže použití všech dalších dostupných prognostických systémů má své limitace. Mezinárodní prognostický systém (ISS – International Staging System) představený poprvé v roce 2005 byl po dlouhé době prvním prognostickým systémem u MM, u kterého můžeme říct, že byl skutečně robustněji validován [27]. „V jednoduchosti je krása“. Použití dvou jednoduchých biochemických parametrů (albumin a beta2 mikroglobulin) umožnilo nepochybně celosvětové využití ISS. Je nepřehlédnutelné, že z pohledu MM jde o důležité parametry. Snaha o zlepšení ISS v podobě revidovaného ISS (R-ISS), představeného v roce 2015, zůstala tak nějak na půl cesty [28]. Zatímco doplnění původního indexu o hodnotu laktátdehydrogenázu lze považovat z pohledu využitelnosti za neutrální, nutnost znalosti stavu chromozomálních abnormalit (viz odstavec 1.4) je velkou limitací index pro celosvětové využití. Je dokonce možné, že zůstane především stratifikačním nástrojem pro klinické studie. Za frustrující pro experty lze možná označit fakt, že dnes nemáme věrohodný prognostický model v relapsu onemocnění, třebaže původní ISS a R-ISS dílem fungují.

V této oblasti se snaží být aktivní Česká myelomová skupina. Podílí se na vývoji prognostických nástrojů u MGUS, SMM (smouldering myeloma; doutnající myelom) a MM [29, 30, 31]. Nejnověji byl navrhnutý prognostický systém „Risk-Stratification Algorithm“ (RSA) pro nemocné s relapsem MM. Systém poprvé unikátním způsobem zahrnuje data o agresivitě onemocnění, fragilitě nemocných a kombinuje je s výstupy minulé léčby. Je však komplikovaný a podle výše uvedeného lze předpokládat, že to bude i jeho největší limitace [31]. Je jisté, že prognostické nástroje by se u mnohočetného myelomu měly zlepšit. Uvidíme, zda k tomu technologický pokrok a zvyšující se dostupnost nejmodernějších metod v oblasti analýzy genomu a proteomu nějak zásadně přispějí. Zatím ne. Při stávající dostupnosti bioinformatických nástrojů a limitované praktické zkušenosti s nimi jde spíše na konci této dekády o stav „výkladového zmatku“. Aspoň tomu tak je u MM. Je potřeba zůstat pozitivní, neboť tato oblast se bouřlivě vyvíjí a je jisté, že dříve nebo později dojde ke zjednodušení výstupů a jejich vyšší použitelnosti v klinické praxi. V roce 2018 je skutečností, že nejdůležitějším prognostickým faktorem se stává léčebný výstup – dosažení MRD negativity. Bohužel se u MM za posledních 25 let nijak neposunul vývoj v oblasti prediktivních nástrojů.
3 Léčebné nástroje u MM
Před 25 lety byla část světa (nejvyspělejší země Evropy a USA) již 5 let plně v éře druhého klíčového pokroku v léčbě mnohočetného myelomu po zavedení alkylačních léků a glukokortikoidů do léčby MM v 70. letech minulého století. Tím pokrokem bylo zavedení autologních transplantací do léčby mnohočetného myelomu. V České republice byla tato metoda zavedena v polovině 90. let minulého století.
Následující pokrok znamenal postupně objevení a ověření účinnosti dalších léků v první dekádě tohoto století (thalidomid, bortezomib, lenalidomid) a v druhé dekádě (pomalidomid, carfilzomib, ixazomib, elotuzumab, daratumumab, panobinostat) včetně testování nových léků či postupů v posledních 3 letech (isatuximab melflufen, selinexor, venetoclax, CAR-T buněčná terapie, bispecifické protilátky,...). Zajímavé je, že klíčový pokrok vždy přinesly léky, které se používají doposud, třebaže jejich použití bylo zahájeno před 40, 30 či 20 lety. Tak to platí o melfalanu a glukokortikoidech, autologní transplantaci a thalidomidu [1]. Zcela jistě to bude platit o monoklonální protilátce či protilátkách anti-CD38. Nejnověji lze v oblasti hematoonkologie považovat za průlomové využití moderních protokolů buněčné imunoterapie. U významně předléčených nemocných s MM dosahuje jednorázové použití CAR-T buněk 60–100% léčebné účinnosti s významným podílem kompletních remisí (30–50 %) včetně dosažení MRD negativity [32].
Je jen obtížné krátce popsat dynamiku vývoje léčby, která byla lenivá až do představení autologních transplantací, ale skutečně mimořádnou dynamičnost nabrala až na začátku druhé dekády. U nemocných nevhodných k provedení autologní transplantace jsme v roce 1993 byli uprostřed éry použití režimu VAD (vinkristin, doxorubicin, dexametazon), toxického, ale velmi účinného režimu vyžadujícího kanylaci centrální žíly a zpravidla 4denní hospitalizaci. Po nástupu thalidomidu a následně bortezomibu a lenalidomidu jsme byli svědky významného přesunu našich nemocných do ambulantního režimu. Dnes je tento trend dokonaný a naopak se objevují nové typy imunoterapie vyžadující přinejmenším krátkodobou hospitalizaci s ohledem na bezpečnost nemocného.
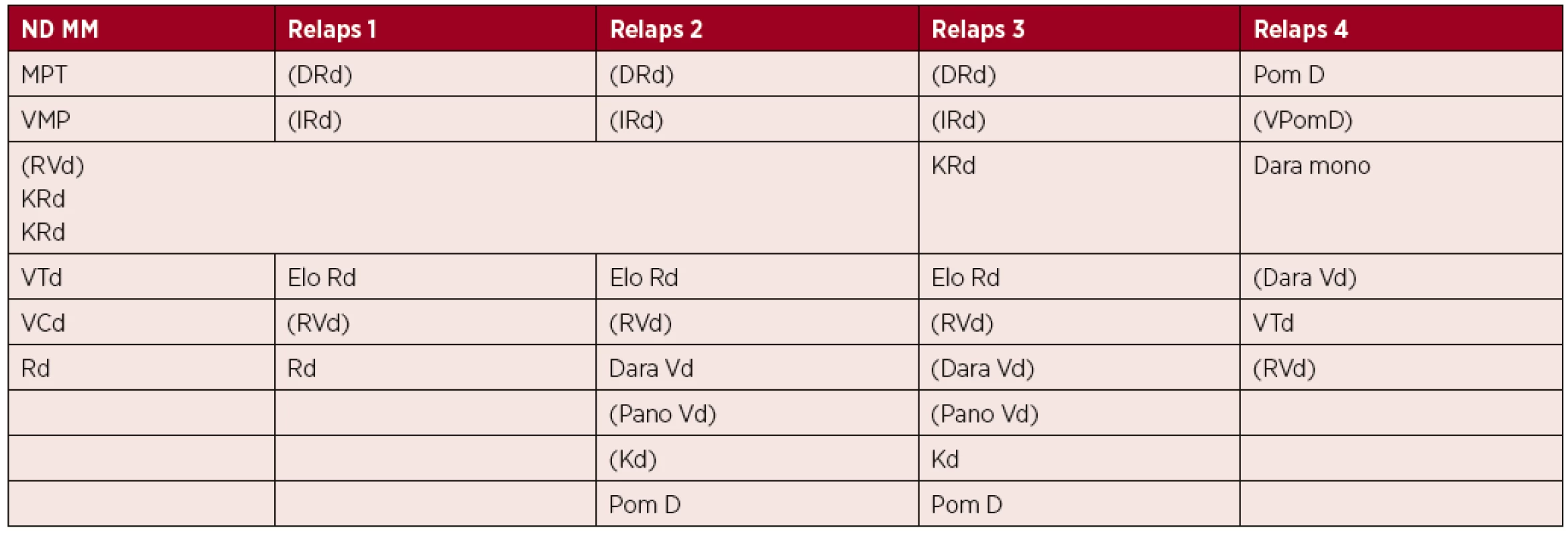
V roce 2018 máme k dispozici nejméně 12 účinných léků s možností různých kombinací. Jejich přehled naleznete v přiložené tabulce 4. Doba je skutečně mimořádná, odborně vzrušující. Není například neobvyklé, že v 2.–4. léčebné linii dosahujeme v roce 2018 paradoxně lepších výsledků než u nemocných s novou diagnózou, neboť nemocné s novou diagnózou nemůžeme léčit moderními trojkombinacemi.
Přehodnotili jsme hodnotu prvního léčebného cíle. Nejprve to bylo dosažení aspoň parciální remise, pod vlivem francouzských studií jsme se na začátku tohoto století posunuli k velmi dobré parciální remisi. Když počet dosažitelných remisí u nově diagnostikovaných nemocných dosáhl asi 50 %, stalo se o deset let později prvním cílem dosažení kompletní remise. Není tedy překvapení, že dnes by mělo být cílem spíše dosažení MRD negativity a léčba do 4. linie by měla být aktivně vyměněna, pokud není dostatečně účinná. U nově diagnostikovaných MM dosáhnou dnes ty nejúčinnější postupy kompletní remise v 80–90 % včetně 70–80 % MRD negativity [1].
Změnili jsme formulaci „mnohočetný myelom je nevyléčitelným onemocněním“ a snažíme se formulovat nově „operational cure“ – stav, kdy nemocní zůstávají po jedné léčebné linii v hluboké kompletní remisi nejméně 10 let, nejsou dále léčeni a následně někdy zemřou z jiného důvodu. Takových nemocných je asi 10 %, pokud byli léčeni jen autologní transplantací (z dat nemocných první dekády tohoto století). Tento podíl se významně zvyšuje a bude dále zvyšovat tak, jak se významně posunují mediány celkového přežití při zavádění nových léků, v dnešní době trojkombinací, do naší komplexní léčebné strategie [1, 33].
Ve světě je díky rychlému pokroku situace významně nerovnoměrná. Je jen málo států i v ekonomicky silné části Evropy, které si mohou dovolit indikovat tu nejmodernější léčbu podobně jako v USA. Měsíční cena trojkombinací přesahuje zpravidla více než 200 tisíc Kč, často víc než 300 tisíc Kč. Osm desetin světa si takovou léčbu nemůže dovolit. Situace v České republice není zlá, třebaže dostupnost nových léků je stále limitovaná. Česká republika patří mezi nejvyspělejší země s transplantačním programem, který probíhá ve všech univerzitních centrech dlouhodobě na vysoké odborné úrovni. V roce 2018 jsou zatím z moderních trojkombinací schváleny dvě (carfilozmib-lenalidomid-dexametazon a elotuzumab-lenalidomid-dexametazon) a dalších 5 trojkombinací žádá o úhradu (ixazomib, daratumumab, panobinostat). V roce 1993 byla péče v České republice rovnoměrně a kvalitně rozložena a tento stav trval až do roku 2010. Poté přechodně zakolísal, ale nakonec se všechna univerzitní centra vyrovnala s ekonomickou zátěží dvou nových léků – bortezomibu a lenalidomidu. Skutečností je, že poprvé od roku 2016 hovoříme o nerovnoměrné dostupnosti péče o nemocné s MM v České republice, což samozřejmě souvisí s ekonomickou zátěží a celkovou kondicí jednotlivých univerzitních pracovišť. Pravdou je, že v celém oboru hematoonkologie došlo v poslední dekádě k významnému zlepšení léčebných možností. Prodlužuje se přežití nemocných (u MM prevalence stoupla od roku 1990 téměř 3krát) a dochází k významné kumulaci nemocných. Všechna pracoviště pracují na hranicích nebo dokonce za hranicí svých možností. Některá univerzitní pracoviště musela redukovat svůj program a lůžkový fond.
Společenské a odborné aktivity u mnohočetného myelomu
V roce 1993 již byla aktivní organizace International Myeloma Foundation (IMF), vedená Susie Novis, která ji vede doposud. Její aktivity byly zaměřeny směrem k nemocným s MM především v USA. Během 25 let se záběr IMF stal celosvětovým, s nejnovějšími aktivitami v oblasti Asie a rozvojem aktivit v oblasti Jižní Ameriky. Jen Afrika doposud není v zorném poli tohoto nadačního fondu. Jde o nejvýznamnější nadační fond na světě. Snaha o vznik podobného tělesa v první dekádě tohoto století v rámci EU se víceméně nezdařila. Za zmínku stojí anglický nadační fond (IFM UK), který je podle mého názoru nejlépe organizovaným fondem na národní úrovni. „Česká myelomová skupina, nadační fond“ vznikl v listopadu 2012 a spolu s „Klubem pacientů mnohočetný myelom“, který vznikl neformálně v roce 2007 a formálně v listopadu 2014, spolupracují na řadě edukačních aktivit a vybraných charitativních akcích v České republice.
V roce 1993 reprezentoval IFM, respektive její součást IMWG, i odborné aktivity u MM. Opět především v oblasti USA a vyspělých zemí EU. Má podobný vývoj, třebaže jeho celosvětový záběr je dnes omezen konkurujícími aktivitami a organizacemi. Pro IMWG jsou dnes charakteristické aktivity vydávání mezinárodních doporučení a společné analýzy dat u vybraných projektů. Odbornou záštitu, nejméně nad kongresy týkající se MM, převzala od roku 2008 International Myeloma Society (IMS), jejíž význam a role v myelomové komunitě přes obtížné začátky postupně stoupá. V rámci EU vznikla v roce 2005 European Myeloma Network (EMN) jako reakce na velkou sílu národních myelomových skupin ve Francii a Španělsku, které získávaly nejvýznamnější klinické studie. V posledních dvou letech však dochází k vyšší koordinaci a vzniku řady společných aktivit. I španělská, anglická a francouzská myelomová skupina se postupně zapojuje do vybraných aktivit EMN a stávají se její součástí.
Česká myelomová skupina (CMG) byla v roce 1996 založena nejdříve jako „dobrovolné sdružení lékařů“, aby se stala následně formálním právním tělesem nejprve s dovětkem „občanské sdružení“ a po změně legislativy „spolek“. Její zaměření je odborné. Podporuje aktivně standardizaci řady výzkumných a klinických aplikovatelných metod v oblasti monoklonálních gamapatií, pořádá odborné semináře a workshopy na národní i mezinárodní úrovni. Od roku 2007 se stala oficiálním partnerem IMF, od roku 2005 se podílí na aktivitách EMN, především spolupracuje na akademických klinických studiích. Zcela zásadní a celosvětově uznávanou aktivitu představuje registr RMG (Register of monoclonal gammopathy), dnes pravděpodobně největší a nejkvalitnější registr s reálnými daty u mnohočetného myelomu a dalších monoklonálních gamapatií na světě. Po 11 letech od jeho založení, právě v listopadu 2018, dosáhl registr počtu 10 000 zařazených nemocných. Všem nemocným, kteří souhlasili se vstupem do registru, všem lékařům a především všem data-manažerkám patří mimořádné a upřímné poděkování.
Ukončené aktivity za 25 let aneb o pomíjivosti
Před 25 lety bylo arkansaské pracoviště v Little Rocku v USA vedené profesorem Barlogie v začínajícím rozkvětu. Měl jsem tu čest zde právě v tomto období dlouhodoběji být a byla to pro mě životně a odborně významná zkušenost. Jednak zde byl poprvé popsán významný účinek thalidomidu u mnohočetného myelomu. Především se však pracoviště, respektive prof. Barlogie proslavil svým agresivním přístupem k léčbě MM. Jeho vize byla léčit MM stejně agresivně jako akutní leukemie, což bylo ve své době velmi revoluční a neakceptovatelné pro většinu myelomové komunity. Různé typy protokolů Total Therapy známé svoji velkou intenzitou a zařazením povinné tandemové autologní transplantace se staly světoznámé. Nemocní jezdili do jím vedeného „Myeloma Institute for Research and Therapy, University of Arkansas for Medical Sciences“ z celého světa po dobu nejméně 20 let, aby dostali tu nejlepší léčbu na světě. A výsledky léčby byly na danou dobu mimořádné: 10letá doba do progrese (PFS) a dosažení kompletních remisí (CR) se postupně zvyšovaly s čísly protokolů Total Therapy (TT): PFS 8,8 %/CR 17,9 % pro TT1, 25,1 %/35,6 % pro TT2 rameno s thalidomidem, 32,9 %/48,8 % in TT3 pro rameno s thalidomidem a bortezomibem. Bylo propočítané, že část nemocných bude vyléčená [34]. Pracoviště bylo v období 2000–2010 považováno za jedno ze tří nejlepších pracovišť na světě v oblasti MM a profesor Barlogie byl v roce 2006 vyhlášen nejlepším lékařem roku v USA. Doba se však změnila. Objevila se řada nových léků a léčebných možností, které jsou mimořádně účinné a dostupné v řadě myelomových center ve světě. Profesor Barlogie již několik let v centru nepracuje. Přestal být důvod jezdit za ním do Arkansasu. Řada dalších faktorů potom způsobila, že Myeloma Institute for Research and Therapy bude od roku 2019 zrušen. I to se může během 25 let stát.
ZÁVĚR
Léčba mnohočetného myelomu se v průběhu posledních 25 let zásadně změnila, a to díky novým účinným léčebným možnostem. V České republice je kvalita péče o nemocné s MM na velmi dobré úrovni. K ní přispívají i společné odborné a edukační akce České myelomové skupiny a jejího nadačního fondu ve spolupráci s Klubem pacientů mnohočetný myelom uspořádané v posledních 15 letech (obr. 1 a 2). Dílem se daří rychle implementovat technologický vývoj do klinické praxe i následovat pokrok v moderní léčbě. Ekonomické nastavení v České republice je limitující, respektive nastavený systém úhrady nákladných léků nereaguje na dynamiku vývoje moderní léčby v hematoonkologii. Univerzitní pracoviště jsou trvale pod mimořádným tlakem. Každým rokem však stoupá nemocným naděje na lepší prognózu a šanci na vyléčení. Pokud by šel pokrok takto dramaticky vpřed, zůstane nevyléčitelná za dalších 25 let jen menší část nebo dokonce velmi malá část nemocných.


Čestné prohlášení
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 20. 11. 2018.
Přijato po recenzi dne 10. 12. 2018.
prof. MUDr. Roman Hájek, CSc.
Klinika hematoonkologie
Fakultní nemocnice Ostrava
17. listopadu 1790/5
708 52 Ostrava-Poruba
e-mail: roman.hajek@fno.cz
Zdroje
1. Hájek R, Krejčí M, Maisnar V, et al. Diagnostika a léčba mnohočetného myelomu. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou Myelómovou Spoločností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze Hematol dnes 2018;24(Suppl 1):1–157.
2. Hájek R, Adam Z, Maisnar V, et al. Diagnostika a léčba mnohočetného myelomu. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou Myelómovou Spoločností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze Hematol dnes 2009;15(Suppl 2):1–80.
3. Adam Z, Straub J, Ščudla V. Doporučení České myelomové skupiny (CMG) pro zajištění časné diagnostiky mnohočetného myelomu v podmínkách ambulantní klinické praxe. Transfuze Hematol dnes 2008;14(2):93–94.
4. Malušková D, Svobodová I, Kučerová M, et al. Epidemiology of multiple myeloma in the Czech Republic. Klin Onkol 2017;30:35–42.
5. Landgren O, Kyle RA, Pfeiffer RM, et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study. Blood 2009;113:5412–5417.
6. Bradwell AR, Carr-Smith HD, Mead GP, et al. Highly sensitive, automated immunoassay for immunoglobulin free light chains in serum and urine. Clin Chem 2001;47:673–680.
7. Dispenzieri A, Kyle R, Merlini G, et al. International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. Leukemia 2009;23(2):215–224.
8. Kyle RA, Durie BG, Rajkumar SV, et al. Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma: IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. Leukemia 2010;24:1121–1127.
9. Bradwell AR, Harding SJ, Fourrier NJ, et al. Assessment of monoclonal gammopathies by nephelometric measurement of individual immunoglobulin kappa/lambda ratios. Clin Chem 2009;55:1646–1655.
10. Ščudla V, Lochman P, Novák M, Pika T, Minařík J, Langová K. Analýza vztahu poměru volných lehkých řetězců (FLC-r, FreeliteTM), párů těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM) v séru a výsledků multiparametrické průtokové cytometrie plazmocytů k „progression free survival“ u mnohočetného myelomu. Transfuze Hematol dnes 2016;22(1):14–27.
11. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014;15(12):e538–548.
12. Cavo M, Terpos E, Nanni C, et al. Role of (18)F-FDG PET/CT in the diagnosis and management of multiple myeloma and other plasma cell disorders: a konsensus statement by the International Myeloma Working Group. Lancet Oncol 2017;18(4):e206–e217.
13. Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol 2016;17(8):e328–e346.
14. Minařík J, Hrbek J, Mysliveček M, et al. Racionální algoritmus zobrazovacích vyšetření u mnohočetného myelomu v podmínkách České republiky. Transfuze Hematol dnes 2015;21(4):200–205.
15. Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol 2016;17:e328–e346.
16. Munshi NC, Avet-Loiseau H, Rawstron AC, et al. Association of minimal residual disease with superior survival outcomes in patients with multiple myeloma: a meta-analysis. JAMA Oncol 2017;3:28–35.
17. Shaughnessy JD Jr, Haessler J, van Rhee F, et al. Testing standard and genetic parameters in 220 patients with multiple myeloma with complete data sets: superiority of molecular genetics. Br J Haematol 2007;137(6):530–536.
18. Chng WJ, Dispenzieri A, Chim CS, et al. IMWG consensus on risk stratification in multiple myeloma. Leukemia 2014;28:269–277.
19. Sonneveld P, Avet-Loiseau H, Lonial S, et al. Treatment of multiple myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group. Blood 2016;127:2955–2962.
20. Ross FM, Avet-Loiseau H, Ameye G, et al. European Myeloma Network. Report from the European Myeloma Network on interphase FISH in multiple myeloma and related disorders. Haematologica 2012;97(8):1272–1277.
21. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014;15:e538–e548.
22. Bladé J, Samson D, Reece D, et al. Criteria for evaluating disease response and progression in patients with multiple myeloma treated by high-dose therapy and haemopoietic stem cell transplantation. Myeloma Subcommittee of the EBMT. European Group for Blood and Marrow Transplant. Br J Haematol 1998;102(5):1115–1123.
23. Durie BG, Harousseau JL, Miguel JS, et al. International Myeloma Working Group. International uniform response criteria for multiple myeloma. Leukemia 2006;20(9):1467–1473.
24. Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol 2016;17:e328–e346.
25. Rajkumar SV. Harousseau J-L, Durie B, et al. Consensus recommendations for the uniform reporting of clinical trials: report of the International Myeloma Workshop Consensus Panel 1. Blood 2011;117:4691–4695.
26. Durie BGM, Salmon SE. A clinical staging system for multiple myeloma cell mass with presenting clinical features, response to treatment and survival. Cancer 1975;36:842–854.
27. Greipp PR, San Miguel JF, Durie BGM, et al. International staging system for multiple myeloma. J Clin Oncol 2005;23:3412–3420.
28. Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised international staging system for multiple myeloma: a report from International Myeloma Working Group. J Clin Oncol 2015;33:2863–2869.
29. Sandecká V, Hájek R, Pour L, et al. Czech Myeloma Group. A first Czech analysis of 1887 cases with monoclonal gammopathy of undetermined significance. Eur J Haematol 2017; 99(1):80–90.
30. Hájek R, Pour L, Hose D, et al. The road to identification of patients with smoldering multiple myeloma at ultra-high risk of progression to symptomatic disease (manuskript v přípravě).
31. Hájek R, Delforge M, Raab MS, et al. A novel risk-stratification algorithm for relapsed multiple myeloma (RMM): Assessment of performance and validation using real-world patient data from France, Germany and the United Kingdom. (zasláno k tisku 2018).
32. Cohen AD. CAR T cells and other cellular therapies for multiple myeloma: 2018 update. Am Soc Clin Oncol Educ Book 2018;38:6–15.
33. Attal M, Lauwers-Cances V, Hulin C, et al. Study IFM. Lenalidomide, bortezomib, and dexamethasone with transplantation for myeloma. N Engl J Med 2017;376:1311–1320.
34. Barlogie B, Mitchell A, van Rhee F, Epstein J, et al. Curing myeloma at last: defining criteria and providing the evidence. Blood 2014;124(20):3043–3051.
Štítky
Hematológia Interné lekárstvo OnkológiaČlánok vyšiel v časopise
Transfuze a hematologie dnes

2019 Číslo 1
- Nejasný stín na plicích – kazuistika
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
Najčítanejšie v tomto čísle
- Hodgkinův lymfom – nekončící příběh
- Non-Hodgkinův lymfom v České republice
- Vývoj transfuzní služby v České republice po roce 1990
- Vývoj léčby chronické myeloidní leukemie v posledních 25 letech
