-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nezvyklý a nepriaznivý priebeh chronickej myelocytovej leukémie – kazuistika a prehľad literatúry
Rare and unfavorable course of chronic myeloid leukemia – a case report and review of the literature
Patients with chronic myeloid leukaemia (CML) in chronic phase have a life expectancy similar to the general population when treated with tyrosine kinase inhibitors. Despite these improvements, the major challenge for haematologists is to determine the optimal treatment approach in advanced CML phases (primary or therapy-induced and associated with clonal evolution). Advanced disease has varied clinical manifestations and may be associated with unusual and often life-threatening situations. We present here a rare case of continuous disease progression on tyrosine kinase inhibitor treatment with severe haemorrhagic manifestations in blast crisis, and posttransplant relapse. We also present a review of published literature.
Keywords:
chronic myeloid leukaemia – ponatinib – advanced phases of disease – intraabdominal bleeding – allogeneic stem cell transplantation
Autori: P. Rohoň 1; V. Markuseková 1; E. Bojtárová 1; L. Sopko 1; I. Majeský 2; A. Žákovičová 3; Ľ. Majerová 3; L. Tatayová 3; A. Blahová 3; M. Krajčíková 3; A. Bátorová 1
Pôsobisko autorov: Klinika hematológie a transfúziológie LF UK, SZU a UN Bratislava, Slovensko 1; II. chirurgická klinika LF UK a UN Bratislava, Slovensko 2; Oddelenie lekárskej genetiky, Medirex, a. s., Slovensko 3
Vyšlo v časopise: Transfuze Hematol. dnes,29, 2023, No. 1, p. 40-49.
Kategória: Kazuistiky
doi: https://doi.org/10.48095/cctahd202340Súhrn
Pacienti s chronickou myelocytovou leukémiou (CML) v chronickej fáze choroby majú pri liečbe inhibítormi tyrozínových kináz očakávanú dĺžka života približujúcu sa veku prežívania bežnej populácie. Napriek týmto pokrokom zostáva pre hematológov veľkou výzvou určenie optimálnej liečebnej stratégie pre zriedkavé, pokročilé ochorenie – vznikajúce v podobe primárnej alebo terapiou indukovanej a spojené s klonovou evolúciou. Pokročilé ochorenie má pochopiteľne pestrejšie klinické prejavy a prináša aj niektoré neobvyklé a často i život ohrozujúce situácie. Popisujeme zriedkavý prípad pokračujúcej klinickej progresie CML počas liečby inhibítormi tyrozínových kináz so závažnou hemoragickou manifestáciou pri blastovom zvrate a potransplantačným návratom choroby. Je tiež doplnený prehľad niektorých publikovaných prác z tejto oblasti.
Klíčová slova:
chronická myelocytová leukémia – ponatinib – pokročilé fázy ochorenia – intraabdominálne krvácanie – alogénna transplantácia krvotvorných buniek
ÚVOD
Chronická myelocytová leukémia (CML) je klonové myeloproliferatívne ochorenie podmienené recipročnou translokáciou medzi chromozómami 9 a 22, t (9; 22) (q34; q11) – chromozómom Philadelphia (Ph) a/alebo prítomnosťou fúzneho génu BCR:: ABL1. Vzniknutý onkoproteín (tyrozínová kináza) je dôležitý v nádorovej transformácii pluripotentných kmeňových buniek [1]. Izolovaná prítomnosť Ph chromozómu je pri diagnóze CML určená asi v 90 % prípadov chronickej fázy (chronic phase – CP) ochorenia, pri progresii (klonová evolúcia) sa často vyskytujú ďalšie prídavné cytogenetické zmeny (additional cytogenetic abnormalities – ACA) v Ph+ klone [2]. Klinické príznaky CML sú podmienené do istej miery štádiom ochorenia; v CP môžu byť veľmi nenápadné: tlak v horných brušných kvadrantoch a tráviace komplikácie (pri hepato/splenomegálii) či zvýraznená metabolická aktivita. K zriedkavým prejavom, pozorovaným najmä pri akcelerácii choroby, patrí prítomnosť krvácania, ktoré však môže predstavovať život ohrozujúcu udalosť (napr. intracerebrálne či intraabdominálne krvácanie) [3,4]. V prípade vzácneho krvácania do dutiny brušnej u pacientov s CML je skôr pozorovaná spontánna atraumatická ruptúra sleziny, iné príčiny sú raritné [5]. Liečba CML patrí medzi najúspešnejšie kapitoly onkohematológie a očakávaná dĺžka života pacientov s novo diagnostikovanou CML v CP sa v súčasnosti vďaka inhibítorom tyrozínových kináz (TKI) približuje veku prežívania bežnej populácie [6]. V popredí klinického záujmu je koncepcia ukončenia/prerušenia liečby (treatment-free remission – TFR) [7]. Úplne iná situácia vzniká v prípade pokročilých fáz ochorenia (akcelerovaná fáza [accelerated phase – AP] a blastový zvrat [blastic phase – BP]) – či už ide o primárne ochorenie alebo dôsledok prebiehajúcej klonovej evolúcie [8]. Predložená kazuistika ukazuje, že napriek nesporným úspechom v starostlivosti o pacientov s CML sa môžu vyskytnúť i závažné komplikácie vo forme spontánneho intraabdominálneho krvácania a nepriaznivého biologického vývoja choroby i po alogénnej transplantácii krvotvorných kmeňových buniek (allogeneic haematopoietic stem cell transplantation – aloHSCT).
POPIS PRÍPADU
34-ročný pacient bol odoslaný na naše pracovisko z rajónnej nemocnice, kde bol vyšetrený pre dlhodobé bolesti brucha, nechutenstvo a zhoršenú toleranciu námahy. V krvnom obraze bol náhodný záchyt hyperleukocytózy (leukocyty 382×109/l), stredne ťažkej normocytovej normochrómnej anémie (hemoglobín 91 g/l, MCV 91 fl), ľahkej trombocytopénie (trombocyty 127×109/l). V rajónnom nemocničnom zariadení prebehlo vstupné hematologické vyšetrenie: 1. v krvnom nátere bol rovnomerný posun doľava až k blastom; 2. základný koagulogram ukazoval výhradne zvýšenú hladinu d-dimérov; 3. v biochemickom skríningu bola významne zvýšená koncentrácia laktátovej dehydrogenázy (LD) – 25 μkat/l a hyperurikémia; 4. ultrasonografia abdomenu potvrdila masívnu splenomegáliu s dosiahnutím ľavého mezogastria kaudálnym úsekom sleziny bez prítomnosti ložiskových parenchýmových zmien, mierne zväčšenú pečeň – tiež bez ložiskových zmien, ostatný nález bol normálny; 5. röntgenové vyšetrenie hrudníka potvrdilo nehomogénne tiene v pravom strednom pľúcnom poli. V predchorobí bolo popisované asi mesiac trvajúce nechutenstvo a ojedinele i zvracanie bez prímesi krvi. Inak sa pacient s ničím neliečil, z rodinnej anamnézy bol významný len údaj o leukémii u maternálnej starej matky – zomrela v 60 rokoch. V pracovnej anamnéze bola uvedená expozícia azbestu. Predbežná diagnóza bola určená ako myeloproliferatívna neoplázia (pravdepodobne typu CML).
Pacient bol pri prijatí kardiopulmonálne kompenzovaný, eupnoický a bez krvácavých prejavov či prejavov hyperviskózneho syndrómu. Bola doplnená aspirácia kostnej drene a určená diagnóza CML (zatiaľ s obrazom chronickej fázy), prehľad základných vstupných i neskôr doručených laboratórnych nálezov uvádza tab. 1, obr. 1a a obr. 2. Vyšetrenie očného pozadia neukazovalo edémy terčov zrakových nervov, boli však zachytené intraretinálne krvácania. U pacienta sa pokračovalo v začatej cytoredukčnej liečbe hydroxyureou v celkovej dennej dávke 4,5 g s prevenciou syndrómu z nádorového rozpadu, empiricky bolo podané i.v. antibiotikum (sulperazón). Po 4 dňoch hospitalizácie bol pacient prepustený vo veľmi dobrom klinickom stave s regresiou splenomegálie a nechutenstva, poklesom hladiny leukocytov (207×109/l), bez prejavov hyperviskózneho syndrómu a po podaní 1 TU erytrocytov do ambulantnej starostlivosti s pokračovaním cytoredukcie v dávke 3 g hydroxyurey denne.
Tab. 1. Vybrané laboratórne parametre pri diagnóze (pri prijatí k hospitalizácii). 
LD – laktátová dehydrogenáza; MCV – stredný objem erytrocytu; MPO – myeloperoxidáza Tab. 1 – pokračovanie. Vybrané laboratórne parametre pri diagnóze (pri prijatí k hospitalizácii). 
SSC – bočný rozptyl (side scatter) Obr. 1. Prehľad cytológie kostnej drene v rôznych štádiách ochorenia (farbenie podľa May-Grünwald a Giemsa, zväčšenie 1 000×). 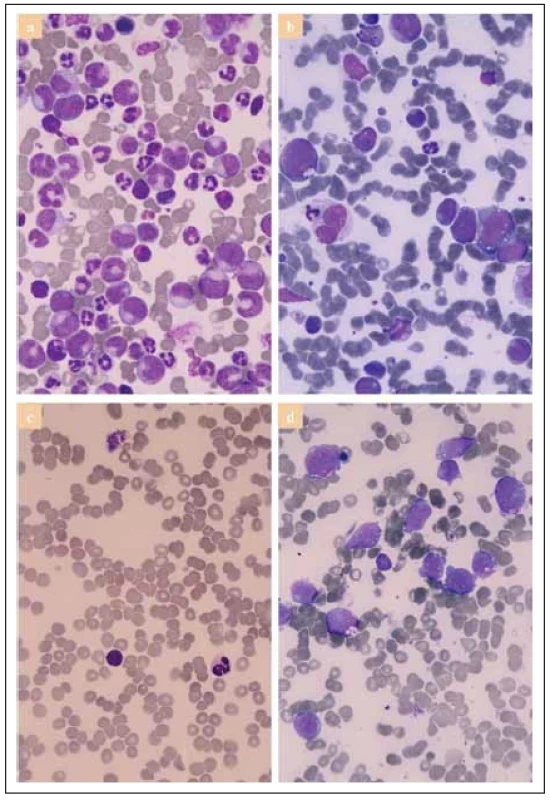
(a) Diagnostická fáza, hypercelulárna kostná dreň s dominujúcou granulopoézou, parciálna degranulácia zrelých foriem, zachytená i eozinofi lová populácia – obraz chronickej fázy CML.
(b) 1. blastový zvrat – masívna infi ltrácia blastovými bunkami rôznej veľkosti s dobre identifi kovateľnou vakuolizáciou (monoblasty).
(c) Dosiahnutie kompletnej hematologickej remisie po indukčnej liečbe, hypocelulárna kostná dreň bez prítomnosti patologických blastov.
(d) Návrat ochorenia po transplantácii (3. monoblastový zvrat) – masívna infi ltrácia uniformnou populáciou blastov (monoblastov) s výraznými cytoplazmovými výbežkami (blebs) a diskrétnou vakuolizáciou.Obr. 2. Vstupné cytogenetické vyšetrenie kostnej drene. 
(a) Konvenčné cytogenetické vyšetrenie s určením prítomnosti patologického klonu s t(9;22), ďalším Ph chromozómom a trizómiou chromozómov č. 2, 6 a 8 (označené červenými šípkami); fl uorescenčná in situ hybridizácia s nálezom 97 % buniek s fúziou BCR::ABL (b) s aditívnou zmenou – extra Ph chromozómom (c).
Poznámka: pomocou fl uorescenčnej in situ hybridizácie boli konfi rmované i ďalšie sekundárne chromozómové zmeny v Ph+ klone, ktoré ukázali evolúciu ochorenia.Pri 1. ambulantnej kontrole 7. deň od určenia diagnózy bol pacient klinicky vo veľmi dobrom stave s vymiznutím B-príznakov a ďalším ústupom splenomegálie, (slezina + 10 cm pod ľavým oblúkom rebra, ĽOR, vstupne +15 cm). V krvnom obraze bola pozorovaná redukcia leukocytovej nálože (leukocyty 73×109/l, hemoglobín 111 g/l, trombocyty 131×109/l). Pacient pokračoval v liečbe hydroxyureou. Po kompletizácii výsledkov bola diagnóza uzatvorená ako CML s akceleráciou pri zohľadnení ACA v Ph+ klone [9] a s prihliadnutím k revidovaným kritériám WHO 2016 a ELN odporúčaniu z roku 2020 [10].
Po poklese počtu leukocytov pod 30×109/l bola iniciovaná liečba nilotinibom v dávke 300 mg 2× denne (14 dní po stanovení diagnózy). V liečbe pokročilého ochorenia sa odporúča podanie imatinibu, ponatinibu (ak je potvrdená mutácia T315I) alebo nilotinibu. Zároveň s ohľadom na biologickú charakteristiku ochorenia bola doplnená HLA typizácia pacienta a jeho súrodencov – bol identifikovaný HLA zhodný brat ako potenciálny darca krvotvorných buniek. Po 6 týždňoch od diagnózy bola dosiahnutá kompletná hematologická odpoveď. Pacient prišiel neplánovane na kontrolu po 2,5 mesiacoch liečby TKI pre celkové zhoršenie stavu, tlak pod ĽOR a oligúriu. Neboli prítomné známky krvácania, kardiopulmonálne bol kompenzovaný. V laboratórnom obraze bolo prítomné akútne renálne zlyhanie. V doplnenom aspiráte kostnej drene bol obraz monoblastového zvratu CML, boli potvrdené vstupné cytogenetické zmeny vrátane zdvojenia Ph chromozómu, novo bola určená delécia exónu 7 v heterozygotnej forme v oblasti ABL1 kinázovej domény, podrobne (tab. 2, obr. 1b).
Tab. 2. Vybrané laboratórne parametre pri 1. blastovom zvrate choroby. 
Tab. 2 – pokračovanie. Vybrané laboratórne parametre pri 1. blastovom zvrate choroby. 
AML – akútna myeloblastová leukémia; FISH – fl uorescenčná in situ hybridizácia; IS – medzinárodná stupnica; LD – laktátová dehydrogenáza; MCV – stredný objem erytrocytu; MPOX – myeloperoxidáza; SSC – bočný rozptyl (side scatter) Po zaistení centrálneho žilového vstupu bola realizovaná neodkladne hemodialýza a zároveň prebiehala cytoredukcia hydroxyureou. Po 3 dňoch dochádza k postupnej úprave renálnych funkcií a zároveň k normalizácii počtu leukocytov. Abdominálna sonografia popisovala významnú hepatosplenomegáliu (hepar bez ložiskových zmien, v MCL asi 18 cm, dilatácia vena portae, slezina v najväčšom rozmere 22,7 cm, vo všetkých intraperitoneálnych priestoroch je prítomná voľná tekutina – významný ascites i so septovanými oddielmi). Pred podaním indukčnej chemoterapie bola indikovaná punkcia ascitu s cieľom zlepšiť respiračne nevýhodné postavenie bránice a znížiť prípadnú akumuláciu cytostatík vo výpotkoch. Punkcia ascitu pod sonografickým značením však nebola úspešná. Počas krátkeho časového úseku u pacienta došlo k významnému prehĺbeniu anémie a zväčšeniu ascitu; kontrolné zobrazenie dutiny brušnej (CT) ukázalo výrazné krvácanie z nejasného zdroja bez súvislosti s predchádzajúcou punkciou s veľkoobjemovým ascitom tiahnucim sa od subfrénia až do oblasti malej panvy. Po konzultácii chirurga bola indikovaná akútna revízia dutiny brušnej, pretože konzervatívne postupy neboli účinné. Predoperačne, s ohľadom na hemogram/koagulogram (leukocyty 2,84×109/l, hemoglobín 72 g/l, trombocyty 41×109/l, Quickov test (INR) 0,96, APTT-R 1,04, fibrinogén 3,5 g/l), bola podaná hemosubstitúcia (2 TU trombocytov a 2 TU erytrocytov) a hemostatiká (kyselina tranexámová). V priebehu operácie po odstránení veľkoobjemového ascitu (denznej tekutiny) bolo sledovateľné difúzne krvácanie z oblasti appendixu (realizovaná appendektómia, histologicky: neutrofilový zápal celej steny), omentum majus a minus (histologicky: potvrdená leukemická infiltrácia). Počas revízie však nastalo ďalšie masívne a neutíšiteľné krvácanie do dutiny brušnej (život ohrozujúce krvácanie s objemovými stratami presahujúcimi 5 l). Bol podaný protrombínový komplex 2× 1 500 IU, hemostatiká a intenzívna podporná hemosubstitúcia. Tento postup neviedol k zastaveniu difúzneho krvácania z oblasti omenta. Peroperačný základný koagulogram bol intaktný. K tvorbe krvného koagula a postupnému zastaveniu difúzneho krvácania viedla až aplikácia rekombinantného koagulačného faktora VIIa (NovoSeven®) v celkovej dávke 7 mg (90 μg/kg). Počas výkonu i po jeho ukončení prebiehala ďalej intenzívna hemosubstitúcia (celkovo 5 TU erytrocytov, 7 TU trombocytov) a širokospektrálna antiinfekčná liečba (piparacilín/tazobaktám, amikacín a metronidazol). Ďalšie epizódy krvácania už neboli pozorované (ani vo forme krvácania do brušnej drenáže či laboratórne vo forme poklesu hladiny hemoglobínu). Po 4 dňoch bolo možné u pacienta odstrániť brušnú drenáž, zdravotný stav bol stabilizovaný bez nutnosti ďalšej bezprostrednej hemosubstitúcie (leukocyty 2,88×109/l, hemoglobín 90 g/l, trombocyty 92×109/l, CRP 33,6 mg/l, prokalcitonín 0,5 ng/ml). Kontrolné CT brucha neukazovalo známky hemoperitonea či plynovej kolekcie. Rozšírené hemostazeologické vyšetrenie realizované s časovým odstupom v pooperačnom období ukazovalo fyziologické hodnoty.
18 dní po revíznej operácii a odstránení stehov zo zhojenej operačnej rany (per secundam) bola podaná indukčná chemoterapia (tab. 3). Do liečby bol pridaný dasatinib s cieľom zaistiť účinný spôsob prechodu liečiva cez hematoencefalickú bariéru [11]. I pri redukcii dávky na 70 mg/denne a forsírovanej diuréze boli pozorované významné, limitujúce pleurálne výpotky. Dasatinib bol pre nežiaduce účinky nahradený ponatinibom v dávke 45 mg/deň.
Tab. 3. Zloženie indukčnej, konsolidačnej liečby a prípravného režimu. 
TBI – celotelové ožiarenie V kontrolnom aspiráte kostnej drene bola mesiac po indukcii dosiahnutá kompletná hematologická remisia choroby (obr. 1c), neboli prítomné ani prídavné cytogenetické zmeny, hladina BCR:: ABL1 transkriptu dosiahla 2 % IS (medzinárodná stupnica) – 2. chronická fáza CML. U pacienta bola plánovaná aloHSCT od príbuzného darcu, predtransplantačne bol podaný 1. cyklus konsolidačnej chemoterapie HIDAC (tab. 3).
Pacient bol prijatý s krátkym časovým odstupom od 1. konsolidácie v klinicky uspokojivom stave (6 mesiacov od vstupnej diagnózy) k realizácii príbuzenskej aloHSCT. Žiaľ, v čase prijatia bola u pacienta bicytopénia s vyplavením blastov do periférnej krvi (leukocyty 8,5×109/l, hemoglobín 80 g/l, MCV 83 fl, trombocyty 42×109/l, blasty 59 %) s potvrdením významnej infiltrácie kostnej drene (77 % blastov – monoblastov – s pôvodným imunofenotypom, AML M5, 2. monoblastový zvrat), znova bola prítomná splenomegália (22 × 7 cm) bez prítomnosti voľnej tekutiny v dutine brušnej. Pri zohľadnení základného ochorenia ako ultimum refugium bol zvolený prípravný režim FLAMSA-RIC s dobrou toleranciou (tab. 3). Bol podaný štep krvotvorných kmeňových buniek s celkovou výťažnosťou 7,63×106 CD34+ buniek/kg hmotnosti príjemcu. Profylaxia GvHD po transplantácii bola zabezpečená kombináciou cyklosporín-A (CS-A) a mykofenolát mofetil (MMF). Sekundárny imunodeficit bol korigovaný pravidelným podaním IVIG. Odo dňa+13 bola zaznamená regenerácia v hemograme pacienta (neutrofily > 0,5×109/l deň +15, trombocyty > 20×109/l deň +20). Pacient bol deň +28 prepustený do ambulantnej starostlivosti (leukocyty 1×109/l, hemoglobín 82 g/l, trombocyty 30×109/l, neutrofily 0,5×109/l), bez klinických prejavov choroby štepu proti hostiteľovi (GvHD) v dobrom klinickom stave s dostatočnou hladinou CS-A, konverziou krvnej skupiny, štandardnou protiinfekčnou profylaxiou. Po reštitúcii krvotvorby bola pridaná potransplantačná profylaxia pomocou TKI (ponatinib, redukcia dávky pri trombocytopénii s postupným navýšením na 30 mg/deň). V kontrolnom aspiráte kostnej drene bola pozorovaná kompletná hematologická remisia choroby, chimérizmus ukazoval 99,1 % donor špecifických markerov a zníženie hladiny BCR:: ABL1 transkriptu na úroveň 0,04 % (IS). V deň +35 bol zaznamenaný jednoznačný trend postupnej normalizácie krvného obrazu (leukocyty 2,5×109/l, hemoglobín 98 g/l, trombocyty 122×109/l, neutrofily 1,5×109/l) V súlade s liečebným protokolom bolo podanie MMF ukončené do dňa +50 s plánovanou detrakciou CSA medzi dňom +60 až +90 a pripravovaným podaním infúzie darcovských lymfocytov (DLI). V deň +50 bol pozorovaný nárast hladiny BCR:: ABL1 transkriptu na úroveň 0,8 % (IS) a preto bola skrátená i detrakcia CSA s ukončením v deň +65 bez obrazu rozvoja GvHD. 75 dní po transplantácii bol pozorovaný relaps ochorenia (leukocyty 8,24×109/l, hemoglobín 105 g/l, trombocyty 73×109/l, prietoková cytometria CD45+ gate: 7 % monoblastov, 6 % patologických monocytov, 53 % neutrofilov – pôvodný imunofenotyp leukemických buniek, bol určený komplexný karyotyp pacienta s ďalšou chromozómovou zmenou, 3. monoblastový zvrat, obr. 1d, obr. 3). Ochorenie ihneď vykazovalo agresívny priebeh a napriek cytoredukčnej liečbe pacient zomiera v deň +80 s obrazom hyperleukocytózy a ťažkej trombocytopénie. Schému priebehu ochorenia a sledovanie genetických markerov ukazuje obr. 4.
Obr. 3. Konvenčné cytogenetické vyšetrenie kostnej drene pri relapse ochorenia po transplantácii. Komplexný karyotyp pacienta, navyše bola identifi kovaná prítomnosť extra kópie Y chromozómu, ktorý sa nachádzal výlučne v klone s aditívnym Ph chromozómom. 
ISCN: 47,XY,+8,t(9;22)(q34;q11)[3] / 50,idem,+Y,+6,+der(22)t(9;22)(q34;q11)[10] / 46,XY [7].
Poznámka: pomocou fl uorescenčnej in situ hybridizácie boli konfi rmované všetky sekundárne chromozómové zmeny, ktoré potvrdili ďalšiu evolúciu ochorenia.Obr. 4. Schéma priebehu liečby pacienta a vývoj hladiny BCR::ABL transkriptu v periférnej krvi. 
aloHSCT – alogénna transplantácia krvotvorných kmeňových buniek; CHR – kompletná hematologická odpoveď; CHT – chemoterapia (indukčná/konsolidačná); IS – medzinárodná stupnica; NILO – nilotinib; PON – ponatinib, *krátkodobé podanie dasatinibu po indukcii DISKUSIA
Predložená kazuistika ukazuje obraz veľmi nepriaznivej situácie fulminantnej progresie CML s epizódami krátkodobých remisií (presnejšie redukcií leukemickej populácie), význam ponatinibu v pred - a potransplantačnom období a vlastné postavenie aloHSCT. Zároveň nastoľuje niekoľko dôležitých otázok týkajúcich sa priebehu pokročilých fáz CML: prítomnosť neobvyklého intraabdominálneho krvácania, význam ACA pri diagnóze ochorenia a súčasné prístupy k blastovému zvratu (kríze) pri liečbe TKI.
Liečba CML v pokročilých fázach ochorenia má aj v súčasnej ére TKI veľmi neuspokojivé výsledky. Cytogenetická klonová evolúcia a vývoj rezistentných mutácií v leukemickej kmeňovej bunke predstavujú kľúčové udalosti, ktoré sa podieľajú na progresii ochorenia. Existujú v podstate 3 základné scenáre: 1. pacienti s akceleráciou choroby vystavení vyššiemu riziku zlyhania TKI v porovnaní s pacientmi v CP – ak je však dosiahnutá optimálna odpoveď v 1. línii, liečebný výsledok môže byť priaznivý; 2. pacienti s BP môžu byť liečení TKI alebo TKI spolu s konvenčnými režimami chemoterapie a rozhodnutia o aloHSCT by sa malo opierať o kinetiku odpovede a individuálne transplantačné riziko; 3. pacienti s CP/AP progredujúci pri liečbe TKI predstavujú z pohľadu voľby liečebnej stratégie veľmi zložitú situáciu [8,12]. Ako už bolo uvedené, pri AP môžeme uvažovať o výbere z viacerých TKI, v prípade progresie pri liečbe sa zo zrejmých dôvodov odporúča voľba iného TKI ako pred progresiou so zohľadnením mutačného stavu; po zlyhaní TKI 2. generácie v 1. línii je výhodné uprednostniť ponatinib. Je snaha o dosiahnutie chronickej fázy/kontroly ochorenia. Najnovšie poznatky o BP ukazujú, že kombinácia intenzívnej chemoterapie a TKI (príp. hypometylačných molekúl a TKI) zlepšuje podiel liečebných odpovedí, celkové prežitie (overall survival – OS) a prežitie bez definovanej príhody (event-free survival – EFS) – najmä pri použití TKI 2. a 3. generácie [13]. Pri hodnotení rozsiahlych súborov pacientov s BP sa tiež ukazuje, že najlepšie výsledky sú dosiahnuté pri kombinácii TKI a intenzívnej chemoterapie nasledovanej aloHSCT, medián OS tejto skupiny je však iba 12 mesiacov. Signifikantne vyšší podiel dlhodobo prežívajúcich je ovplyvnený dosiahnutím (kompletnej hematologickej alebo cytogenetickej či veľkej molekulovej) odpovede na liečbu 1. línie, naopak aktívne ochorenie je najsilnejším negatívnym prediktívnym faktorom [12,14]. Asi 70–80 % prípadov BP sa vyskytuje v myeloblastovej, 20–30 % v lymfoblastovej a zvyšok v zmiešanej forme blastovej krízy. Pacienti s lymfoblastovou krízou majú najlepšiu prognózu [15].
Výskyt krvácania ako vstupného klinického prejavu pri CML zvyčajne naznačuje, že ochorenie je akcelerované; ak krvácanie vzniká v priebehu liečby ukazuje skôr na progresiu ochorenia, hoci sú popisované i závažné hemoragie v CP (napr. pri spontánnej ruptúre zväčšenej, infiltrovanej sleziny s hemoperitoneom) [16]. Krvácanie spojené s CML nie je časté (< 10 % prípadov), obyčajne je nezávažné (kožné prejavy) a predpokladá sa, že je spôsobené dvoma zásahmi do hemostázy, ktoré sa môžu kombinovať: kvantitatívnou/kvalitatívnou poruchou funkcie trombocytov, dysfunkciou koagulácie najmä pri hyperleukocytóze spojenej s leukostázou a vaskulárnou mikrotrombózou [17]. Rozvoj krvácania môže súvisieť i s podaním TKI [18]. Krvácanie sa môže objaviť (odhliadnuc od ruptúry sleziny) prakticky kdekoľvek – v literatúre sú uvedené viaceré anatomicky presne lokalizované miesta i difúzne krvácanie: napr. intramuskulárny či mediastinálny hematóm, intracerebrálne krvácanie, subdurálny hematóm, krvácanie z oblasti čriev či do hlbokých mäkkých tkanív. Pri vzniku krvácania je dôležité myslieť okrem vlastnej orgánovej infiltrácie/metastáz leukemických buniek i na raritné príčiny: napr. získaná Glanzmannova trombasténia [19]. Intraabdominálne krvácanie u pacienta bolo zrejme výsledkom kombinácie viacerých faktorov: monoblastového zvratu ochorenia i s infiltráciou dutiny brušnej, trombocytopénie a trombocytopatie.
Významným ukazovateľom progresie či zlyhania liečby je prítomnosť ACA v Ph+ bunkách. Tieto zmeny vo všeobecnosti odzrkadľujú stupeň genómovej nestability a majú pochopiteľne negatívny prognostický význam. Posledné ELN odporúčanie považuje prítomnosť ACA (napr. +8, +Ph, –7/7q, komplexný karyotyp) za vysoko rizikovú zmenu a objavenie sa počas liečby TKI za jej zlyhanie [10,20,21]. Hoci sa ACA v Ph+ klone považujú za znak evolúcie ochorenia a používajú sa ako jedno z kritérií pre akceleráciu, rozdielny prognostický vplyv jednotlivých ACA nie je známy a chýba klasifikačný systém, ktorý by túto skutočnosť v ére TKI reflektoval [22].
Mutácie v ABL1 kinázovej doméne (KD) sú vo väčšine prípadov príčinou rezistencie k liečbe TKI. Vyskytujú sa asi u 1/3 pacientov v CP a 2/3 v pokročilejších fázach choroby [10]. Ich analýza sa odporúča (okrem ďalších indikácii) vždy pri progresii CML do AP/BP [23]. Mutácie sú prítomné v celom rozsahu ABL1 KD, majú rôznu in vivo a in vitro senzitivitu k TKI. Použitie sekvenovania novej generácie patrí medzi preferované a dostatočne citlivé nástroje pre odhaľovanie a monitorovanie mutácií [24]. U pacienta v uvedenej kazuistike bola pri progresii CML odhalená heterozygotná zmena v oblasti ABL1 KD – delécia exónu 7 (c.1086-1270 del1185). Ukazuje sa však, že táto mutácia je relatívne často pozorovaná u pacientov s CML pri použití citlivých techník. Zdá sa, že je výsledkom alternatívneho zostrihového mechanizmu a je nezávislá od výskytu rezistencie k TKI [25].
Ponatinib je TKI 3. generácie a je najúčinnejším z dostupných inhibítorov v reálnej klinickej praxi. Bol schválený pre pacientov s mutáciou BCR:: ABL1 T315I a pre pacientov rezistentných na dva alebo viac TKI. U pacientov s rezistenciou na TKI 2. generácie sa uprednostňuje podanie ponatinibu pred inými TKI 2. generácie [26,27]. Významnou limitáciou pri liečbe ponatinibom sú cievne nežiaduce účinky, ktoré sa vyskytujú najmä u osôb s kardiovaskulárnymi rizikovými faktormi. V súčasnosti sú už dostupné údaje z klinických štúdií optimalizujúcich dávkovanie ponatinibu (OPTIC, OPUS) [28]. Doposiaľ nie je jednoznačne určená úloha ponatinibu ako udržiavacieho lieku po aloHSCT. Zdá sa, že je jednoznačne racionálne podanie pri molekulovom relapse choroby. Publikované práce vo väčšine prípadov potvrdzujú i fakt, že profylaktická liečba prináša pacientom jednoznačný osoh, hoci nie je stanovená optimálna dávka ani presný čas začiatku po aloHSCT. Dávkovací rozptyl je 15–45 mg/deň, najskorší termín iniciácie je deň +30. Na druhej strane je potrebné zdôrazniť, že niektorí pacienti s CML (bez ohľadu na prítomnosť mutácie T315I), sú na podanie ponatinibu rezistentní i z iných príčin a preto by potransplantačná profylaxia mala byť zhodnotená vo väčšej skupine pacientov [14,29,30]. V prípade relapsu CML po aloHSCT sú možnosti veľmi obmedzené – môžeme použiť TKI so zohľadnením mutačného profilu ABL1 kinázy, predtransplantačného typu liečiva a pridružených chorôb pacienta. Je výhodná kombinácia s infúziou darcovských lymfocytov.
Naša kazuistika prezentuje menej obvyklú komplikáciu pacienta s pokročilou CML, sekvenciu liečebných postupov (TKI, aloHSCT, potransplantačná profylaxia) a žiaľ, infaustný priebeh, ktorý je dôsledkom výraznej genómovej nestability choroby.
POĎAKOVANIE
Poďakovanie za poskytnutie morfologickej dokumentácie patrí O. Jánošovej a S. Kostkovej z cytochemického laboratória, nálezy z prietokovej cytometrie analyzovala a doplnila Mgr. D. Harrachová.
PODIEL AUTOROV NA PRÍPRAVE RUKOPISU
PR – príprava rukopisu
VM, LS, EB, IM, ABá – liečba pacienta, podiel na príprave rukopisu, revízia rukopisu
AŽ, ĽM, LT, ABl, MK – realizácia cytogenetických a molekulovo-genetických vyšetrení, revízia rukopisu
ČESTNÉ PREHLÁSENIE
Autori práce deklarujú, že v súvislosti s témou, vznikom a publikáciou tohto článku nemajú konflikt záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou.
Do redakce doručeno dne: 25. 6. 2022.
Přijato po recenzi dne: 16. 9. 2022.
doc. MUDr. Peter Rohoň, Ph.D.
Klinika hematológie a transfúziológie
LF UK, SZU a UN Bratislava
Nemocnica sv. Cyrila a Metoda
Antolská 11
SK851 07 Bratislava
e-mail: peter.rohon@upol.cz
Transfuze Hematol Dnes 2023; 29(1): 40 – 49
Zdroje
1. Jabbour E, Kantarjian H. Chronic myeloid leukemia: 2020 update on diagnosis, therapy and monitoring. Am J Hematol. 2020; 95 (6): 691–709.
2. Chen Z, Cortes JE, Jorgensen JL, et al. Differential impact of additional chromosomal abnormalities in myeloid vs lymphoid blast phase of chronic myelogenous leukemia in the era of tyrosine kinase inhibitor therapy. Leukemia. 2016; 41 : 327–328.
3. Wang H, Cao F, Li J, et al. Intracerebral hemorrhage as the initial presentation of chronic myeloid leukemia: a case report and review of the literature. Front Neurol. 2020; 11 : 571576.
4. Padmanabhan V, Shahin MM, Abdallah K. Chronic myeloid leukaemia manifesting as a gynecological emergency in a young woman. Int J Reprod Contracept Obstet Gynecol. 2017; 6 (8): 3655–3656.
5. Jafferbhoy S, Chantry A, Atkey N, et al. Spontaneous splenic rupture: an unusual presentation of CML. BMJ Case Rep. 2011; bcr0220113 879.
6. Sasaki K, Strom SS, O’Brien S, et al. Relative survival in patients with chronic-phase chronic myeloid leukaemia in the tyrosine-kinase inhibitor era: analysis of patient data from six prospective clinical trials. Lancet Haematol. 2015; 2: e186-e193.
7. Čičátková P, Žáčková D. Vysazování inhibitorů tyrozinkináz u pacientů s chronickou myeloidní leukemií ve studiích a klinické praxi. Transfuze Hematol Dnes. 2020; 26 (4): 279–291.
8. Bonifacio M, Stagno F, Scaffidi L, et al. Management of chronic myeloid leukemia in advanced phase. Front Oncol. 2019; 25 (9): 1132.
9. Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood. 2013; 122 : 872–884.
10. Hochhaus A, Baccarani M, Silver RT, et al. Chronic myelogenous leukemia. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020; 34 : 966–984.
11. Porkka K, Koskenvesa P, Lundán T, et al. Dasatinib crosses the blood-brain barrier and is an efficient therapy for central nervous system Philadelphia chromosome-positive leukemia. Blood. 2008; 112 (4): 1005-1012.
12. Hehlmann R, Saussele S, Voskanyan A, et al. Management of CML-blast crisis. Best Pract Res Clin Haematol. 2016; 29 : 295–307.
13. Saxena K, Jabbour E, Issa G, et al. Impact of frontline treatment approach on outcomes of myeloid blast phase CML. J Hematol Oncol. 2021; 14 : 94.
14. Žáčková D. Ponatinib v léčbě pacienta s lymfoblastickým zvratem chronické myeloidní leukemie – význam před - a potransplantačního podání inhibitorů tyrosinkinázy. In Rohoň P, et al. Hematologie a hematoonkologie v kazuistikách. Praha, Maxdorf 2020, 118–122.
15. Chereda B, Melo JV. Natural course and biology of CML. Ann Hematol. 2015; 94 (S2): 107–121.
16. Vemulakonda SHP, Subramaniyan S, Jain A, et al. A rare case of spontaneous splenic rupture as the index presentation of chronic myeloid leukemia. Cureus. 2021; 13 (11): e19647.
17. Porcu P, Cripe LD, Ng EW, et al. Hyperleukocytic leukemias and leukostasis: a review of pathophysiology, clinical presentation and management. Leuk Lymph. 2000; 39 : 1–18.
18. Quintas-Cardama A, Kantarjian H, Ravandi F, et al. Bleeding diathesis in patients with chronic myelogenous leukemia receiving dasatinib therapy. Cancer. 2009; 115 : 2482–2490.
19. Kartthik S, Mandal PK, Abdullah SM. An unusual cause of bleeding in a patient with chronic myeloid leukemia chronic phase. Case Rep Hematol. 2019; Article ID: 5674 193.
20. Fabarius A, Leitner A, Hochhaus A, et al. Impact of additional cytogenetic aberrations at diagnosis on prognosis of CML: Long-term observation of 1151 patients from the randomized CML Study IV. Blood. 2011; 118 (26): 6760–6768.
21. Vinhas R, Lourenco A, Santos S, et al. A double Philadelphia chromosome-positive chronic myeloid leukemia patient, co-expressing P210BCR-ABL1 and P195BCR-ABL1 isoforms. Haematologica. 2018; 103 (11): e549–e552.
22. Wang W, Cortes JE, Tang G, et al. Risk stratification of chromosomal abnormalities in chronic myelogenous leukemia in the era of tyrosine kinase inhibitor therapy. Blood. 2016; 127 (22): 2742–2750.
23. Soverini S, Hochhaus A, Nicolini FE, et al. BCR-ABL kinase domain mutation analysis in chronic myeloid leukemia patients treated with tyrosine kinase inhibitors: recommendations from an expert panel on behalf of European LeukemiaNet. Blood. 2011; 118 (5): 1208–1215.
24. Soverini S, Abruzzese E, Bocchia M, et al. Next-generation sequencing for BCR-ABL1 kinase domain mutation testing in patients with chronic myeloid leukemia: a position paper. J Hematol Oncol. 2019; 12 : 131.
25. Gaillard J-B, Arnould C, Bravo S, et al. Exon 7 deletion in the bcr-abl gene is frequent in chronic myeloid leukemia patients and is not correlated with resistance against imatinib. Mol Cancer Ther. 2010; 9 (11): 3083–3089.
26. Cortes JE, Kim DW, Pinilla-Ibarz J, et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial. Blood. 2018; 132 : 393–404.
27. Demitrovičová Ľ, Chudej J, Mikušková E, et al. Odporúčania pre manažment pacientov s chronickou myelocytovou leukémiou v Slovenskej republike Onkol Supl. 2021; 16: S3–S22.
28. Cortes JE, Apperley J, Lomaia E, et al. Ponatinib dose-ranging study in chronic-phase chronic myeloid leukemia: a randomized, open-label phase 2 clinical trial. Blood. 2021; 138 (21): 2042–2050.
29. Kishida Y, Najima Y, Otsuka Y, et al. Post-transplant maintenance treatment with ponatinib for Philadelphia chromosome positive leukemia. Blood. 2019; 134: S5694.
30. Kucukyurt S, Kelezoglu A, Elverdi T, et al. Ponatinib both as an effective bridge to allogeneic hematopoietic stem cell transplantation and as posttransplant maintenance therapy in a chronic myeloid leukemia patient with myeloid blast crisis. Hematol Transfusion Cell Ther. 2021; 16: S2531–1379 (21) 00082–1.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Editorial
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2023 Číslo 1- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Editorial
- Povrchové markery leukemických kmenových buněk u chronické myeloidní leukemie
- Blastický zvrat chronické myeloidní leukemie
- Cévní nežádoucí účinky u pacientů s chronickou myeloidní leukemií při terapii inhibitory tyrozinkináz v každodenní klinické praxi – analýza z databáze INFINITY
- Nezvyklý a nepriaznivý priebeh chronickej myelocytovej leukémie – kazuistika a prehľad literatúry
- Doporučený postup stratifikace rizika trombózy a cílené tromboprofylaxe u žen podstupujících asistovanou reprodukci
- Prevence, diagnostika a léčba trombózy spojené se zhoubným nádorem
- Doporučení České hematologické společnosti pro diagnostiku a léčbu imunitní trombocytopenie dospělých
- Sympozium a workshop – aktuální výzvy a uplatnění nových technologií v léčbě chronické myeloidní leukemie
- Fixní délka léčby CLL – realita, nebo fikce?
- Jubileum primářky Lenky Walterové
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Doporučení České hematologické společnosti pro diagnostiku a léčbu imunitní trombocytopenie dospělých
- Doporučený postup stratifikace rizika trombózy a cílené tromboprofylaxe u žen podstupujících asistovanou reprodukci
- Blastický zvrat chronické myeloidní leukemie
- Nezvyklý a nepriaznivý priebeh chronickej myelocytovej leukémie – kazuistika a prehľad literatúry
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



