-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
MYKOTICKÉ INFEKCE
Mycotic infections
The 70’s of last century meant a significant milestone in the view of infectuous diseases. Wide range of new preparations and their combinations asserted itself in the treatment and prophylaxis of the infections. Other infectuous agents were passed by, anaerobic infections were rare, protozoal infections exceptional, the mycotic ones out of interest. Significant development of invasive diagnostic and therapeutic methods, intensified chemotherapy, anticancer as well as an extensive use of antimicrobial wide-spectrum agents and their combinations, transplantation programs and realimentation methods with long-term central venous catheters with consequent disorder of immune mechanism, lead to a serious growth of opportune infections, especially the mycotic ones. Acquired Immunodeficiency Syndrome (AIDS) boosts the adjusted trend. Rising occurence affects all significant anatomic localizations of the infection (lungs, CNS, GIT, urinary system).
The 90’s and present time had not brought anything new to armamentary of antimicrobial preparations for treatment of urinary infections, the preparations or whole drug groups diminish. Almost 2% of uroinfections which have common denominator - micromycetes - are of marginal concern, or, rather non-concern.KEY WORDS:
mycotic infections, opportune infections, antimycotics
Autoři: MUDr. Matoušková Michaela
Působiště autorů: Urocentrum Praha
Vyšlo v časopise: Urol List 2005; 3(2): 39-43
Souhrn
70. léta minulého století znamenala významný mezník v pohledu na infekční onemocnění. V léčbě a profylaxi bakteriálních infekcí se uplatnila široká paleta nových přípravků a jejich kombinací. Ostatní původci infekcí byli opomíjeni, anaerobní infekce byly vzácné, protozoární výjimečné, mykotické stranou zájmu. Významný rozvoj invazivních diagnostických a terapeutických postupů, intenzifikované chemoterapie jak protinádorové, tak i extenzivní, používání antimikrobiálních širokospektrých přípravků a jejich kombinací, transplantačních programů a realimentačních postupů s dlouhodobě zavedenými centrálními žilními katétry s následnou poruchou imunitních mechanizmů vedl k závažnému nárůstu oportunních infekcí, především mykotických. Syndrom získané imunodeficience (AIDS) nastavený trend zesiluje. Vzestupný výskyt postihuje všechny významné anatomické lokalizace infekce (plíce, CNS, GIT, močové ústrojí).
90. léta a současnost nepřinesla do armamentaria antimikrobiálních přípravků v léčbě močových infekcí nic nového, spíše na našem trhu přípravky či celé skupiny léků ubývají. Na okraji zájmu, či spíše v nezájmu, pak stojí necelá 2 % uroinfekcí, které mají společního jmenovatele - mikromycety.KLÍČOVÁ SLOVA:
mykotické infekce, oportunní infekce, antimykotikaEPIDEMIOLOGIE OPORTUNNÍCH MYKOTICKÝCH INFEKCÍ
V literatuře jsou houby popisovány v 8–12 % jako původci nozokomiálních infekcí. Z nich nejčastěji (cca 80–90 %) bývají detekovány kmeny kandid. Mortalita fungemie je vysoká. V závislosti na predispozičním stavu se pohybuje mezi 5–86 %.
Oportunní infekce řadíme do 3 skupin podle epidemiologických kritérií:
- méně časté patogeny, které u zdravého jedince vyvolají latentní či lokální infekci se spontánním vyhojením (torulopsis, zygomycety, trichosporon, fusarium, geotrichum)
- saprofytické houby, které u zdravého jedince mohou způsobit nepříliš závažná onemocnění (kandidy, aspergily)
- agens schopná vyvolat závažná onemocnění u zdravého jedince (kryptokoky, histoplazma, kokcidioidomykóza).
Se stupněm imunoalterace narůstá riziko vzniku a rozvoje závažného manifestního onemocnění.
Jiné rozdělení vychází z možného způsobu vzniku systémového onemocnění. Rozlišujeme endemické a oportunní mykózy. Patogeny endemických mykóz infikují část zdravých jedinců v endemických oblastech, k manifestaci onemocnění dojde u pouze malé části obyvatelstva (kokcidioidomykóza, histoplazmóza, blastomykóza). Patogeny oportunních mykóz jsou ubikvitární (kandidy, kryptokoky, aspergily, zygomycety). Často žijí saprofyticky jako komenzální flóra a kolonizují („infikují“) většinu lidí. Onemocní však jen imunokompromitovaní jedinci. Sem patří především nozokomiální infekce s negativním ovlivněním morbidity, event. mortality, prolongováním hospitalizace spojené s významným navýšením nákladů na léčbu.
Nozokomiální mykotické infekce byly definovány Walshem v roce 1989 jako jakákoliv forma (povrchová, lokálně invazivní nebo diseminovaná) mykotické infekce získaná v nemocničním prostředí (exogenní zdroj) a/nebo manifestující se během hospitalizace (endogenní zdroj) (tab. 1).
Tab. 1. Klasifikace nozokomiálních mykotických infekcí. 
Při lokalizaci a pokusu o eliminaci možného zdroje infekce je důležité pečlivé epidemiologické šetření.
Nejčastějším agens jsou kandidové infekce (tab. 2). Naprosto převažují endogenní infekce.
Tab. 2. Incidence oportunních systémových mykóz. 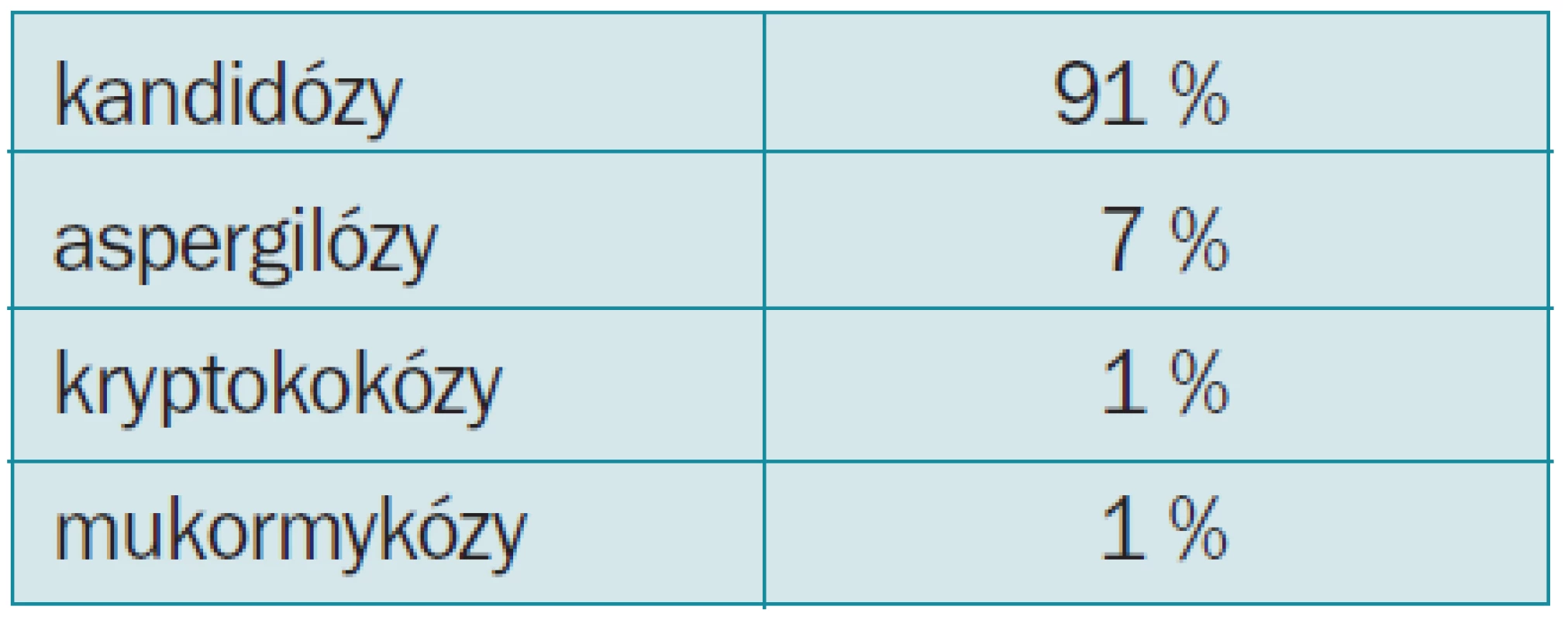
Vznik a rozvoj mykotické oportunní infekce závisí na vlastnostech infekčního agens a obranyschopnosti hostitele (tab. 3). Virulenci infekce charakterizuje patogenicita, minimální inokulační dávka a infekciozita. Předpokladem rozvoje a vzniku infekce je zdroj, rezervoár, cesta nákazy a vnímavý jedinec. Nejčastěji dochází k přenosu vzduchem, jinou možnost představuje kontakt se zdro-jem, často se zdravotnickým perso-nálem, nebo nepřímo implantovanými protézami, infuzemi tuků či tekutin, potravou apod.
Tab. 3. Faktory vzniku a rozvoje oportunní infekce. 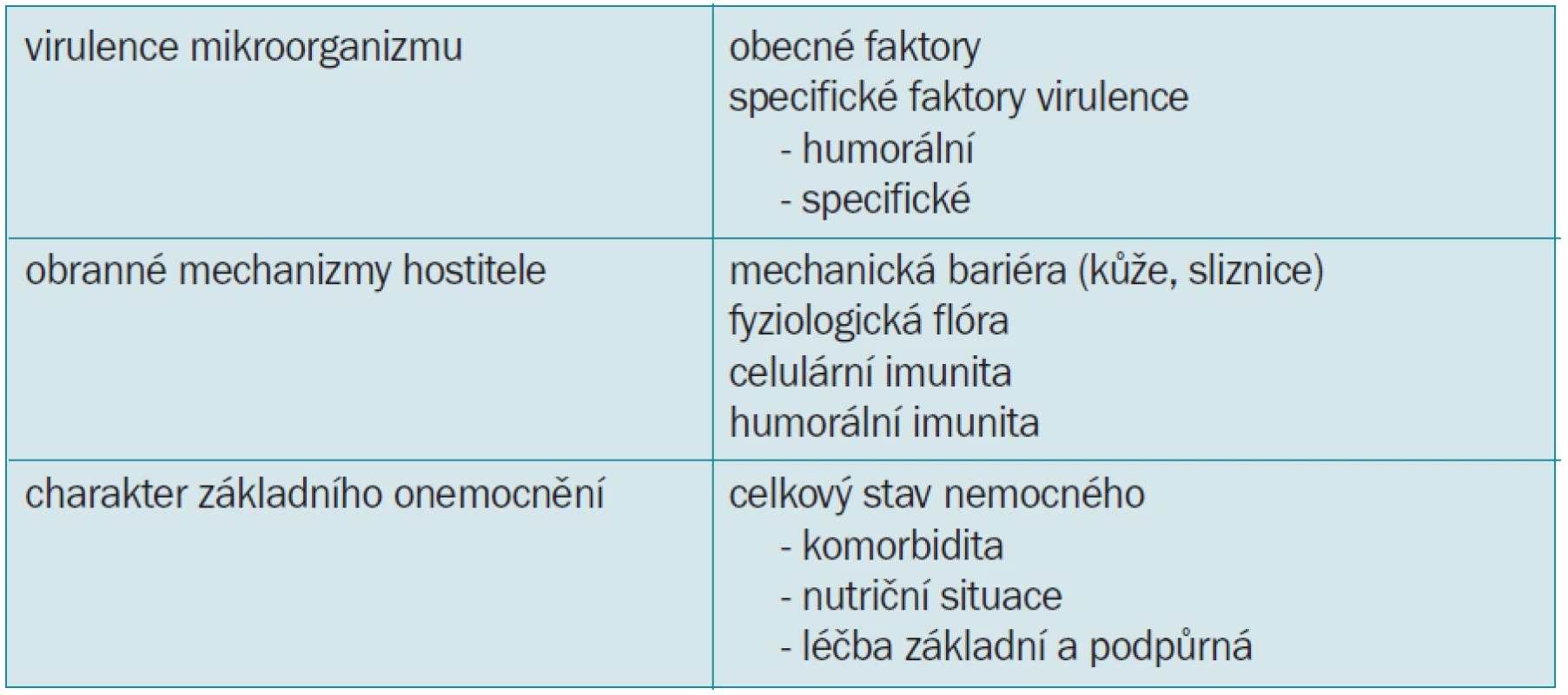
V obraně makroorganizmu proti infekci se uplatňuje široký komplex mechanizmů, neimunitních i imunitních, nespecifických i specifických. Infaustní průběh mykotické infekce u imunokompetentních je vzácností. Přítomnost a složení fyziologické mikroflóry sliznic a stav či porušení anatomických bariér ovlivní neimunitní obranné faktory. K imunitním reakcím nespecifického charakteru, které se uplatňují v likvidaci plísňové infekce, náleží především faktory druhé obranné linie, a to fagocytární aktivita neutrofilů, makrofágů a komplementový systém. Klíčovými v obraně proti oportunním mykotickým infekcím jsou granulocyty. Cytotoxická léčba a radiace navodí dlouhodobou granulocytopenii. Kortikoterapie potlačuje fagocytární aktivitu makrofágů, oslabuje jejich schopnost ničit hyfy a omezuje migrační aktivitu neutrofilů. U diabetiků bývá omezena kandidacidní schopnost neutrofilů. Gentamicin a vysoké dávky amfotericinu B (AmB) inhibují migraci neutrofilů. V obraně proti povrchovým formám mykóz má významnou roli T-lymfocytární systém, především cytotoxické buňky (Tc/s) a NK-buňky. U nemocných s AIDS a maligními lymfoproliferativními onemocněními s poruchou imunity zprostředkované T-lymfocyty bývá nejčastějším projevem mukokutánní forma kandidózy. Obdobná situace bývá i u dalších onemocnění léčených imunosupresivy a cytostatiky, popř. u sarkoidózy a onemocnění endokrinního systému. Kvalitativní či kvantitativní malnutrice vede k oslabení slizniční a kožní bariery, projevům imunodeficience v oblasti humorální i buněčné imunity s infekčními komplikacemi, včetně mykotických. Problémy s výživou bývají nejen v souvislosti s onkologickou, ale i chirurgickou léčbou nemocných. Náležitá podpůrná léčba je prevencí rozvoje oportunních infekcí.
DIAGNOSTIKA
Diagnostika mykotických infekcí se opírá o klinické nálezy a výsledky pomocných vyšetření. Klinicky pro možnou systémovou mykózu svědčí febrilní (event. septický) stav, který přetrvává přes adekvátní intenzivní léčbu antimikrobiálními přípravky. K posouzení je nezbytná znalost základního onemocnění a možných rizikových faktorů, které vznik a rozvoj mykotické infekce podporují (granulocytopenie, léčba imunosupresivy, širokospektrými antibiotiky, zavedené kanyly apod). Klinický stav spolu s obtížemi nemocného (dysfagie, myozitický syndrom, poruchy zraku) a s fyzikálním vyšetřením (slizniční soor, papulózní kožní projevy, retinální léze) mohou podezření podpořit. Avšak i u nemocného s vyznačenými příznaky nelze pominout možnost virové, protozoární či specifické infekce.
Instrumentální vyšetření umožní přímým způsobem potvrdit nález mykózy, častěji však slouží k odběru tkáně k mikrobiologickému či mykologickému vyšetření. Histologické vyšetření umožní posoudit hloubku tkáňové invaze.
Zobrazovací metody (RTG-postupy, ultrasonografie, NMR) jsou nespecifické. Potvrdí pouze strukturální změny vnitřních orgánů.
Pro rychlou orientaci využíváme vizualizaci mikroskopickým vyšetřením biologického materiálu, např. stěrů sliznic, výplachů, moči a tkání. Biopsie tkáně s histologickým vyšetřením umožňuje odlišit invazivní progresi slizničních forem (jícen, bronchy, močový měchýř) a tkáňové postižení (ledviny, játra).
Kvantitativní a kvalitativní kultivační průkaz patogena se stanovením citlivosti vůči antimykotikům, pozitivní hemokultura, změny titru a třídy protilátek podporují možnou diagnózu mykotické infekce. Rutinní laboratorní vyšetření mají význam pro určení rizika rozvoje mykotické infekce (glykemie, stanovení počtu granulocytů), možného orgánového postižení (ALT, AST, kreatinin) a pro volbu a dávkování antimykotické léčby (kreatinin, kalemie, AST, ALT). Specifické laboratorní testy využívají stanovení titru protilátek nebo průkazu cirkulujících mykotických antigenů. Problémem je, že imunoalterace významně ovlivňuje imunitní odpověï a může vést k nesprávné interpretaci nálezů. Při stanovení antigenů využíváme monoklonální protilátky, které jsou druhově specifické (mannan pro kandidy, galaktomannan pro aspergily, glukuronoxylomannan pro kryptokoky). Stanovení antigenů má rovněž úskalí, především v přechodném trvání antigenemie a jejím ovlivnění rozsahem infekce, neutropenií či profylaktickým podáváním antimykotik.
Tab. 4. Rozdělení antimykotik. 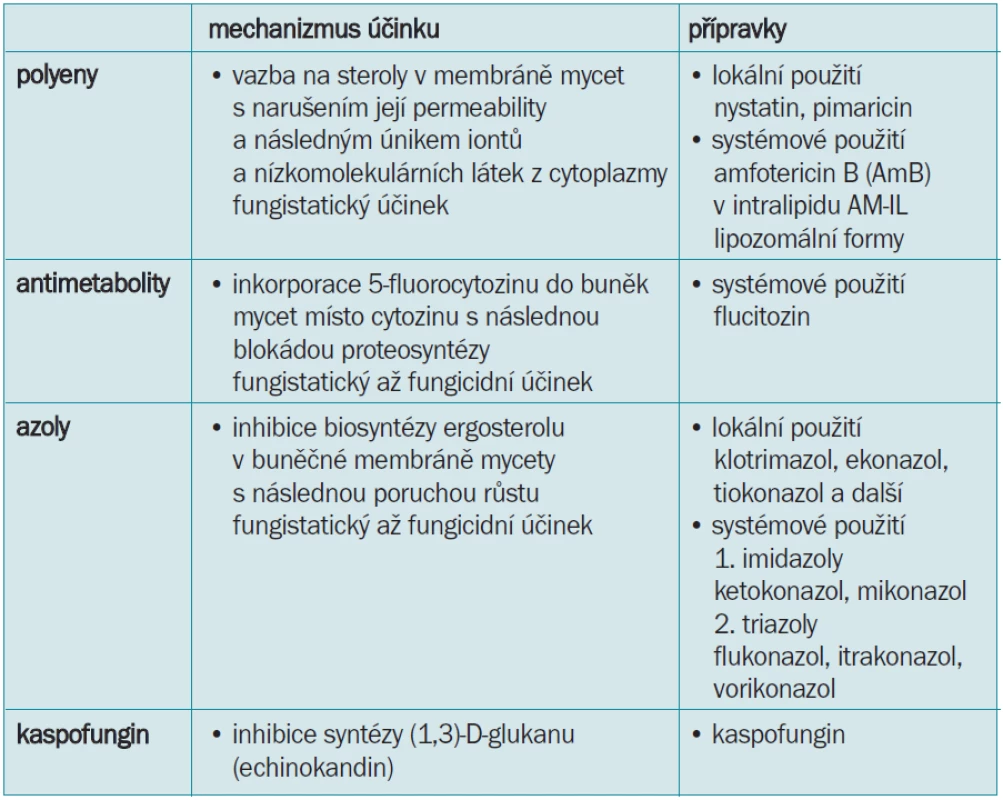
Pro maximální diagnostickou jistotu je nezbytné vyšetřovací metody kombinovat.
Pro průkaz mykotické infekce uropoetického traktu bychom měli splnit následující kritéria:
- histologický průkaz patogena
- pozitivní kultivace ve dvou následných vzorcích moči (bez zavedeného permanentního katétru) a v hemokultuře
- pozitivní sérologické testy + kultivační průkaz v moči nebo hemokultuře.
KLINICKÝ OBRAZ UROGENITÁLNÍ MYKOTICKÉ INFEKCE
V rozvinutých zemích našeho geografického pásma ohrožují nemocné s poruchou imunity oportunní mykotické infekce, z nich v absolutní převaze pak kandidóza. V závislosti na klinické manifestaci a rozsahu infekce rozdělujeme kandidózu do skupin:
- mukokutánní formy
- systémové postižení
- a) orgánové postižení
- b) diseminovaná kandidóza
- kandidemie.
Přechod mezi jednotlivými skupinami je diskrétní. Charakterizován je penetrací do hlubších vrstev tkáně.
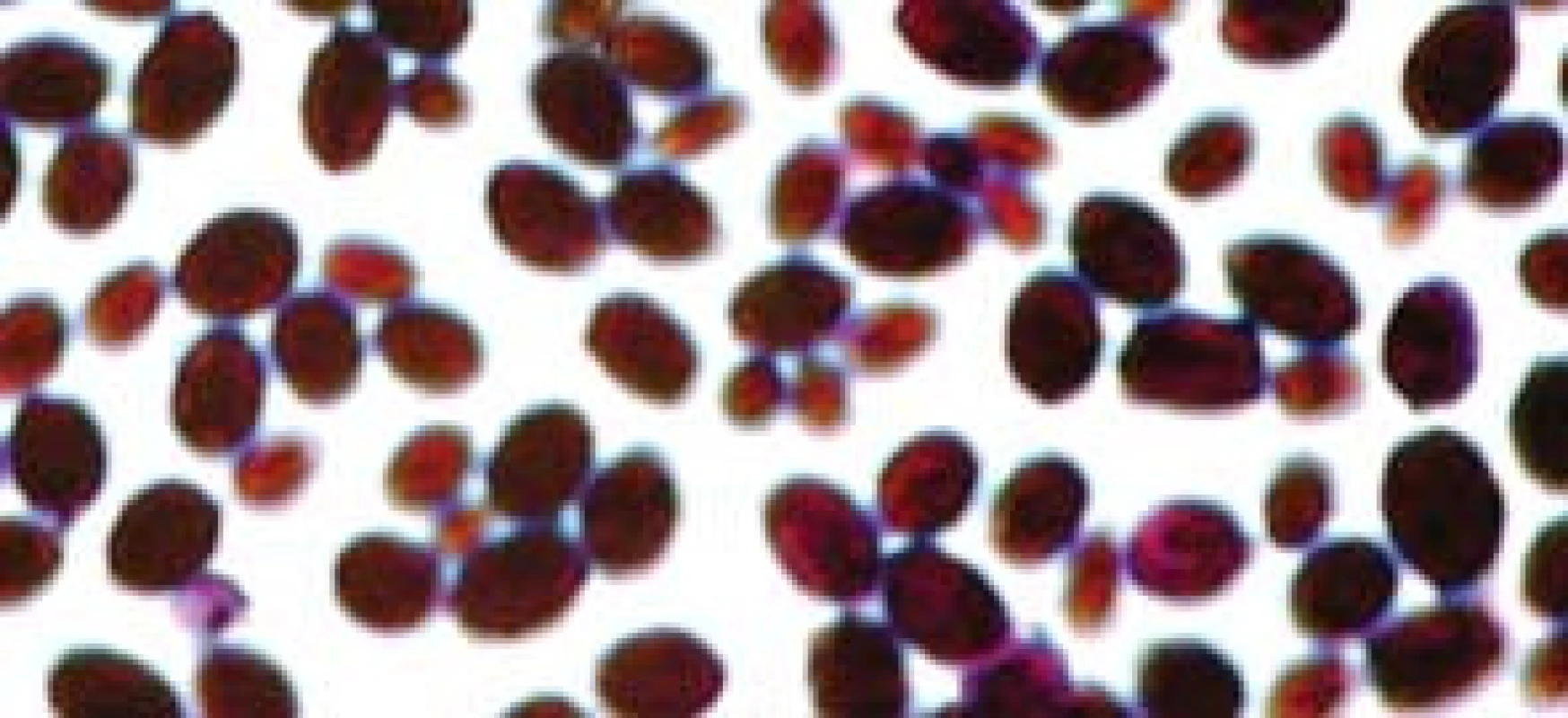
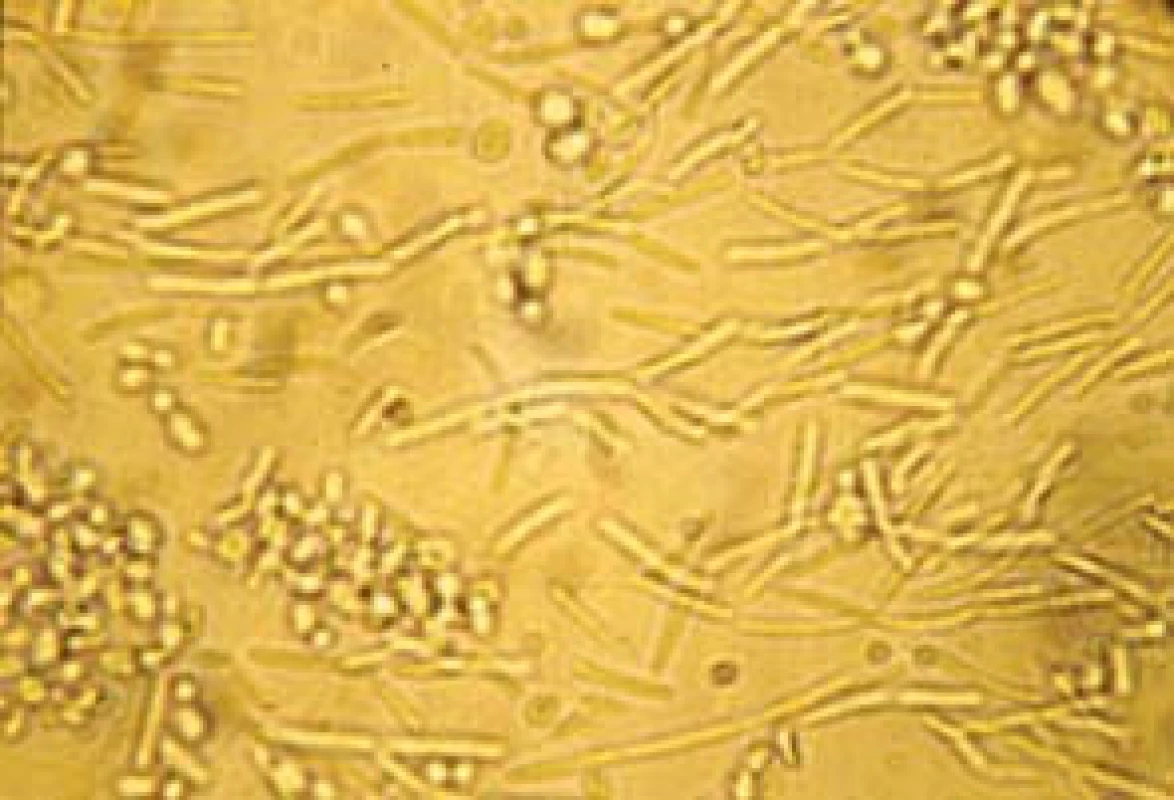
Popsáno je více než 150 druhů kandid. Pouze několik je frekventněji patogenních pro člověka. V kultivačních nálezech dosahuje výskyt až v 70 % Candida albicans (obr. 2, 3). Na významu v posledních letech nabývají „non-albicans“ kmeny, především C. krusei, C. glabrata (obr. 4), C. parapsilosis, C. tropicalis (obr. 5).
Obr. 1. Mechanizmus účinku polyenů a azolů. 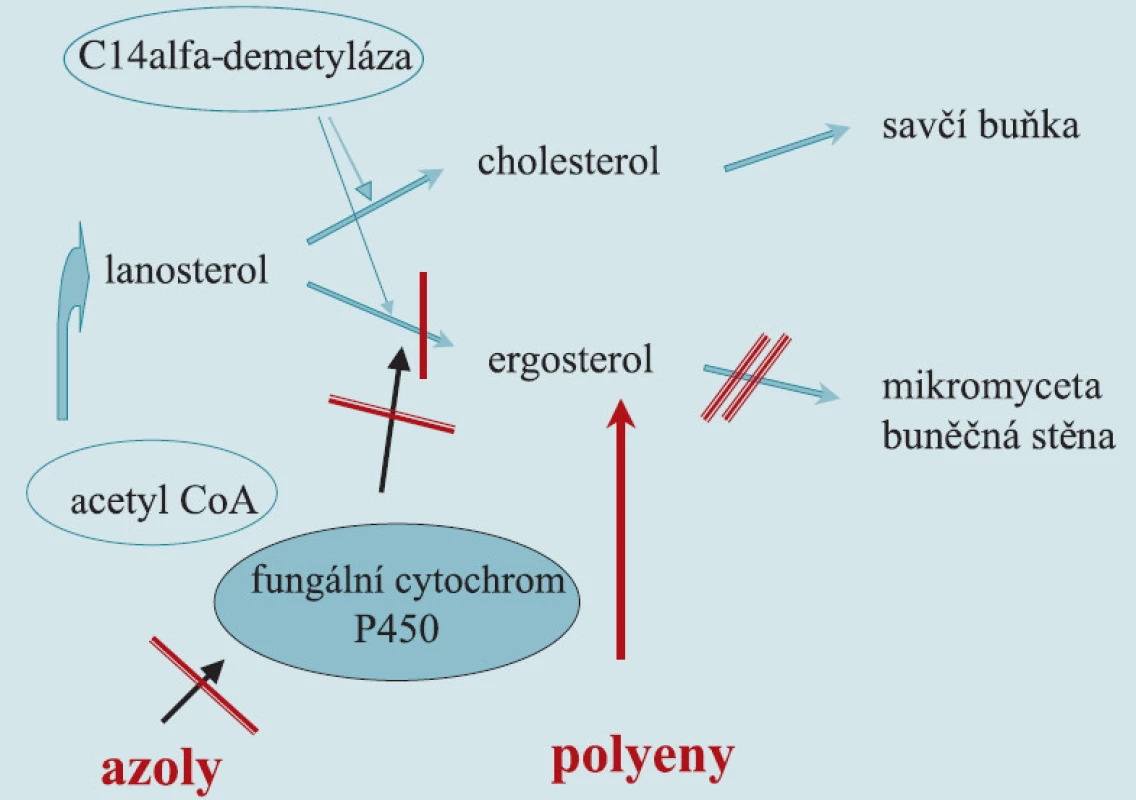
Obr. 2. Candida albicans, kvasinková forma. 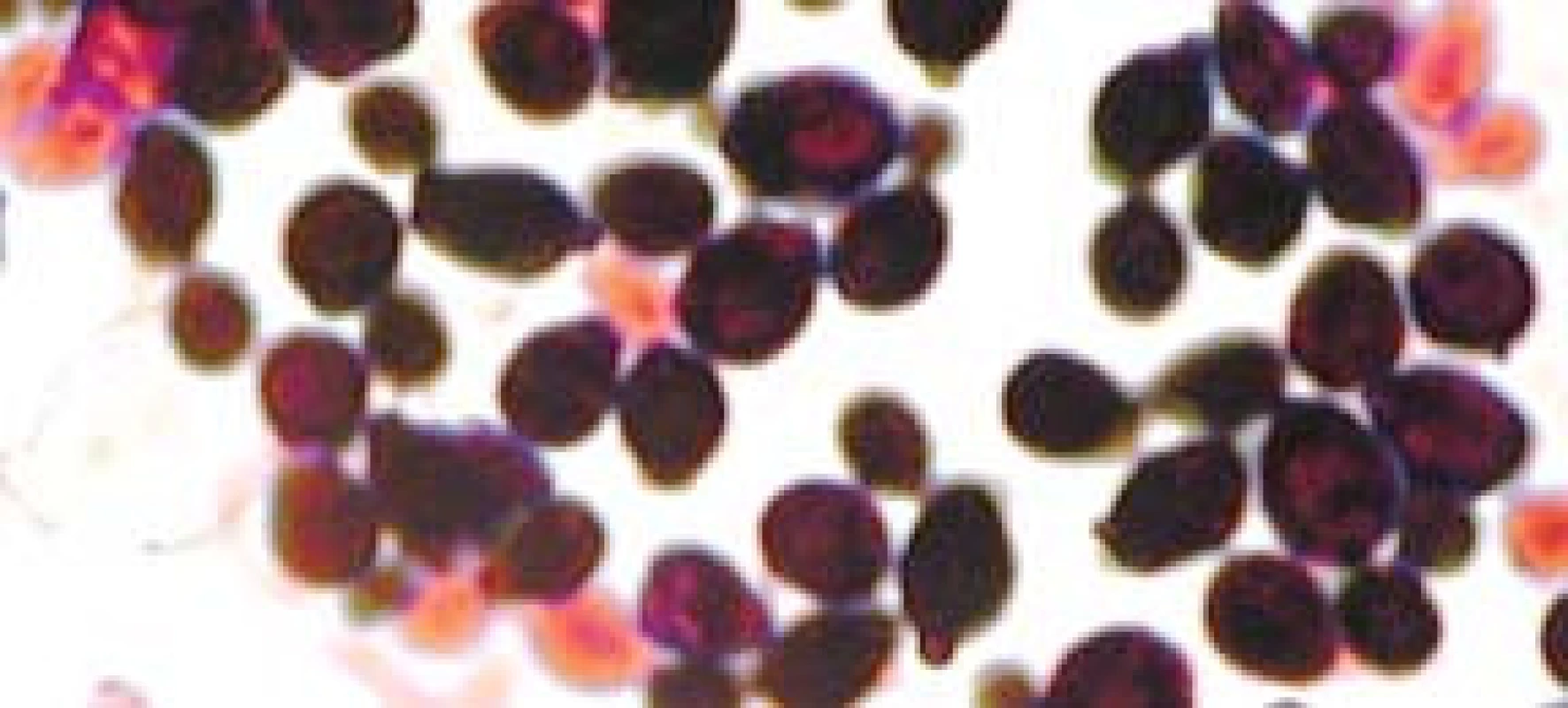
Obr. 3. Candida albicans, vláknitá forma (hyfy). 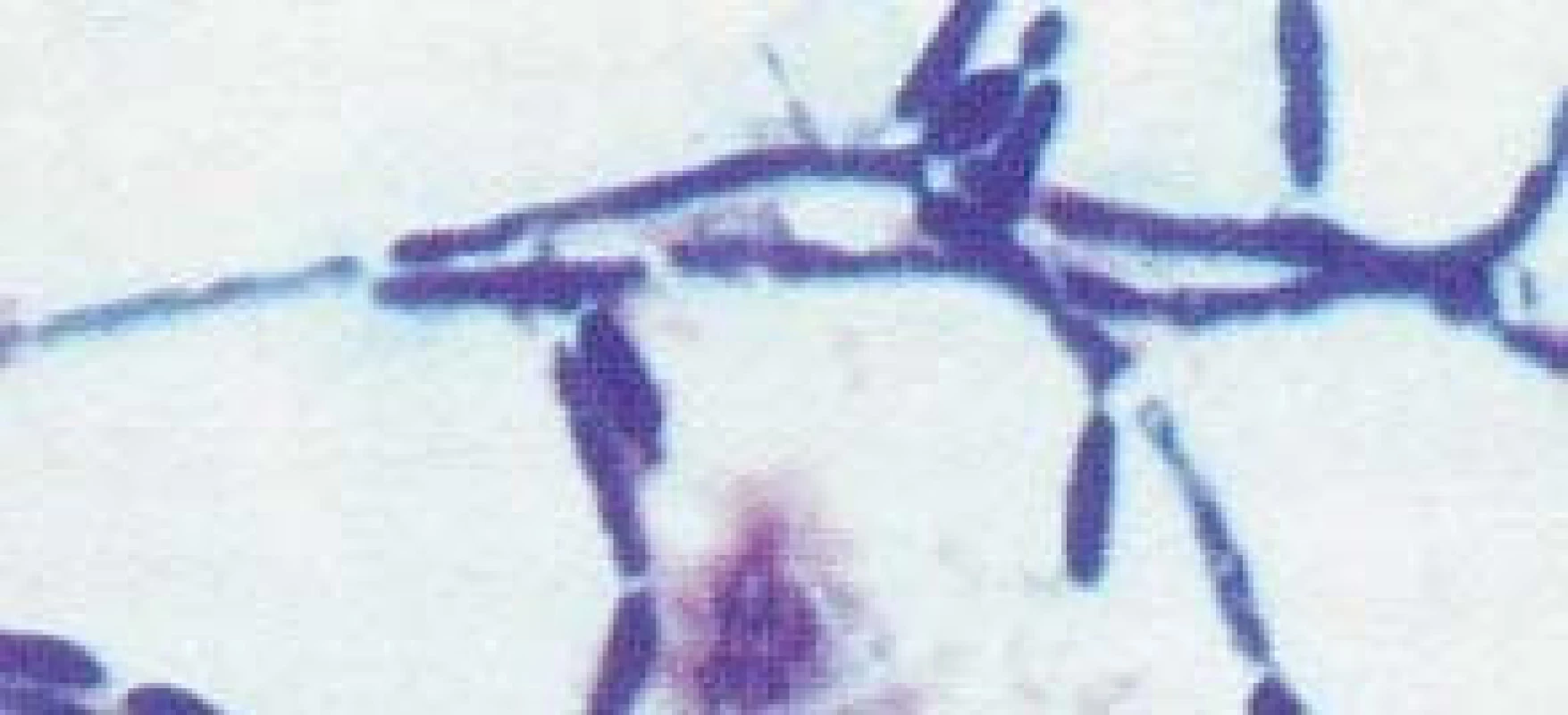
V urologické praxi se s mukokutánními formami kandidózy setkáváme u žen s recidivujícími infekty močových cest a současnou vaginózou. Klinické projevy akutní kandidové vulvovaginitidy jsou rozmanité. Intenzivní pruritus a pálení, mnohdy spojené se stranguriemi, provází edém a zarudnutí vulvy. Na sliznici bělavé povlaky, později ragády a eroze. Hutný, tvarohovitý nepáchnoucí fluor bývá charakteristickým průvodním jevem. Rozsáhlé slizniční léze vznikají při šíření na perineum a perianálně. Kandidová vaginóza má specifické rizikové faktory (antibiotika, hormonální léčba, gravidita, diabetes mellitus, imunosuprese, těsné syntetické prádlo, slipové vložky, parfemovaný toaletní papír a další). Nezřídka však lokální alergická reakce např. na latex (kondomy a další) bývá bez vyšetření označena za kandidovou vaginitidu. U mužů jsou charakteristické změny při kandidové balanopostitidě. Prevence a léčba mukokutánních forem je zároveň prevencí invazivních forem onemocnění.
K nejzávažnějším a nejčastějším systémovým postižením patří kandidóza plic, jater a sleziny, ledvin, CNS a kandidová peritonitida. Klinicky probíhá onemocnění pod obrazem diseminovaného onemocnění s dominujícími projevy infekce jednotlivých orgánů. Klinický průběh může být akutní, subakutní nebo chronický. Akutní septický stav s náhlým vzestupem teploty, třesavkou, tachykardií, tachypnoí a hypotenzí, které charakteristicky provází myalgie a kožní rash. Plíživý nástup má subakutní forma s cyklickými vzestupy teplot. Při progresi dochází k orgánovému postižení až selhání. Především u nemocných s kortikoterapií se manifestuje chronická forma diseminované infekce, pozvolna probíhající, obvykle bez febrilních reakcí, a kromě progredující únavy bez zřetelných klinických nálezů.
KANDIDÓZA LEDVIN A MOČOVÝCH CEST
Kolonizace močových cest kandidami je vzácná. Přechodná kandidurie bývá v souvislosti s léčbou antibiotiky a kortikosteroidy. Často bývá spojena s permanentním katétrem. Zdrojem infekce bývají okolní tkáně, především kolonizace střeva, pochvy, perinea. U nemocných probíhá pod obrazem cystitidy. Při hematogenním šíření postihuje kandidóza renální parenchym. Více než 80 % nemocných s diseminovanou kandidózou má postiženy ledviny. Prakticky u všech nemocných s postižením ledvin zjistíme kandidurii. Kromě již zmíněných kritérií postižení urogenitálu (v moči nález ³ 104 cfu/ml, pozitivní hemokultura, pozitivní sérologická vyšetření) hledáme další predispoziční faktory, především diabetes mellitus s glykosurií, endourologická vyšetření, anatomické anomálie, chirurgické výkony v oblasti močových cest, léčbu antibiotiky a další.
Podle klinického obrazu nelze odlišit bakteriální a kandidovou cystitidu. Vzhledem k tomu, že kultivace mycet trvá déle, obvykle není možné z běžného kultivačního vyšetření potvrdit jejich přítomnost a nález z laboratoře přichází jako sterilní kultivace. Ani cystoskopický nález nepřinese kromě nálezu hemoragické cystitidy žádné vodítko pro diagnózu, jen zřídka jsou patrné bělavé hmoty v měchýři.
Kandidovou pyelonefritidu provází febrilní stav, lumbalgie a jindy bolesti břicha kolikovitého charakteru. Nezřídka je jediným klinickým symptomem horečka. Ascendentní infekce postupuje z pánvičky na papily, vede k jejich destrukci a šíří se do renálního parenchymu. Urologické anomálie, jako reflux či obstrukce, progresi infekce akcelerují. Relativně vzácný je mycetom, obvykle pod obrazem obstrukční uropatie s renálními kolikami.
Tvorba mikroabscesů v parenchymu ledvin je typická pro hematogenní šíření infekce. Jejich progrese ve směru tubulů vede k nekróze papil s následným rozvojem renální insuficience.
LÉČBA
Léčbou volby je aplikace antimykotik a snaha o úpravu základní příčiny onemocnění. V rámci podpůrné léčby lze v závislosti na klinickém stavu a vyvolávající příčině doporučit širokou paletu imunomodulační léčby (od probiotik až po podání hemopoetických růstových faktorů - GM CSF). Úprava malnutrice a realimentace je v léčbě důležitým faktorem. Profylaktické podání antimykoticky působících přípravků při nebezpečí vzniku myotické infekce - jodid draselný, genciánová viole, nevstřebatelné polyeny (pimafucin, fungicidin) či mikonazol k eliminaci slizniční kolonizace. Nezbytné chirurgické výkony (bioptická vyšetření, zajištění derivace močových cest, event. nefrektomie) je vhodné provádět vždy pod clonou antimykotik. U indikovaných skupin nemocných je nezbytné profylaktické podávání systémových antimykotik, především ze skupiny azolů.
Antimykotika
Antimykotika rozdělujeme podle struktury a léčebného rozsahu, tedy na lokálně a systémově působící. Podle struktury rozdělujeme antimykotika na polyenová, antimetabolity a azoly.
Amfotericin B (AmB) je makrolidové polyenové antibiotikum se systémovým antimykotickým účinkem. V klinické praxi je používán od roku 1960 a dosud je považován za zlatý standard v léčbě houbových infekcí. AmB se váže na plazmatické bílkoviny, relativně špatně proniká do tkání a tělesných tekutin, dosahuje v nich nízkých koncentrací, obvykle pouze fungistatických. Z tkání se uvolňuje jen pomalu a v játrech či ledvinách jej lze prokázat ještě 12 měsíců po aplikaci. Vylučován je především žlučí. Vysoká afinita k bílkovinám plazmy neumožňuje eliminaci AmB hemodialýzou.
AmB představuje referenční lék. Dnes se stále více uplatňují azolová antimykotika. Důvodem ke zdrženlivosti aplikace AmB je jeho značná nefrotoxicita - nefrokalcinóza, tubulární acidóza a renální insuficience až selhání ledvin, ale i další nežádoucí účinky, např. časně febrility, rigor, bolesti hlavy a svalstva, pozdně pak normocytární anémie při snížení produkce erytropetinu, neurotoxicita či poškození kostní dřeně. Významně nižší nefrotoxicitu a množství nežádoucích účinků mají emulze AmB + intralid (amB-IL) a další amfotericiny na lipidových nosičích (lipozomy, koloidní disperze - ABLC). Spektrum účinnosti je shodné s konvenčním AmB, zahrnuje kvasinky, vláknité houby a některá protozoa, která mají ergosterol v buněčné stěně (původci leishmaniázy a malárie). ABLC může být s úspěchem podán i po selhání léčby konvenčním AmB a tam, kde se při konvenčním AmB objevila toxicita. Cena je však mnohonásobně vyšší.
Zvláštní indikací může být intermitentní či kontinuální irigace močového měchýře při kandidové urocystitidě. Léčba bývá provázena výraznou chemickou cystitidou a i v této indikaci dáváme dnes přednost perorální terapii triazoly, popř. flucitozinem.
Flucitozin (5-fluorocytosin, 5-FC) je fluorovaná pyrimidinová baze, antimetabolit. Do buňky mikromycet je aktivně transportován (cytozin-permeáza), zde je deaminován na 5-fluorouracil (5-FU). Metabolity 5-FU jsou inkorporovány do RNA s následnou inhibicí syntézy nukleových kyselin. V omezené míře 5-FC blokuje syntézu DNA přímo jako antagonista cytozinu. Blokáda transportu a narušení několikastupňové intracelulární konverze na účinnou látku jsou příčinou vysokého výskytu sekundární rezistence. Proto se s výjimkou krátkodobé léčby mykotických infekcí močových cest podává v kombinovaných režimech. Významný je synergizmus s AmB, ale i s azolovými antimykotiky. Allopurinol snižuje myelotoxicitu 5-FC.
Azolová antimykotika jsou bezpečnou a efektivní alternativou pro většinu systémových mykóz, především pak přípravky ze skupiny triazolů. Azoly blokují syntézu ergosterolu inhibicí enzymu C14alfa-demetylázy. Katalytická aktivita enzymu závisí na mediatorovém působení cytochromu P450. Cytochrom P450 je ubikvitární hemoprotein, který u člověka hraje klíčovou roli v syntéze a degradaci endogenních mastných kyselin, syntéze steroidních hormonů, dále pak v biotransformaci žlučových kyselin, tromboxanů, vitaminů rozpustných v tucích, prostacyklinů, leukotrienů a dalších. Azolová antimykotika se liší mezi sebou v míře ovlivnění enzymatické funkce cytochromu P450 u člověka (antiandrogenní efekt ketokonazolu). Nežádoucí projevy léčby a orgánová toxicita jsou významnější pouze u imidazolů. Triazoly jsou obecně velmi dobře tolerovány a orgánová toxicita je prakticky nulová. Flukonazol se vymyká unikátními farmakokinetickými vlastnostmi celé skupině. Vedle přímého fungistatického účinku blokuje morfogenezi z kvasinkové do myceliální formy, omezuje adherenční schopnost mikromycet na povrchy fyziologických membrán, na endotel cév i na umělé povrchy. Omezení adherence snižuje riziko generalizace infekce. Flukonazol dosahuje vysokých koncentrací ve tkáních, ale i v moči, lze jej odstranit hemodialýzou. Přípravek je na rozdíl od itrakonazolu vhodný pro léčbu urogenitální mykotické infekce.
ZÁVĚR
Mykotické infekce v urologii jistě nejsou frekventním onemocněním, jejich výskyt však zdaleka není vzácný. Léčba povrchových forem mykotických onemocnění je prevencí vzniku a rozvoje závažných diseminovaných stavů, nezřídka letálně končících. Kauzální antimykotická léčba s podpůrnou léčbou musí být dostatečně dlouhodobá s náležitým monitorováním rozvoje možné toxicity léčby. Interdisciplinární spolupráce je v diagnostice a léčbě mykotických infekcí nezastupitelná.
MUDr. Michaela Matoušková
Urocentrum Praha
Zdroje
1. Boedeker KS, Kilzer WJ. Fluconazole dose recommendation in urinary tract infection. Ann Pharmacother 2001; 35(3): 369-372.
2. Hazem KC, Theisz GW, Howell SA. Chronic urinary tract infection due to Candida utilis. J Clin Microbiol 1999; 37(3): 824-827.
3. Krčmery S, Doubrava M, Krčmery V Jr. Fungl urinary tract infections in patient at risk. Int J Antimicrobiol Agents 1999; 11(3-4): 289-291.
4. Laupland KB et al. Intensive care unit-acquired urinary tract infection in a regional critical care unit system. Crit Care 2005; 9(2): 60-65.
5. Špaček J, Buchta V, Veselský Z, Kalousek I. Host-yeast interaction in relation to the urogenital tract, vulvovaginal candidiasis and urological aspects of mycotic diseases. Česká Gynekol 2003; 68(6): 432-439.
Štítky
Detská urológia Urológia Gynekológia a pôrodníctvo
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2005 Číslo 2- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
- Jak podpořit využití železa organismem bez nežádoucích účinků
-
Všetky články tohto čísla
- NEKOMPLIKOVANÉ UROINFEKCE: CO JE NOVÉHO A CO SE ZMĚNILO
- KOMPLIKOVANÉ UROINFEKCE: CO JE NOVÉHO A CO SE ZMĚNILO
- INFEKCIE MOČOVÝCH CIEST U DETÍ A V TEHOTENSTVE
- MYKOTICKÉ INFEKCE
- Editorial
- UROGENITÁLNÍ TUBERKULÓZA NA POČÁTKU 3. TISÍCILETÍ
- CHRONICKÉ PÁNEVNÍ BOLESTI
- PRINCIPY ANTIMIKROBIÁLNÍ LÉČBY U UROINFEKCÍ
- SEXUÁLNĚ PŘENOSNÁ ONEMOCNĚNÍ Z POHLEDU UROLOGA
- SEPTICKÝ ŠOK U UROINFEKCÍ
-
GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH CEST, VČETNĚ POHLAVNÍCH CEST U MUŽŮ
1. ČÁST - KVÍZ
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- MYKOTICKÉ INFEKCE
- INFEKCIE MOČOVÝCH CIEST U DETÍ A V TEHOTENSTVE
- SEPTICKÝ ŠOK U UROINFEKCÍ
-
GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH CEST, VČETNĚ POHLAVNÍCH CEST U MUŽŮ
1. ČÁST
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy