-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
NEKOMPLIKOVANÉ UROINFEKCE: CO JE NOVÉHO A CO SE ZMĚNILO
Non - complicated uroinfections - what is new and what has changed
Urinary tract infections (UTI), together with respiratory infects, belong to the most frequent inflammatory diseases at all and they occur at both sexes during the lifetime. Considering the anatomic proportions and common communication of lower urinary tract and sexual organs in men, the inflammatory diseases of male sexual organs are also ranked to this issue. UTI are frequent cause of morbidity and in complicated cases they may also lead to a significant mortality [97]. Better understanding of pathogenesis and the role of host and bacterial factors participating in the development of UTI makes possible to identify the risk patients, to minimize the consequences of the disease or enforced treatment and that way to improve the fate of the affected people. Rational pharmacotherapy, including the use of modern antimicrobial drugs, enables to reduce the morbidity and connected costs which are not small. This comprehensive article deals with non-complicated uroinfections. The problem of complicated UTI and sexually transmitted diseases (STD) will be mentioned only in basic level, unavoidable for explanation of neccessary relationships related to non-complicated UTI and it will be discussed in detail in separate articles.
KEY WORDS:
urinary infections, diagnostics, therapy, prophylaxis
Autoři: MUDr. Ivan Kolombo; Febu
Působiště autorů: Urologická ambulance Městské nemocnice Turnov
Vyšlo v časopise: Urol List 2005; 3(2): 13-29
Souhrn
Infekce močových cest (IMC) patří spolu s respiračními infekty k vůbec nejčastějším zánětlivým onemocněním, které se vyskytují v průběhu celého života u obou pohlaví. Vzhledem k anatomickým poměrům a společné komunikaci dolních močových cest a pohlavních orgánů u mužů jsou k této problematice řazena také zánětlivá onemocnění mužských pohlavních orgánů. IMC jsou častou příčinou morbidity a v komplikovaných případech mohou vést také k významné mortalitě [97]. Lepší porozumění patogenezi a roli hostitelských a bakteriálních faktorů podílejících se na rozvoji IMC umožní identifikovat rizikové nemocné, minimalizovat následky onemocnění či vynucené léčby, a zlepšit tak osud postižených. Racionální farmakoterapie včetně užití moderních antimikrobiálních léků umožňuje redukovat morbiditu a s ní spojené nemalé náklady. Tento přehledný článek se zabývá nekomplikovanými uroinfekcemi. Problematika komplikovaných IMC a sexuálně přenosných nemocní (Sexually Transmitted Diseases - STD) bude zmíněna pouze v základní rovině nezbytné pro objasnění potřebných souvislostí týkajících se nekomplikovaných IMC a bude podrobněji diskutována v samostatných článcích.
KLÍČOVÁ SLOVA:
močové infekce, diagnostika, terapie, profylaxeDEFINICE
Definice IMC zůstává kontroverzním tématem [13]. V současné době neexistuje jednotně přijímaná definice charakterizující velmi heterogenní skupinu onemocnění, jakým bezesporu infekce močového a mužského pohlavního systému jsou.
Příkladem lze uvést několik užívaných definic.
- Močová infekce je patologický stav, při kterém lze prokázat přítomnost patogenních mikroorganizmů v moči anebo ve tkáních močového ústrojí [114].
- Infekce močového systému je zánětlivou odpovědí urotelu na bakteriální invazi obvykle spojenou s bakteriurií a pyurií (Campbellova prestižní učebnice urologie) [97].
- Akutní, nekomplikovaná IMC dospělých zahrnuje epizody akutní cystitidy a akutní pyelonefritidy u jinak zdravých jedinců (zvláště žen bez rizikových faktorů, které nemají strukturální ani funkční abnormality močového traktu a nemají ani přidružené onemocnění, které by zvyšovalo riziko k získání infekce či k selhání léčby). Tuto definici zahrnují současná guidelines Evropské urologické asociace [74].
- Uroinfekcí rozumíme onemocnění charakterizované přítomností bakterií nebo jiných mikroorganizmů a zánětlivých buněk v moči, provázených klinickými příznaky [23].
- Z vědeckého pohledu bývá na uroinfekci pohlíženo jako na interakci mezi patogenem a hostitelem [60].
Vzhledem k definicím, které se opírají o průkaz bakteriurie a pyurie při diagnostice IMC, je nutné další vymezení těchto ukazatelů. Rovněž zde je možno nalézt některé odlišnosti v kvantifikaci těchto parametrů, jak ukazují tab. 1 a 2.
Tab. 1. Oxfordská kritéria diagnózy signifikantní bakteriurie [18]. ![Oxfordská kritéria diagnózy signifikantní bakteriurie [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/109879199c67a4fb3c98da944fa4a778.png)
Tab. 2. Hodnocení významné bakteriurie [91,92], která jsou uvedena v doporučeních Evropské urologické asociace (EAU Guidelines, Update March 2004) [74]. ![Hodnocení významné bakteriurie [91,92], která jsou uvedena v doporučeních Evropské urologické asociace (EAU Guidelines, Update March 2004) [74].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/dc5a361f9f609591553887ddea20aebc.png)
Asymptomatická bakteriurie (ABU) je definována jako 2 kultivačně pozitivní vzorky moči odebrané v časovém odstupu alespoň 24 hodin obsahující ³ 105 uropatogenů/ml stejného bakteriálního kmene.
Pyurie je nález ³ 10 leukocytů v jednom velkém zorném poli při hodnocení nesuspendovaného močového sedimentu centrifugované moči. V běžné praxi může být použita také papírková metoda vyšetření moči zahrnující test se stanovením leukocytární esterázy, hemoglobinu a zřejmě nitritové reakce.
EPIDEMIOLOGIE
IMC představují spolu s respiračními infekty nejčastější zánětlivé onemocnění a postihují člověka od narození v průběhu celého života. Například v USA je odhadován výskyt na 7 milionů epizod nekomplikovaných IMC za rok [36]. Celosvětová incidence se odhaduje na více než 250 miliónů epizod ročně a představuje nezanedbatelné nároky na ekonomické náklady, diagnostické a léčebné postupy [59]. Rozdílná četnost jejich výskytu vyplývá z rozdílného výskytu urologických onemocnění v jednotlivých věkových kategoriích a z biologické odlišnosti obou pohlaví [77]. V novorozeneckém období je výskyt uroinfekcí asi 3–5krát vyšší u chlapců, což odpovídá významně vyššímu výskytu vrozených odchylek močových cest u chlapců. U dívek výrazně narůstá prevalence IMC od batolecího věku a je pak relativně konstantní až do puberty. Ve věku 16 let představuje kumulativní incidence IMC pro chlapce 3,6 % a pro dívky 11,3 % [42]. Rekurentní IMC postihne až třetinu dívek v průběhu 1 roku [108]. V reprodukčním věku výrazně převyšuje výskyt uroinfekcí u žen. Graf 1 poskytuje představu o narůstající kumulativní pravděpodobnosti IMC u žen v USA v průběhu života [27]. Odhaduje se, že nejméně 20 % žen v průběhu života prodělá IMC [95]. Následkem nárůstu obstrukčních uropatií (BPH) u mužů se četnost IMC vyrovnává u obou pohlaví až v 6. dekádě života. U žen mladšího a středního věku se ve většině případů jedná o nekomplikované IMC (cystitidy a pyelonefritidy). Přibližně u 5 % mladých dospělých jedinců můžeme prokázat symptomatickou bakteriurii a její incidence se zvyšuje v každé dekádě přibližně o 1–2 % [12]. Naproti tomu u mužů je potenciálně vyšší pravděpodobnost závažnějšího průběhu a je nutné zvážit možnost přítomnosti rizikových faktorů (dosud nerozpoznané anomálie močových cest, urolitiáza, nádorové onemocnění). V současnosti je IMC také u části dospělé mužské populace řazena k nekomplikovaným IMC.
Graf 1. Kumulativní pravděpodobnost IMC u žen v USA [27]. ![Kumulativní pravděpodobnost IMC u žen v USA [27].](https://pl-master.mdcdn.cz/media/image/2c93b7df6417d46eb7937a52313a2005.jpg?version=1537793246)
KLASIFIKACE A ETIOLOGIE
IMC mohou být klasifikovány a děleny dle řady ukazatelů. Jedná se spíše o didaktické členění podle vyvolávající příčiny (tab. 3, 4) a histopatologických změn (tab. 5). V praxi se uplatňuje dělení IMC dle klinického obrazu a v závislosti na závažnosti průběhu a výskytu komplikujících faktorů a onemocnění (tab. 6).
Tab. 3. Dělení IMC podle vyvolávající příčiny. 
Tab. 4. Dělení klinicky relevantních bakteriálních původců IMC. 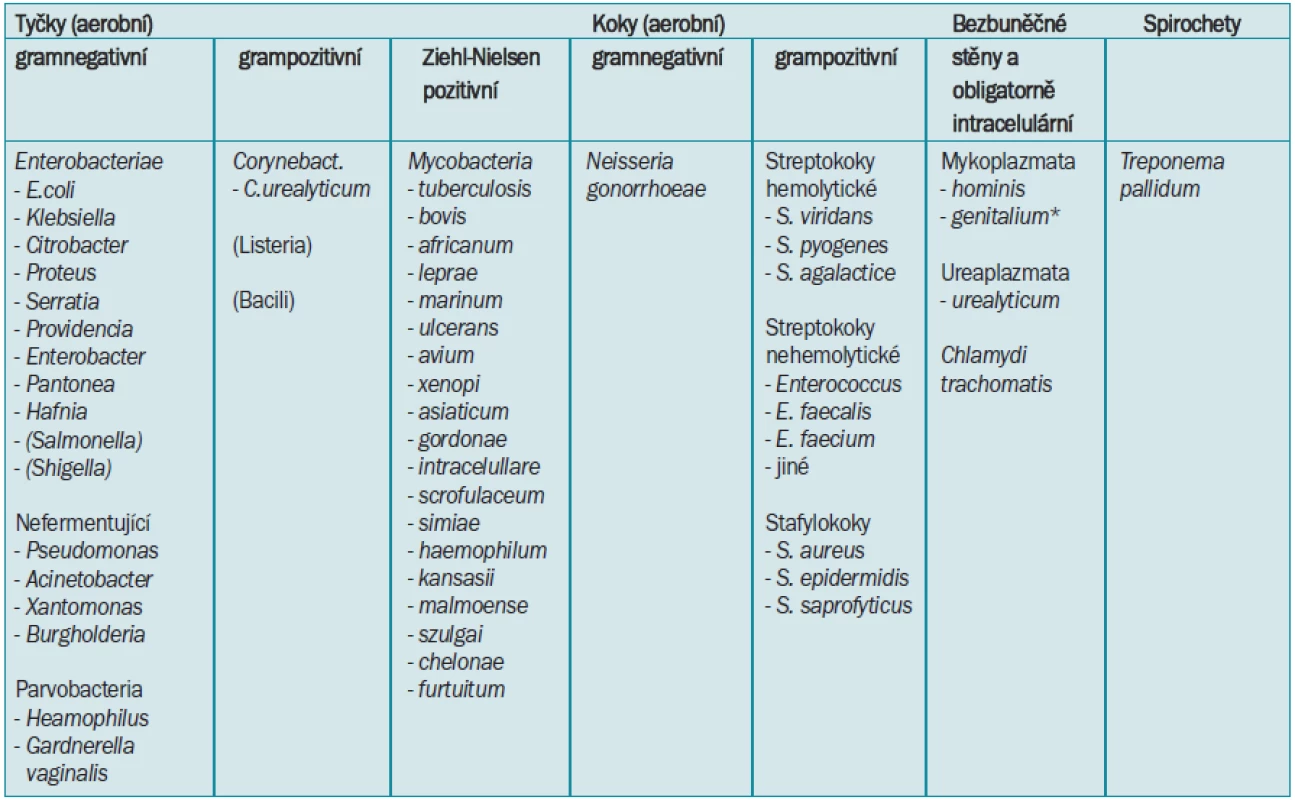
*Mykoplasma genitalium je prokazatelně dalším humánním patogenem, který se zřejmě uplatňuje u řady nemocných s obrazem negonokokové a nechlamydiové uretritidy, u nichž je však laboratorní průkaz zatím omezen pouze na malý počet světových pracovišť [103,56]. Tab. 5. Faktory spojené s rizikem potenciálně komplikované IMC shrnuje následující tabulka [6,74]. ![Faktory spojené s rizikem potenciálně komplikované IMC shrnuje následující tabulka [6,74].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/62d3e0a3b1693c69a08167212b8315ef.png)
Na základě přítomnosti, či absence typických histopatologických změn dělíme IMC na specifické či nespecifické. Specifické infekce s histopatologicky definovaným granulomatozním zánětem mohou být vyvolány především mykobakteriemi, aktinomykózou, syfilis, gonoreou. Přehled mykobakterií vyvolávajících infekce u člověka je uveden v tab 4.
Tab. 6. Dělení zánětů podle histopatologických změn. 
Z klinického hlediska se jeví vhodné rozdělit IMC postihující horní či dolní močové cesty a rozlišit je na komplikované a nekomplikované IMC. Podrobnější členění a charakteristika dle konkrétního postižení umožní rozdělit záněty dle lokalizace - například: uretritis, cystitis, prostatitis, prostatovesiculitis, funiculitis, epididymitis, orchitis, ureteritis (zvláště histologická a rentgenologická diagnostika) a pyelonephritis. Za nekomplikovanou považujeme IMC u jinak zdravých nemocných se strukturálně a funkčně normálním močovým systémem. Komplikovaný průběh lze předpokládat u nemocných oslabených či imunokompromitovaných či se strukturálními nebo funkčními abnormalitami močopohlavního systému [16,113], což vede ke zvýšené náchylnosti k rozvoji infekce a snižuje efektivitu léčby. V případě recidivujících IMC či obrazu sterilní pyurie má být diferenciálně diagnosticky pomýšleno také na možnost tuberkulózy močového traktu [33,57], u níž dle odhadů WHO je celá jedna třetina světové populace infikována Mycobacteriem tuberculosis a ročně přibývá asi 8–10 milionů nových aktivních případů (WHO, 1997) [110].
Ke správnému rozpoznání a zařazení nekomplikovaných a komplikovaných případů IMC přispívají klinické, anamnestické a laboratorní údaje a výsledky zobrazovacích metod. Modifikovaná kritéria pro diagnostiku IMC vycházející z guidelines IDSA (Infectious Diseases Society of America) a ESCMID (European Society of Clinical Mikrobiology and Infectious Diseases) jsou doporučena také EAU (tab. 7).
Tab. 7. Charakteristiky a základní členění IMC [74]. ![Charakteristiky a základní členění IMC [74].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4a92b5f9862187c0e7449febdd241442.png)
Výsledek bakteriurie a číselné vyjádření koncentrace bakterií v moči se opírá o počitatelné vyrostlé bakteriální kolonie. Vyjadřuje se počtem tzv. cfu (colony - -forming unit) na 1 ml. Evropská společnost klinické mikrobiologie a infekčního lékařství s Evropskou konfederací laboratorní medicíny vydaly doporučení k redefinici bakteriální koncentrace, včetně parametrů vyjadřujících signifikantní bakteriurii ve vztahu k typu odebraného vzorku, klinické symptomatologii a počtu druhů zachycených uropatogenů. Počet cfu na 1 ml je doporučeno nahradit cfb (colony - -forming bacteria) na 1 litr moči. Termín cfu je považován za obsoletní a příliš abstraktní a jednotka 1 ml není standardizována tak jako 1 litr. Redefinici si vyžádaly i nově zaváděné diagnostické technologie (Members of the ECLM and ESCMID Working Party, 2000) [70].
ETIOPATOGENEZE
Bakteriální IMC se šíří ve více než 95 % ascendentně, méně než 5 % hematogenní cestou, eventuelně přímým šířením z infekčního ložiska.
Ascendentní IMC způsobují především bakterie z anorektální oblasti [53]. Komunitní infekce způsobuje především komenzální střevní flóra, nozokomiální infekce vznikají nejčastěji v souvislosti s instrumentálními výkony v močových cestách a v souvislosti s drenážemi močového systému (močové katétry). U žen je kromě anorekta rezervoárem uroinfektů vulvovaginální oblast. Kolonizace pochvy uropatogeny typu E. coli nemusí způsobovat gynekologické klinické obtíže, ale přispívá k rozvoji rekurentních uroinfektů. Normální flóra v pochvě s fyziologicky nízkým pH je důležitým prvkem v zábraně kolonizace sliznice vaginy enteropatogenními kmeny. Narušení rovnováhy poševního ekosystému může být zapříčiněno nadměrným užíváním hygienických přípravků (změnou pH), spermicidních krémů a vaginálních diafragmat. Obdobně se riziko zvyšuje v menopauze při hormonálním deficitem navozené atrofizaci sliznice a snížením osídlení pochvy bakterií Lactobacillus acidophilus.
Hematogenní infekce jsou většinou zapříčiněny grampozitivními kmeny stafylokoků a streptokoků, anaeroby a také plísněmi. Vznikají pak většinou abscesy parenchymatózních orgánů.
Lymfogenní šíření z oblasti cervixu a rektosigmatu je diskutabilním způsobem přenosu, se sporným významem pro rozvoj uroinfekce.
Příkladem přímého šíření infekce mohou být píštěle mezi močovými cestami a GIT.
Přenos infekce pohlavním stykem nepatří k typickým patogenetickým cestám šíření IMC, patří ale do geneze uretritid, prostatitid a epididymitis u STD.
Pro nejčastější způsob ascendentního rozvoje IMC je rozhodující poměr virulence mikroorganizmu a stupeň obranyschopnosti hostitele. Přehled faktorů virulence mikroorganizmů a obranyschopnosti hostitele poskytuje tab. 8. V současné době, kdy je možné pro epidemiologické účely využít metod molekulární biologie, jsou stále častěji diskutovány další možnosti šíření uropatogenů. Tradiční paradigma patogeneze IMC zahrnuje mechanický transfer střevních bakterií přes perineum do oblasti vulvovaginální a následně uretrou do jinak sterilního močového měchýře. Nepřekvapuje proto skutečnost, že nejvýznamnějším rizikovým faktorem při rozvoji IMC je pohlavní styk. Metoda molekulární typizace uropatogenních kmenů E. coli potvrdila zvýšené sdílení identického uropatogenního kmene v rámci rektální kolonizace u partnera v heterosexuálním sexuálně aktivním páru, ve kterém je žena náchylná k recidivujícím IMC oproti kontrolním párům (ženy zde netrpěly na recidivující IMC). Obdobný zvýšený sklon ke kolonizaci identickým uropatogenním kmenem E. coli byl zaznamenán i u dalších členů společné domácnosti u žen s recidivující IMC. Molekulární typizace tak přispívá ke stále větší podpoře tohoto mechanizmu přenosu E. coli z jedné osoby na druhou osobu v rodinách v rámci kontaktů v domácnosti a u dětí v dětských denních centrech. Metody molekulární typizace s nálezem identických uropatogenních klonů E. coli s multirezistencí k antibiotikům mohou přispět k objasnění regionálního propuknutí epidemie IMC (např. v oblasti jižního Londýna v letech 1986–1987, v Kodani v roce 1991 atd). Nálezy podporují hypotézu šíření E. coli kontaminovanými potravinářskými produkty, za nečekaný rozvoj polyrezistence může být například zodpovědné podávání antibiotik jako růstového promotoru chovanému dobytku [66]. Některé uropatogenní kmeny (konkrétně E. coli 0157:H7) se mohou šířit přímo ze zvířete na dítě při chovu domácích mazlíčků [101].
Tab. 8. Přehled faktorů virulence mikroorganizmů a obranyschopnosti hostitele [6,10,21,28,29,60,112]. ![Přehled faktorů virulence mikroorganizmů a obranyschopnosti hostitele [6,10,21,28,29,60,112].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4340268829596c439c9e632b16a03254.png)
Vzhledem k tomu, že Escherichia coli je zdaleka nejčastějším původcem IMC, týkají se dosud prováděné výzkumy bakteriální virulence právě tohoto patogenu. Virulence je zjišována u určitých kmenů E. coli a je spojena s určitými znaky ve zvláštních liniích. Tato takzvaná uropatogenní výbava zahrnuje sérovou rezistenci, produkci cytotoxinů, jako je hemolyzin (spojený s genovým clustrem HLY), adherenci, přítomnost sideroforů a karboxylesterázový fenotyp. Vzhledem k tomu, že proces adherence je prvním krokem patogeneze IMC, je právě tento mechanizmus podrobován intenzivnímu výzkumu. Jedná se o velmi komplexní děj adherence mikrobiálního patogenu k epiteliálnímu povrchu. Například Gal-Gal podskupina manozo-rezistentních adhezinů váže receptor skupiny P krevních antigenů a je spojena s rizikem rozvoje pyelonefritidy. Adherence a následná patogenita některých kmenů E. coli vychází z přítomnosti P-fimbrií [111]. V současné době je zkoumána možnost kolonizace močových cest apatogenními kmeny E. coli. Tato koncepce vychází ze zjištění, že kolonizace a následná bakteriurie nepatogenních kmenů může bránit rozvoji symptomatické superinfekce. Studován je význam koncového papG adhezinu P-fimbrií. Odstranění papG adhezinu z P-fimbrií může limitovat virulenci a umožnit kolonizaci neinvazivním kmenem [112].
Další poznatky o chemických procesech a genetice zodpovědné za adherenční charakteristiky poskytují důležité informace pro pochopení těchto dějů. Příkladem je glykosfingolipid sialosyl galaktosyl globosid. Jeho přítomnost na povrchu uroepiteliálních bunE. coli s pyelonefritidou asociovanými pili kodovanými adheziny. Byl identifikován fenotyp žen na základě krevních antigenních struktur spojený s vyšším výskytem rekurentní IMC. Takzvaný Lewisův antigen kontroluje fukosylaci struktur buněčného povrchu s protektivním účinkem vůči adherenci uropatogenů. Jde zřejmě o snížení dostupnosti předpokládaného nezbytného receptoru pro E. coli adheziny. Ženy s nesekrečním fenotypem pro Lewisův antigen krevních skupin Le(a-b-) nebo Le(a+b-) mají signifikantně větší incidenci rekurentních IMC než ženy se sekrečním fenotypem Le(a-b+). Vaginální epiteliální buňky žen s nesekrečním fenotypem tak zvýšeně váží patogenní E. coli, vzhledem k selektivní expresi sialosyl galaktosylglobosidu [60].
Další velmi důležitou současnou teorií vysvětlující bakteriální virulenci je klonální hypotéza. Kmeny E. coli izolované u nemocných s pyelonefritidou či sepsí a normálními močovými cestami disponují mnohočetnými faktory virulence. Kmeny E. coli izolované u žen s prostou cystitidou disponují většinou pouze jedním faktorem virulence a fekální kmeny E. coli mají mnohem menší pravděpodobnost přítomnosti charakteristik spojených s virulencí. Porozumění těmto odlišnostem na klonálním konceptu vychází z genetické struktury E. coli. Faktory virulence E. coli mají tendenci být organizovány do velkých bloků bakteriální DNA nazývané ostrůvky patogenity. Tyto ostrůvky patogenity mohou být lokalizovány na řadě míst bakteriální buňky, jako jsou plazmidy, bakteriofágy nebo bakteriální chromozomy. Nejzávažnějším zjištěním je, že tyto velké bloky DNA umožňují simultánní diseminaci mnohočetných virulentních faktorů mezi odlišnými kmeny E. coli.
Na straně obranyschopnosti hostitele je recentně věnován zájem defenzinům, což jsou klastry malých vysoce kationtických antimikrobiálních peptidů. Ty můžeme na základě molekulární struktury rozdělit na 3 základní skupiny, tj. defenzin a, b, q. Jsou produkovány v močovém systému po jeho vystavení uropatogenům a mají schopnost ničit bakterie, houby a některé opouzdřené viry. Po vazbě na aniontické fosfolipidy buněčné stěny mikroorganizmů způsobí defenziny narušení její membránové funkce, zvýší permeabilitu a navodí buněčnou smrt. Defenziny dále umožňují chemotaxi neutrofilů zvýšením produkce interleukinu-8 a zvětšují vrozenou odpověï degranulace mastocytů [29].
Další obranný mechanizmus hostitele je iniciován interakcí lipopolysacharidů buněčné stěny gram-negativních bakterií s toll-like receptorem 4 (TLR4). Tento receptor je exprimován leukocyty a epiteliálními buňkami k rozpoznání zachovaného molekulárního motivu nacházejícího se na patogenech. TLR indukují fagocytózu bakterií prostřednictvím p38 vedoucího k vyšší regulaci „scavengerových“ receptorů. TLR ligandy mohou zvyšovat procento fagocytóz uropatogenních E. coli [21]. Naopak byla recentně prokázána schopnost uropatogenů invadovat intracelulárně do povrchních epiteliálních buněk a formovat zde velké shluky bakterií. Tato invaze sice spouští imunitní odpověï a proces exfoliace, avšak ještě před tím, než je proces exfoliace dokončen, dochází k úniku uropatogenů z odlučujících se buněk a jejich invazi do hlouběji uložené vrstvy epitelu močového měchýře.Takto perzistující rezervoár přítomných bakterií vede k rekurentním IMC [73].
Rovněž byla prokázána paradoxní situace, kdy bakterie využívají imunitní odpověï ve vlastní prospěch. Opsonizace bakterií aktivovaným komplementem C3 je spíše spojena s možností invaze do uroteliálních buněk než s prevencí této invaze. Pravděpodobně se jedná o interakci s povrchovými receptory epiteliálních buněk [100].
Právě bakteriální virulence se jeví jako klíčová k překonání normálně fungující obranyschopnosti hostitele. Jedná se o vzorový případ u většiny nekomplikovaných IMC. Naopak při narušené obranyschopnosti hostitele je bakteriální virulence mnohem méně důležitá. Toto paradigma se týká zvláště komplikovaných případů IMC [60].
Na základě současných poznatků o patofyziologii nekomplikovaných IMC je zřejmé, že při vzniku infekce je na straně obranyschopnosti hostitele rozhodující vrozená nespecifická imunita. Nastartování specifické imunitní obranné reakce zprostředkované T - a B-lymfocyty vyžaduje delší časové období s rozpoznáním antigenních struktur vyvolávajícího patogenu. Nemocní s HIV či imunodeficitem ve specifické imunitní odpovědi zprostředkované T - a B-lymfocyty proto nejsou většinou náchylnější ke vzniku IMC. Rozhodující pro sanaci bakteriální invaze se u IMC jeví nespecifická - vrozená imunitní odpověï zprostředkovaná neutrofily [102].
Dle těchto recentních zjištění je zánětlivý proces v močovém systému popisován jako 2krokový (two step model). V 1. fázi hostitelské odpovědi jsou bakteriální adhezí aktivovány buňky sliznice, které spouštějí kaskádu, během níž se uvolňuje celá řada cytokinů a mediátorů. Cytokiny jako interleukin 6 a 8 (IL-6 a IL-8) jsou signálními mediátory mezi imunitními buňkami. Chemokinetickým efektem IL-8 dochází k migraci neutrofilů z krevních cév směrem k submukóze a přes epiteliální bariéru do místa infekce, což představuje 2. fázi [30]. Porucha 1. či 2. kroku imunitní odpovědi přispívá k náchylnosti hostitele k IMC.
Narušení první fáze vyplývá z dysfunkce receptoru TLR4, což má za následek nespuštění zánětlivé reakce a k následnému přetrvávání bakteriurie. Pro druhý krok je nezbytná funkce IL-8 receptoru neutrofilů, který je kódován CXCR1-genem. Pyelonefritida v dětství se ve většině případů vyhojí bez následků. Při dysfunkci CXCR1 genu se však zřejmě zvyšuje riziko vzniku jizev v parenchymu ledviny a náchylnosti k rozvoji pyelonefritidy [28]. Při sledování CXCR1 genu byla nalezena dramaticky nižší exprese právě u dětí s opakujícími se pyelonefritidami [28,112]. Toto zjištění přispívá k domněnce, že náchylnost k pyelonefritidám s tvorbou jizev je geneticky podmíněný defekt postihující funkci neutrofilů. V klinické praxi je nutné mezi rizikové faktory pro opakující se IMC řadit kromě genetických, anatomických a funkčních změn také řadu dalších ukazatelů. Tab. 9 uvádí nejčastější rizikové faktory zodpovědné za výskyt rekurentních IMC u žen.
Tab. 9. Přehled nejčastějších rizikových faktorů zodpovědných za výskyt rekurentních IMC u žen [37]. ![Přehled nejčastějších rizikových faktorů zodpovědných za výskyt rekurentních IMC u žen [37].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/89c6690bb839ecfdb7f493f3e2a72014.png)
DIAGNOSTIKA
U nekomplikovaných IMC je anamnéza nejdůležitější pro stanovení diagnózy a pro odlišení od komplikovaných případů IMC. Pro věkovou skupinu žen od 18 do 65 let, pro kterou je výskyt nekomplikované IMC typický, jsou nejčastějšími příznaky: dysurie, polakisurie, urgence.
Přítomnost jednoho nebo více těchto symptomů iniciuje spuštění příslušných „guidelines“ pro IMC [49]. Při neobvyklém průběhu s delší anamnézou je diferenciálně diagnosticky nutné pomýšlet na zánětlivá onemocnění neinfekční povahy [32,54], jinou funkční či organickou patologii, nádory nevyjímaje [5]. Rozhodující je zhodnocení anamnestických údajů a odlišení od komplikované IMC. V případě, že nejsou anamnesticky zjištěny žádné rizikové faktory komplikující IMC ani jiná rizika dalších urogenitálních onemocnění, a v případě, že nemocná a lékař preferují léčbu na základě telefonické konzultace, je možná edukace a empirická antibiotická léčba v krátkém režimu bez provádění dalších vyšetření [49]. K léčbě „po telefonu“ se užívá dobře propracovaný protokol. V ostatních případech se přistoupí k osobní konzultaci s lékařem a kromě klinického vyšetření je doplněno vyšetření moči. Na komplikovanou IMC pomýšlíme v následujících situacích, které shrnuje tab. 10. V těchto případech není léčba „po telefonu“ indikována a je nutné další vyšetření, o jehož rozsahu rozhodne lékař na základě klinického vyšetření a zhodnocení příznaků a anamnézy.
Tab. 10. Přehled anamnestických a symptomatických kritérií, která vylučují léčbu „po telefonu“ [49,109]. ![Přehled anamnestických a symptomatických kritérií, která vylučují léčbu „po telefonu“ [49,109].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ece0cf2139d8048dfeb2e9359fea6560.png)
Obraz cystitidy mohou vyvolat také patogeny (chlamydie, ureaplazma, garderella atd), jinak postihující spíše uretru [13,56]. Na přítomnost dalšího onemocnění postihujícího urogenitální systém má být pomýšleno v případě výskytu dalších příznaků a rizikových faktorů, které shrnuje následující tab. 11 [49]. V těchto případech je indikováno příslušné podrobnější lékařské vyšetření.
Tab. 11. Přehled anamnestických a symptomatických kritérií upozorňujících na další onemocnění urogenitálního traktu. 
V případech, v nichž se lékař rozhodne na základě anamnézy a klinického obrazu pro primární vyšetření moči včetně bakteriologie, je nutná dobrá spolupráce s příslušnou mikrobiologickou laboratoří. Nezřídka je ještě za tradiční standard považována nutná přítomnost ³ 105 cfu uropatogenů/ml moči odebrané ze středního proudu. Při hodnotě nižší pak již v řadě případů není stanovena citlivost vykultivovaného bakteriálního kmene k antibiotikům. Tento přístup bohužel přetrvává na základě více než 40 let starých doporučení [48]. Limitní hodnota ³ 105 cfu/ml se ukázala jako nedostatečně citlivý standard, nebo až u poloviny žen s akutní cystitidou může být bakteriurie < 105 cfu/ml [62]. V dnešní době se však v řadě případů považuje za významné již množství ³ 102 cfu uropatogenů/ml. Jedná se například o symptomatickou IMC u malých dětí [14] nebo o akutní nekomplikovanou cystitidu žen spojenou s pyurií a způsobenou stafylokoky či gramnegativními bakteriemi [13].
Rovněž je nutné vědět o úskalích a limitech při použití papírkových metod. Reagenční papírky k vyšetření moči při suspekci na IMC (tzv: dipstick-method) jsou většinou založeny na kolorimetrických změnách, jejichž podstatou je reakce chemické substance s produktem bakterií nebo leukocytů [38]. K nejužívanějším patří esterázový test na přítomnost pyurie a nitritový test na přítomnost bakteriurie. Při pyurii dochází vlivem leukocytární esterázy ke konverzi esteru ve sloučeninu modré barvy (indigo). Zde je však nutno podotknout, že ne vždy je IMC provázena významnější leukocyturií [12] a senzitivita testu také klesá s dobou, která uplynula od sběru moči [23]. Obdobně má své nedostatky nitritový test. Metoda vychází ze skutečnosti, že normální moč neobsahuje dusitany (nitrity). Celá řada zvláště gramnegativních bakteriálních kmenů je však schopna konvertovat nitráty (dusičnany) na nitrity. Aby byla reakce prokazatelná, musí být koncentrace bakterií dostatečná, a test se proto doporučuje provádět brzo ráno z čerstvé moči. Test neprokáže IMC způsobenou pseudomonádami a enterokoky, tyto kmeny neredukují nitráty. Z uvedených důvodů se ke zvýšení senzitivity doporučuje kombinovat nitritový a esterázový test s vyšetřením na přítomnost krve a bílkoviny v moči [13].
Chemické vyšetření moči je možné například u nás známými testovacími proužky Hexaphan®, doplněné informacemi z mikroskopického vyšetření močového sedimentu. Odhaduje se, že asi u 10–15 % symptomatických nemocných se nedaří bakteriurii prokázat běžně používanými metodami [74].
Nelze vyloučit, že současné testy nebudou nahrazeny novými technologiemi. Japonští autoři přikládají velký význam nové metodě průtokové cytometrie, která umožňuje v extrémně krátké době 4 hodin analyzovat přítomnost bakterií v moči a zároveň stanovit citlivost k antibiotikům s přesností 87,4–91,6 % [82]. Pokud se metoda ukáže jako spolehlivá, finančně dostupná a využitelná pro rutinní praxi, umožní nahradit dnes běžnou empirickou antimikrobiální terapii cíleným nasazením antibiotik již v počátku nemoci. Autoři předpokládají možnost snížení rizika vzniku rezistentních bakteriálních kmenů.
V nejasných případech může mít pro diagnostiku IMC jako příčiny febrilního stavu kromě běžných, ale nespecifických testů (FW, CRP, leukocytóza) význam také stanovení močové N-acetyl-b-glukosaminidázy. Ta je markerem tubulárního postižení [44], i když její zvýšení může být způsobeno také vezikoureterálním refluxem - VUR [106].
KLINICKÝ OBRAZ
Akutní cystitida se nejčastěji manifestuje dysurickými obtížemi, urgentně/frekventní mikční symptomatologií s citlivostí až bolestivostí za sponou zasahující někdy až do suprapubické oblasti [115,51]. Kterýkoli z těchto příznaků má vyvolat podezření na možnou IMC. Přibližně u 40 % žen je akutní cystitida provázena hematurií, což však není spojeno s rizikem komplikované IMC [74]. V průměru na jednu epizodu nekomplikované cystitidy je doba trvání obtíží 6,1 dne, doba s omezením aktivity 2,4 dne, doba neumožňující školní či pracovní docházku 1,2 dne a doba nutného pobytu na lůžku 0,4 dne [27]. Pokud se u IMC objeví horečky, je to již v souvislosti s progresí zánětu na parenchymatozní orgán. U mužů se může jednat o akutní prostatitidu, u žen se jedná většinou o rozvoj akutní pyelonefritidy.
Klasický obraz akutní pyelonefritidy zahrnuje bolesti v místě postižené ledviny. Lokalizace bývá nejčastěji v bederní krajině [71] či v průběhu ipsilaterálního močovodu až mezogastria. Lehčí případy, které můžeme hodnotit jako nekomplikovanou akutní pyelonefritidu, probíhají bez alterace celkového stavu s dobře zachovaným perorálním příjmem a hydratací. Případy s alterací celkového stavu, s třesavkami, zimnicemi, opakovaným zvracením, dehydratací, vystupňovanými vegetativními příznaky až se známkami kardiovaskulární nestability již podle dříve zmíněných kritérií řadíme ke komplikovaným IMC. Tyto případy vyžadují hospitalizaci a příslušnou komplexní léčbu s intravenózní aplikací širokospektrých antibiotik, rehydrataci infuzemi a pátrání po eventuální přítomnosti obstrukční uropatie.
TERAPIE
Tak jako u jiných bakteriálních infekcí je rovněž u IMC kauzální léčbou podání antibiotik (ATB). Vzhledem ke sklonu k častým recidivám byly v minulosti paušálně používány poměrně dlouhé léčebné režimy s ATB v délce 2–3 týdnů. Postup-ně vzhledem k vedlejším nežádoucím účinkům, které jsou u protrahované ATB--léčby častější, se ukázalo jako nezbytné stratifikovat nemocné a optimalizovat léčebné režimy. V tomto ohledu není nezajímavé ani zjištění, že i u neléčených nemocných dojde ke spontánnímu ústupu bakteriurie asi v 50–70 % případů během několika dnů [74]. Na druhé straně se symptomatická IMC objeví do 2 let u 52 % žen [12].
Na základě analýzy řady randomizovaných dvojitě zaslepených studií, které jsou základem medicíny založené na důkazech (evidence-based medicine), je v současnosti považována za plně postačující standardní léčbu nekomplikované cystitidy 3denní terapie antibiotiky. V této indikaci nebyl prokázán statisticky lepší efekt dlouhodobějšího podávání antibiotik, zatímco léčba jednou dávkou antibiotika je obecně považována za méně účinnou [12,64,74,81]. Delší léčba antibiotiky je spojena s větším počtem nežádoucích účinků (NÚ) a je provázena zhoršením kompliance ze strany nemocných.
Toto vše včetně znalosti o farmakokinetice jednotlivých ATB a znalost citlivosti bakteriálních kmenů k ATB v jednotlivých regionech musí být zohledněno při individuálním posouzení a rozhodnutí o léčebném režimu. Například současné Guidelines EAU doporučují pro iniciální empirickou antimikrobiální terapii nekomplikované akutní cystitidy 3denní léčbu trimethoprimem/sulfamethoxazolem (TMP-SMX) nebo fluorochinolony (FQ) s převahou renální exkrece. Toto doporučení se plně osvědčuje v běžné praxi i dle našich vlastních zkušeností, je nutná dobrá znalost charakteristik jednotlivých preparátů a zvládnutí případných nežádoucích účinků, které vzácně mohou být závažného charakteru [65]. Jako alternativní je v Guidelines EAU uváděna týdenní léčba nitrofurantoinem nebo pivmecilinamem a jednodenní léčba fosfomycin trometamolem (FOS). FOS je používán v západoevropských zemích již řadu let, a přestože bylo o tomto ATB nadějně referováno v našem písemnictví již v roce 1995 [94], v České republice není dosud tento lék registrován. Podrobnější přehled standardní a alternativní empirické léčby akutní nekomplikované cystitidy poskytuje tab. 12. Účinnou alternativou v léčbě nekomplikovaných IMC může být také nifuratel [52] zvláště při aktuální nedostupnosti nitrofurantoinu (FUR).
Tab. 12. Přehled iniciální empirické léčby akutní cystitidy [3,15,20,55,74,89,109]. ![Přehled iniciální empirické léčby akutní cystitidy [3,15,20,55,74,89,109].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/12adc5df6b1ced102d15b7d23759e148.png)
O léčbě IMC existuje nezměrné množství prací, ale přísná kritéria včetně dvojitého zaslepení splňuje pouze 32 studií [74]. Většinou je za lék první volby považován TMP-SMX. V některých regionech však již bakteriální rezistence k TMP-SMX přesáhla hranici 20 % [66,101]. V těchto oblastech jsou proto většinou doporučovány pro první linii léčby FQ. Rovněž zde však hrozí nárůst vzniku rezistence, vzhledem k mechanizmu účinku FQ (inaktivace DNA - -gyrázy a bakteriální topoizomerázy II a IV) se vznik rezistence týká i dalších FQ. Příkladem neuvážené antibiotické politiky může být situace týkající se ciprofloxacinu a gentamycinu. Zatímco kmeny Pseudomonas aeruginosa jsou k těmto antibiotikům citlivé v tradičních státech Evropské unie nejméně v 75 % případů, ve východoevropských zemích je situace mnohem horší. Rezistence například v Estonsku a Srbsku přesahuje 50 % vůči FQ a neamikacinovým aminoglykosidům [107]. Velmi znepokojující je i zjištění o progresivním rozvoji multirezistence některých kmenů E. coli, u kterých je společná rezistence vůči TMP-SMX, ampicilinu, cefalotinu a tetracyklinu přenášena jediným společným plazmidem [101].
Na tomto místě je vhodné si připomenout některé z důležitých příčin vzniku bakteriální rezistence. Jsou známy nespecifické mechanizmy vzniku rezistence bakteriálních kmenů k antibiotikům, které indukují léky neantibiotické povahy. Příkladem může být používání salicylátů [107]. Riziko vzniku rezistentních mutovaných bakteriálních kmenů se významně zvyšuje, pokud jsou bakterie dlouhodoběji vystaveny působení ATB pod hodnotami minimální inhibiční koncentrace. Toto koncentrační okno se nazývá selekční mutační okno a negativně se týká antibiotik s extrémně dlouhým biologickým poločasem. Naopak optimálními antibiotiky z tohoto hlediska jsou preparáty, které při zahájení i ukončení léčby rychle procházejí selekčním mutačním oknem. To znamená, že rychle dosahují účinných hladin při zahájení léčby a rychle jsou z organizmu eliminovány po skončení léčby [107]. Pro krátký dávkovací interval však nejsou tato ATB tolik oblíbená a většina nemocných, ale i lékařů má sklon upřednostňovat právě ATB s velmi dlouhým biologickým poločasem. Velký problém představuje také nutnost dlouhodobého podávání ATB nemocným s imunodeficitními stavy, což je spojeno se vznikem i multirezistentních bakteriálních kmenů v selektované střevní flóře. Příkladem možno uvést profylaktické podávání antibiotik proti Pneumocystis carinii v USA, která je obávanou respirační infekcí u nemocných s HIV [101].
Dalším mechanizmem přispívajícím ke vzniku bakteriální rezistence může být neuvážené používání ATB v zemědělství a v domácnostech [66]. Příkladem může být rozvoj rezistence ke streptograminům. Jedná se o ATB-deriváty pristinamycinu IA a IIA, faktorů tvořených aktinomycetou Streptomyces pristinaespiralis, které se váží na různé části ribozomů bakterií a každá složka sama o sobě působí bakteriostaticky, kombinace je však baktericidní s velmi rychlým nástupem účinku. Pro povahu společného působení se streptograminy někdy označují jako synergistiny. Případy rezistence vůči streptograminům byly hlášeny i v zemích, v nichž streptograminy nebyly nikdy použity. Jedním z důvodů může být, že virginiamycin je přidáván do krmných směsí. Mohly se vyvinout rezistentní zvířecí kmeny, které pak byly přeneseny na člověka. Obdobně avoparcin (glykopeptidové ATB příbuzné vancomycinu) používaný v zemedělství vedl u brojlerů v Dánsku v 90. letech k rozšíření kmene Enterococcus faecium, který byl v 80 % rezistentní k vancomycinu [2]. Přehled o narůstající bakteriální rezistenci k běžně doporučovaným ATB mezi kmeny E. coli způsobující nekomplikované IMC poskytuje graf 2 [80].
Nejcennější skupinou ATB používaných také v léčbě nekomplikované cystitidy jsou z celosvětového a všeobecně medicínského pohledu bezesporu FQ. řada těchto preparátů je vysoce efektivní také u život ohrožujících infekcí a FQ jsou rovněž velmi cennými rezervními ATB pro léčbu TBC. Právě na tuto jejich důležitou úlohu by mělo být pamatováno a jejich použití u banálních infekcí by mělo být vždy pečlivě uváženo [57]. Naopak u febrilních IMC jsou FQ považovány za lék první volby také v přítomnosti rizikových faktorů a mnohdy i u nozokomiálních infekcí. Kromě širokého antimikrobiálního spektra se za jednu z největších předností považuje velmi dobrý průnik do tkání. Vysoké koncentrace ciprofloxacinu (chemická difuze ATB) jsou dosahovány i v zánětlivých ložiscích, například v abscesech a infikovaných renálních cystách, tedy místech pro jiná antibiotika téměř nedostupných. Z tohoto důvodu jsou lékem první volby pro klinika v jinak velmi složitých situacích, jakou je například febrilní IMC v terénu polycystických ledvin. V současné době kromě standardně při léčbě IMC používaných FQ, jakými jsou například norfloxacin, ofloxacin, ciprofloxacin, pefloxacin, se stále častěji uplatňují mnohé další FQ, ke kterým patří enoxacin, lomefloxacin, sparfloxacin, alatrofloxacin, gatifloxacin, gemifloxacin, fleroxacin, rufloxacin, grepafloxacin a moxifloxacin [9,31,75,107]. FQ 3. generace vykazují zvýšený efekt vůči grampozitivním bakteriím a FQ 4. generace zejména proti anaerobům. Rozšiřující se antibakteriální spektrum FQ 3. a 4. generace je však spojeno většinou také s větším výskytem NÚ a například trovafloxacin byl stažen z trhu v roce 1999. V současnosti není proto dostupný žádný parenterální preparát FQ 4. generace [74].
V posledních letech doznalo renesance také používání aminopenicillinu/BLI (b-laktamázový inhibitor). V minulosti dlouhodobým používáním aminopenicillinu (AMP) se stala většina bakteriálních kmenů rezistentních k samotnému ampicillinu a amoxicillinu. Kombinací s BLI byla obnovená širokospektrost těchto ATB. Vzhledem k vyšší ceně však jsou užívány spíše jako alternativa při nemožnosti použít FQ [89].
Podrobnější přehled o empirické iniciální léčbě nekomplikované akutní pyelonefritidy (PNF) poskytuje tab. 13. Za standardní léčbu akutní nekomplikované PNF se považuje 7–10denní ATB terapie [74]. Při těžším průběhu může být léčba zahájena parenterální aplikací antibiotika a po zlepšení stavu, které obvykle při nekomplikované pyelonefritidě nastává již za 1–3 dny, se přechází na perorální (p.o.) ATB-léčbu. Tento přechod z intravenózní (i.v.) na perorální ATB-léčbu bývá označován jako „switch therapy“ či jako sestupná léčba. K jeho výhodám patří menší ekonomická náročnost, menší invazivita a v neposlední řadě umožní léčbu mimo zdravotnické zařízení, čímž se eliminuje riziko rozvoje nozokomiální infekce. Během tohoto způsobu léčby je možná změna ATB. Například v úvodu použitý i.v. cefalosporin (CEF) 3. generace je vystřídán použitím p.o. CEF 2. generace nebo po úvodní léčbě FQ se přejde na TMP-SMX a podobně. Většinou je doporučována 1–2týdenní léčba, ale při velmi lehkém průběhu a včas zahájené léčbě může být léčba i kratší, kolem 5 dnů. Za adekvátní terapii pro většinu žen je považována i 2týdenní léčba TMP-SMX (toto doporučení je uvedeno v plné verzi Guidelines EAU, ale není zahrnuto do zkrácené verze Guidelines EAU ) [74].
Tab. 13. Přehled iniciální empirické léčby akutní nekomplikované pyelonefritidy [12,55,74,89,109]. ![Přehled iniciální empirické léčby akutní nekomplikované pyelonefritidy [12,55,74,89,109].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3988fd505eae6306883f1aca4a93da18.png)
Při léčbě akutní PNF je možná a v některých případech i vhodná kombinovaná ATB-terapie. Například kombinace gentamicinu a ampicillinu se jeví jako efektivnější než perorální monoterapie ATB i více efektivní než léčba cefalosporinem 3. generace [12]. Navíc vzhledem k postantibiotickému efektu aminoglykosidů (AGL) je možná jejich aplikace pouze v jedné denní dávce, což kromě snížení jejich toxicity umožňuje léčbu mimo lůžkové oddělení. Základní součástí léčby je kromě alespoň přechodného klidového režimu také dobrá hydratace nemocného s navozením hojné diurézy.
SLEDOVÁNÍ PO LÉČBĚ A PROFYLAXE
Neexistuje jednomyslná shoda týkající se sledování a případné profylaxe u nemocných po proběhlé léčbě nekomplikované IMC. Nicméně z výsledků proběhlých randomizovaných studií a případných metaanalýz lze opět stratifikovat celou velmi heterogenní populaci nemocných, u kterých se IMC vyskytla, na několik rozdílných podskupin. V nejpříznivějším případě se jedná o nekomplikovanou cystitidu s banálním průběhem, kdy obtíže odezněly prakticky ihned po zahájení léčby. V případě, že i po ukončení léčby je další průběh zcela bezpříznakový a anamnesticky nejsou vyjádřena rizika spojená s možností recidivy IMC, pak další vyšetření ani specifická profylaxe není potřebná [49]. V takových případech je plně dostačující poučení o charakteru onemocnění a o základních zásadách prevence IMC, která je zaměřena na ovlivnění predispozičních příčin.
Pokud se potvrdí hypotézy o možném zdroji IMC při kolonizaci uropatogenními bakteriemi u rodinných příslušníků a ostatních členů kolektivu nebo jejich přenos například potravou, bude nutné preventivní opatření zaměřit tímto směrem [66]. Obvykle bývá nemocným doporučován dostatečný a pravidelný přísun tekutin, vyvarování se prochlazení a předržování mikce a také dodržování zásad zdravého sexuálního chování včetně vymočení se po pohlavním styku [3,47,89]. Nicméně nutno podotknout, že většina těchto tradičních doporučení není podložena důkazy a většina nevede ke statisticky signifikantnímu snížení recidiv IMC [60,99].
Statisticky významně zvýšený výskyt IMC byl prokázán při užívání spermicidních látek (zvláště s obsahem nonoxynolu-9) a vaginální diafragmy. Tento zjevný faktor lze eliminovat ve spolupráci s gynekologem převodem na jiný typ antikoncepce (hormonální, postkoitální) nebo přechodně i snížit četnost pohlavního styku [4,39,60]. Dle Guidelines EAU při asymptomatickém průběhu po léčbě nemusí být kultivační vyšetření moči prováděno a pro rutinní praxi postačuje papírková metoda [74]. V každém regionu je však potřebné zajistit kontinuální monitoraci výskytu jednotivých uropatogenních kmenů a trendy výskytu rezistence k antimikrobiální léčbě [107].
Dle vlastních skutečností se již několik let v našich podmínkách osvědčuje systém odpovídající recentním názorům. Iniciální empirickou léčbu na základě papírkového vyšetření v banálních případech provádí praktický lékař, gynekolog etc. V případech, ve kterých jsou obtíže výraznější nebo se jedná o recidivu či přetrvávání symptomatologie a kdy lékaři v terénu nemají možnost nepřetržitého napojení na svoz materiálu do mikrobiologické laboratoře, jsou nemocní odesíláni do nemocnice na naši urologickou ambulanci s možností zajistit potřebná kultivační vyšetření po celý rok.
Kultivační vyšetření moči a stanovení citlivosti bakteriálních kmenů k antimikrobiální léčbě je zajištěno pro případy, které do 3 dnů neodpovídají na empirickou ATB léčbu [74] a při výskytu rizikových faktorů, které jsou uvedeny v tab. 9, 10 a 11 [37,49,74,76]. Při přetrvávání obtíží a febrilií více než 72 hod je nutné doplnění sonografie, eventuálně CT–vyšetření k vyloučení obstrukční uropatie či jiné abnormality, která by vyžadovala intervenční léčbu (zavedení ureterálního stentu, nefrostomie, drenáž zánětlivého ložiska). V případě recidivující cystitidy a po proběhlé pyelonefritidě je indikováno provedení kultivačního vyšetření moče do 2 týdnů po skončení ATB-léčby a eventuálně cílenou ATB-terapii dle nálezu bakteriologické citlivosti. ATB-léčba by měla v těchto případech trvat 2 týdny se zvážením aplikace jiného ATB. V případě, že se jedná o relaps IMC způsobený stejným patogenem, který vyvolal primární ataku IMC, by měl být 6týdenní ATB-režim kurativní [74].
Při recidivujících nekomplikovaných IMC je indikována profylaktická léčba (PL). U PL by měl přínos pro individuálního nemocného převážit nad vedlejšími NÚ a riziky pro společnost [14], protože dlouhodobé užívání ATB je dvojsečný meč spojený s rizikem nárůstu bakteriální rezistence. Indikace PL vychází z poznání, že riziko recidivy IMC může být v různých situacích statisticky výrazně sníženo podáváním ATB, a to i v subinhibičním dávkování [78,88]. Právě subinhibiční efekt redukuje NÚ a je spojen s menším rizikem rozvoje dysmikrobie ve vulvovaginální oblasti. Tento efekt byl dobře dokumentován u TMP, TMP/SMX a u FQ [60]. V průběhu let však neexistoval konsenzus v otázkách: Pro které skupiny rizikových nemocných je PL přínosná? a Jak dlouho má PL trvat?
V současnosti bylo dosaženo plné shody, že PL je přínosná a indikovaná pro několik rizikových skupin, které jsou uvedeny v tab. 14. Jednomyslné shody o délce PL zatím nebylo dosaženo a vhodné je posouzení délky na základě individuálního zhodnocení u nemocného a s ohledem, pro kterou skupinu nemocných je léčba určena. V současné době se nepovažuje rutinní používání PL za přínosné pro ABU (asymptomatická bakteriurie) u školních dívek a starých žen, u nemocných s neurogenní dysfunkcí dolních močových cest při míšní lézi, u nemocných na ČIK, s derivací močového systému s užitím střevního segmentu, při použití dlouhodobé drenáže močového systému, při imunodeficitních stavech, jako je například AIDS, ani u nemocných na jednotkách intenzivní péče [14,105]. Problémem zůstává prevence IMC u nemocných s dlouhodobější zevní derivací moči [69]. Slibné výsledky se snížením výskytu symptomatické IMC u nemocných po gynekologické operaci s přechodnou katetrizací byly nedávno publikovány při použití 5denního režimu metenaminem [98].
Tab. 14. Přehled situací, u kterých je vhodná profylaktická léčba ATB [14,12,74,96,108,109]. ![Přehled situací, u kterých je vhodná profylaktická léčba ATB [14,12,74,96,108,109].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8a7af2050973faf836d4164276b7eaf2.png)
K profylaktickým účelům se osvědčilo několik ATB a údaje týkající doporučovaných režimů pro PL jsou uvedeny v tab. 15. Několikatýdenní až několikaměsíční kontinuální léčba může být podávána denně na noc nebo v intermitentním režimu například po - st - pá. Část žen však nemá dostatečnou komplianci k dlouhodobějšímu podávání ATB PL [60]. U žen, u kterých je zřejmá vazba vzniku recidivy IMC na pohlavní styk, může být ATB podáno postkoitálně.
Tab. 15. Přehled antimikrobiálních režimů k prevenci akutní IMC u žen [74]. ![Přehled antimikrobiálních režimů k prevenci akutní IMC u žen [74].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1f7e75b673cf41984d84c2c0befc5128.png)
Ani tento způsob PL však nemusí vyhovovat. Sami ošetřujeme mladou nemocnou, která jednoznačně udává propuknutí IMC vždy v krátkém odstupu po pohlavním styku. Nemocné bylo proto doporučeno užití ATB postkoitálně. Překvapilo nás, že se nemocná ve velmi krátké době hlásila k předepsání dalších ATB. Podrobnějším rozborem anamnézy jsme zjistili, že nemocná pracuje se svým partnerem ve stejné firmě a že pár má zcela obvyklou frekvenci pohlavních styků několikrát denně v průběhu celého dne. PL v postkoitálním režimu u této nemocné nepředpokládaně vedlo k užívání ATB ve větší dávce než je obvyklá terapeutická dávka.
Další alternativou PL tak je „self start“ - -terapie. Při tomto režimu je žena vybavena dávkou ATB na 3 dny a soupravou ke kultivaci moči. Při propuknutí symptomatické IMC nemocná ihned odebere vzorek středního proudu moči do sterilní zkumavky ke kultivačnímu vyšetření a následně bez další prodlevy zahájí empirickou 3denní ATB terapii [96]. V závislosti na kultivačním nálezu a efektu předchozí empirické léčby je po 3 dnech možno přejít na cílenou ATB terapii.
Předpokladem prospěšnosti PL je dobrá informovanost a spolupráce s nemocným a v těchto případech může dojít ke snížení recidiv IMC až o 95 %. Po ukončení PL je nutno počítat s pravděpodobnou reinfekcí asi u 60 % žen během 3–4 měsíců. Je možná i delší profylaxe po dobu 1/2–1 roku [74] a u profylaxe TMP/SMX byla prokázáno přetrvávání efektivity i po 2–5 letech [34,77].
ALTERNATIVNÍ ZPŮSOBY PROFYLAXE
Obecně je alternativní léčba (AL) v profylaxi IMC bez použití ATB považována ze méně účinnou [74,60,79]. Vzhledem k narůstajícímu počtu alergií k ATB, zhoršené GIT-toleranci ATB u části nemocných a také nižší komplianci k ATB léčbě obecně [56], se však u některých žen vytváří předpoklady pro užití AL. Do této skupiny opatření se řadí acidifikace moči při užívání brusinkové šávy a extraktu z Uvae ursi či lokální instilační terapií, ovlivnění vulvovaginálního prostředí topickými estrogeny, antiseptickými krémy (povidonum iodinatum) nebo aplikací preparátů s lactobacilli. Zatím jsou největší naděje vkládány do imunostimulačních režimů, ke kterým v současnosti řadíme probiotickou léčbu a různé typy vakcín [12,60,74].
Acidifikace moči a obnovení glykosaminoglykanové (GAG) vrstvy
Tato AL recidivujících IMC vychází z poznatků, že intaktní GAG-vrstva chrání urotel před toxickými komponentami v moči a spolu s kyselým pH moči vytváří jedny ze základních faktorů obranyschopnosti močového traktu. Narušení GAG-vrstvy je spojeno s rizikem vzniku onemocnění, ke kterým patří běžné IMC, intersticiální cystitida a v neposlední řadě také možnost vzniku karcinomu (TCC) močového měchýře [50,83].
Obnovení GAG intravezikální aplikací kyseliny hyaluronové (HA) vede ke zmírnění obtíží u nemocných s intersticiální cystitidou [72,84]. Ze stejného předpokladu se vychází také při intravezikální aplikaci HA (40 mg HA v 50 ml roztoku pufrovaného fosfátu, 4krát jednou týdně a následně ještě 4 aplikace v měsíčních intervalech) v prevenci recidiv IMC. Předběžné výsledky s touto metodou publikované v letošním roce jsou velmi slibné [19], ale budou vyžadovat ověření v placebem kontrolované studii, která nyní probíhá.
Další velmi oblíbenou metodou jsou extrakty a šávy z brusnice a plodů horské brusinky (cranberry-lingonberry juice). Jejich možný bakteriostatický efekt se odvozuje na základě acidifikace moči exkrecí kyseliny hippurové v preparátech bohatě obsahujících kyselinou benzoovou [89] a inhibicí fimbriální adherence bakterií k uroteliálním buňkám [46]. Příznivý efekt byl pozorován v randomizované, dvojitě zaslepené, placebem kontrolované studii s redukcí bakteriurie a pyurie při denním pití 300 ml brusinkové šávy během 6měsíčního období [1]. Přesto denní užívání brusinkové šávy neprokázalo statisticky významné snížení výskytu symptomatických IMC a zatím není považováno řadou autorů za léčbu založenou na důkazech [43,60]. Citován může být i hodnotící výrok z expertního komentáře: „V současnosti neexistuje důkaz, že denní používání brusinkové šávy zlepšuje výsledky.“ [79]. Nicméně si tato původně lidová léčba našla hojně zájemců mezi pacienty. Rovněž mezi lékaři má díky dobré toleranci bez významnějších vedlejších účinků také nezanedbatelnou podporu a jsou nalézány další dílčí důkazy podporující zájem o využívání brusinkové šávy v prevenci IMC [25,35,58].
Estrogenní suplementace (HRT) v postmenopauze
Deficit estrogenů je spojen s negativním vlivem na urogenitální oblast. Dochází ke zvýšení původně kyselého pH a původní kolonizace vulvovaginální oblasti laktobacilem je nahrazováno kmeny enterobakterií. Následkem těchto změn je sklon k recidivujícím IMC. V současné době se HRT s celkovým či topickým podáním estrogenů považuje za přínosnou a standardní v PL recidivujících IMC v postmenopauze [74,86,89]. Velmi výhodné je perorální podávání estradiolu se současnou aplikací intravaginální. Vzhledem k tomu, že při topické léčbě je dosahováno minimálních sérových koncentrací, není se třeba obávat systémových nežádoucích účinků. Léčba estrogeny krom obnovení fyziologických poměrů v urogenitální oblasti zlepšuje prokrvení a trofiku tkání v oblasti malé pánve a zabraňuje přirozenou cestou recidivám IMC [39].
Probiotika
Koncepce probiotické léčby vychází ze snahy perorálním či intravaginálním podáním obnovit fyziologickou mikroflóru. Situace je paradoxní v tom, že tradičně je kolonizace laktobacilem považována za jeden z faktorů obranyschopnosti organizmu. Na druhé straně se objevují informace, že právě některé laktobacilární kmeny mohou být zodpovědné za obtíže charakteru uretrálního syndromu či bakteriální cystitidy. Je pravděpodobné, že dysbalance ve vaginálním prostředí může být navozena řadou kmenů a jejich rozdílnou koncentrací [12]. Byla zkoušena řada režimů s použitím jogurtů i čistých bakteriálních kultur v perorální i topické, intravaginální aplikaci [87]. Kromě obnovení fyziologického mikrobiálního prostředí vaginy se předpokládá také imunomodulační efekt probiotik. Při perorální aplikaci například dochází k aktivaci GALT (lymfatická tkáň asociovaná se střevním systémem), což vede k aktivaci T - a B-lymfocytů a následně k produkci slizničních IgA. Zlepšená obranyschopnost sliznic takovouto imunomodulací může být provedena podáváním probiotik včetně mléčných kultur. Kromě příznivého efektu v oblasti urogenitální se snížením recidiv IMC lze u části nemocných očekávat také příznivý efekt na případné GIT obtíže [67]. V současné době je význam a přínos probiotické léčby chápán hlavně v prevenci fungální vaginitidy [12].
Imunoterapie
Imunoterapie v PL recidivujících IMC představuje modalitu, do které jsou vkládány největší naděje. Již mnoho let jsou používány perorální vakcíny, které obsahující buï celé bakterie nebo extrakty z bakteriálních antigenů [90] a u kterých je pozorován zřejmý imunostimulační efekt, díky kterému dochází ke snížení frekvence a intenzity IMC [104]. Tento typ léčby vede ke zvýšení nespecifické imunitní odpovědi a zvyšuje obsah IgA na sliznicích. Nedávno publikovaná metaanalýza hodnotící 10leté zkušenosti s orální imunizací lyofilizovaným extraktem uropatogenů (Uro-Vaxom®) potvrdila efektivitu a přínosnost této léčby [11]. Obdobný efekt mají i individuálně připravované autovakcíny [5], které mohou být připraveny také ve formě nazálních kapek a injekcí [68]. Na našem pracovišti se nejvíce osvědčuje perorální typ autovakcíny ve formě kapek individuálně zhotovených mikrobiologickou laboratoří z vykultivovaného uropatogenního kmene při recidivující IMC. Kompliance řady nemocných k této dlouhodobé léčbě (několik měsíců) je lepší než k dlouhodobé antibiotické léčbě.
Sofistikovanějším přístupem je intravaginální imunizace extraktem jedním z nejdůležitějších fimbriálních antigenů FimH [63]. Jednou ze studovaných hypotéz je také metoda takzvané bakteriální interference přímo v močových cestách, ABU či kolonizace nepatogenními kmeny může naopak bránit bakteriální superinfekci uropatogeny a následnému rozvoji symptomatické infekce. Takzvané „hodné“ bakterie brání „zlým“ bakteriím v rozvoji symptomatické IMC [60]. Tuto teorii podporuje řada zjištění. Například randomizovaná studie porovnávající výskyt symptomatické IMC mezi čistou intermitentní katetrizací (ČIK) a sterilní intermitentní katetrizací (SIK) neprokázala přínos SIK ve snížení počtu symptomatických IMC, pouze výrazně zvýšila náklady u SIK [22]. Obdobně provokativní zjištění bylo poskytnuto při aktivní kolonizaci dolních močových cest u nemocných s míšní lezí. Nemocným byly do močového měchýře vstřikovány nepatogenní kmeny E. coli 83972. Tam, kde se kolonizace podařila, neměli nemocní symptomatickou IMC v průběhu dalšího roku sledování. Naopak všichni nemocní, u kterých se infikování nepodařilo, prodělali další IMC [40].
EKONOMICKÉ ASPEKTY
Celosvětově představují IMC závažný ekonomický problém. Příkladem mohou být údaje z USA. V roce 1995 byly přímé náklady na léčbu komunitních IMC vyčísleny na cca 659 milionů USD a nepřímé nákla-dy spojené s menší produktivitou na 936 milionů USD [27]. Náklady na léčbu nozokomiálních IMC byly odhadnuty na 424–451 milionů USD za rok [45]. Bylo zjištěno, že nozokomiální IMC prodlužují hospitalizaci v průměru o 2,5 dne a zvyšují náklady na 750 dolarů denně [93]. Náklady na léčbu onemocnění vyvolaných rezistentními mikroorganizmy se ve Spojených státech amerických blíží částce 4 miliardy USD za rok [24].
BUDOUCÍ SMĚRY
Očekává se, že pokroky v základním výzkumu IMC přinesou poznatky, které se uplatní v přesnější diagnostice a v zavedení nových léčebných metod. Již nyní se dá tušit, že zásadní budou aplikace molekulární genetiky [12,112]. Jako optimistická vize výzkumu se jeví vytvoření „molekulárního ochranného štítu“ s přirozenou inhibicí působení endotoxinů a podpoření likvidace bakterií uvolněním série antibiotikům podobných substancí, jako je například BPI (Bactericidal permeability-increasing protein) [17]. Při výzkumu biofilmů se rýsuje nová velmi nadějná změna: heparinem kryté povrchy stentů, cévek a dalších katetrů, což může výrazně přispět k omezení tvorby biofilmů a inkrustací a následné redukci IMC [105]. Převratné „vše řešící“ změny si však vyžádají další časově náročný výzkum, a proto je nezbytné se v nejbližším časovém horizontu zaměřit na pragmatické postupy. Zde je nutno upozornit na nutnost lepšího využití již nyní dostupných režimů a antibiotik [56,60].
MUDr. Ivan Kolombo, FEBU
urologická ambulance Městské nemocnice Turnov
Zdroje
1. Avorn J, Monane M, Gurwitz JH. Reduction of bacteriuria and pyuria after ingestion of cranberry juice. JAMA 1994; 271 : 751-754.
2. Bager F, Aarestrup FM, Madsem M, Wegener HC. Glycopeptide resistance in Enterococcus faecium from broilers and pigs following discontinued use of avoparcin. Microb Drug Resist 1999; 5 : 53-56.
3. Bailey RR. Management of lower urinary tract infections. Drugs 1993; 45(Suppl 3): 134-139.
4. Bartoníčková K. Infekce dolních močových cest. Doporučené postupy pro praktické lékaře. Projekt MZ ČR zpracovaný ČLS JEP 2001; (http://www.cls.cz/dp).
5. Bartoníčková K. Infekce močových cest u urologických nemocných. In: Teplan V et al. Infekce ledvin a močových cest v dospělém a dětském věku. Praha: Grada Publishing 2004 : 127-151.
6. Bartoníčková K. Nespecifické močové infekce. In: Dvořáček J et al. Urologie. Praha: ISV nakladatelství 1998 : 683-738.
7. Bartoníčková K. Uroinfekce. Praha: Galén 2000.
8. Bauer SB, Kord SA, Jayanthi VR. Voiding dysfunction in children: neurogenic and non-neurogenic. In: Walsh PC, Retik AB, Vaughan ED, Wein AJ. Campbell´s Urology CD-Rom. Vol 3, Section 9, Chapter 64, Copyright 2003, Elsevier Science (USA).
9. Bebear CM, Renaudin H, Schaeverbeke T et al. In-vitro activity of grepafloxacin, a new floroquinolone, against mycoplasmas. J Antimicrob Chemother 1999; 43 : 711.
10. Bébrová E. Mikrobiologické aspekty patogeneze infekcí močových cest. In: Teplan V et al. Infekce ledvin a močových cest v dospělém a dětském věku. Praha: Grada Publishing 2004 : 31-43.
11. Bichler KH. Urovaxom-a metaanalysis. Presented at 7th International Symposium on Clinical Evaluation of Drug Efficacy in UTI. International Society of Chemotherapy Commission for Urinary Tract Infection. Amsterdam, The Netherlands, July 1-3, 2001.
12. Bishop MC. Uncomplicated urinary tract infection. EAU Update Series 2004; 2 : 143-150.
13. Bishop MC. Update on urinary tract infection. EAU Update Series 2004; 2 : 93.
14. Bjerklund Johansen TE. Bacteriuria and Prophylaxis. EAU Update Series 2004; 2 : 136-142.
15. Bjerrum L, Dessau RB, Hallas J. Treatment failures after antibiotic therapy of uncomplicated urinary tract infections: A prescription database study. Scand J Prim Health Care 2002; 20 : 97-101.
16. Broïák M. Dysfunkce dolních močových cest. Medicína v praxi 2001; 5-6 : 56-58.
17. Canag G, Levy O, Furuta GT et al. Rapid mediator induced expression of bactericidal permeability increasing protein (BPI) in human mucosal epithelia. Proc Natl Acad Sci 2002; 99 : 3902-3907.
18. Cattell WR. Urinary tract infection: definitions and classifications. In: Cattell WR. Infections of the kidney and urinary tract. Oxford: Oxford University Press 1996 : 1-7.
19. Constantinides C, Manousakas T, Nikolopoulos P, Stanitsas A, Haritopoulos K, Giannopoulos A. Prevention of recurrent bacterial cystitis by intravesical administration of hyaluronic acid: a pilot study. BJU Int 2004; 93(9): 1262-1266.
20. Cooper J, Raeburn AL, Brumfitt W, Hamilton-Miller JM. General practitioner study: fosfomycin trometamol versus amoxycillin clavulanate in acute urinary tract infections. Chemotherapy 1990; 36(Suppl 1): 24-26.
21. Doyle SE, O´Connell RM, Miranda GA et al. Toll-like receptors induce a phagocytic gene program through p38. J Exp Med 2004; 199 : 81-90.
22. Duffy LM, Cleary J, Ahern S. Clean and sterile intermittent catheterization: safe, cost-effective bladder management for male residents of VA nursing homes. J Am Geriatr Soc 1995; 43 : 865-870.
23. Dvořáček J. Vyšetřovací metody moče a uretrálních sekretů. In: Dvořáček J et al. Urologie. Praha: ISV 1998; 1. vol: 125-137.
24. File TM. Overview of resistance in the 1990s. Chest 1999; 115(Suppl 3): 3-8.
25. Fleet JC. New support for a folk remedy: cranberry juice reduces bacteriuria and pyuria in elderly women. Nutr Rev 1994; 52 : 168.
26. Foxman B, Frerichs RR. Epidemiology of UTI: I. Diaphragm use and sexual intercourse. Am J Public Health 1985; 75 : 1308-1313.
27. Foxman B. Epidemiology of urinary tract infections: Incidence, morbidity and economic costs. Am J Med 2002; 113 (Suppl 1A): 5-13.
28. Frendeus B, Godaly G, Hang L, Karpman D, Svanborg C. Interleukin-8 receptor deficiency confers susceptibility to acute pyelonephritis. J Infect Dis 2001; 183(Suppl 1): S 56-60.
29. Ganz T. Defensins. Antimicrobial peptide sof innate imunity. Nature Rev Immunol 2003; 3 : 710-720.
30. Godaly G, Bergsten G, Hang L, Fischer H, Frendeus B, Lundstedt AC. Neutrophil recruitment, chemokine receptors, and resistence to mucosal infection. J Leukoc Biol 2001; 69(6): 899-906.
31. Hannan PC, Woodnutt G. In vitro activity of gemifloxacin (SB265805;LB20304a) against human mycoplasmas. J Antimicrob Chemother 2000; 45 : 367.
32. Hanuš T, Zámečník L. Diagnostika. In: Intersticiální cystitida. Hradec Králové: NUCLEUS HK 2002 : 13-33.
33. Hanuš T. Tuberculosis of the urinary tract. In: Course book of 2nd European Urological Winter Escape Meeting, Tenerife, Spain 2003. Arnhem: ESU Office 2003; 78-92.
34. Harding GK, Ronald AR, Nicolle LE, Thomson MJ, Gray GJ. Long-term antimicrobial prophylaxis for reccurent urinary tract infection in women. Rev Infect Dis 1982; 4 : 438-443.
35. Henig YS, Leahy MM. Cranberry juice and urinary-tract health: science supports folklore. Nutrition 2000; 16 : 684.
36. Hooton TM, Scholes D, Hughes JP. A prospective study of risk factors for symptomatic urinary tract infection in young women. N Engl J Med 1996; 335 : 468-474.
37. Hooton TM. Recurrent urinary tract infection in women. Int J Antimicrob Agents 2001; 17 : 259-268.
38. Horáčková M . Infekce močového traktu - vyšetřovací metody. In: Teplan V, Horáčková M, Bébrová E, Janda J et al. Infekce ledvin a močových cest v dospělém a dětském věku. Praha: Grada Publishing 2004 : 17-30.
39. Horčička L, Kolařík D. Záněty dolních močových cest. In: Halaška M et al. Urogynekologie. Praha: Galén 2004; 63-69.
40. Hull R, Rudy D, Donova D, Svanborg C, Wiesner I, Stewart C et al. Urinary tract infection prophylaxis using Escherichia coli 83972 in spinal cord injured patients. J Urol 2000; 163 : 872.
41. Chmel R. Močová inkontinence a uroinfekce u žen v postmenopauze. Lek Listy 2003; 38 : 19-22.
42. Jakobsson B, Esbjorner E, Hansson S. Minimum incidence and diagnostic rate of first urinary tract infection. Pediatrics 1999; 104 : 222-226.
43. Janda J. Infekce močových cest u dětí. In: Teplan V, Horáčková M, Bébrová E, Janda J et al. Infekce ledvin a močových cest v dospělém a dětském věku. Praha: Grada Publishing 2004 : 93-114.
44. Jantausch PA, Rifai N, Getson P, Akrem S, Majd M, Wiedermann BL. Urinary N-acetyl-beta-glukosaminidase and beta-2-microglubulin in the diagnosis of urinary tract infections in fibrile infants. Pediatr Infect Dis J 1994; 13(4): 294-299.
45. Jarvis WR. Selected aspectsof the socioeconomic impact of nosocomial infections: morbidity, mortality, cost, and prevention. Infect Control Hosp Epidemiol 1996; 17 : 552-557.
46. Jepson RG, Mihaljevic, L, Craig J. Cranberries for the prevention of urinary tract infections (Cochrane Review). In: Cochrane Library, Issue 4. Oxford: Update Software 1998.
47. Karram MM. Lower urinary tract infection. In: Ostergard DR, Bent AE (eds). Urogynecology and urodynamics: theory and practice. 3rd ed. Baltimore: Williams & Wilkins 1991; 306-328.
48. Kass EH. Asymptomatic infections of the urinary tract. Trans Assoc Am Physcians 1956; 69 : 56.
49. Kasten MJ, Olson D, Marroquin R, Grubbs N, Strike D, Robinson S, Greer N, Meyer J. Health Care Guideline: Uncomplicated Urinary Tract Infection in Women. 9th ed. Bloomington: Institute for Clinical Systems Improvement Health Care Guideline (www.icsi.org) 2004 : 1-21.
50. Kaufman JE, Anderson K, Parsons CL. Inactivation of antiadherence effect of bladder surfaře glycosaminoglycans as possible mechanism for carcinogenesis. Urology 1987; 30 : 255-288.
51. Kawaciuk I. Nespecifické infekce v urogenitálním systému In: Kawaciuk I. Urologie obecná a speciální. Jinočany: H&H vydavatelství 1992 : 78-99.
52. Kladenský J, Pacík D, Čermák A. Nifuratel tbl. v léčbě akutní nekomplikované uroinfekce. Česká urologie 1998; 5 : 8-10.
53. Kladenský J, Pacík D. Infekce močových cest u dopělých. Aspekty komplikací nesprávné či pozdní diagnózy a neadekvátní léčby. Forum Medicinae 2001; 4 : 21-26.
54. Klečka J, Hora M, Boudová L, Michal M. Cystitis cystica - příčiny, diagnostika, léčba: kasuistika. Česká urologie 2003; 2 : 33-36.
55. Kolář M, Čekanová L, Urbánek K, Koukalová D. Antibiotická léčba komunitních infekcí dolních močových cest. Urolog pro praxi 2002; 3 : 242-245.
56. Kolombo I, Berndt D, Pabišta R, Smetana L, Porš J et al. Problémy současných STD v naší urologické praxi. Urologie pro praxi 2004; 5 : 29-30.
57. Kolombo I, Berndt D, Pabišta R, Smetana L, Porš J et al. TBC v ordinaci urologa - stále aktuální téma.Urologie pro praxi 2003; 4 : 251-253.
58. Kontiokari T, Sundquist K, Nuutinen M, Pokka T, Koskela M, Uhari M. Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women. BMJ 2001; 322 : 1571.
59. Krčméry S. Predhovor. In: Teplan V et al. Infekce ledvin a močových cest v dospělém a dětském věku. Praha: Grada Publishing 2004 : 13-14.
60. Krieger JN. Urinary tract infections: What´s new? J Urol 2002; 168 : 2351-2358.
61. Kucheria R, Sheerin NS, Dasgupta P, Khan MS. Urinary tract ifections: advenced and new therapies. BJU Int 2004; 93(6): 690-691.
62. Kunin CM. Guidelines for the evaluation of new anti-infective drugs for the treatment of UTI: additional consideration. Clin Inf Dis 1992; 15 : 1041-1044.
63. Langermann S, Mollby R, Burlein JE et al. Vaccination with FimH adhesin protects cynomolgus monkeys from colonization and infection by uropathogenic E. coli. J Infect Dis 2000; 181 : 774-778.
64. Leibovici L, Wysenebek AJ. Single dose antibiotik treatment for symptomatic urinary tract infections in women: an analysis of randomised trials. Q J Med 1991; 285 : 43-57.
65. Louda M, Žák P, Pacovský J, Salavec M, Loudová M, Zachoval R, Ságlová S. Toxická epidermální nekrolýza u pacienta léčeného trimethoprim/sulfamethoxasolem. Česká urologie 2001; 5 : 12-14.
66. Manges AR. Molecular epidemiology of acute, uncomplicated urinary tract infections in young women. Curr Infect Disease Rep 2003; 5 : 504-509.
67. Matoušková M, Rollová M. Imunomodulace probiotiky v léčbě recidivujících zánětů dolních močových cest. Česká urologie 2001; 4 : 39 (abstrakt 52).
68. Matoušková M, Rollová M. Význam imunostimulační léčby u recidivujících zánětů dolních močových cest. Česká urologie 2000; 3 : 34 (abstrakt 51).
69. Mečl J. Naše přístupy pro antibakteriální profylaxi urologických výkonů. Česká urologie 2000; 3 : 34 (abstrakt 50).
70. Members of the ECLM and ESCMID Working Party, Articles European Urinalysis Guidelines: Summary Scandinavian Journal of Clinical and Laboratory Investigation. Vol. 60, No.4, Suppl. 231, August 2000.
71. Merta M. Infekce horních cest močových - akutní pyelonefritida. Lék Listy 2002; 22 : 14-16.
72. Morales A, Emerson L, Nickel JC. Intravesical hyaluronic acid in the treatment of refraktory interstitial cystitis. Urology 1997; 49(Suppl 5A): 111-113.
73. Mulvey MA, Joel SD, Hultgren SJ. Establishment of a persistent Escherichia coli reservoir during the acute phase of a bladder infection. Infection Immunity 2001; 69 : 4572-4579.
74. Naber KG, Bergman B, Bishop MC, Bjerklund Johansen TE, Botto H, Lobel B, Jimenez Cruz F, Selvaggi FP. Guidelines of Urinary and Male Genitál Tract Infections. European Association of Urology (Update March 2004) (http://www.uroweb.org/).
75. Naber KG. Complicated urinary tract infections - part two. In: Naber KG. Lectures in hospital infections. London: Science Press Ltd 2003 : 1-13.
76. Nickel JC. Akutní pyelonefritida u dospělých. AUA Update Series 2003, české vydání. Praha: MMN - Mezinárodní medicínské nakladatelství 2003.
77. Nicolle LE, Harding GK, Thomson M, Kennedy J, Urias B, Ronald AR. Efficacy of five years of continuous, low-dose trimethoprim-sulfamethoxazole prophylaxis for urinary tract infection. J Infect Dis 1988; 157 : 1239-1242.
78. Nicolle LE, Ronald AR. Recurrent UTI in adult women: diagnosis and treatment. Inf Dis Clin North Am 1987; 1 : 793-806.
79. Nicolle LE. Urinary tract infection in long-term-care facilities. Clin Infect Dis 2000; 31 : 757.
80. Nicolle LE. Urinary tract infection: traditional pharmacologic therapies. Am J Med 2002; 113(Suppl 1A): 35S-44S.
81. Norrby SR. Short term treatment of uncomplicated lower urinary tract infections in woman. Rev Infect Dis 1990; 12 : 458-467.
82. Okada H, Shigemura K, Tanaka K, Hinata N, Shirakawa T, Gotoh A, Hamaguchi Y, Arakawa S, Kamidono S. A new rapid bacterial drug susceptibility testing method in the urinary tract infection using flow-cytometry. Jour Urol 2003; 169(Suppl 4): 7.
83. Parsons CL. Bladder surface glycosaminoglycans - efficient mechanism of environmental adaption. Urology 1986; 27(Suppl 2): 9-14.
84. Parsons CL. Epithelial coating techniques in the treatment of interstitial cystitis. Urology 1997; 49(Suppl 5A): 100-104.
85. Quatan N, Kirby RS. Improving outcomes in Fournier´s gangrene. BJU Int 2004; 93(9): 691-692.
86. Raz R, Stamm WE. A controlled trial of intravaginal estriol in postmenopausal women with reccurent urinary tract infections. N Engl J Med 1993; 329 : 753-756.
87. Reid G, Bruce AW, Tailor M. Instillation of lactobacillus and stimulation of indigenous organism to prevent recurrent UTI. Micro Exil Ther 1995; 23 : 32-45.
88. Reid G. Potential preventative strategies and therapies in UTI. World J Urol 1999; 17 : 359-363.
89. Ribeiro RM, Rossi P, Pacetta AM, Haddad JM, Pinotti JA. Therapy of uncomplicated urinary tract infections. Int Urogynecol J 2002; 13 : 190-194.
90. Roberts JA, Kaack MB, Langermann S. FIMCH vaccine against a pyelonephritic E. coli. J Urol 2001; 165(Suppl): 27.
91. Rubin RH, Shapiro ED, Andriol VT, Davies RJ, Stamm WE, with modifications by a European Working Party. General guidelines for the evaluation of new anti-infective drugs for the treatment of UTI. Taufkirchen, Germany. The European Society of Clinical Microbiology and Infectious Diseases 1993; 294-310.
92. Rubin RH, Shapiro ED, Andriol VT, Davies RJ, Stamm WE. Evaluation of new anti-infective drugs for the treatment of UTI. Clin Infect Dis 1992; 15(Suppl 1): S216-S227.
93. Rutledge KA,MacDonald HP. Costs of treating simple nosocomial urinary tract infection. Urology 1985; 26(Suppl 1): 24-26.
94. Sabra R. Uroinfekce v dospělém věku. In: Sabra R et al. Infekce v urologii. Praha: StudioGea 1995; 44-66.
95. Sanford JP. Urinary tract symptomas and infections. Ann Rev Med 1975; 26 : 485-496.
96. Schaeffer AJ, Stuppy BA. Efficacy and safety of selfstart therapy in women with reccurent urinary tract infections. J Urol 1999; 161 : 207.
97. Schaeffer AJ. Infections of the urinary tract. In: Walsh PC, Retik AB, Vaughan ED, Wein AJ. Campbell´s Urology CD-Rom, Vol 1, Section 4, Chapter 14, Copyright 2002, Elsevier Science (USA).
98. SchiOtz HA, Guttu K. Value of urinary prophylaxis with methenamine in gynecologic surgery. Acta Obstet Gynecol Scand 2002; 81 : 743-746.
99. Scholes D, Hooton TM, Roberts PL, Stapleton AE, Gusta K, Stamm WE. Risk factors for recurrent urinary tract infection in young women. J Infect Dis 2000; 182 : 1177.
100. Springall T, Sheerin NS, Abe K, Bolera VM, Wan H, Sacks SH. Epithelial secretion of C3 promotes colonization of the upper urinary tract by Escherichia coli. Nature Med 2001; 7 : 803-808.
101. Stamm WE. An epidemic of urinary tract infection? New Engl J Med 2001; 14 : 1055-1056.
102. Svanborg C, Bergsten G, Fischer H, Frendeus B, Godaly G, Gustafsson E. The "innate" host response protects and damages the infected urinary tract. Ann Med 2001; 33(9): 563-570.
103. Takashi D, Schin-ichi M. Mycoplasma genitalium: Another important pathogen of nongonococcal uretritis. J Urol 2002; 167 : 1210-1217.
104. Tammen H. The German urinary tract infection study group. Immunobiotherapy with urovaxom in recurrent urinary tract infection. Br J Urol 1990; 65 : 6-9.
105. Tenke P, Jackel M, Nagy E. Prevention and treatment of catheter-associated infections: Myt hor reality? EAU Update Series 2004; 2 : 106-115.
106. Vrána J. Infekce močových cest u dětí. Urologie pro praxi 2004; 1 : 10-13.
107. Wagenlehner FME, Naber KG. Antibiotics and resistence of uropathogens. EAU Update Series 2004; 2 : 125-135.
108. Watson AR. Pediatric urinary tract infection. EAU Update Series 2004; 2 : 94-100.
109. Weiser AC, Schaeffer AJ. Antimikrobní léčiva v urologii: správná a nesprávná preskripce. AUA Update Series 2002, české vydání. Praha: MMN - Mezinárodní medicínské nakladatelství 2002.
110. World Health Organization Report on the Tuberculosis Epidemic, 1997. Geneva, Switzerland, WHO 1997.
111. Wullt B, Bergsten G, Connell H, Rolland P, Gebretsadik N, Hull R. P fimbriae enhance the early establishment of Escherichia coli in the human urinary tract. Mol Microbiol 2000; 38(3): 456-64.
112. Wullt B, Bergsten G, Fischer H. Application of laboratory research in UTI. EAU Update Series 2004; 2 : 116-124.
113. Zachoval R, Záleský M, Heráček J, Lukeš M, Kuncová J, Urban M. Neurogenní dysfunkce dolních močových cest. Urol pro praxi 2004; 2 : 73-77.
114. Zámečník L. Močové infekce - nespecifické infekce horních močových cest. Postgraduální medicína 2003; 8 : 824-827.
115. Zvara V. Symptomatológia urologických chorôb. In: Zvara V et al. Klinická urológia. Martin: Vydavatelstvo Osveta 1990 : 53-61.
Štítky
Detská urológia Urológia
Článek MYKOTICKÉ INFEKCEČlánek EditorialČlánek CHRONICKÉ PÁNEVNÍ BOLESTIČlánek SEPTICKÝ ŠOK U UROINFEKCÍČlánek GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH CEST, VČETNĚ POHLAVNÍCH CEST U MUŽŮ1. ČÁSTČlánek KVÍZ
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2005 Číslo 2- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- NEKOMPLIKOVANÉ UROINFEKCE: CO JE NOVÉHO A CO SE ZMĚNILO
- KOMPLIKOVANÉ UROINFEKCE: CO JE NOVÉHO A CO SE ZMĚNILO
- INFEKCIE MOČOVÝCH CIEST U DETÍ A V TEHOTENSTVE
- MYKOTICKÉ INFEKCE
- Editorial
- UROGENITÁLNÍ TUBERKULÓZA NA POČÁTKU 3. TISÍCILETÍ
- CHRONICKÉ PÁNEVNÍ BOLESTI
- PRINCIPY ANTIMIKROBIÁLNÍ LÉČBY U UROINFEKCÍ
- SEXUÁLNĚ PŘENOSNÁ ONEMOCNĚNÍ Z POHLEDU UROLOGA
- SEPTICKÝ ŠOK U UROINFEKCÍ
-
GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH CEST, VČETNĚ POHLAVNÍCH CEST U MUŽŮ
1. ČÁST - KVÍZ
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- MYKOTICKÉ INFEKCE
- INFEKCIE MOČOVÝCH CIEST U DETÍ A V TEHOTENSTVE
- SEPTICKÝ ŠOK U UROINFEKCÍ
-
GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH CEST, VČETNĚ POHLAVNÍCH CEST U MUŽŮ
1. ČÁST
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



