-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
BRACHYTERAPIE V LÉČBĚ KARCINOMU PENISU
BRACHYTHERAPY IN THE TREATMENT OF PENILE CARCINOMA
Carcinoma of the penis is a rare tumour of the male urogenital tract, which may be treated by using several modalities. Interstitial brachytherapy is an effective organ sparing treatment for tumors of less than 4 cm in diameter with no invasion of the corpora cavernosa. This modality permits to achieve the local control of penile carcinoma in 80% of patients while conserving penile morphology and function.
KEY WORDS:
penile cancer, brachytherapy, radiotherapy
Autori: MUDr. Martin Doležel; doc. MUDr. Jiří Petera, Ph.D.; doc. MUDr. Karel Odrážka, Ph.D.
Pôsobisko autorov: Klinika onkologie a radioterapie LF UK a FN Hradec Králové
Vyšlo v časopise: Urol List 2005; 3(4): 22-25
Súhrn
Karcinom penisu je vzácný nádor urogenitálního systému, který může být léčen několika modalitami. Intersticiální brachyterapie je efektivní, orgán zachovávající léčebná metoda pro pacienty s tumory do velikosti 4 cm bez invaze do kavernózních těles. V těchto případech se dosahuje lokální kontroly u 80 % pacientů při zachování orgánu i funkce.
KLÍČOVÁ SLOVA:
karcinom penisu, brachyterapie, radioterapieÚVOD
Karcinom penisu je vzácně se vyskytující nádor. S incidencí 1 : 100 000 tvoří u mužů méně než 1 % všech tumorů [5]. V ČR bylo v roce 2000 hlášeno 69 nových případů [18].
Histologicky patří tumory penisu ve více než 95 % mezi dlaždicobuněčné karcinomy. Zbývajících 5 % připadá na sarkomy, bazaliomy, lymfom a Kaposiho sarkom. Raritně se může na penisu manifestovat metastatická diseminace karcinomu prostaty, močového měchýře, rektosigmatu či ledviny [1].
Karcinom penisu postihuje ve 48 % glans, ve 21 % preputium, v 9 % glans i preputium, v 6 % sulcus coronarius a ve 2 % corpus penis [26]. Palpovatelné ingvinální uzliny jsou přítomny u 50 % pacientů, avšak jen u poloviny z nich se histologicky prokáže přítomnost tumoru. Naopak u 20 % pacientů s klinicky negativními uzlinami je zachycena mikroskopická diseminace [3]. S rizikem postižení lymfatických uzlin (LU) úzce souvisí způsob růstu. Povrchově se šířící karcinomy metastazují ve 42 %, vertikálně rostoucí tumory v 82 % a multicentrické karcinomy ve 33 %. Lymfatické šíření verukózních karcinomů je vzácné [1].
Postižení lymfatických uzlin je významným prognostickým faktorem. Zatímco 5leté přežití u pacientů s negativními uzlinami je až 95%, u nemocných s nálezem 1–3 LU již 81% a u pacientů mnohočetným postižením pouze 50%. 5leté přežití u pacientů s postižením pánevních uzlin je raritní [23].
LÉČBA
Vzhledem k vzácnému výskytu se způsob léčby neopírá o žádné randomizované studie, ale je založen pouze na retrospektivních zkušenostech.
Nosnou modalitou je chirurgická resekce. Ideální výkon by měl eliminovat onemocnění při zachování sexuální a urologické funkce. I s ohledem na fakt, že přibližně 20 % nemocných je mladších 40 let, mohou být radikálnější výkony pro některé z pacientů psychologicky devastující. V indikovaných případech může část z nich profitovat z orgán zachovávajících léčebných alternativ. Případné lokální recidivy lze řešit chirurgicky bez vlivu na prognózu [29].
Primární tumor
Pacienti s nádory Ta1 G1-2 jsou vhodnými kandidáty pro penis zachovávající léčebné výkony (laser, lokální excize s rekonstrukcí, radioterapie, amputace glandu), přitom není prokázán rozdíl v míře lokální recidivy mezi jednotlivými modalitami.
Pokročilejší stadia (T1G3, T ≥ 2) jsou dle rozsahu indikována k parciální či radikální amputaci, příp. emaskulinizaci. Metodou volby je radioterapie.
Roli chemoterapie je zatím nutno přes počáteční slibné výsledky v neoadjuvantním, adjuvantním i v konkomitantním podání dále ozřejmit ve větších studiích [8,11,22].
Regionální lymfatické uzliny
Léčebná strategie u pacientů s klinicky negativními lymfatickými uzlinami je nejednoznačná. Názory na profylaktickou ingvinální lymfadenektomii jsou vzhledem k významné morbiditě a omezenému přínosu kontroverzní [14,16]. V rozhodnutí o léčebném postupu se proto bere ohled na rozsah nemoci, histopatologický grading, charakter růstu a celkový stav nemocného.
European Association of Urology doporučuje u pacientů s vysokým rizikem výskytu okultních lymfatických metastáz (T ≥ 2 nebo G3) modifikovanou či radikální lymfadenektomii a u nemocných s nízkým rizikem (Ta G1-2, T1 G1) důslednou dispenzarizaci. Léčba nádorů T1 G2 závisí na přítomnosti lymfangioinvaze a charakteru růstu tumoru.
U nemocných s palpovatelnými uzlinami je doporučena bilaterální radikální lymfadenektomie. V případě histologicky potvrzené přítomnosti 2 a více lymfatických uzlin (LU) či extrakapsulárního růstu je nutná adjuvantní léčba.
Radioterapie
Zásadní výhodou radioterapie je její schopnost zachovat plně funkční orgán. V minulosti ovšem malé celkové dávky, vysoké dávky na jednotlivou frakci a nedokonalé ozařovací techniky vedly k nedostatečné dávkové distribuci, jež měla za následek špatnou lokální kontrolu při významné pozdní toxicitě [9,10,17,20]. V současnosti se optimalizací frakcionace i techniky dosahuje lokální kontroly srovnatelné s chirurgickým výkonem (tab. 2).
Tab. 1. Teleterapie v léčbě karcinomu penisu [21]. ![Teleterapie v léčbě karcinomu penisu [21].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2e5bb85edb37e65dcaefaa2b798db0e8.png)
Rovněž v léčbě klinicky negativních ingvinálních lymfatických uzlin došlo ke změně přístupu. Zatímco v ranějších pracích [9,14,17,24] nebyl prokázán benefit profylaktické iradiace, v současné době přináší radioterapie regionální kontrolu až v 95 % případů [13,21].
Zvláštní úlohu hraje v léčbě karcinomu penisu brachyterapie.
Brachyterapie
Brachyterapie (BT) je technika charakterizovaná vysokou konformitou (vysokou dávkou záření v místě tumoru s prudkým poklesem do okolí) a velkou nehomogenitou (významným rozdílem v absorbované dávce v cílovém objemu). Umožňuje proto aplikovat v relativně krátkém čase velkou dávku do tumoru se šetřením zdravých tkání v okolí. Dle dávkového příkonu (množství absorbované dávky za časovou jednotku) se dle ICRU No. 38, resp. No. 58 rozděluje na brachyterapii s nízkým dávkovým příkonem (LDR: 0,4–2 Gy/h), středním dávkovým příkonem (MDR: 2–12 Gy/h) a s vysokým dávkovým příkonem (HDR: více než 12 Gy/h).
Indikací pro samostatnou brachyterapii jsou tumory do velikosti 4 cm lokalizované na glans, nepřesahující sulcus coronarius [28]. Před zahájením léčby musí pacient podstoupit cirkumcizi. Tato totiž umožňuje optimální stanovení cílového objemu a současně signifikantně snižuje postradiační komplikace.
Technika
Brachyterapie může být aplikována buï intersticiálně, nebo formou povrchové muláže. Muláž je indikována jen u povrchových, dobře ohraničených tumorů invadujících max. do 5 mm [28]. Při užití této techniky je zdroj záření aplikován do katétrů, které jsou dle uložení tumoru upevněny ve speciální, individuálně připravené formě přiléhající na povrch glandu tak, aby byla při ozáření pokryta veškerá oblast tumoru s patřičným lemem. Při použití LDR BT musí být forma fixována k penisu vzhledem k hrozící dislokaci v průběhu iradiace.
Při intersticiální brachyterapii jsou v celkové anestezii (po předchozí aplikaci permanentního katétru - PMK pro determinaci uložení uretry a snížení rizika jejího poškození) zaváděny přímo do tumoru „afterloadingové“ jehly, do nichž je následně zaveden zdroj záření. Jejich orientace v prostoru by měla odpovídat geometrickým pravidlům Pařížského systému. Dle rozsahu tumoru mohou být aplikovány v 1 či více rovinách. Jehly jsou fixovány v improvizované, či komerčně vyráběné šabloně. Nejčastěji se používají 2 průsvitné plastové destičky s perforovanými otvory o průměru 1 mm ve vzdálenosti 5 mm. Možnost fixace destiček ve 2 paralelních rovinách umožňuje nejen zachovat postavení jehel, ale rovněž ulehčuje jejich vlastní zavedení v požadovaném optimálním geometrickém postavení. Někteří autoři doporučují v průběhu léčby profylaktickou antikoagulaci [6].
Cílový objem (CTV) zahrnuje makroskopický tumor (GTV) s 5–10mm bezpečnostním lemem při současném maximálním možném šetření uretry [28].
VÝSLEDKY
Veškerá publikovaná literatura o brachyterapii se týká léčby s nízkým dávkovým příkonem. V takovém případě je doporučená dávka (minimal target dose) LD 65 Gy kontinuálně v 6–7 dnech při dávkovém příkonu 40 cGy/h.
V publikovaných studiích zabývajících se BT karcinomu penisu (tab. 1) bylo léčeno více než 500 pacientů, z nichž 80 % mělo stadium T1 nebo T2. Lokální kontroly bylo dosaženo v 80–85% případů při 5letém přežití (OS) 70–75%. Penis byl zachován u 80 % pacientů [2,7,12,15, 19,25,27].
Tab. 2. LDR–brachyterapie v léčbě karcinomu penisu [28]. ![LDR–brachyterapie v léčbě karcinomu penisu [28].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ce1591dc34495292857867dbec5c31ed.png)
Postradiační komplikace byly sledovány u 20–30 % pacientů. Nejčastější akutní poradiační reakcí je mukozitida, která je někdy komplikována infekcí močových cest. Nejvýznamnějšími pozdními komplikacemi jsou nekróza a striktura uretry. Striktura se vyskytuje u 10–20 % pacientů a je ve více než v 90 % případů úspěšně řešena dilatací. Nekróza postihuje 10–15 % pacientů [4,6].
Je velice důležité rozlišit poradiační nekrózu od recidivy. Neuváženě časný invazivní odběr k histologické verifikaci může totiž několikanásobně prodloužit dobu hojení nekrózy. Daleko vhodnější je (přes svou omezenou specificitu) cytologický stěr. Častěji je možno pozorovat mírné teleangiektatické a fibrózní změny, které však nemají vliv na funkci orgánu a kvalitu života.
Obr. 1. Intersticiální HDR–brachyterapie. 
Obr. 2. Izodózový plán aplikace. 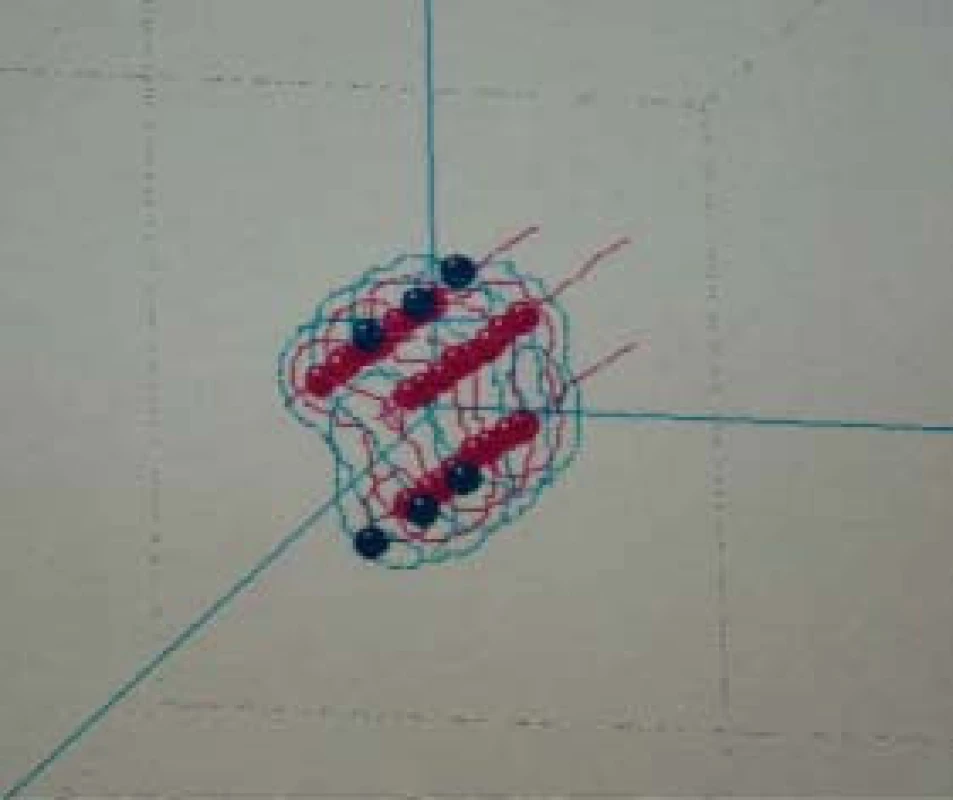
Obr. 3. Kontrola po 12 měsících. 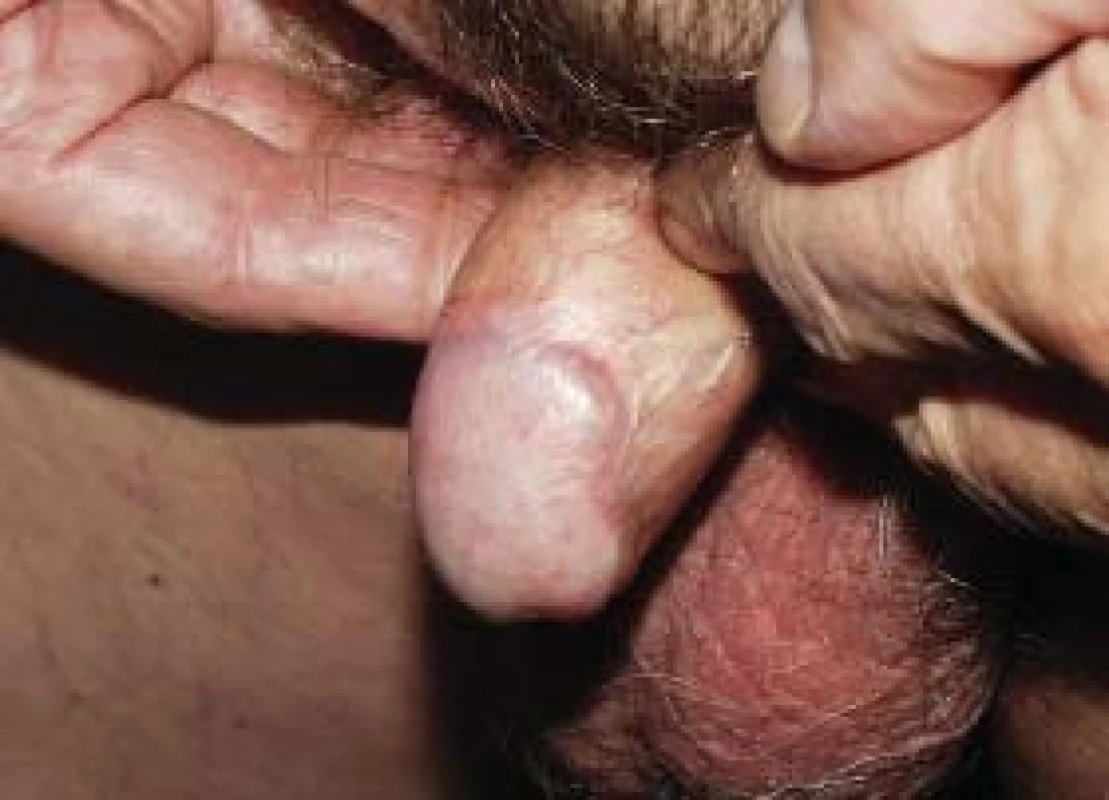
V současnosti na mnoha pracovištích nahradila brachyterapii s manuálním zaváděním LDR–zdrojů brachyterapie s vysokým dávkovým příkonem (HDR) používající automatické „afterloadingové“ přístroje. Kromě vyššího stupně radiační bezpečnosti a kratšího ozařovacího času umožňuje tato technika i optimalizaci dávky v jednotlivých referenčních bodech. Nevýhodou je zúžení terapeutického intervalu (rozdíl mezi dávkou kurativní a dávkou vyvolávající radiační komplikace).
Přestože zkušenosti s HDR–brachyterapií v léčbě karcinomu penisu nebyly dosud v literatuře publikovány, pokusili jsme se na naší klinice o její provedení u 2 pacientů s exofytickým tumorem T1N0M0. Použili jsme frakcionační schéma 54 Gy a 3 Gy v 18 frakcích aplikované 2krát denně v odstupu minimálně 6 h (umožňující reparaci zdravých tkání). Akutní postradiační reakce (edém a mukozitida) odezněla do 6 týdnů. Drobná povrchní postradiační nekróza o velikosti 3 mm (resp. 2 mm) se zhojila u obou pacientů do 3 měsíců.
V současné době jsou oba pacienti (28 a 9 měsíců) bez známek recidivy.
ZÁVĚR
Brachyterapie je adekvátní alternativou chirurgického výkonu, která dává až 75% šanci na vyléčení se zachováním plně funkčního orgánu.
MUDr. Martin Doležel
doc. MUDr. Jiří Petera, Ph.D.
doc. MUDr. Karel Odrážka, Ph.D.
Klinika onkologie a radioterapie LF UK a FN Hradec Králové
Zdroje
1. Abeloff MA, Armitage JO, Lichter AS et al (eds). Clinical Oncology. 2nd ed. New York: Churchill Livingstone 2000.
2. Akimoto T, Mitsuhashi N, Takahashi I. Brachytherapy for penile cancer using silicon mold. Oncology 1997; 54(1): 23-7.
3. Burgers JK, Badalament RA, Drago JR. Penile cancer. Clinical presentation, diagnosis and staging. Urol Clin N Am 1992; 19 : 247-256.
4. Chaudhary AJ, Ghosh S, Bhalavat RL: Interstitial brachytherapy in carcinoma of the penis, Strahlenther Onkol 1999; 175(1): 17-20.
5. Crawford ED, Dawkins CA. Cancer of the penis. In: Skinner DG, Lieskovsky G (eds). Diagnosis and management of genitourinary cancer. Philadelphia: WB Saunders 1988 : 549-563.
6. Crook J, Grimard L, Tsihlias J. Interstitial brachytherapy for penile cancer: an alternative to amputation. J Urol 2002; 167(2/1): 506-11.
7. Delannes M, Malavaud B, Douchez J. Iridium-192 interstitial therapy for squamous cell carcinoma of the penis. Int J Radiat Oncol Biol Phys 1992; 24(3): 479-483.
8. Edsmyr F, Andersson L, Esposti PL. Combined bleomycin and radiation therapy in carcinoma of the penis. Cancer 1985; 56 : 1257-1263.
9. Ekstrom T, Edsmyr F. Cancer of the penis: A clinical study of 229 cases. Acta Chir Scan 1958; 115 : 25-45.
10. Engelstad RG. Treatment of cancer of the penis at the Norwegian Radium Hospital. Radiology 1948; 60 : 801-806.
11. Fisher HA, Barada JH, Horton J. Neoadjuvant therapy with cisplatin and 5-fluorouracil for stage III squamous cell carcinoma of the penis. J Urol 1990; 146 : 653.
12. Gerbaulet A, Lambin P, Haie-Meder C. Brachytherapy in cancer of the penis. Ann Urol 1994; 28(6-7): 306-311.
13. Henderson RH, Parsons JT, Morgan L. Elective ilioinguinal lymph node irradiation. Int J Radiat Oncol Biol Phys 1984; 10(6): 811-819.
14. Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. Part 2: The Role and Technique of Lymph Node Dissection. BJU Int 2001; 88(5): 473-83.
15. Kiltie AE, Elwell C, Close HJ. Iridium-192 implantation for node-negative carcinoma of the penis: the Cookridge Hospital experience. Clin Oncol (R Coll Radiol) 2000; 12(1): 25-31.
16. Misra S, Chaturvedi A, Misra NC. Penile carcinoma: a challenge for the developing world. Lancet Oncol 2004; 5(4): 240-247.
17. Murrell DS, Williams JL. Radiotherapy in the treatment of carcinoma of the penis. Br J Urol 1965; 37 : 212-222.
18. Mazanová V. Incidence nádorů v ČR 2000. ÚZIS ČR, NOR ČR: Praha 2004.
19. Mazeron JJ, Langlois D, Lobo PA. Interstitial radiation therapy for carcinoma of the penis using iridium 192 wires: the Henri Mondor experience (1970-1979). Int J Radiat Oncol Biol Phys 1984; 10(10): 1891-1895.
20. Newaishy GA, Deeley TJ. Radiotherapy in the treatment of carcinoma of the penis. Br J Radiol 1968; 41 : 519-521.
21. Perez CA, Brady LW, Halperin EC (eds). Principles and Practice of Radiation Oncology. 4th ed. New York: Lippincott-Raven Publishers 2004.
22. Pizzocaro G, Piva L, Nicolai N. Treatment of lymphatic metastasis of squamous cell carcinoma of the penis: experience at the National Tumor Institute of Milan. Arch Ital Urol Androl 1996; 68 : 169-172.
23. Ravi R. Correlation between the extent of nodal involvement and survival following groin dissection for carcinoma of the penis. Br J Urol 1993; 72 : 817.
24. Ravi R, Chaturvedi HK, Sastry DV. Role of radiation therapy in the treatment of carcinoma of the penis, Br J Urol 1994; 74(5): 646-651.
25. Rozan R, Albuisson E, Giraud B. Interstitial brachytherapy for penile carcinoma: a multicentric survey (259 patients). Radiother Oncol 1995; 36(2): 83-93.
26. Sufrin G, Huber R. Benign and malignant lesions of the penis. In: Gillenwater JY, Grayhack JT, Howards SS (eds). Adult and Pediatric Urology. 2nd ed. St. Louis: Mosby-Year Book 1991 : 1643.
27. Suchaud JP, Kantor G, Richaud P. Brachytherapy of cancer of the penis. Analysis of a series of 53 cases. J Urol 1989; 95(1): 27-31.
28. Gerbaulet A, Potter R, Mazeron JJ, Meertens H, Limbergen E (eds). The GEC ESTRO Handbook of Brachytherapy. Brussels: Estro 2002.
29. Zouhair A, Coucke PA, Jeanneret W. Radiation therapy alone or combined surgery and radiation therapy in squamous-cell carcionoma of the penis? Eur J Cancer 2001; 37 : 198-203.
30. Kanfir K, Haie-Meder C, Albano M: Outcome of patients treated with exclusive brachytherapy for carcinoma of the penis: IGR experience. Radiother Oncol 2000; 55 : 25.
Štítky
Detská urológia Urológia
Článek ROZHOVOR S PROFESOREM PATRICKEM C. WALSHEM O JEHO POHLEDU NA RETROPUBICKOU RADIKÁLNÍ PROSTATEKTOMIIČlánek LYMFATICKÁ DRENÁŽ PENISUČlánek ZE ZAHRANIČNÍCH PERIODIKČlánek RECENZEČlánek KVÍZČlánek GENITÁLNÍ LYMFEDÉM U MUŽŮ
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2005 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- PROBLEMATIKA UZLINOVÉHO POSTIŽENÍ U KARCINOMU PENISU
- CHIRURGICKÁ LÉČBA KARCINOMU PENISU LOKALIZOVANÉHO NA ORGÁN
- CHEMOTERAPIE KARCINOMU PENISU
- BRACHYTERAPIE V LÉČBĚ KARCINOMU PENISU
- GENITÁLNÍ LYMFEDÉM U MUŽŮ
- SOUČASNÉ INFORMACE O PROBLEMATICE KARCINOMU PROSTATY
- ROZHOVOR S PROFESOREM PATRICKEM C. WALSHEM O JEHO POHLEDU NA RETROPUBICKOU RADIKÁLNÍ PROSTATEKTOMII
- CO NA PUBLIKOVANÉ ČLÁNKY ŘÍKÁ PROFESOR PATRICK C. WALSH?
- LYMFATICKÁ DRENÁŽ PENISU
- ZE ZAHRANIČNÍCH PERIODIK
- GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU KARCINOMU PENISU
- RECENZE
- KVÍZ
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- GENITÁLNÍ LYMFEDÉM U MUŽŮ
- LYMFATICKÁ DRENÁŽ PENISU
- PROBLEMATIKA UZLINOVÉHO POSTIŽENÍ U KARCINOMU PENISU
- CHIRURGICKÁ LÉČBA KARCINOMU PENISU LOKALIZOVANÉHO NA ORGÁN
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



