KINETIKA PSA − MŮŽE POMOCI PREDIKOVAT PŘÍTOMNOST A ZÁVAŽNOST KARCINOMU PROSTATY?
Autori:
H. Ballentine Carter M. D.
Pôsobisko autorov:
Hospital, Baltimore, USA
; Department of Urology, Johns Hopkins
Vyšlo v časopise:
Urol List 2006; 4(4): 26-34
ÚVOD
Vzhledem k tomu, že absolutní hodnoty PSA nejsou schopny přesně predikovat přítomnost karcinomu prostaty a jeho závažnost, budí koncept zabývající se kinetikou PSA (změna PSA) velký zájem. Tab. 1 ukazuje, jaká omezení s sebou nese používání absolutních hodnot PSA při vylučování karcinomu prostaty a/nebo diagnostikování karcinomu vyššího grade (signifikantního). Vychází z údajů Prostate Cancer Prevention Trial [1].
![Senzitivita a specifita karcinomu prostaty a onemocnění vyššího grade pomocí různých hraničních hodnot PSA [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/782d0ad00ffc5e34168cf82bc5f9d8a2.png)
DEFINICE KINETIKY PSA
Kinetika PSA popisuje změny PSA, k nimž dochází v průběhu času. Pro popsání změn PSA se užívají veličiny velocita PSA (PSAV) a PSA doubling time (PSADT čili zdvojnásobující doba PSA). Jaký je rozdíl mezi těmito 2 kinetickými měřeními? PSADT popisuje procento růstu (doba do zdvojnásobení) PSA a počítá se pomocí sklonu křivky regrese logaritmu transformovaného PSA v čase a předpokládá tedy exponenciální závislost PSA na čase. PSADT může být konstantní, zatímco hodnota PSA se exponenciálně zvyšuje (obr. 1).

Kinetika je změna fyzikálního nebo chemického systému.
VÝPOČET PSAV A PSADT (viz výše)
Pokles křivky regrese PSA v průběhu času ukazuje míru změny PSA nebo PSAV. Vzorec, jenž popisuje přímku je y = mx + b, kde m je sklon křivky a b úsečka vymezená 2 body. Tento přístup předpokládá přímou závislost PSA na čase, jak ukazuje výše uvedené schéma. Sklon křivky (PSAV) je v tomto příkladu 3,6 ng/ml za rok v průběhu 4 let. Pokud zaneseme do grafu logaritmickou transformaci PSA v průběhu času u tohoto příkladu (graf 1), spočítáme PSADT pomocí rovnice: In (2)/sklon křivky = PSADT. In2 = 0,693 a křivka = 0,693 udává PSADT za 1 rok.

Další metodou pro výpočet PSAV je průběh průměrné nebo prosté PSAV (podíl změny a času) mezi 2 body plus PSAV mezi dalšími 2 body dělený 2. Například průměrné procento změny ve výše uvedeném schématu pro 2. až 4. rok je ([8 ng/ml - 4 ng/ml]/1rok) + ([16 ng/ml - 8 ng/ml ]/ 1 rok)/2 = 6 ng/ml za rok.
KINETIKA PSA A PŘEDPOVĚĎ KARCINOMU PROSTATY
PSAV je u mužů s karcinomem prostaty vyšší než u mužů bez karcinomu. Údaje z Baltimore Longitudinal Study of Aging (BLSA) ukazují, že u mužů s karcinomem prostaty se hodnota PSA zvyšuje rychleji než u mužů bez tohoto onemocnění (viz dále uvedená legenda ke grafu 2). 5 až 10 let před stanovením klinické diagnózy byla střední hodnota PSAV u mužů s lokalizovaným karcinomem prostaty (0,27 ng/ml za rok) a metastazujícím onemocněním (1,33 ng/ml za rok) významně vyšší než u mužů s benigní hyperplazií prostaty - BPH (0,09 ng/ml za rok) a u kontrolní skupiny (0,01 ng/ml za rok). 10–15 let před stanovením klinické diagnózy byla střední hodnota PSAV u mužů s lokalizovaným karcinomem prostaty (0,14 ng/ml za rok) a metastazujícím onemocněním (0,30 ng/ml za rok) signifikantně vyšší, než u kontrolní skupiny (0,02 ng/ml za rok), ovšem nikoliv vyšší než u mužů s BPH (0,09 ng/ml za rok).
![Křivky představují průměrné hodnoty PSA a 95% konfidenční limit PSA u mužů bez onemocnění prostaty (spodní křivka), u mužů s BPH, kteří podstoupili prostou prostatektomii (2. křivka zdola), u mužů s lokalizovaným karcinomem prostaty (3. křivka zdola) a u mužů s metastazujícím karcinomem prostaty (horní křivka) jako funkce počtu let před stanovením diagnózy (karcinom prostaty), prostou prostatektomií nebo poslední návštěvou BLSA indikované hodnotou doby 0. U mužů v této studii bylo onemocnění diagnostikováno před érou PSA a ve srovnání s muži, u nichž je onemocnění diagnostikováno v současné době, u nich byla větší pravděpodobnost přítomnosti život ohrožujícího onemocnění [2].](https://pl-master.mdcdn.cz/media/image/134ce057660d92cc1087ec5dabc05b79.jpg?version=1537792497)
Rozdíly v publikovaných studiích týkající se PSAV a predikce karcinomu souvisí zřejmě s rozdíly ve zkoumaných populacích. Mnoho studií v éře PSA zahrnuje větší počet mužů s nesignifikantními karcinomy detegovanými pomocí PSA-testů. PSAV může lépe indikovat život ohrožující karcinom (viz dále).
PSA KINETIKA A PREDIKCE ŽIVOT OHROŽUJÍCÍHO ONEMOCNĚNÍ
Před léčbou
D´Amico et al nedávno prokázal, že PSAV v roce předcházejícím stanovení diagnózy souvisí s přítomností život ohrožujícího karcinomu prostaty. Ve srovnání s roční hodnotou PSAV 2 ng/ml nebo nižší byla roční hodnota PSAV vyšší než 2 ng/ml rok před stanovením diagnózy spojená s významně kratší dobou do úmrtí způsobeného karcinomem prostaty po operaci [3] a po radiační terapii [4]. Rok před stanovením diagnózy tedy PSA vyšší než 2 ng/ml za rok souvisela u mužů s předpokládaným lokalizovaným onemocněním s přítomností mikrometastazujícího onemocnění a se selháním lokální terapie (ozáření a operace). Tato pozorování ukazují, že PSAV může být užitečná při hodnocení biologické povahy karcinomu prostaty před léčbou.
Pokud mají muži s relativně vysokou hodnotou PSAV rok před stanovením diagnózy vyšší pravděpodobnost pokročilejšího karcinomu prostaty, který nelze léčit operativně, je zřejmé, že by onemocnění mělo být identifikováno dříve v závislosti na hodnotě PSAV, ještě v době, kdy je onemocnění léčitelné lokální terapií (ozáření nebo operace). Současné údaje z BLSA ukazují, že pomocí PSAV lze identifikovat muže s život ohrožujícím karcinomem prostaty v době, kdy je vyléčení ještě pravděpodobné [5]. Během posledních 3 desetiletí se opakovaně stanovovala hodnota PSA pomocí zmrzlého séra u 980 mužů, kteří byli součástí BLSA. 10–15 let před stanovením diagnózy došlo u mužů, kteří později zemřeli na karcinom prostaty k exponencionálnímu zvýšení hodnoty PSA. K tomuto zvýšení nedošlo u mužů s onemocněním prostaty, které nebylo smrtelné a u mužů bez karcinomu. Při průměrné hodnotě PSA méně než 4,0 ng/ml (10–15 let před diagnózou) bylo po 25 letech specifické přežití s karcinomem prostaty 92 % (84, 96) u mužů s PSAV 0,35 ng/ml za rok nebo méně a 54 % (15, 82) u mužů s PSAV vyšší než 0,35 ng/ml za rok (p = 0,0001). Relativní riziko úmrtí na karcinom prostaty bylo 4,7 (1,3-16,5) u pacientů s PSAV vyšší než 0,35 ng/ml za rok ve srovnání s těmi, jejichž PSAV byla 0,35 ng/ml za rok nebo méně (p = 0,02).
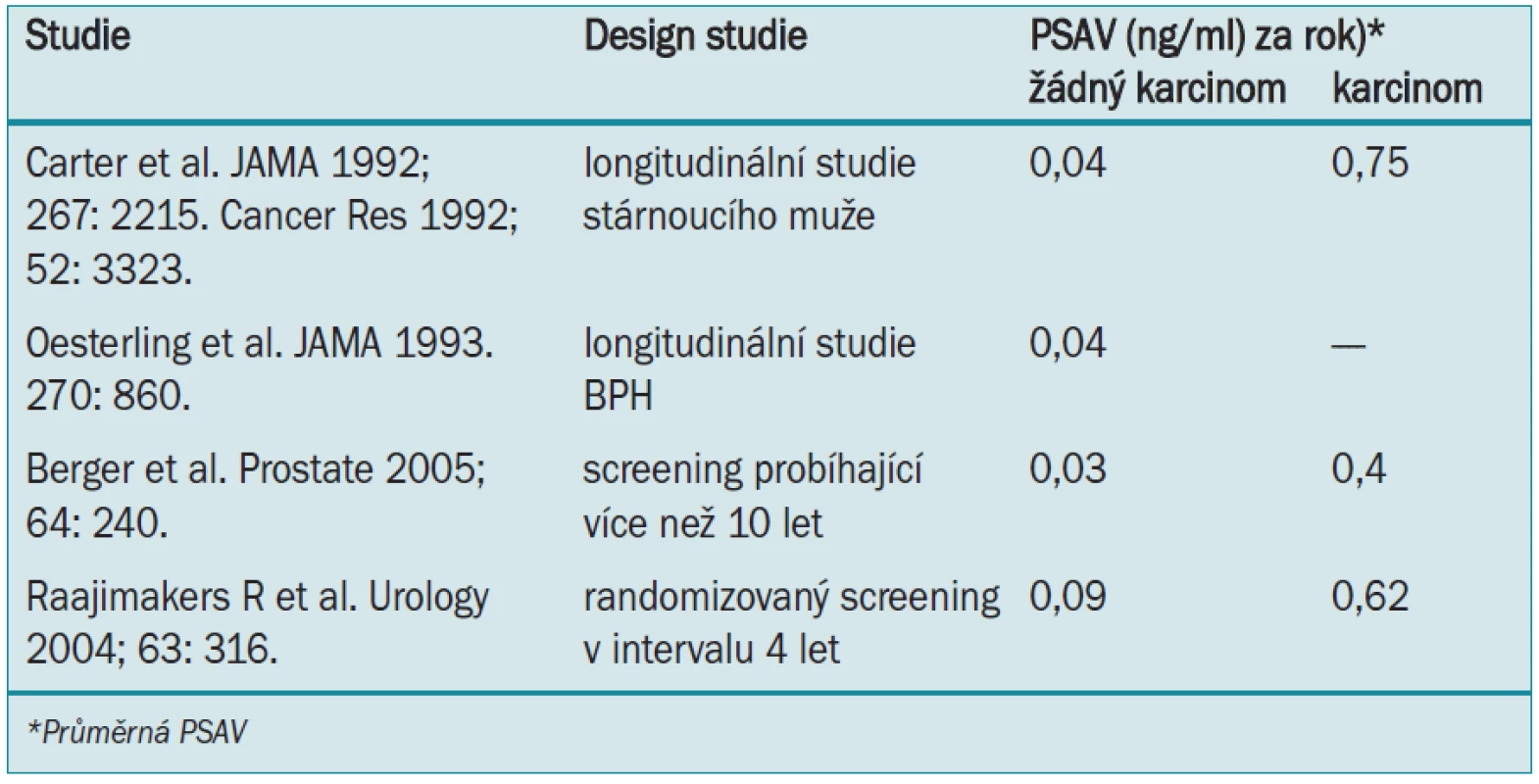
Růst PSA o více než 0,35 ng/ml za rok tedy indikuje v době, kdy hodnota PSA signalizuje přítomnost vyléčitelného onemocnění, relativně vysoké riziko úmrtí na karcinom prostaty v průběhu dalších 30 let, což je informace, jež by mohla být užitečná pro identifikaci mužů, u kterých bude přínosná aktivní léčba.

Po léčbě
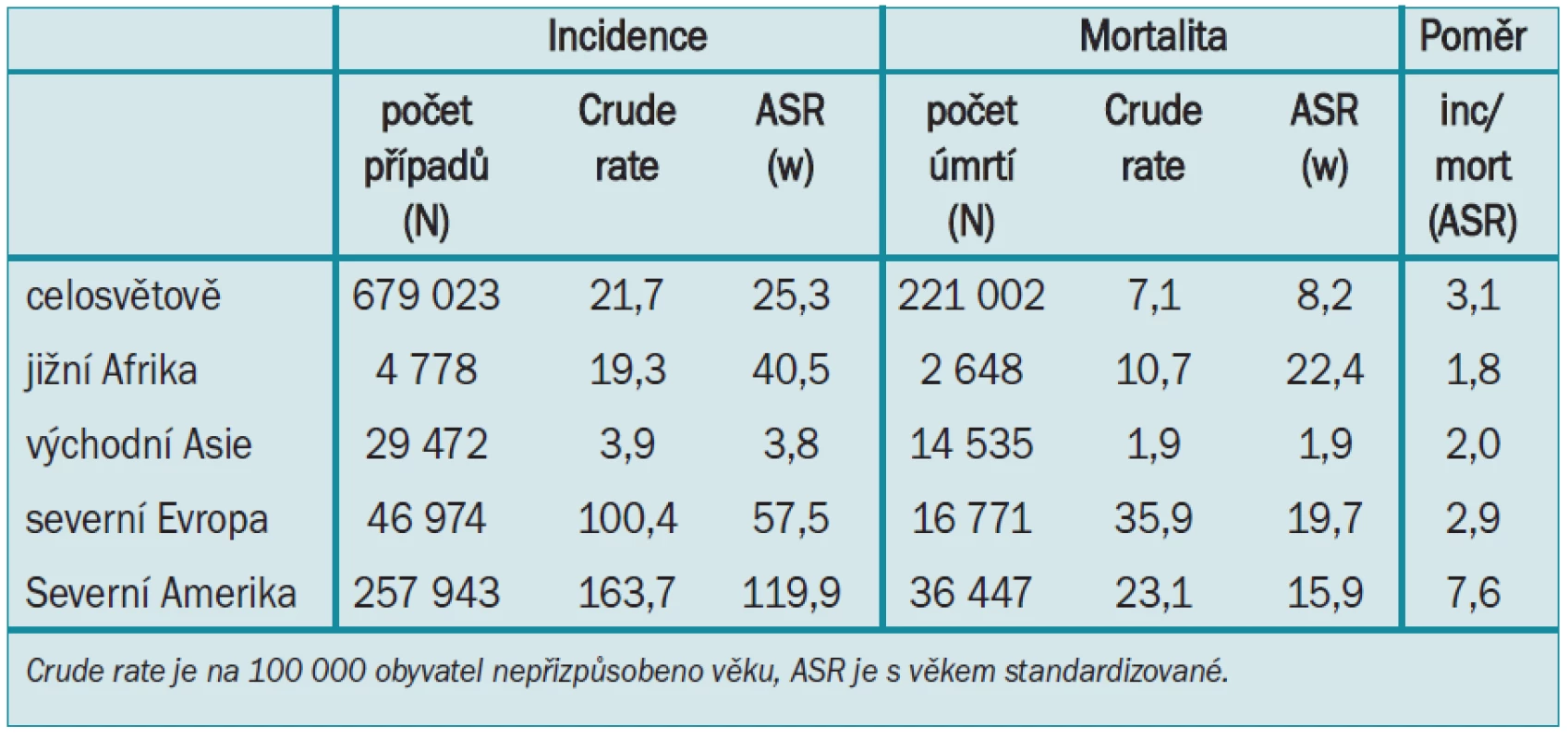
Po lokální léčbě karcinomu prostaty (ozáření nebo operace) je u mužů s rostoucím PSA alternativním hraničním bodem pro úmrtí způsobené karcinomem prostaty PSADT (graf. 3). I další autoři [6] publikovali koncept užívání PSADT pro identifikaci mužů s vyšším rizikem úmrtí na karcinom prostaty po lokalizované léčbě a tento koncept se používá pro výběr mužů, jimž může okamžitá léčba prospět.
![Specifické přežití při karcinomu prostaty u mužů s rostoucí PSA po operaci a radiační terapii. Horní 2 křivky představují muže s PSADT 3 nebo více měsíců po operaci nebo radiaci (oranžová čára = operace, zelená čára = radiace) a spodní křivky představují muže s PSADT méně než 3 měsíce po operaci a radiační terapii. Hodnoty pod grafem udávají počty mužů s rizikem. U 12 % mužů léčených operativně a 20 % mužů léčených radioterapií bylo PSADT < 3 měsíce [7].](https://pl-master.mdcdn.cz/media/image/6e2ca968d63f8f59b58f93367f506bf1.jpg?version=1537794508)
Vyskytuje se overdiagnosis a overtreatment karcinomu prostaty detegovaného na základě screeningu založeného na PSA u asymptomatických mužů?
Pokud ano, v jakém rozsahu? Screening by měl na základě definice vést ke stanovení diagnózy u jakéhokoliv onemocnění v případech, kdy je nepravděpodobné, že diagnóza bude stanovena v průběhu života pacienta bez screeningu (overdiagnosis). Počet těchto případů je u onemocnění s dlouhým přirozeným vývojem, jako je karcinom prostaty, poměrně vysoký. Pokud jsou muži s detegovaným karcinomem, u nichž by bez screeningu karcinom detegován nebyl, aktivně léčeni, jedná se o overtreatment, jelikož léčba neprodlouží život pacienta.
Čtyři významná pozorování ukazují, že overdiagnosis a overtreatment se často vyskytují spolu se screeningem založeným na PSA:
- detekce onemocnění s nízkým rizikem se spolu se screeningem PSA zvýšila
- přirozený vývoj onemocnění s nízkým rizikem je dlouhodobý
- další příčiny úmrtí snižují u starších mužů pravděpodobnost úmrtí na karcinom prostaty
- randomizovaná studie porovnávající metody pozorování a operace ukazuje minimální absolutní rozdíl (5 %) v úmrtí na karcinom prostaty po 10 letech, a to u mužů s mírným až vysokým rizikem karcinomu, jenž nebyl detegován pomocí screeningu. Je to důkaz, že overtreatment onemocnění s nízkým rizikem se vyskytuje často.
1. Detekce onemocnění s nízkým rizikem se spolu se screeningem založeným na PSA (graf 4) dramaticky zvýšila. Pomocí klasifikačního systému dle D´Amica et al [8] jsou při stanovení diagnózy, v závislosti na stadiu karcinomu, grade a PSA, definovány 3 rizikové kategorie: onemocnění s nízkým rizikem (stadium T2 nebo nižší, Gleasonovo skóre 6 nebo méně, PSA 10 ng/ml nebo méně), onemocnění s vysokým rizikem (stadium T3/T4, Gleasonovo skóre 8-10), PSA > 20 ng/ml) a onemocnění se středním rizikem (všechna ostatní). Přibližně u 50 % pacientů je dnes diagnostikováno onemocnění s nízkým rizikem.
![Detekce onemocnění s nízkým rizikem se spolu se screeningem založeným na PSA dramaticky zvýšila [9].](https://pl-master.mdcdn.cz/media/image/45d84526144ba4920850d5d9fef56aae.jpg?version=1537793722)
2. Přirozený vývoj onemocnění s nízkým rizikem je dlouhodobý. Albertsen et al [10] zaznamenali ve studii založené na populaci mužů s neléčeným lokalizovanýmkarcinomem prostaty (detegovaným nikoliv pomocí screeningu), sledovaným po dlouhou dobu (více než 15 let), procento mortality 30/1 000 osob za rok. Johannson et al [11] zaznamenali během prvních 15 let sledování u mužů s lokalizovaným karcinomem prostaty (nedetegovaným pomocí screeningu), kteří nebyli léčeni, stabilní procento úmrtí na karcinom prostaty. Podobně jako v údajích od Albertsena et al [12] byla mortalita karcinomu prostaty během prvních 15 let 15/1 000 osob za rok, ovšem narozdíl od nálezů Albertsena se po 15 letech mortalita zvýšila na 44/1 000 osob za rok. Tyto údaje ukazují, že většina mužů s karcinomem prostaty detegovaným pomocí screeningu ve věku 70 let nebo později nebude mít z aktivní léčby žádný užitek. Přesto podstupuje v dnešní době většina mužů s karcinomem prostaty detegovaným po 70. roce života aktivní léčbu. [13]
3. Další příčiny úmrtí snižují pravděpodobnost toho, že starší muži s karcinomem prostaty s nízkým rizikem zemřou na toto onemocnění. Graf 5 ukazuje, že v dekádě po dosažení 70 let se riziko úmrtí z jiného důvodu, než je karcinom prostaty, ztrojnásobí vzhledem k úmrtí na karcinom prostaty.

4. V randomizované studii srovnávající operaci a pozorné vyčkávání u mužů s karcinomem prostaty nedetegovaným pomocí screeningu, s mírným až vysokým rizikem, byl absolutní rozdíl v úmrtí na karcinom prostaty během 10 let následujících po stanovení diagnózy pouze 5 % ve prospěch operované skupiny. Je tedy pravděpodobné, že pokud by byli pacienti s karcinomem prostaty detegovaným pomocí screeningu a s nízkým rizikem, randomizováni k léčbě vs žádné léčbě, byl by po 15–20 letech nalezen rozdíl v mortalitě na karcinom prostaty, vzhledem k tomu, že v současné době jsou díky screeningu karcinomy prostaty detegovány přibližně o 10 let dříve než ve výše uvedené studii [14].
Odhady týkající se overdiagnosis a overtreatment
V zemích, kde screening stále ještě není příliš rozšířen, se poměr mezi incidencí a mortalitou pohybuje v rozmezí 2 : 1 (tab. 4). To je způsobeno poměrně vysokým procentem interkurentních úmrtí, k nimž dochází dokonce i u klinicky diagnostikovaných karcinomů. V oblastech, kde je screening více rozšířen, zejména v Severní Americe, je poměr incidence/ mortalita 7,6 (2002), což jasně dokazuje, že screening pro identifikování karcinomu prostaty vede k významnému zvýšení incidence. Údaje v tabulce neobsahují informace týkající se opakovaného screeningu. Je pravděpodobné, že v oblasti intenzivního screeningu dojde časem k poklesu incidence. V USA i v jiných částech světa zatím ještě k významnému poklesu nedošlo. Možným vysvětlením, proč se incidence nesnížila, je pokles indikačního prahu PSA pro biopsii, agresivnější techniky biopsie a posun věkové hranice pro provádění biopsie. Je dobře známo, že v rizikových věkových skupinách je prostata rezervoárem velkého počtu malých karcinomů a současné údaje z Prostate Cancer Prevention Trial [15] jasně ukazují, že velké množství těchto karcinomů lze detegovat dokonce pomocí sextantové biopsie.
Etzioni et al [16] zjistili, že dle údajů z NCI programu Surveillance Epidemiology and End Results bylo procento overdiagnosis (detekce karcinomů, které by bez screeningu nebyly detegovány) při screeningu založeném na PSA u mužů mezi 60–84 lety přibližně 30 %. Draisma et al. [17] zjistili, že dle údajů European Randomized Study of Prostate Cancer Screening se procento overdiagnosis zvyšuje z 27 % ve věku 55 let na 56 % ve věku 75 let. Procento overdiagnosis se tedy zvyšuje s věkem.
Welch et al [18] zjistili, že snížení hodnoty indikačního prahu PSA pro biopsii na 2,5 ng/ml zdvojnásobí počet mužů považovaných za nemocné. A vzhledem k tomu, že procento detekce karcinomu je podobné u mužů s hodnotami PSA 2,6– –4,0 ng/ml a 4,0–10 ng/ml a že je více mužů s hodnotami PSA 2,6–4,0 ng/ml než 4,0–10 ng/ml, může snížení prahové hodnoty PSA při biopsii zdvojnásobit počet mužů s diagnózou karcinomu prostaty. Současný počet pacientů s karcinomem prostaty je 1,8 milionů (http://seer.cancer. gov/) a pokud by se tento počet zvýšil na 3 miliony (snížením indikačního prahu PSA pro biopsii), rovnalo by se to celkovému počtu mužů žijících se všemi dalšími druhy karcinomu (http://seer.cancer.gov/).
Schröder a Robol [19] odhadují (v závislosti na pozitivním procentu biopsie v daném rozmezí hodnot PSA), že pokud by se indikační práh PSA pro biopsii snížil na 2,5 ng/ml a více, diagnostikovali bychom v roce 2005 v USA o 542 910 více případů než odhadovaných 232 090 a na karcinom prostaty by zemřelo 25,6krát více mužů než předpokládaných 30 350. Overdiagnosis karcinomu prostaty je tedy dnes významným tématem.
Overdiagnosis karcinomu prostaty může vést u mužů, kteří by i bez léčby měli stejnou délku života, ke zbytečné léčbě. Pokud se procento overdiagnosis zvyšuje s věkem, měl by se počet mužů, kteří žijí déle díky léčbě karcinomu detegovaného screeningem, s věkem snižovat. Ross et al [20] simulovali screening karcinomu prostaty u mužů ve věku 40–90 let a měnili věk pro poslední PSA-test (nebo diagnózu). Zjistili, že souvislost mezi léčbou a zabráněním úmrtí se s věkem rozvolňuje (graf 6). Ve srovnání se screeningem prováděným ve věku do 65 let, vyžadoval screening prováděný do věku 75 a 80 let 2krát až 3krát vyšší počet prováděných terapií na osobu a rok zachráněného života.
![Léčba nutná pro prevenci úmrtí na karcinom prostaty při ukončení screeningu v různém věku. Počet prováděných terapií ( ) a prevence úmrtí na karcinom ( ) jako funkce věku v době provádění posledního testování PSA [21].](https://pl-master.mdcdn.cz/media/image/b812eca54818c4126608d9045eb88500.jpg?version=1537796164)

McGregor et al [22] zjistili, že u každých 16 (13–22) pacientů ze 100, ve věku 50–70 let s karcinomem prostaty detegovaným pomocí screeningu, může operace prodloužit život.
Navzdory tomu, že většina mužů, u nichž je dnes diagnostikován karcinom prostaty, má onemocnění s nízkým rizikem a navzdory četným důkazům, že starší muži s karcinomem prostaty s nízkým rizikem nemají z léčby prospěch, podstupuje většina mužů, u nichž je karcinom prostaty diagnostikován, aktivní léčbu. V výzkumné databázi 35 akademických a komunitních urologických soukromých praxí v USA mělo 43 % mužů s diagnózou karcinomu prostaty při stanovení diagnózy 70 nebo více let a 84 % těchto mužů podstoupilo aktivní terapii sestávající z operace, radioterapie nebo hormonální terapie [23]. Nárůst aktivní léčby u starších mužů s karcinomem prostaty může být způsoben různými faktory, například screeningem karcinomu prostaty založeným na PSA, zlepšením léčebných postupů u mužů s lokalizovaným onemocněním, zvyšujícím se věkem dožití. Faktorem napomáhajícím rozmachu aktivní léčby může být i to, že ani lékař ani pacient nepochopí, že s přibývajícím věkem se prospěšnost screeningu snižuje.
Jedním z přístupů, jak snížit overtreatment u mužů s nově diagnostikovaným karcinomem prostaty s nízkým rizikem je aktivní sledování nebo vyčkávání. Cílem sledování by v této situaci mělo být snížení procenta zbytečné léčby a jejích fyzických i duševních vedlejších dopadů u mužů, kterým nehrozí úmrtí na toto onemocnění. Na rozdíl od pozorného vyčkávání s paliativním záměrem, jež bylo často praktikováno v době, kdy se neprováděl screening, má sledování s léčebným záměrem za cíl identifikovat muže s nízkým rizikem progrese při aplikaci odložené kurativní terapie, a je-li to nezbytné, zahájit odloženou terapii. To vyžaduje výběr správných případů a stanovení režimu sledování, jenž umožní identifikovat progresi onemocnění ve stadiu, kdy ještě lze aplikovat kurativní léčbu.
Je možné identifikovat pacienty s karcinomem prostaty, u nichž je pozorné vyčkávání bezpečné, a pokud ano, jak?
V dnešní době, kdy se vzorky prostaty odebírají pomocí ultrazvukem řízené biopsie a při periprostatické infiltrační analgezii, můžeme z odebraných vzorků odhadnout skutečný rozsah karcinomu prostaty. Řada studií ukazuje, že je možné identifikovat muže, u nichž by nebylo vyčkávání bezpečné, ale že je obtížnější identifikovat pacienty, u nichž by toto řešení bezpečné bylo. Užití kritérií PSA a bioptických nálezů pro identifikaci mužů s karcinomem nižšího grade o malém objemu vede k overtreatment značného počtu mužů, avšak méně pravděpodobně ke sledování mužů, kteří by měli být okamžitě léčeni. Jelikož neexistují dlouhodobé studie, které by prokázaly bezpečnost vyčkávání v případě karcinomu prostaty detegovaného při screeningu PSA, definuje se indolentní čili nesignifikantní nádor, který může zůstat delší dobu v klidu, podle objemu a grade karcinomu. Při absenci dlouhodobých studií, prokazujících bezpečnost vyčkávacího řešení karcinomu prostaty detegovanému díky skríninku PSA, se užívá pro definici „indolentního“ nebo „nesignifikantního“ karcinomu prostaty, jenž může zůstat po delší dobu v klidovém stavu, objem a grade karcinomu.
Pro koho je vyčkávací řešení bezpečné?
Publikované údaje o sledování neléčených mužů ukazují, že přirozený vývoj karcinomu prostaty je dlouhý, zejména u onemocnění nízkého stadia i grade. Jako 2 nejvýznamnějšími predikátory úmrtí na karcinom prostaty byly v nedávno provedené studii mezi neléčenými muži vyhodnoceny grade karcinomu a doba sledování [24]. Starší muži (jimž zbývá méně let života vzhledem k jiným možným příčinám úmrtí) s karcinomem nízkého grade se tedy zdají nejvhodnějšími kandidáty pro pozorné vyčkávání. Tito starší muži s onemocněním s nízkým rizikem definovaným D´Ámicem et al. [8] jako stadium T2 a nebo nižší, Gleasonovo skóre 6 nebo nižší a PSA 10 ng/ml nebo méně se zdají být vhodnými kandidáty pro pozorování, přestože muži s onemocněním s vyšším rizikem mohou mít příznivé výsledky i bez léčby.
Roemeling a Schroder et al (zatím pouze rukopis) v současné době hodnotili 293 z 1 014 (29 %) mužů, u nichž byl diagnostikován karcinom prostaty, ve větvi randomizované studie zabývající se screeningem, kteří splňovali kritéria pro aktivní sledování (biopsie Gleasonovo skóre 6 nebo méně, 2 nebo méně vzorků s karcinomem, denzita PSA méně než 0,2 s maximální hodnotou PSA 15 ng/ml a klinickým stadiem T1c nebo T2). Z těchto 293 mužů s průměrným věkem 66 let byla u 136 (46,6 %) zvolena radikální prostatektomie, u 91 (31,1 %) radioterapie a u 64 (21,8 %) pozorné vyčkávání. Po průměrné době sledování 81 měsíců bylo přežívání specifické pro karcinom prostaty po 8 letech 99,2 % a celkové přežití bylo 85,4 %. Žádný z mužů, u nichž se přistoupilo k vyčkávání, nezemřel na karcinom prostaty ani u něj během sledování nepropuklo metastazující onemocnění. Střední objem tumoru, zjištěný ve vzorcích radikální prostatektomie, byl 0,24 ml (průměrně 0,49, rozmezí 0,001–4,71), u 6 % došlo k rozšíření mimo prostatu a 86 % mělo Gleasonovo skóre 6 nebo méně. K určení nižší hodnoty Gleasonova skóre došlo u 23 ze 136 mužů, kteří podstoupili operaci (17 %), z nichž 2 (1,5 %) měli Gleasonovo skóre ze vzorku radikální prostatektomie vyšší než 7 (5 + 4 = 9 a 5 + 3 = 8). V této studii se prováděla sextantová biopsie; pečlivější odebrání vzorku s rozšířenou biopsií by snížilo procento undersampling („podvzorkování“).
Někteří odborníci se domnívají, že ideální kandidáti pro vyčkávací řešení mají nesignifikantní onemocnění s malým objemem tumoru. Jednou z definic nesignifikantního onemocnění je tumor ohraničený na orgán, menší než 0,5 ml, s žádnými komponentami vyššího grade (Gleasonův typ 4 nebo 5 nebo Gleasonovo skóre vyšší než 6). Tyto karcinomy o malém objemu představují v souborech radikální prostatektomie přibližně 20 % karcinomů [25,26]. Tato definice je však arbitrární, protože i ten nejmenší karcinom nízkého grade může v průběhu času progredovat do neléčitelného stadia. Při absenci molekulárních markerů karcinomu prostaty, který ohrožuje život, budeme objem a grade tumoru považovat za náhradu biologického potenciálu.
Je možné identifikovat karcinom prostaty o malém objemu?
Epstein et al [27] jako první popsal kritéria PSA a nálezy biopsie jehlou pro predikci přítomnosti karcinomu prostaty o malém objemu (nízkého grade), který má nízké riziko progrese do agresivního onemocnění. Tab. 5 ukazuje, která předléčebná kritéria predikují přítomnost karcinomu prostaty o malém objemu při radikální prostatektomii (méně než 0,5 ml, ohraničený na orgán, žádný Gleasonův typ 4 nebo 5 nebo Gleasonovo skóre více než 6) v retrospektivní [27] a prospektivní studii. [28]
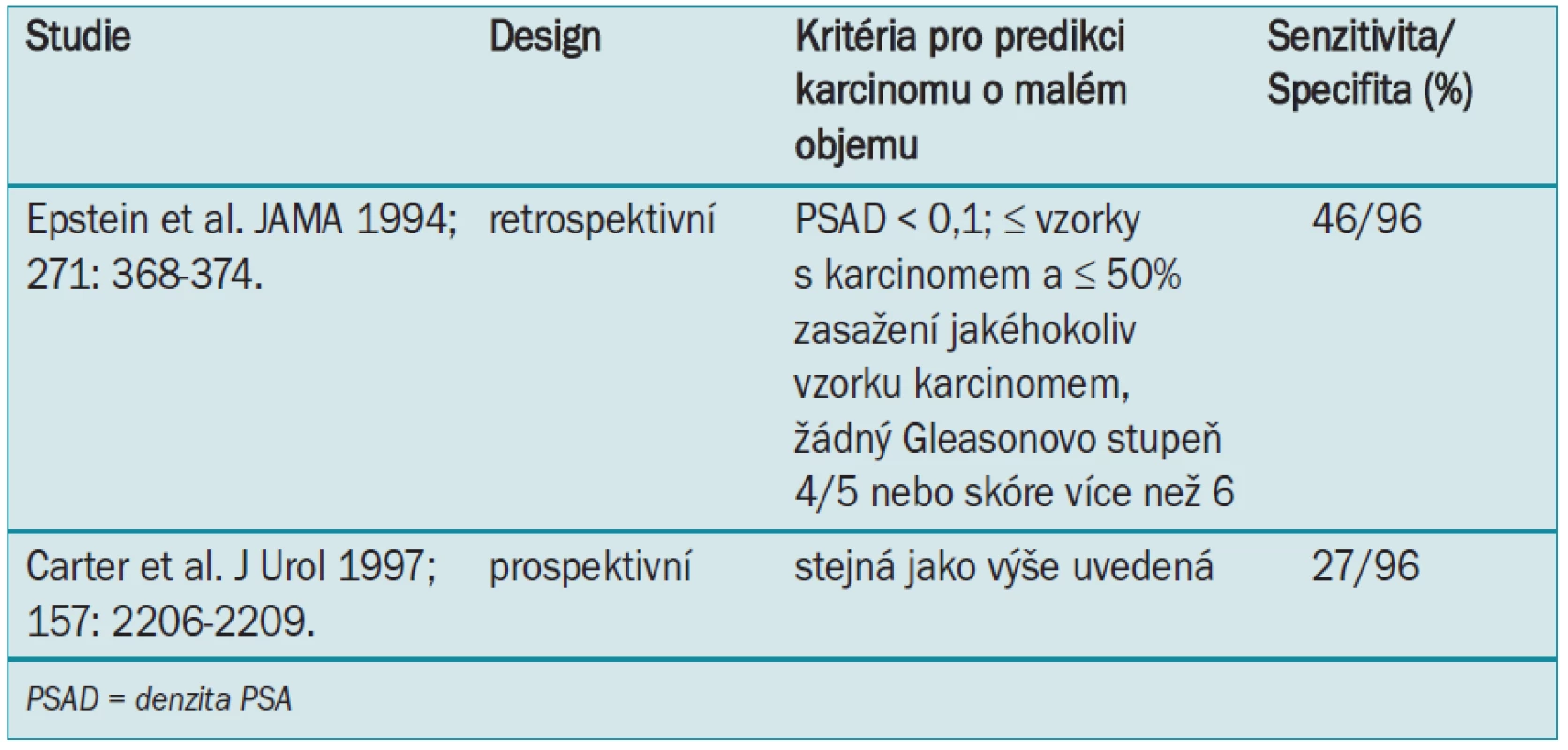
Tab. 5 ukazuje, že při užití předléčebných kritérií popsaných Epsteinem et al [27] budou ve 30–50 % případů (senzitivita) správně klasifikováni muži s karcinomem prostaty o malém objemu a muži s karcinomem s větším objemem nebo vyšším grade budou správně klasifikováni v 96 % případů (specifita). Tato kritéria tedy nevedou k selekci mužů bez karcinomu o malém objemu (nízký grade) pro vyčkávání, ale mohou vést k záměně karcinomů s malým objemem za karcinom s velkým objemem, což by vedlo k dalšímu overtreatment. Tato zjištění byla podpořena dalšími lékaři.
Kattan et al [26] hodnotili předléčebná kritéria při selekci mužů s karcinomem o malém objemu. Graf 5 ukazuje ROC-křivku zobrazující senzitivitu a 1-specifitu pomocí různých kritérií pro predikci karcinomů s malým objemem (na orgán ohraničený tumor o objemu 0,5 ml nebo méně, žádné Gleasonův typ 4/5 nebo Gleasonovo skóre více než 6) u 409 pacientů podstupujících radikální prostatektomii ve 2 institucích.
Dosažení 90% specifity (1-specifita 10%), kdy 10 % mužů bez karcinomu s malým objemem bylo mylně klasifikováno, vede k 30% senzitivitě, 70 % mužů s karcinomem o malém objemu je špatně klasifikováno (obr. 7). Tyto údaje se podobají údajům v tab. 5, užívající kritéria stanovená Epsteinem a opět ukazují, že je možné přesně identifikovat muže s karcinomem, který nebude považován za malý, ale daleko obtížnější je přesně identifikovat muže s karcinomem s malým objemem a nízkým stupněm.
Kattan et al. [26] dává přednost užití nomogramu (obr.) před prostou selekcí kandidátů v závislosti na absenci nebo přítomnosti některých kritérií, jak je popisuje Epstein et al [27].
Je třeba zdůraznit, že karcinomy, jež nejsou považovány za karcinomy s malým objemem, nemusí být nutně agresivní karcinomy prostaty, které ohrozí život pacienta. Klasifikace onemocnění o malém objemu založená na vzorku získaném při radikální prostatektomii je arbitrární a nemusí popisovat biologické chování karcinomu. Je pravděpodobné, že výše uvedená selekční kritéria podceňují množství biologicky indolentních karcinomů, ale vzhledem k tomu, že nejsme schopni předvídat chování karcinomu, je prozíravější připustit chybu směřující k overtreatment než k undertreatment.
Které spouštěcí momenty bychom měli brát v úvahu při identifikaci mužů, u nichž probíhá pozorné vyčkávání a kteří vyžadují kurativní intervenci?
Umožňují tyto spouštěcí momenty zahájení léčby během „okna vyléčitelnosti“ (window of curability)? Jelikož nejsou stanoveny přesné postupy pro zobrazení karcinomu prostaty malého objemu a monitorování progrese karcinomu, spoléhají vědci na jiné predikátory progrese onemocnění, které by upozornily na potřebu intervence u mužů nacházejících se v procesu vyčkávání. Možné spouštěcí momenty pro kurativní intervenci u mužů v programu pozorného vyčkávání mohou zahrnovat lokální progresi onemocnění při digitálním rektálním vyšetření (DRE), kinetiku PSA a patologické nálezy při biopsii. Někdo by mohl argumentovat, že progrese při DRE a progrese do vyššího stupně karcinomu (Gleasonovo skóre 7 nebo více) při biopsii jehlou ukazuje na vyšší pravděpodobnost úmrtí na karcinom prostaty, a že tedy může signalizovat potřebu kurativní intervence. Role kinetiky PSA při identifikování pacientů, jejichž stav vyžaduje léčbu, je méně jasná.
Bylo prokázáno, že kratší PSADT souvisí s vyšším rizikem progrese do vyššího stadia onemocnění [29] a že PSADT méně než 2 roky je spojena s lokální progresí. [30] Prahová hodnota kinetiky PSA, která by intervenci v době umožňující vyléčení u mužů v programu vyčkávacího řešení, však není známa.
D´Amico et al. [3] zjistili, že PSAV více než 2 ng/ml za rok v roce před stanovením diagnózy je spojena s 10násobně vyšším rizikem úmrtí na karcinom prostaty po radikální prostatektomii než je riziko při PSAV 2 ng/ml nebo méně. Tato hodnota PSAV (více než 2 ng/ml) odpovídá PSADT přibližně 3 roky nebo méně u muže s PSA 6 ng/ml, což ukazuje na přítomnost onemocnění, jež nelze vyléčit pomocí lokální terapie. Údaje z Baltimore Longitudinal Study of Aging ukazují, že PSADT 2 roky je charakteristická pro muže, kteří mají v době diagnózy pravděpodobně pokročilejší onemocnění, než jaké dnes běžně objevíme při screeningu [31].
SPOUŠTĚCÍ MOMENTY PRO INTERVENCI UŽÍVANÉ V PROGRAMU SLEDOVÁNÍ
Klotz [32] popisuje v prospektivní studii sledování 299 mužů, kteří byli vybráni na základě předpokladu přítomnosti onemocnění s nízkým rizikem, přestože někteří z těchto mužů měli karcinom vyššího grade (Gleasonovo skóre 7 nebo vyšší), hodnoty PSA více než 10 ng/ml a onemocnění u nich bylo hmatné. Plán sledování zahrnoval v tomto programu PSA a DRE každé 3 měsíce po dobu 2 let, poté každých 6 měsíců a sledovací biopsii po roce a poté každé 3 roky do věku 80 let. Počáteční kritéria pro intervenci v této skupině byla PSADT méně než 2 roky a progrese stadia do Gleasonova skóre 8. V současné době jsou spouštěcími momenty pro intervenci PSADT méně než 3 roky a progrese stadia do Gleasonova skóre 7 (4 + 3). Při střední době sledování 64 měsíců odstoupilo z programu pozorného vyčkávání 34 % pacientů (15 % z důvodu progrese PSA, 3 % kvůli klinické progresi, 4 % kvůli histologické progresi a 12 % z vlastního rozhodnutí).
Program pozorného vyčkávání s kurativním záměrem v Johns Hopkins Hospital [33,34] zahrnul do prospektivní pozorovací studie více než 300 mužů s průměrným věkem 67 let a průměrnou dobou stálého sledování 3 roky. Selekčními kritérii pro vstup do programu byla PSAD a příznivé výsledky biopsie prováděné jehlou (2 nebo méně vzorků karcinomu, 50 % nebo méně vzorků zasažených karcinomem a žádné Gleasonův typ 4/5 nebo Gleasonovo skóre 7 nebo více), jak již bylo v tomto článku popsáno. Sledování zahrnuje PSA (a free PSA) a DRE v 6měsíčních intervalech a každoroční kontrolní biopsii. Spouštěcí momenty pro intervenci vycházejí z výsledků kontrolní biopsie a zahrnují nález více karcinomů při biopsii (více než 2 vzorky s karcinomem nebo více než 50% postižení jakéhokoliv vzorku karcinomem) nebo přítomnost karcinomu s vysokým grade při biopsii (Gleasonův typ 4/5 nebo Gleasonovo skóre 7 a více). Ke kurativní intervenci došlo vzhledem k nepříznivým výsledkům kontrolní biopsie u 31 % mužů a u 7 % z důvodu osobní volby.
Patel et al [35] provedli retrospektivní studii 88 mužů s karcinomem prostaty ve stadiu T1-2, Gleasonovo skóre 7 nebo méně, léčených ve 2 institucích odloženou terapií s průměrnou dobou sledování 44 měsíců. V této studii byla objektivní progrese definována jako jakékoliv nové Gleasonovo pattern 4/5, nebo PSAV vyšší než 0,75 ng/ml za rok během 24 měsíců, nová léze prokázaná biopsií nebo více než 4 vzorky karcinomu. Sledování zahrnovalo DRE a PSA v 3měsíčních intervalech po dobu 1 roku a poté jednou za 6 měsíců. Opakování biopsie bylo doporučeno po 6 měsících, pokud DRE nebo PSA poskytly důkaz progrese onemocnění.
Umožňují současné spouštěcí momenty kurativní intervenci?
Ve studii prováděné v Torontu [32] byla po 8 letech celková doba přežití 85 % a přežívání specifické pro karcinom prostaty 99 %. Autoři popsali 24 pacientů, kteří podstoupili radikální prostatektomii z důvodu PSADT méně než 2 roky. 42 % mělo patologické stadium pT2 (ohraničené na orgán), 58 % pT3a až pT3c (lokálně pokročilé onemocnění) a 8 % N1. Tyto nálezy ukazují, že při daných kritériích měla v této studii většina pacientů s PSADT méně než 2 roky operativně nevyléčitelné onemocnění a ztratila možnost na vyléčení. Není známo, zda současný spouštěcí moment pro intervenci PSADT méně než 3 roky umožní léčbu ve vyléčitelném stadiu. Muži, jejichž karcinom byl v době operace neléčitelný, mohli mít toto neléčitelné onemocnění už při zahájení studie.
Zkušenost Johns Hopkins Hospital s vyčkávacím řešením se od studie provedené v Torontu liší ve výběru pacientů, ve stanovení spouštěcích momentů pro intervenci a v nálezech radikální prostatektomie u mužů s progredujícím onemocněním [33,34]. Selekční kritéria se snažila identifikovat skupinu mužů s onemocněním s nízkým rizikem, s karcinomem o malém objemu (nízký grade) a spouštěcí moment pro intervenci závisel na nálezech biopsie prováděné jehlou, nikoliv na kinetice PSA. V tomto programu podstoupilo operační zákrok 38 mužů. Na základě patologických nálezů jsme definovali operačně nevyléčitelné onemocnění, jež je spojeno s méně než 75% pravděpodobností přežívání bez biochemické recidivy 10 let po operaci (onemocnění omezené na orgán, stadia pT2, pokud bylo Gleasonovo skóre ≥ 7 (4 + 3) a/nebo v případě, že operační okraje byly pozitivní, onemocnění stadia pT3a N0 rozšířené mimo prostatu, pokud bylo Gleasonovo skóre ≥ 7 a/nebo v případě, že operační okraje byly pozitivní, a jakékoliv stadium vyšší než pT3a bez ohledu na stupeň nebo stav okrajů nebo jakékoliv N+ onemocnění). Srovnali jsme výsledky 38 pacientů, kteří podstoupili opožděnou operační intervenci v průměru 26,5 měsíců po stanovení diagnózy se 150 podobnými pacienty, kteří splňovali naše kritéria pro vyčkávací řešení, ale podstoupili okamžitou operaci 3 měsíce po stanovení diagnózy. [34] Nevyléčitelný karcinom byl diagnostikován u 9 (23 %) z 38 pacientů ve skupině s opožděnou intervencí a u 24 (16 %) ze 150 mužů ve skupině s okamžitou operací. Po zohlednění věku a PSAD se rizika nevyléčitelného karcinomu spojená s opožděnou a okamžitou intervencí statisticky nelišila (relativní riziko = 1,08, 95% konfidenční interval = 0,55 až 2,12, P = 0,819, dvoustranná Cochran-Mantel-Haenszelova statistika). Tyto údaje ukazují, že opožděná operace karcinomu prostaty u pacientů s onemocněním o malém objemu a nízkém grade a na základě výše popsaných spouštěcích momentů pro intervenci neovlivňuje vyléčitelnost.
Ve studii provedené Patelem et al [35] došlo při střední době sledování 45 měsíců u 22 pacientů z 88 (25 %) k progresi onemocnění. Pozitivní výsledek 2. biopsie byl nejprůkaznějším faktorem predikujícím progresi a jako prediktor progrese sloužila taktéž hodnota PSA při diagnóze. Tito autoři neshledali významnou spojitost mezi PSADT a progresí. 17 mužů podstoupilo radikální prostatektomii buď z důvodu progrese onemocnění nebo úzkosti. Autoři studie publikovali, že všichni muži kromě jednoho, kteří podstoupili operaci z důvodu progrese, měli onemocnění ohraničené na orgán.
Je možné, že zásadním faktorem predikujícím slibný výsledek u mužů v programu vyčkávání, je počáteční selekce kandidátů s onemocněním s nízkým rizikem, kteří by s větší pravděpodobností zemřeli vzhledem k dlouhému přirozenému vývoji karcinomu prostaty nebo z jiné příčiny než na karcinom prostaty. Například Roemeling a Schroder et al (pouze rukopis) prokázali, že u žádného mužů, u nichž byl karcinom prostaty identifikován v randomizované screeningové studii a kteří splňovali kritéria pro aktivní sledování (Gleasonovo skóre 6 nebo méně, 2 nebo méně vzorků s nádorem a PSAD méně než 0,2 s maximální hodnotou PSA 15 ng/ml a klinické stadium T1c nebo T2) nedošlo při průměrné době sledování 82,4 měsíců k metastazujícímu onemocnění nebo k úmrtí na karcinom prostaty bez definitivní léčby karcinomu, zatímco u 17,8 % došlo k úmrtí z jiné příčiny. U 19 z 64 mužů (30 %), z nichž 2 podstoupili radikální prostatektomii a měli onemocnění ohraničené na orgán, bylo spouštěcím momentem pro intervenci zvýšení hodnoty PSA.
Příhodné spouštěcí momenty pro intervenci, které by umožnily léčbu v době, kdy je vyléčení ještě možné, jsou hodnoceny ve výše zmíněných prospektivních studiích.
H. Ballentine Carter, M.D.
Department of Urology, Johns Hopkins Hospital, Baltimore, USA
Zdroje
1. Thompson IM et al. Operating characteristics of prostate-specific antigen in men with an initial PSA level of 3.0 ng/mL or lower. JAMA 2005; 294: 66-70.
2. Carter HB et al. Longitudinal evaluation of prostatespecific antigen levels in men with and without prostate disease. JAMA 1992; 267: 2215.
3. D´Amico AV et al. Preoperative PSA velocity and the risk of death from prostate cancer after radical prostatectomy. N Engl J Med 2004; 351: 125-135.
4. D´Amico AV et al. Pretreatment PSA velocity and risk of death from prostate cancer following external beam radiation therapy. JAMA 2005; 294: 440-447.
5. Carter HB et al. Can a baseline prostate specific antigen level identify men who will have lower urinary tract symptoms later in life? J Urol 2005; 173(6): 2040-2043.
6. Freedland SJ et al. Risk of prostate cancer-specific mortality following biochemical recurrence after radical prostatectomy. JAMA 2005; 294: 433-439.
7. D´Amico AV et al. Prostate specific antigen doubling time as a surrogate end point for prostate cancer specific mortality following radical prostatectomy or radiation therapy. J Urol 2004; 172(5 Pt 2): S42-46.
8. D´Amico AV et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998; 280: 969-974.
9. Cooperberg MR et al. The changing face of prostate cancer. J Clinical Oncology 2005; 23: 8146.
10. Albertsen PC et al. 20-year outcomes following conservative management of clinically localized prostate cancer. JAMA 2005; 293: 2095-2101.
11. Johannson JE et al. Natural history of early, localized prostate cancer. JAMA 2004; 291: 2713-2717.
12. Cooperberg MR et al. National practice patterns and time trends in androgen ablation for localized prostate cancer. J Natl Cancer Inst 2003; 95: 981-989.
13. Draisma G et al. Lead times and overdetection due to prostate-specific antigen screening: estimates from the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst 2003; 95: 868- 878.
14. Thompson IM et al. Prevalence of prostate cancer among men with a prostate-specific antigen level ≤4.0 ng per milliliter. N Engl J Med 2004; 350: 2239- 2246.
15. Etzioni R et al. Overdiagnosis due to prostate-specific antigen screening: lessons from U.S. prostate cancer incidence trends. J Natl Cancer Inst 2002; 94: 981-990.
16. Welch HG et al. Prostate-specific antigen levels in the United States: implications of various definitions for abnormal. JNCI 2005; 97: 1132-1137.
17. Schröder FH, Robol MJ. Does PSA velocity predict prostate cancer in pre-screened populations? Eur Urol 2006; 49(3):460-465.
18. Ross KS et al. Estimation of treatment benefits when PSA screening for prostate cancer is discontinued at different ages. Urology 2005; 66: 1038-1042.
19. McGregor M et al. Screening for prostate cancer: estimating the magnitude of overdetection. CMAJ 1998; 159: 1368-1372.
20. Cheng L et al. Preoperative prediction of small volume cancer (less than 0.5 ml) in radical prostatectomy specimens. J Urol 2005; 174: 898-902.
21. Kattan MW et al. Counseling men with prostate cancer: a nomogram for predicting the presence of small, moderately differentiated confined tumors. J Urol 2003; 170: 1792-1797.
22. Epstein JI et al. Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer. JAMA 1994; 271: 368-374.
23. Carter HB et al. Prospective evaluation of. men with stage T1c adenocarcinoma of the prostate. J Urol 1997; 157: 2206-2209.
24. McLaren DB et al. Watchful waiting or watchful progression?: prostate specific antigen doubling times and clinical behavior in patients with early untreated prostate carcinoma. Cancer 1998; 82: 342-348.
25. Klotz L et al. Active surveillance with selective delayed intervention using PSA doubling time for good risk prostate cancer. Eur Urol 2005; 47: 16-21.
26. Carter HB et al. Estimation of prostatic growth using serial prostate-specific antigen measurements in men with and without prostate disease. Cancer Res 1992; 52: 3323.
27. Klotz L. Active Surveillance for Prostate Cancer: For Whom? J Clin Oncol 2005; 23: 8165.
28. Carter HB et al. Expectant management of nonpalpable prostate cancer with curative intent: preliminary results. J Urol 2002; 167: 1231-1234.
29. Warlick C et al. Delayed versus immediate surgical intervention and prostate cancer outcome. JNCI 2006; 98:355-357.
30. Patel MI et al. An analysis of men with clinically localized prostate cancer who deferred definitive therapy. J Urol 2004; 171: 1520-1524.
Štítky
Detská urológia UrológiaČlánok vyšiel v časopise
Urologické listy

2006 Číslo 4
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
Najčítanejšie v tomto čísle
- STRAVA A KARCINOM PROSTATY
- PSA A VČASNÁ DETEKCE KARCINOMU PROSTATY
- PÁNEVNÍ LYMFADENEKTOMIE U KARCINOMU PROSTATY A JEJÍ HRANICE
- LYMFATICKÁ DRENÁŽ PROSTATY
