-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
KLINICKÝ PŘÍSTUP K SUPRESI ANDROGENŮ A RADIOTERAPII ZALOŽENÝ NA DŮKAZECH U MUŽŮ S LOKÁLNĚ POKROČILÝM NEBO LOKALIZOVANÝM KARCINOMEM PROSTATY
EVIDENCE-BASED CLINICAL APPROACH TO ANDROGEN SUPPRESSION AND RADIOTHERAPY IN MALE PATIENTS WITH LOCALLY ADVANCED OR LOCALIZED CARCINOMA OF THE PROSTATE
The article deals with issues of radiotherapy in the treatment of localized or locally advanced carcinoma of the prostate. The different modalities of external radiotherapy are addressed including their complications, and brachyradiotherapy as a method offering good prospects in this country is mentioned.
Also included are the options for the reduction of risk of prostate carcinoma recurrence after primary therapy with currative intention. Based on analysis of clinical studies, neoadjuvant and adjuvant hormonal deprivation is assessed for its effect on the course of prostate carcinoma after radiotherapy with currative intention.
The author's conclusion is that neoadjuvant and adjuvant androgen deprivation enhances local control of the tumour, extends the time to dissemination and increases total survival in patients after radiotherapy with currative intention.KEY WORDS:
prostate carcinoma, radiotherapy, neoadjuvant androgen deprivation, adjuvant androgen deprivation
Autori: MUDr. Vítězslav Vít; Prof. MUDr. Dalibor Pacík, CSc.
Pôsobisko autorov: Urologická klinika LF MU a FN Brno pracoviště Bohunice
Vyšlo v časopise: Urol List 2006; 4(4): 45-49
Súhrn
Autor se ve svém sdělení zabývá problematikou radioterapie v léčbě lokalizovaného nebo lokálně pokročilého karcinomu prostaty. Jsou uvedeny jednotlivé modality zevní radioterapie včetně jejich komplikací a jako metoda u nás perspektivní je uvedena i brachyradioterapie.
Dále se autor zabývá možnostmi snížení rizika recidivy karcinomu prostaty po primární léčbě s kurativním záměrem. Na základě rozboru klinických studií je hodnocen vliv neoadjuvantní a adjuvantní hormonální deprivace na průběh karcinomu prostaty po radioterapii s kurativním záměrem.
V závěru práce autor konstatuje, že neoadjuvantní a adjuvantní androgenní deprivace zvyšuje lokální kontrolu nádoru, prodlužuje čas do vzniku diseminace a u pacientů po radioterapii s kurativním záměrem prodlužuje celkové přežití.KLÍČOVÁ SLOVA:
karcinom prostaty, radioterapie, neoadjuvantní androgenní deprivace, adjuvantní androgenní deprivaceÚVOD
Karcinom prostaty je v současné době považován za jeden z hlavních medicínských problémů týkajících se mužské populace. Představuje nejen zdravotní, ale i společenský a ekonomický problém. Incidence onemocnění v České republice se zvýšila z 2 228 nových případů v roce 1995 (tj. 44,4/100 000 mužů a 8,2 % všech zhoubných nádorů) na 2 722 nových případů v roce 2000 (tj. 54,4/100 000 mužů a 9,2 % všech zhoubných nádorů). Nárůst činí 22,2 % [1].
Rovněž celosvětová incidence tohoto onemocnění - bez ohledu na rasové, geografické a nutriční rozdíly - ročně roste o 2–3 %. Podle některých statistik dochází kromě celkového nárůstu incidence i k posunu výskytu karcinomu prostaty do mladších věkových kategorií, což však může být i projevem stále aktivnějšího přístupu k vyhledávání tohoto onemocnění v co nejčasnějším stadiu [2].
Z hlediska léčby karcinomu prostaty je základním problémem rozlišení karcinomů signifikantních (tedy těch, které pacienta ohrozí na životě svou progresí) a nesignifikantních (pacient trpící karcinomem prostaty zemře, ale karcinom není příčinou úmrtí). Z tohoto pohledu stojíme v řadě případů, zejména u nádorů v počátečních stadiích, před otázkou, koho vůbec léčit, a pokud ano, jak léčit. Při volbě léčebné modality je nutno vždy postupovat individuálně a vždy je třeba zvážit tyto faktory:
- věk pacienta a předpokládanou délku životní exspektace
- jeho celkový zdravotní stav
- stadium nádorového onemocnění
- komplikace a rizika jednotlivých léčebných modalit
- přání a názor dokonale informovaného pacienta
LÉČEBNÉ MOŽNOSTI – – RADIOTERAPIE
Jednou z možností léčby s kurativním záměrem u pacientů s nemetastazujícím karcinomem prostaty omezeným na prostatickou žlázu nebo lokálně pokročilým je radioterapie, která je stále považována za alternativu kurativního řešení. Za tzv. „zlatý standard“ této léčby je možno považovat metodu zevního ozáření, další možností je brachyradioterapie.
Radioterapie s kurativním záměrem je indikována u pacientů s karcinomem prostaty ve stadiích T1T2N0M0 a u pacientů, u nichž z nějaké příčiny nelze provést radikální prostatektomii. Nicméně konformní radioterapie nebo intersticiální brachyradioterapie je považována za kurativní alternativu chirurgického výkonu a ve stadiu T3N0M0 je zřejmě optimální léčebnou metodou.
Radioterapie je sice spojena s riziky akutní nebo pozdní toxicity (tab. 1), avšak v současnosti používané moderní technologie umožňují provést vysokodávkovanou radioterapii kvalitně a s přijatelnou toxicitou [3,4].
Tab. 1. Vedlejší účinky radioterapie KP – metaanalýza [5]. ![Vedlejší účinky radioterapie KP – metaanalýza [5].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b9df0a9411bc367d9b65251db6b3a46d.png)
Trojrozměrná konformní radioterapie 3D-CRT (three-dimensional conformal radiation therapy) je ozařovací technika, při které hranice cílového objemu odpovídají trojrozměrnému zobrazení objemu tumoru. Dosažení vysoké konformity záření je umožněno rozvojem výpočetní techniky, rozšířením lineárních urychlovačů a zavedením 3D-plánování [6,7].
Další možností je radioterapie s modulovanou intenzitou - IMRT. Tato ozařovací technika využívá svazky o různé intenzitě. Radioterapie s modulovanou intenzitou má lepší konformitu a umožňuje zvýšení dávky v některých částech cílového objemu [8].
Optimálním schématem aplikace radioterapie je standardní frakcionace 5krát 2,0 Gy/týden. Velikost dávky zevní radioterapie je významným prediktivním faktorem 5letého přežití bez klinického a biochemického relapsu, přičemž za standard kurativní radioterapie je v současnosti považována dávka 70 Gy a vyšší. V případě radioterapie s kurativním záměrem se aplikuje dávka 40 Gy na oblast prostaty a semenných váčků (eventuálně 40–44 Gy na oblast malé pánve). Pak je oblast prostaty cíleně ozařována do celkové dávky 70–74 Gy. V případě použití IMRT - -techniky se aplikovaná dávka zvyšuje až na 80 Gy.
Při brachyradioterapie (intersticiální radioterapii) prostaty je zaváděn zářič přímo do tkáně prostaty. Existují 2 varianty: jednak použití nízkého dávkového příkonu (low-dose rate – LDR), jednak použití vysokého dávkového příkonu (high-dose rate – –HDR). Brachyradioterapie prostaty při použití HDR se provádí pomocí tzv. „afterloadingu“, kdy se zářiče zavádějí do cílového objemu pomocí speciálních zavaděčů napojených na ozařovač, který je ovládán z vedlejší místnosti. Při použití LDR jsou radioaktivní zrna zaváděna speciálním zavaděčem přímo do prostaty.
Z dozimetrického porovnání brachyradioterapie a zevní konformní radioterapie vyplývá větší možnost elevace dávky při brachyradioterapii.
V případech vyššího rizika šíření karcinomu do periprostatické tkáně, popřípadě pánevních lymfatických uzlin, je vhodné zevně ozářit v počátečním cílovém objemu oblast malé pánve v rozsahu zahrnujícím obturátorové a zevní ilické uzliny. Poté je možné provést brachyradioterapeutické ozáření. Výhodou této kombinace je snížení nehomogenity dávky při současném zvýšení dávky na prostatu [9].
RIZIKOVÉ A PROGNOSTICKÉ FAKTORY
U části pacientů léčených s kurativním záměrem však bohužel časem dojde k progresi, popřípadě k úmrtí. Riziko biochemické recidivy karcinomu prostaty u pacientů léčených s kurativním záměrem i u velmi pečlivě indikované skupiny činí až 30 % během 10 let [10,11].
Je to dáno tím, že i přes veškerou snahu detekovat karcinom prostaty v co nejčasnějším období a správně indikovat kurativní postup se nevyhneme tomu, že pacient má skutečné patologické stadium vyšší, než je předpokládané stadium klinické, a dojde k progresi onemocnění. Jednou z příčin je nemožnost přesného určení biologických vlastností každého nádoru a také diagnostická nepřesnost, především podhodnocení skutečného rozsahu nádoru při klinickém vyšetření (understaging), kdy 43–75 % cT2 je přehodnoceno na pT3 [12,13]. Na selhání terapie s kurativním záměrem se může podílet také nesprávně provedená definitivní léčba (pozitivní okraje, nedostatečné ozáření prostaty).
Měli bychom se vždy snažit zjistit, jaká je pravděpodobnost, že po primární léčbě s kurativním záměrem dojde k recidivě, resp. zjistit, zda jsou přítomny některé prognostické faktory progrese.
V současné době se prognostické faktory KP dají rozdělit do několika skupin:
• klinicky aplikovatelné - PSA v séru, stage, grade, chirurgické okraje
• rutinně neužívané - ploidita, histologický typ, objem tumoru
• potenciální - cirkulující buňky, angiogenetické růstové faktory, apoptóza, jaderná morfometrie, neuroendokrinní diferenciace, perineurální invaze, PSA-deriváty, onkogeny, tumor-supresorové geny (TSG)
Ve snaze odhadnout na základě klinického vyšetření možná rizika další progrese onemocnění bylo navrženo několik klasifikací karcinomu prostaty, z nichž je nejužívanější klasifikace podle D´Amica et al z roku 1998 (tab. 2).
Tab. 2. D´Amicova klasifikace KP dle rizika progrese [14]. ![D´Amicova klasifikace KP dle rizika progrese [14].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/144bd61fed593f45a1120f420c5eb931.png)
U pacientů s nízce rizikovým lokalizovaným KP je monoterapie RAPE, radioterapie dostačující, na druhé straně u pacientů s vysokým rizikem progrese onemocnění by měla být doplněna další léčebná modalita, která by příznivě ovlivnila další průběh onemocnění.
Vzhledem k androgenní dependenci většiny karcinomů prostaty je logickým krokem k doplnění terapie s kurativním záměrem právě androgenní deprivace (AD).
NEOADJUVANTNÍ ANDROGENNÍ BLOKÁDA
Neoadjuvantní androgenní blokáda představuje užití androgenní deprivace před definitivní léčbou. Cílem tohoto postupu je zmenšení objemu nádoru (downstaging), a tím zlepšení efektu radioterapie. Redukce objemu tumoru umožní, zejména v 3D-plánování, zmenšení ozařovaného cílového objemu a oxygenace tumoru, která se po neoadjuvantní hormonální léčbě zlepšuje a vede k vyšší senzitivitě tumoru vůči radioterapii. Velice důležitá je rovněž redukce případných mikrometastáz.
Existuje několik studií, které hodnotí efekt neoadjuvantní androgenní blokády a radioterapie. Použití neoadjuvantní androgenní deprivace před radioterapií karcinomu prostaty s kurativním záměrem dlouho vycházelo zejména z výsledků studie Radiotherapy and Oncology Group (RTOG ) 86-10, do níž bylo zařazeno 471 mužů s lokálně pokročilým onemocněním, náhodně rozdělených do skupiny s radioterapií samotnou a do skupiny, v níž radioterapii předcházela 4měsíční neoadjuvantní androgenní deprivace. Celkové 8leté přežití činilo 53 % ve skupině s neoadjuvantní androgenní deprivací oproti 44 % ve skupině s radioterapií samotnou [15].
Také výsledky několika dalších menších randomizovaných, kontrolovaných klinických studií nasvědčují tomu, že krátkodobá (tj. méně než 9měsíční) androgenní deprivace zlepšuje výsledky léčby, je-li aplikována před radioterapií a během ní u mužů s lokálně pokročilým karcinomem prostaty, kteří mají vysoké riziko vzniku metastáz. Laverdiere et al [16] se snažili odpovědět na otázku, jaká je optimální doba podávání androgenní deprivace ve spojení s radioterapií. Do 2 prospektivních randomizovaných studií bylo zařazeno celkem 481 pacientů s karcinomem prostaty ve stadiích T2 a T3. Bez známek biochemického relapsu bylo po 7 letech 42 % pacientů po samotné radioterapii, 66 % pacientů po 3měsíční AD před RT a 69 % pacientů, u kterých byla k neoadjuvanci a RT doplněna ještě 10měsíční adjuvantní léčba. Ze závěrů vyplývá, že oproti krátkodobé neoadjuvanci další přidání hormonální adjuvance nemusí přinášet výraznější výhody.
D'Amico et al [17] ve své studii 206 pacientům s klinicky lokalizovaným karcinomem prostaty (PSA do10 ng/ml, GS > 6) aplikovali buď samotnou zevní RT (70 Gy), nebo kombinaci zevní RT a AD po dobu 6 měsíců. Medián sledování souboru byl 4,5 roku. Pacienti pouze ozařovaní měli signifikantně kratší dobu přežití (78 % vs 88 %) a nižší dobu přežití bez nutnosti salvage terapie (57 % vs 82 %).
Jedna z největších studií hodnotících krátkodobou androgenní deprivaci a radioterapii v léčbě lokálně pokročilého karcinomu prostaty byla studie TROG 96-01 [18]. Bylo do ní zařazeno celkem 818 pacientů s KP ve stadiu T2b, T2c, T3 a T4, bez průkazu postižení lymfatických uzlin, kostních metastáz nebo metastáz v jiných lokalitách. Pacienti byli stratifikováni podle věku (do 70 a nad 70 let), stadia (T2b + T2c vs T3 + T4) a diferenciace nádoru (dobře vs středně vs špatně). Pacienti v kontrolní skupině byli léčeni pouze radioterapií. Pacientům náhodně zařazeným do skupiny s AD byl aplikován goserelin 3,6 mg s.c. 1krát měsíčně + flutamid 3krát 250 mg denně. Skupina s AD byla rozdělena na další 2 podskupiny: v 1. byla podávána AD celkem 3 měsíce se zahájením 2 měsíce před RT, ve 2. podskupině byla celková doba podávání AD 6 měsíců se zahájením 5 měsíců před RT.
Studie prokázala význam krátkodobé (3měsíční nebo 6měsíční) androgenní deprivace v léčbě pacientů s lokálně pokročilým karcinomem prostaty. 3měsíční androgenní deprivace statisticky významně snižuje riziko biochemického selhání, zvyšuje bezpříznakové přežití. 6měsíční androgenní deprivace také zlepšuje přežití specifické pro karcinom prostaty. 84 % pacientů s prokázaným přínosem delší neoadjuvantní androgenní deprivace v porovnání s aplikací kratší patřilo do skupiny s vysokým rizikem.
Studie Crooka et al [19] porovnávala 3měsíční a 8měsíční neoadjuvantní androgenní deprivaci u 378 mužů a dospěla k negativním výsledkům - s 5letou biochemickou kontrolou 61 % pro 3měsíční léčbu a 62 % pro 8měsíční léčbu. Analýza podskupin však ukázala, že pacienti s vysokým rizikem (tj. T2c T3, Gleasonovo skóre 8–10 nebo koncentrace prostatického specifického antigenu > 20 ng/ml) mohou mít prospěch z delší neoadjuvantní androgenní deprivace (5letá biochemická kontrola 52 % proti 39 %).
ADJUVANTNÍ ANDROGENNÍ BLOKÁDA
Horwitz et al uvedli v práci prezentované na 41. výroční konferenci ASTRO dlouhodobé výsledky RTOG-studií (Radiation Therapy Oncology Group) 85.31 a 86.10 (575 pacientů T3 N0 M0 a 418 pacientů T2b-T4 N0 M0) [20]. Pacienti byli randomizováni a v RTOG 85-31 dostávali dlouhodobou hormonální léčbu goserelinem, s počátkem v posledním týdnu radioterapie a pokračováním na neurčitě dlouhou dobu. Pacienti v RTOG 86-10 byli léčeni hormony krátkodobě: 2 měsíce před radioterapií a v jejím průběhu dostávali goserelin a flutamid. Sledované společné body zahrnovaly poměr celkového 8letého přežívání, kauzálně specifické selhání, vzdálené metastázy a 5leté biochemické přežívání bez onemocnění, definované jako hladina PSA po léčbě nižší než 1,5 ng/ml déle než 1 rok po randomizaci. Statisticky významné rozdíly ve výsledcích byly zaznamenány v poměru biochemického přežívání bez onemocnění a v poměru vzdálených metastáz mezi skupinami samostatně prováděné radioterapie a radioterapie s hormonální léčbou. Hraniční statisticky významné rozdíly byly zaznamenány při porovnání kauzálně specifického selhání, ve výskytu vzdálených metastáz a v 5letém biochemickém přežívání bez onemocnění. U pacientů, kteří podstoupili dlouhodobou hormonální léčbu, byly poměry v jejich prospěch omezeny na tumory s Gleasonovým skóre 7 a 8–10, a to v biochemickém přežívání bez onemocnění (p = 0,0002), ve výskytu vzdálených metastáz (p = 0,05) a v kauzálně specifickém selhání (p = 0,02). Autoři konstatují, že u pacientů s lokálně pokročilým karcinomem prostaty dochází ke zlepšení poměru biochemického přežívání bez onemocnění a výskytu vzdálených metastáz v případě, že jsou léčeni adjuvantní hormonální terapií a radioterapií. Ukázalo se, že dlouhodobá adjuvantní blokáda je lepší než hormonální terapie krátkodobá.
Bolla et al provedli randomizovanou studii (fáze III studie EORTC - European Organisation for Research and Treatment of Cancer), v níž hormonální terapii (cyproteron acetát 1 měsíc a goserelin 3 roky) s konvenčním ozářením srovnávali s ozářením samotným u 415 pacientů s klinickým stadiem T1, T2 a vysokým grade (G3) nebo lokálně pokročilými nádory T3 nebo T4. Většina pacientů ve studii měla PSA vyšší než 10 ng/ml. Celkové 5leté přežití (78 % vs 62 %), doba bez klinických známek recidivy (74 % vs 40 %) a specifické přežití (94 % vs 79 %) byly signifikantně lepší při použití radioterapie v kombinaci s hormonální léčbou než při radioterapii samotné [21,22].
Metaanalýza více než 2200 pacientů Radiation Therapy Oncology Group RTOG (Roach et al) prokázala, že přidání dlouhodobé hormonální léčby ke konvenční radioterapii zvyšuje 8leté přežití asi o 20 % u pacientů s GS 8 10, u pacientů s GS 7 a více a u pacientů s klinickým stadiem T2 a více [23].
Early Prostate Cancer (EPC) Programme je doposud světově největší a stále probíhající program studií pacientů s lokalizovaným nebo lokálně pokročilým karcinomem prostaty léčených adjuvantně bikalutamidem 150. Tvoří jej 3 prospektivní, dvojitě zaslepené, placebem kontrolované studie zahrnující celkem 8 113 mužů.
Zařazeni byli pacienti s nádorem T1b – –T4 M0. V severoamerické studii byla léčba podávána adjuvantně po dobu 2 let, v dalších 2 studiích do doby relapsu nemoci, smrti nebo objevení se závažných vedlejších účinků. V kategorii T1–T2 bylo 67,4 % pacientů, v kategorii T3 31 % a v kategorii T4 1 %. Celkem 22 % pacientů mělo GS 2–4, GS 5 – 6 mělo 44,3 % a GS 7–10 mělo 32,6 % pacientů.
Již první publikované výsledky s průměrným 3letým sledováním ukázaly ve větvích s bikalutamidem signifikantně delší přežívání pacientů bez progrese (PFS) ve srovnání se standardní léčbou. Další výsledky pacientů s průměrným sledováním 5,4 roku prokázaly prodloužení PFS o 26 % u pacientů po radioterapii s adjuvantně podávaným bikalutamidem.
V současné době byla publikována data z poslední, 3. analýzy po průměrné době sledování 7,4 roku. V souladu s předchozími hodnoceními nebyl v žádné z dílčích studií zjištěn statisticky významný rozdíl v celkovém přežití ve srovnání s pacienty bez další léčby. Výsledky však potvrzují významné zlepšení v objektivní době bez progrese onemocnění 21 %.
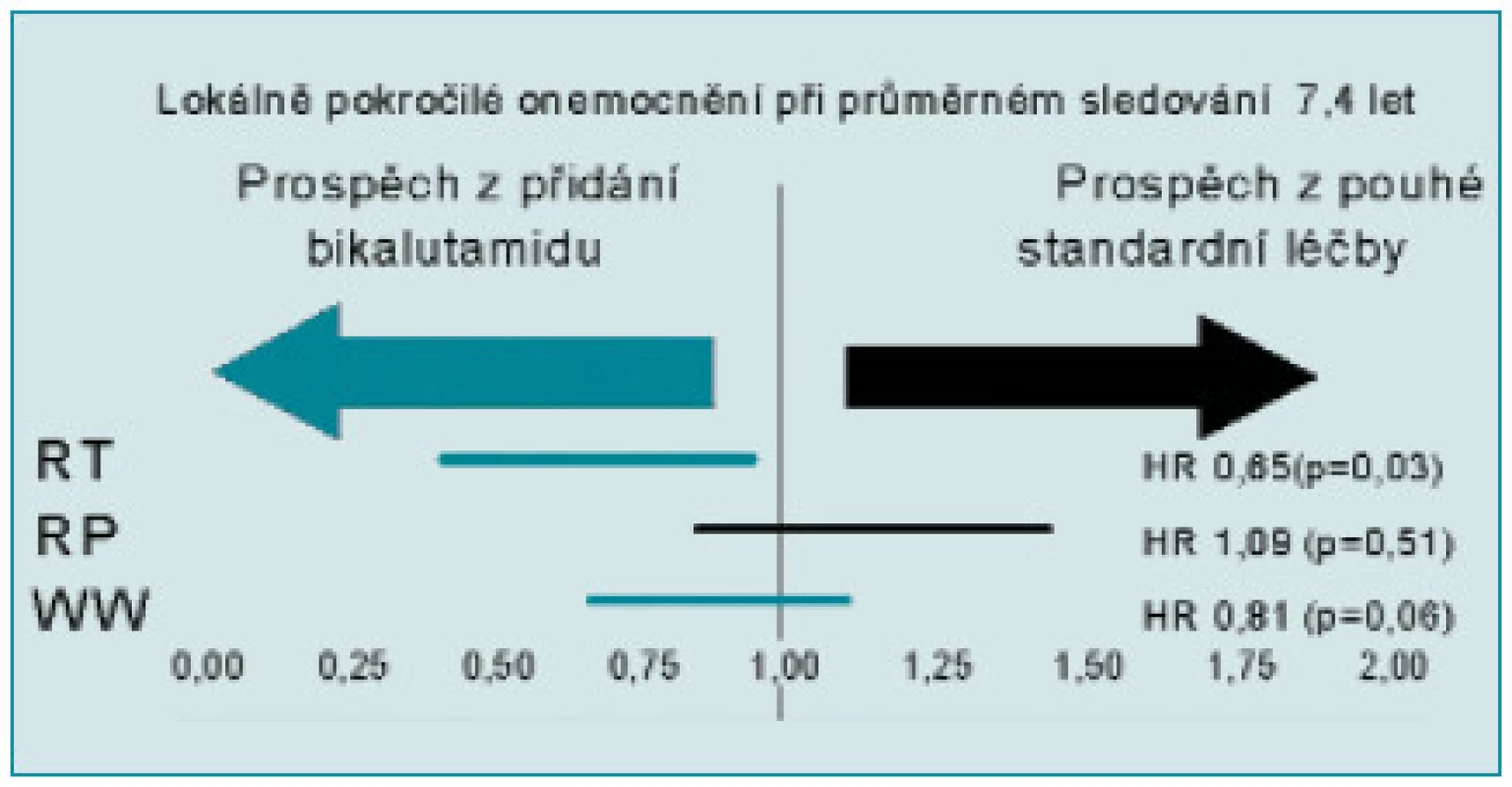
Za účelem bližší specifikace výsledků v jednotlivých podskupinách byly v posledním hodnocení nově provedeny analýzy rozdělující pacienty do skupiny s lokalizovaným KP (T1 2) a s nádory pokročilými (T3 4). U lokalizovaných KP nebyl zjištěn významný přínos podávání bikalutamidu ve smyslu zlepšení celkového přežití bez ohledu na způsob předchozí léčby. Analýza naopak jasně prokázala přínos bikalutamidu 150 u pacientů s lokálně pokročilým KP. Nejjednoznačnější rozdíl je patrný u pacientů léčených radioterapií s kurativním záměrem (36 %), benefit byl zaznamenán i u pacientů jen sledovaných (19 %) (obr. 1, 2). Rozdíly ve skupině po radikální prostatektomii nejsou statisticky významné [24,25,26].
ZÁVĚR
Naší hlavní a primární snahou je detekovat karcinom prostaty včas, tedy ve fázi, kdy onemocnění můžeme definitivně vyléčit. Přes veškerou snahu se však nevyhneme tomu, že pacient má skutečné patologické stadium vyšší, než je předpokládané stadium klinické, a že jsou přítomny rizikové faktory, a tedy vyšší riziko progrese onemocnění. Vyléčitelnost onemocnění radikálním léčebným postupem se potom stává více spornou a spolu s ní i indikace radikální léčby.
Dosud provedené studie prokázaly, že u pacientů s lokálně pokročilým KP nebo u pacientů s přítomnými rizikovými faktory progrese onemocnění léčených radioterapií s kurativním záměrem by radioterapie neměla být užita jako monoterapie, ale měla by být kombinována s androgenní deprivací. Bylo zjištěno, že neoadjuvantní a adjuvantní androgenní deprivace zvyšuje lokální kontrolu nádoru, prodlužuje čas do vzniku diseminace a u pacientů po radioterapii s kurativním záměrem prodlužuje celkové přežití.
MUDr. Vítězslav Vít
prof. MUDr. Dalibor Pacík, CSc.
Urologická klinika LF MU a FN Brno, pracoviště Bohunice
Zdroje
1. Údaje Národního onkologického registru České republiky.
2. Jemal A, Tiwari RC, Murray T et al. Statistics, 2004 Ca Cancer. J Clin 2004; 54 : 8 29.
3. Hanks GE. Three-dimensional conformal radiation therapy for prostate cancer. In: D´Amico AV, Hanks GE (eds). Radiotherapeutic management of prostate adenocarcinoma. London: Arnold 1999 : 21 50.
4. Hanks GE. Conformal radiotherapy for prostate ancer. Ann Med 2000; 32 : 57 63.
5. Gunderson LL, Tepper JE. Clinical Radiation Oncology. New York: Churchil Livingstone 2000 : 761 878.
6. Zimmerman FB, Molls M. Three-dimensional treatment planning. Principles and practice. Onkologie1998; 21 : 474 484.
7. Feldmann HJ, Kneschaurek P, Molls M. Threedimensional radiation treatment. Basel: Karger 2000.
8. Fraass BA, Kessler ML, McShan LH et al. Optimization and clinical use of multisegment intensity-modulated radiation therapy for high-dose conformal therapy (review). Semin Radiat Oncol 1999; 9 : 60 77.
9. Martinez A, Gonzales J, Stromberg J et al. Conformal prostate brachytherapy. Initial experience of a phase I/II dose-escalating trial. Int J Radiat Oncol Biol Phys 1995; 33 : 1019 1027.
10. Grossfeld GD, Stier DM, Flanders SC, Henning JM, Schonfeld W, Warolin K, Carroll PR. Use of second treatment following definitive local therapy for prostate cancer: data from the CaPSURE database. J Urol 1998; 160 : 1398 1404.
11. Koppie TM, Grossfeld GD, Miller D, Yu J, Stier D, Broering JM, Lubeck D, Henning JM, Flanders SC, Carroll PR. Patterns of treatment of patients with prostate cancer initially managed with surveillance: Results from the CaPSURE database. J Urol 2000; 164 : 81 88.
12. Catalona WJ, Bigg SW. Nerve sparing radical prostatectomy. Evaluation of results after 250 patients. J Urol 1990; 143 : 539 544.
13. Hering F, Rist M, Roth J et al. Does microinvasion of the capsule and/or micrometastases in regional lymph nodes influence disease-free survival after radical prostatectomy? Br J Urol 1990; 66 : 177 181.
14. D´Amico AV et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998; 280 : 969 974.
15. Pilepich M, Winter K, John M et al. Phase III radiation therapy oncology group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001; 50 : 1243 1252.
16. Laverdiere J, Nabid A, De Bedoya LD, Ebacher A, Fortin A, Wang CS, Harel F. The efficacy and sequencing of a short course of androgen suppression on freedom from biochemical failure when administred with radiatio therapy for T2 T3 prostate cancer. J Urol 2004; 171(3): 1137 1140.
17. D´Amico AV, Manola J, Lofredo M et al. 6. month androgen suppression plus radiation therapy vs radition therapy alone for patients with clinically localized prostate cancer: a randomized controlled trial. JAMA 2004; 292 : 821 827.
18. Denham J, Steigler A, Lamb D et al. Short-term androgen deprivation and radiotherapy for locally advance prostate cancer: results from the Trans-Tasman Radiation Oncology Group 96.01 randomised controlled trial. Lancet Oncol 2005; 6 : 841 850.
19. Crook J, Ludgate C, Malone S et al. Report of multicenter Canadian phase III randomized trial of 3 months vs 8months neoadjuvant androgen deprivation before standard-dose radiotherapy for clinically localized prostate cancer. Int J Radiat Oncol Biol Phys 2004; 60 : 15 23.
20. Horwitz EM, Winter K, Hanks GE, Byhardt RW, Russell AH, Machtay M, Pilepich MV. Long-term outcome for patients with locally advanced non-metastatic prostate cancer treated with adjuvant hormones and radiaion therapy versus radiation therapy alone: subset analysis od RTOG 85.31 and 86.10. Int J Radiat Oncol Biol Phys 1999; 45(suppl): 220 221.
21. Bolla M, Gonzales D, Warde P et al. Improved survival in patients with locally adanced prostate cancer treated with radiotherapy and goserelin. N Engl J Med 1997; 337 : 295 300.
22. Bolla M, Collette L, Blank L, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002; 360 : 103 108.
23. Roach M, Lu J, Pilepich MV et al. Predicting longterm survival and the need for hormonal therapy: a meta-analysis of RTOG prostate cancer trials. Int J Radiat Oncol Biol Phys 2000; 47 : 617 627.
24. Wirth H, Tyrrel C, Wallace M et al. Bicalutamide (Casodex) 150 mg as immediate therapy in patients with localised or locally advanced prostate cancer significantly reduced risk of disease progression. Urology 2001; 58 : 146 151.
25. McLeod DG, See W, Iversen P et al. Tolerability of bicalutamide (Casodex) 150mg as immediate or adjuvant therapy in 8113 men with localised or locally advanced prostate cancer. J Urol 2001; 165 : 150 151.
26. Svoboda T. EPC program, přidání bicalutamidu ke standardní léčbě časného karcinomu prostaty, 3. analýza po 7,4 roku. Med Trib 2005; 19 : 8 12.
Štítky
Detská urológia Urológia
Článek LYMFATICKÁ DRENÁŽ PROSTATYČlánek KvízČlánek STRAVA A KARCINOM PROSTATYČlánek ZE ZAHRANIČNÍCH PERIODIK
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2006 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- LYMFATICKÁ DRENÁŽ PROSTATY
- PÁNEVNÍ LYMFADENEKTOMIE U KARCINOMU PROSTATY A JEJÍ HRANICE
- Kvíz
- GENETICKÁ NÁCHYLNOST A OXIDAČNÍ STRES U KARCINOMU PROSTATY: INTEGROVANÝ MODEL S DOPORUČENÍMI PRO PREVENCI
- KINETIKA PSA − MŮŽE POMOCI PREDIKOVAT PŘÍTOMNOST A ZÁVAŽNOST KARCINOMU PROSTATY?
- PSA A VČASNÁ DETEKCE KARCINOMU PROSTATY
- PATOLOGIE PROSTATY A HLADINY ANDROGENŮ A ESTROGENŮ
- KLINICKÝ PŘÍSTUP K SUPRESI ANDROGENŮ A RADIOTERAPII ZALOŽENÝ NA DŮKAZECH U MUŽŮ S LOKÁLNĚ POKROČILÝM NEBO LOKALIZOVANÝM KARCINOMEM PROSTATY
- CO JE NOVÉHO V HODNOCENÍ PATOLOGIE KARCINOMU PROSTATY V ROCE 2006
- CYTOTOXICKÁ CHEMOTERAPIE U KARCINOMU PROSTATY
- ROBOTICKY ASISTOVANÁ RADIKÁLNÍ LAPAROSKOPICKÁ PROSTATEKTOMIE: SOUČASNÝ STAV
- STRAVA A KARCINOM PROSTATY
- AKTUÁLNÍ INFORMACE O KARCINOMU PROSTATY
- CO NA PUBLIKOVANÉ ČLÁNKY ŘÍKÁ PROFESOR PATRICK C. WALSH?
- ZE ZAHRANIČNÍCH PERIODIK
- GUIDELINES EAU PRO KARCINOM PROSTATY
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- STRAVA A KARCINOM PROSTATY
- PSA A VČASNÁ DETEKCE KARCINOMU PROSTATY
- PÁNEVNÍ LYMFADENEKTOMIE U KARCINOMU PROSTATY A JEJÍ HRANICE
- LYMFATICKÁ DRENÁŽ PROSTATY
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy