-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ze zahraničních periodik
Vyšlo v časopise: Urol List 2008; 6(2): 85-96
komentáře zpracovali J. Fitzpatrick, N. Haldar, B. Khoubehi, R. Sutherland
U pacientů s TCC ohraničeným na orgán je konkomitantní karcinom in situ – detekovaný při radikální cystektomii – známkou agresivní povahy onemocnění
Concomitant carcinoma in situ is a feature of aggressive disease in patients with organ-confined TCC at radical cystectomy
Shariat SF, Palapattu GS, Karakiewicz PI et al. University of Texas Southwestern Medical Center, Dallas, TX, USA. Eur Urol 2007; 51 : 152-160.
Přítomnost karcinomu in situ (CIS) je u pacientů s povrchovým a svalovinu invadujícím karcinomem močového měchýře známkou horší prognózy. Tato studie hodnotí prognostický význam vzniku konkomitantního CIS po radikální cystektomii.
Autoři této retrospektivní studie hodnotili záznamy 713 pacientů (z celkových 812) s karcinomem močového měchýře z přechodných buněk (TCC), kteří podstoupili radikální cystektomii a pánevní lymfadenektomii ve 3 amerických akademických centrech. Autoři studie zjistili, že u 330 pacientů (43,6 %) byl při radikální cystektomii detekován konkomitantní CIS. CIS se vyskytoval častěji u pacientů, u nichž TCC zasahoval také močovou trubici. Výskyt CIS byl dále významně častější u pacientů s tumory nižšího stadia a vyššího grade.
Univarietní analýza prokázala, že pacienti s konkomitantním CIS mají ve srovnání s pacienty, u nichž nebyl detekován CIS, vyšší riziko recidivy onemocnění (p = 0,0371). Po přizpůsobení vlivu běžných pooperačních znaků představuje u pacientů s onemocněním ohraničeným na orgán konkomitantní CIS nezávislý faktor předpovídající recidivu onemocnění (ale nikoliv mortalitu specifickou pro karcinom močového měchýře).
Recidiva karcinomu z přechodných buněk v horních močových cestách po radikální cystektomii pro TCC: analýza 1 069 pacientů sledovaných po dobu 10 let
Upper tract urothelial recurrence following radical cystectomy for transitional cell carcinoma of the bladder: an analysis of 1,069 patients with 10-year followup
Sanderson KM, Cai J, Miranda G et al. University of Southern California/Norris Cancer Center, Los Angeles, CA, USA. J Urol 2007; 177 : 2088-2094.
Přibližně u 3 % pacientů s karcinomem močového měchýře z přechodných buněk (TCC) dojde po radikální cystektomii k recidivě TCC v urotelu horních cest močových (UUT) [J Urol 2005; 173 : 1163-1168]. Rizikové faktory zodpovědné za recidivu TCC v UUT po radikální prostatektomii nebyly doposud zcela jednoznačně rozpoznány. Tato retrospektivní studie hodnotí tyto rizikové faktory a prognózu u pacientů, u nichž dojde po radikální cystektomii k recidivě TCC v UUT. K hodnocení autoři užili prospektivní databázi University of Southern California (Los Angeles, CA, USA). V období od ledna 1985 do prosince 2001 podstoupilo radikální cystektomii celkem 1 069 pacientů (853 mužů a 216 žen).
Střední doba sledování byla 10,3 let. Ve studii bylo zaznamenáno celkem 27 případů (2,5 %) recidivy UUT po radikální cystektomii, k níž došlo po střední době 3,3 let (0,4–9,3 let). Autoři hodnotili následující rizikové faktory: věk a pohlaví pacienta, stadium a grade tumoru. Za faktor předpovídající recidivu UUT byla považována pouze invaze TCC do močové trubice. U mužů souvisí invaze superficiálního TCC do prostatické uretry se zvýšeným rizikem vzniku recidivy UUT (ve srovnání s invazí do prostatického stromatu nebo absencí invaze TCC do prostaty, p < 0,01). U žen souvisí invaze TCC do močové trubice se zvýšeným rizikem recidivy UUT (p = 0,01).
Nejčastější příčinou detekce recidivy UUT byla přítomnost symptomů, které se vyskytly navzdory rutinnímu sledování horních cest močových u 78 % pacientů. Prognóza pacientů, u nichž dojde k recidivě UUT, je velmi špatná - se střední očekávanou dobou života 1,7 let (0,2–8,8 let). Zajímavým zjištěním je fakt, že ani u pacientů, u nichž byl UUT tumor detekován během sledování před vznikem symptomů, nedošlo ke zlepšení doby přežití.
Závěrem autoři uvádějí, že pacienti s TCC, kteří podstupují radikální cystektomii, mají po celý zbytek života vyšší riziko recidivy UUT. Tato recidiva není obvykle při běžném sledování detekována. Za jediný významný rizikový faktor lze u těchto pacientů považovat invazi TCC do močové trubice.
Analýza progrese a doby přežití v randomizované prospektivní studii srovnávající účinek mitomycinu C a BCG u pacientů s karcinomem močového měchýře s vysokým rizikem (po 10 letech)
Analysis of progression and survival after 10 years of a randomized prospective study comparing mitomycin-C and bacillus Calmette-Guérin in patients with high-risk bladder cancer.
Gårdmark T, Jahnson S, Wahlquist R et al. Surgical Sciences, Uppsala, Sweden. BJU Int 2007; 99 : 817-820.
Mitomycin C (MMC) a bacillus Calmette-Guérin (BCG) jsou preparáty doporučované pro léčbu karcinomu močového měchýře s vysokým rizikem, který neinvaduje do svalové tkáně. Zatímco guidelines publikované Americkou urologickou asociací neupřednostňují jeden typ léčby před druhým, guidelines Evropské urologické asociace (EAU) uvádějí BCG jako standardní možnost léčby. Doporučení EAU vycházejí z důkazů, že aplikace BCG umožňuje větší snížení míry recidivy papilárních tumorů a karcinomu in situ (CIS) než intravezikální chemoterapie s MMC. Vliv této terapie na progresi onemocnění a dobu přežití je méně zřetelný. Dřívější studie prokazují, že BCG umožňuje větší snížení míry recidivy (ve srovnání s MMC), mezi oběma terapiemi však nebyl zaznamenán žádný rozdíl v celkové době přežití [J Urol 1999; 161 : 1124-1127].
Autoři tohoto článku hodnotili progresi, nutnost provedení další, agresivnější terapie, celkovou míru přežití a míru přežití specifickou pro karcinom u pacientů s vysoce rizikovým karcinomem močového měchýře neinvadujícím svalovou tkáň, kteří podstoupili léčbu BCG a MMC [randomizovaná studie – J Urol 1996; 156 : 372-376] po 10 letech sledování.
V letech 1987–1992 bylo celkem 261 pacientů randomizováno k aplikaci 40 mg MMC nebo 120 mg BCG (dánský kmen 1331) – po dobu prvních 6 týdnů 1krát týdně, po dobu dalšího roku 1krát za měsíc a po dobu dalšího roku 1krát za 3 měsíce.
Průměrný věk pacientů při randomizaci byl 68 let (27–86 let). 131 pacientů bylo randomizováno k aplikaci MMC a 131 pacientů k aplikaci BCG. K dispozici byly údaje 125 pacientů z každé skupiny. Střední doba sledování (pacientů, kteří přežili) byla 123 měsíců. K progresi onemocnění – která byla definována jako vznik onemocnění vyššího stadia – došlo u 58 (23 %) pacientů (34/125 – 27 %) ve skupině pacientů léčených pomocí MMC a u 24/125 (19 %) ve skupině pacientů léčených pomocí BCG (p = 0,26). Střední doba do progrese onemocnění byla 27 měsíců (2–171 měsíců). 26 pacientů léčených MMC a 19 pacientů léčených BCG zemřelo na karcinom (p = 0,98). U 47 (19 %) pacientů byla indikována sekundární léčba (26 pacientů užívajících MMC, 21 pacientů užívajících BCG, p = 0,42). Nejčastěji byla indikována cystektomie (13 pacientů léčených MMC) a radioterapie (10 pacientů léčených BCG).
Závěrem autoři uvádějí, že v této studii nebyl s ohledem na progresi, potřebu další léčby, ani doby přežití u pacientů s povrchovým karcinomem s vysokým rizikem prokázán žádný rozdíl mezi aplikací MMC a BCG.
Radikální hypofrakcionovaná akcelerovaná radioterapie s buněčnou ochranou při léčbě karcinomu močového měchýře
Radical hypofractionated accelerated radiotherapy with cytoprotection for invasive bladder cancer
Koukourakis MI, Tsolos C, Touloupidis S. University Hospital of Alexandroupolis, Alexandroupolis, Greece. Urology 2007; 69 : 245-250.
Zachování močového měchýře pomocí radiochemoterapie umožňuje u > 60 % pacientů dosáhnout až 70% míry odezvy během 10letého období bez recidivy onemocnění. Tato metoda tedy v současné době představuje vhodnou alternativu k cystektomii. V současnosti také probíhá výzkum zvýšené účinnosti změny frakcionované dávky.
Užívání velkých frakcí dávek ozáření se v klinické praxi ukázalo jako účinné a umožňuje dosáhnout 20–30% míry lokální kontroly. Užívání radikální hypofrakcionované akcelerovaná radioterapie (s i bez chemoterapie) nebylo při léčbě karcinomu močového měchýře doposud testováno. Tato metoda se však užívá při léčbě karcinomu prsu, prostaty a nádorů hlavy a krku (s aplikací vysoké dávky amifostinu). Autoři této studie testovali účinek hypofrakcionované akcelerované radioterapie s buněčnou ochranou (hypoARC) s nebo bez aplikace doxorubicinu na 38 pacientech.
Do této studie byli zařazeni pacienti s invazivním karcinomem močového měchýře z přechodných buněk. Léčba zahrnovala 14 dávek 3,4 Gy/den a doplňkovou dávku 3,4 Gy 19. den terapie. Všem pacientům byla před radioterapií aplikována injekce 1 000 mg amifostinu. 19 pacientům byla navíc aplikována chemoterapie s 25 mg/m2 lipozomálního doxorubicinu. Autoři zjišovali celkový krevní obraz, hladinu urey a kreatininu v séru, hladinu jaterních enzymů a toxicitu radioterapie a chemoterapie.
36 pacientů (z celkových 38) snášelo aplikovanou dávku amifostinu dobře (i nejvyšší dávku 1 000 mg), pouze 2 pacienti nebyli schopni léčbu tolerovat. U pacientů užívající vyšší dávku (750–1 000 mg) byla zaznamenána nižší incidence cystitidy a průjmu než u pacientů užívajících nižší nebo žádnou dávku amifostinu. U pacientů užívajících vyšší dávku bylo také menší opoždění aplikace radioterapie. U 32 pacientů byla zaznamenána úplná odezva na léčbu, u 5 pacientů došlo ke zmenšení objemu tumoru. Doplňková chemoterapie zlepšila míru výskytu recidivy o 10 %, toto zlepšení však nelze považovat za statisticky signifikantní. U 84 % pacientů byla zaznamenána úplná odezva na léčbu. Dále byla zaznamenána 80% míra v 24měsíční době přežití bez recidivy onemocnění, 75% míra celkové doby přežití a 86% míra doby přežití specifické pro onemocnění – tyto výsledky lze považovat za velmi povzbudivé.
Tato studie prokazuje, že léčba hypoARC umožňuje dosáhnout vyšší míry kontroly karcinomu močového měchýře a je spojena s přijatelnou mírou toxicity. Ve srovnání s běžným režimem je tato léčba o 4 týdny kratší.
Změna léčebného režimu může u pacientů s povrchovým karcinomem močového měchýře s vysokým rizikem vést ke zlepšení doby přežití
Treatment paradigm shift may improve survival of patients with high risk superficial bladder cancer
Raj GV, Herr H, Serio AM et al. Memorial Sloan-Kettering Cancer Center, New York, NY, USA. J Urol 2007; 177 : 1283-1286.
U pacientů s tumory močového měchýře T1 se obvykle za léčbu první volby považuje intravezikální aplikace BCG. U pacientů, u nichž dojde po této terapii k recidivě T1 onemocnění, v minulosti urologové upřednostňovali techniky umožňující zachování močového měchýře. Z důvodu rizika invaze onemocnění do svalové tkáně lékaři v současné době pacientům častěji nabízejí možnost radikální cystektomie. Tato studie hodnotí dopad změny terapie na míru progrese a míru přežití specifického pro onemocnění u pacientů s recidivujícím karcinomem T1 (po počáteční intravezikální aplikaci BCG).
Tato retrospektivní studie srovnává 2 kohorty pacientů – 1. skupina zahrnuje 307 pacientů, kteří byli v období 1980–1989 léčeni pomocí intravezikální aplikace BCG, 2. skupina se sestává ze 589 pacientů, kteří podstoupili léčbu v období 1992–2004.
V 1. skupině došlo k recidivě T1 onemocnění u 85/307 pacientů. Pacienti následně podstoupili transuretrální resekci a další intravezikální aplikaci BCG. U 60/85 pacientů došlo k progresi onemocnění do svalové tkáně. V této skupině byla 5 let po recidivě onemocnění zaznamenána 71% míra kumulativní incidence progrese onemocnění T2 a 48% míra kumulativní incidence úmrtí na toto onemocnění.
Ve 2. skupině došlo k recidivě T1 onemocnění u 129/589 pacientů. Na rozdíl od 1. skupiny, byla v této skupině u 65 pacientů provedena okamžitá radikální cystektomie. Po 5 letech byla v této skupině pacientů zaznamenána 28% míra kumulativní incidence progrese onemocnění T2 a 31% míra kumulativní incidence úmrtí na toto onemocnění.
Přestože nebyl zaznamenán žádný statisticky signifikantní rozdíl v míře přežití po recidivě onemocnění, byla zde zaznamenána tendence k tomuto rozdílu.
Můžeme tedy předpokládat, že časná cystektomie může u pacientů, u nichž dojde po aplikaci BCG k recidivě onemocnění, vést k lepší míře doby přežití specifické pro karcinom.
Chování uroteliálního karcinomu v závislosti na jeho lokalizaci
Behavior of urothelial carcinoma with respect to anatomical location
Catto JW, Yates DR, Rehman I et al. University of Sheffield, Sheffield, UK. J Urol 2007; 177 : 1715-1720.
Většina uroteliálních karcinomů se vyskytuje v močovém měchýři a v závislosti na jejich stadiu je možné je léčit pomocí lokální resekce nebo radikální cystektomie a radioterapie. Až 5 % těchto karcinomů je detekováno v horních cestách močových (UUT), z nichž přibližně 2/3 se nacházejí v renální pánvičce. Běžný způsob léčby tumorů v UUT zahrnuje radikální excizi ledviny, ureteru a přilehlé manžety močového měchýře bez ohledu na stadium a lokalizaci onemocnění.
Tomuto radikálnímu přístupu však konkurují endoskopické metody, užívané pro léčbu tumorů s nízkým rizikem. Vzhledem k tomu, že hladká svalovina pokrývající UUT je mnohem tenčí než svalovina pokrývající močový měchýř, mohou zde lokalizované tumory zůstávat ohraničené na orgán kratší dobu než v močovém měchýři.
Tyto tumory mají obvykle vyšší grade a vyšší stadium než karcinomy močového měchýře. Autoři této studie srovnávali klinické výsledky u pacientů s uroteliálními karcinomy horních a dolních cest močových (> 400), kteří byli léčeni ve 4 centrech ve Francii a Velké Británii. Analyzovali 425 pacientů s uroteliálním karcinomem, 275 pacientů s karcinomem močového měchýře, 67 pacientů s karcinomem ureteru a 79 pacientů s karcinomem renální pánvičky.
Autoři nezjistili žádný rozdíl v chování s ohledem na lokalizaci po UUT, poté všechny karcinomy močového měchýře korelovali dle stadia a grade. Multivarietní analýza prokázala, že pouze stadium a grade tumoru lze považovat za faktory předpovídající výsledný stav. Výsledky této studie ukazují, že posun v léčbě uroteliálních karcinomů UUT pomocí nefrony šetřící techniky lze považovat za bezpečný a analogický s technikami používanými u karcinomu močového měchýře. Při invazi lamina propria dochází k signifikantnímu zhoršení míry progrese a míry přežití, což nasvědčuje tomu, že samotná endoskopická ablace představuje nedostatečný způsob léčby onemocnění ve stadiu pT1.
Nízká míra přežití u pacientů s UUT uroteliálním karcinomem invadujícím svalovou tkáň navíc ukazuje potřebu prozkoumat, zda u této populace pacientů umožňuje adjuvantní chemoterapie zlepšení míry přežití, nebo nikoliv.
Typ recidivy onemocnění a výsledný stav po indukční terapii BCG u pacientů s karcinomem močového měchýře Ta, T1 s vysokým rizikem
Patterns of recurrence and outcomes following induction bacillus Calmette - Guerin for high risk Ta, T1 bladder cancer
Lerner SP, Tangen CM, Sucharew H et al. Baylor College of Medicine, Houston, TX, USA. J Urol 2007; 177 : 1727-1731.
U povrchových tumorů močového měchýře s vysokým rizikem se uvádí 50% míra pravděpodobnosti progrese. Za standardní léčbu pacientů s tímto onemocněním lze považovat terapii BCG – míra úplné odezvy na indukční léčbu se pohybuje v rozmezí 50–70 %. V nedávné době provedená metaanalýza prokázala, že ke snížení rizika progrese onemocnění došlo pouze u pacientů, kteří podstoupili udržovací terapii BCG [Urology 2006; 67 : 1216-1223]. Pacienti s recidivujícím onemocněním, kteří podstupují udržovací terapii BCG, však mají vyšší riziko progrese onemocnění a proporcionálně nižší míru dlouhodobého přežití. Pacienti, u nichž dojde k časné recidivě tumoru (během nebo po BCG terapii), mohou mít ve srovnání s pacienty, u nichž dojde k pozdější recidivě, biologicky agresivnější karcinom s vyšším rizikem progrese, který vyžaduje jiný terapeutický přístup.
Autoři této studie provedli analýzu 550 pacientů zařazených do studie SWOG (Southwest Oncology Group), kteří podstoupili udržovací terapii BCG. Cílem této analýzy bylo určení dopadu časné (≤ 12 měsíců) nebo pozdní (≥ 12 měsíců) recidivy na míru dlouhodobého přežití.
Z celkem 501 pacientů, u nichž bylo možné analýzu provést, došlo u 251 pacientů k recidivě a u 229 pacientů k úmrtí. U 59 % pacientů (kteří poté zemřeli) došlo po indukční terapii k recidivě onemocnění. Výsledky této sekundární analýzy velké, randomizované studie III. fáze, která testovala udržovací terapii BCG, neprokázaly žádnou souvislost mezi dobou, kdy došlo k recidivě onemocnění po indukční BCG, a dlouhodobým přežitím. Zajímavým zjištěním je také fakt, že v analýze nebyla prokázána souvislost mezi trváním léčby a změnami v době vzniku recidivy nebo přežití.
Naopak udržovací terapie a cystektomie vedou ke snížení rizika úmrtí. Je obtížné určit, zda tyto výsledky odráží skutečný účinek léčby nebo k nim dochází pouze ve statistických analýzách.
Povrchová (pTa2) a hluboká (pT2b) invaze svalové tkáně při určování patologického stadia karcinomu močového měchýře po radikální cystektomii
Superficial (pT2a) and deep (pT2b) muscle invasion in pathological staging of bladder cancer following radical cystectomy
Yu RJ, Stein JP, Cai J et al. University of Southern California Keck School of Medicine, Los Angeles, CA, USA. J Urol 2006; 176 : 493-498.
Klasifikační systém tumor, uzlina, metastáza umožňuje rozdělení svalovinu invadujících karcinomů močového měchýře ohraničených na orgán na tumory invadující povrchovou (pT2a) a hlubokou (pT2b) svalovinu močového měchýře. Autoři tohoto článku použili pro hodnocení pacientů s onemocněním pT2a a PT2b jednu z největších studií, která zahrnuje pacienty s karcinomem z přechodných buněk, kteří podstoupili cystektomii v letech 1971–2001.
Z celkem 1 359 pacientů byl u 23 % z nich po cystektomii detekován karcinom močového měchýře invadující svalovou tkáň (pT2). U 47 % z nich byl detekován karcinom invadující svalovou tkáň ve stadiu pT2a a u 53 % z nich karcinom ve stadiu pT2b. U celkem 242 pacientů nebyly zjištěny žádné známky výskytu metastáz (včetně 127 pacientů s onemocněním pT2a a 115 pacientů s onemocněním pT2b).
Po střední době sledování 14,3 roku byla u všech pacientů s onemocněním ve stadiu pT2 zaznamenána 72% míra 10leté doby přežití bez recidivy a 47% míra celkové doby přežití. Pacienti s tumorem ve stadiu pT2b měli výrazně vyšší riziko vzniku metastáz do lymfatických uzlin (ve srovnání s pacienty s onemocněním ve stadiu pT2a –30 % vs 14 %, p < 0,001).
Mezi skupinou pacientů s onemocněním ve stadiu pT2a neinvadujícím lymfatické uzliny (84 %) a skupinou pacientů s onemocněním ve stadiu pT2b neinvadujícím/invadujícím lymfatické uzliny nebyl zaznamenán žádný významný rozdíl v míře 10leté doby přežití bez recidivy. Doba přežití bez recidivy byla signifikantně vyšší u pacientů s onemocněním ve stadiu pT2 neinvadujícím lymfatické uzliny než u pacientů s onemocněním pT2 invadujícím lymfatické uzliny (79 % vs 49 %, p < 0,001). U 10/311 pacientů s onemocněním ve stadiu pT2 došlo ke vzniku lokální recidivy, u 69 pacientů došlo ke vzniku vzdálených metastáz. U těchto pacientů však místo recidivy tumoru nijak nesouviselo s jeho stadiem (pT2a vs. pT2b, p = 0,24) nebo zasažením lymfatických uzlin (negativní vs pozitivní, p = 0,37).
Závěrem autoři uvádějí, že přestože pacienti s onemocněním ve stadiu pT2b mají ve srovnání s pacienty s onemocněním ve stadiu pT2a vyšší riziko šíření tumoru do lymfatických uzlin, mezi oběma skupinami nebyl zaznamenán žádný rozdíl v době přežití bez recidivy. Pacienti s tumorem ve stadiu pT2 invadujícím do lymfatických uzlin mají signifikantně nižší míru přežití bez recidivy než pacienti s negativními lymfatickými uzlinami.
Vliv ofloxacinu na toxicitu vyvolanou aplikací BCG u pacientů s povrchovým karcinomem močového měchýře: výsledky randomizované, prospektivní, dvojitě zaslepené, placebem kontrolované multicentrické studie
The effect of ofloxacin on bacillus calmette-guerin induced toxicity in patients with superficial bladder cancer: results of a randomized, prospective, double-blind, placebo controlled, multicenter study
Colombel M, Saint F, Chopin D et al. Universite Claude Bernard, Lyon, France. J Urol 2006; 176 : 935-939.
U značné části pacientů s povrchovým karcinomem močového měchýře, kteří podstupují intravezikální léčbu BCG, je zaznamenána nějaké forma toxicity. Nejenom, že je toxicita potencionální příčinou morbidity u těchto pacientů, ale vede také k přerušení léčby, což může ovlivnit recidivu onemocnění a dobu přežití bez progrese. Cílem této studie bylo zjistit, zda může profylaxe ofloxacinem snížit toxicitu vyvolanou BCG.
Tato randomizovaná, dvojitě zaslepená, multicentrická studie zahrnovala 115 pacientů (průměrný věk 65,6 let) s primárním nebo recidivujícím povrchovým karcinomem močového měchýře (Ta/T1, karcinom in situ, G1–G3), kteří nebyli dříve léčeni pomocí BCG. Tito pacienti byli randomizováni k intravezikální aplikaci BCG plus 200 mg ofloxacinu (skupina 1-57 pacientů) nebo intravezikální aplikaci BCG plus placebo (skupina 2-58 pacientů). Vedlejší účinky vyvolané aplikací BCG byly hodnoceny pomocí detailní klasifikační sítě.
Střední doba sledování 1. skupiny byla 369 dní, střední doba sledování 2. skupiny 374 dní. Mezi 4. a 6. instilací ofloxacinu došlok signifikantnímu snížení (18,5 %) incidence středně závažných a závažných vedlejších účinků a vedlejších účinků II. třídy. Mezi 1. a 9. instilací dále ofloxacin signifikantně snížil incidenci vedlejších účinů III. třídy. Přestože aplikace ofloxacinu vedla ke snížení výskytu komplikací souvisejících s dolními cestami močovými, neumožnila předejít vzniku vedlejších účinků I. třídy. Ofloxacin také zlepšil komplianci léčby BCG – o 80,7 % v 1. skupině (9 instilací) a pouze o 65,5 % ve 2. skupině (p = 0,092). V sekundární analýze autoři hodnotili míru recidivy a progrese v obou skupinách. 12měsíční míra přežití bez recidivy byla 12,7 % v 1. skupině a 17,2 % v 2. skupině, míra progrese 5,5 % v 1. skupině a 1,7 % ve 2. skupině.
Závěrem autoři uvádějí, že aplikace ofloxacinu snižuje u pacientů podstupujících intravezikální aplikaci BCG incidenci středně závažných až závažných vedlejších účinků, zejména komplikací III. třídy, které mají obvykle za následek ukončení léčby. Adjuvantní aplikace ofloxacinu může také zlepšovat komplianci indukční i udržovací terapie. Jedná se o velmi užitečnou studii, která může mít významný klinický dopad. Autoři zdůrazňují, že pro potvrzení těchto počátečních nálezů je nutné provést další dlouhodobé komparativní studie testující ostatní preventivní opatření.
Jaké jsou indikace pro provedení biopsie okrajů ureterů „na zmrzlo“ během cystektomie u pacientů s karcinomem močového měchýře z přechodných buněk?
Is there an indication for frozen section examination of the ureteral margins during cystectomy for transitional cell carcinoma of the bladder?
Schumacher MC, Scholz M, Weise ES et al. Hospital Bern, Bern, Switzerland. J Urol 2006; 176 : 2409-2413.
Otázka provedení vyšetření distálního ureteru „na zmrzlo“ (FSE) během cystektomie zůstává stále kontroverzní. Autoři této studie hodnotili užitek FSE pomocí určení incidence patologických nálezů ureteru při cystektomii u pacientů s karcinomem z přechodných buněk (TCC).
Tato retrospektivní studie zahrnovala 805 pacientů s TCC močového měchýře, kteří podstoupili cystektomii. Autoři srovnávali histopatologické nálezy FSE s odpovídající definitivní histologií a hodnotili diagnostickou přesnost této techniky. Vzorky odebrané při FSE byly následně srovnávány se segmenty proximálnějšího úseku ureteru resekovanými v místě, kde se kříží se společnými iliakálními arteriemi. Histopatologické nálezy byly následně korelovány s recidivou v horních močových cestách a celkovou dobou přežití.
TCC nebo karcinom in situ byl pomocí FSE detekován u 4,8 % pacientů, pomocí definitivní histologie u 3,6 % pacientů a při resekci proximální části ureteru u 1,2 % pacientů. Falešně negativní míra FSE močovodu byla 0,8 %. K recidivě tumoru v horních cestách močových po radikální cystektomii došlo u 3 % pacientů s negativním výsledkem FSE a u 17 %, u nichž byl při FSE detekován karcinom in situ. Zajímavým zjištěním je fakt, že u 80 % pacientů, u nichž byl při prvním FSE detekován karcinom in situ, byl také přítomen karcinom in situ močového měchýře.
Závěrem autoři uvádějí, že u pacientů s TCC, kteří podstupují radikální cystektomii (v případě, že jsou močovody resekovány v místě, kde kříží společné iliakální arterie), se FSE doporučuje provádět pouze u těch jedinců, u nichž je detekován karcinom močového měchýře in situ.
Efekt přizpůsobený výsledkům mortality a délky hospitalizace po radikální cystektomii
The effects of adjusting for case mix on mortality and length of stay following radical cystectomy
Hollenbeck BK, Miller DC, Taub DA et al. University of Michigan, Ann Arbor, MI, USA. J Urol 2006; 176 : 1363-1368.
Identifikace předoperačních rizikových faktorů souvisejících se zvýšením míry mortality a delší dobou hospitalizace po radikální cystektomii může podpořit předoperační poradenství a usnadnit peroperační péči. Většina publikací zabývajících se těmito faktory se skládá převážně z retrospektivních údajů jednotlivých institucí. Tento článek je však součástí amerického projektu National Surgical Quality Improvement Project prospektivně hodnotící kvalitu péče ve 123 VAMC na celém světě.
Autoři tohoto projektu shromáždili předoperační a peroperační klinické údaje a výsledky týkající se celé řady operačních zákroků z různých oblastí medicíny.
Autoři hodnotili 2 538 radikálních cystektomií, které byly zahrnuty do projektu National Surgical Quality Improvement Project od roku 1991. Autoři zaznamenali 2,9% míru 30denní mortality a 6,8% míru 90denní mortality, střední doba hospitalizace byla 11 dní. Předoperační faktory související s mortalitou a delší dobou hospitalizace (> 90 percentil) zahrnovaly vyšší věk (OR 1,2–1,4), ≥ 3 třídu American Society of Anesthesiologists (OR 1,5–3,3), funkční stav (OR 1,7–2,0) a nízkou hladinu albuminu v séru (OR 2,1–12,0).
Závěrem autoři uvádějí, že existují určité definované předoperační rizikové faktory, které nezávisle souvisejí s vyšší mírou mortality a delší dobou hospitalizace po radikální prostatektomii. Dále se domnívají, že tyto faktory je třeba brát v potaz při srovnávání výsledků.
Přirozený vývoj pooperačních renálních funkcí u pacientů s nádorem močového měchýře, kteří podstoupili derivaci moči formou ileálního konduitu, měřené pomoci sériové izotopové glomerulární filtrace a renografie pomocí 99mtechnecia
The natural history of postoperative renal function in patients undergoing ileal conduit diversion for cancer measured using serial isotopic glomerular filtration rate and 99m technetiummercaptoacetyltriglycine renography
Samuel JD, Bhatt RI, Montague RJ et al. Christie Hospital, Salford, UK. J Urol 2006; 176 : 2518-2522.
Ileální konduit má při léčbě derivace moči již své pevné místo, doposud však nebylo dosaženo konsenzu v otázce týkající se dlouhodobého sledování renální funkce u těchto pacientů. Cílem této studie bylo určit, jaký význam má hodnocení renální funkce (užívající měření hladiny kreatininu v séru, míry GFR a renografické diurézy) u pacientů, kteří podstoupili derivaci moči s vytvořením ileálního konduitu.
Autoři identifikovali celkem 340 pacientů, kteří podstoupili derivaci moči formou ileálního konduitu v letech 1990 až 2000, do studie však zahrnuli pouze 178 pacientů (s dobou sledování > 4 roky). Střední doba sledování byla 8,2 roku, po níž byla u 52 pacientů zaznamenána výrazně horší GFR. Mezi nejčastější rizikové faktory patřily hypertenze, recidivující močové sepse a počáteční GFR < 50 ml/min/1,73, přestože hypertenze představovala nezávislý předpovědní faktor snížení GFR. Z celkem 52 pacientů, u nichž došlo ke zhoršení GFR, byla při renografii u 19 zaznamenána křivka typu II nebo IIIb, následkem čehož 13 pacientů podstoupilo revizi. Po této operaci došlo u těchto pacientů ke stabilizaci nebo zlepšení renální funkce. U 18 % pacientů nebyla zjištěna žádná chirurgická příčina zhoršení GFR.
Závěrem autoři uvádějí, že provedení renografie a hodnocení GFR u pacientů podstupujících derivaci moči s vytvořením ileálního konduitu hraje důležitou úlohu při identifikaci těch jedinců, u nichž došlo během sledování ke zhoršení renální funkce. Křivku typu IIIb lze považovat za časný indikátor obstrukce.
[1]. Význam provádění druhé transuretrální resekce při léčbě karcinomu močového měchýře ve stadiu T1
The value of a second transurethral resection for T1 bladder cancer
Schwaibold HE, Sivalingam S, May F et al. Bristol Urological Institute, Bristol, UK. BJU Int 2006; 97 : 1199-1201.
[2]. Je nezbytné u pacientů s nově diagnostikovaným karcinomem močového měchýře ve stadiu T1 provádět druhou transuretrální resekci?
Is a second transurethral resection necessary for newly diagnosed pT1 bladder cancer?
Divrik T, Yildirim U, Eroglu AS et al. SSK Tepecik Teaching Hospital, Izmir, Turkey. J Urol 2006; 175 : 1258-1261.
[3]. Opakovaná ransuretrální resekce (TUR) pro stanovení stadia onemocnění umožňuje předpovědět časnou progresi povrchového karcinomu močového měchýře
A re-staging transurethral resection predicts early progression of superficial bladder cancer
Herr HW, Donat SM. Memorial Sloan-Kettering Cancer Center, New York, NY, USA. BJU Int 2006; 97 : 1194-1198.
Dříve publikované studie zdůrazňují význam druhé TUR nebo opakované TUR pro stanovení stadia onemocnění u pacientů s povrchovým karcinomem močového měchýře z přechodných buněk (TCC) s vysokým rizikem. Zdaleka ne všichni urologové však tento postup dodržují. Následující 3 studie poukazují na důležitost opakované TUR pro stanovení stadia onemocnění.
Schwaibod et al prospektivně hodnotili opakované provádění TUR u pacientů s karcinomem močového měchýře ve stadiu T1 [1]. Opakovanou TUR prováděli u těchto pacientů s cílem zaručit úplnou resekci tumoru a vyloučit možnost invaze tumoru do svalové tkáně.
Opakovaná TUR byla provedena u celkem 136 po sobě jdoucích pacientů, u nichž byl na základě histopatologického vyšetření detekován TCC ve stadiu T1 (invaze do submukózy). U 101 pacientů bylo stadium T1 detekováno při první prezentaci, u 35 pacientů jako recidiva.
Při opakované resekci (následující o 4–6 týdnů později) autoři hodnotili následující parametry: přítomnost nedetekovaného reziduálního tumoru při předchozí TUR, změnu histopatologického stadia nebo grade a lokalizaci tumoru. Reziduální tumor byl ve vzorku opakované TUR detekován u 52 % pacientů. Autoři hodnotili onemocnění stadia Ta, T1, Tis a ≥ T2 (detekované při opakované TUR). U 21 % pacientů byly přítomny histopatologické změny, které měly za následek zhoršení prognózy (> T1 a/nebo Tis). U 14 % pacientů došlo ke změně lokalizace reziduální maligní tkáně. Celkem u 21 % pacientů byla následkem nálezů opakované TUR indikována radikální cystektomie.
Autoři této studie doporučují u pacientů s TCC močového měchýře ve stadiu T1 rutinní provádění TUR, díky níž je možné docílit úplné resekce tumoru a určit, u kterých pacientů je nutné okamžité provedení cystektomie.
Autoři 2. studie hodnotili benefit opakované TUR u pacientů s primárním TCC močového měchýře ve stadiu T1 (pT1) [2]. Studie zahrnovala 80 pacientů s pT1 TCC, kteří v průběhu 2–6 týdnů po původním zákroku podstoupili opakovanou TUR. Cystoskopické vyšetření prokázalo, že u 22,5 % pacientů byl přítomen makroskopický tumor. Na základě patologického vyšetření však byl reziduální tumor detekován u 33,8 % pacientů. U 7 pacientů bylo přítomno onemocnění ve stadiu pTa, u 14 pacientů onemocnění ve stadiu pT1, u 3 pacientů pT1 a pTis a u 3 pacientů pT2. Reziduální tumor byl detekován u 5,8 % pacientů s G1, 38,2 % pacientů s G2 a 62,5 % pacientů s G3.
Grade tumoru detekovaného při první TUR přímo souvisel s rizikem detekce reziduálního tumoru.
Autoři této studie doporučují provádění opakované TUR u pacientů s pT1 (zejména u pacientů s onemocněním s vysokým rizikem) i přesto, že její výsledek změnil strategii léčebného postupu pouze u malého procenta pacientů.
Autoři studie provedené v Memorial Sloan-Kettering Cancer Center (New York, NY, USA) hodnotili, zda patologické vyšetření při opakované TUR umožňuje předpovědět časnou progresi povrchového karcinomu močového měchýře [3]. Tato retrospektivní studie zahrnovala pacienty s několikanásobným povrchovým karcinomem močového měchýře, kteří podstoupili opakovanou TUR a byli sledováni po dobu 5 let. Tumory byly klasifikovány na základě svého stadia a grade (nízký nebo vysoký). Pouze u 39 % pacientů (z celkových 710) nebyl při opakované TUR detekován žádný důkaz onemocnění (T0). Toto procento bylo srovnatelné u všech typů tumoru.
V průběhu 5 let došlo k recidivě onemocnění u 69 % pacientů –74 % pacientů s TaG1, 70 % pacientů s TaG3, 56 % pacientů s T1G1 a 66 % pacientů s T1G3 (z celkových 220). Střední doba přežití bez recidivy byla u všech pacientů 19 měsíců. V průběhu 5 let došlo k progresi stadia nebo grade onemocnění u 21 % pacientů. Střední doby do progrese onemocnění nebylo dosaženo.
Ze 630 pacientů, u nichž bylo při opakované TUR detekováno onemocnění v jiném stadiu než T1 (tj. T0 nebo Ta), došlo u 14 % k progresi stadia nebo grade – ve srovnání s progresí u 76 % se svalovinu invadujícím onemocněním. Přestože u 29 % pacientů s onemocněním T1 došlo nakonec k progresi, u 76 % pacientů došlo k rychlé progresi bez ohledu na stadium a grade původního tumoru. Pouze u 24 % pacientů s reziduálním T1 tumorem nedošlo během 5 let k jeho progresi.
Závěrem lze říci, že opakované provádění TUR umožňuje u pacientů s povrchovým TCC identifikovat jedince s vysokým rizikem časné progrese tumoru.
[1]. Oddálení cystektomie o více než 3 měsíce po prvním diagnostikování karcinomu močového měchýře vede ke snížení celkové doby přežití a doby přežití specifické pro onemocnění
Cystectomy delay more than 3 months from initial bladder cancer diagnosis results in decreased disease specific and overall survival.
Lee CT, Madii R, Daignault S et al. University of Michigan, Ann Arbor, MI, USA. J Urol 2006; 175 : 1262-1267.
[2]. Dopad oddálení operace na dobu přežití u pacientů s karcinomem močového měchýře, kteří podstupují cystektomii (Quebec): studie založená na populaci
Effect of preoperative delay on survival in patients with bladder cancer undergoing cystectomy in Quebec: a population based study
Mahmud SM, Fong B, Fahmy N et al. McGill University, Montréal, QC, Canada. J Urol 2006; 175 : 78-83.
Řada studií publikovaných v několika uplynulých letech poukazuje na fakt, že delší oddálení cystektomie u pacientů s karcinomem močového měchýře má negativní dopad na pacientovu prognózu. Následující 2 studie se dále zabývají touto problematikou.
Lee et al zkoumali dobu mezi detekcí karcinomu močového měchýře ve stadiu T2 a provedením cystektomie, její dopad na dobu přežití pacienta a mezi potencionálními příčinami oddálení operace [1]. Tato retrospektivní studie zahrnovala pacienty s karcinomem močového měchýře ve stadiu T2, kteří podstoupili radikální cystektomii. Autoři hodnotili délku trvání intervalu do provedení cystektomie, patologické stadium, dobu přežití specifickou pro onemocnění a celkovou dobu přežití.
Střední doba do provedení cystektomie byla v celé skupině 60 dní. Pacienti, kteří podstoupili cystektomii za ≤ 93 dnů, měli signifikantně lepší celkovou dobu přežití i dobu přežití specifickou pro karcinom než pacienti, kteří operaci podstoupili později. Multivarietní analýza prokázala u pacientů podstupujících cystektomii do ≤ 93 dnů zlepšení celkové doby přežití.
Nejčastější příčinou odložení operace bylo v této studii plánované oddálení (ve 46 % případů). Oddálení operace o ≥ 93 dní tedy vede ke zkrácení doby přežití. Autoři této studie se domnívají, že tento fenomén je zapříčiněn vznikem mikrometastáz (vzhledem k tomu, že nebyla detekována lokální progrese).
Autoři druhého článku (Quebec, Kanada) na základě údajů založených na populaci hodnotili průměrný interval oddálení radikální cystektomie, a zda má toto oddálení negativní dopad na dlouhodobé přežití [2].
Pomocí Provincial Billing Database byli identifikováni všichni muži ≥ 18 let s karcinomem močového měchýře, kteří v letech 1990–2002 podstoupili radikální cystektomii. Oddálení operace bylo definováno jako interval mezi poslední transuretrální resekcí a cystektomií. Na základě tohoto intervalu byli pacienti rozděleni do 3 skupin:
- skupina 1: ≤ 20 dní
- skupina 2 : 21–47 dní
- skupina 3: ≥ 48 dní
V letech 1990–2002 bylo provedeno celkem 1 592 radikálních cystektomií. Střední doba tohoto intervalu byla 33 dní, přestože v průběhu sledované doby se tento interval prodloužil. Po přizpůsobení údajů kalendářnímu věku a dalším proměnným nebyl mezi jednotlivými skupinami zaznamenán žádný signifikantní rozdíl v době přežití. Pacienti podstupující operaci po > 12 týdnech však měli o 20% vyšší riziko úmrtí. Oddálení cystektomie o > 12 týdnů je spojeno s horší dlouhodobou prognózou.
Autoři obou studií tedy dospěli k závěru, že oddálení cystektomie o ≥ 3 měsíce vede ke zhoršení prognózy.
Opakovaná transuretrální resekce (TUR) k určení stadia vede u pacientů s povrchovým karcinomem močového měchýře s vysokým rizikem ke zlepšení odezvy na aplikaci BCG (bacillus Calmette-Guérin)
Restaging transurethral resection of high risk superficial bladder cancer improves the initial response to bacillus Calmette-Guérin therapy
Herr HW. Memorial Sloan-Kettering Cancer Center, New York, NY, USA. J Urol 2005; 174 : 2134-2137.
Informace publikované v současné literatuře nasvědčují tomu, že pacienti s povrchovým karcinomem z přechodných buněk (TCC) s vysokým rizikem, zejména ti s onemocněním ve stadiu T1 G3, mají benefit z opakované TUR (stanovením správného vyššího stadia u signifikantního počtu pacientů). K dispozici však máme jen málo důkazů, které by prokazovaly, že opakovaná TUR zlepšuje odezvu na aplikaci BCG.
Do této studie autoři zahrnuli pacienty s povrchovým karcinomem močového měchýře s vysokým rizikem, ve stadiu Ta a T1, vyskytující se současně s karcinomem in situ.
Z celkem 347 pacientů podstoupilo 132 před zahájením 6týdenní intravezikální aplikace BCG jedinou TUR a 215 pacientů opakovanou TUR ke zjištění stadia tumoru. Autoři hodnotili odezvu na léčbu (přítomnost nebo absenci tumoru) při 1. kontrolní cystoskopii a při cystoskopii po 6 a 12 měsících léčby. Během 3letého sledování dále hodnotili progresi stadia onemocnění.
Reziduální nebo recidivující tumor byl při první cystoskopii detekován u 75 pacientů (57 %), kteří podstoupili před terapií BCG pouze jedinou TUR. U 45 (34 %) těchto pacientů došlo následně k progresi onemocnění. Ve skupině pacientů, kteří před terapií BCG podstoupili opakovanou TUR, byl reziduální nebo recidivující tumor při první cystoskopii detekován pouze u 62 pacientů (29 %), z nichž pouze u 16 (7 %) došlo k progresi (p = 0,001). Závěrem lze říci, že opakovaná TUR u pacientů s povrchovým karcinomem s vysokým rizikem zvyšuje míru odezvy na terapii BCG, snižuje frekvenci výskytu recidivy tumoru a zřejmě také oddaluje jeho progresi.
Tato studie, jejímž autorem je jeden z největších odborníků v oblasti léčby povrchového karcinomu močového měchýře, prokazuje význam opakované TUR pro zjištění stadia onemocnění při léčbě povrchového karcinomu močového měchýře i při zlepšování odezvy na BCG terapii.
Dlouhodobý účinek transuretrální resekce povrchového karcinomu močového měchýře s pomocí flurescence 5-aminolevulové kyseliny: Výsledky prospektivní randomizované studie po 5 letech
Long-term benefit of 5-aminolevulinic acid fluorescence assisted transurethral resection of superficial bladder cancer: 5-year results of a prospective randomized study
Daniltchenko DI, Riedl CR, Sachs MD et al. Charité Medical University, Berlin, Germany. J Urol 2005; 174 : 2129-2133.
Různé studie publikované v průběhu posledních několika let prokazují, že transuretrální resekce (TUR) povrchového tumoru močového měchýře s pomocí flurescence 5-aminolevulové kyseliny (ALA) zvyšuje míru detekce tumoru o přibližně 20 %. Dlouhodobý benefit transuretrální resekce povrchového močového měchýře s pomocí flurescence ALA nebyl však doposud zcela objasněn. Tento článek uvádí výsledky prospektivní, randomizované studie, která srovnávala účinnost TUR užívající běžné bílé světlo a ALA fluorescence.
Celkem 155 pacientů s podezřením na povrchový karcinom močového měchýře bylo randomizováno k běžné TUR nebo TUR s užitím ALA.
Střední doba sledování pacientů, kteří podstoupili běžnou TUR, byla 39 měsíců, střední doba sledování pacientů ve skupině podstupující ALA byla 42 měsíců. Střední doba do vzniku recidivy v první skupině byla 5 měsíců, ve druhé skupině 12 měsíců. Tab. ukazuje míru recidivy tumoru po různé době sledování (u obou skupin pacientů).
Tab. 1. Míra recidivy tumoru u pacientů podstupujících dvě různé detekční metody. Převzato ze studie Daniltchenka DI et al. 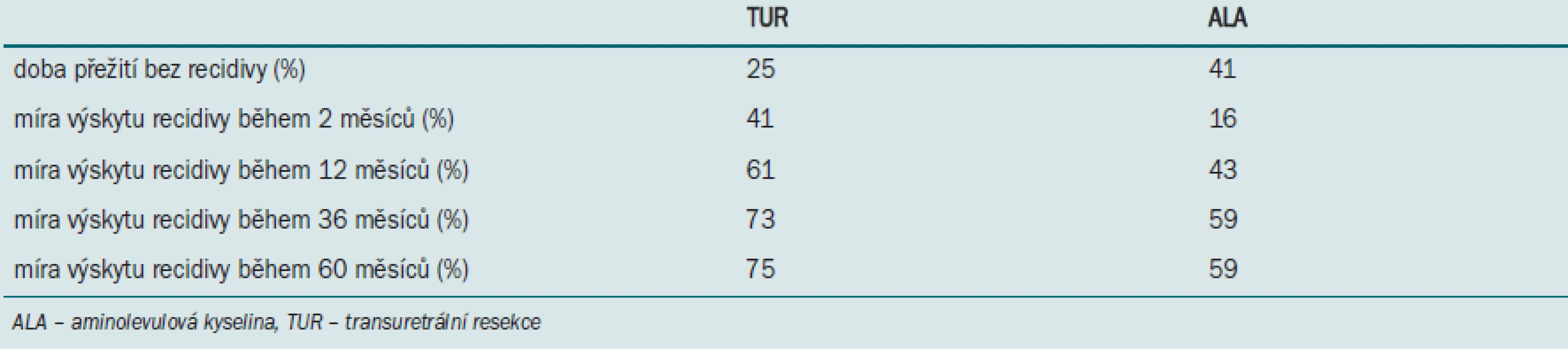
Ve skupině pacientů podstupujících běžnou TUR bylo zaznamenáno 82 případů recidivy, ve skupině pacientů podstupujících ALA bylo zaznamenáno 61 případů recidivy. K progresi onemocnění došlo u 9 pacientů ve skupině podstupující standardní léčbu a u 4 pacientů ve skupině ALA. Analýza cenové náročnosti obou metod prokázala významný ekonomický benefit ALA s TUR ve srovnání se standardním výkonem.
Závěrem autoři uvádějí, že počáteční benefit v detekci tumoru a snížení míry recidivy nádoru, který ALA s TUR umožňuje, přetrvá po mnoho let. ALA s TUR navíc u pacientů s povrchovým karcinomem močového měchýře umožňuje snížení míry morbidity a ceny zákroku.
Má trojnásobně nižší dávka BCG (bacillus Calmette-Guérin) stejný účinek proti recidivě a progresi tumoru močového měchýře ve stadiu T1 GR a Tis jako běžně užívaná dávka? Výsledky prospektivní randomizované studie
Has a 3-fold decreased dose of bacillus Calmette-Guérin the same efficacy against recurrences and progression of T1 G3 and Tis bladder tumors than the standard dose? Results of a prospective randomized trial
Martinez-Pineiro JA, Martinez-Pineiro L, Solsona E et al. Club Urologico Espanol de Tratamiento Oncologico (CUETO). La Luz Clinic, Madrid, Spain. J Urol 2005; 174 : 1242-1247.
Přestože aplikace BCG (bacillus Calmette-Guérin) přináší u pacientů s povrchovým karcinomem močového měchýře s vysokým rizikem (T1 G3 a karcinom in situ) benefit, většina klinických lékařů si je vědoma toho, že tato terapie je u signifikantního počtu pacientů spojena s výskytem vedlejších účinků. Autoři této studie zkoumali účinek aplikace nižší dávky BCG (snížení dávky o 2/3) u pacientů s povrchovým karcinomem močového měchýře s vysokým rizikem.
Tato randomizovaná studie zahrnovala 155 pacientů, kteří po transuretrální resekci všech viditelných lézí podstoupili intravezikální léčbu BCG. Pacienti užívali standardní dávku (SD – 81 mg) nebo sníženou dávku (DD – 27 mg) Connaught kmene BCG – 1krát týdně po dobu prvních 6 týdnů a po uplynutí této doby jednou za 14 dní. Z celkem 155 pacientů mělo 90 onemocnění ve stadiu T1 GR, 23 ve stadiu Tis a 42 současně přítomný Tis.
Průměrný věk pacientů byl 67 let (standardní odchylka ± 10,1) a střední doba sledování 61 měsíců (rozmezí 3–102 měsíců). K recidivě došlo u 32 pacientů (39 %) užívajících SD a u 33 pacientů (45 %) užívajících DD. Střední doba do recidivy ve větvi pacientů užívajících DD byla 63 měsíců, u pacientů užívajících SD jí nebylo dosaženo.
Mezi oběma skupinami nebyl zjištěn signifikantní rozdíl v době do vzniku recidivy. K progresi tumoru došlo u 20 pacientů (24,7 %) v SD skupině a 19 (26 %) pacientů v DD skupině. U 4 pacientů (6,1 %) s Tis došlo k rozšíření onemocnění do prostaty, uretry a semenných duktů – 3 z nich (8,3 %) byli léčeni pomocí SD a 1 (3,4 %) pomocí DD. Ani v jednom rameni nebylo dosaženo střední doby do progrese onemocnění. Mezi oběma skupinami nebyl zjištěn signifikantní rozdíl v době do vzniku progrese onemocnění. U 7 pacientů v obou skupinách (8,4 % v SD skupině, 9,5 % v DD skupině) byla provedena odložená cystektomie. Výsledky analýzy podskupin, která testovala věk pacienta, stav, počet a velikost tumoru a stadium T (T1 G3 vs Tis) se významně nelišily, ani míra mortality specifická pro onemocnění se signifikantně nelišila v obou skupinách (12,2 % ve větvi SD, 16,4 % ve větvi DD).
Vedlejší účinky se vyskytly u 57 pacientů užívajících SD (69,5 %) a 35 pacientů užívajících DD (47,9 %; p = 0,009). Výskyt systémových vedlejších účinků byl také signifikantně častější u pacientů užívajících SD (SD 15,9 % vs 5,5%, p = 0,043). Počet pacientů, kteří ukončili léčbu pro výskyt toxicity, byl v obou skupinách srovnatelný (12,2 % vs 9,6 %).
Závěrem autoři uvádějí, že při snížení dávky BCG na 1/3 dávky původní dosáhneme u pacientů s karcinomem močového měchýře s vysokým rizikem stejného účinku jako při aplikaci SD. Nižší dávka je navíc spojena s nižší toxicitou.
Klinické výsledky radikální cystektomie u pacientů s primárním karcinomem močového měchýře z nepřechodných buněk ve srovnání s pacienty s karcinomem močového měchýře z přechodných buněk
Clinical outcomes following radical cystectomy for primary nontransitional cell carcinoma of the bladder compared to transitional cell carcinoma of the bladder
Rogers CG, Palapattu GS, Shariat SF et al. The Johns Hopkins Hospital, Baltimore, MA, USA. J Urol 2006; 175 : 2048-2053.
V západních zemích představují jiné karcinomy než z přechodných buněk (non-TCC) pouze malé procento tumorů močového měchýře. Z tohoto důvodu nebyl doposud zcela objasněn vliv nonTCC histologie na výsledný stav. Autoři této retrospektivní, multicentrické studie hodnotili prognostický význam nonTCC histologie u pacientů, kteří podstoupili cystektomii.
Záznamy 955 pacientů s karcinomem močového měchýře, kteří podstoupili radikální cystektomii s bilaterální pánevní lymfadenektomií, byly hodnoceny ve 3 akademických centrech. TCC byl detekován ve vzorku radikální cystektomie celkem u 888 (93 %) pacientů. U 67 pacientů byla detekována nonTCC histologie – u 26 karcinom ze skvamózních buněk (SqCC), u 13 adenokarcinom, u 10 malobuněčný karcinom a u 18 pacientů další podtypy nonTCC (např. karcinomy z vřetenovitých buněk, karcinosarkomy a nediferencované karcinomy).
Mezi pacienty s SqCC a TCC nebyl zjištěn žádný signifikantní rozdíl v míře progrese specifické pro karcinom ani míře mortality. U pacientů s nonTCC a nonSqCC bylo zaznamenáno signifikantně vyšší riziko progrese specifické pro karcinom a úmrtí na tento karcinom (než u pacientů s TCC nebo SqCC, p < 0,001). Toto riziko je statisticky významné jak u pacientů s onemocněním ohraničeným na orgán (stadium pT2 nebo nižší), tak u pacientů s onemocněním neohraničeným na orgán (stadium pT3 nebo vyšší); (p < 0,001). Multivarietní analýza prokázala, že nonTCC a nonSqCC histologie je spojena s vyšším rizikem progrese a úmrtí na karcinom močového měchýře (OR 2,272 a 2,585, p < 0,001) – dokonce po přizpůsobení závěrečnému patologickému stadiu, stavu lymfatických uzlin, zasažení lymfovaskulárního systému a neoadjuvantní a adjuvantní léčbě.
Závěrem autoři uvádějí, že klinické výsledky se u pacientů s SqCC a TCC významně neliší. U pacientů s karcinomem močového měchýře, kteří podstupují cystektomii, představuje nonTCC a nonSqCC histologický podtyp nezávislý předpovědní faktor progrese a mortality.
Souvislost mezi cytologickým a patologickým vyšetřením u pacientů s nonTCC onemocněním močových cest
Association between urinary cytology and pathology for nontransitional cell malignancies of the urinary tract
Raj GV, Bochner BH, Vickers A et al. Memorial Sloan-Kettering Cancer Center, New York, NY, USA. J Urol 2006; 175 : 2038-2041.
V literatuře existuje pouze malé množství publikací, které by se zabývaly souvislostí mezi cytologickým a patologickým vyšetřením u pacientů s nonTCC onemocněním močových cest. Autoři této retrospektivní studie hodnotili 55 946 cytologických vzorků s cílem zjistit souvislost mezi cytologickým a patologickým vyšetřením u pacientů s nonTCC onemocněním močových cest.
Autoři hodnotili výsledky cytologických vyšetření 12 705 pacientů, které byly provedeny v letech 1992–2004. Dále zjišovali souvislost mezi přítomností uroteliálních neoplazmat a výsledky cytologických vyšetření. NonTCC byly klasifikovány jako adenokarcinomy, karcinomy ze skvamózních buněk (SqCC) a ostatní, které zahrnovaly malobuněčné nádory, sarkomy, melanomy a lymfomy.
Celkem u 260 pozitivních cytologických vzorků byl detekován nonTCC. 108 pacientů, u nichž cytologické vyšetření prokázalo adenokarcinom, mělo histologický důkaz karcinomu, 86 % pacientů mělo adenokarcinom močových cest. U všech 110 pacientů, u nichž cytologické vyšetření prokázalo SqCC, byl detekován karcinom (včetně 47 % pacientů s primárním SqCC). Všech 42 pacientů s dalšími nonTCC mělo při cytologickém vyšetření karcinom, u 64 % z nich byla histologická shoda.
Autoři provedli oddělené patologické vyšetření, při němž provedli korelaci patologického nálezu s cytologickým vyšetřením. Ze 70 pacientů, u nichž byla při patologickém vyšetření potvrzena přítomnost adenokarcinomu, mělo 57 % pacientů pozitivní předchozí cytologické nálezy, 19 % mělo histologickou shodu. Z celkem 85 pacientů s SqCC mělo 81 % pacientů pozitivní nález před cytologií, 60 % mělo histologickou shodu. Z celkem 83 pacientů s ostatními nonTCC mělo 70 % pacientů pozitivní předchozí cytologické nálezy, 31 % mělo histologickou shodu.
Závěrem autoři uvádějí, že u všech pacientů, u nichž byla při cytologickém vyšetření prokázána přítomnost nonTCC, byl detekován karcinom močových cest. Shoda s histologickou klasifikací při patologickém vyšetření se pohybuje od 49 % u pacientů s SqCC do 86 % u pacientů s adenokarcinomem. Autoři této studie doporučují provádět u pacientů, u nichž byl při cytologickém vyšetření detekován nonTCC, důkladné vyšetření močových cest.
Výsledky radikální cystektomie u pacientů s onemocněním pT0
Cancer specific outcomes in patients with pT0 disease following radical cystectomy
Palapattu GS, Shariat SF, Karakiewicz PI et al. Bladder Cancer Research Consortium, The Johns Hopkins Hospital, Baltimore, MA, USA. J Urol 2006; 175 : 1645-1649.
U části pacientů, kteří podstoupí radikální cystektomii, není nakonec v preparátu detekována žádná známka onemocnění, tj. v preparátu získaném při cystektomii pT0. Tato retrospektivní studie prováděná ve 3 centrech hodnotí klinický výsledek u těchto pacientů.
Autoři hodnotili záznamy 955 pacientů, kteří podstoupili radikální cystektomii v letech 1984–2003. Po vyloučení pacientů, u nichž chyběly požadované údaje, a pacientů s nonTCC bylo do studie zahrnuto 888 případů.
Celkem u 59 pacientů bylo při histologickém vyšetření vzorku odebraném při cystektomii detekováno onemocnění ve stadiu pT0. U 2 z těchto pacientů onemocnění invadovalo do lymfatických uzlin. U 56 pacientů byly k dispozici údaje týkající se klinického stadia onemocnění nebo stadia onemocnění při transuretrální resekci – u 5 pacientů onemocnění ve stadiu Tis, u 2 pacientů onemocnění ve stadiu Ta, u 18 pacientů onemocnění ve stadiu T1, u 29 pacientů ve stadiu T2 a u 2 pacientů ve stadiu T3.
Střední doba sledování byla 56 měsíců (rozmezí 3–183 měsíců). U 6 pacientů s onemocněním ve stadiu pT0 došlo k recidivě (u 1 pacienta s cTis, u 1 pacienta s cT1, u 3 s cT2 a u 1 s cT3). Celkem zemřelo 7 pacientů – 3 pacienti zemřeli na karcinom močového měchýře, další 4 pacienti zemřeli na jiné onemocnění. Doba přežití bez progrese po 5 letech byla 90 %, po 10 letech 81 %, doba přežití specifická pro onemocnění po 5 letech byla 95 %, po 10 letech 85 %.
Závěrem autoři uvádějí, že pacienti, u nichž je při cystektomii detekováno onemocnění ve stadiu pT0, mají vynikající prognózu (přestože ne všechny lze vyléčit). K recidivě onemocnění došlo u pacientů, u nichž bylo při transuretrální resekci detekováno onemocnění neinvadující svalovinu nebo onemocnění invadující svalovinu ohraničené na orgán. Autoři zdůrazňují nezbytnost provedení dalších studií umožňujících identifikaci prognostických faktorů u těchto pacientů.
Neoadjuvantní terapie na bázi metotrexátu, vinblastinu, doxorubicinu a cisplatiny u pacientů s karcinomem močového měchýře invadujícím do lymfatických uzlin (prokázaným při histologickém vyšetření)
Neoadjuvant methotrexate, vinblastine, doxorubicin and cisplatin for histologically proven lymph node positive bladder cancer
Nieuwenhuijzen JA, Bex A, Meinhardt W et al. Antoni van Leeuwenhoek Hospital, Amsterdam, Nizozemí. J Urol 2005; 174 : 80-85.
Údaje v různých publikacích prokazují, že neoadjuvantní chemoterapie na bázi platiny umožňuje u pacientů s karcinomem močového měchýře dosáhnout po 5 letech 5% zlepšení doby přežití a 9% doby přežití bez recidivy. Autoři této studie hodnotili účinek neoadjuvantní chemoterapie a následné operace u pacientů s karcinomem močového měchýře invadujícím do lymfatických uzlin prokázaným při histologickém vyšetření (při lymfadenektomii nebo aspirační cytologii). Celkem 52 pacientů podstoupilo chemoterapii a operaci s cílem dosáhnout částečné nebo úplné odezvy.
Částečná nebo úplná odezva na chemoterapii byla zaznamenána celkem u 86 % pacientů. Úplná odezva byla zaznamenána u 29 % pacientů, částečná odezva byla zaznamenána u 57 % pacientů, stabilní/progresivní onemocnění u 14 %. Po 5 letech byla u těchto pacientů zaznamenána 42%, 19% a 0% míra přežití. Objektivní odezva (poměr rizik – HR 4,1), zejména úplná odezva (HR 8,0), závisela na době přežití.
Autoři samostatně hodnotili reakci tumoru na chemoterapii a prognostickou hodnotu této odezvy v lymfatických uzlinách a močovém měchýři. Močový měchýř bez nádoru kombinovaný s uzlinami bez nádoru souvisel se zlepšením doby přežití (HR 4,4), stejně jako negativní lymfatické uzliny u pacientů s reziduálním karcinomem močového měchýře (HR 2,8). Všichni pacienti, u nichž byly po chemoterapii přítomny pozitivní lymfatické uzliny, zemřeli během 2 let. U 4 z 15 pacientů, u nichž byla zaznamenána úplná klinická odezva, byla zjištěna přítomnost reziduálního onemocnění, u 3 z 29 pacientů s částečnou odezvou nebyl detekován žádný tumor.
Autoři závěrem uvádějí, že u pacientů s pozitivními lymfatickými uzlinami poskytuje neoadjuvantní chemoterapie benefit v době přežití. Údaje v této studii prokazují, že stav lymfatických uzlin po aplikaci metotrexátu, vinblastinu, doxorubicinu a cisplatiny je významnějším faktorem než stav lokálního onemocnění.
Radikální cystektomie při léčbě primárních neuroendokrinních tumorů močového měchýře: zkušenost z University of Southern California
Radical cystectomy for primary neuroendocrine tumors of the bladder: the University of Southern California experience
Quek ML, Nichols PW, Yamzon J et al. University of Southern California, Los Angeles, CA, USA. J Urol 2005; 174 : 93-96.
Výskyt primárních neuroendokrinních tumorů močového měchýře je poměrně vzácný, a proto nemáme k dispozici dostatek klinických zkušeností s léčbou tohoto druhu onemocnění. Autoři této studie z University of Southern California (Los Angeles, CA, USA) uvádějí svoji zkušenost s léčbou tohoto typu onemocnění. Ve své studii autoři hodnotí histopatologickou charakteristiku a klinické výsledky.
Z celkem 2 005 pacientů s primárním karcinomem močového měchýře, kteří podstoupili v letech 1971–2004 radikální cystektomii, byl neuroendokrinní tumor přítomen pouze u 25 (1,2 %) – u 20 pacientů karcinom z malých buněk (SCC), u 5 karcinom z velkých buněk (LCC). Histologické vyšetření prokázalo přítomnost čistě neuroendokrinního podtypu u 16 pacientů – u 1 pacienta byla prokázána přítomnost onemocnění z malých i velkých buněk, u ostatních pacientů byla detekována smíšená histologie (u 8 pacientů TCC, u 1 pacienta adenokarcinom). 14 pacientů podstoupilo kombinovanou chemoterapii.
Z těchto 25 pacientů, u nichž byl detekován neuroendokrinní tumor, bylo 19 mužů se střední hodnotou věku 68 let (rozmezí 40–82 let). Z celkem 19 pacientů (76 %), u nichž tumor invadoval do lymfatických uzlin, byly u 2 detekovány metastázy do jater, u 4 (16 %) onemocnění ohraničené na orgán a u 2 (8 %) extravezikální tumor nepostihující lymfatické uzliny.
Střední doba sledování byla 11,8 let (rozmezí 18 dní–15,1 let). Míra celkové doby přežití po 5 letech byla 10 %, míra doby přežití bez recidivy 13 %. Mezi SCC a LCC nebyl zaznamenán žádný signifikantní rozdíl v době přežití. U pacientů se smíšenou histologií byl zaznamenán lepší výsledek než u pacientů s čistě neuroendokrinním tumorem, tento výsledek však není statisticky signifikantní (p = 0,064). U pacientů léčených pomocí kombinované terapie byla zaznamenána signifikantně lepší celková míra přežití (p = 0,051) a míra přežití bez recidivy (p = 0,003) než u pacientů, kteří podstoupili samotnou cystektomii.
Závěrem autoři uvádějí, že pacienti s neuroendokrinními tumory močového měchýře mají špatnou prognózu. Tyto tumory jsou obvykle detekovány v pokročilém patologickém stadiu. Autoři se domnívají, že kombinace adjuvantní chemoterapie a cystektomie umožňuje dosáhnout lepší prognózy.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2008 Číslo 2- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
-
Guidelines EAU pro karcinom močového měchýře (TAT1 – neinvadujícího svalovinu)
VERZE 2007 - Kvíz
- Neinvazivní karcinom močového měchýře – kdy je indikována adjuvantní intravezikální instilační léčba a co dělat při jejím selhání?
- Postup při selhání terapie BCG u pacientů s povrchovým karcinomem močového měchýře
- Místo a rozsah lymfadenektomie u pacientů s nádory močového měchýře
- Sexuální funkce šetřící radikální cystektomie
- Úvodník
- Komplikace spojené s cystektomií a derivací moči
- Technika provádění TUR u pacientů s karcinomem močového měchýře – význam opakovaného provádění TUR a náhodné biopsie
- Derivace moči po cystektomii
- „Indiana pouch“ – minulost a současnost
-
TVT – nová epocha urogynekologické operativy
Současná urogynekologická operativa II - Zpráva z kongresu EAU v Miláně
- Ohliadnutie za Sorrentom
- Správa z konferencie AUA Annual Meeting 2008
- Ze zahraničních periodik
- Současná praxe při řešení povrchového karcinomu močového měchýře v Nizozemí a belgických Flandrech: průzkum
-
Guidelines EAU pro neurogenní dysfunkci dolních cest močových
VERZE 2007
-
Guidelines EAU pro karcinom močového měchýře (TAT1 – neinvadujícího svalovinu)
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Neinvazivní karcinom močového měchýře – kdy je indikována adjuvantní intravezikální instilační léčba a co dělat při jejím selhání?
- Technika provádění TUR u pacientů s karcinomem močového měchýře – význam opakovaného provádění TUR a náhodné biopsie
- Derivace moči po cystektomii
- Komplikace spojené s cystektomií a derivací moči
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



