-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Urologické komplikácie po transplantácii obličky
UROLOGICAL COMPLICATIONS AFTER KIDNEY TRANSPLANTATION
Urinary tract reconstruction is an integral part of kidney transplantation. The aim of urinary tract reconstruction is to obtain optimum and socially acceptable drainage of urine from the transplanted kidney. The anatomical and functional status of the urinary tract significantly affects not only the patient´s quality of life after kidney transplantation, but also the function and survival of the transplanted kidney, and of the patients themselves.
Urological complications, related to urinary tract reconstruction, create a specific family among surgical complications after kidney transplantation, and belong to the most severe complications after kidney transplantation. They can cause loss of the transplanted kidney, and endanger the patient´s life.
In the case of urological complications, immediate precise diagnostics and appropriate surgical therapy, based on individual characteristics of the complication, is indicated.KEY WORDS:
kidney transplantation, urological complications
Autoři: J. Breza ml.; Z. Žilinská; P. Bujdák; J. Breza st.
Působiště autorů: Urologická klinika s Centrom pre transplantácie obličiek, Bratislava
Vyšlo v časopise: Urol List 2009; 7(1): 38-48
Souhrn
Rekonštrukcia močových ciest je integrálnou súčasťou transplantácie obličky. Cieľom rekonštrukcie močových ciest je snaha dosiahnuť optimálnu a sociálne najprijateľnejšiu drenáž moču z transplantovanej obličky. Anatomický a funkčný stav močových ciest významne ovplyvňuje nielen kvalitu života pacienta po transplantácii obličky, ale aj funkciu a prežitie transplantovanej obličky i samotných pacientov.
Komplikácie urologického charakteru, ktoré majú súvislosť s rekonštrukciou močových ciest tvoria samostatnú kapitolu medzi chirurgickými komplikáciami po transplantácii obličky a patria medzi najzávažnejšie komplikácie po transplantácii obličky. Môžu byť príčinou straty transplantovanej obličky, ale môžu pacientov aj priamo ohrozovať na živote.
V prípade urologických komplikácií sa indikuje promptná diagnostika a razantné chirurgické riešenie a to individuálne podľa charakteru komplikácie.KĽÚČOVÉ SLOVÁ:
transplantácia obličky, urologické komplikácieTransplantácia obličky predstavuje významný medzník v histórii medicíny. Navždy zostane prvou úspešnou orgánovou transplantáciou, na základe ktorej následne vyrástol celý multidisciplinárny odbor – transplantológia.
Rozvoj transplantačnej medicíny bol začiatkom 20. storočia zviazaný s pokrokmi v cievnej chirurgii a v imunogenetike. Prvú experimentálnu transplantáciu obličky vykonal viedenský chirurg Emmerich Ullmann v roku 1902 u psa. Obličkové cievy prišil na krčné cievy experimentálneho zvieraťa, močovod vyviedol navonok formou kutánnej ureterostómie. Prvú, ale neúspešnú, transplantáciu obličky u človeka vykonal ukrajinský chirurg J. J. Voronoj v roku 1933. Cievy obličky odobratej od mŕtveho darcu prišil na femorálne cievy pacientky a deriváciu moču vyriešil takisto kutánnou ureterostómiou.
Intenzívna vedecko-výskumná práca v oblasti imunológie nakoniec viedla v roku 1954 k prvej úspešnej transplantácii obličky medzi jednovaječnými dvojčatmi. Príjemca obličky žil s funkčným štepom 9 rokov [27].
Prvú transplantáciu obličky v bývalom Československu urobili v Hradci Králové v roku 1961 [34]. Systematický program transplantácií obličiek sa zahájil o 5 rokov neskôr v pražskom IKEM [58]. Prvú transplantáciu obličky na Slovensku urobil na Urologickej klinike LF UK v Bratislave profesor Zvara so svojimi spolupracovníkmi v roku 1972 [64].
Pri transplantácii obličky ide o alotransplantáciu, t.j. prenos orgánu medzi jedincami toho istého druhu. Autotransplantácia obličky znamená jej prenos z pôvodnej polohy do panvy a to pri postihnutí arteria renalis alebo pri poranení močovodu.
Obr. 1. Obličky odobraté so segmentami aorty a dolnej dutej žily. Zachované tukové tkanivo v hile obličiek a v okolí močovodov. 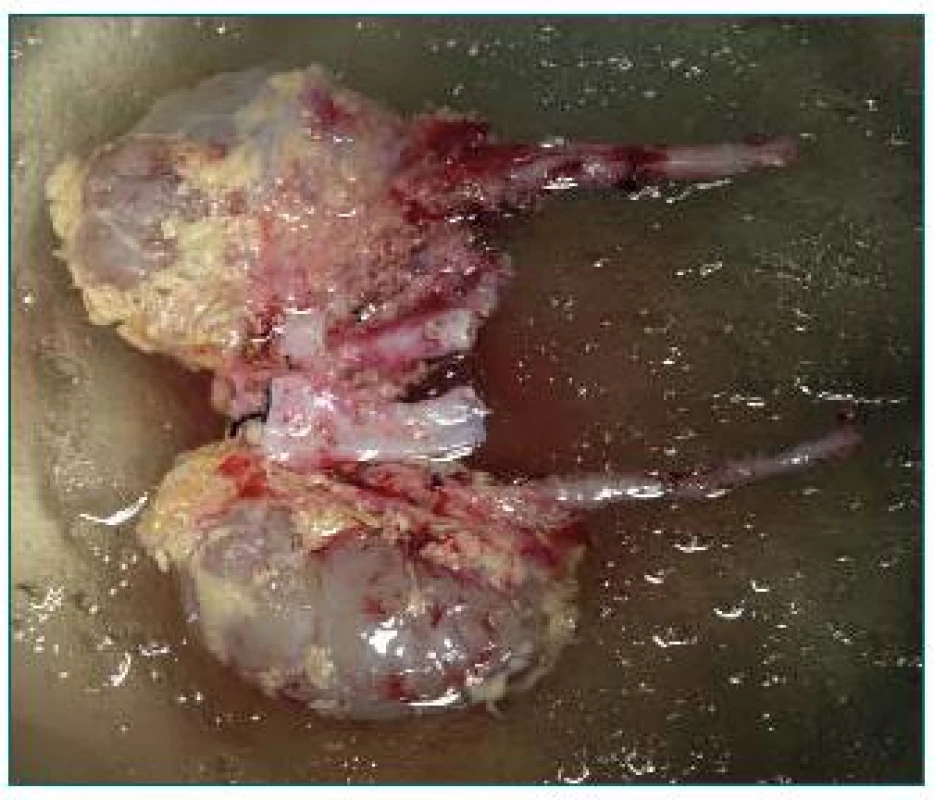
Chirurgická stránka transplantácie obličky sa v posledných desaťročiach v podstate nezmenila, používa sa technika, ktorú opísal v 50. rokoch 20. storočia profesor Küss [26]. Malé rozdiely v operačnej technike a taktike sú dané tradíciou a skúsenosťami konkrétneho transplantačného centra. Oblička sa pri transplantácii vkladá extraperitoneálne do fossa iliaca, jej cievy sa zošívajú s iliackými cievami. Integrálnou súčasťou transplantácie obličky je rekonštrukcia močových ciest. Cieľom rekonštrukcie močových ciest je snaha dosiahnuť optimálnu a sociálne najprijateľnejšiu drenáž moču z transplantovanej obličky.
Rekonštrukcia močových ciest významne ovplyvňuje nielen kvalitu života pacienta po transplantácii obličky, ale aj funkciu a prežitie transplantovanej obličky i samotných pacientov.
Komplikácie, s ktorými sa stretávame počas transplantácie obličky alebo v pooperačnom období, sa v zásade nelíšia od príhod sprevádzajúcich iné náročné chirurgické výkony. Ich priebeh však býva modifikovaný a to vzhľadom na celý rad nepriaznivých okolností u príjemcu (urémia, dialyzačná liečba s podávaním antikoagulancií, imunosupresia). Samostatnú kapitolu medzi chirurgickými komplikáciami po transplantácii obličky tvoria komplikácie urologického charakteru, ktoré majú súvislosť s rekonštrukciou močových ciest a patria medzi najzávažnejšie komplikácie po transplantácii obličky. Môžu byť príči-nou straty transplantovanej obličky, ale môžu pacientov aj priamo ohrozovať na živote.
Preto je problematike rekonštrukcie močových ciest potrebné venovať náležitú a komplexnú pozornosť. Pri odbere obličiek od mŕtvych aj živých darcov je potrebné zachovávať princípy šetrnej preparácie, neporaniť nielen cievy obličky, ale aj močovod a zachovať jeho anatomickú i funkčnú integritu [7,8]. Rovnako pozorná musí byť manipulácia s močovodom transplantovanej obličky aj pri samotnej rekonštrukcii močových ciest.
V pooperačnom období je sledovanie morfológie dutého systému obličky a močovodu rovnako dôležité ako sledovanie funkcie transplantovanej obličky a modifikácia imunosupresívnej liečby.
V prípade komplikácií sa indikuje promptná diagnostika a razantné chirurgické riešenie a to individuálne podľa charakteru komplikácie.
TRANSPLANTÁCIA OBLIČKY A REKONŠTRUKCIA MOČOVÝCH CIEST
Príprava odobratej obličky pre transplantáciu
Vlastná transplantácia obličky začína kontrolou odobratého orgánu pred samotnou operáciou. Oblička sa kontroluje v nádobe s ľadovou drťou, v podmienkach hypotermickej konzervácie, za prísne sterilných podmienok. Kontrolujú sa anatomické štruktúry obličky a efektívnosť preplachu obličky konzervačnou tekutinou pri jej odbere.
Správne premytá oblička je homogénne odfarbená, belavej farby. O jej nedostatočnom premytí svedčia modravé mramorové škvrny najčastejšie lokalizované v oblasti horného resp. dolného pólu. V prípade nedostatočného premytia je indikovaná reperfúzia obličky konzervačným roztokom (UW roztok alebo Custodiol) 0–4 °C studeným pod tlakom maximálne 100 cm H2O, a to až do úplného vyčírenia roztoku vytekajúceho z vena renalis a odfarbenia obličky.
Odobratá oblička je často doručená do transplantačného centra aj so svojim tukovým obalom. Capsula adiposa renis treba opatrne odstrániť z oblasti konvexity obličky a zachovať v oblasti hilu odobratej obličky. V hilovom tuku totiž môžu prebiehať drobné krvné vetvičky zásobujúce stenu obličkovej panvičky. Excesívne odstránenie hilového tuku obličky by mohlo spôsobiť ischémiu a následnú nekrózu steny panvičky a močovodu. Podobne treba zachovať aj tuk medzi proximálnym močovodom a dolným pólom obličky.
Kontrola arteriálneho systému odobratej obličky spočíva vo vykrojení terčíka (patchu) zo steny aorty s odstupmi jednej alebo viacerých renálnych artérií. A. renalis sa preparuje do vzdialenosti 1–2 cm od odstupu z aorty, pričom sa identifikuje a podviaže a. suprarenalis inferior, ktorá odstupuje z hlavného kmeňa a. renalis alebo z artérie zásobujúcej horný pól obličky. Nesmie sa podviazať a preťať a. ureterica, ktorá je tiež vetvičkou a. renalis.
V prípade viac početných renálnych artérií odobratých bez segmentu aorty je možné vytvoriť z nich spoločný arteriálny kmeň, ktorý sa následne prišije na arteriálny systém príjemcu obličky.
Obvykle tenšiu pólovú artériu, zásobujúcu dolný pól obličky, možno prišiť koncom k boku hlavného kmeňa a. renalis. Izolovanú pólovú artériu možno tiež osobitne prišiť na iliackú artériu príjemcu. Artériu zásobujúcu krvou dolný pól transplantovanej obličky treba každopádne zachovať a to najmä preto, že z nej môže odstupovať a. ureterica – jediný zdroj krvného zásobenia močovodu.
Podviazať možno len tenkú samostatnú artériu alebo arteriálnu vetvičku pre horný pól obličky a to len vtedy, ak sa nedá chirurgicky ošetriť a ak zásobuje krvou menej ako 10 % obličkového tkaniva (čo obvykle vidno ako farebne iný, nepremytý segment na hornom póle odobratej obličky).
Pri ošetrení venózneho systému obličky treba podviazať všetky, aj drobné, vetvičky, ktoré sa vlievajú do vena renalis. Toto je mimoriadne dôležité najmä v prípade retroaortálnej v. renalis vľavo, do ktorej sa vlievajú početné drobné vetvičky. Ľavá v. renalis sa z hilového tuku uvoľní až po vstupe v. testicularis resp. ovarica sin. a v. suprarenalis inf. sin., ktoré sa takisto podviažu.
Pravá vena renalis je podstatne kratšia ako ľavá v. renalis (3 cm oproti 7 cm). Krátka vena renalis pravej obličky by mohla byť problémom sťažujúcim manipuláciu obličky počas anastomózy v. renalis a v. ilica externa. Tomuto problému sa možno vyhnúť predĺžením v. renalis dx. pomocou priľahlého žilného segmentu vykrojeného z dolnej dutej žily. Pravú renálnu vénu tak možno predĺžiť o cca 3 cm, čo je zhruba priemer dolnej dutej žily.
Poranený močovod resp. obličkovú panvičku sa neodporúča rekonštruovať predoperačne, ale charakteru poranenia treba pri transplantácii obličky prispôsobiť metódu rekonštrukcie močových ciest.
Posledným krokom pri predoperačnej kontrole odobratej obličky je biopsia z parenchýmu obličky (tzv. nultá biopsia). Z konvexity obličky sa skalpelom vykrojí malý segment parenchýmu (približne 3 × 2 × 1 mm), miesto biopsie sa následne prešije niekoľkými matracovými stehmi.
Technika transplantácie obličky
Pri heterotopickej transplantácii obličky sa pravá oblička vkladá extraperitoneálne do iliackej jamy vľavo a naopak, ľavá oblička do iliackej jamy vpravo. Dôvodom je potreba zachovať paralelný priebeh arteria a vena renalis transplantovanej obličky a predísť ich kríženiu. Pri takomto postupe sú totiž a. iliaca externa aj a. renalis uložené ventrálne a za nimi sú lokalizované v. iliaca externa a v. renalis.
Ako prístup do fossa iliaca sa používa šikmý rez v podbrušku vedený cez obidva šikmé brušné svaly. Na našom pracovisku máme dobré skúsenosti s pararektálnym rezom od symfýzy supraumbilikálne. Tento rez pokladáme za podstatne šetrnejší, pretože sa pri ňom pozdĺžne pretína len vagina musculi recti abdominis, a nie svaly.
Peritoneum sa odsunie mediálne a kraniálne a v retroperitoneu sa odhalia iliacké cievy. Pri ich revízii je potrebné informovať sa najmä o rozsahu aterosklerotického postihnutia a. iliaca communis a jej bifurkácie, ako aj a. iliaca externa. Závažné aterosklerotické zmeny panvového arteriálneho riečišťa u príjemcu, nepoznané pred operáciou, môžu byť dôvodom na ukončenie transplantácie obličky. Stáva sa totiž, že na skleroticky zmenené iliacké artérie nie je možné ani založiť cievne klemy, a nie prišiť na ne artérie transplantovanej obličky. Riešenie takejto situácie ponúka prípadný aorto-femorálny bypass, na ktorý by bolo možné prišiť a. renalis.
Pri preparácii iliackých ciev príjemcu treba značnú pozornosť venovať aj lymfatickým cievam, ktoré prebiehajú paralelne s krvnými cievami. Lymfatické cievy je potrebné cielene elektro-koagulovať alebo podväzovať, aby sa čo najviac znížilo riziko vzniku pooperačnej lymfokely.
Koniec a. renalis sa prišíva pokračujúcim stehom na oválny otvor v bočnej stene a. iliaca externa. Podobným spôsobom sa prišíva koniec v. renalis k boku v. iliaca externa. Ako šijací materiál sa používa monofilné vlákno.
Rekonštrukcia močových ciest pri transplantácii
Po ukončení cievnych anastomóz, obnovení cirkulácie krvi v transplantovanej obličke a ukončení fázy tzv. studenej ischémie, prichádza na rad rekonštrukcia močových ciest.
U prevažnej väčšiny pacientov sa rekonštrukcia močových ciest dosiahne formou implantácie močovodu transplantovanej obličky do močového mechúra príjemcu [64,56]. Zásadne sa používa protirefluxová technika a to extravezikálnou metódou podľa Lich-Gregoira alebo Taguchiho [28,63]. Na našom pracovisku paušálne používame a máme dobré skúsenosti s transvezikálnou protirefluxovou technikou reimplantácie močovodu podľa Politano-Leadbettera, pri ktorej sa močovod transplantovanej obličky zasúva do 2–3 cm dlhého submukózneho tunela.
Vo výnimočných prípadoch, keď z dôvodov najmä anatomických nie je možné použiť túto techniku, používame priamu anastomózu močovodu so sliznicou / stenou močového mechúra podľa Boeminghausa a ak to stav močovodu dovolí, aj s vytvorením protirefluxovej papuly podľa Paquina. V týchto prípadoch močovod paušálne intubujeme krátkym stentom, ktorý ponechávame in situ 3–4 týždne.
Pri implantácii močovodu treba dbať na to, aby močovod nebol zatočený alebo zalomený. Musí prebiehať priamo, byť čo najkratší a jeho anastomóza s močovým mechúrom musí byť bez napätia.
Podstatne zriedkavejšie sa pre rekonštrukciu močových ciest používa metóda spočívajúca v spojení konca močovo-du transplantovanej obličky s koncom distálneho pahýľa preťatého vlastného močovodu príjemcu. Podväz a preťatie vlastného močovodu príjemcu obvykle nie je problémom u anurických pacientov. U pacientov so zachovanou diurézou je niekedy nutné odstrániť aj obličku, ktorej močovod sa použil na rekonštrukciu močových ciest.
Pri uretero-ureteroanastomóze sa navzájom zošívajú spatulizované, pozdĺžne nastrihnuté konce oboch močovodov. Anastomóza sa zaisťuje hrubým stentom, ktorý sa ponecháva in situ 3–4 týždne.
Výnimočným spôsobom rekonštrukcie močových ciest, ktorý sa používa najmä pri ortotopickej transplantácii obličky (oblička sa transplantuje na miesto odstránenej vlastnej obličky príjemcu), je anastomóza vlastnej obličkovej panvičky príjemcu s panvičkou transplantovanej obličky, ktorá bola patrične zostrihnutá [1].
Po ukončení transplantácie obličky sa operačná rana drenuje pararenálne uloženým drenom, močový mechúr sa drenuje uretrálnou cievkou, vo výnimočných prípadoch epicystostómiou.
Pooperačný priebeh u pacientov po transplantácii obličky je podobný pooperačnému priebehu po iných náročných operáciách. Pooperačné sledovania a liečba sú však náročnejšie preto, že ide o polymorbídnych, uremických, niekedy oligo-anurických pacientov, ktorým sa podávajú imunosupresívne látky a antikoagulanciá. Navyše, ak transplantovaná oblička neobnoví svoju funkciu bezprostredne po operácii, je potrebné pacientov opakovane dialyzovať. Keďže pri imunosupresívnej liečbe je znížená odolnosť pacientov, odporúča sa profylaktické podávanie antibiotík ako ochrana proti vzniku a rozvoju interkurentných infekcií.
UROLOGICKÉ KOMPLIKÁCIE PO TRANSPLANTÁCII OBLIČKY
Urinózna fistula
I napriek podstatným pokrokom v technike rekonštrukcie močových ciest, zostávajú urologické komplikácie významnou príčinou morbidity i mortality pacientov po transplantácii obličky [22]. Incidencia urologických komplikácií po transplantácii obličky varíruje od 3 % do 14 % s pravdepodobnosťou straty štepu u 10–15 % pacientov a mortalitou až 15 %, a to i napriek zlepšeniam v prevencii, diagnostike a liečbe komplikácií a používaniu nových imunosupresívnych látok. Incidencia urologických komplikácii je vyššia u detí (až 20 %), pričom tieto komplikácie významne znižujú aj prežitie transplantovanej obličky [41,14,29].
Obr. 2. Urinózna fistula. Močovod transplantovanej obličky poranený pri perkutánnej drenáže lymfokély. 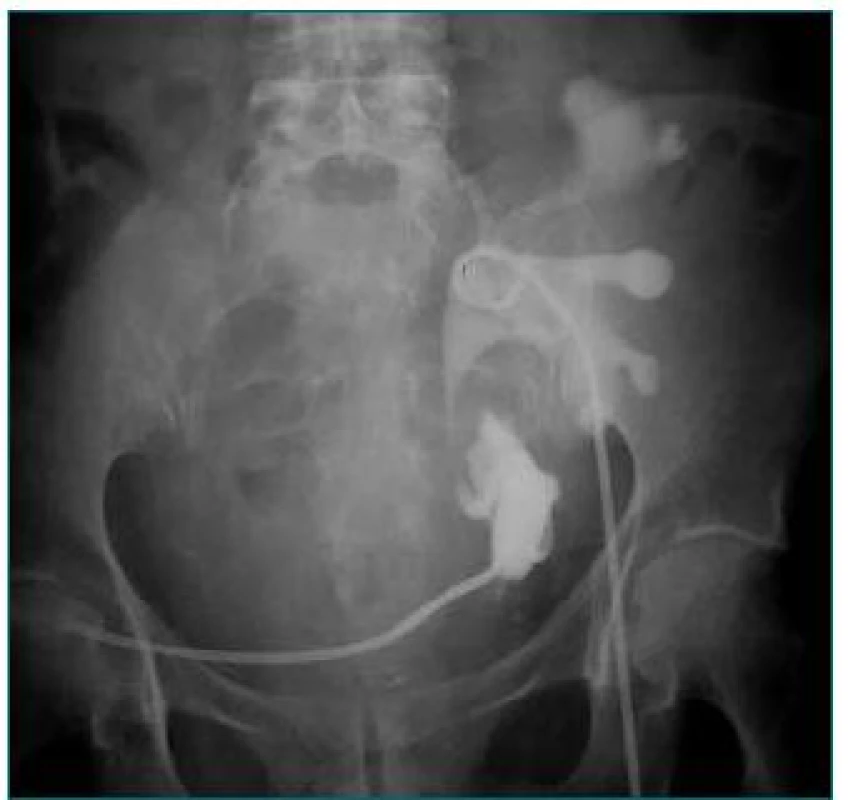
Obr. 3. Urinózna fistula podmienená nekrózou močovodu transplantovanej obličky. 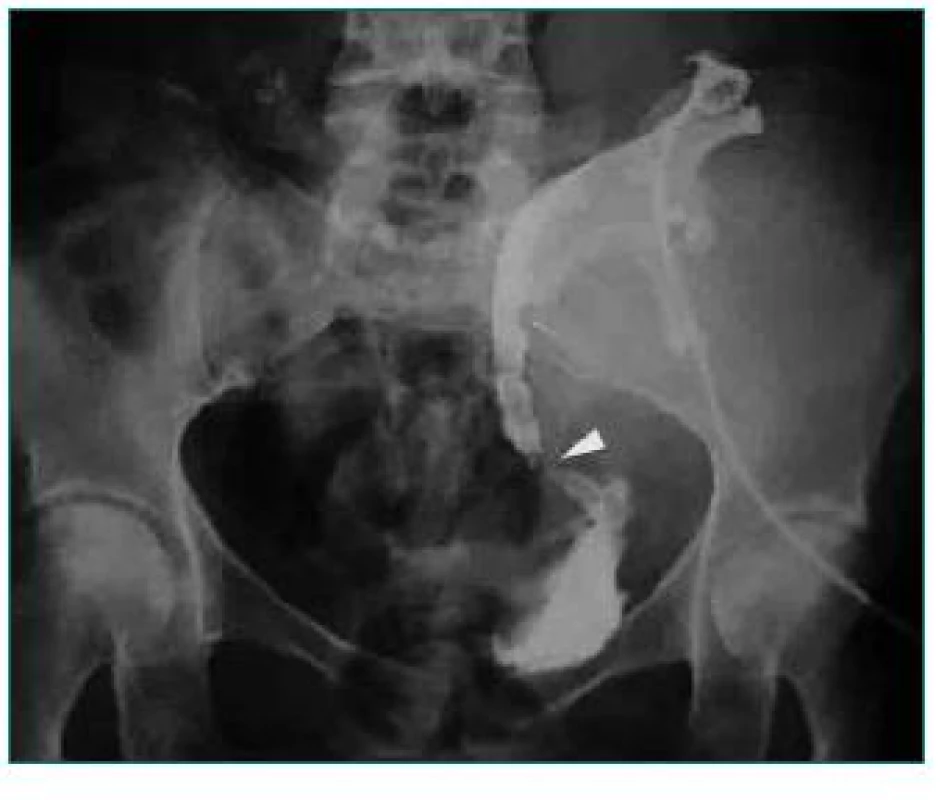
Obr. 4. Urinózna fistula podmienená nezahojenou suturou cystotómie u pacienta po transplantácii obličky. 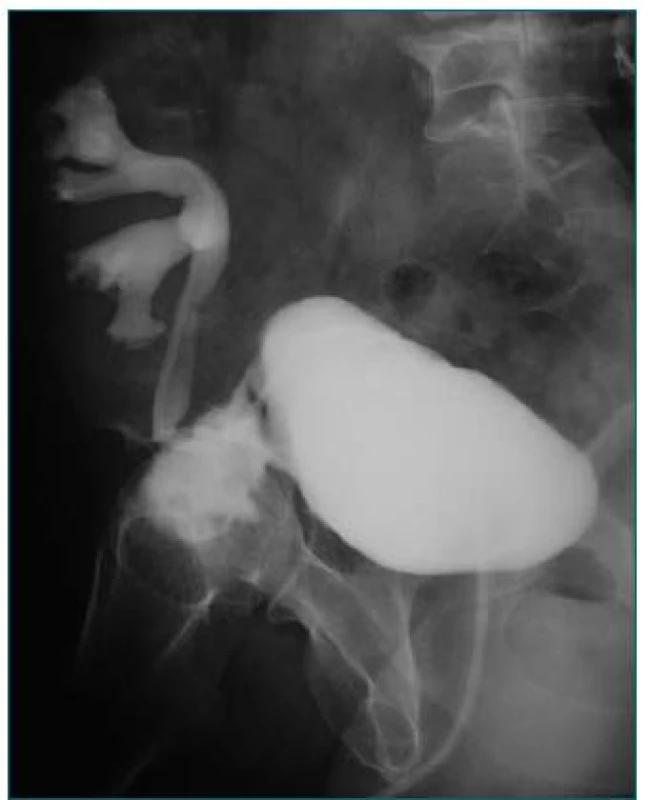
Urinózne fistuly môžu byť dôsledkom technickej chyby pri samotnej transplantácii obličky resp. ischemického poškodenia a následnej nekrózy močovodu alebo až obličkovej panvičky. Incidencia urinóznych fistúl po transplantácii obličky sa v literatúre udáva v rozmedzí 1,3–5,4 % [42,2,14,15,17,29].
Typicky sa vyskytujú vo včasnom potransplantačnom období. Väčšina z nich vychádza z miesta spojenia močovodu transplantovanej obličky s močovým mechúrom resp. v prípade transvezikálnej reimplantácie močovodu aj z netesnej sutury stien močového mechúra.
V neskoršom pooperačnom období môže vzniknúť urinóm ako dôsledok iatrogénneho poranenia močovodu (napr. pri laparoskopickej operácii pre lymfokelu) alebo pri endoskopickej manipulácii (napr. pre ureterolitiázu).
Najčastejšou príčinou úniku moču bezprostredne po transplantácii obličky je technicky nedokonalá reimplantácia močovodu do močového mechúra príjemcu. Medzi extravezikálnymi protirefluxovými technikami a transvezikálnou reimplantáciou močovodu nie sú popísané rozdiely vo výskyte pooperačnej močovej fistuly [41,63].
V prípade včasnej obnovy diurézy transplantovanou obličkou sa spomínaná technická chyba prejaví masívnym únikom moču cez drén uložený pararenálne. K úniku moču v tejto lokalizácii môže dôjsť aj cez cystotómiu pri preplnení nedostatočne drenovaného močového mechúra.
Inou príčinou urinómu resp. urinóznej fistuly je nekróza močovodu transplantovanej obličky. Incidencia nekrózy močovodu sa udáva v rozmedzí 0,4–3,2 % transplantácií obličiek [44,15,24].
Ako urinóm sa označuje kolekcia moču v okolí transplantovanej obličky. Ak sa urinóm prevalí cez ranu alebo cez otvor po drene, vzniká urinózna fistula. Urinóm môže komunikovať aj s peritoneálnou dutinou resp. s niektorými orgánovými systémami, napr. GIT-om [34].
Príčinou nekrózy, ktorá postihuje najčastejšie terminálny úsek močovodu, niekedy však i celý močovod a časť obličkovej panvičky, je ischémia ako dôsledok porušenia krvného zásobenia steny močovodu. K porušeniu výživy steny močovodu často vedie poranenie arteriálneho zásobenia resp. venóznej drenáže močovodu pri odbere obličky alebo pri nešetrnej manipulácii s močovodom počas samotnej transplantácie.
Urinózna fistula pri nekróze močovodu typicky vzniká neskôr, okolo 7. až 10. dňa po transplantácii.
K minimálnym mikroskopickým zmenám v stene močovodu dochádza už pri smrti dárcu a pri hypotermickej konzervácii odobratej obličky v zmysle lymfocytárnej infiltrácie (mierna až stredne závažná infiltrácia hlavne CD8(+) T lymfocytmi), exfoliácie urotelu (u 42 % močovodov) a bunečnej vakuolizácie (u 52,4 % močovodov). Nezaznamenali sa žiadne súvislosti medzi zmenami v stene močovodu a HLA kompatibilitou dárcu a príjemcu obličky [18].
Po obnovení cirkulácie krvi v obličke a v močovode vznikajú v dlhšom časovom horizonte ďalšie charakteristické zmeny v stene močovodu: atrofia urotelu (u 20 % močovodov) a rejekčné lézie. Intenzitu a frekvenciu atrofie urotelu významne ovplyvňuje vek dárcu. Rejekčné zmeny vznikajú typicky v súvislosti s akútnou rejekčnou epizódou – až u 38 % močovodov počas prvých 3 mesiacov po ope-rácii, neskôr u menej ako 15,4 % močovodov [19].
Diagnostika príčiny vzniku urinómu resp. močovej fistuly musí byť rýchla a presná. Na možnú nekrózu močovodu treba myslieť v prípade vzniku závaž-nej dysfunkcie transplantovanej obličky [48].
Biochemickým vyšetrením sekrétu vytekajúceho z drenu alebo operačnej rany odlíšime moč od krvného séra. V okolí transplantovanej obličky je obvykle hmatná bolestivá rezistencia. Prítomnosť a rozsah tekutinovej kolekcie a jej vzťah k transplantovanej obličke a k močovému mechúru potvrdia vizualizačné vyšetrenia (USG, CT, MR). Ultrasonogragficky sa obvykle dokáže dilatácia dutého systému obličky a proximálneho močovodu. Pod ultrasonografickou kontrolou možno následne cielene napichnúť dutý systém transplantovanej obličky a urobiť antegrádnu pyelo-ureterografiu, pri ktorej sa presne potvrdí únik moču mimo močové cesty a s veľkou presnosťou sa ukáže aj miesto úniku moču. Cez punkčný kanál sa následne na vodiči zasunie do dutého systému transplantovanej obličky nefrostomický kateter a tak sa zabezpečí dokonalá derivácia moču z obličky [9].
V prípade podozrenia na únik moču z močového mechúra je indikovaná cystografia.
U všetkých pacientov s urinóznou fistulou močovodu sa odporúča chirurgická revízia. Jedine včasnou chirurgickou intervenciou možno dosiahnuť zachovanie resp. obnovenie funkcie transplantovanej obličky [29].
O endourologickú liečbu spočívajúcu v zavedení ureterálneho stentu a spoľahlivej drenáže transplantovanej obličky a močového mechúra sa možno pokúsiť len v prípade nezávažného „premokania“ moču z miesta uretero-vezikálnej anastomózy [2,47]. Ak sa urinózna fistula po endourologickej liečbe nezahojí, indikuje sa otvorená chirurgická liečba. Cieľom operácie je identifikácia charakteru lézie, miesta a príčiny úniku moču a následne rekonštrukcia močových ciest.
Ak je príčinou urinóznej fistuly inkompetentná uretero-vezikálna anastomóza, je metódou voľby jej liečby spoľahlivá opakovaná implantácia močovodu do močového mechúra so zavedením ureterálneho stentu.
Podstatne zložitejšia a technicky náročnejšia je rekonštrukcia močových ciest pri nekróze močovodu transplantovanej obličky. Nekróza väčšinou postihuje distálnu tretinu močovodu. Kým zdravý močovod má ružovo-červenú farbu, nekrotická časť je žlto-šedá. Problémom v tejto situácii je neistota v tom, či rozsah nekrózy močovodu je definitívny, či sa nekróza už demarkovala alebo bude pokračovať na proximálnu časť močovodu.
V prevažnej väčšine prípadov je možné urinóznu fistulu, ktorá je dôsledkom nekrózy terminálneho močovodu, riešiť resekciou nekrotickej časti a reimplantáciou močovodu s použitím ureterálneho stentu.
Ako alternatívne metódy prichádzajú do úvahy Boariho plastika [29], uretero-uretero anastomóza s natívnym močovodom príjemcu [17], anastomóza natívneho močovodu s panvičkou [30,48] alebo s dolným kalichom transplantovanej oblič-ky [53,34] alebo pyelocystoanastomóza [44].
Vo výnimočných prípadoch možno nekrotický močovod nahradiť exkludovaným segmentom ilea [62] či dokonca apendixom [5].
Čím komplikovanejší spôsob rekonštrukcie močových ciest, tým vyšší býva výskyt perioperačných komplikácií.
Konečným riešením vážnych, najmä septických komplikácií súvisiacich so vznikom a neúspešnou liečbou urinóznej fistuly po transplantácii obličky je graftnefrektómia asi u 1 % pacientov [29].
Striktúra močovodu
Jedným z možných faktorov podieľajúcich sa na pooperačnej dysfunkcii transplantovanej obličky môže byť prekážka v odtoku moču, obvykle na úrovni močovodu transplantovanej obličky.
Prekážka môže vzniknúť jednak v dôsledku patologických zmien samotného močovodu, ale i pri iných peroperačných a pooperačných špecifických problémoch transplantácie.
Obr. 5. Nekrotický močovod transplantovanej obličky nahradený segmentom ilea. 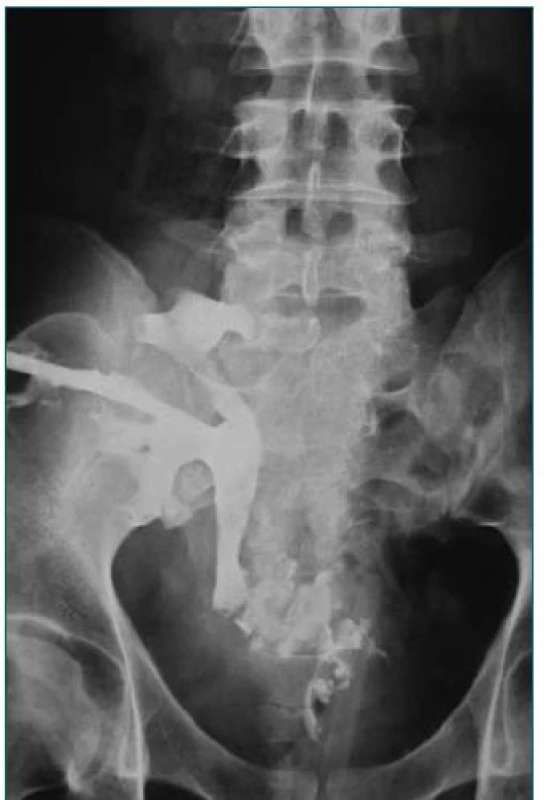
Obr. 6. Hydronefróza transplantovanej obličky podmienená zalomením močovodu v mieste pyelo-ureterálnej junkcie. 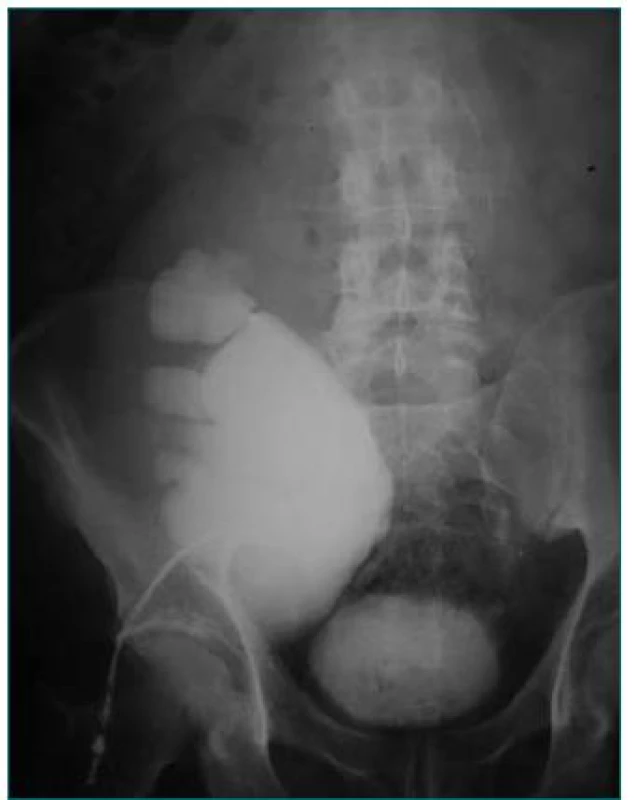
Pri atypickej polohe transplantovanej obličky umiestnenej v panve príjemcu môže dôjsť k zalomeniu alebo torkvácii močovodu. Močovod sa zvykne zalomiť v oblasti pyelo-ureterálnej junkcie alebo juxtavezikálne, kde príčinou zalomenia môžu byť zrasty v okolí močovodu. Dôsledkom oboch situácii je porucha drenáže transplantovanej obličky, ktorá sa obvykle prejaví vo včasnom pooperačnom období. Ďalšou príčinou môže byť technická chyba pri reimplantácii močovodu, ktorej dôsledkom je nepriechodný močovod na úrovni uretero-vezikálneho spojenia. Problémom s drenážou moču v týchto situáciách možno predísť peroperačným zavedením ureterálneho stentu. Stent sa okrem drenážnej funkcie podieľa aj na stabilizácii polohy močovodu transplantovanej obličky.
Obr. 7. Zalomený terminálny močovod transplantovanej obličky. 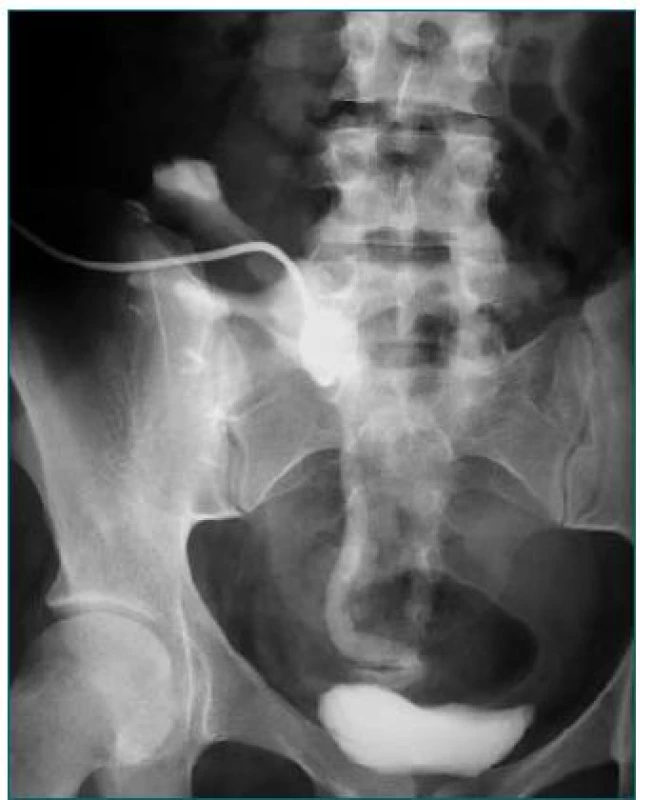
Obr. 8. Striktúra terminálneho úseku močovodu transplantovanej obličky. 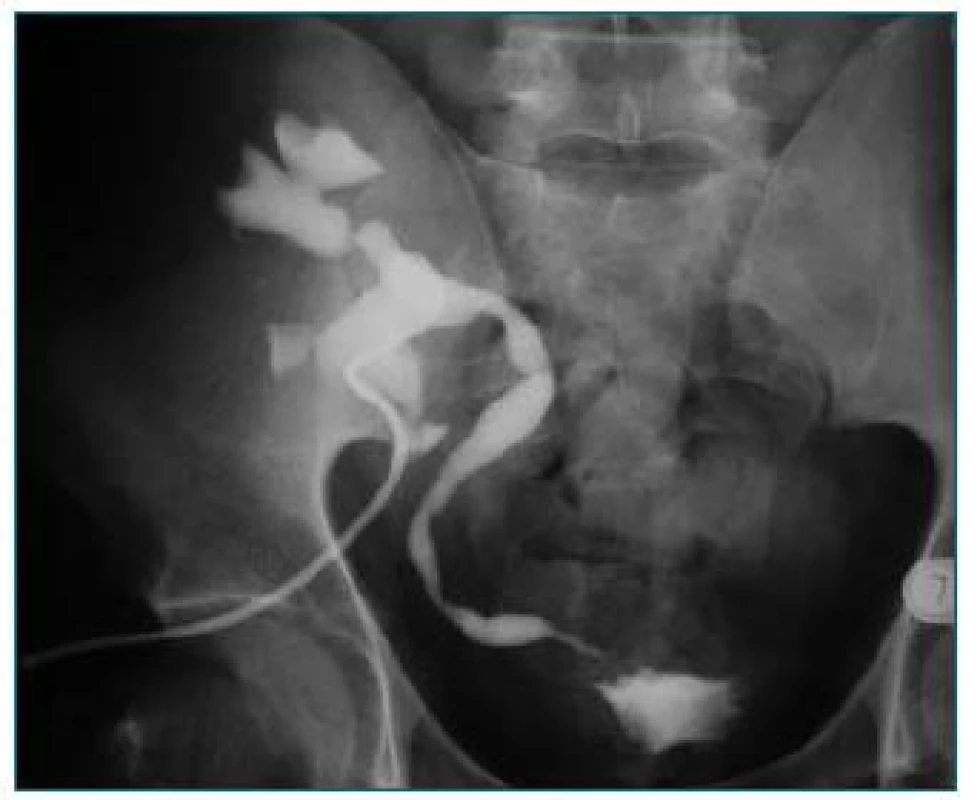
Známe sú však aj extrémne situácie, keď sa prekážkou pre voľný odtok moču z transplantovanej obličky stal močovod dislokovaný do inguinálnej hernie [36,23].
Najvýznamnejšou príčinou porušenej drenáže moču z transplantovanej obličky je striktura močovodu. Vznik striktury močovodu, ktorá je neskorou komplikáciou, býva dôsledkom patologických zmien v stene samotného močovodu a môže mať súvislosť s infekciami močových ciest, abscesmi v operačnej rane, ischémiou močovodu s následnými fibrotickými zmenami. Pri vzniku striktúry močovodu sa pripúšťa aj účasť rejekčných zmien [29,34].
Dôsledkom prekážky v odtoku moču z transplantovanej obličky akejkoľvek etiológie je zhoršenie funkcie transplantovanej obličky a dilatácia dutého systému obličky a močovodu nad prekážkou. Stáza moču nad prekážkou znamená súčasne významný predisponujúci moment pre vznik a rozvoj infekcie močových ciest. Na základe infekcie v takomto teréne často vzniká urosepsa.
Na druhej strane je ureterohydronefróza transplantovanej obličky často asymptomatickou komplikáciou, ktorá sa odhalí náhodne pri rutinnom ultrasonografickom vyšetrení alebo na podklade zhoršujúcej sa funkcie transplantovanej obličky.
Pri ureterohydronefróze sa postupne zhoršuje funkcia transplantovanej obličky. Presnú informáciu o funkcii resp. dysfunkcii transplantovanej obličky (a dynamike dysfunkcie) poskytne gamagrafia. Diagnostický a súčasne terapeutický význam má perkutánna punkčná pyelo-ureterografia a následná nefrostómia hydronefroticky zmenenej transplantovanej obličky. Antegrádnou pyelo-ureterografiou možno presne lokalizovať miesto aj charakter striktury močovodu. Derivácia moču nefrostómiou umožní nielen presné vyšetrenie horných močových ciest, ale „odľahčením“ obličky a znížením hydrostatického tlaku v jej dutom systéme aj zlepšenie funkcie obličky a efektívnu liečbu sprievodnej infekcie močových ciest. Neinvazívne vyšetrenie – urografia – obvykle neprináša dostatočne validné diagnostické informácie. Hydronefroticky zmenená transplantovaná oblička s poškodenou funkciou nevylučuje totiž dostatočne intenzívne kontrastnú látku, preto zobrazenie dutého systému obličky a močovodu je nedostatočné. V individuálnych prípadoch je však možné k diagnostickému záveru dospieť aj na základe urografie.
Liečba ureterohydronefrózy transplantovanej obličky závisí od klinického stavu pacienta. V prípade oligo-anurického a uremického pacienta, niekedy s teplotami, je ako prvý krok indikovaná perkutánna punkčná nefrostómia, rehydratácia pacienta a adekvátna antibiotická liečba. Po stabilizácii klinického stavu prichádza do úvahy definitívna liečba spočívajúca v odstránení alebo obídení prekážky v močovode endoskopickou alebo otvorenou chirurgickou intervenciou.
Principiálne u pacientov so striktúrou močovodu je prvým krokom endoskopická liečba antegrádnym alebo retrográdnym prístupom. O endoskopickú liečbu sa možno pokúsiť najmä vo včasných štádiách resp. pri miernom stupni obštrukcie močovodu. Z endoskopických techník prichádza do úvahy endopyelotomia pri striktúre močovodu v mieste pyelo-ureterálnej junkcie, perkutánne antregrádne techniky, ureteroskopia [4], dilatácia striktúry balónom [10], použitie samo-expandabilného kovového stentu [12,11] alebo incízia striktúry elektrickým vláknom – Acucise.
Naopak, pri neskorom vzniku striktúry močovodu a pri závažnej obštrukcii sa indikuje chirurgická revízia.
Metódou voľby je identifikácia močovodu, jeho uvoľnenie z rozsiahlych zrastov, resekcia časti močovodu so striktúrou a následná reimplantácia močovodu do močového mechúra. Pri operácii treba o. i. dostatočne mobilizovať stenu močového mechúra tak, aby bola možná reimplantácia bez napätia [34,25].
V prípade, že z rôznych dôvodov nie je možná jednoduchá reimplantácia močovodu, využívajú sa alternatívne chirurgické metódy popísané v časti o chirurgickej liečbe nekrózy močovodu transplantovanej obličky.
V prípade dilatovanej extrarenálnej panvičky transplantovanej obličky prichádza do úvahy priame spojenie panvičky s močovým mechúrom. Adonian a spol. (2005) ako prví popísali použitie silikón-polyesterového „umelého“ močovodu (pyelo-vezikálneho bypassu) u pacientov po neúspešnej endourologickej resp. otvorenej chirurgickej liečbe striktúry močovodu po transplantácii obličky. Pre definitívne posúdenie a klinické uplatnenie tejto liečebnej možnosti sú však potrebné ďalšie dlhodobé klinické štúdie.
URETERÁLNE STENTY
Do kategórie „protektívnych“ opatrení pri rekonštrukcii močových ciest patrí aj používanie ureterálnych stentov.
Literárne údaje svedčia o priaznivom vplyve ureterálnych stentov v prevencii vzniku urologických komplikácií po transplantácii obličky. Mangus a Haag (2004) formou meta-analýzy hodnotili výhody a nevýhody spojené s používaním ureterálnych stentov publikované v 49 štúdiách a kazuistikách. U pacientov, u ktorých boli pri transplantácii obličky použité ureterálne stenty, bol významne nižší výskyt urologických komplikácií (1,5 až 3,2 %) v porovnaní so skupinou pacientov, u ktorých ureterálne stenty použité neboli (4,8 až 9 %). Sansalone a spol. (2005), Minnee a spol. (2006), Du Bay a spol. (2007) a Tavakoli a spol. (2007) poukazujú na významne nižší výskyt urologických komplikácií najmä vo včasnom štádiu po transplantácii obličky, teda vtedy, keď je výskyt komplikácií najvyšší.
Napriek týmto skúsenostiam sa však profylaktické používanie ureterálnych stentov jednoznačne neodporúča. Rutinné používanie ureterálnych stentov z profylaktických dôvodov nesie so sebou tak benefit ako aj špecifické komplikácie. Pacienti vo všeobecnosti ureterálne stenty dobre znášajú. Medzi špecifické komplikácie patrí hematuria, infekcie močových ciest, príznaky porúch skladovania moču v močovom mechúre, migrácie a inkrustácie stentov a súvislosť stentov so vznikom polyovirusovej nefropatie štepu [54]. Ku komplikáciám vedú najmä dlhé ureterálne stenty (dlhšie ako 20 cm) a stenty ponechané in situ dlhšie ako 6 týždňov [22,61]. Do istej miery umožňuje znížiť závažnosť nepriaznivého vplyvu stentov profylaktická protibakteriálna liečba a odstránenie ureterálnych stentov do 4 týždňov po transplantácii obličky.
Kvôli spomínaným problémom odporúčajú Osman a spol. (2005) obmedziť použitie ureterálnych stentov len pre pacientov s patologickým alebo nefunkčným močovým mechúrom.
PROFYLAXIA VZNIKU UROLOGICKÝCH KOMPLIKÁCIÍ PO TRANSPLANTÁCII OBLIČKY
V súvislosti s technikou obnovenia kontinuity močových ciest pri transplantácii obličky a s rekonštrukciou komplikácií postihujúcich močovod transplantovanej obličky je v praktickej medicíne mimoriadne aktuálnym problémom okrem zachovania viability a predchádzania poškodenia močovodu tiež používanie ureterálnych stentov.
Už počas odberu obličky od živého i mŕtveho darcu treba zachovaniu anatomickej i funkčnej integrity močovodu venovať mimoriadnu pozornosť.
Ako už bolo uvedené, výživu močovodu transplantovanej obličky zabezpečuje len jedna artéria – a. ureterica, ktorá je vetvičkou a. renalis, a to prostredníctvom hustej siete arteriol v adventícii močovodu. Pri odbere obličky sa preto treba za každú cenu vyhnúť poraneniu arteriálneho zásobenia, ale aj venóznej drenáže močovodu. Odoberajúci urológ resp. chirurg musí preto močovod preparovať veľmi opatrne, nechytať ho pinzetou, len vlastnými prstami a v okolí močovodu zachovať asi 1 cm vrstvu periureterálneho tkaniva. Zachovaný musí zostať aj trojuholník tukové tkaniva medzi močovodom a dolným pólom obličky, v ktorom prebiehajú drobné vetvičky zásobujúce krvou stenu obličkovej panvičky a proximálneho močovodu.
Rovnako dôležité je zachovanie akcesórnej, pólovej artérie pre dolný pól obličky, pretože práve z nej môže odstupovať arteriálna vetvička pre močovod [29].
Arteria a vena renalis sa nesmú preparovať hlboko do hilu obličky, opäť pre riziko poranenia drobných arteriál-nych vetvičiek zásobujúcich obličkovú panvičku.
Význam zachovania testikulárnej resp. ovarickej vény, ktorá prebieha paralelne s močovodom, pre viabilitu močovodu (resp. v prevencii striktúr močovodu) sa nepotvrdil [6].
Obr. 9. Terminálny úsek močovodu transplantovanej obličky obliterovaný v dôsledku ischémie. 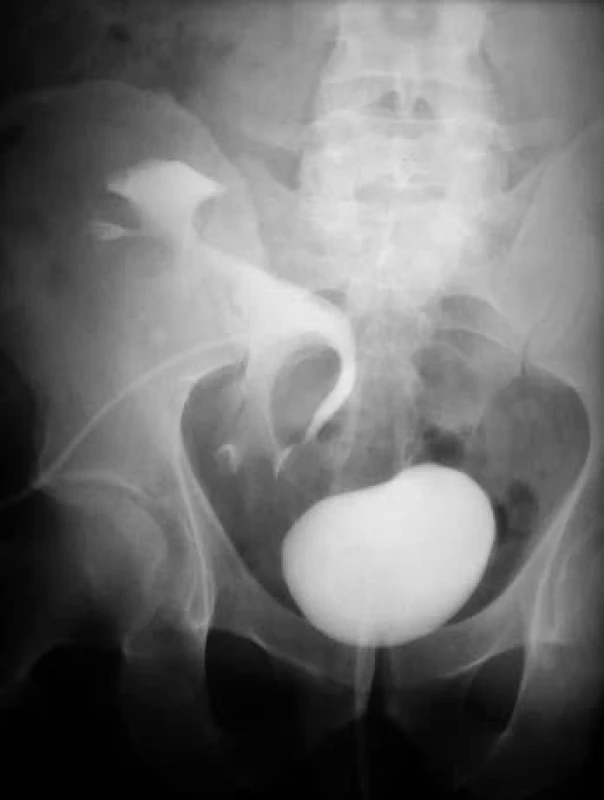
Obr. 10. „Double J“ ureterálny stent zavedený peroperačne do dutého systému transplantovanej obličky. 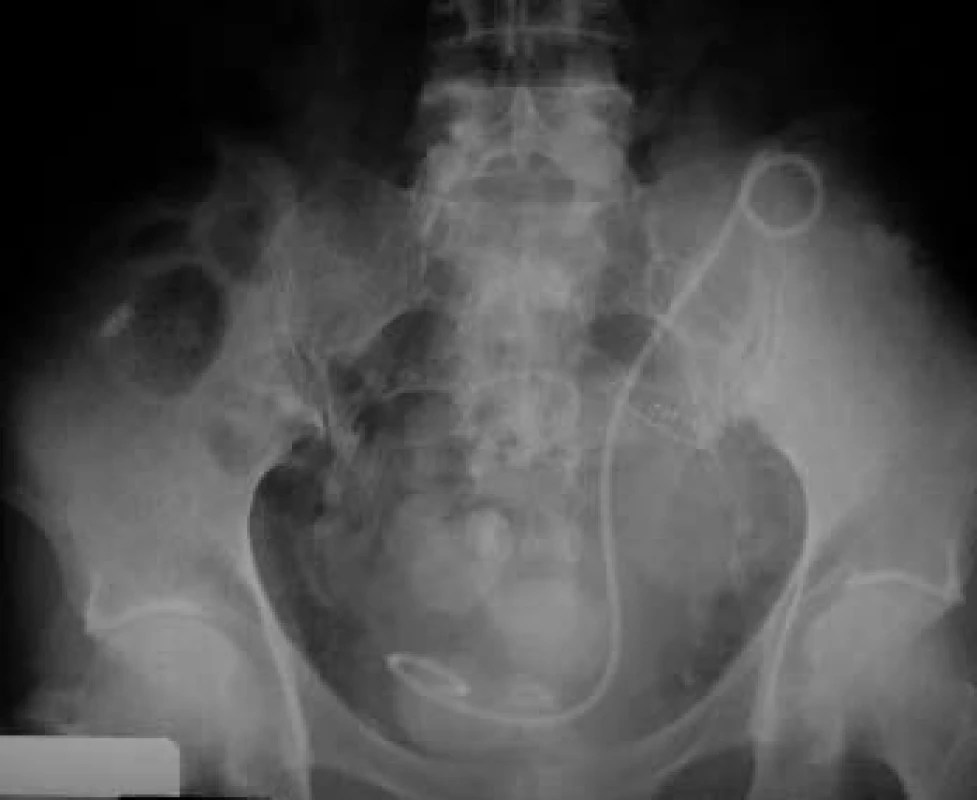
Ren et ureter duplex, krátky močovod
Zdvojená oblička so zdvojeným močovodom nie je kontraindikáciou pre jej odber a transplantáciu.
Pre zachovanie anatomickej i funkčnej integrity obidvoch močovodov je potrebné dodržiavať všetky už uvedené podmienky. V každom prípade sa odporúča ponechať obidva močovody v spoločnej fibróznej pošve. Ich oddelenie by mohlo viesť k poruche výživy s rizikom následnej nekrózy močovodov.
V záujme zachovania životaschopnosti močovodov sa obidva spolu v spoločnej pošve implantujú do močového mechúra cez spoločný submukózny kanál. Frekvencia urologických komplikácií u obličiek so zdvojenými močovodmi nie je vyššia ako u obličiek s jedným močovodom [49,20,57].
Pri odbere obličky sa močovod pretína pod jeho skrížením so spoločnou iliackou tepnou. Krátky močovod znamená technickú chybu pri odbere obličky, nemení však kvalitu odobratej obličky.
Ak močovod pri samotnej transplantácii obličky nedosiahne k močovému mechúru, je najvýhodnejšie rekonštruovať močové cesty formou uretero-ureteroanastomózy s vlastným močovodom príjemcu. Odporúča sa anastomóza end-to-end po patričnej spatulizácii oboch pahýľov močovodov (močovodu transplantovanej obličky a vlastného močovodu príjemcu). Transureteroureterostómia (koniec močovodu transplantovanej obličky k boku vlastného močovodu príjemcu) sa neodporúča a to pre vysoký výskyt komplikácií súvisiacich s touto technikou.
Veziko-renálny reflux po transplantácii obličky
Pod pojmom veziko-renálny reflux sa rozumie spätný tok moču z močového mechúra do horných močových ciest. Veziko-renálny reflux a s ním súvisiaca refluxová nefropatia pri súčasnej infekcii močových ciest je známou príčinou chronickej renálnej insuficiencie.
Pasívny veziko-renálny reflux je klinicky závažnejší a znamená spätný tok počas skladovania moču v močovom mechúre. Ku aktívnemu veziko-renálnemu refluxu dochádza pri zvýšení intravezikálneho tlaku počas mikcie.
Veziko-renálny reflux vedie k progresívnej dilatácii horných močových ciest. Hydrostatický tlak z močového mechúra sa prenáša kanalikulárnym systémom voľne do parenchýmu obličky a vedie k jeho tlakovej atrofii. Súčasná infekcia významne urýchľuje škodlivý vplyv refluxu na osud postihnutej obličky.
Pri rekonštrukcii močových ciest počas transplantácie obličky sa venuje pozornosť prevencii veziko-renálnemu refluxu a to protirefluxovou reimplantáciou močovodu do močového mechúra. Súčasťou každej metódy reimplantácie močovodu, extravezikálnej i transvezikálnej, je vytvorenie protirefluxového mechanizmu, pri ktorom sa močovod vkladá do podslizničného tunela.
Veziko-renálny reflux má negatívny vplyv aj na funkciu transplantovanej obličky. Sú známe dve príčiny veziko-renálneho refluxu. Prvou je technicky nedokonalá, inkompetentná uretero-vezikálna anastomóza a druhou príčinou je funkčná porucha močového mechúra, najmä neurogénny mechúr s hyperaktívnym detrusorom.
Incidencia veziko-renálneho refluxu po transplantácii obličky sa udáva v rozmedzí 1–79 % [34,13]. Veľký rozptyl v incidencii veziko-renálneho refluxu sa vysvetľuje najmä tým, že po refluxe sa cielene pátra len u symptomatických pacientov.
Dominantným príznakom veziko-renálneho refluxu je pretrvávajúca resp. recidivujúca infekcia močových ciest, niekedy až vo forme septickej pyelonefritidy.
Pre diagnostiku veziko-renálneho refluxu u pacientov po transplantácii obličky sa používa štandardná mikčná cystouretrografia. Ide o invazívne vyšetrenie. DMSA gamagrafiou možno nielen posúdiť funkciu transplantovanej obličky, ale aj detekovať dôsledky veziko-renálneho refluxu vo forme jaziev v parenchýme obličky.
Liečba veziko-renálneho refluxu u pacientov po transplantácii obličky je konzervatívna alebo chirurgická. Väčšina autorov odporúča konzervatívny postup vyplývajúci z poznania, že veziko-renálny reflux nemá na funkciu transplantovanej obličky taký negatívny vplyv ako obštrukcia uretero-vezikálneho spojenia.
Podstatou chirurgickej liečby je vytvorenie antirefluxného mechanizmu predĺžením podslizničného úseku močovodu [25].
Ide o operáciu technicky náročnú a zložitú. Výhodný je transvezikálny prístup, pri ktorom sa obkrojí ústie močovodu, močovod sa uvoľní v dĺžke 2–3 cm a implantuje do novovytvoreného submukózneho kanála.
Urolitiáza v transplantovanej obličke
Ďalšou klinickou jednotkou, ktorá je výsostne urologická a ktorá sa môže vyskytnúť aj v transplantovanej obličke, je urolitiáza.
Nefrolitiáza však nepatrí medzi časté komplikácie po transplantácii obličky. V prípade nefrolitiázy v transplantovanej obličke ide častejšie o konkrementy prenesené od darcu resp. menej často o konkrementy, ktoré sa v obličke vytvorili po transplantácii.
Obr. 11. Nefrolitiáza transplantovanej obličky. 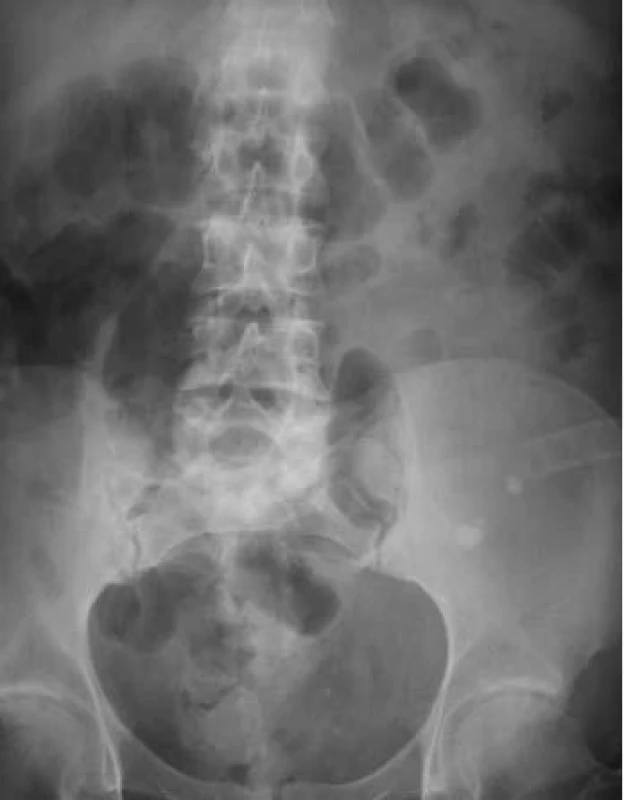
Na vzniku konkrementov de novo v transplantovanej obličke sa podieľajú dva typické etiologické faktory – hyperurikémia (potencovaná liečbou cyklosporinom A) a infekcia močových ciest baktériami štiepiacimi ureu a alkalizujúcimi moč. Pri hyperurikémii a hyperurikosurii vznikajú urátové kamene, pri infekcii moču struvitové kamene (fosforečnan horečnato-amónny). Ku vzniku konkrementov v transplantovanej obličke prispieva tiež stáza v močových cestách a prítomnosť cudzieho telesa (ureterálneho stentu alebo nefrostomického katetra).
Kamene prenesené v obličkách odobratých od živých aj mŕtvych darcov bývajú rôzneho chemického zloženia – oxalátové, urátové aj kalcium fosfátové.
Symptomatológia nefrolitiázy v transplantovanej obličke a ureterolitiázy sa líši od príznakov nefrolitiázy u iných pacientov a to preto, že transplantovaná oblička je denervovaná. Najčastejším príznakom litiázy transplantovanej obličky je hematuria a pokles diurézy, s čím môže súvisieť zhoršenie funkcie transplantovanej obličky.
Pre diagnostiku nefrolitiázy po transplantácii obličky sa používajú štandardné rőntgenologické a ultrasonografické metódy. Ultrasonografia okrem detekcie konkrementu poskytuje informácie aj o počte, veľkosti a lokalizácii konkrementov v dilatovanej panvičke a prípadne v proximálnom močovode. Natívna rtg snímka dokáže konkrementy obsahujúce kalcium. Asi 1/3 konkrementov v transplantovanej obličke sú kamene rtg nekontrastné. Modernou a presnou metódou pre diagnostiku nefrolitiázy a ureterolitiázy po transplantácii obličky je natívne špirálové CT [34].
V liečbe nefrolitiázy a ureterolitiázy po transplantácii obličky sa používajú štandardné minimálne invazívne metódy. Špecifickou metódou liečby konkrementov v odobratej obličke je ex vivo ureteroskopia s litotripsiou obličky v ľadovom kúpeli. Prístupom cez pahýľ močovodu sa konkrementy mechanicky desintegrujú a jednotlivé úlomky sa odstránia kliešťami. Potom nasleduje transplantácia takto ošetrenej obličky [55].
Po transplantácii obličky sa nefrolitáza rieši extrakorporálnou litotripsiou šokovými vlnami (ESWL) so spontánnou pasážou drte alebo perkutánnou litotripsiou a extrakciou úlomkov. Pri obidvoch metódach zostáva fakultatívnou vnútorná derivácia moču ureterálnymi stentami [51].
Konkrementy v mieste uretero-vezikálneho spojenia sa po transplantácii obličky riešia endoskopickou veziko-litotripsiou 59].
MOČOVÝ MECHÚR PRI TRANSPLANTÁCII OBLIČKY
Výsledky transplantácie obličky do značnej miery ovplyvňuje stav močového mechúra príjemcu. Ide najmä o pacientov, u ktorých funkčná alebo anatomická dysfunkcia resp. anomália dolných močových ciest bola priamou príčinou nefropatie, obvykle intersticiálnej nefritídy, vedúcej k zlyhaniu obličiek (veziko-renálny reflux, megauretery, neurogénny močový mechúr, chlopne zadnej uretry, tbc cystitida).
Patologické zmeny močového mechúra predstavujú závažný rizikový faktor súvisiaci jednak s technickými problémami pri rekonštrukcii močových ciest pri transplantácii obličky a jednak významný rizikový faktor ovplyvňujúci funkciu a prežívanie transplantovanej obličky.
U časti pacientov liečených pred transplantáciou obličky hemodialýzou je sprievodným príznakom základného ochorenia ich obličiek anuria. Pre močový mechúr znamená oligoanuria nefyziologický stav, ide o afunkčný, tzv. „suchý“ močový mechúr. Pre fyziologickú funkciu močového mechúra je totiž podstatné a charakteristické opakované plnenie močom a rytmické vyprázdňovanie. Keďže u anurických pacientov táto prirodzená „rytmicita“ chýba, močový mechúr sa následne mení, najmä sa podstatne zmenšuje jeho funkčná kapacita. Histologicky sa však štruktúra steny afunkčného močového mechúra nemení. Z urologického hľadiska je v tejto situácii značnou nevýhodou, že nemožno spoľahlivo ohodnotiť funkciu močového mechúra a dospieť k funkčným parametrom charakterizujúcim zvráštený močový mechúr. Anurický pacient totiž obvykle ani nie je schopný popísať akt močenia a z objektívnych dôvodov nemožno urobiť prietokové štúdie a odmerať postmikčné reziduum [34]. Pri normálnej diuréze transplantovanou obličkou sa funkčné parametre močového mechúra spontánne upravia v priebehu 3 mesiacov po operácii.
Druhá kategória dysfunkčných močových mechúrov sú mechúre zvráštené v dôsledku jazvenia po opakovaných operáciách (najviac po reimplantáciách močovodov) s fibrotickou rigidnou stenou. Dysfunkčné močové mechúre tejto kategórie sú príčinou resp. súčasťou syndrómu chronickej renálnej insuficiencie v dôsledku chronickej pyelonefritidy. K zlyhaniu obličiek pri dysfunkcii dolných močových ciest dochádza však u relatívne nízkeho percenta pacientov.
Podmienkou transplantácie obličky u týchto pacientov je vyriešenie problémov s dolnými močovými cestami. Pri močových mechúroch dysfunkčných po opakovaných operáciách sa nedá očakávať spontánna úprava funkcie zjazveného močového mechúra.
TRANSPLANTÁCIA OBLIČKY PACIENTOM S ANOMÁLIAMI DOLNÝCH MOČOVÝCH CIEST
Medzi ďalšie ochorenia dolných močových ciest, ktoré môžu poškodiť jednak vlastné obličky a následne i transplantovanú obličku u príjemcu, sú niektoré vrodené anomálie dolných močových ciest.
Do kategórie organických porúch dolných močových ciest patria aj maligné ochorenia, ktoré si vyžiadali radikálnu cystoprostatektómiu s následnou deriváciou moču alebo ortotopickou náhradou močového mechúra. U časti týchto pacientov po liečbe primárneho maligného ochorenia dochádza k chronickej renálnej insuficiencii, pre ktorú je potrebné zahájiť liečbu hemodialýzou. Ak v priebehu niekoľkých rokov po liečbe nedôjde k recidíve nádorového ochorenia, stanú sa títo pacienti kandidátmi na transplantáciu obličky, pričom tým najväčším problémom u nich býva rekonštrukcia močových ciest. Podobný problém je, keď sa ma-ligné ochorenia dolných močových ciest diagnostikujú roky po transplantácii obličky.
U pacientov, so závažnými organickými poruchami alebo vrodenými vývojovými anomáliami dolných močových ciest, je potrebné už pred transplantáciou obličky zabezpečiť vhodný spôsob derivácie moču resp. vytvoriť z močového mechúra veľkokapacitný nízkotlakový rezervoár, ktorý zabráni poškodeniu transplantovanej obličky a pacientom umožní pravidelné vyprázdňovanie a prijateľnú kvalitu života.
U mnohých pacientov sa často v mladom veku riešili problémy nízko-kompliantného močového mechúra formou uretero-ileostómie. Existujúci ileálny konduit možno po transplantácii obličky využiť pre deriváciu moču formou implantácie močovodu priamo do kľučky ilea. Uretero-ileostómia je metóda, ktorá efektívne chráni transplantovanú obličku a súčasne príjemcovi transplantátu umožňuje prijateľnú kvalitu života.
Pre augmentáciu (zväčšenie kapacity) nízko-kompliantného močového mechúra, resp. pre ortotopickú náhradu močového mechúra sa používajú detubulizované segmenty ilea. Detubulizáciou, t.j. pozdĺžnym preťatím cirkulárnej svaloviny ilea na jeho antimezenteriálnej strane, sa efektívne potlačí peristaltická aktivita čreva a predíde sa vytváraniu tlakových vĺn. Augmentácia močového mechúra je bezpečná a účinná metóda vedúca k obnove funkcie močového mechúra s nízkou compliance. Po augmentácii močového mechúra možno bezpečne urobiť transplantáciu obličky [33].
Rovnako ortotopická náhrada močového mechúra ileálnym rezervoárom je výhodnou formou derivácie moču u pacientov pred alebo po transplantácii obličky, u ktorých bolo nutné odstrániť vlastný močový mechúr, najčastejšie pre maligný urotelový nádor. Kontinentný ortotopický rezervoár moču umožňuje zachovať funkciu transplantovanej obličky a súčasne poskytuje pacientom vysokú kvalitu života [35,46,50].
MUDr. Ján Breza ml.
MUDr. Zuzana Žilinská
doc. MUDr. Peter Bujdák, PhD
prof. MUDr. Ján Breza, DrSc.Urologická klinika s Centrom pre transplantácie obličiek, Bratislava
janbreza@hotmail.com
Zdroje
1. Ahn HJ, Kim YS, Rha KH et al. Technical refinement for third kidney transplantation. Urology 2006; 68 : 189–192.
2. Alcaraz A, Bujons A, Pascual X et al. Percutaneous management of transplant ureteral fistulae is feasible in selected cases. Transplant Proc 2005; 37 : 2111 – 2114.
3. Andonian S, Zorn KC, Paraskevas S et al. Artificial ureters in renal transplantation. Urology 2005; 66 : 1109.
4. Basiri A, Nikoobakht MR, Simforoosh N et al. Ureteroscopic management of urological complications after renal transplantation. Scand J Urol Nephrol 2006; 40 : 53–56.
5. Blaszak RT, Dunn JF, Finck CM. Use of appendix for complete transplant ureteral necrosis. Pediatr Transpl 2003; 7 : 243–246.
6. Breda A, Bui MH, Liao JC et al. Incidence of ureteral strictures after laparoscopic donor nephrectomy. J Urol 2006; 176 : 1065–1068.
7. Breza J, Zvara V, Řezníček J. Faktory ovplyvňujúce kvalitu obličiek použitých pre transplantáciu. Rozhl Chir 1984; 63 : 228–234.
8. Breza J, Řezníček J. Príprave kadaveróznych dárcov pre odber obličiek a technika odberu obličiek en bloc. Rozhl Chir 1985; 64 : 767–774.
9. Breza J, Řezníček J, Polák V et al. Antegrádna pyeloureterografia transplantovanej obličky. Bratisl Lek Listy 1989; 90 : 597–603.
10. Bromwich E, Coles S, Atchley J et al. A 4-year review of baloon dilation of ureteral strictures in renal allografts. J Endourol 2006; 20 : 1060–1061.
11. Burgos FJ, Pascual J, Marcen R et al. Self-expanding metallic ureteral stents for treatment of uretral stenosis after kidney transplantation. Transplant Proc 2005; 37 : 3828–3829.
12. Cantasdemir M, Kantarci F, Numan F et al. Renal transplant ureteral stenosis: treatment by self-expanding metallic stent. Cardiovas Interv Radiol 2003; 26 : 85–87.
13. Coulthard MG, Keir MJ. Reflux nephropathy in kidney transplants, demonstrated by dimercaptosuccinic acid scanning. Transplantation 2006; 82 : 205–210.
14. Dalgic A, Boyvat F, Karakayali H et al. Urologic complications in 1523 renal transplantations: The Baskent University experience. Transplant Proc 2006; 38 : 543–547.
15. Davari HR, Yarmohammadi H, Malekhosseini SA et al. Urological complications in 980 consecutive patients with renal transplantation. Int J Urol 2006; 13 : 1271–1275.
16. Du Bay DA, Lynch R, Cohn J et al. Is routine ureteral stenting cost-effective in renal transplantation? J Urol 2007; 178 : 2509–2513.
17. Faenza A, Nardo B, Fuga G et al. Urological complications in kidney transplantation: ureterocystostomy versus uretero-ureterostomy. Transplant Proc 2005; 37 : 2518–2520.
18. Figueiredo AJ, Cunha MX, Mota AF et al. Histological alterations found in the ureter during organ preservation and early phases of renal transplantation. Transplant Proc 2005; 37 : 2743–2745.
19. Figueiredo AJ, Cunha MX, Mota AF et al. Ureteric lesions detected in normally functioning kidney allografts: risk factors and clinical implications. Transplant Proc 2005; 37 : 2762–2764.
20. Gurkan A, Yakupoglu YK, Dinckan A et al. Comparing two ureter reimplantation techniques in kidney transplant recipients. Transplant Int 2006; 19 : 802–806.
21. Haberal M, Emiroglu R, Karakayali H et al. A corner-saving ureteral reimplantation technique without stenting. Transplant Proc 2006; 38 : 548–551.
22. Henderson A, Gujral S, Mitchelmore AE et al. Endo-urological techniques in the management of stent complications in the renal transplant recipients. Transpl Int 2002; 15 : 664–666.
23. Ingber MS, Girdler BJ, Moy JF et al. Inguinal herniation of a transplant ureter: rare cause of obstructive uropathy. Urology 2007; 70 : 1224.
24. Karam G, Maillet F, Parant S et al. Ureteral necrosis after kidney transplantation: risk factors and impact on graft and patient survival. Transplantation 2004; 78 : 725–729.
25. Krishnan A, Swana H, Mathias R et al. Redo ureteroneocystostomy using an extravesical approach in pediatric renal transplant patients with reflux: a retrospective analysis and description of technique. J Urol 2006; 176 : 1582–1587.
26. Küss R, Bourget P. An Illustrated History of Organ Transplantation. The Great Advanture of the Century. Sandoz 1992.
27. Laca Ľ, Grandtnerová B. Transplantácie obličiek od žijúcich darcov. Martin: Enterprise 2003.
28. Lee RS, Bakthavatsalem R, Marsh CL et al. Ureteral complications in renal transplantation: a comparison of the Lich-Gregoir versus the Taguchi technique. Transplant Proc 2007; 39 : 1461–1464.
29. Li Marzi V, Filocamo MT, Dattolo E et al. The treatment of fistulae and ureteral stenosis after kidney transplantation. Transplant Proc 2005; 37 : 2516 – 2517.
30. Mahdavi R, Gholamrezaie HR. The use of contralateral native pelvis and ureter for total transplant ureteric reconstruction. BJU Int 2004; 94 : 439–440.
31. Mangus RS, Haag BW. Stented versus nonstented extravesical ureteroneocystostomy in renal transplantation: a metaanalysis. Am J Transplant 2004; 4 : 1889–1896.
32. Minnee RC, Surachno S, Kox C et al. Is a selective splinted ureterocystostomy protocol feasible in renal transplantation? An analysis of 475 renal transplantations. Transpl Int 2006; 19 : 558–562.
33. Nahas WC, Antonopoulos IM, Piovesan AC et al. Comparison of renal transplantation outcomes in children with and without bladder dysfunction. A customized approach equals the difference. J Urol 2008; 179 : 712–716.
34. Navrátil P. Praktická urologie u nemocných v dialyzační léčbě, před a po transplantaci ledviny. Hradec Králové: vydavatelství Olga Čermáková 2005.
35. Nimeh T, Ng CS, Goldfarb DA et al. Orthotopic neobladder and subsequent renal transplantation. Urology 2002; 60 : 911.
36. Oddens JR, Vos PF, de Kort LM. Rare cause of ureteral stenosis more than 10 years after kidney transplantation. Urology 2005; 65 : 798.
37. Osman Y, Ali-El-Dein B, Shokeir AA et al. Routine insertion of ureteral stent in live-donor renal transplantation: is it worthwhile? Urology 2005; 65 : 867–871.
38. Praz V, Leisinger HJ, Pascual M et al. Urological complications in renal transplantation from cadaveric donor grafts: a retrospective analysis of 20 years. Urol Int 2005; 75 : 144.
39. Řezníček J, Zvara V, Horňák M et al. Transplantácia detských obličiek „en bloc“. Rozhl Chir 1981; 60 : 301–304.
40. Řezníček J, Zvara V, Breza J et al. Allograft rupture after kidney transplantation. Int Urol Nephrol 1981; 13 : 119–122.
41. Řezníček J, Zvara V, Breza J. The ureter in renal transplantation. Int Urol Nephrol 1984; 16 : 69–76.
42. Řezníček J, Breza J, Borošová E et al. 100 transplantácií obličiek na Urologickej klinike v Bratislave. Bratisl Lek Listy 1984; 81 : 404–412.
43. Řezníček J, Zvara V, Horňák M et al. Transplantation of pediatric kidneys into adult patients. Czechoslov Med 1985; 8 : 221–225.
44. Řezníček J, Zvara V, Pribylincová V. Pyelocystostómia pri nekróze močovodu transplantovanej obličky. Rozhl Chir 1988; 67 : 675–677.
45. Sansalone CV, Maione G, Aseni P et al. Advantages of short-time ureteric stenting for prevention of urological complications in kidney transplantation: an 18-year experience. Transplant Proc 2005; 37 : 2511 – 2515.
46. Selli C, Boggi U, Travaglini F et al. Cystectomy and orthotopic ileal neobladder in a male patient 12 years after kidney transplantation: good preservation of the renal function. Transpl Int 2004; 17 : 97–100.
47. Shokeir AA, Osman Y, Ali-El-Dein B et al. Surgical complications in live-donor pediatric and adolescent renal transplantation: study of risk factors. Pediatr Transplant 2005; 9 : 33–38.
48. Sinha M, Lewis MA, Riad H et al. Complete necrosis of allograft ureter after cadaveric renal transplantation. Pediatr Transplant 2004; 8 : 91–93.
49. Sulikowski T, Zietek Z, Ostrowski M et al. Experiences in kidney transplantation with duplicated ureter. Transplant Proc 2005; 37 : 2096–2099.
50. Taghizadeh AK, Desai D, Ledermann SE et al. Renal transplantation or bladder augmentation first? BJU Int 2007; 100 : 1365–1370.
51. Tanneau Y, Vidart A, Sibert L et al. Management of coraliform lithiasis on renal allograft with bricker-type ureterointestinal anastomosis. Transplant Proc 2005; 37 : 2104–2106.
52. Tavakoli A, Surange RS, Pearson RC et al. Impact of stent on urological complications and health care expenditure in renal transplant recipients: results of a prospective, randomized clinical trial. J Urol 2007; 177 : 2260–2264.
53. Thevedran G, Al-Akraa MA, Sweny P et al. Calycoureterostomy: a novel technique for post-renal transplant stricture. Surgeon 2004; 2 : 176–178.
54. Thomas A, Dropulic LK, Rahman MH et al. Ureteral stents: a novel risk factor for polyomavirus nephropathy. Transplantation 2007; 84 : 433–436.
55. Trivedi A, Patel S, Devra A et al. Management of calculi in a donor kidney. Transplant Proc 2007; 39 : 761–762.
56. Tzimas GN, Hayati H, Tchervenkov JI et al. Ureteral implantation technique and urologic complications in adult kidney transplantation. Transplant Proc 2003; 35 : 2420–2422.
57. Uchida J, Naganuma T, Machida Y et al. Modified extravesical ureteroneocystostomy for completely duplicated ureters in renal transplantation. Urol Int 2006; 77 : 104–106.
58. Viklický O, Janoušek L, Baláž P et al. Transplantace ledviny v klinické praxi. Praha: Grada Publishing 2008.
59. Watanabe Y, Itoh S, Mitsuhata N. Bladder stone at an ureterovesical anastomotic site after renal transplantation: report of three cases. Hinyokika Kiyo 2005; 51 : 97–100.
60. Weiss RM. Clinical implications of ureteral physiology. J Urol 1979; 121 : 401–404.
61. Wilson CH, Bhatti AA, Rix DA et al. Routine intraoperative ureteric stenting for kidney transplant recipients. Cochrane Database Syst Rev 2005; 19: CD004925.
62. Wolters HH, Palmes D, Krieglstein CF et al. Reconstruction of ureteral necrosis in kidney transplantation using an ileum interposition. Transplant Proc 2006; 38 : 691–692.
63. Zargar MA, Shahrokh H, Mohammadi Fallah MR et al. Comparing Taguchi and anterior Lich-Gregoir ureterovesical reimplantation technique for kidney transplantation. Transplant Proc 2005; 37 : 3077 – 3078.
64. Zvara V, Řezníček J. Možnosti aktívnej liečby terminálneho štádia chronickej nedostatočnosti obličiek chronickou hemodialýzou a transplantáciou obličiek. Lek Obzor 1973; 22 : 489–495.
Štítky
Detská urológia Urológia
Článek Úvodní slovo
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2009 Číslo 1- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Tři zdroje ledvin k transplantaci
- Transplantace ledvin od žijících dárců
- Urologická příprava a sledování pacienta před transplantací ledviny
- Principy transplantačního zákona
- Úvodní slovo
- Chirurgické techniky transplantace ledviny
- Urologické komplikácie po transplantácii obličky
- Urologické malignity u nemocných po transplantaci ledviny
- Co na publikované články říká profesor Patrik C. Walsh?
- Urologická onemocnění vedoucí k ledvinné nedostatečnosti a možné cesty prevence konečného stadia selhání ledvin
- GUIDELINES EAU PRO TRANSPLANTACI LEDVINY (část 1)
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Urologické komplikácie po transplantácii obličky
- Urologická onemocnění vedoucí k ledvinné nedostatečnosti a možné cesty prevence konečného stadia selhání ledvin
- Chirurgické techniky transplantace ledviny
- Tři zdroje ledvin k transplantaci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



